A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בחירה בידוד מושבות של בתאי גזע pluripotent מושרה לתכנות מחדש של Fibroblasts למבוגרים
In This Article
Summary
אנו מציגים פרוטוקול תכנות מחדש יעיל של האדם התאים הסומטיים אל האדם המושרה בתאי גזע pluripotent (hiPSC) באמצעות וקטורים retroviral קידוד Oct3 / 4, Sox2, Klf4 ו-c-myc (OSKM) וזיהוי של hiPSC לתכנות מחדש בצורה נכונה על ידי צביעה חיה עם Tra למוצרי 1-81 נוגדנים.
Abstract
במסמך זה אנו מציגים פרוטוקול של תכנות מחדש fibroblasts בוגרים האדם אל האדם המושרה בתאי גזע pluripotent (hiPSC) באמצעות וקטורים retroviral קידוד Oct3 / 4, Sox2, Klf4 ו-c-myc (OSKM) בנוכחות סודיום בוטיראט 1-3. השתמשנו בשיטה זו כדי לתכנת מחדש את המעבר מאוחר (> P10) fibroblasts בוגרים האדם הנגזרות של המטופל Friedreich אטקסיה (GM03665, Coriell Repository). הגישה תכנות מחדש כולל פרוטוקול התמרה היעילה ביותר באמצעות צנטריפוגה חוזרת של fibroblasts בנוכחות המכילים וירוסים התקשורת. המושבות hiPSC לתכנות מחדש זוהו באמצעות immunostaining חי עבור Tra-1-81, סמן פני השטח של תאים pluripotent, מופרד fibroblasts לא לתכנות מחדש ו passaged ידני 4,5. HiPSC אלה הועברו לאחר מכן צלחות Matrigel וגדלה במזין נטולי תנאים, ישירות מהצלחת תכנות מחדש. החל מ במעבר 1, מושבות hiPSC להפגין מאפיין הס-lאייק המורפולוגיה. שימוש בפרוטוקול זה יותר מ 70% של מושבות שנבחרו ניתן להרחיב בהצלחה והקים את שורות תאים. הקווים hiPSC שהוקמו מוצג סמנים אופייניים pluripotency כולל סמנים פני השטח tra-1-60 ו SSEA-4, כמו גם סמנים גרעיני Oct3 / 4, ו Sox2 Nanog. הפרוטוקול המובא כאן הוקם ונבדק באמצעות fibroblasts בוגרים שהתקבלו מחולים אטקסיה של Friedreich ויחידים בקרת 6, fibroblasts אדם שזה עתה נולדו, כמו גם קרטינוציטים אדם.
Protocol
1. וירוס ייצור התמרה
- צלחת הפניקס Ampho תאים בצפיפות של צלחת 10 ~ 7-8x10 6 ס"מ לכל 10 מ"ל של DMEM בינוני (גלוקוז DMEM גבוהה, 10% FBS חום מומת, 2 מ"מ L-גלוטמין, ללא אנטיביוטיקה). מקום בחממה ותרבות לילה בשעה 37 ° C, 5% CO 2.
- למחרת transfect הפניקס תאים באמצעות 12 מיקרוגרם של קידוד וקטורי או Oct3 / 4, Sox2, Klf4, c-myc, או GFP גן (Addgene פלסמידים 17217, 17218, 17219, 17220) ו 35 Fugene μl 6. להכין תערובת transfection ב μl של 500 DMEM בינוני (גלוקוז DMEM גבוהה, 2 מ"מ L-גלוטמין, לא FBS ואנטיביוטיקה). דגירה 20 דקות. בעדינות פיפטה מתחמי דנ"א לתוך צלחות 10 ס"מ המכיל 70-80% תאים confluent הפניקס.
- החלף התקשורת 6-8 שעות שלאחר transfection עם DMEM בינוני (גלוקוז DMEM גבוהה, 10% FBS חום מומת, 2 מ"מ L-גלוטמין) המכיל פניצילין וסטרפטומיצין.
- לאחר מכן, לאסוף וירוסים המכיל מדיה 4 פעמים ב 12 שעותבמרווחים, לשלב את כל החלקים ומסוננים באמצעות כמה 0.45 מיקרומטר סינון להסיר תאים משפחתיים ופסולת (מדיה המכילים חלקיקים נגיפיים אפשר לשמור במקרר במשך 2 שבועות מבלי לאבד את פעילות זיהומיות, אולם ההקפאה אינה מומלצת).
- עבור retroviral, התמרה צלחת fibroblasts בוגרים האדם (מעבר 10, Coriell מעבדות) מ h קפוא המניה 24 שקדמו ליום האחרון של אוסף המדיה retroviral. זרעים התאים על 6 צלחות מכוסות היטב ג'לטין בבתי 1x10 צפיפות 5 תאים לכל גם ב DMEM גלוקוז גבוהה, 10% FBS, 2 מ"מ L-גלוטמין, פניצילין, סטרפטומיצין ולא חיוניות חומצות אמינו.
- תחליף למחרת DMEM התקשורת עם התקשורת המכילים חלקיקים נגיפיים שהתקבלו תאים הפניקס. הוסף מדיה נגיפיים (1 מ"ל של כל אחד Oct4, Sox2, Klf4, ו-c-myc התקשורת, הכולל 4 מ"ל) השלימו עם 6 מיקרוגרם / מ"ל של polybrene אל היטב בכל צלחת 6-גם של התרבויות פיברובלסטים ו צנטריפוגות ב 1600g עבור 1h על 20 ° C. כ 12 שעות AFter התמרה, להחליף את התקשורת ויראלי עם המדיום תרבות פיברובלסטים. בצע זיהום ויראלי צנטריפוגה 3 פעמים ב -24 מרווחי ש.
- תרבות fibroblasts ב DMEM מדיה עבור H 48 לאחר ההדבקה האחרונות. יש לבדוק את היעילות של זיהום על ידי transductions מקבילים עם מדיה retroviral המבטאים GFP. איור 1 מדגים את היעילות של זיהום צנטריפוגה הקל retroviral של פיברובלסטים האדם.
2. תכנות מחדש
- הכן 6 צלחות גם עם γ-מוקרן שכבות מזין MEF ידי זריעת תאים MEF בצפיפות של ~ 2x10 5 תאים לכל היטב את הג'לטין טיפול 6 צלחת גם במדיום גידול פיברובלסטים. למחרת לפצל fibroblasts אדם שנדבקו באמצעות 0.05% טריפסין / EDTA וזרעי אותם בצפיפות של 1.2x10 ~ 4 לכל גם במדיום fibroblasts הצמיחה.
- למחרת להחליף את התקשורת עם הס התקשורת (DMEM/F12, 20% סרום נוק תחליף, לא חיוניות חומצות אמינו, penicillin / סטרפטומיצין, 2 מ"מ L-גלוטמין, 0.1 מ"מ β-mercaptoethanol, 20 ng / ml הצמיחה הבסיסי פיברובלסטים פקטור (bFGF), השלימו עם בוטיראט 0.5 מ"מ נתרן ל -7 הימים הראשונים של תכנות מחדש. לשנות את התקשורת מדי יום.
- לעקוב אחר שינויים מורפולוגיים בתאים transduced מדי יום. מושבות של הירכיים דמויי תאים יתחיל לצאת כ 5 - 10 ימים לאחר העברת fibroblasts transduced על גבי תאים מזין. המושבות hiPSC מוכנים לבודד כ 14 - 28 ימים לאחר ציפוי אותם על התאים מזין MEF.
3. הבידוד של hiPSC המושבות
- יום לפני בחירת המושבות hiPSC להכין 24 גם צלחות עם γ-מוקרן מזין תאים MEF (~ 4 4x10 תאים בכל טוב) במצע גידול fibroblasts. בשלב זה מושבות hiPSC יכול גם להעביר את התרבות מזין בחינם באמצעות Matrigel ובינוניים mTeSR1.
- לפני בידוד של מושבות hiPSC להכין צלחות MEF על ידי הסרת הגידול fibroblasts mediuמ 'ושטיפה MEFs עם PBS להסיר עקבות של FBS. לאחר מכן מוסיפים 0.5 מ"ל הס בינוני (או mTeSR1 בינוני במקרה של בארות מצופה Matrigel) עם מעכב 10 מיקרומטר רוק Y27632 זה 7,8 היטב.
- במידת הצורך, להסיר את fibroblasts סביב המושבות hiPSC עם מחט 21 מד תחת מיקרוסקופ רכוב בשכונה למינרית הזרימה (איור 2 א - ג). יש לשטוף את הצלחות עם PBS ולהוסיף טריים התקשורת הס המכיל נוגדנים ספציפיים Tra-1-81 StainAlive (1:200, Stemgent). אחרי 30 דקות., החלף מדיה המכילה את הנוגדן עם טריים התקשורת הס השלימו עם מעכב רוק 10 מיקרומטר. לבחון את הצלחות תחת מיקרוסקופ פלואורסצנטי ומארק Tra-1-81 מושבות חיוביים באמצעות סמן אובייקטיבי (איור 2 ד).
- חותכים את Tra-1-81 מושבות hiPSC חיוביים תחת המיקרוסקופ של מכסה המנוע למינרית, לחתיכות קטנות כמה באמצעות מחט מד 21 כפי שמוצג באיור 2E ופ
- שימוש אוטומטי פיפטה (P200) שברי העברה של מושבות hiPSC אל תעשבארות ividual של צלחת 24 גם עם MEFs או Matrigel. למנוע העברת שאינם הירכיים תאים. מניחים את הצלחות ב 37 מעלות צלזיוס, 5% CO 2 באינקובטור ולאפשר המושבות hiPSC לצרף עבור 24-36 שעות.
- שינוי הס או mTeSR1 (על מושבות על מצע של Matrigel) התקשורת מדי יום. המושבות hiPSC עם מורפולוגיה הס דמוי נכונה ניתן יהיה לראות 48 שעות לאחר ההעברה הראשונית לצלחת של 24 באר.
- מעבר ידני hiPSC מושבות כל 6 - 8 ימים על גבי 12-היטב ולאחר מכן על צלחת 6 היטב.
- לאחר הרחבת משובט והקמת קווי hiPSC, לנתח ביטוי של סמנים pluripotency tra-1-60, SSEA-4, Oct3 / 4, ו Sox2 Nanog באמצעות immunocytochemistry כפי שמוצג באיור 3. להעריך את תקינות הגנומי ובפוטנציאל בידול של קווי להשיג באמצעות קריוטיפ היווצרות תפלצת רוחנית ניתוח 6,9.
4. נציג תוצאות
התמרה יעיל עם רטרווירוס המכיל התקשורת אניזה קריטי עבור תכנות מחדש מוצלחת. מומלץ לבצע את ההליך כולו transfection / זיהום באמצעות GFP להביע וירוס בכל ניסוי תכנות מחדש אחת כדי לפקח על יעילות כפי שמוצג באיור 1. כייל של וירוס ה-GFP להביע נקבע, כמתואר 10, דרך התמרה של fibroblasts האדם באמצעות המדיה שאינם מרוכזים ויראלי היה בדרך כלל בטווח של 0.5-5 x 10 -7 חלקיקים נגיפיים לכל מ"ל (סמנכ"ל / ml).
Fibroblasts לשנות את המורפולוגיה כבר 2 ימים לאחר ההדבקה האחרון. Fibroblasts אדם Trypsinized יש לספור היטב לפני זריעת אותם על התאים מזין MEF. מומלץ לתאי זרע לאחר 3 צפיפויות שונות (6x10 3, 1.2x10 4, 2.5x10 4 לכל אחד גם צלחת גם 6) מאז כל שורה תא מדגים מאפיין צמיחה שונה וצפיפות זריעת הוא קריטי ליעילות של תכנות מחדש. סודיום בוטיראט המשמשראשוני 7 - 14 ימים של תכנות מחדש מגביר את היעילות של היווצרות hiPSC כ 5 פי. לעתים קרובות, במיוחד כאשר fibroblasts נגועים היו זרע בצפיפות גבוהה יותר, דמויי תאים פיברובלסטים יכול לגדול יותר מאכל תרבות לכסות מושבות hiPSC כפי שמוצג באיור 2 א. במקרה זה, שכבת פיברובלסטים ניתן הרים בזהירות להסיר לחשוף מושבות hiPSC (איור 2 ב). לאחר מכן, מושבות hiPSC יש לשטוף עם הס מדיה מוכתם נוגדנים Tra-1-81. בהתאם תאים פיברובלסטים, כ 20 - 40% של מושבות מפגינים עם מורפולוגיה iPSC כמו לא ללכלך עם נוגדנים Tra-1-81. מושבות hiPSC המזוהים ניתן להעביר מהצלחת בתוך 12 הבא - 24 שעות. דגירה ממושכת תגרום הבחנה מהירה של hiPSCs. מושבות ניתן passaged באופן ידני על גם בתאי מזין MEF או Matrigel מצופים צלחות. לאחר ההרחבה הוקמה שיבוטים hiPSC יש לבדוק באמצעות immunocytochemistry (ICC) לביטוי של pluripotenסי סמנים כמו הדגים באיור 3. בנוסף, אפיון מולקולארי מפורט של קווי שב"ס שנוצר התא צריכה לכלול: ניתוח ביטוי גנים pluripotency באמצעות RT-PCR, הפגנה של demethylation DNA על היזמים של גנים וניתוחים pluripotency של transgenes להשתקת 9.
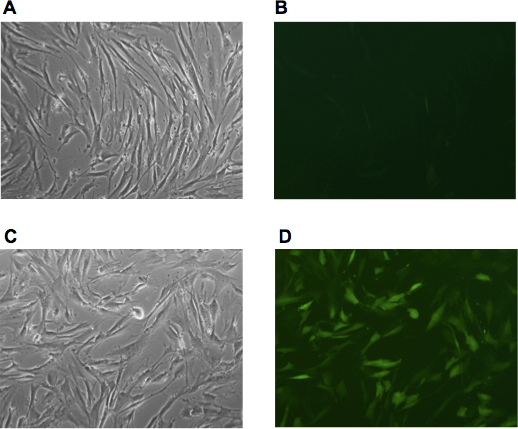
באיור 1. היעילות של התמרה ויראלית נקבע באמצעות רטרווירוס GFP להביע. (א, ב) fibroblasts בוגרים האדם הנגזרות של המטופל Friedreich אטקסיה (GM03665, Coriell Repository) היו דמיינו אחרי שתי דלקות רצופות עם התקשורת GFP retroviral. (C, D) fibroblasts אדם נדבקו אצווה זהה של התקשורת GFP retroviral ואחריו צנטריפוגה של תאים ישירות על 6 צלחות גם עבור 1h ב 1600g. תמונות נתפסו 48h לאחר ההדבקה.

איור 2. זיהוי ובידוד של מושבות hiPSC. (א) בניגוד שלב תמונה של צלחת המכילה hiPSCs מוקפים fibroblasts. התאים היו בתרבית במשך 21 ימים על הס התקשורת. (B, C) המושבה hiPSC אותו לאחר הסרת שכבת פיברובלסטים שמסביב. (ד) מושבות hiPSC לתכנות מחדש כראוי מזוהים מכתים חי עם נוגדנים Tra-1-81 פני דה מרקר, לחתוך באמצעות מחט סטרילית (E, F) והועברו בארות נפרדות של צלחת של 24 באר.
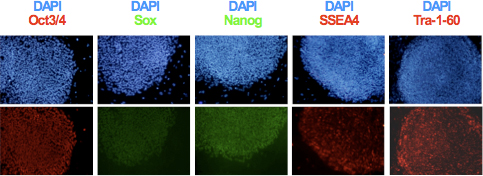
איור 3. הביטוי של סמנים ספציפיים pluripotency Oct3 / 4, Nanog, Sox2, SSEA4 ו Tra-1-60 hiPSCs נקבע על ידי immunocytochemistry.
Discussion
לימוד מחלות אנושיות, נוירולוגיות ניווניות במיוחד, כבר מאתגר במיוחד בשל חוסר נגישות של מודלים מתאימים הסלולר אדם. היכולת לתכנת מחדש תאים סומטיים להשגה בקלות לתוך המושרה בתאי גזע pluripotent ואת הפוטנציאל להבדיל אותם סוגי תאים שונים נפתחה האפשרות ליצור דגמים סלולריים של מ?...
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי ברית אטקסיה המחקר של Friedreich ומענק טייס מן ארנולד קרן משפחת והמרכז בתאי גזע וביולוגיה התפתחותית ב MD Anderson Cancer Center.
Materials
| Name | Company | Catalog Number | Comments |
| מגיב | חברה | מספר קטלוגי | |
| DMEM | Invitrogen | 11965 | |
| DMEM/F12 | Invitrogen | 11330 | |
| KSR | Invitrogen | 10828 | |
| שאינם חיוניים aminoacids | Invitrogen | 11140 | |
| סודיום בוטיראט | סיגמא | B5887 | |
| Y27632 | Stemgent | 04-0012 | |
| bFGF | Stemgent | 03-0002 | |
| Tra-1-81 נוגדן | Stemgent | 09-0069 | |
| Oct3 / 4 נוגדן | סנטה קרוז | SC-8628 | |
| Nanog נוגדן | התא איתות טכנולוגיה | 4903S | |
| Tra-1-60 נוגדן | Millipore | MAB4360 | |
| Sox2 נוגדן | התא איתות טכנולוגיה | 3579S | |
| SSEA4 | Millipore | MAB4304 | |
| CF1 MEFs | Globalstem | GSC-6201G | |
| המטרה סמן | ניקון | MBW10010 | |
| Matrigel | BD Biosciences | 354277 | |
| mTeSR1 | StemCell טכנולוגיות | 05850 | |
| β-mercaptoethanol | סיגמא | M7522 | |
| Fugene 6 | רוש | 11814443001 | |
| polybrene | סיגמא | H9268 | |
| סמן אובייקט | ניקון | MBW10010 |
References
- Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., Yamanaka, S. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Mali, P., Chou, B. K., Yen, J., Ye, Z., Zou, J., Dowey, S., Brodsky, R. A., Ohm, J. E., Yu, W., Baylin, S. B., Yusa, K., Bradley, A., Meyers, D. J., Mukherjee, C., Cole, P. A., Cheng, L. Butyrate greatly enhances derivation of human induced pluripotent stem cells by promoting epigenetic remodeling and the expression of pluripotency-associated genes. Stem Cells. 28, 713-720 (2011).
- Wernig, M., Meissner, A., Foreman, R., Brambrink, T., Ku, M., Hochedlinger, K., Bernstein, B. E., Jaenisch, R. In vitro reprogramming of fibroblasts into a pluripotent ES-cell-like state. Nature. 448, 318-324 (2007).
- Lowry, W. E., Richter, L., Yachechko, R., Pyle, A. D., Tchieu, J., Sridharan, R., Clark, A. T., Plath, K. Generation of human induced pluripotent stem cells from dermal fibroblasts. Proc. Natl. Acad. Sci. U.S.A. 105, 2883-2888 (2008).
- Dick, E., Matsa, E., Bispham, J., Reza, M., Guglieri, M., Staniforth, A., Watson, S., Kumari, R., Lochmuller, H., Young, L., Darling, D., Denning, C. Two new protocols to enhance the production and isolation of human induced pluripotent stem cell lines. Stem Cell Res. 6, 158-167 (2011).
- Ku, S., Soragni, E., Campau, E., Thomas, E. A., Altun, G., Laurent, L. C., Loring, J. F., Napierala, M., Gottesfeld, J. M. Friedreich's ataxia induced pluripotent stem cells model intergenerational GAATTC triplet repeat instability. Cell Stem Cell. 7, 631-637 (2010).
- Emre, N., Vidal, J. G., Elia, J., O'Connor, E. D., Paramban, R. I., Hefferan, M. P., Navarro, R., Goldberg, D. S., Varki, N. M., Marsala, M., Carson, C. T. The ROCK inhibitor Y-27632 improves recovery of human embryonic stem cells after fluorescence-activated cell sorting with multiple cell surface markers. PLoS One. 5, e12148-e12148 (2011).
- Watanabe, K., Ueno, M., Kamiya, D., Nishiyama, A., Matsumura, M., Wataya, T., Takahashi, J. B., Nishikawa, S., Muguruma, K., Sasai, Y. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nat. Biotechnol. 25, 681-686 (2007).
- Maherali, N., Hochedlinger, K. Guidelines and techniques for the generation of induced pluripotent stem cells. Cell Stem Cell. 3, 595-605 (2008).
- Yu, J., Thomson, J. A., Lanza, R. Induced Pluripotent Stem Cell Derivation. Essentials of Stem Cell Biology. , 331-337 (2009).
- Yu, J., Hu, K., Smuga-Otto, K., Tian, S., Stewart, R., Slukvin, I. I., Thomson, J. A. Human induced pluripotent stem cells free of vector and transgene sequences. Science. 324, 797-801 (2009).
- Woltjen, K., Michael, I. P., Mohseni, P., Desai, R., Mileikovsky, M., Hamalainen, R., Cowling, R., Wang, W., Liu, P., Gertsenstein, M., Kaji, K., Sung, H. K., Nagy, A. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Zhou, W., Freed, C. R. Adenoviral gene delivery can reprogram human fibroblasts to induced pluripotent stem cells. Stem Cells. 27, 2667-2674 (2009).
- Warren, L., Manos, P. D., Ahfeldt, T., Loh, Y. H., Li, H., Lau, F., Ebina, W., Mandal, P. K., Smith, Z. D., Meissner, A., Daley, G. Q., Brack, A. S., Collins, J. J., Cowan, C., Schlaeger, T. M., Rossi, D. J. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., Kim, C. H., Moon, J. I., Chung, Y. G., Chang, M. Y., Han, B. S., Ko, S., Yang, E., Cha, K. Y., Lanza, R., Kim, K. S. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Han, S. S., Williams, L. A., Eggan, K. C. Constructing and deconstructing stem cell models of neurological disease. Neuron. 70, 626-644 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved