A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Nanoinjection לזווג ו Assay Electrophysiology למסך עבור bioactivity של תרכובות באמצעות תסיסנית melanogaster סיבים הענק מערכת
In This Article
Summary
מהיר In vivo Assay לבדיקת תרכובות neuromodulatory באמצעות מערכת סיבים הענק (GFS) של תסיסנית melanogaster מתוארת. Nanoinjections בראש של חיה יחד עם הקלטות של אלקטרו GFS יכול לחשוף bioactivity של תרכובות על עצב או שריר.
Abstract
תרכובות סינון עבור בפעילות vivo יכול לשמש כצעד ראשון כדי לזהות מועמדים שניתן התפתח 1,2 סוכני תרופתי. פיתחנו nanoinjection / electrophysiology הרומן assay המאפשר זיהוי של תופעות modulatory ביו של תרכובות על הפונקציה של מעגל עצבי מתווכת תגובה מפלט תסיסנית melanogaster 3,4. שלנו assay vivo, אשר עושה שימוש במערכת הענק תסיסנית סיבים (GFS, איור 1) מאפשר הקרנה של סוגים שונים של תרכובות, כגון מולקולות או פפטידים קטנים, ודורשת רק כמויות מינימליות כדי לעורר אפקט. בנוסף, GFS תסיסנית מציעה מגוון רחב של מטרות מולקולריות אפשריות על עצב או שריר. סיבי ענק (GFS) סינפסה חשמלית (GAP כלאיים), וכן כימי (כולינרגית) על Synapsing Interneuron היקפיים (PSI) ו Trochanteral Tergo שריר תא עצב (TTMn) 5 6. לבסוף, צמתים neuromuscular (NMJ) של TTMn ו DLMn עם קפיצה (TTM) ואת שרירי התעופה (DLM) הם glutamatergic 7-12. כאן, אנו מדגימים כיצד להזריק כמויות nanoliter של המתחם, תוך קבלת הקלטות תאיים אלקטרו ממערכת סיבים Giant 13 ואיך לפקח על השפעותיה של התרכובת על הפונקציה של מעגל זה. אנחנו מראים הספציפיות של assay עם ציטראט methyllycaconitine (MLA), אנטגוניסט nAChR, אשר משבש את PSI כדי DLMn חיבור אבל לא GF כדי TTMn חיבור או פונקציה של NMJ על קפיצה או שרירי התעופה.
לפני תחילת הווידאו הזאת זה קריטי, כי אתה בזהירות לראות ולהכיר את הסרטון שכותרתו "יופיטר הקלטות אלקטרו מן השביל סיב הענק של ד melanogaster "מ אוגוסטין ואח' 7, כמו וידיאו המוצג כאן נועד כהרחבה לטכניקה זו הקיימת. כאן אנו משתמשים בשיטה הקלטות אלקטרו ולהתמקד בפרטים רק על תוספת של nanoinjections לזווג וטכניקה ניטור.
Protocol
1. Electrophysiology לבוש הקמה
- הציוד הנדרש עבור המתקן electrophysiology הגדרת מתואר בפירוט על ידי אוגוסטין et al. על זה כתב העת 14. עיין במאמר זה לקבלת הסבר מפורט של מנגנונים אלקטרו הדרושים.
- שנה קודם לכן תיאר electrophysiology לבוש הגדרת 14 על ידי הוספת micromanipulator 6, המחזיקה nanoinjector. כדי להקל את הגישה בראש של חיה זה צריך להיות ממוקם בין שני micromanipulators אלקטרודה מגרה כפי שמוצג באיור 2.
- לפני תחילת הניסוי, להבטיח כי יש לך טווח נוח על כל צירי סיבוב עם micromanipulators כל, וכי כל אלקטרודות, כמו גם הזרקת micropipette (ראה שלב 2) יכול להגיע החי.
2. Nanoinjection Set-up
- Nanoinjection הגדרת דורש Nanoliter2000 (העולם Precisiעל מכשירים, Sarasota, פלורידה, ארה"ב) או סוג דומה של מזרק המאפשר זריקות מבוקרת בכמויות nanoliter.
- הכן את מחט הזריקה באמצעות micropipettes זכוכית שסופקו עם מזרק על ידי משיכת להם התנגדות של 80-100 MΩ עם חולץ האלקטרודה.
- על זריקות חלקות נדרש שפוע micropipettes עד הפתיחה 11-17 מיקרומטר בזווית של 45 מעלות (איור 3).
- אט אט לגבות את micropipette הזרקת בשמן סינטטי באמצעות מזרק המילטון כפי שהורה במדריך Nanoliter2000, להבטיח כי אין בועות אוויר נוכחים.
- בזהירות להבטיח micropipette על nanoinjector ולהכין את זה כדי לטעון את המתחם על ידי ריקון עודפי השמן כפי שהורה במדריך Nanoliter2000.
- מניחים את מזרק על micromanipulator וטען את המתחם כפי שמוסבר במדריך Nanoliter2000. ודא כי את קצה micropipette לא לשבור במהלך הזהההליך.
- קבע את כמות הרצויה של nanoliters להיות מוזרק בתיבת הבקרה של ההזרקה כפי שהורה במדריך Nanoliter2000. יש לציין כי הזריק הסכום הכולל לא יעלה על 100 NL. מצאנו כי כמויות גדולות יותר של פתרונות בקרה מלוחים עשויים להשפיע על תפקוד של המעגל GFS.
- זה קריטי שיש מזרק ניתק מתיבת הבקרה במהלך הרכישה הקלטה למעט הזריקה עצמה, שכן אספקת החשמל של nanoinjector מפריע ההקלטות, וזה נראה כמו רעש רקע (איור 4). עם זאת, אין לנתק את הספקת הזרם לתיבת הבקרה, כפי שיופיע מחדש להגדיר את זה.
3. תסיסנית הכנה melanogaster
- להרדים 2 עד 6 זבובים ביום ישנים עם CO 2 או על קרח כפי שתואר קודם לכן 14,15.
- תנועה אחת, השתמש פינצטה להעביר את בעל החיים Wi צלחת קטנהה שעווה שיניים רכה ידי מרים אותו מהרגליים שלו. לידיעתך, זבוב הפירות זכר שוקל כ 1.0 מ"ג ו זבוב הפירות נקבה שוקל כ 1.2 מ"ג, ובכך מתחם אל הגוף משקל יחס שונה אצל זבובי גברים לעומת נשים. לכן, מומלץ להשתמש רק 1 מין עבור הניסויים.
- כפי שתואר קודם לכן 14,15, בזהירות לעלות על הצד הגבי לטוס מעלה להבטיח כי החזה והראש הם משותקים בשעווה שיניים רכה להציב סביב הגוף. בזהירות להפיץ את הכנפיים החוצה, כך שהם שכבו ניצב בית החזה (איור 2, C). זבוב צריך להיות מותקן עם נזק מועט ככל האפשר.
4. Nanoinjection לזווג / electrophysiology
- מניחים את זבוב רכוב על המתקן electrophysiology עם ראשו כלפי אלקטרודות גירוי.
- לדקור את בעל החיים עם הקרקע המתאימה מגרה, ואלקטרודות הקלטה כפי שתואר קודם לכן 14,15 (Figure 2, C). אלא אם כן הרצוי אחרת, מקום אחד הקלטה אלקטרודה לתוך DLM והשני לתוך השריר TTM. שרירים DLM ממוקם בית החזה בין Dorso-מרכז שערות הקדמי ואת קו האמצע של הזבוב. שרירים TTM ממוקם ליד את הקבצים המצורפים כנף, בין העל עלאר שערות האחוריים ואת הקדמי של זבוב 7.
- יישר micropipette זריקה המכילה תרכובת עם מרכז של 3 ocelli הממוקם בחלק האחורי של הראש המדיאלי אך לא להזריק עוד (איור 2, C).
- לפני הזרקת תרכובת להשיג הקלטה בסיסית של GF כדי TTM ו GF כדי DLM מסלולים של מערכת סיבים הענק (GFS, איור 1) באמצעות גירוי מוחי. לשם כך, הפעילו את סיבי ענק (GFS) עם 10 רכבות של 10 גירויים (40-50 mV) כל נתון למשך של 0.03 מילישניות ב 100 הרץ עם עיכוב 1 2 רכבות בין 14,15 (איור 4). סוג הפרוע עף shולד יוכלו לעקוב אחד לאחד בקצב הזה של גירוי של DLM והן המסלולים TTM. מחק את הזבוב אם GF כדי DLM ו GF אל המסלולים TTM לא מבין גירוי 100 הרץ ביחס 1:1.
- לעבור גירוי מתמשך של GF עם פולסים בודדים ב 1 הרץ (איור 4).
- עד מהרה לחבר מזרק לתוך תיבת הבקרה. למרות רעשי הרקע יפריע את 1 הקלטות גירוי הרץ, אין להפסיק את זה.
- בזהירות להוסיף את micropipette זריקה לתוך הקפסולה ראש לטוס מתחת cuticule, ולהזריק את כמות הרצויה של המתחם לתוך hemolymph של הזבוב תוך שמירה על גירוי 1 הרץ (איור 4). בשל מערכת הדם הפתוחה של זבוב, מערכת העצבים כולה יהיו חשופים המתחם בתוך שניות. למרות ההזרקה מסוים אינו קריטי לספק תרכובות אל hemolymph, אנו מוצאים את האזור של ocelli, אשר בתרגוםד המדיאלי בצד הגבי ביותר של הקפסולה את הראש, להיות אתר נוח המאפשר הזרקת קל שמוביל הפצה מהירה אפילו של המתחם.
- להסיר לאלתר micropipette הזרקת מאתר ההזרקה לנתק את ההזרקה מתיבת הבקרה תוך גירוי 1 הרץ GF עד 1 דקות לאחר ההזרקה (איור 4).
- על מנת לחשוף השפעות עדינות יותר של תרכובות על GFS, להדגיש את סיבי ענק (GFS) עם 10 רכבות של 10 גירויים ב 100 הרץ עם עיכוב 1 2 בין הרכבות. ממשיכים לבדוק את הפונקציה של המסלולים GF עם הפרדיגמה הזו כל 5 דקות עד 15 דקות (איור 4). עם זאת, במרווחים קצרים יותר או תקופות ארוכות יותר ניטור גם אפשרי.
- על מנת לבחון האם המתחם יש השפעה בצמתים neuromuscular (NMJs) של GFS, ואולי גם לצמצם את ההשפעות של המתחם, להמשיך להפעיל את הנוירונים המנוע directly ידי גירוי החזה. לשם כך, להסיר את האלקטרודות מגרה מהעיניים ולהחליף אותם בצידי הקדמי של בית החזה על מנת לעורר את הנוירונים המוטוריים עם 10 רכבות של 10 גירויים ב 100 הרץ.
הערה: עקבות electrophysiology רואים בסרט לא מתאימות את ההשפעות של הזרקת צבע טהור.
5. נציג תוצאות
ההשפעה של אנטגוניסט על PSI ל DLM סינפסה של מערכת סיבים ענק
Methyllycaconitine ציטרט (MLA) הוא אנטגוניסט nAChR ספציפי עבור α7 תת nAChR. PSI כדי DLMn סינפסה במסלול GF-DLM תלויה תת Dα7 nAChR לתפקוד תקין, תוך הסרת הגנטי של תת Dα7 nAChR אין כל השפעה על מסלול GF-TTM 5,6. כדי להמחיש את הספציפיות ואת הרגישות של assay שלנו אנחנו מזריקים MLA בריכוזים שונים (0, 0.02, 0.04, 0.08, 0.12 נ"ג / מ"ג, 46 NL מוזרק) לתוך הראש של החיה (n = 10 לכל טיפול במתחם, n = 15 לטיפול מלוחים). רק זבובים זכרים (של גנוטיפ בטבע הפראי מסוג 10E) שימשו, ואת ההשפעה של המתחם היה פיקוח עבור סכום כולל של 15 דקות לאחר ההזרקה.
איור 5 מתאר את ההבדל בין הקלטות הבסיס שהתקבלו לפני הזריקה לבין אלה מתקבלים לאחר ההזרקה בתגובה MLA פתרון בקרת מלוחים. מצאנו כי הזרקת MLA הביא חוסר היכולת של מסלול GF-DLM ללכת אחד על אחד 100 הרץ על ידי גירויים של GFS במוח תוך מסלול GF-TTM נותר ללא פגע. (איור 5, סימן ו באמצע הדף, לא בדיקה שבוצעה בין שולטת מלוחים [0 ng / mg] לבין ריכוזים שונים של MLA בנקודה בכל פעם אלא אם כן הנתונים הלא פרמטרית [נורמליות ו שונויות שוות נבדק], אחרת אנו משתמשים Mann-Whitney סכום מבחן דרגה. * p <0.001). עם זאת, r 1-to-1esponse של DLM נצפתה כאשר הנוירונים המוטוריים היו מגורה ישירות (איור 5, זכר למטה), הוכחת כי את הפונקציה NMJ של DLM ו TTM אינו מושפע MLA. MLA הופיע להגיע 1 דקות המקסימלית שלה השפעה לאחר ההזרקה של 0.04, 0.08 ו - 0.12 ng / מ"ג MLA מוזרק, שכן אין שינויים משמעותיים נוספים נרשמו במהלך 15 הדקות הבאות של תקופת הבדיקה. יתר על כן, מתחם הגיע השפעה מקסימלית על 0.08 ng / mg מאז תגובות חזקות יותר לא נצפו עם מינון גבוה יותר של 0.12 ng / mg.
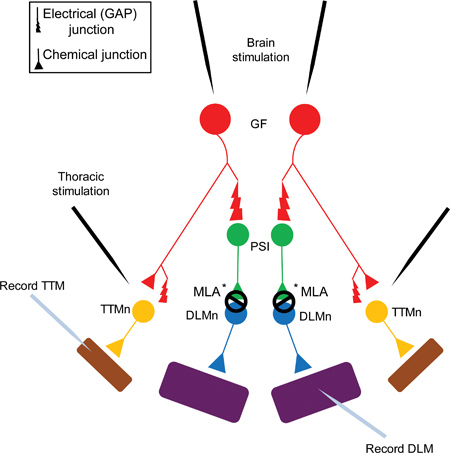
באיור 1. סיבים הענק מערכת דיאגרמה של מערכת סיבים הענק (GFS). סיבי ענק (GFS, באדום) סינפסה חשמלית (GAP כלאיים), וכן כימי (כולינרגית) על Interneuron Synapsing היקפיים (PSI, המוצג ירוק) נוירון Trochanteral שריר Tergo (TTMn, שמוצג צהוב) 5. PSאני חיבור (שריר הגבי נוירון אורך, מוצגים בכחול) DLMn תלויה תת nAChR Dα7 6. לבסוף צומת neuromuscular (NMJ) של TTMn ו DLMn על קפיצה (TTM, שמוצג סגול) ואת שרירי התעופה (DLM, שמוצג סגול) הוא glutamatergic.
הערה: GF לקשר PSI הוא גם חשמלי וכימי. עם זאת, מוטציות shakB (אשר חסרים צמתים GAP), פניות אלה לא ניתן להקליט מ DLM על גירוי של GFS במוח, הוכחת כי מרכיב כימי בהעדר חיבורי חשמל אינו מספיק כדי לעורר פוטנציאל פעולה PSI 5,16-18. כי GF לקשר PSI הוא צומת תלוי הפער, נתון זה מראה רק את צומת GAP בסינפסה מסיבות הפשטות.

איור 2.
Micromanipulators יםet-up.
- שינוי הגדרת של הפרוטוקול שפורסם קודם לכן 14 משמש כדי להתאים micromanipulator הזרקת עבור לזווג הקלטות GFS עם nanoinjections בו זמנית. הכנה זבוב רכוב מכוונת עם ראש של זבוב לקראת הניסוי. Micromanipulator ההזרקה (# 1) ממוקם מול הנסיין בין שני המניפולטורים עבור אלקטרודות טונגסטן מגרה (2 # ו # 3). שני micromanipulators עבור ההקלטה אלקטרודות זכוכית (# 4 ו # 5) ממוקמים בצד שמאל וימין בהתאמה. Micromanipulator עבור אלקטרודה טונגסטן הקרקע (# 6) ממוקם רחוק מאחור או בצד שמאל (המוצג כאן) או בצד ימין.
- סגור את הנוף העליון של ההסדרים של אלקטרודות שונות micropipette ההזרקה.
- מותקן כראוי ד melanogaster משופדת עם אלקטרודות micropipette הזרקת מוכן להזרקה. שימו לב כי בעלי החיים של הגוףהוא רכוב עם החזה שלה אופקית כנפיו פרושות. שעווה עטוף היטב סביב גופו למנוע את החיה לנוע. בנוסף, את האלקטרודה הקרקע (# 6, בחלל הבטן), ההקלטה זכוכית אלקטרודות (# 4 ו # ב בית החזה, 5, מודגשת על ידי קווי מתאר שחורים), וכן אלקטרודות גירוי (מס '2 ו -3, אחד בכל עין ) הם משופד במקום, כפי שתואר קודם לכן 14. Micropipette ההזרקה (# 1) מיושר כראוי עם מרכז של 3 ocelli (מוקף בעיגול). החדרת micropipette הזרקת צריך להיות ממוקם באזור זה.
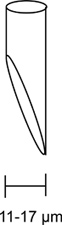
איור 3. Micropipette זריקה משופעת. תרשים של micropipette משופעים כראוי מוצג כאן. פתיחת האלקטרודה יש משופעים בזווית של 45 מעלות ויש לי פתח בין 11 ל 17 מיקרומטר. Micropipette נכונה הזרקת beveled חיונית הזרקת חלקה עם d מינימליamage כדי לטוס.
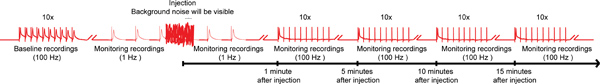
באיור 4. התוכנית הכוללת של פרוטוקול nanoinjection / electrophysiology. תרשים נציג תכנית כוללת nanoinjection / פרוטוקול electrophysiology. התחל על ידי קבלת הקלטה בסיסית על ידי גירוי של סיבי ענק (GFS) ב 100 הרץ עם 10 רכבות של 10 גירויים כל אחד (רק רכבת אחת המוצג כאן). לפני הזריקה, להתחיל את הגירויים 1 הרץ 1 2 מזה. בזמן ההזרקה (תוך כדי ההזרקה מחוברת לתיבת שליטה), תוכלו לצפות רעשי רקע משמעותי, עם זאת, אין להפסיק את ההקלטות. לאחר ההזרקה (ו ההזרקה הוא ניתק מתיבת שליטה), המשך גירוי 1 הרץ לרגע על 1 יותר. בסופו של דבר, המשך להדגיש GFS עם 10 רכבות של 10 גירויים ב 100 הרץ ולהמשיך לבדוק את הפונקציה של המסלולים GF עם הפרדיגמה הזו כל 5 דקות עד 15 דקות. הערה: הקלטות Wפה מניפולציה כדי ליצור תוכנית הכוללת אינם מייצגים תוצאה ספציפית להשיג. לא בקנה מידה, לא זכר את כל מוצגים. לחץ כאן לקבלת תמונה מוגדלת .
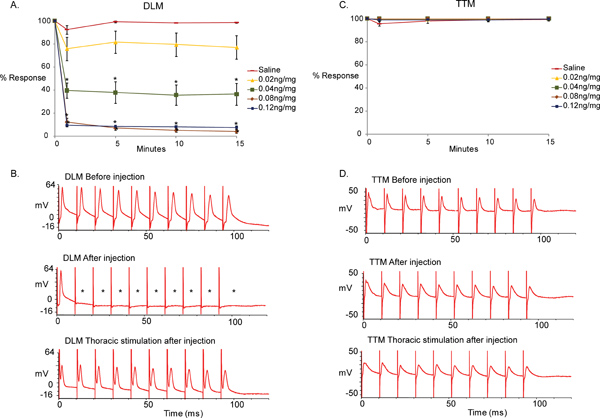
איור 5. את ההשפעות של MLA של GFS.
- תיאור גרפי של ההשפעה של ציטראט α7 אנטגוניסט nAChR Methyllycaconitine (MLA) על מסלול GF-DLM של זבוב הפירות בריכוזים שונים (0, 0.02, 0.04, 0.08, 0.12 ng / n = 10 מ"ג לכל טיפול במתחם. n = 15 לטיפול מלוחים). רק דקה אחת לאחר ההזרקה, השפעה משמעותית ומיידית נראה עם 0.04 ng / מ"ג MLA. אפקט משמעותי היה לראות גם עם 0.8ng/mg ו 0.12ng/mg של MLA על גירוי 100Hz של GFS. הבדל משמעותי צוין בין הפקדים מליחים 0.02 ng / מ"ג MLA. כמו כן, לא חל שינוי אניאפקט n נראה לאחר ההזרקה 1 בהודעה דקות בזמן נבדק (15 דקות). מבחן t נערך בין שולטת מלוחים (0 נ"ג / מ"ג) לבין ריכוזים שונים של MLA בנקודה בכל פעם. רמות כפי שדווח ממוצע + / - SEM, * p <0.001.
- לדוגמא עקבות של התגובות DLM על גירוי Hz 100. זכר למעלה מראה את התגובות של השריר לפני הזרקת MLA על גירוי GF במוח. שמתי לב, שריר הוא מסוגל להגיב לגירוי אחד אחד על אחד 100 הרץ. התיכון עקבות מציג את תשובותיהם של DLM לאחר הזרקת MLA (0.12 ng / mg). שימו לב כי השריר אינו מסוגל להגיב לגירוי אחד אחד על אחד 100 הרץ. (כוכביות). זכר התחתון מראה את התגובות של DLM ההכנה זהה (0.12 ng / mg) על גירוי ישיר של הנוירונים המוטוריים של בית החזה. בגלל DLM מגיב אחד על אחד 100 הרץ עם גירוי החזה, אי ספיקת התגובות עם גירויים במוח ניתן לייחס את חיבור PSI-DLMn כולינרגית.
- תיאור גרפי של תופעות שונות עם ריכוזים MLA (0, 0.02, 0.04, 0.08, 0.12 ng / mg) על מסלול GF-TTM. תופעות לא משמעותיים נראו בין מלוחים (0 נ"ג / מ"ג) זריקות מתחם בכל נקודת זמן. מבחן t נערך בין שולטת מלוחים (0 נ"ג / מ"ג) לבין ריכוזים שונים של MLA בכל נקודת זמן, * p <0.001.
- לדוגמא עקבות של התגובות TTM על גירוי Hz 100. זכר למעלה מראה את התגובות של השריר לפני MLA זריקה עם הפעלת GF עם גירוי במוח. שמתי לב, שריר הוא מסוגל להגיב לכל גירוי ב 100 הרץ. התיכון זכר מראה את התגובות של DLM לאחר הזרקת MLA (0.12 ng / mg). התגובות של השריר TTM לגירוי של GF במוח נשארים אחד על אחד. זכר התחתון מראה את התגובות של TTM ההכנה זהה לגירוי 100 הרץ של הנוירונים המוטוריים של בית החזה (0.12 ng / mg).
Discussion
המבדק nanoinjection / electrophysiology המוצג כאן מאפשר סינון מהיר של תרכובות במערכת העצבים של זבוב הפירות. זהו רומן בטכניקה vivo הדורש כמויות קטנות של חומר כדי לעורר השפעה על מגוון רחב של מטרות מולקולריות במעגל עצבי היטב מאופיין. בשיטה זו ניתן להשתמש כדי לבדוק את bioactivity של תרכוב?...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
היינו רוצים להכיר את חברי המעבדה מארי ואת המעבדה Godenschwege, במיוחד אלין Yonezawa, להערות ועזרה פרוטוקול זה. עבודה זו מומנה על ידי המכון הלאומי להפרעות נוירולוגיות ושבץ מענק R21NS06637 כדי FM, TAG, א.ב. מומן על ידי מספר קרן המדע הלאומית פרס 082925, URM: לביולוגיה אינטגרטיבית עבור חוקרים עתידיים.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| אלקטרודות זכוכית הקלטה: ההתכה של זכוכית בורו נימים | Precision של מכשירים בעולם | 1B100F-4 | 1.0mm OD, 0.58mm מזהה |
| ממריץ | דשא מכשירים | דגם S48 | |
| מגבר | קבלת מכשירים בע"מ | דגם 5 א | |
| נתונים רכישת תוכנה: Digidata | התקנים מולקולריים | דגם 1440A | |
| נתונים אוסף תוכנות: pCLAMP | התקנים מולקולריים | גרסה 10 | |
| סטראו Wסיבים אופטיים ith מיקרוסקופ טבעת הפנס | AmScope | SM-4T דגם HL250-AR | |
| לנתח את היקף עבור הרכבה | AmScope | SM-2TZ | |
| עפיפון ידני micromanipulator & הטיה מאגר | Precision של מכשירים בעולם | דגם # M3301 העפיפונים: דגם # עפיפון M3-L | |
| תסיסנית melanogaster הפרוע 10E גנוטיפ (זן סוג בר) | Bloomington צילומים מרכז | המניות # 3892 | |
| אנכי פיפטה חולץ | דוד קופף מכשירים | דגם 700c | |
| זכוכית הזרקת micropipettes: ההתכה של זכוכית בורו נימים | Precision של מכשירים בעולם | קטלוג # 4878 | 1.14mm OD, 0.5mm ID |
| הסיליקון שמן | דיג | קטלוג # S159-500 | |
| Beveler | סאטר כלי ושות | KT סוג בראון מק"ט BV-10 | |
| Nanoliter2000 | Precision של מכשירים בעולם | קטלוג # B203XVY | |
| מזון כחול צביעה | מקורמיק | N / A | מרכיבים: מים, פרופילן גליקול, FD & C כחול 1, ו -0.1% Propylparaben (חומר משמר). |
| Methyllycaconitine ציטרט (MLA) | Bioscience Tocris | קטלוג # 1029 | |
| שעווה מקלות פלסטיק | Hygenic Corporation (אקרון אוהיו ארה"ב) |
References
- Koehn, F. E., Carter, G. T. The evolving role of natural products in drug discovery. Nat. Rev. Drug Discov. 4, 206-220 (2005).
- Miljanich, G. P. Ziconotide: neuronal calcium channel blocker for treating severe chronic pain. Curr. Med. Chem. 11, 3029-3040 (2004).
- Layer, R. T., Wagstaff, J. D., White, H. S. Conantokins: peptide antagonists of NMDA receptors. Curr. Med. Chem. 11, 3073-3084 (2004).
- Lewis, R. J. Conotoxins as selective inhibitors of neuronal ion channels, receptors and transporters. IUBMB Life. 56, 89-93 (2004).
- Allen, M. J., Godenschwege, T. A., Tanouye, M. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Fayyazuddin, A., Zaheer, M. A., Hiesinger, P. R., Bellen, H. J. The nicotinic acetylcholine receptor Dalpha7 is required for an escape behavior in Drosophila. PLoS biology. 4, e63 (2006).
- Jan, L. Y., Jan, Y. N. L-glutamate as an excitatory transmitter at the Drosophila larval neuromuscular junction. The Journal of physiology. 262, 215-236 (1976).
- Usherwood, P. N., Machili, P., Leaf, G. L-Glutamate at insect excitatory nerve-muscle synapses. Nature. 219, 1169-1172 (1968).
- Marrus, S. B., Portman, S. L., Allen, M. J., Moffat, K. G., DiAntonio, A. Differential localization of glutamate receptor subunits at the Drosophila neuromuscular junction. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 1406-1415 (2004).
- Petersen, S. A., Fetter, R. D., Noordermeer, J. N., Goodman, C. S., DiAntonio, A. Genetic analysis of glutamate receptors in Drosophila reveals a retrograde signal regulating presynaptic transmitter release. Neuron. 19, 1237-1248 (1997).
- Qin, G. Four different subunits are essential for expressing the synaptic glutamate receptor at neuromuscular junctions of Drosophila. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 3209-3218 (2005).
- Schuster, C. M. Molecular cloning of an invertebrate glutamate receptor subunit expressed in Drosophila muscle. Science. 254, 112-114 (1991).
- Tanouye, M. A., Wyman, R. J. Motor outputs of giant nerve fiber in Drosophila. Journal of. 44, 405-421 (1980).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. (47), e2412 (2011).
- Allen, M. J., Godenschwege, T., Zhang, B., Freeman, M. R., Waddell, S. . Drosophila Neurobiology. , 215-224 (2010).
- Blagburn, J. M., Alexopoulos, H., Davies, J. A., Bacon, J. P. Null mutation in shaking-B eliminates electrical, but not chemical, synapses in the Drosophila giant fiber system: a structural study. J. Comp. Neurol. 404, 449-458 (1999).
- Thomas, J. B., Wyman, R. J. Mutations altering synaptic connectivity between identified neurons in Drosophila. J. Neurosci. 4, 530-538 (1984).
- Baird, D. H., Schalet, A. P., Wyman, R. J. The Passover locus in Drosophila melanogaster: complex complementation and different effects on the giant fiber neural pathway. Genetics. 126, 1045-1059 (1990).
- Gorczyca, M., Hall, J. C. Identification of a cholinergic synapse in the giant fiber pathway of Drosophila using conditional mutations of acetylcholine synthesis. J. Neurogenet. 1, 289-313 (1984).
- Allen, M. J., Murphey, R. K. The chemical component of the mixed GF-TTMn synapse in Drosophila melanogaster uses acetylcholine as its neurotransmitter. The European journal of neuroscience. 26, 439-445 (2007).
- Mejia, M. A novel approach for in vivo screening of toxins using the Drosophila Giant Fiber circuit. Toxicon. 56, 1398-1407 (2010).
- Stork, T. Organization and function of the blood-brain barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved