È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Nanoinjection associato e test Elettrofisiologia allo schermo per la bioattività dei composti con il Drosophila melanogaster Sistema Fiber Giant
In questo articolo
Riepilogo
Un rapido In vivo Test per verificare i composti neuromodulatori che utilizzano il sistema di Giant Fiber (GFS) di Drosophila melanogaster Descritto. Nanoinjections nella testa dell'animale insieme registrazioni elettrofisiologiche di GFS può rivelare la bioattività dei composti sui neuroni e muscoli.
Abstract
Composti di screening per l'attività in vivo può essere utilizzato come un primo passo per identificare candidati che possono essere sviluppati in 1,2 agenti farmacologici. Abbiamo sviluppato un nanoinjection / elettrofisiologia nuovo metodo di analisi che permette il rilevamento di effetti modulatori di composti bioattivi sulla funzione di un circuito neuronale che media la risposta di fuga in Drosophila melanogaster 3,4. Il saggio in vivo, che utilizza la fibra Drosophila Giant System (GFS, Figura 1) permette lo screening dei vari tipi di composti, come piccole molecole o peptidi, e richiede quantità minime per provocare un effetto. Inoltre, il GFS Drosophila offre una grande varietà di potenziali bersagli molecolari sui neuroni e muscoli. Le fibre giganti (GFS) sinapsi elettricamente (Gap Junction) e chimicamente (colinergica) su una sinapsi Interneuron Peripheral (PSI) e il Trochanteral Tergo Muscle neurone (TTMn) 5 6. Infine, la giunzioni neuromuscolari (NMJ) del TTMn e la DLMn con il salto (TTM) e dei muscoli di volo (DLM) sono glutamatergica 7-12. Qui, si dimostra come iniettare quantità nanolitri di un composto, ottenendo registrazioni elettrofisiologiche intracellulari dal sistema fibra Giant 13 e come controllare gli effetti del composto sulla funzione di questo circuito. Mostriamo la specificità del test con citrato methyllycaconitine (MLA), un antagonista nAChR, che interrompe il PSI di DLMn connessione, ma non il GF a TTMn connessione o la funzione del NMJ al salto o dei muscoli del volo.
Prima di iniziare questo video, è fondamentale che si guarda con attenzione e familiarizzare con il video intitolato "JOVE registrazioni elettrofisiologiche dal sentiero fibra gigante di D. Melanogaster "da Augustin et al 7, come il video presentato qui è inteso come un ampliamento di questa tecnica esistente. Qui si utilizza il metodo elettrofisiologico registrazioni e focalizzazione in dettaglio solo l'aggiunta delle nanoinjections accoppiati e la tecnica di monitoraggio.
Protocollo
1. Elettrofisiologia Rig Set-up
- L'attrezzatura necessaria per l'impianto elettrofisiologia set-up è descritto in dettaglio da Augustin et al. in questo Journal 14. Si prega di fare riferimento a questo articolo per una spiegazione dettagliata degli apparati elettrofisiologici necessari.
- Modificare il precedentemente descritto elettrofisiologia rig set-up 14 con l'aggiunta di un micromanipolatore sesto, che detiene il nanoinjector. Per accedere facilmente alla testa dell'animale deve essere collocato tra i due elettrodi micromanipolatori stimolanti come mostrato nella Figura 2.
- Prima di iniziare l'esperimento, assicurarsi di avere una gamma comoda su tutti gli assi di rotazione con tutti i micromanipolatori, e che tutti gli elettrodi e la micropipetta iniezione (vedi punto 2) può raggiungere l'animale.
2. Nanoinjection Set-up
- Il nanoinjection set-up richiede un Nanoliter2000 (World Precisisugli strumenti, Sarasota, FL, USA) o altri tipi di iniettore che permette iniezioni controllate in quantità nanolitri.
- Preparare ago per iniezione utilizzando le micropipette di vetro forniti con l'iniettore tirando ad una resistenza di 80-100 mQ con un estrattore elettrodo.
- Per iniezioni lisce è necessario smussare le micropipette ad un'apertura 11-17 micron ad un angolo di 45 gradi (Figura 3).
- Lentamente la micropipetta in sostegno degli iniezione con olio sintetico, utilizzando una siringa Hamilton come da istruzioni del manuale Nanoliter2000, assicurandosi che non siano presenti bolle d'aria.
- Cautela fissare il micropipetta sul nanoinjector e si prepara a caricare il composto con lo svuotamento olio in eccesso secondo le istruzioni del manuale Nanoliter2000.
- Posizionare l'iniettore sul micromanipolatore e caricare il composto come indicato nel manuale Nanoliter2000. Assicurarsi che la punta della micropipetta non si rompe durante questoprocedura.
- Impostare la quantità desiderata di nanolitri da iniettare nella casella di controllo dell'iniettore secondo le istruzioni del manuale Nanoliter2000. Si prega di notare che l'iniezione di importo complessivo non deve superare i 100 nl. Abbiamo trovato che grandi quantità di soluzioni saline controllo può influenzare la funzione del circuito GFS.
- È fondamentale disporre l'iniettore scollegato dalla scatola di controllo durante l'acquisizione di registrazione con l'eccezione della stessa iniezione, poiché l'alimentazione del nanoinjector interferisce con le registrazioni, che è visibile come rumore di fondo (Figura 4). Tuttavia, non togliere l 'alimentazione alla scatola di controllo come sarà ri-impostato.
3. Drosophila melanogaster Preparazione
- Anestetizzare da 2 a 6 mosche giorno di vita con la CO 2 o su ghiaccio come descritto in precedenza 14,15.
- Una volta immobile, usare un paio di pinzette per trasferire l'animale a una rete Wi piccolo piattoth cera molle dentale raccoglierlo dalle sue gambe. Si prega di notare che un moscerino della frutta maschio pesa circa 1,0 mg e un moscerino della frutta femmina pesa circa 1,2 mg, così composto a corpo rapporto peso è diverso nei moscerini maschi contro femmine. Pertanto, si raccomanda di utilizzare solo un genere per gli esperimenti.
- Come descritto in precedenza 14,15, con attenzione montare la mosca lato dorsale fino e assicurare che il torace e la testa vengono immobilizzati con morbida cera dentale disposte intorno al corpo. Attentamente diffondere le ali in modo che depongono perpendicolare al torace (Figura 2, C). La mosca deve essere montato con il minor danno possibile.
4. Nanoinjection associati / elettrofisiologia
- Posizionare il fly montato sul rig elettrofisiologia con la testa verso gli elettrodi stimolanti.
- Infilzare l'animale con il corrispondente stimolante, a terra e gli elettrodi di registrazione come descritto in precedenza 14,15 (FIGURA 2, C). Salvo diversa desiderato, posto un elettrodo di registrazione nel DLM e l'altra nel muscolo TTM. Il muscolo DLM è situato nel torace tra le anteriori dorso-centrali capelli e la linea mediana della mosca. Il muscolo TTM si trova vicino gli allegati ala, tra le anteriori e posteriori Supra-alari peli della mosca 7.
- Allineare la micropipetta iniezione contenente il composto con il centro delle tre ocelli situata sulla porzione mediale posteriore della testa, ma non ancora iniettare (figura 2, C).
- Prima di compound per iniezione di ottenere una registrazione di base del GF di TTM e GF a DLM percorsi del sistema Fiber Giant (GFS, Figura 1) attraverso la stimolazione del cervello. Per farlo, attivare le fibre giganti (GFS) con 10 treni di 10 stimoli (40-50 mV), ciascuno determinato per una durata di 0,03 ms a 100 Hz con un ritardo di 1 secondo tra i treni 14,15 (Figura 4). Tipo selvatico vola should essere in grado di seguire one-to-one a questo ritmo di stimolazione sia per DLM e le vie di TTM. Eliminare la mosca se il GF di DLM e GF a percorsi TTM non seguono la stimolazione 100 Hz con un rapporto 1:1.
- Passa alla stimolazione continua del GF con singoli impulsi a 1 Hz (Figura 4).
- Collegare rapidamente l'iniettore nella casella di controllo. Anche se il rumore di fondo interferisce con le registrazioni 1 Hz stimolazione, non interrompere.
- Inserire delicatamente la micropipetta iniezione nella capsula testa della mosca appena sotto il cuticule, e iniettare la quantità desiderata di composto nella emolinfa della mosca mantenendo la stimolazione 1 Hz (Figura 4). Grazie al sistema circolatorio aperto della mosca, l'intero sistema nervoso verrà esposta al composto in pochi secondi. Anche se un particolare sito di iniezione non è critico per fornire composti nella emolinfa, troviamo la regione del ocelli, che vengono localizzared mediale sul lato più dorsale della capsula testa, per essere un sito conveniente che consente una facile iniezione che porta ad una distribuzione rapida ed uniforme del composto.
- Rimuovere immediatamente micropipetta iniezione dal sito di iniezione e scollegare l'iniettore dalla casella di controllo, pur continuando la stimolazione GF 1 Hz fino a 1 min dopo l'iniezione (figura 4).
- Al fine di rivelare effetti più sottili di composti sulla GFS, sottolineano le fibre giganti (GFS) con 10 treni di 10 stimoli a 100 Hz con un ritardo di 1 secondo tra i treni. Continua per testare la funzione dei percorsi GF con questo paradigma ogni 5 minuti fino a 15 minuti (Figura 4). Tuttavia, intervalli più brevi o più lunghi periodi di monitoraggio sono inoltre possibili.
- Al fine di verificare se il composto ha un effetto a giunzioni neuromuscolari (NMJs) del GFS, ed eventualmente ridurre gli effetti del composto, procedere per attivare il motore neuroni direzioneTLY dalla stimolazione toracica. Per questo, rimuovere gli elettrodi stimolatori dagli occhi e sostituirli sui lati anteriori del torace per stimolare i neuroni motori con 10 treni di 10 stimoli a 100 Hz.
Nota: Le tracce elettrofisiologia mostrati nel video non corrispondono agli effetti di iniezione colorante puro.
5. Risultati rappresentativi
Effetto di un antagonista del PSI di DLM sinapsi del sistema Fiber Giant
Methyllycaconitine citrato (MLA) è un antagonista nAChR che è specifico per α7 sottotipi nAChR. Il PSI di DLMn sinapsi in GF-DLM percorso dipende dal sottotipo Dα7 nAChR per il corretto funzionamento, mentre la rimozione genetica di Dα7 sottotipo nAChR ha alcun effetto sulla GF-TTM percorso 5,6. Per dimostrare la specificità e la sensibilità del nostro dosaggio MLA abbiamo iniettato a differenti concentrazioni (0, 0,02, 0,04, 0.08, 0,12 ng / mg, 46 nl iniettato) nella testa dell'animale (n = 10 per il trattamento composto; n = 15 per il trattamento salino). Solo le mosche maschio (di tipo selvatico genotipo selvatico 10E) sono stati utilizzati, e l'effetto del composto è stata monitorata per un totale di 15 minuti dopo l'iniezione.
Figura 5 illustra la differenza tra registrazioni di base ottenute prima dell'iniezione e quelli ottenuti dopo l'iniezione in risposta a MLA e soluzione salina di controllo. Abbiamo trovato che l'iniezione di MLA ha portato alla incapacità del GF-DLM percorso da seguire one-to-one a 100 Hz da stimoli del GF nel cervello, mentre il GF-TTM percorso rimasto inalterato. (Figura 5, traccia top e middle, t-test eseguito tra i controlli saline [0 ng / mg] e le diverse concentrazioni di MLA ad ogni tempo a meno che i dati non è parametrico [normalità e varianze uguali testato], altrimenti usiamo uno Mann-Whitney test somma dei ranghi. * p <0,001). Tuttavia, uno-a-uno response del DLM è stata osservata quando i motoneuroni sono stati stimolati direttamente (Figura 5, traccia inferiore), dimostrando che la funzione NMJ del DLM e TTM non è influenzata da MLA. MLA è apparso per raggiungere il suo massimo effetto 1 minuto dopo l'iniezione per 0,04, 0,08 e 0,12 ng / mg di MLA iniettato, poiché non sono cambiamenti significativi sono stati notati durante i successivi 15 minuti di periodo di prova. Inoltre, il composto ha raggiunto un effetto massimo a 0,08 ng / mg poiché forti risposte non sono state osservate con la dose maggiore di 0,12 ng / mg.
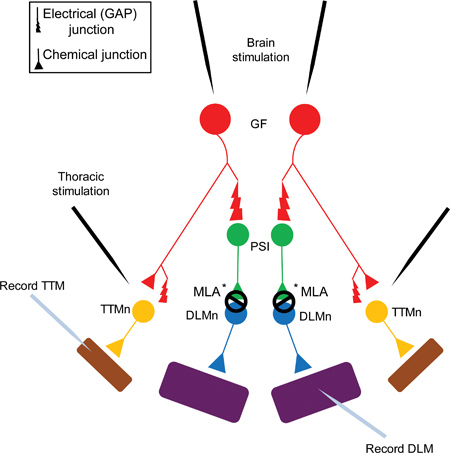
Figura 1. Il Gigante Diagramma di fibra del Sistema Fiber Giant (GFS). Le fibre giganti (GFS, mostrato in rosso) sinapsi elettricamente (Gap Junction) e chimicamente (colinergica) su un Interneuron sinapsi periferica (PSI, mostrati in verde) e il Trochanteral Tergo neurone muscolare (TTMn, mostrato in giallo) 5. Il PSI DLMn (dorsale neurone muscolare longitudinale, in blu) la connessione dipende Dα7 sottotipo nAChR 6. Infine, la giunzione neuromuscolare (NMJ) del TTMn e DLMn sul salto (TTM, mostrato in viola) e dei muscoli di volo (DLM, mostrato in viola) è glutamatergica.
Nota: il GF e la connessione di PSI è sia elettrica e chimica. Tuttavia, in mutanti shakB (che mancano giunzioni), nessuna risposta può essere registrato dal DLM dopo stimolazione del FG nel cervello, dimostrando che il componente chimico in assenza di collegamenti elettrici non è sufficiente a evocare un potenziale di azione nella PSI 5,16-18. Perché il GF alla connessione PSI è giunto dipende gap, questa figura mostra solo il bivio GAP alla sinapsi per ragioni di semplicità.

Figura 2.
Micromanipolatori set-up.
- Una versione modificata del set-up di uno precedentemente pubblicato con il protocollo 14 è utilizzato per adattare il micromanipolatore iniezione per coppie di registrazioni GFS con nanoinjections simultanei. La preparazione fly montato è orientato con la testa della mosca verso lo sperimentatore. Il micromanipolatore iniezione (# 1) è posto di fronte al sperimentatore tra i due manipolatori per gli elettrodi di tungsteno stimolante (# 2 e # 3). I due elettrodi di registrazione micromanipolatori per il vetro (# 4 e # 5) sono disposti sul lato sinistro e destro, rispettivamente. Il micromanipolatore per l'elettrodo di massa di tungsteno (# 6) è posto più lontano nella parte posteriore o sul lato sinistro (qui illustrato) o sul lato destro.
- Una stretta vista dall'alto del regime dei vari elettrodi e micropipette iniezione.
- Un montato correttamente D. melanogaster impalato con elettrodi e micropipette iniezione pronta per l'iniezione. Si noti che il corpo dell'animaleè montato con il torace in orizzontale e le sue ali sparsi. La cera viene saldamente avvolto attorno al corpo impedendo l'animale da movimento. Inoltre, l'elettrodo di massa (# 6, nell'addome), gli elettrodi di registrazione di vetro (# 4 e # 5, nel torace, evidenziato da contorni scuri), e gli elettrodi stimolatori (# 2 e # 3, uno in ciascun occhio ) sono impalati in posizione, come descritto in precedenza 14. La micropipetta di iniezione (# 1) sia correttamente allineato con il centro dei tre ocelli (cerchiato). Inserimento della micropipetta iniezione deve essere posto in questo settore.
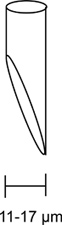
Figura 3. Micropipetta iniezione smussato. Un diagramma di una micropipetta correttamente smussati viene mostrato qui. L'apertura elettrodo deve essere smussata con un angolo di 45 gradi e ha un'apertura tra 11 a 17 um. Una micropipetta corretta iniezione smussata è cruciale per una iniezione regolare con un minimo damage al fly.
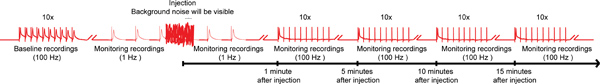
Figura 4. Schema generale della nanoinjection / elettrofisiologia protocollo. Un diagramma rappresentante del regime generale per la nanoinjection / protocollo elettrofisiologia. Iniziare ottenendo una registrazione di base, stimolando le fibre giganti (GFS) a 100 Hz con 10 treni di 10 stimoli ciascuna (un solo treno mostrato qui). Prima dell'iniezione, iniziare le stimolazioni 1 Hz uno secondo di distanza. Durante il tempo di iniezione (iniettori, mentre è collegato alla centralina di controllo), si potrà osservare il rumore di fondo significativo, tuttavia, non interrompere le registrazioni. Dopo l'iniezione (iniettore e sia scollegato dalla scatola di controllo), continuare la stimolazione 1 Hz per circa 1 minuto in più. Infine, procedere a sottolineare la FG con 10 treni di 10 stimoli a 100 Hz e continuare a testare la funzione delle vie GF con questo paradigma ogni 5 minuti fino a 15 minuti. Nota: le registrazioni were manipolate per creare lo schema generale e non rappresentano un risultato specifico ottenuto. Non in scala, non tutte le tracce vengono visualizzati. Clicca qui per ingrandire l'immagine .
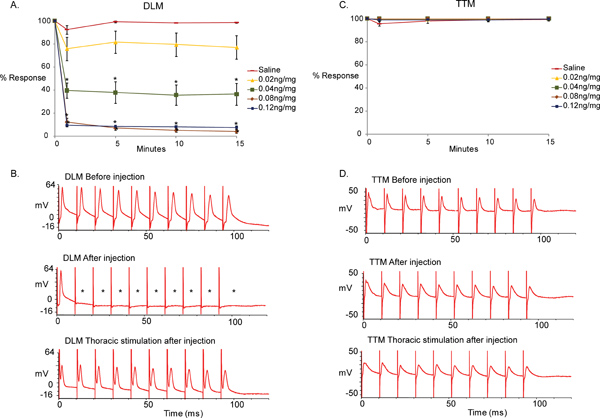
Figura 5. Gli effetti di mutua assistenza giudiziaria in GFS.
- Una rappresentazione grafica degli effetti dell'antagonista α7 citrato nAChR Methyllycaconitine (MLA) sul GF-DLM percorso della mosca della frutta a diverse concentrazioni (0, 0,02, 0,04, 0,08, 0,12 ng / mg n = 10 per il trattamento composto.; n = 15 per il trattamento salino). Solo un minuto dopo l'iniezione, un effetto significativo e immediato è stato visto con 0,04 ng / mg di MLA. Un effetto significativo è stato osservato anche con 0.8ng/mg e 0.12ng/mg di MLA a 100Hz stimolazione del GFS. Nessuna differenza significativa è stata osservata tra i controlli saline e 0,02 ng / mg di MLA. Inoltre, non posso cambiaren effetto è stato osservato dopo 1 minuto dopo l'iniezione durante il tempo di prova (15 minuti). A t-test è stato eseguito tra i controlli saline (0 ng / mg) e le concentrazioni diverse di MLA ad ogni tempo. I livelli sono riportati come media + / - SEM, * p <0,001.
- Tracce del campione delle risposte DLM a 100 Hz stimolazione. Traccia in alto mostra le risposte del muscolo prima dell'iniezione MLA GF dopo stimolazione nel cervello. Si noti che il muscolo è in grado di rispondere ad ogni stimolo uno-ad-uno a 100 Hz. Medio traccia mostra le risposte del DLM MLA dopo l'iniezione (0,12 ng / mg). Si noti che il muscolo non è in grado di rispondere ad ogni stimolo uno-a-uno a 100 Hz. (Asterischi). Traccia in basso mostra le risposte del DLM della stessa preparazione (0,12 ng / mg) dopo stimolazione diretta dei motoneuroni del torace. Poiché DLM risponde uno-ad-uno a 100 Hz con stimolazione toracica, il fallimento delle risposte con stimolazioni cerebrali può essere attribuita alla colinergica PSI-DLMn collegamento.
- Una rappresentazione grafica degli effetti con differenti concentrazioni di MLA (0, 0,02, 0,04, 0,08, 0,12 ng / mg) sul GF-TTM percorso. Non sono stati osservati effetti significativi tra salina (0 ng / mg) e iniezioni composti in qualsiasi punto nel tempo. A t-test è stato eseguito tra i controlli saline (0 ng / mg) e le concentrazioni diverse di MLA in ogni punto temporale, * p <0,001.
- Tracce del campione delle risposte TTM a 100 Hz stimolazione. Traccia in alto mostra le risposte del muscolo prima di MLA al momento dell'attivazione di iniezione GF con la stimolazione nel cervello. Si noti che il muscolo è in grado di rispondere a tutti gli stimoli a 100 Hz. Medio traccia mostra le risposte del DLM dopo MLA iniezione (0,12 ng / mg). Risposte dal muscolo TTM alla stimolazione del GF nel cervello rimangono uno-a-uno. Traccia in basso mostra le risposte del TTM della stessa preparazione a 100 Hz stimolazione dei neuroni motori nel torace (0,12 ng / mg).
Discussione
Il nanoinjection / elettrofisiologia biotest qui presentata consente un rapido screening di composti nel sistema nervoso del moscerino della frutta. Si tratta di una nuova tecnica in vivo che richiede piccole quantità di un composto per provocare un effetto su una varietà di bersagli molecolari in un circuito ben caratterizzato neuronale. Questo metodo può essere utilizzato per testare la bioattività di diversi composti, da tossine sconosciuti agenti farmacologici disponibili in commercio.
Divulgazioni
Non ci sono conflitti di interesse dichiarati.
Riconoscimenti
Vorremmo ringraziare i membri del laboratorio Mari e il laboratorio Godenschwege, in particolare Aline Yonezawa, per i commenti e aiutare con questo protocollo. Questo lavoro è stato finanziato dall'Istituto Nazionale per la Neurological Disorder and Stroke concessione R21NS06637 di FM e TAG, AB è stato finanziato dalla National Science il premio Foundation numero 082925, URM: Biologia Integrativa per i futuri ricercatori.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| Registrazione elettrodi di vetro: vetro borosilicato capillari | Mondo Strumenti di precisione | 1B100F-4 | 1,0 millimetri OD, 0,58 millimetri ID |
| Stimolatore | Grass Instruments | Modello S48 | |
| Amplificatore | Come Instruments Inc. | Modello 5A | |
| Acquisizione dati Software: Digidata | Molecular Devices | Modello 1440A | |
| Software di raccolta dati: PClamp | Molecular Devices | Versione 10 | |
| Stereomicroscopio wesima fibra ottica microscopio illuminatore anulare | AmScope | SM-4T Modello HL 250-AR | |
| Dissezione possibilità per il montaggio | AmScope | SM-2TZ | |
| Kite & Manual Micromanipolatore Tilting Base | Mondo Strumenti di precisione | Model # M3301 Kite: Model # KITE-M3-L | |
| Drosophila melanogaster selvatica 10E genotipo (ceppo selvatico) | Bloomington magazzino centrale | Stock # 3892 | |
| Vertical pipette puller | David Kopf Instruments | Modello 700c | |
| Iniezione micropipette di vetro: vetro borosilicato capillari | Mondo Strumenti di precisione | Catalogo # 4878 | 1,14 millimetri OD, 0.5mm ID |
| Olio siliconico | Pescatore | Catalogo # S159-500 | |
| Beyeler | Sutter Instrument Co. | KT Brown Type Model # BV-10 | |
| Nanoliter2000 | Mondo Strumenti di precisione | Catalogo # B203XVY | |
| Colorante alimentare blu | McCormick | N / A | Ingredienti: acqua, glicole propilenico, FD & C Blue 1, e 0,1% Propylparaben (conservante). |
| Methyllycaconitine citrato (MLA) | Bioscience Tocris | Catalogo # 1029 | |
| Bastoncini di cera plastica | Hygenic Corporation (Akron Ohio USA) |
Riferimenti
- Koehn, F. E., Carter, G. T. The evolving role of natural products in drug discovery. Nat. Rev. Drug Discov. 4, 206-220 (2005).
- Miljanich, G. P. Ziconotide: neuronal calcium channel blocker for treating severe chronic pain. Curr. Med. Chem. 11, 3029-3040 (2004).
- Layer, R. T., Wagstaff, J. D., White, H. S. Conantokins: peptide antagonists of NMDA receptors. Curr. Med. Chem. 11, 3073-3084 (2004).
- Lewis, R. J. Conotoxins as selective inhibitors of neuronal ion channels, receptors and transporters. IUBMB Life. 56, 89-93 (2004).
- Allen, M. J., Godenschwege, T. A., Tanouye, M. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Fayyazuddin, A., Zaheer, M. A., Hiesinger, P. R., Bellen, H. J. The nicotinic acetylcholine receptor Dalpha7 is required for an escape behavior in Drosophila. PLoS biology. 4, e63 (2006).
- Jan, L. Y., Jan, Y. N. L-glutamate as an excitatory transmitter at the Drosophila larval neuromuscular junction. The Journal of physiology. 262, 215-236 (1976).
- Usherwood, P. N., Machili, P., Leaf, G. L-Glutamate at insect excitatory nerve-muscle synapses. Nature. 219, 1169-1172 (1968).
- Marrus, S. B., Portman, S. L., Allen, M. J., Moffat, K. G., DiAntonio, A. Differential localization of glutamate receptor subunits at the Drosophila neuromuscular junction. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 1406-1415 (2004).
- Petersen, S. A., Fetter, R. D., Noordermeer, J. N., Goodman, C. S., DiAntonio, A. Genetic analysis of glutamate receptors in Drosophila reveals a retrograde signal regulating presynaptic transmitter release. Neuron. 19, 1237-1248 (1997).
- Qin, G. Four different subunits are essential for expressing the synaptic glutamate receptor at neuromuscular junctions of Drosophila. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 3209-3218 (2005).
- Schuster, C. M. Molecular cloning of an invertebrate glutamate receptor subunit expressed in Drosophila muscle. Science. 254, 112-114 (1991).
- Tanouye, M. A., Wyman, R. J. Motor outputs of giant nerve fiber in Drosophila. Journal of. 44, 405-421 (1980).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. (47), e2412 (2011).
- Allen, M. J., Godenschwege, T., Zhang, B., Freeman, M. R., Waddell, S. . Drosophila Neurobiology. , 215-224 (2010).
- Blagburn, J. M., Alexopoulos, H., Davies, J. A., Bacon, J. P. Null mutation in shaking-B eliminates electrical, but not chemical, synapses in the Drosophila giant fiber system: a structural study. J. Comp. Neurol. 404, 449-458 (1999).
- Thomas, J. B., Wyman, R. J. Mutations altering synaptic connectivity between identified neurons in Drosophila. J. Neurosci. 4, 530-538 (1984).
- Baird, D. H., Schalet, A. P., Wyman, R. J. The Passover locus in Drosophila melanogaster: complex complementation and different effects on the giant fiber neural pathway. Genetics. 126, 1045-1059 (1990).
- Gorczyca, M., Hall, J. C. Identification of a cholinergic synapse in the giant fiber pathway of Drosophila using conditional mutations of acetylcholine synthesis. J. Neurogenet. 1, 289-313 (1984).
- Allen, M. J., Murphey, R. K. The chemical component of the mixed GF-TTMn synapse in Drosophila melanogaster uses acetylcholine as its neurotransmitter. The European journal of neuroscience. 26, 439-445 (2007).
- Mejia, M. A novel approach for in vivo screening of toxins using the Drosophila Giant Fiber circuit. Toxicon. 56, 1398-1407 (2010).
- Stork, T. Organization and function of the blood-brain barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon