É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Nanoinjection emparelhado e Eletrofisiologia Ensaio para a tela de bioatividade dos compostos utilizando os Drosophila melanogaster Sistema Fibra Gigante
Neste Artigo
Resumo
Uma rápida In vivo Ensaio para testar compostos neuromoduladores usando o sistema de fibra gigante (GFS) do Drosophila melanogaster É descrito. Nanoinjections na cabeça do animal, juntamente com gravações eletrofisiológicas do GFS pode revelar bioatividade dos compostos nos neurônios ou músculos.
Resumo
Os compostos de rastreio para a actividade in vivo pode ser usada como um primeiro passo para identificar candidatos que podem ser desenvolvidos em 1,2 agentes farmacológicos. Nós desenvolvemos uma nova ensaio nanoinjection / electrofisiologia que permite a detecção de efeitos modulatórios bioactivos de compostos sobre a função de um circuito neuronal que medeia a resposta de fuga em Drosophila melanogaster 3,4. O nosso ensaio in vivo, que utiliza o sistema de fibra de Drosophila gigante (GFS, Figura 1) permite a triagem de diferentes tipos de compostos, tais como pequenas moléculas ou péptidos, e requer apenas quantidades mínimas de eliciar um efeito. Além disso, a Drosophila GFS oferece uma grande variedade de potenciais alvos moleculares nos neurônios ou músculos. As fibras gigantes (FG) sinapse electricamente (Junções Gap), bem como quimicamente (colinérgica) sobre uma sinapse periférica Interneuron (PSI) e do músculo tergo Trochanteral neurónio (TTMn) 5 6. Finalmente, a junção neuromuscular (JNM) do TTMn eo DLMn com o salto (TTM) e os músculos de vôo (DLM) são glutamatérgica 7-12. Aqui, é mostrado como para injectar quantidades nanolitros de um composto, enquanto que a obtenção de electrofisiológicos gravações intracelulares a partir do sistema de fibra gigante 13 e como para monitorizar os efeitos do composto sobre a função deste circuito. Nós mostramos especificidade do ensaio com methyllycaconitine citrato (MLA), um antagonista nAChR, que interrompe o PSI para DLMn ligação, mas não o GF para TTMn ligação ou a função do JNM no salto ou músculos de voo.
Antes de começar este vídeo é fundamental que você observar cuidadosamente e se familiarizar com o vídeo intitulado "JOVE gravações eletrofisiológicas da via fibra gigante de D. melanogaster "de Augustin et al 7, como o vídeo aqui apresentado destina-se como uma expansão a esta técnica existente. Aqui usamos o método gravações eletrofisiológico e foco em detalhes apenas na adição dos nanoinjections emparelhados e técnicas de monitoramento.
Protocolo
1. Eletrofisiologia Rig Set-up
- O equipamento necessário para o equipamento de electrofisiologia de configuração é descrito em detalhe por Augustin et ai. neste Jornal 14. Por favor, consulte este artigo para uma explicação detalhada dos aparatos necessários eletrofisiológicas.
- Modifique o descrito anteriormente eletrofisiologia plataforma set-up 14 por adição de um micromanipulador sexta, que detém a nanoinjector. Para um fácil acesso para a cabeça do animal deve ser colocada entre os dois eléctrodos estimulantes micromanipuladores como mostrado na Figura 2.
- Antes de iniciar a experiência, garantir que tem uma gama confortável em todos os eixos de rotação com todos os micromanipuladores, e que todos os eléctrodos, assim como a micropipeta de injecção (ver passo 2) pode chegar ao animal.
2. Nanoinjection Set-up
- O conjunto nanoinjection-se requer uma Nanoliter2000 (World precisisobre os instrumentos, Sarasota, FL, EUA) ou de tipo semelhante de injetor que permite injeção em quantidades controladas nanolitros.
- Preparar agulha de injecção usando as micropipetas de vidro fornecidos com o injector, puxando-as para uma resistência de 80-100 mohms com um puxador de eléctrodo.
- Para injecções lisas é exigido que os bisel micropipetas para uma abertura iM 11-17 a um ângulo de 45 graus (Figura 3).
- Lentamente aterrar a micropipeta de injeção com óleo sintético utilizando uma seringa Hamilton com as instruções do manual do Nanoliter2000, garantindo que nenhuma bolha de ar estão presentes.
- Cuidadosamente garantir a micropipeta na nanoinjector e prepará-lo para carregar o composto por esvaziar o excesso de óleo com as instruções do manual do Nanoliter2000.
- Coloque o injector na micromanipulador e carregar o composto como indicado no manual Nanoliter2000. Assegure-se que a ponta da micropipeta não quebre durante esteprocedimento.
- Defina a quantidade desejada de nanolitros ser injetados na caixa de injetor de controle conforme as instruções do manual do Nanoliter2000. Por favor, note que o montante total injetado não deve exceder 100 nl. Nós descobrimos que maiores quantidades de soluções de controlo de solução salina pode afectar a função do circuito GFS.
- É crítico para ter o injector desligado da caixa de controlo durante a aquisição de gravação com a excepção da injecção de si, uma vez que a fonte de energia do nanoinjector interfere com as gravações, que é visível como o ruído de fundo (Figura 4). No entanto, não desligue a fonte de alimentação para a caixa de controle como ele vai voltar a defini-la.
3. Drosophila melanogaster Preparação
- Anestesiar 2 a 6 dias de idade moscas com CO 2 ou em gelo, como descrito anteriormente 14,15.
- Uma vez imóvel, use um par de pinças para transferir o animal para uma pequena placa wicera mole ª dental por pegá-la de suas pernas. Por favor, note que uma mosca da fruta macho pesa cerca de 1,0 mg e uma mosca de fruta fêmea pesa cerca de 1,2 mg, assim composto-a-corpo relação peso é diferente nas moscas do sexo masculino versus feminino. Portanto, recomenda-se usar apenas um dos sexos para as experiências.
- Como descrito anteriormente 14,15, cuidadosamente montar o lado dorsal mosca-se e assegurar que o tórax e da cabeça são imobilizados com cera dental macio colocado em torno do corpo. Cuidadosamente espalhar as asas para fora de modo que eles estabelecem perpendicular ao tórax (Figura 2, C). A mosca deve ser montado com como danos pouco quanto possível.
4. Nanoinjection emparelhado / eletrofisiologia
- Coloque o fly montado sobre a plataforma de eletrofisiologia com a cabeça em direção aos eletrodos de estimulação.
- Empalar o animal com a correspondente estimulante chão, e eléctrodos de registo, como descrito anteriormente 14,15 (Figura 2, C). Salvo disposição em contrário desejado, a gravação de um eletrodo lugar para o DLM eo outro no músculo TTM. O músculo DLM está localizado no tórax entre os anteriores dorso-centrais cabelos e da linha mediana da mosca. O músculo TTM está localizado perto das ligações da asa, entre os posteriores e anteriores Supra-Alar pêlos da mosca 7.
- Alinhar o micropipeta de injecção contendo o composto com o centro do ocelos três situado sobre a porção média posterior da cabeça, mas não injectar ainda (Figura 2, C).
- Antes da injecção composto obter uma gravação de linha de base do GF o MTT e GF para DLM vias do sistema de fibras gigante (GFS, Figura 1) através da estimulação do cérebro. Para fazer isso, activar as fibras gigantes (FG) com 10 trens de 10 estímulos (40-50 mV) cada dado para uma duração de 0,03 ms a 100 Hz, com um atraso de 1 segundo entre os trens 14,15 (Figura 4). Tipo selvagem voa should ser capaz de seguir um-para-um, a este ritmo de estimulação para ambos DLM e vias TTM. Descarte a mosca se o GF a DLM e GF para as vias de TTM não seguem o estímulo de 100 Hz em uma proporção de 1:1.
- Mudar a estimulação contínua do GF com pulsos simples, no Hz 1 (Figura 4).
- Rapidamente conecte o injector na caixa de controle. Mesmo que o ruído de fundo vai interferir com as gravações de estimulação 1 Hz, não eliminá-la.
- Cuidadosamente inserir o micropipeta de injecção para dentro da cápsula cabeça da mosca logo abaixo da cutícula, e injectar a quantidade desejada de composto na hemolinfa da mosca enquanto se mantém a estimulação 1 Hz (Figura 4). Devido ao sistema circulatório aberta da mosca, todo o sistema nervoso será exposto ao composto em poucos segundos. Embora um local de injecção particular não é crítica para entregar compostos na hemolinfa, encontramos a região do ocelos, que são localizard medial no lado mais dorsal da cápsula cabeça, para ser um local conveniente que permite para a injecção fácil que leva a uma distribuição rápida e uniforme do composto.
- Imediatamente remover micropipeta de injecção a partir de local da injecção e desligue o injector a partir da caixa de controlo, enquanto continua a 1 Hz estimulação GF até 1 min após a injecção (Figura 4).
- A fim de revelar efeitos mais sutis de compostos no GFS, sublinham os fibras gigantes (GFS), com 10 trens de 10 estímulos de 100 Hz com um atraso de 1 segundo entre os trens. Continuar a testar a função das vias GF com este paradigma a cada 5 minutos até 15 minutos (Figura 4). No entanto, intervalos mais curtos ou longos períodos de monitoramento também são possíveis.
- A fim de testar se o composto tem um efeito nas junções neuromusculares (NMJs) do GFS, e possivelmente diminuir os efeitos do composto, proceder para activar o motor neurónios direcçãoqüentemente por estimulação torácica. Para isso, remover os eléctrodos estimulantes dos olhos e substituí-los nos lados anterior do tórax, a fim de estimular os neurónios motores com 10 trens de 10 a 100 Hz estímulos.
Nota: Os traços electrofisiologia mostrados no vídeo não correspondem aos efeitos da injecção de corante puro.
5. Os resultados representativos
Efeito de um antagonista sobre o PSI para DLM sinapse do sistema de fibras Gigante
Methyllycaconitine citrato (MLA) é um antagonista nAChR que é específico para α7 subtipos nAChR. A PSI para DLMn sinapse na via de GF-DLM é dependente do subtipo nAChR Dα7 para o bom funcionamento, enquanto a remoção genética de Dα7 subtipo nAChR não tem efeito sobre a via GF-TTM 5,6. A fim de demonstrar a especificidade e sensibilidade do nosso ensaio que injectado MLA em diferentes concentrações (0, 0,02, 0,04, 0.08, 0,12 ng / mg, 46 nl injectada) para a cabeça do animal (n = 10 por tratamento com composto, n = 15 para o tratamento de solução salina). Apenas as moscas do sexo masculino (do tipo selvagem genótipo selvagem 10E) foram usados, eo efeito do composto foi monitorizado durante um total de 15 minutos após a injecção.
A Figura 5 representa a diferença entre valores basais obtidos antes da injecção e os obtidos após a injecção, em resposta a MLA e solução salina de controlo. Nós descobrimos que a injecção de MLA resultou na incapacidade da via GF-DLM para seguir um-para-um a 100 Hz por estímulos do FG no cérebro enquanto a via GF-TTM permaneceram inalterados. (Figura 5, o traço superior e médio, t-teste realizado entre os controlos de solução salina [0 ng / mg] e as concentrações diferentes de MLA em cada ponto de tempo, a menos que os dados são não-paramétrico [normalidade e variâncias iguais testado], caso contrário, usamos de Mann-Whitney Rank Sum Test. * p <0,001). No entanto, r um-para-umesposto do DLM foi observado quando os neurónios motores foram estimuladas directamente (Figura 5, traço de fundo), demonstrando que a função JNM do DLM e TTM não é afectada pela MLA. MLA apareceu para atingir o seu máximo efeito de 1 minuto após a injecção para 0,04, 0,08 e 0,12 ng / mg de MLA injectado, como não há mais alterações significativas foram observados durante os seguintes 15 minutos de período de teste. Além disso, o composto alcançado um efeito máximo a 0,08 ng / mg uma vez que as respostas mais fortes não foram observadas com a dosagem mais elevada de 0,12 ng / mg.
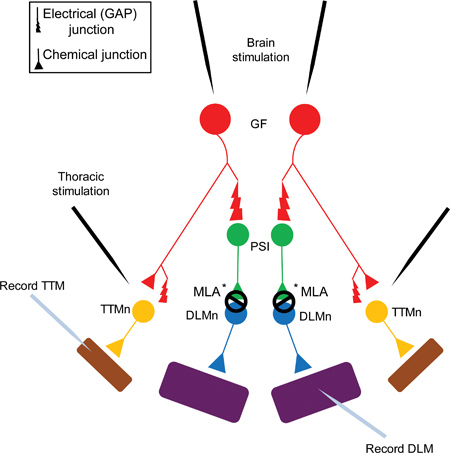
Figura 1. O diagrama de sistema gigante de fibra do sistema de fibras gigante (GFS). As fibras gigantes (FG, mostrado em vermelho) sinapse electricamente (Junções Gap), bem como quimicamente (colinérgica), sobre um Interneuron sinapse periférica (PSI, mostrado em verde) e o tergo neurónio Muscle Trochanteral (TTMn, mostrado na amarelo) 5. O PSI DLMn conexão (neurônio músculo dorsal longitudinal, mostrado em azul) é dependente Dα7 subtipo nAChR 6. Finalmente, a junção neuromuscular (JNM) do TTMn eo DLMn para o salto (TTM, mostrado em roxo) e músculos de vôo (DLM, mostrado em roxo) é glutamatérgica.
Nota: O GF para conexão PSI é tanto elétrica e química. No entanto, em mutantes shakB (que carecem de junções), nenhuma resposta pode ser gravado a partir do DLM após estimulação da FG no cérebro, demonstrando que o componente químico, na ausência de ligações eléctricas não é suficiente para evocar um potencial de acção no PSI 5,16-18. Porque o GF para conexão PSI é dependente junções, esta figura mostra apenas a junção de GAP na sinapse por razões de simplificação.

Figura 2.
Micromanipuladores set-up.
- A modificado set-up de um protocolo publicado anteriormente 14 é utilizado para ajustar a injeção micromanipulador para gravações emparelhados GFS com nanoinjections simultâneas. A preparação fly montado é orientado com o chefe da mosca para o experimentador. O micromanipulador injecção (# 1) é colocado na frente do experimentador entre os dois manipuladores para os eléctrodos de tungsténio estimulantes (2 # e # 3). Os dois micromanipuladores para os eléctrodos de vidro de gravação (# 4 e # 5) são colocados no lado esquerdo e direito, respectivamente. O micromanipulador para o eléctrodo de terra de tungsténio (# 6) é colocado mais distante na parte de trás, quer do lado esquerdo (mostrado aqui) ou no lado direito.
- Um fim vista a partir do topo do regime dos eléctrodos e vários micropipeta de injecção.
- Um devidamente montado D. melanogaster empalado com eletrodos e micropipeta de injeção pronto para a injecção. Note-se que o corpo do animalé montado com o seu tórax horizontalmente e as asas se espalhar. A cera está firmemente enrolado em torno do seu corpo impedindo o animal de se mover. Além disso, o eléctrodo de terra (# 6, no abdómen), os eléctrodos de registo de vidro (# 4 e # 5, no tórax, em destaque por contornos escuras), e os eléctrodos de estimulação (# 2 e # 3, uma em cada olho ) são empalado no lugar, como descrito anteriormente 14. A micropipeta de injecção (# 1) está correctamente alinhado com o centro do ocelos três (círculo). A inserção da micropipeta de injecção deve ser colocado nesta área.
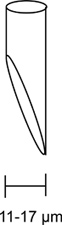
Figura 3. Micropipeta de injeção chanfrada. Um diagrama de uma micropipeta devidamente chanfrado é mostrado aqui. A abertura do eléctrodo deve ser chanfrada a um ângulo de 45 graus e têm uma abertura entre 11 a 17 uM. A micropipeta de injecção adequada chanfrada é crucial para uma injeção suave com mínimo damage à mosca.
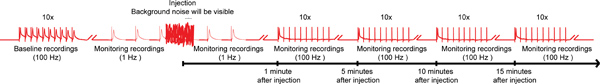
Figura 4. Esquema geral do protocolo nanoinjection / eletrofisiologia. Um diagrama representativo do regime geral para o nanoinjection / protocolo de eletrofisiologia. Comece por obter uma gravação de linha de base, estimulando as fibras gigantes (GFS) a 100 Hz com 10 trens de 10 estímulos cada (apenas um trem mostrado aqui). Antes da injeção, começam os estímulos 1 Hz um segundo de intervalo. Durante o tempo de injeção (injetora, enquanto está ligado à caixa de controle), você vai observar o ruído de fundo significativo, no entanto, não interromper as gravações. Após a injeção (e injetor está desconectado da caixa de controle), continuar a estimulação de 1 Hz por cerca de mais 1 minuto. Finalmente, proceder para salientar a FG com 10 trens de 10 estímulos a 100 Hz e continuar para testar a função das vias GF com este paradigma a cada 5 minutos até 15 minutos. Nota: gravações were manipulado para criar o regime geral e não representam um resultado específico obtido. Não à escala, nem todos os traços são mostrados. Clique aqui para ampliar a imagem .
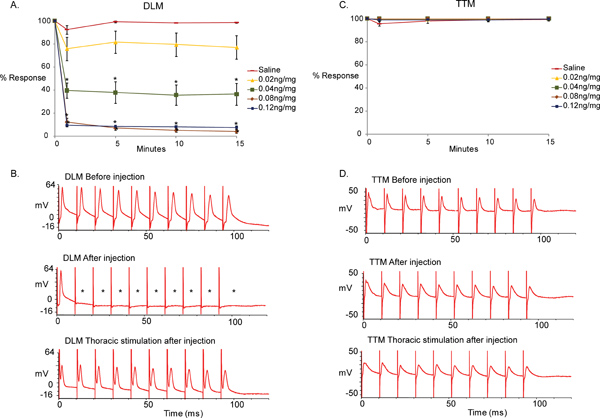
Figura 5. Os efeitos do MLA no GFS.
- Uma representação gráfica dos efeitos do nAChR citrato antagonista α7 Methyllycaconitine (MLA) sobre a via de GF-DLM da mosca da fruta em diferentes concentrações (0, 0,02, 0,04, 0,08, 0,12 ng / mg n = 10 por tratamento com composto.; n = 15 para o tratamento de solução salina). Apenas um minuto após a injecção, um efeito significativo e imediata foi observada com 0,04 ng / mg de MLA. Um efeito significativo também foi visto com 0.8ng/mg e 0.12ng/mg de MLA a 100Hz estimulação do FG. Nenhuma diferença significativa foi observada entre os controles de salinas e 0,02 ng / mg de MLA. Além disso, não mudar in efeito foi observado após uma injecção de pós minutos durante o tempo testado (15 minutos). Um t-teste foi realizado entre os controlos de solução salina (0 ng / mg) e as concentrações diferentes de MLA em cada ponto de tempo. Os níveis são apresentados como média + / - SEM, * p <0,001.
- Vestígios de exemplo das respostas DLM a 100 Hz estimulação. Traço superior mostra as respostas do músculo antes MLA injecção após estimulação GF no cérebro. Note-se que o músculo é capaz de responder a cada estímulo de um-para-um a 100 Hz. Meio de rastreio exibe as respostas do DLM após injecção MLA (0,12 ng / mg). Note-se que o músculo não é capaz de responder a cada estímulo de um-para-um a 100 Hz. (Asteriscos). Traço inferior mostra as respostas do DLM da mesma preparação (0,12 ng / mg) com a estimulação direta dos neurônios motores no tórax. Devido DLM responde um-para-um a 100 Hz, com a estimulação torácica, a falha de respostas com estímulos cerebrais pode ser atribuído à ligação PSI DLMn-colinérgico.
- Uma representação gráfica dos efeitos com diferentes concentrações MLA (0, 0,02, 0,04, 0,08, 0,12 ng / mg) sobre a via do GF-TTM. Não houve diferenças significativas foram observadas entre o soro fisiológico (0 ng / mg) e injeções de compostos em nenhum momento. Um t-teste foi realizado entre os controlos de solução salina (0 ng / mg) e as concentrações diferentes de MLA em cada ponto de tempo, * p <0,001.
- Vestígios de exemplo das respostas TTM a 100 Hz estimulação. Traço superior mostra as respostas do músculo antes MLA injeção sobre GF ativação com estimulação no cérebro. Note-se que o músculo é capaz de responder a todos os estímulos a 100 Hz. Meio rastreio mostra as respostas do DLM após injecção MLA (0,12 ng / mg). As respostas a partir do músculo TTM à estimulação do GF no cérebro permanecer um-para-um. Traço inferior mostra as respostas do MTT da mesma preparação a 100 Hz estimulação dos neurónios motores no tórax (0,12 ng / mg).
Discussão
O bioensaio nanoinjection / eletrofisiologia aqui apresentada permite uma rápida triagem de compostos no sistema nervoso da mosca da fruta. Este é um novo na técnica in vivo que requer pequenas quantidades de um composto para eliciar um efeito sobre uma variedade de alvos moleculares em um circuito bem caracterizado neuronal. Este método pode ser usado para testar a bioactividade de compostos diferentes, a partir de toxinas desconhecidos para comercialmente disponíveis agentes farmacológicos.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Gostaríamos de agradecer aos membros do laboratório Mari eo laboratório Godenschwege, em especial Aline Yonezawa, para comentários e ajudar com este protocolo. Este trabalho foi financiado pelo Instituto Nacional de Distúrbios Neurológicos e Derrame R21NS06637 concessão para FM e TAG; AB foi financiado pelo número prêmio National Science Foundation 082925, URM: Biologia Integrativa para futuros pesquisadores.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Gravação de eletrodos de vidro: vidro borosilicato capilares | Instrumentos de precisão do mundo | 1B100F-4 | 1,0 milímetros OD, 0,58 milímetro ID |
| Estimulador | Grass Instruments | Modelo S48 | |
| Amplificador | Obtendo Instruments Inc. | 5A modelo | |
| Aquisição de dados Software: Digidata | Molecular Devices | Modelo 1440A | |
| Dados software de coleta: pCLAMP | Molecular Devices | Versão 10 | |
| Estereomicroscópio wom fibra óptica iluminador anel microscópio | AmScope | SM-4T Modelo HL250-AR | |
| Dissecando espaço para montagem | AmScope | SM-2TZ | |
| Kite micromanipulador Manual & Inclinação da Base | Instrumentos de precisão do mundo | Modelo # M3301 Kite: Modelo # KITE-M3-L | |
| Drosophila melanogaster Selvagem genótipo 10E (cepa selvagem) | Bloomington estoque centro | Stock # 3892 | |
| Vertical pipeta extrator | David Kopf Instruments | Modelo 700c | |
| Injeção micropipetas de vidro: vidro borosilicato capilares | Instrumentos de precisão do mundo | Catálogo # 4878 | OD 1,14 milímetros, 0,5 milímetros ID |
| Óleo de silicone | Pescador | Catálogo # S159-500 | |
| Beveler | Sutter Instrument Co. | KT Tipo Brown Modelo # BV-10 | |
| Nanoliter2000 | Instrumentos de precisão do mundo | Catálogo # B203XVY | |
| Corante azul | McCormick | N / A | Ingredientes: água, propileno glicol, FD & C Azul 1, e 0,1% Propilparabeno (conservante). |
| Methyllycaconitine citrato (MLA) | Tocris Bioscience | Catálogo # 1029 | |
| Plástico paus de cera | Hygenic Corporation (Akron Ohio EUA) |
Referências
- Koehn, F. E., Carter, G. T. The evolving role of natural products in drug discovery. Nat. Rev. Drug Discov. 4, 206-220 (2005).
- Miljanich, G. P. Ziconotide: neuronal calcium channel blocker for treating severe chronic pain. Curr. Med. Chem. 11, 3029-3040 (2004).
- Layer, R. T., Wagstaff, J. D., White, H. S. Conantokins: peptide antagonists of NMDA receptors. Curr. Med. Chem. 11, 3073-3084 (2004).
- Lewis, R. J. Conotoxins as selective inhibitors of neuronal ion channels, receptors and transporters. IUBMB Life. 56, 89-93 (2004).
- Allen, M. J., Godenschwege, T. A., Tanouye, M. A., Phelan, P. Making an escape: development and function of the Drosophila giant fibre system. Semin. Cell Dev. Biol. 17, 31-41 (2006).
- Fayyazuddin, A., Zaheer, M. A., Hiesinger, P. R., Bellen, H. J. The nicotinic acetylcholine receptor Dalpha7 is required for an escape behavior in Drosophila. PLoS biology. 4, e63 (2006).
- Jan, L. Y., Jan, Y. N. L-glutamate as an excitatory transmitter at the Drosophila larval neuromuscular junction. The Journal of physiology. 262, 215-236 (1976).
- Usherwood, P. N., Machili, P., Leaf, G. L-Glutamate at insect excitatory nerve-muscle synapses. Nature. 219, 1169-1172 (1968).
- Marrus, S. B., Portman, S. L., Allen, M. J., Moffat, K. G., DiAntonio, A. Differential localization of glutamate receptor subunits at the Drosophila neuromuscular junction. The Journal of neuroscience : the official journal of the Society for Neuroscience. 24, 1406-1415 (2004).
- Petersen, S. A., Fetter, R. D., Noordermeer, J. N., Goodman, C. S., DiAntonio, A. Genetic analysis of glutamate receptors in Drosophila reveals a retrograde signal regulating presynaptic transmitter release. Neuron. 19, 1237-1248 (1997).
- Qin, G. Four different subunits are essential for expressing the synaptic glutamate receptor at neuromuscular junctions of Drosophila. The Journal of neuroscience : the official journal of the Society for Neuroscience. 25, 3209-3218 (2005).
- Schuster, C. M. Molecular cloning of an invertebrate glutamate receptor subunit expressed in Drosophila muscle. Science. 254, 112-114 (1991).
- Tanouye, M. A., Wyman, R. J. Motor outputs of giant nerve fiber in Drosophila. Journal of. 44, 405-421 (1980).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological Recordings from the Giant Fiber Pathway of D. melanogaster. J. Vis. Exp. (47), e2412 (2011).
- Allen, M. J., Godenschwege, T., Zhang, B., Freeman, M. R., Waddell, S. . Drosophila Neurobiology. , 215-224 (2010).
- Blagburn, J. M., Alexopoulos, H., Davies, J. A., Bacon, J. P. Null mutation in shaking-B eliminates electrical, but not chemical, synapses in the Drosophila giant fiber system: a structural study. J. Comp. Neurol. 404, 449-458 (1999).
- Thomas, J. B., Wyman, R. J. Mutations altering synaptic connectivity between identified neurons in Drosophila. J. Neurosci. 4, 530-538 (1984).
- Baird, D. H., Schalet, A. P., Wyman, R. J. The Passover locus in Drosophila melanogaster: complex complementation and different effects on the giant fiber neural pathway. Genetics. 126, 1045-1059 (1990).
- Gorczyca, M., Hall, J. C. Identification of a cholinergic synapse in the giant fiber pathway of Drosophila using conditional mutations of acetylcholine synthesis. J. Neurogenet. 1, 289-313 (1984).
- Allen, M. J., Murphey, R. K. The chemical component of the mixed GF-TTMn synapse in Drosophila melanogaster uses acetylcholine as its neurotransmitter. The European journal of neuroscience. 26, 439-445 (2007).
- Mejia, M. A novel approach for in vivo screening of toxins using the Drosophila Giant Fiber circuit. Toxicon. 56, 1398-1407 (2010).
- Stork, T. Organization and function of the blood-brain barrier in Drosophila. J. Neurosci. 28, 587-597 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados