A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מלוטשת מחוזק דליל, הגולגולת חלון הדמיה לטווח ארוך של מוח עכבר
In This Article
Summary
אנו מציגים שיטה ליצירת חלון הדמיה בגולגולת העכבר החובקת מילימטרים והוא יציב במשך חודשים ללא דלקת של המוח. שיטה זו גם מתאים מחקרים ארוכי טווח של זרימת דם, דינמיקה סלולריים, ותא / מבנה כלי הדם באמצעות שני פוטונים במיקרוסקופ.
Abstract
In vivo הדמיה של תפקוד קליפת המוח דורש גישה אופטית למוח ללא הפרעה של הסביבה תוך גולגולתי. אנו מציגים שיטה ליצירת הגולגולת דליל מלוטשת מחוזק (יציאות) חלון בגולגולת העכבר החובקת כמה מילימטרים בקוטר והוא יציב במשך חודשים. הגולגולת הוא דליל עד 10 עד 15 מיקרומטר עובי עם יד שנערך תרגיל כדי להשיג בהירות אופטית, והוא מעולף ואז עם דבק cyanoacrylate וכוס כיסוי ל: 1) לספק קשיחות, 2) לעכב לצמיחה מחודשת העצם 3) להפחית את פיזור אור מ חריגות על פני העצם. מאז הגולגולת לא פרוץ, דלקת העלולה להשפיע על תהליך הנלמד מופחת במידה ניכרת. בעומק הדמיה של עד 250 מיקרומטר מתחת לפני השטח של קליפת המוח יכולה להיות מושגת באמצעות שני פוטונים מיקרוסקופיית לייזר. חלון זה הוא גם מתאים ללמוד זרימת הדם במוח ותפקוד הסלולר ההכנות הן הרדים ו ער. זה עוד יותר מציעה אופportunity לתמרן פעילות התא באמצעות optogenetics או לשבש את זרימת הדם בכלי ממוקדות על ידי הקרנה של מחזורי פוטוסנסיטייזרים.
Protocol
1. הכנות לקראת ניתוח אני
- נקו את כלי הניתוח על ידי sonicating בתערובת של חלב Maxizyme וכירורגי של שואב קולי. החיטוי כלי ניתוח לפני כל ניסוי.
- ודא שכל ריאגנטים הדרושים מתכלים זמינים. רשימה של ריאגנטים מתכלה מסופק בטבלה 2. ריאגנטים מתכלים הבאים במגע עם רקמות נחשף צריך להיות סטרילי, במידת האפשר.
- לגרום הרדמה. הרדמה אופייניות מתאימים ללימודים ההישרדות מתוארים בטבלה 1. ודא המטוס כירורגית של הרדמה על ידי סימון מחוסר רפלקס קמצוץ הבוהן. הגיל האופטימלי של העכבר הוא 3 עד 6 שבועות. גולגלות של עכברים צעירים יותר הם יותר רך ויותר קשה רזה. עכברים מבוגרים יותר יש גולגלות עבה אשר לדמם יותר במהלך ההליך דליל.
- להבטיח חיים במסגרת stereotaxic 1. רשימה של ציוד כירורגי מסופק בטבלה 2.
- לשמור על הגוף טמפרהture על 37 מעלות צלזיוס באמצעות משוב מוסדר בדיקה רקטלית וכן משטח חום.
- החל משחת עיניים לעיניים כדי לשמור על הלחות.
- לגלח את הקרקפת בסכין גילוח חשמלי קטן.
- לנקות את הקרקפת בבטאדין, ואחריו בניקוי עם 70% (V / V) אלכוהול איזופרופיל.
- אם תרצה, לבדוק כי קצב הלב והנשימה הם בטווח הנורמה באמצעות oximeter הדופק. עבור העכבר, מספרים אלה צריך מרכז סביב 10 ל 2 הרץ, בהתאמה.
- לחמם aliquot של נוזל סטרילי מלאכותית מסונן השדרה מוחין (ACSF) ל 37 ° C (125 mM NaCl, גלוקוז 10 מ"מ, 10 מ"מ HEPES, 3.1 mM
CaCl 2, 1.3 mM MgCl 2, pH 7.4) (כל הכימיקלים של סיגמא) 2.
2. הרכבה מסגרת ראש
- הסר את הקרקפת על פני הגולגולת כולה הגב עם זוג מלקחיים ומספריים כירורגית. לחתוך את העור רוחבית את הקצוות של השרירים הזמני משני צדי הגולגולת ופוסטerior על שרירי הצוואר (איור 1 א).
- השתמש בלהב סכין המנתחים להסיר את periosteum דק מפני השטח של הגולגולת.
- לנקות את הגולגולת בצמר גפן לח נוטה המוליך ומייבשים פני הגולגולת עם זרם של אוויר ואבק יכול. ואז למרוח שכבה דקה של דבק cyanoacrylate אל פני השטח את הגולגולת כולה. אפשר הדבק להתייבש היטב. שכבה זו של דבק נדרשת עמידה נכונה של מלט שיניים בשלבים הבאים. דבק cyanoacrylate לא צריך לעבור עיקור.
- צרף מחבר מתכת אל פני השטח את הגולגולת, הרחק מאזור החלון הרצוי. על ההכנות רדומה אגוז קטן עשוי להיות מאובטח כדי הגולגולת עם טיפה של דבק cyanoacrylate, שיכול להיות מאוחר יותר מוברג ההתקנה הדמיה באמצעות בורג (איור 1 ב, 1 ליטר ו - 1N). לאטום את הישבן של אגוז עם קלטת כדי להבטיח כי הדבק לא נכנס החוטים במהלך המצורף הגולגולת. אגוז והסרט יש לעקר על ידי מעוקר לפני הניתוח.
- על ההכנות הדמיה ער, לצרף מחבר מותאם אישית נוקשה יותר עם שתי נקודות צירוף קובץ (איור 1M ו 1N). לקדוח שני חורים בגולגולת מעל חצי הכדור קליפת המוח הנגדי עם מ"מ ½ תרגיל בר, ולאחר מכן להציג את שני # 000 העצמית הקשה ברגים. ברגים אלה יסייעו לעגן בראש הר לגולגולת. החל רק בסיבוב מלא של הבורג, על מנת למנוע הפעלת לחץ על קליפת המוח הבסיסית. לאחר מכן, לצרף את סרגל מותאם אישית צלב מתכת עם טיפה קטנה של דבק cyanoacrylate על המוח הקטן. אפשר דבק cyanoacrylate להתייבש היטב. זה מחבר מתכת מקטינה באופן משמעותי את דרגות החופש ומפשטת העתקת בתחום ההדמיה אותו מחקרים ארוכי טווח. בר צלב רחב נותן מספיק מקום מיקום האלקטרודה וגירוי של vibrissae. תכניות מפורטות ליצירת הר ראש מותאמים אישית למכשיר מצורף זמינים באופן מקוון (sics / links.html "> http://physics.ucsd.edu/neurophysics/links.html). הברגים ובר הצלב יש לעקר על ידי מעוקר לפני הניתוח.
- לכסות את פני הגולגולת כולה, למעט המיקום של החלון, עם שכבה של דבק דנטלי (איור 1 ג ו 1D). להבטיח כי כל הקצוות החשופים של העור מכוסים על ידי מלט. מרכיבי הבטון שיניים לא צריך לעבור עיקור.
3. דור מלוטש וחיזקו דליל, גולגולת (יציאות) חלון
- ודא הקוצים לקדוח חדים ולמנוע שימוש חוזר בהם. שימוש במהירות נמוכה על התרגיל שיניים, דקה 2 מ"מ לפי אזור 2 מ"מ מעל קליפת המוח somatosensory עם ½ מ"מ בר. לסירוגין להרטיב את הגולגולת עם ACSF ולאחר מכן לייבש את פני השטח הגולגולת בזרם עדין של אוויר מטלית גז; רטוב לקירור, ויבש עבור דליל. זה דורש דילול דרך שכבת שבכתי הגולגולת, אשר עלולים לדמם, אבל יכול להיות בשליטהאד על ידי שטיפה עם ACSF (איור 1E). הגולגולת מתחילה להגמיש בלחץ קל של התרגיל כאשר הוא ~ 50 מיקרומטר, וכלי pial צריך להיות גלוי דרך העצם רטוב (איור 1F). על עובי זה, כתמים לבנים קטנים בתוך העצם יהיה גלוי במשך כמה שניות מיד לאחר פני הגולגולת הוא יבש מורטב.
- בשלב זה, עצם דק עוד יותר. השתמש מהירות התרגיל לאט יותר, כלומר, 1000 סל"ד, אשר מתגלח פני הגולגולת עם נגיעה קלה בלבד. השתמש בתנועות מבוקרים קטנים תוך כדי לחיצה תרגיל כמו עט ורק להפעיל כוח בכיוון לרוחב. בעצם יש ~~~V 10 עד 15 מיקרומטר על עובי הסופי (איור 1G). כאשר העצם הוא דק מספיק, כתמים לבנים קטנים בעצם כבר לא יהיה גלוי כאשר פני הגולגולת יבש הוא לח.
- לצחצח את האזור חלון עם אבקת תחמוצת בדיל. צרף קצת מוכנות תרגיל כי כבר טבול איטום אקווריום עם סיליקוןנמשך, והשאיר שוט קוני (הבלעה, איור. 1H). שוט סיליקון יש להכין לפחות יום אחד לפני הניתוח, ולאחר עיקור עם 70% isopropanol לפני השימוש. מניחים צביטה קטנה של פודרה על החלון יחד עם ירידה של ACSF (איור 1H). להתסיס slurry על החלון של עד עשר דקות על ידי לגעת בעדינות את קצה השוט נע על פני הגולגולת. לשטוף ממנו את אבקת תחמוצת בדיל היטב מהחלון באמצעות ACSF ולייבש את העצם ביסודיות עם זרם עדין של אוויר. אי סדירות פני השטח שבבי עצם חסיד שהותירו קידוח בשלבים הקודמים יש להסיר לאחר ליטוש (איור 1H ו 1i). אבקת תחמוצת בדיל לא צריך לעבור עיקור.
- חותכים ריבועי לא. 0 הזכוכית המכסה קצת יותר קטן מגודל החלון. השתמש הסופר בעדינות כדי להבקיע קווים אופקיים ואנכיים מופרדות בתחתונית כיסוי באמצעות קצה ישר. ואז למקם את תלוש כיסוי בצלחת פטרי ו KNock צלחת על קצה השולחן כדי להפריד את חתיכות זכוכית. צלחת פטרי כולו אז יכול להיות autoclaved כדי להבטיח סטריליות.
- מניחים מכסה זכוכית בגודל מתאים הסמוך לחלון יבשים. החל טיפה קטנה של דבק cyanoacrylate על החלון באמצעות קצה של קצה המוליך שבור עץ, כותנה, ובמהירות לדחוף חתיכת precut של זכוכית המכסה על גבי הדבק. להימנע מיצירת בועות מתחת לזכוכית המכסה. דחף בעדינות את הזכוכית המכסה על פני הגולגולת, לחיצה ארוכה במשך כמה שניות (איור 1J ו 1o). אפשר הדבק להתייבש היטב מעל 15 דקות. דבק cyanoacrylate עודף ניתן להסיר מפני השטח העליון של הזכוכית המכסה עם להב אזמל אחרי זה הוא מיובש. סוגרים את הקצוות של זכוכית המכסה במלט שיניים וליצור מורם מעט גם להחזיק מים העדשה טבילה (1K איור ו 1o).
4. התאוששות
- מניחים את החיה לכלוב ניתוח החם הבא. לפקח עלבעל חיים מעת לעת עד מלא מתאושש מן ההרדמה.
- אם הכנת אמור לשרוד יותר מיום אחד, לספק עצירות (0.03 מיקרוגרם לכל מכרסם ז) על כאבים. אנחנו בדרך כלל תמונה חיה לפחות יום אחד לאחר ההשתלה הראשונית.
5. הדמיה הכנה
- לייצב את חיה על קרש החיתוך אופטי הדמיה, באמצעות מסגרת כתמיכה הראש (איור 1 ליטר ו - 1M). מנגנון ריסון יכול להיות עשוי רכיבים optomechanical זמינים מסחרית של Qioptiq או ThorLabs. בצלחת נפרדת שלנו יכול להיות מועבר בין חבילות הדמיה כירורגיות שני פוטונים בעלי חיים וכל מערכות התראה פיזיולוגיים מורכבים כיחידה אחת 3.
- אם זרימת הדם הדמיה הוא הרצוי, להזרים 0.05 מ"ל של 5% (w / v) ניאון dextran הצבע מומס מלח סטרילית או דרך וריד הזנב או וריד infraorbital לתייג דם בסרום (איור 2 א ו 2 ג ל 2H ) 4-7. זה חייב להיעשות תחת הרדמה כללית. הממשל הוריד Infraorbital ייתכן שיהיה קל יותר למתחילים, כמו פתרונות dextran הם צמיגי יותר. וריד הזנב יכול להיות קשה לאתר בעכברים בצבע כהה, ואת הווריד נוטה לקרוס לאחר ההזרקה נכשל. הדמיה vasculature ירוק פליטה, השתמש isothiocyanate dextran fluorescein. עבור פליטת אדום, להשתמש האדום טקסס dextran. עם משקל מולקולרי גבוה dextrans, צבע יישארו במחזור למשך מספר שעות. לחילופין, בעלי חיים עם תוויות ניאון אנדוגניים ניתן הדמיה ישירות באורך גל שני הפוטונים עירור מתאים. פתרון dextran ניתן קפוא aliquots לשימוש עתידי.
- לנקות בעדינות את משטח החלון עם צמר גפן לח נוטה המוליך.
- הדמיה ממושכת של הכנות רדומה מזריקים intraperitoneally פתרון רינגר לקטט של סטרילית בהיקף של 3 μL לגרם כל 2 שעות כדי לשמור על נוזלי הגוף ודרישות האנרגיה.
- כאשר בעלי חיים הדמיה במצב ער, להגביל איפוק ראש רק כמה שעות בכל פעם, כדי להפחית את רמות הלחץ. להחזיר את החיה לכלוב בבית בין המפגשים הדמיה של מזון ומים.
6. נציג תוצאות
חלון מוצלח יאפשר הדמיה בעומק עד 250 מיקרומטר מתחת לפני השטח pial במשך כמה חודשים. בשיטה זו נעשה שימוש כדי ללמוד את זרימת הדם vivo נימי 4, 8, הפעלת microglial 8, 9, והמבנה הדנדריטים בתוך parenchyma קליפת המוח 8. בדוגמה אחת, אנו משתמשים שני פוטונים הדמיה להראות vasculature קליפת המוח של העכבר הרדים Thy1 צהוב ניאון חלבון (YFP), לאחר בסרום הדם מסומן על ידי הזרקה תוך ורידית של טקסס האדום dextran (איור 2 א). כלי dural לעיתים נראה מעט מעל פני קליפת המוח של מאטר דורה (איור 2 ג, חץ). Arterioles pial גדולים venules li,דואר על פני קליפת המוח (איור 2 ד). ענף כלי חודר מהרשת זה השטח לצלול לתוך קליפת המוח, שם הם להסתעף למיטה נימי סמיך המזין את רקמת קליפת המוח (2E איור ל 2H). סוכות דנדריטים של YFP עמוק להביע נוירונים בקליפת המוח, אנדוגני האות לקו זה עכבר, ניתן הדמיה במקביל בערוץ 2 10 (איור 2 ב ל 2H). האות ההרמוני השני של העצם נאסף בערוץ השלישי, והוא יכול לשמש כדי לאמוד את עובי הגולגולת דליל לאחר איסוף ערמות תמונה (איור 2 א ל 2 ג).
הדינמיקה של כלי הדם בקליפת המוח מושפעים עמוקות הרדמה 11. בדוגמה 2, אנו מראים וידאו של vasoactivity ספונטנית שנאסף על ידי מיקרוסקופ שני הפוטונים של העכבר ער מורגל. תנודות vasomotor בולטים בקוטר לומן נראים עם עורקיק pial, אך לא עם ורדיד השכנה. זהטווח הבסיסי של vasoactivity היא פחתה עם 4 הרדמה urethane. כדי לכמת שינויים ספונטניים ועוררה את זרימת הדם, אנו משתמשים בטכניקות סריקה המותאמים קו ללכוד הן את קוטר כלי הדם ומהירות תא דם אדום של כלי בודדים. מקורות מפורטים על הדמיה זרימת הדם הכמותית באמצעות שני פוטונים מיקרוסקופיה זמינים 3, 12.
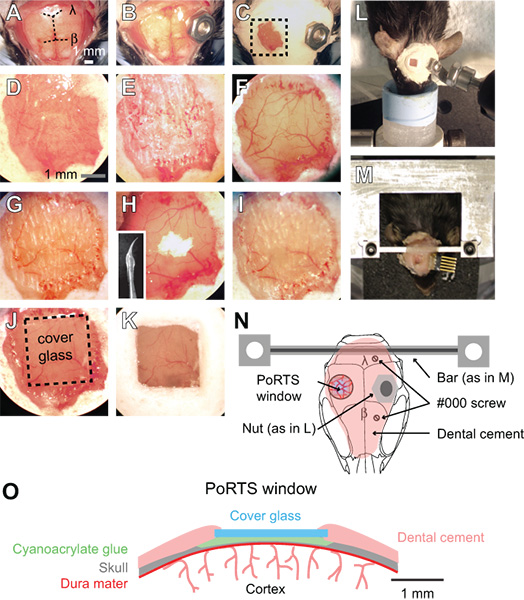
באיור 1. נוהל חלון בנמלי הים. (ל-K) תמונות של צעדים עוקבים בהליך להפקת חלון בנמלי הים. לראות את הטקסט כדי לקבל הוראות מפורטות. β = גבחת ו λ = למבדה. (L) הבריח אגוז מערכת לאבטחת ראש במהלך ההדמיה של ההכנות בהרדמה. (M) מותאם אישית במכונה הר צלב בראש רף ההכנות ערים. בדוגמה זו, מחבר הושתלה גם הקלטות electrocorticogram חוזרות ונשנות. (N)תרשים סכמטי המציג נוף של הר הגב הראש ואת המיקום של הרכיבים השונים. אגוז שימוש L הפאנל נועד כתחליף לבר צלב באמצעות בלוח מ דו # 000 עצמית הקשה ברגים נוספים עם בר חוצה הר ליציבות הוסיף בהכנות הדמיה ערים. (O) תרשים סכמטי המציג חתך של חלון בנמלי הים.
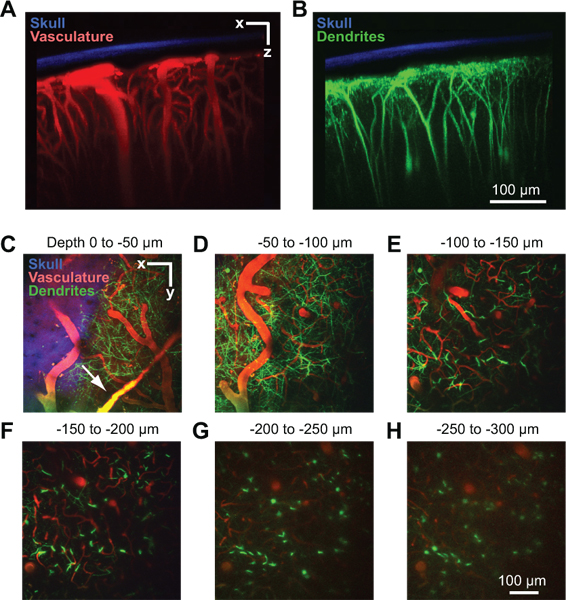
איור 2. הדמיה דו פוטון של מבנה כלי הדם ואת העצבית בקליפת המוח העכבר. כל התמונות נאספו דרך החלון בנמלי הים של העכבר Thy1-YFP ב 2 ימים לאחר ההשתלה חלון 10. הקרנת מקסימלי מעל 150 מיקרומטר של רקמת בכיוון העטרה מראה הגולגולת דליל ביחס בכלי הדם (A) דנדריטים (ב '). העצם (כחול) זוהה על ידי איסוף הקרינה הרמוני 2 על פליטת 450 ננומטר עם עירור 900 ננומטר 8. בכלי הדם (אדום) סומן על ידי מוזרק לווריד 70 kDa טקסס האדום dextran 6. שדות דנדריטים של נוירונים (ירוק) הם אנדוגניים לקו מהונדס Thy1-YFP העכבר. (CH) תחזיות מקסימלי מעל 50 מיקרומטר של רקמת בכיוון אופקי בעומקים שונים מתחת פיא. הנתונים מתוך ערימה אותה תמונה המוצגת לוחות א 'וב' כלי dural יכול להיות גלוי מעל פני קליפת המוח (חץ ב-C).
סימני קצור
ACSF = מלאכותית נוזל השדרה מוחין
= Ports מלוטשים מחוזקים הגולגולת דליל חלון
YFP = חלבון פלואורסצנטי צהוב
אני לוודא את הנהלים המתוארים מאושרים על ידי טיפול בבעלי חיים מוסדי מקומי ולהשתמש הוועדה.
Access restricted. Please log in or start a trial to view this content.
Discussion
שני פוטונים הדמיה דרך החלון בנמלי הים דורש שידור דרך העצם דליל ואת דורה, אשר פוחתת אור לייזר ומוסיף סטיות אופטיות בעומקים גדולים יותר 8. עם זאת, למרות החיסרון הזה, במעמקי הדמיה עד 250 מיקרומטר מתחת לפני השטח pial ניתן להשיג עם עירור 900 ננומטר. בעומק הדמיה גדולים יותר ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי איגוד הלב האמריקני (פוסט דוקטורט מלגה כדי AYS) לבין המכון הלאומי לבריאות בארה"ב (MH085499, EB003832, ו OD006831 אל DK). אנו מודים בית פרידמן פבלו Blinder על הערות על כתב היד.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments | |||
| סוכן | מסלול של משלוח | מינון של העכבר | משך | הערות | מקור | Ref Ref |
| Pentobarbital (נמבוטל) | ה-IP | 90 מיקרוגרם / g | 15-60 דקות | בטיחות צמצם את השוליים. לעבוד עד מינון נכון של הרדמה לאט. תוספת 10% במינון אינדוקציה כנדרש. | 036093; באטלר שיין | 7 |
| קטמין (Ketaset) מעורבב עם Xylazine (Anased) | ה-IP | 60 מיקרוגרם / g (K) 10 מיקרוגרם / g (x) (לערבב אותו במזרק) | 20-30 דקות | Xylazine הוא שותף מוזרק כמו להרפיית שרירים כאבים. להשלים רק קטמין על 50% במינון אינדוקציה כנדרש. | (K) 010177, (X) 033,198; באטלר שיין | 7 |
| Isoflurane (Isothesia) | שאיפה | 4% כלומר ריכוז מכתשיים (MAC) לזירוז; 1-2% MAC לצורך תחזוקה | 4-6 שעות. | בתנאי בתערובת של חמצן 70% ו 30% תחמוצת החנקן. הרדמה ממושכת גורמת להאטת ההתאוששות. | 029403; באטלר שיין | 26 |
טבלה 1. הצעה בחומרי הרדמה ללימודים הישרדות.
| פריט | החברה | קטלוג # / דגם |
| בבטאדין | שיין באטלר | 6906950 |
| עצירות (Buprenex) | שיין באטלר | 031919 |
| Fluorescein isothiocyanate dextran, 2 משקל מולקולרי מד"א | סיגמא | FD2000S |
| איזופרופיל אלכוהול | דיג | AC42383-0010 |
| לקטט רינגר של פתרון | שיין באטלר | 009846; |
| לידוקאין פתרון, 2% (V / V) | שיין באטלר | 002468 |
| מלוח | שיין באטלר | 009861 |
| כירורגי חלב | שיין באטלר | 014325 |
| טקסס אדום dextran, משקל מולקולרי 70 kDa | Invitrogen | D1864 |
| Maxizyme | שיין באטלר | 035646 |
| Disposables | ||
| קרביד הקוצים, גודל עצה 1/2 מ"מ | מדע כלים עדינים | 19007-05 |
| עצה applicators בצמר גפן | פישר סיינטיפיק | 23-400-100 |
| כיסוי זכוכית, לא. 0 עובי | תומאס מדעי | 6661B40 |
| Cyanoacrylate דבק | ND תעשיות | 31428 H04308 |
| גז מטלית | Newegg | N82E16848043429 |
| המלט גריפ אבקת | Dentsply | 675571 |
| המלט גריפ ממס | Dentsply | 675572 |
| מזרק אינסולין, נפח 0.3 מ"ל עם מחט מד 29.5 | שיין באטלר | 018384 |
| אגוז בורג כדי לאבטח את ראש | Digikey | אגוז, H723-ND, בורג, R2-56X1/4-ND |
| Opthalmic משחה | שיין באטלר | 039886 |
| להבי אזמל הניתוחים | פישר סיינטיפיק | 12-460-448 |
| ברגים, עצמית הקשה # 000 | JI החברה מוריס | FF000CE125 |
| סיליקון איטום האקווריום | פרפקטו ייצור | 31001 |
| אבקת תחמוצת בדיל | אמא של מינרלים | EQT-TINOX |
| ציוד | ||
| זכוכית סופר | פישר סיינטיפיק | 08-675 |
| לנתח מיקרוסקופ | Carl Zeiss | OPMI-1 FC |
| מקדח חשמלי המופעל | Foredom או Osada | K.1020 (Foredom) או EXL-M40 (Osada) |
| סכין גילוח חשמלית | וואהל | סדרה 8900 |
| מלקחיים, Dumont לא. 55 | מדע כלים עדינים | 11255-20 |
| החום מוסדר משוב כרית | Fhc | 40-90-8 (thermistor פי הטבעת, 40-90-5D-02, Hלאכול כרית, 40-90-2-07) |
| Isoflurane מאדה | Ohmeda | IsoTec4 |
| הדופק oximeter | סטאר מדעי החיים | MouseOx |
| מברג, בזעיר אנפין | גארט ווייד | 26B09.01 |
| Stereotaxic מסגרת | קופף מכשירים | דגם 900 (עם מסכת העכבר הרדמה שאינם הקרע מוטות אוזניים) |
| מספריים כירורגיות, סוף בוטה | מדע כלים עדינים | 14078-10 |
| Ultrasonic Cleaner | פישר סיינטיפיק | 15-335-30 |
טבלה 2. רשימת חומרים כימיים מסוימים, disposables וציוד.
References
- Cetin, A. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1, 3166-3173 (2006).
- Kleinfeld, D., Delaney, K. R. Distributed representation of vibrissa movement in the upper layers of somatosensory cortex revealed with voltage sensitive dyes. Journal of Comparative Neurology. 375, 89-108 (1996).
- Driscoll, J. D. Quantitative two-photon imaging of blood flow in cortex. Imaging in Neuroscience and Development. Yuste, R. , Cold Spring Harbor Laboratory Press. New York. 927-937 (2011).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extends arteriole capacity. Proceedings of the National Academy of Sciences U.S.A. 108, 8473-8473 (2011).
- Mostany, R., Portera-Cailliau, C. A Method for 2-Photon Imaging of Blood Flow in the Neocortex through a Cranial Window. J. Vis. Exp. (12), e678-e678 (2008).
- Zhang, S. Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia. Journal of Neuroscience. 25, 5333-5338 (2005).
- Takano, T. Astrocyte-mediated control of cerebral blood flow. Nature Neuroscience. 9, 260-267 (2006).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Marker, D. F. A thin-skull window technique for chronic two-photon in vivo imaging of murine microglia in models of neuroinflammation. Journal of Visualized Experiments. (43), e2059-e2059 (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Martin, C. Investigating neural-hemodynamic coupling and the hemodynamic response function in the awake rat. Neuroimage. 32, 33-48 (2006).
- Shih, A. Y. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. , Forthcoming (2011).
- Kobat, D. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17, 13354-13364 (2009).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4, 1128-1144 (2009).
- Xu, H. T. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nature Neuroscience. 10, 549-551 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308, 1314-1318 (2005).
- Davalos, D. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8, 752-758 (2005).
- Ascenzi, A., Fabry, C. Technique for dissection and measurement of refractive index of osteons. The Journal of Biophysical and Biochemical Cytology. 6, 139-142 (1959).
- Stosiek, C. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences U.S.A. 100, 7319-7324 (2003).
- Grinvald, A. Functional architecture of cortex revealed by optical imaging of intrinsic signals. Nature. 324, 361-364 (1986).
- Dunn, A. K. Dynamic imaging of cerebral blood flow using laser speckle. Journal of Cerebral Blood Flow & Metabolism. 21, 195-201 (2001).
- Villringer, A. Capillary perfusion of the rat brain cortex: An in vivo confocal microscopy study. Circulation Research. 75, 55-62 (1994).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76 (1990).
- Srinivasan, V. J. Optical coherence tomography for the quantitative study of cerebrovascular physiology. Journal of Cerebral Blood Flow & Metabolism. 31, 1339-1345 (2011).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15, 011101-011101 (2010).
- Flecknell, P. A. Laboratory animal anesthesia. , Academic Press. San Diego. (1987).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved