È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Un lucido e rinforzato Assottigliato cranio-Window a lungo termine Imaging del cervello di topo
In questo articolo
Riepilogo
Presentiamo un metodo per formare una finestra di imaging nel cranio topo che si estende millimetri ed è stabile per mesi senza infiammazione cerebrale. Questo metodo è adatto per studi longitudinali di flusso sanguigno, dinamica cellulare, e cellule / struttura vascolare con microscopia a due fotoni.
Abstract
In vivo imaging della funzione corticale richiede l'accesso ottico al cervello senza interruzioni dell'ambiente intracranica. Vi presentiamo un metodo per formare un cranio lucido e rinforzato diluito (porte) finestra nel cranio del mouse che si estende su parecchi millimetri di diametro ed è stabile per mesi. Il cranio è diluito a 10 a 15 pm di spessore con una mano trapano per ottenere chiarezza ottica, e viene poi ricoperto con colla di cianoacrilato e un vetro di copertura a: 1) fornire rigidità, 2) inibiscono la ricrescita ossea e 3) ridurre la dispersione della luce da irregolarità sulla superficie dell'osso. Dal momento che il cranio non è violato, qualsiasi infiammazione che potrebbe influenzare il processo in fase di studio è notevolmente ridotto. Imaging profondità fino a 250 um sotto la superficie corticale può essere realizzato utilizzando due fotoni microscopia a scansione laser. Questa finestra è particolarmente adatta a studiare il flusso ematico cerebrale e la funzione cellulare in preparazioni sia anestetizzati e sveglio. Offre inoltre l'opportunità di manipolare l'attività delle cellule utilizzando optogenetics o per interrompere il flusso di sangue nei vasi destinatari irradiazione di circolazione fotosensibilizzanti.
Protocollo
1. Preparazione per la chirurgia i
- Pulire gli strumenti chirurgici dalla sonicazione in una miscela di latte Maxizyme e chirurgica in un pulitore ad ultrasuoni. Sterilizzare gli strumenti chirurgici prima di ogni esperimento.
- Assicurarsi che tutti i reagenti necessari e monouso sono disponibili. Un elenco di reagenti e prodotti monouso è fornita in Tabella 2. Reagenti e monouso che vengono in contatto con il tessuto esposto deve essere sterile, quando possibile.
- Indurre l'anestesia. Anestetici tipici adatti per studi di sopravvivenza sono descritti nella Tabella 1. Garantire piano di anestesia chirurgica controllando per mancanza di reflex punta pizzico. L'età ottimale del mouse è da 3 a 6 settimane di età. I crani di giovani topi sono più morbide e più difficili da sottili. Topi più anziani sono più spesse teschi che sanguinano di più durante la procedura di diradamento.
- Fissare l'animale in un frame stereotassico 1. Un elenco di apparecchi chirurgici è fornita in Tabella 2.
- Mantenere la temperatura del corpotura a 37 ° C utilizzando una sonda rettale regolata feedback e cuscino termico.
- Applicare una pomata oftalmica per gli occhi per trattenere l'umidità.
- Shave il cuoio capelluto con un rasoio elettrico piccolo.
- Pulire il cuoio capelluto con Betadine, seguita da tampone al 70% (v / v) alcool isopropilico.
- Se lo si desidera, controllare che la frequenza cardiaca e la respirazione sono all'interno di un range di normalità con un pulsossimetro. Per un mouse, questi numeri devono centro di circa 10 Hz e 2, rispettivamente.
- Scaldare un'aliquota di filtrata sterile artificiale fluido spinale cerebrale (ACSF) a 37 ° C (125 mM NaCl, 10 mM di glucosio, 10 mM di HEPES, 3,1 mM
CaCl 2, 1,3 mM MgCl 2, pH 7,4) (tutte le sostanze chimiche da Sigma) 2.
2. Montaggio di un frame testa
- Rimuovere il cuoio capelluto su tutta la superficie dorsale cranio con una coppia di pinze e forbici chirurgiche. Tagliare il pelle lateralmente ai bordi dei muscoli temporali su entrambi i lati del cranio e posterior ai muscoli del collo (Fig. 1A).
- Utilizzare una lama di bisturi per rimuovere il periostio sottile dalla superficie del cranio.
- Pulire il cranio con un applicatore con punta di cotone umido e asciugare la superficie del cranio con un flusso d'aria da una polvere può. Quindi applicare un sottile strato di colla di cianoacrilato l'intera superficie del cranio. Lasciare che la colla si asciughi completamente. Questo strato di colla è necessario per aderenza corretto del cemento dentale in fasi successive. La colla di cianoacrilato non deve essere sterilizzato.
- Fissare un connettore metallico alla superficie del cranio, lontano dalla zona della finestra desiderata. Per i preparati anestetizzati, un dado piccolo può essere fissato al cranio con una piccola quantità di colla di cianoacrilato, che può essere successivamente avvitato nella configurazione di imaging mediante un bullone (Fig. 1B, 1L e 1N). Sigillare la parte posteriore del dado con nastro per garantire che la colla non inserire i fili durante l'attacco al cranio. Il dado e nastro devono essere sterilizzati in autoclave prima dell'intervento.
- Per i preparati di imaging svegli, collegare un connettore più rigido personalizzato con due punti di attacco (Fig. 1M e 1N). Praticare due fori nel cranio sopra l'emisfero controlaterale corticale con un ½ mm trapano bava, e poi introdurre due # 000 viti autofilettanti. Queste viti aiuterà ancorare montare la testa al cranio. Applicare solo un giro completo della vite, in modo da evitare di applicare pressione alla corteccia sottostante. Quindi, fissare il costume traversa di metallo con una goccia di colla cianoacrilato sul cervelletto. Lasciare che il collante cianoacrilato asciugare completamente. Questo connettore metallo riduce notevolmente i gradi di libertà e semplifica trasferimento del campo dell'imaging stesso in studi longitudinali. Una traversa gamma dà ampio spazio per il posizionamento degli elettrodi e la stimolazione di vibrisse. Piani dettagliati per la generazione del supporto personalizzato testa e dispositivo di fissaggio sono disponibili online (SICS / links.html "> http://physics.ucsd.edu/neurophysics/links.html). Le viti e la barra trasversale devono essere sterilizzati in autoclave prima dell'intervento.
- Coprire l'intera superficie del cranio, escludendo la posizione della finestra, con uno strato di cemento dentale (Fig. 1C e 1D). Assicurarsi che tutti i bordi esposte della cute, sono coperti da cemento. I componenti del cemento dentale non devono essere sterilizzati.
3. La generazione di un lucido e rafforzato Assottigliato-cranio (porte) Window
- Assicurarsi che bave trapano sono taglienti ed evitare di riutilizzarli. Utilizzando un basso numero di giri sul trapano dentistico, sottile di 2 mm per 2 mm rispetto alla regione di corteccia somatosensoriale con una bava ½ mm. Alternate tra bagnare il cranio con ACSF e poi asciugare la superficie del cranio con un leggero getto d'aria da un panno gas; umido per il raffreddamento, e secco per la diluizione. Ciò richiede assottigliamento attraverso lo strato spongioso del cranio, che possono sanguinare, ma può essere controlled sciacquando con ACSF (Fig. 1E). Il cranio inizia a flettersi sotto la leggera pressione del trapano quando è circa 50 um, ed i vasi piale deve essere visibile attraverso l'osso umido (Fig. 1F). A questo spessore, piccole macchie bianche all'interno dell'osso diventano visibili per alcuni secondi immediatamente dopo che la superficie del cranio asciutta viene umidificato.
- A questo punto, il sottile osso ulteriormente. Utilizzare una velocità di punta più lento, vale a dire, 1000 rpm, che si rade la superficie del cranio con solo un leggero tocco. Con movimenti controllati mantenendo la punta di una penna e solo applicare una forza nella direzione laterale. L'osso deve essere ~~~V 10 a 15 um Nella spessore finale (Fig. 1G). Quando l'osso è sufficientemente sottile, le piccole macchie bianche nelle ossa non saranno più visibili quando la superficie del cranio secco inumidito.
- Lucidare la regione della finestra con la polvere di ossido di stagno. Collegare un pre-made punta che è stato immerso in silicone sigillante acquario e condisegnato, lasciando una frusta rastremata (inserto, fig. 1H). La frusta silicone deve essere preparato almeno un giorno prima della chirurgia, e sterilizzata con 70% di isopropanolo prima dell'uso. Inserire una piccola presa di polvere sulla finestra con una goccia di ACSF (Fig. 1H). Agitare il slurry sulla finestra fino a dieci minuti sfiorando la punta della frusta mobile alla superficie del cranio. Lavare via la polvere di ossido di stagno accuratamente dalla finestra utilizzando ACSF e asciugare accuratamente l'osso con un leggero getto d'aria. Irregolarità della superficie e frammenti ossei aderenti hanno lasciato foratura nelle fasi precedenti devono essere rimossi dopo la lucidatura (Fig. 1H e 1I). La polvere di ossido di stagno non deve essere sterilizzato.
- Tagliare pezzi quadrati di no. 0 vetro di copertura leggermente inferiore alla dimensione della finestra. Utilizzare uno scriba di segnare delicatamente separate le linee orizzontali e verticali in coprioggetto utilizzando un regolo. Quindi mettere il vetrino in una capsula di Petri e knock il piatto contro un bordo tabella per separare i pezzi di vetro. L'intera piastra di Petri possono essere sterilizzati in autoclave per garantire la sterilità.
- Inserire un vetro di copertura di dimensioni adeguate nei pressi della finestra secca. Applicare una piccola quantità di colla cianoacrilato sopra la finestra con la punta di un applicatore di legno rotta cotton-fioc, e rapidamente spingere il pezzo pretagliato di vetro di copertura sopra la colla. Evitare di creare bolle sotto il vetro di copertura. Spingere delicatamente il vetro di copertura contro la superficie del cranio, e tenere premuto per alcuni secondi (Fig. 1J e 1O). Lasciare che la colla si asciughi completamente nell'arco di 15 minuti. L'eccesso di colla di cianoacrilato può essere rimosso dalla superficie superiore del vetro di copertura con una lama di bisturi dopo che viene essiccato. Sigillare i bordi del vetro di copertura con cemento dentale e formano una leggermente sollevata e per contenere l'acqua per immersione della lente (Fig. 1K e 1O).
4. Recupero
- Mettete l'animale in un intervento chirurgico temperatura in gabbia. Monitorare ilanimale periodicamente fino al completo recupero dall'anestesia.
- Se il preparato è destinato a sopravvivere per più di un giorno, fornire buprenorfina (0,03 pg per roditori g) per analgesia. Abbiamo tipicamente immagine dell'animale almeno un giorno dopo l'impianto iniziale.
5. Imaging Preparazione
- Stabilizzare l'animale su una basetta per l'imaging ottico, utilizzando la cornice come supporto per la testa (Fig. 1L e 1M). Un dispositivo di ritenuta può essere costituito da componenti optomechanical commercialmente disponibile da Qioptiq o Thorlabs. Il nostro piatto a parte può essere trasportato tra le suite di imaging chirurgici e due fotoni con l'animale e tutti i dispositivi di monitoraggio fisiologico assemblati come una sola unità 3.
- Se il flusso sanguigno immagini si desidera, iniettare 0,05 mL del 5% (w / v) fluorescente-destrano colorante disciolto in soluzione fisiologica sterile attraverso la vena della coda o vena infraorbitale per etichettare il siero del sangue (Fig. 2A e 2C a 2H ) 4-7. Questo deve essere fatto in anestesia generale. Amministrazione vena infraorbitale può essere più facile per i principianti, come soluzioni di destrano sono più viscoso. La vena della coda può essere difficile individuare in topi di colore scuro, e la vena tende a collassare dopo una iniezione fallito. Per l'imaging vascolare con il verde delle emissioni, usare un isotiocianato di fluorescina destrano. Per emissione rossa, utilizzare un Texas Red destrano. Con alto peso molecolare destrani, il colorante rimane in circolazione per diverse ore. In alternativa, gli animali con endogeni etichette fluorescenti possono essere esposte direttamente al momento opportuno a due fotoni di lunghezza d'onda di eccitazione. La soluzione destrano può essere congelato in aliquote per uso futuro.
- Pulire delicatamente la superficie della finestra con un applicatore con punta di cotone umido.
- Per l'imaging prolungata delle preparazioni anestetizzati, iniettare per via intraperitoneale soluzione sterile di Ringer lattato presso un volume di 3 pl per grammo ogni 2 ore per mantenere i fluidi corporei ei requisiti energetici.
- Quando gli animali di imaging in stato di veglia, limitare poggiatesta per poche ore alla volta per ridurre i livelli di stress. Rispedire l'animale verso la gabbia a casa tra le sessioni di imaging per il cibo e l'acqua.
6. Risultati rappresentativi
Una finestra corretta vi permetterà di imaging profondità fino a 250 micron sotto la superficie piale per diversi mesi. Questo metodo è stato utilizzato per studiare in vivo flusso sanguigno capillare 4, 8, attivazione della microglia 8, 9, e all'interno della struttura dendritica corticale parenchima 8. In un esempio, si usa due fotoni imaging per mostrare la vascolatura corticale di una anestetizzato Thy1-giallo proteina fluorescente (YFP) topo, dopo il siero del sangue è etichettato mediante iniezione endovenosa di Texas Red destrano (Fig. 2A). Vasi durali sono spesso visibili leggermente al di sopra della superficie corticale della dura madre (Fig. 2C, freccia). Grandi piale arteriole e venule lie sulla superficie corticale (Fig. 2D). Penetrante ramo navi da questa rete di superficie e immergersi nella corteccia dove si ramificano in un letto denso capillare che alimenta il tessuto corticale (Fig. 2E a 2H). Pergole dendritiche di YFP profonda esprimere i neuroni corticali, una endogena di segnale a questa linea di topi, possono essere esposte contemporaneamente in un secondo canale 10 (Fig. 2B a 2H). Il segnale di seconda armonica della osso è stato raccolto in un terzo canale, e può essere utilizzato per misurare lo spessore del cranio assottigliata dopo il prelievo di pile di immagine (Fig. 2A a 2C).
Corticali dinamiche vascolari sono profondamente colpiti da anestetici 11. In un secondo esempio, mostriamo un video di vasoactivity spontanei raccolti da microscopia a due fotoni da un topo abituata sveglio. Oscillazioni vasomotorie rilievo del diametro del lume sono visti con una arteriola piale, ma non con un venule vicina. Questogamma basale di vasoactivity è diminuita con 4 uretano anestesia. Per quantificare i cambiamenti spontanea ed evocata nel flusso sanguigno, usiamo tecniche adeguate linee di scansione per catturare sia il diametro vascolare e la velocità dei globuli rossi dei singoli pescherecci. Informazioni più dettagliate sulle immagini quantitativa del flusso sanguigno tramite microscopia a due fotoni sono disponibili 3, 12.
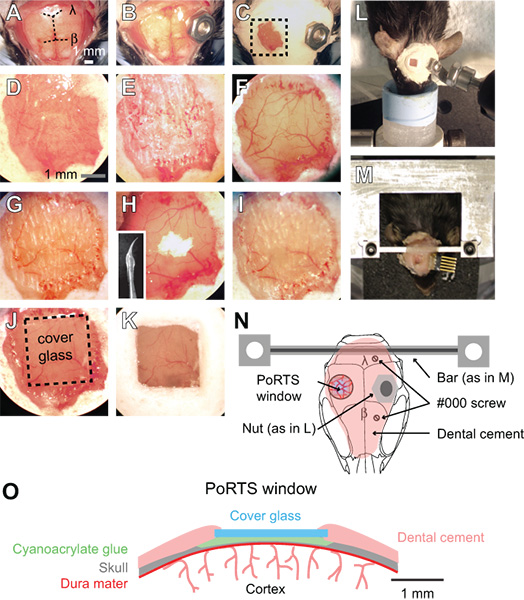
Figura 1. Procedura per una finestra Porte. (Dalla A alla K) Immagini di passi sequenziali nella procedura per la generazione di una finestra porte. Vedere il testo per le istruzioni dettagliate. β = bregma e λ = lambda. (L) del sistema di dadi e bulloni per il fissaggio della testa durante l'imaging di preparati anestetizzati. (M) Custom lavorati croce mount testa bar per la preparazione svegli. In questo esempio, un connettore stato impiantato anche per registrazioni electrocorticogram ripetuti. (N)Diagramma schematico che mostra vista dorsale del supporto testa e la posizione dei vari componenti. Il dado utilizzato in L pannello è inteso come alternativa alla traversa con pannello in M. Two # 000 viti autofilettanti sono aggiunti con la traversa di montaggio per una maggiore stabilità con preparazioni di imaging svegli. (O) Schema che illustra la sezione trasversale di una finestra Porte.
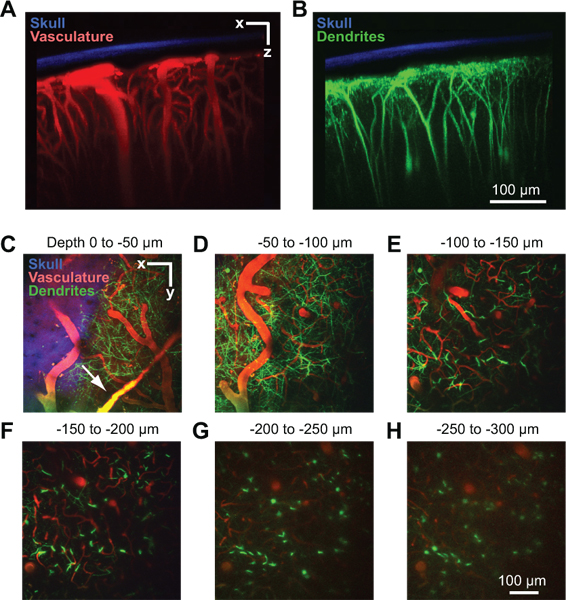
Figura 2. Imaging a due fotoni della struttura vascolare e neuronale nel topo corteccia. Tutte le immagini sono state raccolte attraverso una finestra porte in un Thy1-YFP del mouse a 2 giorni dopo l'impianto finestra 10. Sporgenza massima oltre 150 micron di tessuto nell'orientamento coronale mostra il cranio diluito in relazione al sistema vascolare (A) e dendriti (B). L'osso (blu) è stato rilevato raccogliendo la seconda armonica fluorescenza a 450 nm di emissione di 900 nm di eccitazione 8. Il sistema vascolare (rosso) è stata iniettata per via endovenosa etichettati da 70 kDa Texas Red destrano 6. I campi dendritiche dei neuroni (verde) sono endogeni al Thy1-YFP linea di topi transgenici. (CH) proiezioni massime oltre 50 micron di tessuto in orientamento orizzontale a diverse profondità al di sotto della pia. I dati sono dalla pila stessa immagine mostrata in pannelli A e B. navi Dural può essere visibile appena sopra la superficie corticale (freccia in C).
Abbreviazioni
ACSF = artificiale liquido cerebrospinale
PORTI = finestra lucidato e rinforzato cranio diluito
YFP = proteina fluorescente gialla
mi assicuro che le procedure descritte sono approvati cura del Suo locale Animal istituzionale e Usa comitato.
Access restricted. Please log in or start a trial to view this content.
Discussione
Two-photon immagini attraverso una finestra Porte richiede la trasmissione attraverso l'osso assottigliata e la dura madre, che attenua la luce laser e aggiunge aberrazioni ottiche a maggiori profondità 8. Tuttavia, nonostante questo inconveniente, profondità di imaging fino a 250 um sotto la superficie piale può essere ottenuto con eccitazione 900 nm. Profondità maggiori di imaging possono in linea di principio essere possibile con lunghezze d'onda di eccitazione più 13. Un importante...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Niente da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla American Heart Association (Post-doctoral fellowship a AYS) e il National Institutes of Health (MH085499, EB003832 e OD006831 a DK). Ringraziamo Beth Friedman e Pablo Blinder per i commenti sul manoscritto.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments | |||
| Agente | Via di consegna | Dose per il mouse | Durata | Note | Fonte | Rif. Rif. |
| Pentobarbital (Nembutal) | IP | 90 ug / g | 15-60 min | Margine di sicurezza stretta. Lavorare fino a giusta dose di anestesia lentamente. Supplemento 10% della dose di induzione come richiesto. | 036093; Butler Schein | 7 |
| Ketamina (Ketaset) miscelato con Xylazina (Anased) | IP | 60 mcg / g (K) 10 pg / g (X) (in miscela stessa siringa) | 20-30 min | Xilazina è co-iniettata come un rilassante muscolare e analgesico. Supplemento solo ketamina al 50% della dose di induzione come richiesto. | (K) 010.177, (X) 033.198; Butler Schein | 7 |
| Isoflurano (Isothesia) | Inalazione | 4% concentrazione media alveolare (MAC) per l'induzione; 1-2% MAC per la manutenzione | 4-6 h. | Purché in miscela di 70% di ossigeno e il 30% di ossido di azoto. L'anestesia prolungata porta a rallentare il recupero. | 029403; Butler Schein | 26 |
Tabella 1. Consigliato agenti anestetici per gli studi di sopravvivenza.
| VOCE | AZIENDA | CATALOGO # / MODEL |
| Betadine | Butler Schein | 6906950 |
| Buprenorfina (Buprenex) | Butler Schein | 031919 |
| Isotiocianato di fluorescina destrano, 2 MDa peso molecolare | Sigma | FD2000S |
| Alcol isopropilico | Pescatore | AC42383-0010 |
| Soluzione di Ringer lattato | Butler Schein | 009846; |
| Lidocaina soluzione, 2% (v / v) | Butler Schein | 002468 |
| Salino | Butler Schein | 009861 |
| Milk chirurgico | Butler Schein | 014.325 |
| Texas Red destrano, 70 kDa peso molecolare | Invitrogen | D1864 |
| Maxizyme | Butler Schein | 035646 |
| MONOUSO | ||
| Carbide sbavature, ugello di dimensioni 1/2 mm | Strumenti di Scienze Belle | 19007-05 |
| Applicatori punta la foglia | Fisher Scientific | 23-400-100 |
| Vetro di copertura, no. 0 spessore | Thomas Scientific | 6661B40 |
| Colla di cianoacrilato | ND Industries | H04308 31428 |
| Gas duster | Newegg | N82E16848043429 |
| Grip di cemento in polvere | Dentsply | 675571 |
| Grip cemento solvente | Dentsply | 675572 |
| Insulina siringa, 0,3 mL di volume con il 29,5 gauge | Butler Schein | 018384 |
| Dado e bullone per fissare la testa | Digikey | Dado, H723-ND, bullone, R2-56X1/4-ND |
| Unguento oftalmico | Butler Schein | 039886 |
| Lame di bisturi | Fisher Scientific | 12-460-448 |
| Viti, autofilettante # 000 | JI Morris Azienda | FF000CE125 |
| Silicone sigillante acquario | Perfecto Manufacturing | 31001 |
| Tin polvere di ossido di | Mama Minerals | EQT-TINOX |
| ATTREZZATURE | ||
| Glass scriba | Fisher Scientific | 08-675 |
| Dissezione microscopio | Carl Zeiss | OPMI FC-1 |
| Trapano elettrico alimentato | Foredom o Osada | K.1020 (Foredom) o EXL-M40 (Osada) |
| Rasoio elettrico | Wahl | Serie 8900 |
| Pinza, Dumont no. 55 | Strumenti di Scienze Belle | 11255-20 |
| Commenti pad termico regolamentato | FHC | 40-90-8 (termistore rettale, 40-90-5D-02; hmangiare pad, 40-90-2-07) |
| Vaporizzatore isoflurano | Ohmeda | IsoTec4 |
| Pulsossimetro | Starr Life Sciences | MouseOx |
| Cacciavite miniatura | Garret Wade | 26B09.01 |
| Telaio stereotassico | Kopf Instruments | Modello 900 (con maschera del mouse l'anestesia e non rottura barre di auricolari) |
| Forbici chirurgiche, fine blunt | Strumenti di Scienze Belle | 14078-10 |
| Pulitore ad ultrasuoni | Fisher Scientific | 15-335-30 |
Tabella 2. Elenco dei reagenti specifici e le attrezzature, i materiali monouso.
Riferimenti
- Cetin, A. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1, 3166-3173 (2006).
- Kleinfeld, D., Delaney, K. R. Distributed representation of vibrissa movement in the upper layers of somatosensory cortex revealed with voltage sensitive dyes. Journal of Comparative Neurology. 375, 89-108 (1996).
- Driscoll, J. D. Quantitative two-photon imaging of blood flow in cortex. Imaging in Neuroscience and Development. Yuste, R. , Cold Spring Harbor Laboratory Press. New York. 927-937 (2011).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extends arteriole capacity. Proceedings of the National Academy of Sciences U.S.A. 108, 8473-8473 (2011).
- Mostany, R., Portera-Cailliau, C. A Method for 2-Photon Imaging of Blood Flow in the Neocortex through a Cranial Window. J. Vis. Exp. (12), e678-e678 (2008).
- Zhang, S. Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia. Journal of Neuroscience. 25, 5333-5338 (2005).
- Takano, T. Astrocyte-mediated control of cerebral blood flow. Nature Neuroscience. 9, 260-267 (2006).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Marker, D. F. A thin-skull window technique for chronic two-photon in vivo imaging of murine microglia in models of neuroinflammation. Journal of Visualized Experiments. (43), e2059-e2059 (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Martin, C. Investigating neural-hemodynamic coupling and the hemodynamic response function in the awake rat. Neuroimage. 32, 33-48 (2006).
- Shih, A. Y. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. , Forthcoming (2011).
- Kobat, D. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17, 13354-13364 (2009).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4, 1128-1144 (2009).
- Xu, H. T. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nature Neuroscience. 10, 549-551 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308, 1314-1318 (2005).
- Davalos, D. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8, 752-758 (2005).
- Ascenzi, A., Fabry, C. Technique for dissection and measurement of refractive index of osteons. The Journal of Biophysical and Biochemical Cytology. 6, 139-142 (1959).
- Stosiek, C. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences U.S.A. 100, 7319-7324 (2003).
- Grinvald, A. Functional architecture of cortex revealed by optical imaging of intrinsic signals. Nature. 324, 361-364 (1986).
- Dunn, A. K. Dynamic imaging of cerebral blood flow using laser speckle. Journal of Cerebral Blood Flow & Metabolism. 21, 195-201 (2001).
- Villringer, A. Capillary perfusion of the rat brain cortex: An in vivo confocal microscopy study. Circulation Research. 75, 55-62 (1994).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76 (1990).
- Srinivasan, V. J. Optical coherence tomography for the quantitative study of cerebrovascular physiology. Journal of Cerebral Blood Flow & Metabolism. 31, 1339-1345 (2011).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15, 011101-011101 (2010).
- Flecknell, P. A. Laboratory animal anesthesia. , Academic Press. San Diego. (1987).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon