Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fare Beyin Uzun vadeli Görüntüleme için Parlak ve Takviyeli inceltilmiş-kafatası Pencere
Bu Makalede
Özet
Biz milimetre yayılan ve beyin iltihabı olmadan ay dayanır farenin kafatasında bir görüntüleme penceresi oluşturmak için bir yöntem sunuyoruz. Bu yöntem de iki foton mikroskopi kullanılarak kan akımı, hücresel dinamiği ve hücre / vasküler yapının uzunlamasına çalışmalar için uygundur.
Özet
In vivo kortikal fonksiyon görüntüleme intrakraniyal çevre aksamadan beyne optik erişim gerektirir. Biz, çapı birkaç milimetre yayılan ve ay dayanır farenin kafatasının bir cilalı ve güçlendirilmiş inceltilmiş kafatası (portlar) pencere oluşturmak için bir yöntem sunuyoruz. Kafatası optik netlik elde etmek için matkap tutulan bir el kalınlığının 10 ila 15 um ile inceltilir ve daha sonra siyanoakrilat yapıştırıcı ve bir cam kapak ile kaplanır: 1) sertlik, 2) sağlamak kemik yeniden büyüme inhibe ve 3) ışık saçılımı azaltmak kemik yüzeyine düzensizlikler den. Kafatası ihlal olmadığı için, çalışılan süreci etkileyecek herhangi bir inflamasyon büyük ölçüde azalır. Kadar kortikal yüzeyinin altında 250 um arasında görüntüleme derinlikleri iki-fotonlu lazer tarama mikroskobu kullanılarak elde edilebilir. Bu pencere de anestezisiz ve uyanık hem hazırlıklarına serebral kan akımı ve hücre fonksiyonu incelemek için uygundur. Daha da op sunuyorportunity optogenetics kullanarak hücre aktivitesi işlemek için veya ışığa dolaşan ışınlama tarafından hedef damarlarındaki kan akımını bozabilir.
Protokol
1. Ameliyat için hazırlık i
- Ultrasonik temizleyici Maxizyme ve Cerrahi Süt karışımı içinde sonicating tarafından cerrahi aletler temizleyin. Her deneyden önce cerrahi aletler otoklav.
- Gerekli tüm reaktifler ve sarf kullanılabilir olduğundan emin olun. Reaktifler ve tek kullanımlık bir listesi Tablo 2'de verilmektedir. Mümkün olduğunda maruz doku ile temas Reaktifler ve sarf malzeme, steril olmalıdır.
- Anestezi neden. Sağkalım çalışmaları için uygun olan tipik anestetikler Tablo 1 'de tarif edilmektedir. Ayak tutam refleksi eksikliği denetleyerek anestezi cerrahi uçağı olun. Farenin optimum yaşı yaşı 3-6 hafta. Genç farelerin kafatasları daha yumuşak ve ince daha zordur. Yaşlı farelerde inceltme işlemi sırasında daha fazla kanayacak kalın kafatasları var.
- Bir stereotaksik çerçeve 1 içindeki hayvan sabitlemek. Cerrahi ekipman bir listesi Tablo 2'de verilmektedir.
- Vücut sıcaklığı koruyun37 Ture ° C'de bir geri bildirim düzenlenir rektal ısı probu ve takımını kullanarak.
- Nemi korumak için gözleri oftalmik merhem uygulayın.
- Küçük bir elektrik ustura ile kafa derisi Tıraş.
- 70% (v / v) izopropil alkol ile sürüntü takiben Betadine, kafa derisi ile temizlenir.
- İsterseniz, kalp ve solunum hızları bir pulse oksimetre kullanarak normal sınırlar içinde olup olmadığını kontrol edin. Bir fare için, bu rakamlar sırasıyla 10 civarında merkezi ve 2 Hz gerekir.
- 37 ° C'de (125 mM NaCl, 10 mM glükoz, 10 mM HEPES, 3.1 mM
CaCI2, 1,3 mM MgCl2, pH 7.4) (Sigma tüm kimyasal) için steril-Süzülen yapay serebrospinal akışkan (ACSF) bir kısım ısıtmak 2.
2. Bir baş Çerçeve Montaj
- Pens ve cerrahi makas ile tüm dorsal kafatası yüzeyi üzerinde kafa derisi çıkarın. Kafa ve post her iki tarafında yanal zamansal kaslarının kenarlarına cilt kesinboyun (Şekil 1A) ve kaslara erior.
- Kafatası yüzeyinden ince periost kaldırmak için bir neşter bıçak kullanın.
- Nemli bir pamukla temizleyin kafatası aplikatör uçlu ve bir toz olabilir gelen hava akımı ile kafatası yüzeyi kurulayın. Sonra tüm kafatası yüzeye siyanoakrilat yapıştırıcı ince bir tabaka uygulayın. Tutkal iyice kurumasını bekleyin. Tutkal bu katman ardçıl adımda diş çimento uygun yapışması için gereklidir. Siyanoakrilat yapıştırıcı steril olması gerekmez.
- Uzağa istenen penceresinin alanından, kafa yüzeyine bir metal bağlayıcı takın. Anestezi hazırlıkları için, küçük bir somun sonra bir cıvata kullanarak görüntüleme kurulumu (Şekil 1B, 1L ve 1N) vidalanan siyanoakrilat yapıştırıcı bir DAB ile kafatası tesbit edilebilmektedir. Tutkal kafatasına takma esnasında konuları girmezse sağlamak için bant ile fındık arkasına sürün. Somunu ve teyp sterilize edilmelidir operasyon öncesi otoklavlayarak.
- Uyanık görüntüleme hazırlıkları için iki bağlantı noktaları (Şekil 1M ve 1N) ile daha rijit bir özel konnektör takın. Bir ½ mm matkap çapak ile kontralateral kortikal yarımkürede üzerinde kafatasında iki delik açın ve sonra iki # 000 vidaları tanıtmak. Bu vidalar kafa kafatasına monte demir yardımcı olacaktır. Altta yatan korteks basınç uygulayarak önlemek için, vidanın sadece bir tam dönüş geçerlidir. Sonra, beyincik üzerinde siyanoakrilat yapıştırıcı küçük bir dab ile özel metal çapraz çubuk takın. Siyanoakrilat yapıştırıcı iyice kurumasını bekleyin. Bu metal bağlantı büyük ölçüde özgürlüğü derece azaltır ve uzunlamasına çalışmalarda aynı görüntüleme alanının taşınması kolaylaştırır. Geniş bir çapraz çubuk burun kılı elektrot yerleştirme ve uyarılması için bol bol yer veriyor. Özel kafa montaj ve bağlantı cihazı üretmek için detaylı planlar çevrimiçi mevcuttur (sics / links.html "> http://physics.ucsd.edu/neurophysics/links.html). vida ve çapraz çubuk operasyon öncesi otoklav ile sterilize edilmelidir.
- Diş çimento tabakası ile pencerenin konumu, (Şekil 1C ve 1D) hariç, tüm kafatası yüzeyini kaplayacak. Tüm cilt kenarlar çimento kaplı olduğundan emin olun. Dental çimento bileşenleri sterilize edilmesi gerekmez.
3. Bir Cilalı üretimi ve inceltilmiş-kafatası (port) Pencere Takviyeli
- Matkap çapak keskin olduğundan emin olun ve tekrar kullanmadan kaçının. Bir ½ mm çapak ile somatosensoriyel korteks üzerinden 2 mm bölgeye göre 2 mm'lik ince, diş matkap düşük bir hızda kullanma. Soğutma için ıslak ve inceltme için kuru; ACSF ile kafatası ıslatma ve sonra bir gaz silgi gelen bir hava akımı ile kafatası yüzeyinde kuruma arasında alternatif. Bu kanayabilir kafatası ve süngerimsi katmanı sayesinde incelme gerektirir, ancak controll edilebilirACSF (Şekil 1E) püskürtülerek ed. Kafatası bunu ~ 50 mikron ve pial damarların ıslak kemik (Şekil 1F) aracılığıyla görünür olmalıdır zaman matkap hafif basınç altında flex başlar. Bu kalınlıkta, kemik içindeki küçük beyaz lekeler kuru kafatası yüzeyi nemli hemen sonra bir kaç saniye görünür hale gelecektir.
- Bu noktada, kemiğin ince daha da. Sadece hafif bir dokunuş ile kafatası yüzeyi shaves daha yavaş bir matkap hız, yani, 1000 rpm, kullanın. Bir kalem gibi matkap tutarken küçük kontrollü hareketleri kullanın ve sadece yatay yönde kuvvet uygulanır. Kemik nihai kalınlığı (Şekil 1 G) azından 10-15 um Resimler ~ edilmelidir. Kuru kafatası yüzeyi nemlendirilmiş zaman kemik yeterince ince olduğunda, kemik küçük beyaz noktalar artık görülebilir.
- Kalay oksit tozu ile pencere bölge parlatın. Silikon akvaryum sealant ile batırılmış Önceden hazırlanmış bir matkap ucu takınkonik bir kamçı (inset, Şek. 1H) bırakarak çekilmiş. Silikon kırbaç ameliyattan önce en az bir gün, hazırlanan kullanmadan önce izopropanol% 70 ile sterilize edilmelidir. ACSF (Şekil 1 H) ve bir damla birlikte penceresinde tozu küçük bir tutam yerleştirin. Hafifçe kafatası yüzeye hareketli kamçının ucu dokunarak kadar on dakika için penceresi üzerine bulamaç karıştırın. ACSF kullanarak penceresinden iyice kalay oksit toz uzaklıkta yıkayın ve bir hava akışı ile iyice kemik kurulayın. Önceki adımlarda sondaj bıraktığı Yüzey usulsüzlük ve yapışık kemik parçacıkları parlatma (Şekil 1H ve 1I) sonra çıkartılmalıdır. Kalay oksit tozu steril olması gerekmez.
- Hiçbir kare parça kesin. Pencerenin boyutunu biraz daha küçük 0 cam kapak. Hafifçe bir cetvel kullanarak kapak kayma ayrılmış yatay ve dikey çizgiler skor bir katip kullanın. Sonra bir petri ve kn da kapak kayma yerleştirincam parçaları ayırmak için bir masa kenarına çanak ock. Tüm petri sonra sterilite sağlamak için otoklavlanabilir.
- Uygun boyutta bir cam kapak yakındaki kuru pencere yerleştirin. Kırık bir tahta pamuk uçlu aplikatör ucunu kullanarak penceresi üzerine siyanoakrilat yapıştırıcı küçük bir dab uygulayın ve hızlı bir şekilde tutkal üstüne kapak cam hazır kesilmiş parça itin. Cam kapak altında hava kabarcıkları oluşturarak kaçının. Yavaşça kafatası yüzeye karşı cam kapak itin ve birkaç saniye (Şekil 1J ve 1O) basılı tutun. Tutkal 15 dakika içinde tamamen kurumasını sağlayın. Bu kurutulduktan sonra aşırı siyanoakrilat tutkal bir bisturi ile bıçak cam kapak üst yüzeyi ile kaldırılabilir. Diş çimento, cam kenarları mühür ve oluşturmak biraz eğimli lensi (Şekil 1K ve 1O) su tutmak için de kaldırdı.
4. Kurtarma
- Sıcak bir kafes aşağıdaki cerrahide hayvan yerleştirin. Monitörhayvan periyodik tamamen anestezi kurtarır kadar.
- Hazırlanması, birden fazla gün için hayatta kalmak için anlamına edilirse, analjezi için buprenorfin (rodent g başına 0,03 mg) sağlamaktadır. İlk implantasyondan sonra bu tipik olarak görüntü hayvan en az bir gün.
5.. Görüntüleme Hazırlık
- Bir baş desteği (Şekil 1L ve 1M) gibi çerçeve kullanılarak, görüntüleme için bir optik breadboard hayvan stabilize. Bir tutma cihazı Qioptiq ya ThorLabs ticari olarak temin optomechanical bileşenleri yapılabilir. Bizim ayrı plaka hayvan ve bir ünite 3 olarak monte tüm fizyolojik izleme cihazları ile cerrahi ve iki foton görüntüleme suit arasında taşınabilir.
- Kan akışı görüntüleme isteniyorsa,% 5 0.05 mL (w / v) flüoresan-dekstran boya kan serumu (Şek. 2A ve 2C 2H üzere etiketlemek için ya kuyruk damarından ya infraorbital damarı yoluyla steril salin enjekte içinde çözülmüş ) 4-7. Bu, genel anestezi altında yapılmalıdır. Dekstran çözümleri daha viskoz gibi infraorbital ven yönetimi, yeni başlayanlar için daha kolay olabilir. Kuyruk damarı koyu renkli farelerde bulmak zor olabilir ve ven başarısız bir enjeksiyondan sonra daraltmak eğilimindedir. Yeşil emisyon ile görüntüleme damar, bir floresein izotiyosiyanat dekstran kullanın. Kırmızı salma için bir Texas Kırmızı dekstran kullanın. Yüksek moleküler ağırlığı olan dekstranlar, boya birkaç saat süreyle dolaşımı içinde kalır. Alternatif olarak, endojen floresan etiketleri ile hayvanların uygun iki fotonun dalgaboyu doğrudan görüntülenebilir. Dekstran çözeltisi gelecekteki kullanım için alikots içinde dondurulabilir.
- Hafifçe nemli bir pamukla pencere yüzeyinin temizlenmesi aplikatör uçlu.
- Anestezi hazırlıkları uzun süreli görüntüleme için, vücut sıvıları ve enerji gereksinimleri korumak gram her 2 saat için 3 uL bir hacimde steril laktatlı Ringer solüsyonu intraperitoneal olarak enjekte edilir.
- Zaman uyanık halde görüntüleme hayvanlar, stres seviyesini azaltmak için bir seferde sadece birkaç saat kafalık sınırlayın. Yiyecek ve su için görüntüleme oturumlar arasında ev kafesine hayvan dönün.
6. Temsilcisi Sonuçlar
Başarılı bir pencere birkaç ay pial yüzey altında 250 um görüntüleme derinliklerine kadar izin verecektir. Bu yöntem, kortikal parankimi 8 içinde vivo kılcal kan akışı 4, 8, mikrogliyal aktivasyon 8, 9 ve dendritik yapısında incelemek için kullanılmıştır. Bir örnek olarak, serum Texas Red dekstran (Şek. 2A) intravenöz enjeksiyonu ile etiketlenmiştir sonra, bir anestetize Thy1-sarı bir floresan proteini (YFP) fare kortikal vaskülatürün göstermek için iki-fotonlu görüntüleme kullanabilir. Dural damarları biraz dura mater kortikal yüzey (Şekil 2C, ok) yukarıda görülebilir. Büyük pial arteriol ve venüller liKortikal yüzeyinde e (Şekil 2B). Onlar kortikal doku besleyen yoğun bir kılcal damar yatağı (Şekil 2E için 2H) içine dal budak salmak korteks içine bu yüzey ağı ve dalıştan Penetran damarları dalı. Kortikal nöronların duyduğunuz derin YFP, bu fare hattı için bir sinyal endojen Dendritik Arbors, ikinci bir kanal 10 (Şekil 2B 2H için) aynı anda görüntülenebilir. Kemiğin ikinci harmonik sinyali üçüncü bir kanalda toplandı ve görüntü yığınlarının toplandıktan sonra inceltilmiş kafatası (2C üzere Şek. 2A) ve kalınlık ölçmek için kullanılabilir.
Kortikal vasküler dinamikleri derinden anestezikler 11 etkilenir. İkinci bir örnek olarak, biz alışkın uyanık fare iki-foton mikroskopi tarafından toplanan spontan vasoactivity bir video gösteriyor. Lümen çapında tanınmış vazomotor salınımlar bir pial arteriyol görülen, ancak bir komşu venül ile edilir. Buvasoactivity bazal aralığı üretan anestezisi 4 ile azalır. Kan akımında spontan ve uyarılmış değişiklikleri ölçmek için, tek tek damar damar çapı ve kırmızı kan hücrelerinin hızı hem de yakalamak için uyarlanmış çizgi tarama teknikleri kullanır. İki foton mikroskopi kullanılarak kantitatif kan akışını görüntülemede Ayrıntılı kaynakları, 12 3. mevcuttur.
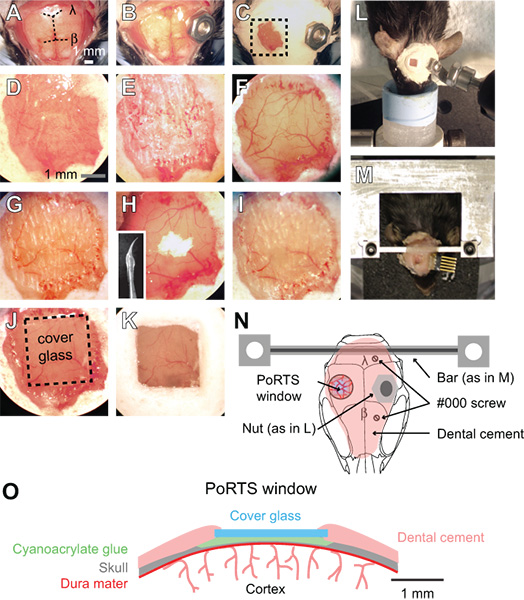
Şekil 1.. A bağlantı noktası pencere için Prosedür. A bağlantı noktası pencere oluşturmak için prosedür sıralı adımlar (A K) Görüntüler. Ayrıntılı talimatlar için metne bakınız. β = bregma ve λ = lambda. Anestezi hazırlıkları görüntüleme sırasında başını sabitlemek için (L) Cıvata ve somun sistemi. (M) Özel uyanık hazırlıkları için çapraz çubuk baş bağlama işlendi. Bu örnekte, bir bağlayıcı da tekrarlayan electrocorticogram kayıtlar için yerleştirildi. (N)Şematik baş bağlama ve çeşitli bileşenlerinin konumu dorsal görünümü gösteren. Panel L kullanılan fındık paneli M. İki kullanarak çapraz çubuk alternatif olarak kastedilen # 000 vidaları uyanık görüntüleme hazırlıkları ile eklenen istikrar için çapraz çubuk montaj ile ilave edilir. A bağlantı noktası pencere kesiti gösteren (O) şematik diyagramı.
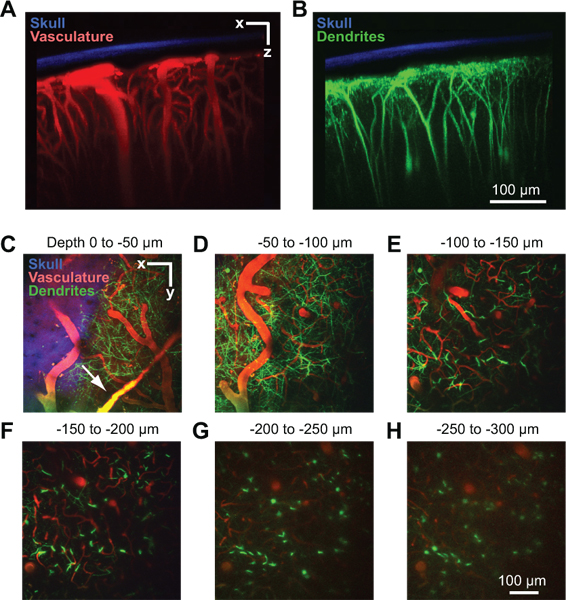
Şekil 2. Fare korteks damarsal ve sinirsel yapının iki-foton görüntüleme. Tüm görüntüler pencere implantasyonu 10 2 gün sonra bir Thy1-YFP fare bir LİMANLARI pencereden toplanmıştır. Vasküler (A) ve dendritler (B) ile ilgili olarak inceltilmiş kafatası gösteren koronal yönde doku 150 mikron üzerinde maksimal projeksiyon. Kemik (mavi) 900 nm eksitasyon 450 nm emisyon de ikinci harmonik floresans toplayarak tespit edildi 8. Damar (kırmızı) damardan enjekte 70 kDa Texas Red dekstran 6 etiketli edildi. Nöronların dendritik alanlar (yeşil) Thy1-YFP transjenik fare hattına endojen vardır. Pia altında farklı derinliklerde yatay olarak doku 50 mikron üstü (CH) Maksimal projeksiyonlar. Veri Paneller gösterilen aynı görüntü yığından A ve B Dural damarlarının sadece kortikal yüzeyi (C de ok) yukarıda görülebilir.
Kısaltmalar
ACSF = yapay beyin omurilik sıvısı
Ports = cilalı ve güçlendirilmiş inceltilmiş kafatası penceresi
YFP = sarı floresan protein
i açıklanan işlemleri yerel Kurumsal Hayvan Bakımı tarafından onaylanmış olduğundan emin olun ve Komite kullanın.
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
İki foton A bağlantı noktası pencereden görüntüleme lazer ışığı zayıflar ve daha büyük derinliklerde 8 de optik sapmaları ekler inceltilerek kemik ve dura, üzerinden iletim gerektirir. Bununla birlikte, bu mahzur, rağmen, yukarı pial yüzeyinin altında 250 um ile görüntüleme derinlikleri 900 nm uyarma ile elde edilebilir. Büyükşehir görüntüleme derinliklerinde prensipte 13 daha uzun dalga boylarında uyarma ile mümkün olabilir. Bu yöntemin önemli bir avantajı tam k...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Ifşa şey yok.
Teşekkürler
Bu çalışma, Amerikan Kalp Derneği (AYS Post-doktora bursu) ve Ulusal Sağlık Enstitüleri (MH085499, EB003832 ve OD006831 DK) tarafından desteklenmiştir. Bu yazının yorumları için Beth Friedman ve Pablo Blinder teşekkür ederiz.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments | |||
| Ajan | Doğum şekli | Fare için Doz | Süre | Notlar | Kaynak | Ref Ref |
| Pentobarbital (Nembutal) | IP | 90 mg / g | 15-60 dak | Dar güvenlik marjı. Yavaş yavaş anestezi uygun dozu kadar çalışın. Gerektiği gibi indüksiyon dozunun% 10 tamamlayın. | 036.093; Butler Schein | 7 |
| Ketamin (Ketaset) Xylazine (Anased) ile karıştırılır | IP | 60 mg / g (K) 10 mg / g (X) (aynı şırınga içinde mix) | 20-30 dakika | Ksilazin bir kas gevşetici ve ağrı giderici olarak birlikte enjekte edilir. Gerektiği gibi indüksiyon dozunun% 50 sadece Ketamin tamamlayın. | (K) 010.177, (X) 033.198; Butler Schein | 7 |
| Izofluran (Isothesia) | Soluma | % 4 indüksiyon için alveoler konsantrasyon (MAC) anlamına gelir; bakım için% 1-2 MAC | 4-6 saat. | % 70 oksijen ve% 30 nitrik oksit karışımı içinde sağlanan. Uzamış anestezi toparlanma yavaş olur. | 029.403; Butler Schein | 26 |
Tablo 1. Yaşam çalışmaları için anestezik ajanların Önerilen.
| MADDE | ŞİRKET | KATALOG # / MODEL |
| Betadine | Butler Schein | 6906950 |
| Buprenorfin (Buprenex) | Butler Schein | 031919 |
| Floresein izotiosiyanat dekstran, 2 MDa moleküler ağırlığı | Sigma | FD2000S |
| İzopropil alkol | Balıkçı | AC42383-0010 |
| Ringer Çözümü | Butler Schein | 009.846; |
| Lidokain çözeltisi,% 2 (v / v) | Butler Schein | 002468 |
| Tuzlu | Butler Schein | 009861 |
| Cerrahi Süt | Butler Schein | 014.325 |
| Texas Red dekstran, 70 kDa molekül ağırlığı | Invitrogen | D1864 |
| Maxizyme | Butler Schein | 035646 |
| SARF | ||
| Karbür çapak, 1/2 mm uç boyutu | Güzel Bilim Araçları | 19007-05 |
| Cottoned ucu aplikatörler | Fisher Scientific | 23-400-100 |
| Cam, hiçbir örtün. 0 kalınlığı | Thomas Bilimsel | 6661B40 |
| Cyanoacrylate yapıştırıcı | ND Sektörler | 31.428 H04308 |
| Gaz silgi | Newegg | N82E16848043429 |
| Kavrama çimento tozu | Dentsply | 675571 |
| Kavrama çimento çözücü | Dentsply | 675572 |
| Insülin enjektörü, 29.5 iğne ile 0.3 mL hacim | Butler Schein | 018384 |
| Somun ve başını sabitlemek için vida | Digikey | Somun, H723-ND, cıvata, R2-56X1/4-ND |
| Oftalmoloji merhem | Butler Schein | 039886 |
| Bisturi bıçakları | Fisher Scientific | 12-460-448 |
| Vidalar, self-tapping # 000 | JI Morris Şirketi | FF000CE125 |
| Silikon akvaryum mastik | Perfecto İmalat | 31001 |
| Kalay oksit tozu | Mama Mineraller | EQT-TINOX |
| EKİPMAN | ||
| Cam scribe | Fisher Scientific | 08-675 |
| Mikroskop Kesme | Carl Zeiss | OPMI-1. FC |
| Elektrikli matkap | Foredom veya Osada | K.1020 (Foredom) veya EXL-M40 (Osada) |
| Elektrikli tıraş | Wahl | Serisi 8900 |
| Forseps, Dumont yok. 55 | Güzel Bilim Araçları | 11255-20 |
| Görüşleri düzenlenmiş ısı yastığı | FHC | 40-90-8 (rektal Termistör, 40-90-5D-02; h) pad, 40-90-2-07 yemek |
| Izofluran vaporizer | Ohmeda | IsoTec4 |
| Pulse oksimetre | Starr Yaşam Bilimleri | MouseOx |
| Minyatür, Tornavida | Garret Wade | 26B09.01 |
| Stereotaktik çerçeve | Kopf Aletleri | Model 900 (fare anestezi maskesi ve non-rüptürü kulak çubukları ile) |
| Cerrahi makas, kör uç | Güzel Bilim Araçları | 14078-10 |
| Ultrasonik temizleyici | Fisher Scientific | 15-335-30 |
Tablo 2. Özel reaktifler, sarf malzeme ve ekipman listesi.
Referanslar
- Cetin, A. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1, 3166-3173 (2006).
- Kleinfeld, D., Delaney, K. R. Distributed representation of vibrissa movement in the upper layers of somatosensory cortex revealed with voltage sensitive dyes. Journal of Comparative Neurology. 375, 89-108 (1996).
- Driscoll, J. D. Quantitative two-photon imaging of blood flow in cortex. Imaging in Neuroscience and Development. Yuste, R. , Cold Spring Harbor Laboratory Press. New York. 927-937 (2011).
- Drew, P. J., Shih, A. Y., Kleinfeld, D. Fluctuating and sensory-induced vasodynamics in rodent cortex extends arteriole capacity. Proceedings of the National Academy of Sciences U.S.A. 108, 8473-8473 (2011).
- Mostany, R., Portera-Cailliau, C. A Method for 2-Photon Imaging of Blood Flow in the Neocortex through a Cranial Window. J. Vis. Exp. (12), e678-e678 (2008).
- Zhang, S. Rapid reversible changes in dendritic spine structure in vivo gated by the degree of ischemia. Journal of Neuroscience. 25, 5333-5338 (2005).
- Takano, T. Astrocyte-mediated control of cerebral blood flow. Nature Neuroscience. 9, 260-267 (2006).
- Drew, P. J. Chronic optical access through a polished and reinforced thinned skull. Nature Methods. 7, 981-984 (2010).
- Marker, D. F. A thin-skull window technique for chronic two-photon in vivo imaging of murine microglia in models of neuroinflammation. Journal of Visualized Experiments. (43), e2059-e2059 (2010).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28, 41-51 (2000).
- Martin, C. Investigating neural-hemodynamic coupling and the hemodynamic response function in the awake rat. Neuroimage. 32, 33-48 (2006).
- Shih, A. Y. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. Journal of Cerebral Blood Flow and Metabolism. , Forthcoming (2011).
- Kobat, D. Deep tissue multiphoton microscopy using longer wavelength excitation. Optics Express. 17, 13354-13364 (2009).
- Holtmaat, A. high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4, 1128-1144 (2009).
- Xu, H. T. Choice of cranial window type for in vivo imaging affects dendritic spine turnover in the cortex. Nature Neuroscience. 10, 549-551 (2007).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308, 1314-1318 (2005).
- Davalos, D. ATP mediates rapid microglial response to local brain injury in vivo. Nature Neuroscience. 8, 752-758 (2005).
- Ascenzi, A., Fabry, C. Technique for dissection and measurement of refractive index of osteons. The Journal of Biophysical and Biochemical Cytology. 6, 139-142 (1959).
- Stosiek, C. In vivo two-photon calcium imaging of neuronal networks. Proceedings of the National Academy of Sciences U.S.A. 100, 7319-7324 (2003).
- Grinvald, A. Functional architecture of cortex revealed by optical imaging of intrinsic signals. Nature. 324, 361-364 (1986).
- Dunn, A. K. Dynamic imaging of cerebral blood flow using laser speckle. Journal of Cerebral Blood Flow & Metabolism. 21, 195-201 (2001).
- Villringer, A. Capillary perfusion of the rat brain cortex: An in vivo confocal microscopy study. Circulation Research. 75, 55-62 (1994).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73-76 (1990).
- Srinivasan, V. J. Optical coherence tomography for the quantitative study of cerebrovascular physiology. Journal of Cerebral Blood Flow & Metabolism. 31, 1339-1345 (2011).
- Hu, S., Wang, L. V. Photoacoustic imaging and characterization of the microvasculature. Journal of Biomedical Optics. 15, 011101-011101 (2010).
- Flecknell, P. A. Laboratory animal anesthesia. , Academic Press. San Diego. (1987).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır