Method Article
הדמיה של HIV-1 מעטפה הנגרמת סינפסה Virological והאיתות על bilayers שומנים סינתטי
* These authors contributed equally
In This Article
Summary
מאמר זה מתאר שיטה לחזות היווצרות הסינפסה virological HIV-1 המעטפה הנגרמת על bilayers זכוכית הנתמכים מישוריים על ידי מיקרוסקופ פלואורסצנטי סך פנימית (TIRF) השתקפות. השיטה ניתן גם לשלב עם כתמים immunofluorescence לזהות הפעלה חלוקה מחדש של מולקולות איתות המתרחשים במהלך היווצרות ה-HIV-1 המעטפה הנגרמת סינפסה virological.
Abstract
וירוס הכשל החיסוני האנושי סוג 1 (HIV-1) ההדבקה מתרחשת בצורה היעילה ביותר דרך תא שידור סלולרי 2,10,11. זה התא העברת התא בין CD4 + T תאים כרוך היווצרות הסינפסה virological (VS), שהוא ה-F-אקטין תלויה תאים תאים צומת הוקמה על האירוסין של מעטפת ה-HIV 1-gp120 על התא הנגוע עם CD4 ו הקולטן chemokine (CKR) CCR5 או CXCR4 על תא המטרה 8. בנוסף gp120 ואת הקולטנים שלו, חלבוני קרום אחרים, בעיקר מולקולות הדבקה LFA-1 ו ligands שלה, משפחת ICAM, לשחק תפקיד מרכזי ביצירת VS והעברת נגיף כפי שהם נמצאים על פני השטח של התאים הנגועים בנגיף התורמות ואת היעד תאים, כמו גם על המעטפה של HIV-1 virions 1,4,5,6,7,13. היווצרות VS מלווה גם אירועים איתות תאיים, כי הם transduced כתוצאה מעורבות-gp120 של הקולטנים שלו. אכן, יש לנו לאחרונה הראה כי CD4 <sup> + אינטראקציה עם תא T gp120 גורם גיוס זרחון של מולקולות איתות הקשורים signalosome TCR כולל Lck, CD3ζ, ZAP70, LAT, SLP-76, Itk, ו PLCγ 15.
במאמר זה, אנו מציגים שיטה לחזות הסדר סופראמולקולרית ו קרום הפרוקסימלי איתות אירועים המתרחשים במהלך היווצרות VS. אנו מנצלים את מערכת הזכוכית נתמך שכבה דו מישורי כמודל הרדוקציוניסטית לייצג את פני השטח של תאים נגועים ב-HIV הנושאים את מעטפת הנגיף gp120 ו מולקולה הידבקות הסלולר ICAM-1. הפרוטוקול מתאר צעדים כלליים ניטור HIV-1 gp120-Induced VS הרכבה והפעלה האות אירועים הכוללים i) שכבת דו הכנה והרכבה בתא זרימה, II) הזרקה של תאים צביעה immunofluorescence לזהות מולקולות איתות תאיים על תאים אינטראקציה עם רכישת ה-HIV-1 תמונה gp120 ו ICAM-1 על דו שכבות, III) על ידי מיקרוסקופ TIRF,ND ד) ניתוח הנתונים. מערכת זו מפיקה תמונות ברזולוציה גבוהה של ממשק VS מעבר לזה שהושג עם מערכת תאים תאים קונבנציונלי שכן היא מאפשרת זיהוי של קבוצות שונות של רכיבים מולקולריים בודדים של VS יחד עם מולקולות איתות מסוימות שגויסו אלה תת תחומים.
Protocol
1. תיוג gp120
צבעי ניאון בשימוש בפרוטוקול זה הם יעיל מחייב חלבונים, הם מספיק צילום stabile הדמיה מיקרוסקופית, ולהתאים את אורכי גל עירור של לייזרים זמינים במיקרוסקופ שלנו. אלו שלושה קריטריונים צריכים להתקיים בעת בחירת מולקולות ניאון עבור חלבונים תיוג.
- Exchange שלו 6-מתויג gp120 DH12 (מתנת ד"ר מייקל צ'ו, איווה סטייט) מאגר חלבון PBS סטרילי באמצעות יחידת מסנן צנטריפוגלי (30 kDa MWCO). ודא gp120 ריכוז לא יותר מ 1 מ"ג / מ"ל. הערה: 6-מתויג שלו gp120 חלבונים מ X4 זה או R5 זנים הטרופיים גם נבדק זמינים כעת מסחרית מ טכנולוגיות החיסון.
- הוספת סודה לשתייה pH 9.0 לפתרון חלבון כדי לקבל ריכוז סופי 50mm של סודה לשתייה עם pH ~ 8.5.
- הוסף תגובה Alexa אמין פלואוריד 488 (AF488) צבע פלואורסצנטי, שהוא דיssolved במים על עודף של פי 10 טוחנת. דגירה את התערובת במשך 1-2 שעות בטמפרטורת החדר בחושך.
- כדי להסיר את עודפי צבע, השתמש יחידת מסנן צנטריפוגלי כמו קודם ולהוסיף טרי סטרילית PBS לעמודה. חזור על פעולה זו עד שכל צבע ללא מוסר (שוטף 3-4 עם 4 מ"ל PBS). ספין למטה עד gp120 מרוכזת של כ 1 מ"ג / מ"ל. הערה: הסרת צבע בחינם על ידי דיאליזה או יחידת מסנן צנטריפוגלי עובד רק אם הצבע הוא מסיס במים, או סינון ג'ל ניתן להשתמש.
- כדי למדוד את עוצמת הקרינה לכל מולקולה של חלבון (F / P) של חלבון הנקרא, לקבוע את ריכוזי (ב מיקרומטר) של צבע פלואורסצנטי באורך גל מתאים (למשל, על 488 ננומטר עבור AlexaFluor 488) וחלבון (אנו משתמשים ספקטרופוטומטר NanoDrop השימוש של חלבונים תוויות על 'הגדרות) ולאחר מכן לחלק את שני המספרים נותן לך את היחס F / P. הליך דומה משמש חלבונים צבעים אחרים כגון ICAM-1 ו Cy5. הערה: סוגים אחרים של spectrophotometers ניתן להשתמש כדי להשיג את ריכוז החלבון וריכוז צבע פלואורסצנטי לקבל יחס F / P אם NanoDrop אינו זמין.
2. תא זרימה התכנסות ההכנה bilayer
נוהל כללי של התא זרימה והכנת bilayer תוארה בפירוט 14 קודם לכן. כאן מתאר במפורש בפרוטוקול להכין bilayers המכילים 6-מתויג שלו gp120 DH12 על התא זרימה Bioptech. עבור מחקרים שכללו וירוסים זיהומיות או תאים נגועים וכאשר בנפחים קטנים נחוצים בשל חומרים כימיים בע"מ, קאמריים זרימת הפנויה Ibidi (Slide דביק אני Luer 0.2) ניתן להשתמש והלך עם הליך שכבה דו אותה הכנה צעדים 2.4-2.9. מידע על חדרי Ibidi זרימה ניתן לקבל באתר האינטרנט של החברה, http://www.ibidi.com/service/display_material/CA_8p_EN_150dpi.pdf .
- הכן פתרון Pirhana (45 מ"ל חומצה גופרתית (כיתה Trace מתכת 98%) ו - 15 30% מ"ל מי חמצן) 14. עם מהדק פלסטיק, מכסה מחליק לטבול בתמיסה Pirhana במשך 15 דקות.
- העברת פתקים כדי לכסות את הכוס מלאה במים מטוהרים פיקה, ולשטוף כל אחד תחת זרם מים דק '2 (1 דקות מכל צד). מקום על מדף לייבוש.
- להרכיב Bioptechs FCSII חדרי כפי שתואר קודם לכן 14.
- תערובת liposome המכיל 12.5% Ni 2 + שומנים chelating משמש ללכידת והצגת שלו 6-gp120 על פני השטח bilayer 16. הוסף 1 טיפות של תערובת μl liposome לשקופית microaqueduct בלי לגעת עצה כדי זכוכית. להכין לכל היותר 5 bilayers לכל תא הזרימה, חזור עד 4 פעמים יותר, כך יש חמש נקודות 1μl כמוצג בעבר 14.
- מניחים פיסת כיסוי על גבי שומנים. מכסים את הטבעת שמירה לבן עם CL נירוסטהיחידת המגבר הבסיס, להעיף את כל המנגנון שוב לאטום. סמן המיקום של bilayers עם הסמן. דגירה במשך 10 דקות בטמפרטורת החדר.
- צרף צינורות עם שסתום דו כיווני אל צינור טפטוף שמאל, כפי שניתן לראות בסרטון. צור המניסקוס חיובית בסוף צינורות עם שסתום 3 כיווני עליו (צינורות כבר מילא בעבר עם HEPES שנאגרו מלוחים (בהרוורד) המכיל האדם סרום אלבומין (HSA) (בהרוורד / HSA: 50 מ"ל בהרוורד 10x [10x HEPES שנאגרו מלוחים: 200 מ"מ HEPES, pH 7.2, 1.37 מ 'NaCl, KCl 50 מ"מ, 7 מ"מ Na 2 HPO 4, 60 מ"מ D-גלוקוז] 20 מ"ל HSA 25x, 500 CaCl 1M μl 2, 1 מ"ל 1 M MgCl 2 ו DH 2 0 להביא הנפח הכולל ל) 500 מ"ל ו - מסנן עם מסנן 0.22μm והוא ללא בועות. חיבור צינור לצינור טפטוף ימין בעדינות חיץ בין התא זרימה.
- חסום bilayer עם μl 300 ~ של קזאין המכיל 100 מיקרומטר NiCl 2 על ידי מילוי במזרק 1 מ"ל ו מצרף לחלק הפתוח של שסתום 3 כיווני. Gently לדחוף דרך חיץ ולסגור שני והברזים למיניהם לפני התנתקות את המזרק. דגירה למשך 30 דקות בטמפרטורת החדר.
- הוסף gp120 6-AF488, מתויג בתווית שלו (ריכוז נקבעת כפי שתואר קודם לכן 16). אנו משתמשים ~~~HEAD=NNS 250 מולקולות של gp120/μm 2 לחקות את צפיפות מקומית של אשכולות Env נמצא על פני השטח-1-HIV virion 17. כמו כן, אנו משתמשים ~~~HEAD=NNS 250 מולקולות / 2 מיקרומטר של ICAM-1 על bilayer כפי שדווח קודם לכן 14. טען לתא זרימת כמו לעשות עם קזאין. דגירה למשך 30 דקות בחושך (מכסים בנייר כסף) בטמפרטורת החדר. הליך דומה משמש לשלב חלבונים אחרים כגון 12-מתויג שלו Cy5 שכותרתו ICAM-1 על bilayer.
- לשטוף bilayers עם 5 מ"ל של המאגר.
3. בקרת איכות של bilayers באמצעות FRAP
חלבונים bilayers חייב להיות diffusible רוחבית. לפני הוספת תאים על bilayers, חשוב להבטיח אתניידות של חלבונים bilayer מוכן. כאן אנו מתארים שחזור פלורסנט לאחר Photobleaching (FRAP) שיטה 3 כי ניתן לבצע באופן ידני על המטרה הכי מואר TIRF, epifluorescence שדה רחב, או סריקת לייזר מיקרוסקופים confocal. המטרה היא שדות דמות אחידה מלאה של הקרינה ב bilayer שומנים, אקונומיקה במקום, כדי לפקח על החזרת מולקולות unquenched לאזור מולבן. התאוששות של 50% ב 2 דקות עשוי להיות מקובל. כל היצרנים הגדולים מיקרוסקופ (לייקה, ניקון, אולימפוס, Zeiss) למכור אובייקטיביים מערכות TIRF מוארים שפועלים היטב עבור יישום זה. בעוד כל חברה מספקת וריאציות של תאורה TIRF ותכונות מבצעיות אחרות, איכות התמונה היא בעצם אותו דבר.
- השתמש בעוצמה נמוכה כדי לצמצם עירור הלבנה. השתמש מטרה גבוהה צמצם המספרי כגון 1.3-1.45 NA 40X, 60x או 100x. כאשר באמצעות מיקרוסקופ פלואורסצנטי או TIRF רגיל, כדי להפחית את intens אורity, מסננים את צפיפות ניטרלי נתיב אור עירור. מערכות לייזר רוב ניתן להגדיר לתאורה נמוכה על ידי הגדרת אופטי acusto מתכונן מסנן (AOTF) או acusto אופטי הקורה ספליטר (AOBS) עם מתח נמוך.
- הקלטת "מראש אקונומיקה" התמונה. אם באמצעות מצלמה מקורר CCD, כדי לפצות על binning לתנאי תאורה נמוכה עשוי להיות מוגדר 2x2 או 4x4, עליה ניתן להגדיר חשיפות גבוהות, או ארוך (למשל, בסדר גודל של שניות) ניתן להשתמש. אם אתה משתמש confocal, צמצם חריר ניתן לפתוח, רווח שנקבע גבוה, סריקה איטי או ממוצע של משתמשים.
- אקונומיקה במקום. אם באמצעות מיקרוסקופ פלואורסצנטי רגילה או TIRF, להסיר את כל המסננים ND, כדי לאפשר תאורה בעוצמה מקסימלית, לסגור את הסרעפת שדה, ולחשוף את המדגם במשך כמה שניות. אם באמצעות סריקת לייזר confocal, להגדיר את כוח לייזר מקסימלית זום 4x כ ל 8x כדי להלבין במקום. אזהרה לשימוש confocal: לא להתקרב גבוה מדי, כי bilayer עלולים להינזק על ידי excesמרוכזים שהבהבה פוטונים.
- בשעה עשר עד 15 שניות במרווחים, תמונות תקליטים באמצעות תאורה זהה הגדרות הקלטה כמו 3.1 ו 3.2. בתוך שנתיים עד שלוש דקות במקום צריך לשחזר את עוצמת מתקרב לזה של תמונת "לפני אקונומיקה". החלמה מהירה הוא סימן bilayer סלולרי מוצלח. אם המקום נשאר שחור, ובמיוחד אם בשולי שומרת ניגודיות גבוהה, החלבונים ניאון הם נייח ב bilayer ולא צריך לשמש עבור הניסוי.
הערה: מיקרוסקופ הנוכחי שלנו, אנחנו יכולים לספק 0.9 מגה וואט של אור 641 ננומטר למקום עגול עם שטח של 240 מיקרומטר 2 אשר עלול להלבין ICAM ניאון בריכוזים האופייניים בפחות מ 4 שניות. הקורא צריך לגלות יישור קריטית של כספית או Xe מנורה עם הלבנת פעמים פחות מ -30 שניות הוא יותר מאשר מספיק כדי לבצע את assay באופן חזרתי. היינו גם להפנות אותך להפנות 3 עבור Det נוסףמציק.
4. הזרקה של תאים צביעה immunofluorescence
- לחמם את התא זרימה 37 ° C (ניתן לעשות זאת ב 37 ° C חממה ללא CO 2 דקות על 30).
- הוסף CD4 אנוש מופעלים + ותאי T (2-5x10 6 / זרימת התא) ב בהרוורד / HSA ~ 400 μl ידי מזרק 1 מ"ל. בואו תאים לצרף bilayer דקות ~ 45 ב 37 ° C חממה. אם לתאי Ibidi משמשים, לספק חיץ נוסף בכל 15-20 דקות.
- לתקן את התאים על ידי הזרקת paraformaldehyde 2% ו דגירה של 10 דקות בשעה 37 ° C.
- לשטוף 3x עם טמפרטורת החדר 1ml חיץ PBS. Permeabilize על ידי הזרקת תאים 0.1% טריטון X-100 במשך 5 דקות בטמפרטורת החדר.
- לשטוף 3x עם 1ml של בטמפרטורת החדר PBS חיץ (לאחר חיטוט עבור חלבונים פוספורילציה, ניתן להוסיף vanadate נתרן בריכוז 1 מ"מ הסופי או אחרת phosphatase מעכב ב PBS כדי למנוע הסרת הפוספט במהלך עיבוד). חסום באמצעות קזאין עם סרום עיזים 5%25 דקות בטמפרטורת החדר. סוג של בעל חיים בסרום תלוי נוגדנים משני.
- לשטוף 3x עם 1 מ"ל של חיץ בטמפרטורת החדר PBS. הוסף הנוגדן העיקרי ~ תא 300 חיץ / זרימת μl דקות 30-1 שעה בטמפרטורת החדר. כדי לזהות את האות הראשונה קרום הפרוקסימלי ההפעלה, אנו משתמשים נוגדנים ספציפיים עבור phosphorylated Lck (pLck), הכולל Lck או פין.
- לשטוף 3x עם 1 מ"ל של חיץ בטמפרטורת החדר PBS. הוסף המתאים נוגדנים משני שכותרתו fluorescently במאגר כפי שנעשה עם נוגדן ראשוני. על הניסויים שלנו, אנו משתמשים Alexa פלואוריד 568 שכותרתו עז נגד ארנב משני. דגירה של 20 דקות בטמפרטורת החדר. לשטוף 3x עם 1 מ"ל של חיץ PBS.
- הערה: חשוב להיות bilayer פקד מטופל עם נוגדנים רק משני (ללא הנוגדן הראשוני). בצע את הפעולות 4.1-4.5 ודלג 4.6, ולאחר מכן להמשיך עם צעד 4.7. זה יקבע את רמת מחייב הלא ספציפית של נוגדנים המשני שלך. לחלופין, ניתן להשתמש ישירות תוויתאד נוגדנים ראשוניים.
5. תמונה הרכישה על ידי מיקרוסקופ TIRF
מיקרוסקופיה TIRF מאפשר עירור של אותות ניאון מוגבל של 250 ננומטר או מטוס רזה על מצע זכוכית ממשק התא. זה מבטיח רכישת התמונה של אותות רק מ bilayer שומנים בדם, ומבין קרום התא apposed מיד. לכן, רק מולקולות בסינפסה הם צילמו. בגלל התמונות TIRF רק באזור קרום הפרוקסימלי בתחתית התא, חלבונים, כי הם הפנימו או כתוב מחדש את קרום הגב לא יזוהו. זה אולי אז יהיה חשוב בנוסף לרכוש תמונות קנה מידה widefield או במיקרוסקופ confocal לקבוע הצטברות או הפצה של חלבונים באזור הסינפטי לעומת כרכים אחרים של התא.
כל היצרנים הגדולים מיקרוסקופ (לייקה, ניקון, אולימפוס, Zeiss) למכור אובייקטיביים מערכות TIRF מוארים שמתאימות לכך APקפול. בעוד כל חברה מספקת וריאציות של תאורה TIRF ותכונות מבצעיות אחרות, איכות התמונה היא בעצם אותו דבר. כל מיקרוסקופ TIRF יש פרטים שלה לפעולה, אבל הכללים הבאים חלים להשיג ברזולוציה גבוהה הדמיה.
- תאורה צריכה להיות נמוכה, כדי למנוע הלבנת.
- המצלמה צריכה להיות תגובה ליניארית.
- המצלמה צריכה להיות מסוגלת הדמיה טווח דינמי רחב עם הרוויה לא.
- כל ההגדרות יש להגדיר קבוע ניתוחים כמותיים.
6. ניתוח נתונים
ללמוד את אותות תאיים מופעלים כתוצאה CD4 + T אינטראקציה עם תא gp120 ב VS, ניתוחים כמותיים של תמונות TIRF נעשות כדי לקבוע אם מולקולות איתות תאיים כגון Lck ו Fyn מופעלים וגייס את הסינפסה 15. כאן אנו מתארים שיטה פשוטה ישימה לניתוח התמונה ביותריישום חבילות כגון ImageJ ו Metamorph. השתמשנו ImageJ, שרץ על חלונות, מקינטוש, ולינוקס, על השיטה שלנו כאן 12.
בכרטיסייה ניתוח> סט מדידות, סמן את התיבות עבור שטח ולהתכוון ערך אפור. כאשר אתה מבצע באזור הריבית על התמונה כי היא מצולע או ביד חופשית צורה סגורה לעקוב ולעשות ניתוח מדד>, התוכנה יהיה לשים את הנתונים מן המדידה הזו בטבלת התוצאות. שטח יהיה מספר הפיקסלים או 2 מיקרומטר. Mean הוא הממוצע עוצמת ביחידות שרירותיות. זה חייב להיות בעוצמה רקע מפחיתים את זה. הכפלת רקע מינוס מתכוון באזור מחזירה את העוצמה המשולבת של חלבון ביחידות שרירותיות.
- קבע את המידות להביע וחבל.
- פתיחת תמונות למצב 1 ניסיוני.
- עבור כל תא, לאתר ולמדוד את האזור של עניין (כלומר) ו לעקוב ולמדוד לאזור מחוץ לאזור של עניין (ברקע).
- בסיום עם בתנאי אחד ניסיוני, בין אם מדידות להעתיק ולהדביק לתוך Excel או לתוכנית גיליון אלקטרוני אחרת או לשמור את המידות.
- חזור לשלב 6.2 עבור כל תנאי הניסוי.
- כאשר המדידות הושלמו, לחשב את התוצאות. הנוסחאות הם:
ממוצע עוצמת = כלומר - רקע
עוצמת משולב = שטח ממוצע * עוצמת
7. נציג תוצאות
כדי למדוד הפעלה וגיוס את קרום הפרוקסימלי מולקולות איתות ראשוני Lck ו Fyn כתוצאה של אינטראקציה עם gp120 ב VS, CD4 + אדם מן המעלה הראשונה ותאי T הוכנסו אל bilayers הנושאים gp120 ו ICAM-1 15. תאים הציג bilayers עם רק ICAM-1 שימש פקד כדי להגדיר את רמות הבסיס של איתות. SPEעוצמת הקרינה cific נמדדה באזור gp120 הקשר של תאים על gp120 ו ICAM-1 bilayers המכילים ונמצא באזור כל קשר עבור תאים אינטראקציה עם bilayer ICAM-1. גידול של עוצמת הקרינה הממוצעת היא סימן מוגבר גיוס והפעלה של מולקולת איתות VS. זה יהיה הפגינו יותר על ידי גידול דומה בעוצמת הקרינה משולב. אם זאת, אין שינוי בעוצמת הקרינה משולב, זה מצביע על חלוקה מחדש של מולקולת איתות.
אחרי התאים תיקשר עם bilayers המכילים gp120 ו ICAM-1, הכולל Lck ו pLck (Y394) גויסו ממשק VS ו colocalized עם gp120 (איורים 1 & 2). העוצמה הממוצעת של סך Lck (איור 1) היה גבוה ב bilayer המכיל גם gp120 ו ICAM-1 מאשר עם ICAM-1 בלבד, אבל ברמות עצימות משולבים (איור 1) היו דומים, טוען כי הוא מחדש את Lckאשכול מרכזי על CD4 + T סלולריים מחייב gp120. עם זאת, כימות pLck (Y394) (איור 2) הראו כי עוצמת הממוצע על gp120 ו ICAM-1 bilayers המכילים גבוה מזה על ICAM-1 bilayers לבד, את העוצמה המשולבת היה גבוה יותר ב bilayers עם שניהם gp120 ו ICAM מ -1 על ICAM-1 bilayers בלבד. זה מצביע על כך בעוד רמות סך Lck על ממשק דומה בתאי שמירה על gp120 ו ICAM-1 ו-ICAM-1 bilayers בלבד, gp120 זרחון מוגבר מחייב של שאריות Y394 ב Lck לולאה ההפעלה. לעומת זאת, Fyn לא גויס VS (איור 3), כפי Fyn יותר היה נוכח באזור איש הקשר של תאים על ICAM-1 bilayers לבד מאשר על bilayers המכילים הן gp120 ו ICAM-1. כתוצאה מכך, אנו מסיקים כי Lck, לא פין, הוא קינאז פעיל VS-1-HIV gp120-Induced.
דמויות: קרום הפרוקסימלי איתות ב-HIV-1 gp120-Induced VS. תמונות של תאים מייצגים עלgp120 + ICAM-1 bilayer (לוחות למעלה) ו bilayer-1 ICAM (לוחות למטה) מוצגים. עוצמות הקרינה של תאים בודדים היו לכמת אזורים לייחס באופן ידני של עקבות סלולריים כפי מאויר על ידי האזור המסומן עם קו צהוב באיור 1. כימות של עוצמות הממוצע ומשולבת שזוהו על ידי מיקרוסקופ TIRF מוצגים הגרפים על ימין ועל שמאל, בהתאמה. סך של 30 עד 350 תאים היו לכמת עבור כל תנאי. ברים = 5 מיקרומטר. נתונים אחד משלושה ניסויים חוזרים מוצגים.
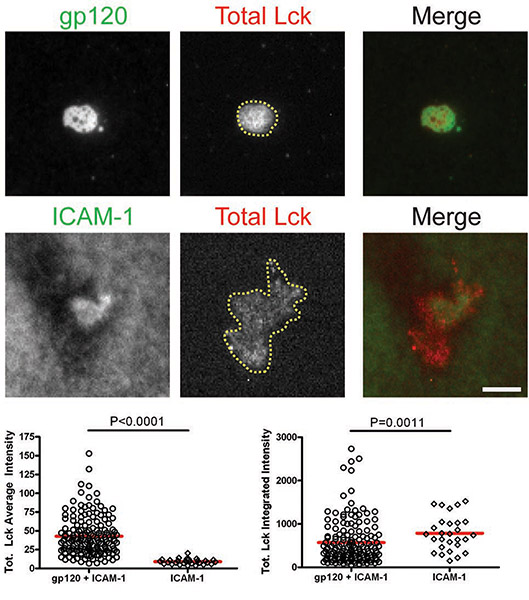
באיור 1. CD4 + ותאי T הוכנסו אל bilayers המכילים gp120 ו ICAM-1 או ICAM-1 לבד 45 דק 'ולאחר מכן קבוע מוכתם עבור סכום כולל Lck.

באיור 2. CD4 + ותאי T הוכנסו אל bilayerזה המכיל gp120 ו ICAM-1 או ICAM-1 לבד 45 דק 'ואז נעץ ומוכתם על pLck (Y394).
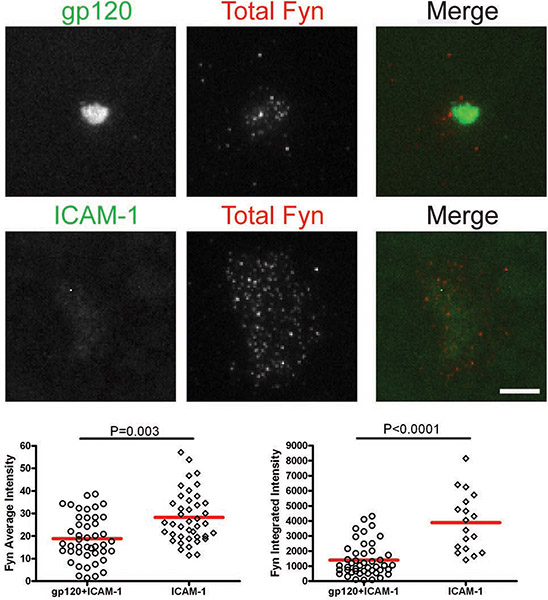
באיור 3. CD4 + ותאי T הוכנסו אל bilayers המכילים gp120 ו ICAM-1 או ICAM-1 לבד 45 דק 'ולאחר מכן קבוע מוכתם עבור Fyn מוחלט.
Discussion
מחקרים קודמים VS דמיינו במערכת תאים תאים הצמוד, אולם מחקרים אלה לא סיפקו תמונות ברזולוציה גבוהה מספיק כדי להמחיש את מבנים מולקולריים בסינפסה. במעבדה שלנו, השתמשנו זכוכית נתמך במערכת bilayer מישוריים לייצג את פני השטח של תאים נגועים המבטאים את המעטפה הנגיף gp120 ו מולקולה הידבקות הסלולר ICAM-1. יחד עם מיקרוסקופיה TIRF, אשר מזהה אותות הקרינה בתוך 100-200 ננומטר מפני השטח bilayer עם יחס אות לרעש גבוה, הצלחנו לזהות הפרדה מולקולריים של gp120 מ ICAM-1 ב VS. יתר על כן, שיטת immunostaining רגיל יכול להיות מיושם על מערכת bilayer ושימש כאן כדי לזהות ולכמת את הגיוס הספציפי של פעיל Lck, אבל לא פין, לאזור gp120 מגע ב VS 15. לפיכך, bilayer מישוריים מציעה מערכת ניסיונית עבור הדמיה ברזולוציה גבוהה של ממשק סינפסה במטוס 2D ידי TIRF מיקרוscopy, כמו גם שיטות תאורה שדה רחב או confocal. עם זאת, המערכת כוללת גם מגבלות כמו התאמת ניידות ליגנד, מחוץ למטוס כיפוף, וכן תנודות של ממברנות ביולוגיות לא לשכפל ידי bilayers מישוריים. יתר על כן, זו מערכת in-vitro, ולכן יש מגבלות אחרות, כמו חוסר מולקולות בממברנה אחרים שיהיו נוכחים על תא נגוע מכונות cytoskeleton המווסת את הניידות מולקולרית תנועתיות הסלולר. כמו כן, הדינמיקה והפצה של מולקולות, כמו trimers לעומת מונומרים של gp120, לא יכול להיות מיוצג על bilayer פיזיולוגית. עם זאת, גם במגבלות אלה, המערכת הזאת עדיין בעל ערך רב לחקר וירוסים תא או תאים תאים אינטראקציות, ושיטות אלה יכולים לשמש כמדריך שימושי חוקרים שמחפשים תמונות ברזולוציה גבוהה לאתר הארגון סופראמולקולרית שאינו ניכר במערכת תאים תאים הקונבנציונלית המצומד.
Disclosures
החוקרים מצהירים שום ניגוד עניינים.
Acknowledgements
עבודה זו נתמכה על ידי NIH מענקים AI071815 (CEH) ו Nanomedicine מפת הדרכים לפיתוח מרכז פרס PN2EY016586 (MLD).
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| HIV מתויג שלו gp120 | מתנת ד"ר צ | DH12 | |
| HIV מתויג שלו gp120 | החיסון טכנולוגיה | X4 שונים או R5 חוג | |
| HSA | וויליאמס חברת מדיקל | 521302 | האדם סרום אלבומין 25% |
| Amicon מסננים צנטריפוגליות אולטרה | Millipore | UFC803024 | Ultracel-30K |
| Lck הארנב MAB | התא איתות | 2787 | |
| P-Lck הארנב PAB | סנטה קרוז ביוטכנולוגיה בע"מ | SC-101728 | Tyr 394 |
| Fyn הארנב MAB | Millipore | 04-353 | |
| Alexa פלואוריד 568 ° 2; Ab | בדיקות מולקולריות | A11034 | נגד ארנב עיזים IgG (H + L) |
| Alexa פלואוריד 488 | בדיקות מולקולריות | A-20000 | carboxylic חומצה succinimidyl אסתר |
| FCS2 הקאמרית | Bioptechs | 060319-2-03 | |
| Microaqueduct Slide | Bioptechs | 130119-5 | |
| 30 מ"מ עגול w / חורים | Bioptechs | 1907-08-750 | 0.75mm עבה |
| מלבן אטם | Bioptechs | 1907-1422-250 | 14x24 0.25mm עבה |
| Tygon Tubing | Bioptechs | 20202275 | 1/16 "(25ft) |
| שלוש דרך שסתום | BioRad | 7328103 | |
| דו דרך שסתום | BioRad | 7328102 | |
| Slide דביק אני 0.2 Luer | Ibidi | 80168 | |
| כיסוי משקפיים | Ibidi | 10812 | |
| 1ml המזרק | BD | 309659 | |
| כלבים, נ.ת. ע | AVANTI ליפידים פולאר | 790404C | |
| DOPC | AVANTI ליפידים פולאר | 850375C | |
| זכוכית coverslip | Bioptechs | 40-1313-0319 | 40mm |
| TIRF מיקרוסקופ | ניקון | ||
| ImageJ | המכונים הלאומיים לבריאות | http://rsbweb.nih.gov/ij/~~V |
References
- Bastiani, L., Laal, S., Kim, M., Zolla-Pazner, S. Host cell-dependent alterations in envelope components of human immunodeficiency virus type 1 virions. J. Virol. 71, 3444-3450 (1997).
- Dimitrov, D. S., Willey, R. L., Sato, H., Chang, L. J., Blumenthal, R., Martin, M. A. Quantitation of human immunodeficiency virus type 1 infection kinetics. J. Virol. 67, 2182-2190 (1993).
- Dustin, M. L. Adhesive Bond Dynamics in Contacts between T Lymphocytes and Glass-supported Planar Bilayers Reconstituted with the Immunoglobulin-related Adhesion Molecule CD58. J. Biol. Chem. 272, 15782-15788 (1997).
- Fortin, J. F., Cantin, R., Lamontagne, G., Tremblay, M. Host-derived ICAM-1 glycoproteins incorporated on human immunodeficiency virus type 1 are biologically active and enhance viral infectivity. J. Virol. 71, 3588-3596 (1997).
- Frank, I., Stoiber, H., Godar, S., Stockinger, H., Steindl, F., Katinger, H. W., Dierich, M. P. Acquisition of host cell-surface-derived molecules by HIV-1. Aids. 10, 1611-1620 (1996).
- Hioe, C. E., Bastiani, L., Hildreth, J. E., Zolla-Pazner, S. Role of cellular adhesion molecules in HIV type 1 infection and their impact on virus neutralization. AIDS Res. Hum. Retroviruses. 14, Suppl 3. S247-S254 (1998).
- Hioe, C. E., Chien, P. C., Lu, C., Springer, T. A., Wang, X. H., Bandres, J., Tuen, M. LFA-1 expression on target cells promotes human immunodeficiency virus type 1 infection and transmission. J. Virol. 75, 1077-1082 (2001).
- Jolly, C., Kashefi, K., Hollinshead, M., Sattentau, Q. J. HIV-1 cell to cell transfer across an Env-induced, actin-dependent synapse. J. Exp. Med. 199, 283-293 (2004).
- Jolly, C., Mitar, I., Sattentau, Q. J. Requirement for an intact T-cell actin and tubulin cytoskeleton for efficient assembly and spread of human immunodeficiency virus type 1. J. Virol. 81, 5547-5560 (2007).
- McDonald, D., Wu, L., Bohks, S. M., KewalRamani, V. N., Unutmaz, D., Hope, T. J. Recruitment of HIV and its receptors to dendritic cell-T cell junctions. Science. 300, 1295-1297 (2003).
- Pearce-Pratt, R., Malamud, D., Phillips, D. M. Role of the cytoskeleton in cell-to-cell transmission of human immunodeficiency virus. J. Virol. , 682898-682905 (1994).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. (1997).
- Rizzuto, C. D., Sodroski, J. G. Contribution of virion ICAM-1 to human immunodeficiency virus infectivity and sensitivity to neutralization. J. Virol. 71, 4847-4851 (1997).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Vasiliver-Shamis, G., Cho, M. W., Hioe, C. E., Dustin, M. L. Human immunodeficiency virus type 1 envelope gp120-induced partial T-cell receptor signaling creates an F-actin-depleted zone in the virological synapse. J. Virol. 83, 11341-11355 (2009).
- Vasiliver-Shamis, G., Tuen, M., Wu, T., Starr, T., Cameron, T., Thomson, R., Kaur, G., Liu, J., Visciano, M., Li, H., Kumar, R., Ansari, R., Han, D., Cho, M., Dustin, M. L., Hioe, C. E. Human immunodeficiency virus type 1 envelope gp120 induces a stop signal and virological synapse formation in noninfected CD4+ T cells. J. Virol. 82, 9445-9457 (2008).
- Zhu, P., Liu, J., Bess, J., Chertova, E., Lifson, J., Grise, H., Ofek, G., Taylor, K., Roux, K. Distribution and three-dimensional structure of AIDS virus envelope spikes. Nature. 441, 847-852 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved