Method Article
Imagem do HIV-1 Synapse Envelope induzida virológica e Sinalização em bicamadas lipídicas sintéticas
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este artigo descreve um método para visualizar a formação de uma sinapse envelope de HIV-1 induzida por virológica em vidro suportados bicamadas planares por reflexão total interna de fluorescência microscopia (TIRF). O método pode também ser combinado com coloração de imunofluorescência para detectar a activação e redistribuição de moléculas de sinalização que ocorrem durante o HIV-1 a formação de sinapses envelope induzida virológica.
Resumo
Vírus da imunodeficiência humana tipo 1 (HIV-1) a infecção ocorre de forma mais eficiente através de célula para célula de transmissão 2,10,11. Esta célula para a transferência de células entre células T CD4 + envolve a formação de uma sinapse virológica (VS), que é uma F-actina-dependente junção célula-célula formada a partir do envolvimento do HIV-1 envelope gp120 na célula infectada com CD4 e o receptor de quimiocina (CKR) CCR5 ou CXCR4 na célula alvo 8. Além disso a gp120 e seus receptores, outras proteínas da membrana, em particular a molécula de adesão LFA-1 e os seus ligandos, a família ICAM, desempenham um papel importante na formação VS e transmissão de vírus em que estejam presentes na superfície das células infectadas pelo vírus de doadores e células alvo, bem como no envelope de HIV-1 viriões 1,4,5,6,7,13. Formação VS é também acompanhada por eventos de sinalização intracelulares que são transduzidas como um resultado da gp120-engajamento dos seus receptores. Na verdade, temos recentemente mostrou que os CD4 <sup> + interacção das células T com gp120 induz o recrutamento e fosforilação de moléculas de sinalização associados com o signalosome TCR incluindo Lck, CD3ζ, ZAP70, LAT, SLP-76, ITK, e PLCγ 15.
Neste artigo, apresentamos um método para visualizar arranjo supramolecular e eventos membrana proximais de sinalização que ocorrem durante a formação do VS. Nós tirar vantagem do vidro suportada sistema bi-camada plana como um modelo reducionista para representar a superfície de células infectadas pelo HIV munidos do envelope viral gp120 e da molécula de adesão celular ICAM-1. O protocolo descreve procedimentos gerais para a monitorização do HIV-1 gp120 induzida por VS montagem e os eventos de sinal de activação que incluem i) preparação bi-camada e de montagem de uma célula de fluxo, ii) A injecção de células e de coloração de imunofluorescência para detectar moléculas de sinalização intracelulares em células interagindo com HIV-1 de aquisição de imagem gp120 e ICAM-1 em bi-camadas, iii) por microscopia TIRF, umand iv) análise dos dados. Este sistema gera imagens de alta resolução de VS interface além que a obtida com o sistema de célula-célula convencional uma vez que permite a detecção de grupos distintos de componentes individuais moleculares de VS, juntamente com moléculas de sinalização específicas recrutados para essas sub-domínios.
Protocolo
1. Marcando GP120
Corantes fluorescentes utilizados neste protocolo são eficazes para a ligação a proteínas, são suficientemente foto-estável para imagens de microscopia, e combinar os comprimentos de onda de excitação de os lasers disponíveis com o nosso microscópio. Estes três critérios precisam ser atendidas ao selecionar moléculas fluorescentes para proteínas de marcação.
- Trocar seus 6-marcado gp120 DH12 (um presente de Dr. Michael Cho, Iowa State University) tampão de proteínas para PBS estéril usando uma unidade centrífuga de filtro (30 kDa MWCO). Assegure-se a gp120 concentração não é mais do que 1 mg / ml. Nota: Sua 6-tag gp120 proteínas a partir de outro X4 ou estirpes R5 trópico também foram testados e estão agora disponíveis comercialmente a partir de Technologies imunitário.
- Adicionar bicarbonato de sódio pH 9,0 a sua solução de proteína para se obter uma concentração final de 50 mM de bicarbonato de sódio com ~ pH 8,5.
- Adicionar amina reactivo Alexa Fluor 488 (AF488) corante fluorescente, que é dissolved em água a um excesso molar de 10 vezes. Incubar esta mistura durante 1-2 horas à temperatura ambiente no escuro.
- Para remover o excesso de corante, utilizar a unidade de filtro centrífugo como antes e adicionar fresco PBS estéril para a coluna. Repetir este passo até que todo o corante livre é removido (3-4 lavagens com 4 ml de PBS). Girar para baixo até que a gp120 é concentrada para cerca de 1 mg / ml. Nota: A remoção do corante livre por diálise ou unidade de filtro centrífugo só funciona se o corante é solúvel em água, ou então de filtração em gel pode ser usado.
- Para medir a intensidade da fluorescência por molécula de proteína (F / P) da proteína marcada, determinar as concentrações (em uM) do corante fluorescente no comprimento de onda apropriado (por exemplo, a 488 nm para AlexaFluor 488) e proteína (usamos um espectrofotômetro NanoDrop utilizando as proteínas e dos rótulos dos ajustes) e depois dividir esses dois números, dando-lhe a razão F / P. O mesmo procedimento é utilizado para outras proteínas e corantes tais como ICAM-1 e Cy5. Nota: Outros tipos de spectrophotometers pode ser usado para obter a concentração de proteína ea concentração de corante fluorescente para se obter o rácio F / P se uma NanoDrop não está disponível.
2. Assembléia fluxo de células e Preparação bicamada
O procedimento geral para a célula de fluxo e de preparação bicamada tenha sido descrita em detalhe anteriormente 14. Aqui destacamos especificamente o protocolo para preparar bicamadas contendo 6-Sua marcado gp120 DH12 em uma célula de fluxo Bioptech. Para estudos envolvendo vírus infecciosos ou células infectadas e quando pequenos volumes são necessárias devido aos reagentes limitados, uma câmara de fluxo descartável Ibidi (Slide pegajoso I 0,2 Luer) pode ser utilizado e seguido com o procedimento de preparação mesma camada de bi-nos Passos 2,4-2,9. Informações para câmaras de fluxo Ibidi podem ser obtidas no site da empresa, http://www.ibidi.com/service/display_material/CA_8p_EN_150dpi.pdf .
- Preparar Pirhana solução (45 ml de ácido sulfúrico (Trace grau metal 98%) e 15 ml de peróxido de hidrogénio a 30%) 14. Com grampos de plástico, a cobertura de imergir desliza na solução Pirhana durante 15 minutos.
- Transferir cobrir desliza para um recipiente cheio de pica-água purificada e lavar cada um sob água corrente durante 2 minutos (um minuto de cada lado). Lugar na grelha para secar.
- Montar Bioptechs FCSII câmaras 14, como descrito anteriormente.
- Uma mistura de lipossomas contendo 12,5% de Ni 2 + lípidos quelantes é usado para capturar e apresentar Sua 6-gp120 na superfície bicamada 16. Adicione 1 gotas ul de mistura de lipossomas para o slide microaqueduct sem tocar na ponta para o vidro. Para preparar o máximo de 5 bicamadas por célula de fluxo, repetir até 4 vezes mais, de maneira que há cinco pontos 1μl como mostrado anteriormente 14.
- Coloque lamínula em cima de lipídios. Cubra o anel de retenção branco com um cl em aço inoxidávelampères unidade de base, vire todo o aparato mais e selar. Marcar localização de bicamadas com um marcador. Incubar durante 10 minutos à temperatura ambiente.
- Anexar tubo com duas vias torneira para o tubo de perfusão esquerda, como mostrado na vídeo. Gerar um menisco positivo no final do tubo com a torneira de 3 vias nele (tubo tenha sido previamente enchido com solução salina tamponada com HEPES (HBS) contendo albumina de soro humano (HSA) (HBS / HSA: 50 ml HBS 10x [10x solução salina tamponada com HEPES: 200 mM de HEPES, pH 7,2, 1,37 M de NaCl, 50 mM de KCl, 7 mM de Na 2 HPO 4, 60 mM D-glucose] 20 mL de HSA de 25 vezes, 500 uL CaCl 1M 2, 1 ml de 1 M de MgCl2 e dH 2 0 para trazer um volume total a) e 500 ml de filtro com filtro 0.22μm e é desprovido de bolhas. Ligar tubagem para o tubo de perfusão direita e empurre tampão através de célula de fluxo.
- Bloquear bicamada com ~ 300 uL de caseína contendo 100 mM NiCl 2, preenchendo uma seringa ml e anexar à porção aberta de 3-vias torneira. Genqüentemente empurrar tampão através do e feche ambas as torneiras antes de desengatar a seringa. Incubar durante 30 min à temperatura ambiente.
- Adicionar Sua gp120 6-tag AF488 marcado com (a concentração é determinada como descrito anteriormente em 16). Usamos ~ 250 moléculas de gp120/μm 2 para imitar a densidade local de aglomerados Env encontrados no HIV-1 de superfície do virião 17. Do mesmo modo, usamos ~ 250 moléculas / iM 2 de ICAM-1 na bicamada como previamente relatado 14. Coloque em célula de fluxo como é feito com a caseína. Incubar durante 30 min no escuro (cobrir com folha fina) à temperatura ambiente. O mesmo procedimento é utilizado para incorporar outras proteínas, tais como o seu 12-etiquetados Cy5-rotulado ICAM-1 para a bicamada.
- Lavar bicamadas com 5 ml de tampão.
3. Controle de Qualidade de Bicamadas através FRAP
Proteínas em bicamadas deve ser lateralmente difusível. Antes de adicionar as células em bicamadas, é importante para assegurar amobilidade das proteínas na bicamada preparada. Aqui nós descrevemos uma recuperação Fluorescente Após Fotodegradação (FRAP) Método 3, que podem ser executadas manualmente em mais objetiva iluminada TIRF, epifluorescência amplo campo, ou laser de microscópios de varredura confocal. O objectivo é o de campos de imagem totalmente uniformes de fluorescência na bicamada lipídica, lixívia um local, e para controlar o regresso das moléculas unquenched para a área branqueada. Uma recuperação de 50% em 2 minutos pode ser aceitável. Todos os fabricantes principais do microscópio (Leica, Nikon, Olympus, Zeiss) vender objetivas sistemas TIRF iluminados que funcionam bem para esta aplicação. Embora cada companhia fornece variações de iluminação TIRF e outras características operacionais, a qualidade da imagem é essencialmente a mesma.
- Usar uma intensidade de excitação baixa para minimizar o branqueamento. Utilizar um objectivo da abertura numérica elevada tal como um 1,3-1,45 NA 40x, 60x ou 100x. Quando se utiliza um microscópio fluorescente padrão ou TIRF, para reduzir as intens luzdade, colocar filtros de densidade neutra no caminho de luz de excitação. A maioria dos sistemas de laser pode ser definido para a iluminação baixa, definindo um acusto óptico sintonizável filtro (AOTF) ou acusto divisor de feixe óptico (AOBS) com baixa tensão.
- Grave um "pré-branqueamento" de imagem. Se utilizando uma câmara CCD arrefecido, para compensar a baixa binning condições de luz pode ser ajustado para 2x2 ou 4x4, o ganho pode ser fixado exposições elevadas, ou longo prazo (por exemplo da ordem de segundos) pode ser usado. Se usando um confocal, a abertura orifício pode ser aberta; o ganho estabelecido alto, e digitalização lenta ou média utilizado.
- Bleach um ponto. Se usando um microscópio de fluorescência padrão ou TIRF, remover todos os filtros ND para permitir a iluminação intensidade máxima, fechar o diafragma de campo, e expor a amostra durante alguns segundos. Se estiver usando um laser de varredura confocal, defina o máximo de potência do laser e zoom em cerca de 4x a 8x para branquear um ponto. Um alerta para o uso confocal: não ampliar muito alto porque a bicamada pode ser danificado por excesexclusivamente concentrada fótons.
- Aos dez a quinze segundos de intervalo, gravar imagens utilizando a mesma iluminação e as configurações de gravação como em 3.1 e 3.2. Dentro de dois a três minutos, o local deve recuperar intensidade que se aproxima do "pré-branqueamento" de imagem. Recuperação rápida é o sinal de uma bicamada de sucesso móvel. Se o ponto permanece escuro, e especialmente se a borda retém alto contraste, as proteínas fluorescentes são imóveis na bicamada e não deve ser utilizado para a experiência.
Nota: Em nosso microscópio atual, podemos entregar 0,9 mW de 641 nm de luz para um ponto circular com uma área de 240 mM 2, que branqueia ICAM fluorescente em concentrações típicas em menos de 4 segundos. Os leitores devem encontrar que o alinhamento crítica de uma lâmpada de Hg ou Xe com o branqueamento vezes menos do que 30 segundos é mais que suficiente para realizar este ensaio de uma forma reproduzível. Gostaríamos também de encaminhá-lo para fazer referência a 3 para det adicionalaflige.
4. A injeção de células e imunofluorescência
- Aquecer célula de fluxo a 37 ° C (isto pode ser feito de uma incubadora a 37 ° C sem 2 CO para cerca de 30 min).
- Adicionar ativadas CD4 + humanas células T (2-5x10 6 de fluxo / celular) em HBS / HSA ~ ul 400 por ml 1 seringa. Deixe células anexar a bicamada para ~ 45 min no 37 ° C incubadora. Se as câmaras Ibidi são utilizados, o fornecimento de tampão adicional a cada 15-20 min.
- Fixar as células por injecção de 2% de paraformaldeído e incubar durante 10 minutos a 37 ° C.
- Lavar 3x com 1ml sala de tampão PBS temperatura. Permeabilizar as células por injecção de 0,1% de Triton X-100 durante 5 min à temperatura ambiente.
- Lavar 3x com 1 ml de tampão PBS à temperatura ambiente (quando o teste para as proteínas fosforiladas, pode adicionar vanadato de sódio a 1 mM concentração final ou outro inibidor da fosfatase em PBS para impedir a remoção do fosfato durante o processamento). Bloquear utilizando caseína com soro de cabra 5% para25 minutos à temperatura ambiente. O tipo de animal soro depende do anticorpo secundário.
- Lavar 3x com 1 ml de tampão de sala de temperatura PBS. Adicionar anticorpo primário em ~ 300 célula tampão / fluxo ul durante 30 min - 1 h à temperatura ambiente. Para detectar o sinal de activação inicial membrana proximal, usamos anticorpos específicos para fosforilado Lck (pLck), total Lck ou Fyn.
- Lavar 3x com 1 ml de tampão de sala de temperatura PBS. Adicionar o anticorpo marcado por fluorescência secundário adequado em tampão como foi feito com o anticorpo primário. Para nossos experimentos, usamos Alexa Fluor 568-cabra marcado com anti-coelho secundário. Incubar durante 20 min à temperatura ambiente. Lavar 3x com 1 ml de tampão PBS.
- Nota: É essencial ter uma bicamada de controlo que é tratado com apenas o anticorpo secundário (sem anticorpo primário). Siga os passos de 4,1-4,5 e saltar 4,6, em seguida, avance para o passo 4.7. Isto vai determinar o nível de ligação não-específica do seu anticorpo secundário. Alternativamente, pode-se utilizar directamente rótuloOs anticorpos primários ed.
5. A aquisição de imagens por microscopia TIRF
Microscopia TIRF permite excitação de sinais fluorescentes limitados a um 250 nm ou mais fino plano no substrato de vidro e de interface celular. Isto garante a aquisição da imagem dos sinais de apenas a partir da bicamada lipídica e das membranas celulares imediatamente apostos. Portanto, apenas moléculas na sinapse são gravadas. Como as imagens TIRF apenas a área de membrana proximal, na parte inferior da célula, proteínas que são internalizados ou redistribuído para a membrana dorsal não será detectado. Pode então ser importante para aquisição de imagens, adicionalmente, pela norma Widefield ou microscopia confocal para determinar a acumulação ou a distribuição das proteínas na área sináptica, em comparação com os outros volumes da célula.
Todos os fabricantes principais do microscópio (Leica, Nikon, Olympus, Zeiss) vender objetivas sistemas TIRF iluminados que funcionam bem para este applicatura. Embora cada companhia fornece variações de iluminação TIRF e outras características operacionais, a qualidade da imagem é essencialmente a mesma. Cada microscópio TIRF tem seus próprios detalhes para a operação, mas as regras gerais a seguir aplicam para obter imagens de alta resolução.
- Iluminação deve ser baixa para evitar o branqueamento.
- A câmera deve ter uma resposta linear.
- A câmara deve ser capaz de imagiologia uma vasta gama dinâmica sem saturação.
- Todas as configurações devem ser definidas constante para análises quantitativas.
6. Análise de Dados
Para estudar os sinais intracelulares activados como um resultado de células CD4 + T de interacção célula com gp120 na VS, análises quantitativas de imagens TIRF são feitos para determinar se ou não moléculas de sinalização intracelulares, tais como Lck e Fyn são activados e recrutados para a sinapse 15. Aqui nós descrevemos um método simples para análise mais aplicável imagempacotes de aplicativos como o ImageJ e Metamorph. Temos usado ImageJ, que roda em Windows, Macintosh e Linux, para o nosso método aqui 12.
No> guia Set analisar as medidas, marque as caixas para a área e valor médio de cinza. Quando você faz uma região de interesse na imagem que é um polígono ou um traçado à mão livre de forma fechada e não Analise Medida>, o software irá colocar os dados a partir dessa medida, em uma tabela de resultados. A Área será em número de pixels ou em 2 uM. A média é a intensidade média em unidades arbitrárias. Deve ter intensidade de fundo subtraído a partir dele. Multiplicando o fundo média menos por área retorna a intensidade integrada da proteína em unidades arbitrárias.
- Definir as medidas a médio e Área.
- Abra as imagens para uma condição experimental.
- Para cada célula, localizar e medir a região de interesse (média) e rastrear e medir uma região fora da região de interesse (de fundo).
- Quando feito com uma condição experimental, as medições quer copiar e colar no Excel ou outro programa de planilha ou salvar as medições.
- Volte ao passo 6.2 para cada condição experimental.
- Quando as medições são completadas, calcular os resultados. As fórmulas são:
Intensidade média = média - fundo
Intensidade integrada = área * Média intensidade
7. Os resultados representativos
Para medir a activação e recrutamento dos iniciais membrana proximal moléculas de sinalização Lck e Fyn como um resultado da interacção com gp120 na VS, CD4 + humanas primárias de células T foram introduzidos no bicamadas munidos gp120 e ICAM-1 15. Células introduzidas para bicamadas com apenas ICAM-1 serviu como um controlo para definir os níveis basais de sinalização. Speintensidade de fluorescência específica foi medida no interior da área de contacto gp120 para células em gp120 e ICAM-1 bicamadas contendo e dentro de toda a área de contacto para as células interagindo com o ICAM-1 bicamada. Um aumento da intensidade de fluorescência média é um sinal de aumentada recrutamento e activação da molécula de sinalização para o VS. Isto irá ser adicionalmente demonstrada por um aumento comparável na intensidade integrada de fluorescência. Se, no entanto, não há alteração na intensidade de fluorescência integrada, isso indica uma redistribuição da molécula de sinalização.
Após as células interagiu com bicamadas contendo gp120 e ICAM-1, total de Lck e pLck (Y394) foram recrutados para a interface VS e colocalized com gp120 (Figs. 1 e 2). A intensidade média do total Lck (Fig. 1) foi mais elevada na bicamada contendo tanto gp120 e ICAM-1 do que com ICAM-1 por si só, mas os níveis de intensidade integrada (Fig. 1) foram semelhantes, sugerindo que Lck é redistribuído paraum cluster central sobre CD4 + de células T de ligação para gp120. No entanto, a quantificação de pLck (Y394) (Fig. 2) mostrou que a intensidade média na gp120 e ICAM-1 bicamadas contendo foi maior do que em ICAM-1 bicamadas sozinho, ea intensidade integrada foi maior em bicamadas com ambos gp120 e ICAM -1 do que em ICAM-1 bicamadas sozinho. Isto indica que, embora os níveis de total de Lck na interface são semelhantes em células aderentes para gp120 e ICAM-1 e ICAM-1 por si só, bicamadas gp120 de fosforilação de ligação aumentada de resíduo Y394 no Lck lacete de activação. Em contraste, não foi Fyn recrutados para o VS (Fig. 3), como mais Fyn estava presente na área de contacto das células em ICAM-1 bicamadas sozinho do que em bicamadas contendo tanto gp120 e ICAM-1. Consequentemente, nós concluímos que não Lck, Fyn, é a cinase activa no HIV-1 VS gp120-induzido.
Figuras: Membrana-proximal de sinalização na HIV-1 VS gp120-induzido. Imagens de células representativas nogp120 + ICAM-1 bicamada (painéis superiores) e da ICAM-1 bicamada (painéis inferiores) são mostrados. Intensidades de fluorescência das células individuais foram quantificados dentro de áreas manualmente traçados das pegadas das células, como ilustrado pela região marcada com a linha amarela na Figura 1. Quantificação de intensidades médios e integrada detectados por microscopia TIRF são apresentados nos gráficos da esquerda e da direita, respectivamente. Um total de 30 a 350 células foram quantificadas para cada condição. Bares = 5 mm. Dados de um dos três experimentos repetidos são mostrados.
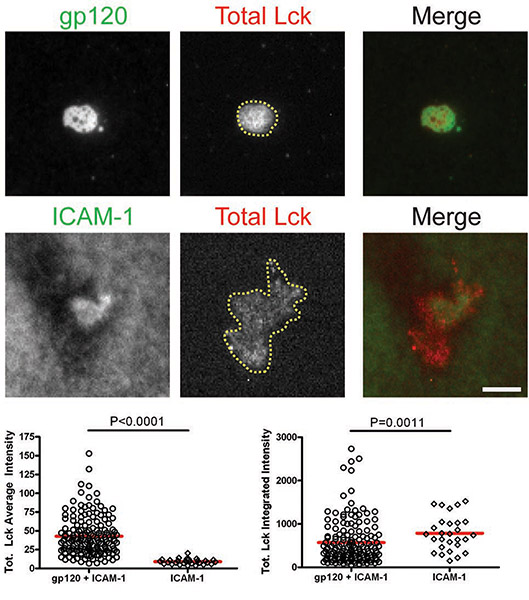
Figura 1. Células T CD4 + foram introduzidos em bicamadas contendo gp120 e ICAM-1 ou ICAM-1 sozinha durante 45 min e, em seguida, fixadas e coradas para o total Lck.

Figura 2. Células T CD4 + foram introduzidos em bicamadas, contendo gp120 e ICAM-1 ou ICAM-1 sozinha durante 45 min e depois fixadas e coradas para pLck (Y394).
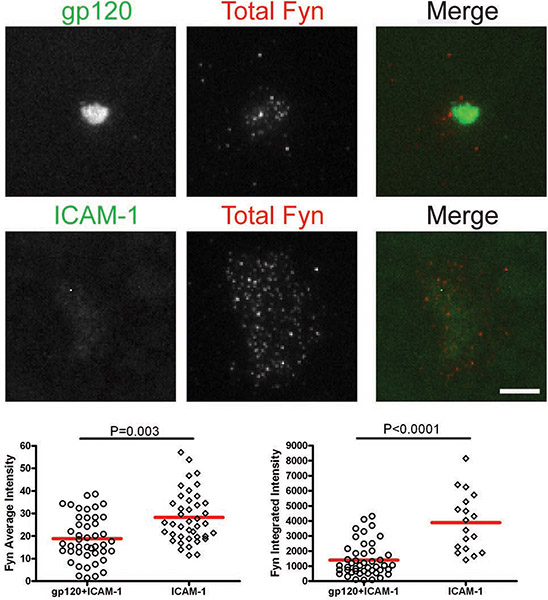
Figura 3. Células T CD4 + foram introduzidos em bicamadas contendo gp120 e ICAM-1 ou ICAM-1 sozinha durante 45 min e depois fixadas e coradas para Fyn total.
Discussão
Estudos anteriores têm VS visualizado no sistema conjugado célula-célula, porém esses estudos não fornecem imagens de resolução alta o suficiente para visualizar as estruturas supramoleculares na sinapse. No nosso laboratório, utilizamos o vidro suportada sistema bicamada planar para representar a superfície das células infectadas que expressam o gp120 envelope do vírus e da molécula de adesão celular ICAM-1. Em conjunção com TIRF microscopia, que detecta sinais de fluorescência dentro 100-200 nm a partir da superfície bicamada com uma relação sinal-ruído elevado, fomos capazes de detectar a segregação supramolecular da gp120 a partir de ICAM-1 no VS. Além disso, o método de imunocoloração padrão pode ser aplicada ao sistema de bicamada e foi utilizado aqui para detectar e quantificar o recrutamento específico de Lck activa, mas não Fyn, para a área de contacto gp120-at VS 15. Assim, a bicamada planar oferece um sistema experimental para geração de imagens de alta resolução de interface de sinapse num plano 2D por TIRF microescopia, bem como métodos de iluminação de campo ou gama-confocal. No entanto, o sistema também tem limitações como ajustar mobilidade ligante, fora do plano de flexão, e as flutuações de membranas biológicas não são reproduzidas por bicamadas planas. Além disso, este é um sistema in vitro e, portanto, tem outras limitações, tais como falta de moléculas da membrana outros que estariam presentes em uma célula infectada e as máquinas citoesqueleto, que regula a mobilidade molecular e da motilidade celular. Além disso, as dinâmicas e distribuição das moléculas, tais como trímeros, versus monómeros de gp120, não podem ser representados fisiologicamente sobre a bicamada. No entanto, mesmo com estas limitações, este sistema é ainda muito valiosa para o estudo do vírus na célula ou interacções célula-célula, e estes métodos podem servir como um guia útil para os investigadores que procuram imagens de alta resolução para detectar organização supramolecular que não é perceptível no sistema conjugado convencional célula-célula.
Divulgações
Os autores declaram nenhum conflito de interesses.
Agradecimentos
Este trabalho foi financiado pelo NIH concede AI071815 (CEH) e do Roteiro Nanomedicina prêmio Centro de Desenvolvimento PN2EY016586 (MLD).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Sua HIV marcados gp120 | Presente do Dr. Cho | DH12 | |
| Sua HIV marcados gp120 | Tecnologia imune | Vários X4 ou R5 trópico | |
| HSA | Williams Medical Company | 521302 | Soro Humano 25% de albumina |
| Amicon Ultra Filtros Centrífugos | Millipore | UFC803024 | Ultracel-30K |
| Lck Coelho mAb | Sinalização celular | 2787 | |
| p-Lck coelho pAb | Santa Cruz Biotechnology Inc. | Sc-101728 | Tyr 394 |
| Fyn Coelho mAb | Millipore | 04-353 | |
| Alexa Fluor 568 2 °; Ab | Molecular Probes | A11034 | Cabra anti-coelho IgG (H + L) |
| Alexa Fluor 488 | Molecular Probes | Um-20000 | carboxilico succinimidil éster |
| FCS2 Câmara | Bioptechs | 060319-2-03 | |
| Microaqueduct slide | Bioptechs | 130119-5 | |
| Rodada 30 milímetros w / furos | Bioptechs | 1907-08-750 | 0,75 milímetros de espessura |
| Retângulo Junta | Bioptechs | 1907-1422-250 | 14x24 0,25 milímetros de espessura |
| Tubulação de Tygon | Bioptechs | 20202275 | 1/16 "(25 pés) |
| Torneira de três vias | BioRad | 7328103 | |
| Two-way Torneira | BioRad | 7328102 | |
| Deslize pegajoso eu 0,2 Luer | Ibidi | 80168 | |
| Cubra óculos | Ibidi | 10812 | |
| Seringa de 1ml | BD | 309659 | |
| CÃES-NTA | Avanti Polar Lipids | 790404C | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Vidro lamela | Bioptechs | 40-1313-0319 | 40 milímetros |
| Microscópio TIRF | Nikon | ||
| ImageJ | National Institutes of Health | http://rsbweb.nih.gov/ij/~~V |
Referências
- Bastiani, L., Laal, S., Kim, M., Zolla-Pazner, S. Host cell-dependent alterations in envelope components of human immunodeficiency virus type 1 virions. J. Virol. 71, 3444-3450 (1997).
- Dimitrov, D. S., Willey, R. L., Sato, H., Chang, L. J., Blumenthal, R., Martin, M. A. Quantitation of human immunodeficiency virus type 1 infection kinetics. J. Virol. 67, 2182-2190 (1993).
- Dustin, M. L. Adhesive Bond Dynamics in Contacts between T Lymphocytes and Glass-supported Planar Bilayers Reconstituted with the Immunoglobulin-related Adhesion Molecule CD58. J. Biol. Chem. 272, 15782-15788 (1997).
- Fortin, J. F., Cantin, R., Lamontagne, G., Tremblay, M. Host-derived ICAM-1 glycoproteins incorporated on human immunodeficiency virus type 1 are biologically active and enhance viral infectivity. J. Virol. 71, 3588-3596 (1997).
- Frank, I., Stoiber, H., Godar, S., Stockinger, H., Steindl, F., Katinger, H. W., Dierich, M. P. Acquisition of host cell-surface-derived molecules by HIV-1. Aids. 10, 1611-1620 (1996).
- Hioe, C. E., Bastiani, L., Hildreth, J. E., Zolla-Pazner, S. Role of cellular adhesion molecules in HIV type 1 infection and their impact on virus neutralization. AIDS Res. Hum. Retroviruses. 14, Suppl 3. S247-S254 (1998).
- Hioe, C. E., Chien, P. C., Lu, C., Springer, T. A., Wang, X. H., Bandres, J., Tuen, M. LFA-1 expression on target cells promotes human immunodeficiency virus type 1 infection and transmission. J. Virol. 75, 1077-1082 (2001).
- Jolly, C., Kashefi, K., Hollinshead, M., Sattentau, Q. J. HIV-1 cell to cell transfer across an Env-induced, actin-dependent synapse. J. Exp. Med. 199, 283-293 (2004).
- Jolly, C., Mitar, I., Sattentau, Q. J. Requirement for an intact T-cell actin and tubulin cytoskeleton for efficient assembly and spread of human immunodeficiency virus type 1. J. Virol. 81, 5547-5560 (2007).
- McDonald, D., Wu, L., Bohks, S. M., KewalRamani, V. N., Unutmaz, D., Hope, T. J. Recruitment of HIV and its receptors to dendritic cell-T cell junctions. Science. 300, 1295-1297 (2003).
- Pearce-Pratt, R., Malamud, D., Phillips, D. M. Role of the cytoskeleton in cell-to-cell transmission of human immunodeficiency virus. J. Virol. , 682898-682905 (1994).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. (1997).
- Rizzuto, C. D., Sodroski, J. G. Contribution of virion ICAM-1 to human immunodeficiency virus infectivity and sensitivity to neutralization. J. Virol. 71, 4847-4851 (1997).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Vasiliver-Shamis, G., Cho, M. W., Hioe, C. E., Dustin, M. L. Human immunodeficiency virus type 1 envelope gp120-induced partial T-cell receptor signaling creates an F-actin-depleted zone in the virological synapse. J. Virol. 83, 11341-11355 (2009).
- Vasiliver-Shamis, G., Tuen, M., Wu, T., Starr, T., Cameron, T., Thomson, R., Kaur, G., Liu, J., Visciano, M., Li, H., Kumar, R., Ansari, R., Han, D., Cho, M., Dustin, M. L., Hioe, C. E. Human immunodeficiency virus type 1 envelope gp120 induces a stop signal and virological synapse formation in noninfected CD4+ T cells. J. Virol. 82, 9445-9457 (2008).
- Zhu, P., Liu, J., Bess, J., Chertova, E., Lifson, J., Grise, H., Ofek, G., Taylor, K., Roux, K. Distribution and three-dimensional structure of AIDS virus envelope spikes. Nature. 441, 847-852 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados