Method Article
Imaging di HIV-1 Envelope indotta Synapse virologica e segnalazione sui doppi strati lipidici sintetici
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo descrive un metodo per visualizzare la formazione di una sinapsi HIV-1 busta-indotta virologici vetro bistrati planari supportate da fluorescenza riflessione interna totale (TIRF) microscopia. Il metodo può anche essere combinato con immunofluorescenza per rilevare l'attivazione e ridistribuzione di molecole di segnalazione che si verificano durante HIV-1 busta indotta la formazione di sinapsi virologica.
Abstract
Virus dell'immunodeficienza umana di tipo 1 (HIV-1) l'infezione si verifica in modo più efficiente per la trasmissione via cellulare delle cellule 2,10,11. Questa cellula di trasferimento di celle tra cellule T CD4 + comporta la formazione di una sinapsi virologica (VS), che è un F-actina-dipendente cellula-cellula giunzione formata per l'impegno di HIV-1 gp120 busta sulla cellula infettata con CD4 e il recettore di chemiochina (CKR) CXCR4 o CCR5 sulla cellula bersaglio 8. Oltre a gp120 e suoi recettori, proteine di membrana altri, in particolare la molecola di adesione LFA-1 e dei suoi ligandi, la famiglia ICAM, giocano un ruolo importante nella formazione VS e la trasmissione del virus come sono presenti sulla superficie di cellule infettate da virus donatore e cellule bersaglio, nonché sulla busta di HIV-1 virioni 1,4,5,6,7,13. Formazione VS è accompagnata anche da eventi intracellulari di segnalazione che sono trasdotti come risultato di gp120-impegno dei suoi recettori. Infatti, abbiamo recentemente dimostrato che i CD4 <sup> + l'interazione delle cellule T con gp120 induce il reclutamento e la fosforilazione di molecole di segnalazione associate al TCR signalosome compresa Lck, CD3ζ, ZAP70, LAT, SLP-76, ITK, e PLCγ 15.
In questo articolo, vi presentiamo un metodo per visualizzare arrangiamento supramolecolare e membrana-prossimali segnalazione eventi che si svolgono durante la formazione VS. Prendiamo vantaggio del vetro supportato planare bi-strato come sistema modello riduzionista per rappresentare la superficie di cellule infettate da HIV recanti l'involucro virale gp120 e la molecola di adesione cellulare ICAM-1. Il protocollo descrive procedure generali per monitorare HIV-1 gp120 indotta VS assemblaggio e gli eventi di attivazione del segnale che comprendono i) bi-strato di preparazione e di montaggio in una cella di flusso, ii) iniezione di cellule e immunofluorescenza per rilevare molecole di segnalazione intracellulare in cellule interagenti con HIV-1 gp120 di acquisizione immagini e ICAM-1 in bi-strati, iii) da microscopia TIRF, unond iv) l'analisi dei dati. Questo sistema genera immagini ad alta risoluzione di interfaccia VS al di là di quello ottenuto con la tradizionale cellula-cellula del sistema in quanto permette di individuare gruppi distinti di singoli componenti molecolari di VS insieme con le molecole di segnalazione specifici assunti a queste sub-domini.
Protocollo
1. Etichettatura GP 120
Coloranti fluorescenti utilizzati nel presente protocollo sono efficaci per il legame alle proteine, siano sufficientemente foto-stabile microscopia per l'imaging, e corrispondono alle lunghezze d'onda di eccitazione dei laser disponibili con il nostro microscopio. Questi tre criteri devono essere soddisfatti quando si selezionano le molecole fluorescenti per le proteine di tagging.
- Cambio 6-Il suo tag gp120 DH12 (un dono del Dr. Michael Cho, Iowa State University) tampone proteine PBS sterile utilizzando una unità di centrifuga filtro (30 kDa MWCO). Assicurarsi gp120 concentrazione non è superiore a 1 mg / ml. Nota: Il suo 6-tagged gp120 proteine provenienti da altri ceppi X4 o R5 tropico sono stati testati e sono ora disponibili in commercio dal Technologies immunitario.
- Aggiungi bicarbonato di sodio pH 9.0 alla soluzione proteica per ottenere 50mM concentrazione finale di bicarbonato di sodio con pH ~ 8.5.
- Aggiungi ammina reattiva Alexa Fluor 488 (AF488) colorante fluorescente, che è dissolved in acqua a 10 volte eccesso molare. Incubare questa miscela per 1-2 ore a temperatura ambiente al buio.
- Per rimuovere l'eccesso di colorante, utilizzare l'unità filtro centrifugo come prima e aggiungere PBS sterile fresca alla colonna. Ripetere questa operazione fino a quando tutti colorante libero viene rimossa (3-4 lavaggi con 4 ml di PBS). Centrifugare fino gp120 viene concentrata a circa 1 mg / ml. Nota: rimozione colorante libero mediante dialisi o centrifugo unità filtro funziona solo se il colorante è solubile in acqua, oppure filtrazione gel può essere utilizzato.
- Per misurare l'intensità di fluorescenza per ogni molecola di proteina (F / P) della proteina marcata determinare le concentrazioni (in pM) del colorante fluorescente alla lunghezza d'onda appropriata (per esempio, a 488 nm per AlexaFluor 488) e proteine (usiamo uno spettrofotometro NanoDrop utilizzando le 'proteine e le etichette di presa) e poi dividere questi due numeri che danno la F / P ratio. La stessa procedura viene utilizzata per altre proteine e coloranti come ICAM-1 e Cy5. Nota: Altri tipi di spectrophotometers può essere utilizzato per ottenere la concentrazione proteica e concentrazione di colorante fluorescente per ottenere il rapporto F / P NanoDrop se non è disponibile.
2. Flusso di assemblaggio delle cellule e preparazione doppio strato
La procedura generale per la cella a flusso e bistrato preparazione è stata descritta in dettaglio in precedenza 14. Qui si delineano in particolare il protocollo per la preparazione doppi strati che contengono la sua 6-tagged gp120 DH12 su una cella di flusso Bioptech. Per gli studi che coinvolgono virus infettivi o cellule infettate e quando sono necessari piccoli volumi a causa di reagenti limitati, una camera di flusso monouso Ibidi (Slide sticky I 0,2 Luer) può essere utilizzato e seguito con lo stesso bi-layer procedura di preparazione nei passi 2.4-2.9. Informazioni per le camere di flusso Ibidi possono essere ottenute dal sito web della società, http://www.ibidi.com/service/display_material/CA_8p_EN_150dpi.pdf .
- Preparare la soluzione Pirhana (45 ml di acido solforico (Grade tracce di metalli 98%) e 15 ml di perossido di idrogeno al 30%) 14. Con fascette in plastica, coperchio scivola immergere nella soluzione Pirhana per 15 minuti.
- Trasferimento copertura scivola in un bicchiere pieno di pica-acqua depurata e lavare ogni uno sotto l'acqua corrente per 2 minuti (un minuto per lato). Posto sulla griglia ad asciugare.
- Montare Bioptechs FCSII camere come descritto in precedenza 14.
- Una miscela contenente liposomi 12,5% Ni 2 + lipidi chelanti viene utilizzato per catturare e presentare il suo 6-gp120 sulla superficie doppio strato 16. Aggiungere 1 pl gocce di miscela liposomi sul vetrino microaqueduct senza toccare la punta per il vetro. Per preparare il massimo di 5 bistrati per cella di flusso, ripetere fino a 4 volte superiore in modo che vi siano cinque punti 1ml come illustrato in precedenza 14.
- Posizionare coprioggetto sopra lipidi. Coprire l'anello bianco di fissaggio con un cl in acciaio inoxunità di base amp, capovolgere tutto l'apparato sopra e sigillare. Contrassegnare la posizione di bistrati con un pennarello. Incubare per 10 minuti a temperatura ambiente.
- Collegare il tubo con bidirezionale rubinetto a tubo perfusione sinistra, come mostrato in video. Generare un menisco positivo al termine del tubo con la 3-way rubinetto su di esso (tubo è stato precedentemente riempito con HEPES-soluzione salina tamponata (HBS) contenente albumina sierica umana (HSA) (HBS / HSA: 50 ml 10x HBS [10x soluzione salina tamponata con HEPES: 200 mM di HEPES, pH 7,2, 1,37 M di NaCl, 50 mM KCl, 7 mM Na 2 HPO 4, 60 mM D-glucosio] 20 ml 25x HSA, 500 pl 1M CaCl 2, 1 ml 1 M MgCl 2 e dH 2 0 per portare un volume totale), 500 ml e filtro con filtro 0.22μm ed è privo di bolle. Collegare il tubo al tubo perfusione destra e spingere delicatamente tampone attraverso la cella di flusso.
- Blocco doppio strato con ~ 300 ml di caseina contenente 100 mM NiCl 2 compilando siringa da 1 ml e allegando alla porzione aperta di 3-way rubinetto. GenTLY spingere attraverso il tampone e chiudere entrambi i rubinetti prima di disattivare la siringa. Incubare per 30 minuti a temperatura ambiente.
- Aggiungere sua 6-etichettato AF488-gp120 marcato (la concentrazione viene determinata come descritto in precedenza in 16). Usiamo ~ 250 molecole di gp120/μm 2 per simulare la densità locale di cluster trovati Env di HIV-1 sulla superficie del virione 17. Analogamente, usiamo ~ 250 molecole / um 2 di ICAM-1 sulla bistrato come riportato in precedenza 14. Caricare in cella a flusso come fatto con la caseina. Incubare per 30 min al buio (coprire con un foglio) a temperatura ambiente. La stessa procedura viene utilizzata per incorporare altre proteine come la sua targhetta 12-Cy5-marcato ICAM-1 sul doppio strato.
- Lavare bistrati con 5 ml di tampone.
3. Controllo di qualità dei Bilayers via FRAP
Le proteine in bistrati devono essere lateralmente diffusibile. Prima di aggiungere cellule su bistrati, è importante assicurare lamobilità di proteine nel bistrato preparato. Qui descriviamo un ripristino fluorescente Dopo Photobleaching (FRAP) metodo 3 che possono essere eseguite manualmente su più oggettivo illuminata TIRF, epifluorescenza ampio campo, o microscopi a scansione laser confocale. L'obiettivo è di campi immagine completamente uniformi fluorescenza nel doppio strato lipidico, candeggina un punto, e per monitorare il ritorno di molecole inappagata alla zona sbiancato. Un recupero del 50% in 2 minuti può essere accettabile. Tutti i principali produttori di microscopio (Leica, Nikon, Olympus, Zeiss) vendere oggettivi TIRF sistemi luminosi che funzionano bene per questa applicazione. Mentre ogni azienda fornisce variazioni di illuminazione TIRF e altre caratteristiche operative, la qualità dell'immagine è essenzialmente la stessa.
- Utilizzare una bassa intensità di eccitazione per ridurre al minimo lo sbiancamento. Utilizzare un obiettivo ad alta apertura numerica come un 1,3-1,45 NA 40x, 60x o 100x. Quando si usa un microscopio standard fluorescente o TIRF, per ridurre i Intens lucelità, mettere i filtri a densità neutra nel percorso della luce di eccitazione. Maggior parte dei sistemi laser può essere impostato per l'illuminazione a basso impostando uno acusto ottico filtro accordabile (AOTF) o acusto divisore di fascio ottico (AOBS) a bassa tensione.
- Registrare un immagine "pre-candeggina". Se si utilizza una camera CCD raffreddata, per compensare binning condizioni di scarsa illuminazione può essere impostato a 2x2 o 4x4, il guadagno può essere impostato esposizioni elevate, o lungo (ad esempio dell'ordine di secondi) possono essere utilizzati. Se si utilizza un microscopio confocale, l'apertura foro può essere aperto, il guadagno impostato alto, e la scansione lenta o media utilizzati.
- Bleach uno spot. Se si utilizza un microscopio a fluorescenza standard o TIRF, rimuovere tutti i filtri ND per consentire l'illuminazione massima intensità, chiudere il diaframma di campo, ed esporre il campione per pochi secondi. Se si utilizza una scansione laser confocale, impostare la massima potenza del laser e lo zoom in circa 4x a 8x di candeggina un posto. Un avvertimento per l'uso confocale: non ingrandire troppo alto a causa del doppio strato può essere danneggiato da eccessivamente concentrate fotoni.
- A dieci a quindici intervalli di un secondo, registrare le immagini con la stessa illuminazione e le impostazioni di registrazione come in 3.1 e 3.2. Entro due o tre minuti il luogo dovrebbe recuperare l'intensità si avvicina a quella dell'immagine "pre-candeggina". Recupero rapido è il segno di un doppio strato mobile di successo. Se il punto rimane oscuro, e specialmente se il bordo mantiene elevato contrasto, le proteine fluorescenti sono immobili nel bistrato e non dovrebbe essere utilizzata per l'esperimento.
Nota: Nel nostro microscopio, possiamo consegnare 0,9 mW luce di 641 nm in un luogo circolare con una superficie di 240 micron 2 che sbianca ICAM fluorescente a concentrazioni tipiche in meno di 4 secondi. I lettori dovrebbero trovare che l'allineamento critica di un Hg o Xe lampada con sbiancante volte meno di 30 secondi è più che sufficiente per eseguire questa analisi in modo ripetibile. Vorremmo inoltre fare riferimento a riferimento del 3 per ulteriori detindispone.
4. Iniezione di cellule e colorazione di immunofluorescenza
- Riscaldare cella di flusso a 37 ° C (questo può essere fatto in un incubatore a 37 ° C senza CO 2 per circa 30 min).
- Aggiungi attivati umani CD4 + (cellule T 2-5x10 6 / cella di flusso) in HBS / HSA ~ 400 microlitri da siringa da 1 ml. Lasciate che le cellule allegare al doppio strato per ~ 45 min nel 37 ° C incubatore. Se le camere Ibidi vengono utilizzati, fornire buffer aggiuntivo ogni 15-20 minuti.
- Fissare le cellule iniettando 2% paraformaldeide e incubare per 10 minuti a 37 ° C.
- Lavare 3x con 1 ml di tampone PBS temperatura ambiente. Permeabile cellule iniettando 0,1% Triton X-100 per 5 min a temperatura ambiente.
- Lavare 3 volte con 1 ml di PBS a temperatura ambiente (quando il riconoscimento delle proteine fosforilate, è possibile aggiungere vanadato di sodio ad una concentrazione 1mM finale o un altro inibitore della fosfatasi in PBS per impedire la rimozione di fosfato durante la lavorazione). Blocco utilizzando caseina con siero di capra al 5% per25 minuti a temperatura ambiente. Il tipo di siero animale dipende l'anticorpo secondario.
- Lavare 3x con 1 ml di tampone PBS temperatura ambiente. Aggiungere anticorpo primario in ~ 300 microlitri tampone / flusso di celle per 30 min - 1 ora a temperatura ambiente. Per rilevare l'iniziale membrana prossimale segnale di attivazione, si usa anticorpi specifici per fosforilata Lck (pLck), totale o Lck Fyn.
- Lavare 3x con 1 ml di tampone PBS temperatura ambiente. Aggiungi fluorescente appropriato anticorpo secondario marcato in tampone come fatto con l'anticorpo primario. Per i nostri esperimenti, abbiamo usare Alexa Fluor 568-marcato di capra anti-coniglio secondario. Incubare per 20 minuti a temperatura ambiente. Lavare 3x con 1 ml di tampone PBS.
- Nota: E 'essenziale avere un doppio strato di controllo che viene trattato con solo anticorpo secondario (non anticorpo primario). Seguire i passaggi 4.1-4.5 e saltare 4.6, quindi procedere con passo 4.7. Ciò determinerà il livello di legame non specifico della anticorpo secondario. In alternativa, si può utilizzare direttamente etichettaEd anticorpi primari.
5. L'acquisizione di immagini al microscopio TIRF
Microscopia TIRF consente eccitazione di segnali fluorescenti limitate a 250 nm o più sottile al piano del substrato di vetro e l'interfaccia cella. Questo garantisce l'acquisizione delle immagini di segnali solo dal doppio strato lipidico e dalle membrane immediatamente apposed. Pertanto, solo le molecole alla sinapsi vengono esposte. Poiché le immagini TIRF solo la membrana-prossimale zona sul fondo della cella, proteine che sono ridistribuiti internalizzati o nella membrana dorsale non verrà rilevata. Esso può quindi essere importante per acquisire immagini ulteriormente dalla norma widefield o microscopia confocale per determinare accumulo o distribuzione delle proteine alla zona sinaptica rispetto agli altri volumi della cellula.
Tutti i principali produttori di microscopio (Leica, Nikon, Olympus, Zeiss) vendere oggettivi TIRF sistemi luminosi che funzionano bene per questo apcazione. Mentre ogni azienda fornisce variazioni di illuminazione TIRF e altre caratteristiche operative, la qualità dell'immagine è essenzialmente la stessa. Ogni microscopio TIRF ha i suoi propri dati per il funzionamento, ma le seguenti regole generali si applicano per ottenere immagini ad alta risoluzione.
- L'illuminazione dovrebbe essere basso per evitare di sbiancamento.
- La fotocamera dovrebbe avere una risposta lineare.
- La fotocamera dovrebbe essere in grado di imaging un'ampia gamma dinamica senza saturazione.
- Tutte le impostazioni devono essere impostate costante per analisi quantitative.
6. Analisi dei dati
Per studiare i segnali intracellulari attivata come risultato di cellule CD4 + T interazione con gp120 al VS, le analisi quantitative di immagini TIRF sono fatto per determinare se le molecole di segnalazione intracellulare come Lck e Fyn vengono attivati e reclutati alla sinapsi 15. Qui si descrive un metodo semplice applicabile per analisi più immaginipacchetti applicativi quali ImageJ e Metamorph. Abbiamo usato ImageJ, che gira su Windows, Macintosh e Linux, per il nostro metodo here 12.
Nel Analizza> Imposta scheda Misurazioni, seleziona le caselle di Area e il valore medio grigio. Quando si effettua una regione di interesse sull'immagine che è un poligono o un tracciato a mano libera forma chiusa e non Misura Analizza>, il software metterà i dati di questa misura in una tabella dei risultati. L'area sarà in numero di pixel o in um 2. La media è l'intensità media in unità arbitrarie. Deve avere intensità sfondo sottratto. Moltiplicando il sfondo media meno dalla zona restituisce l'intensità integrata della proteina in unità arbitrarie.
- Impostare le misure di intendere e Area.
- Aprire le immagini per una condizione sperimentale.
- Per ogni cella, tracciare e misurare la regione di interesse (media) e tracciare e misurare una regione al di fuori della regione di interesse (background).
- Quando avete finito con una condizione sperimentale, sia misure di copiare e incollare in Excel o altro programma di foglio elettronico o di salvare le misurazioni.
- Tornare al punto 6.2 per ogni condizione sperimentale.
- Quando le misure sono completate, calcolare i risultati. Le formule sono:
Intensità media = media - fondo
Intensità integrata = Superficie media intensità *
7. Risultati rappresentativi
Per misurare l'attivazione e il reclutamento di molecole di segnalazione iniziali membrana-prossimali Lck e Fyn a seguito di interazione con gp120 al VS, primari umani CD4 + cellule T sono stati introdotti sul bistrati recanti gp120 e ICAM-1 15. Cellule introdotte per bistrati con solo ICAM-1 servito come controllo per definire i livelli basali di segnalazione. Spespecifico intensità di fluorescenza è stata misurata nella zona di contatto per gp120 celle di gp120 e ICAM-1 e bistrati contenenti all'interno della zona di contatto per tutta cellule interagiscono con il doppio strato ICAM-1. Un aumento di intensità media di fluorescenza è un segno di aumentata assunzione e l'attivazione della molecola di segnalazione al VS. Questo sarà ulteriormente dimostrato da un aumento analogo nel intensità integrata fluorescenza. Se, tuttavia, non vi è alcun cambiamento nell'intensità di fluorescenza integrato, questo indica una ridistribuzione della molecola di segnalazione.
Dopo che le cellule hanno interagito con doppi strati contenenti gp120 e ICAM-1, totale Lck e pLck (Y394) sono stati reclutati per l'interfaccia VS e colocalized con gp120 (Fig. 1 e 2). L'intensità totale medio di Lck (Fig. 1) era maggiore del doppio strato contenente sia gp120 e ICAM-1 che con ICAM-1 da solo, ma i livelli di intensità integrata (Fig. 1) erano simili, suggerendo che Lck è ridistribuito inun cluster centrale su cellule T CD4 + vincolanti gp120. Tuttavia, quantificazione di pLck (Y394) (Fig. 2) ha mostrato che l'intensità media per gp120 e ICAM-1 bistrati contenenti era superiore a quello sul ICAM-1 bistrati soli, e l'intensità integrata era maggiore in bistrati sia con gp120 e ICAM -1 che su ICAM-1 bistrati sole. Ciò indica che mentre i livelli di Lck totale all'interfaccia sono simili in cellule di aderire su gp120 e ICAM-1 e ICAM-1 bistrati solo, gp120 fosforilazione legame maggiore di residuo Y394 al Lck ansa di attivazione. Al contrario, Fyn non è stato assunto al VS (Fig. 3), come più Fyn era presente nella zona di contatto di celle ICAM-1 bistrati soli che in bistrati contenenti sia gp120 e ICAM-1. Di conseguenza, concludiamo che non Lck, Fyn, la chinasi è attivo nella HIV-1 gp120 indotta VS.
Figure: membrana-prossimale segnalazione a HIV-1 gp120 indotta VS. Immagini di cellule rappresentative sulgp120 + ICAM-1 doppio strato (pannelli superiori) e l'ICAM-1 doppio strato (pannelli inferiori) sono mostrati. Intensità di fluorescenza delle cellule singole sono stati quantificati in aree manualmente tracciate delle impronte cella come illustrato dalla regione contrassegnata con la linea gialla in figura 1. Quantificazione di intensità media e integrato rilevati mediante microscopia TIRF sono presentati nei grafici sinistro e destro, rispettivamente. Un totale di 30 a 350 cellule sono state quantificate per ogni condizione. Bar = 5 micron. I dati da uno dei tre esperimenti sono mostrati ripetizione.
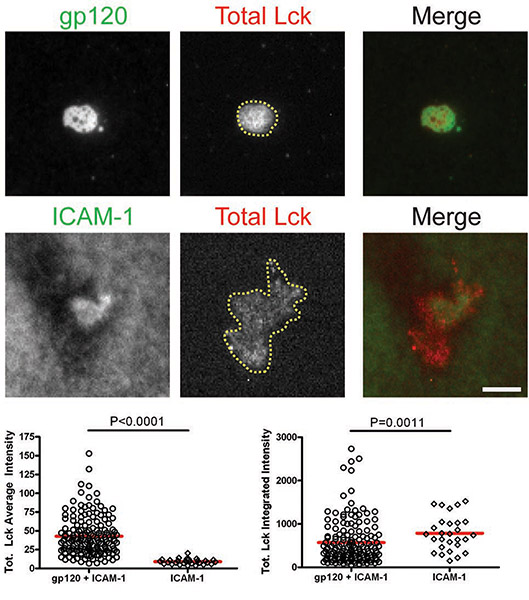
CD4 Figura 1. + Cellule T sono stati introdotti sul bistrati contenenti gp120 e ICAM-1 o ICAM-1 solo per 45 min e poi fissate e colorate per totale Lck.

CD4 Figura 2. + Cellule T sono state introdotte sul doppio stratos contenente gp120 e ICAM-1 o ICAM-1 solo per 45 min e poi fissate e colorate per pLck (Y394).
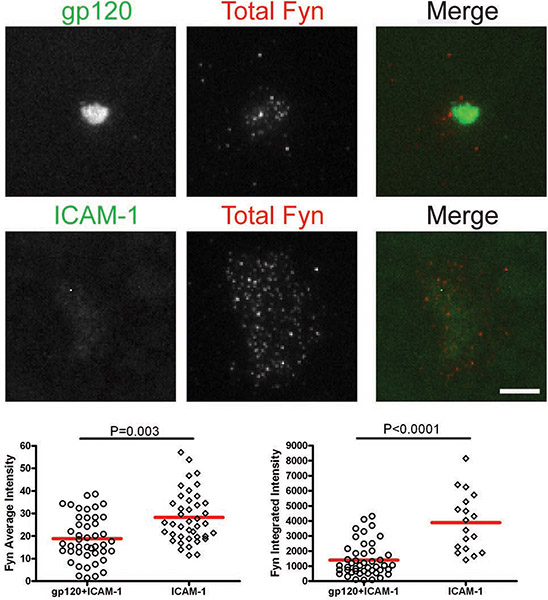
CD4 Figura 3. + Cellule T sono stati introdotti sul bistrati contenenti gp120 e ICAM-1 o ICAM-1 solo per 45 min e poi fissate e colorate per Fyn totale.
Discussione
Studi precedenti hanno VS visualizzato nella cellula-cellula sistema coniugato, tuttavia questi studi non hanno fornire immagini di alta risoluzione sufficiente per visualizzare le strutture supramolecolari alla sinapsi. Nel nostro laboratorio, abbiamo utilizzato il vetro supportato sistema bistrato planare per rappresentare la superficie di cellule infettate esprimono gp120 il virus e la molecola di adesione cellulare ICAM-1. In combinazione con la microscopia TIRF, che rileva segnali di fluorescenza entro 100-200 nm dalla superficie doppio strato con un alto rapporto segnale-rumore, siamo stati in grado di rilevare la segregazione supramolecolare di gp120 da ICAM-1 a VS. Inoltre, il metodo immunostaining standard può essere applicato al sistema doppio strato ed è stato usato qui per rilevare e quantificare il reclutamento specifico di Lck attivo, ma non Fyn, la gp120-area di contatto a VS 15. Quindi, il bistrato planare offre un sistema sperimentale per immagini ad alta risoluzione dell'interfaccia sinapsi in un piano 2D TIRF microscopia, così come i metodi di illuminazione a largo campo o confocale. Tuttavia, il sistema presenta anche limitazioni regolazione mobilità ligando, fuori piano di piegatura, e le fluttuazioni di membrane biologiche non riprodotta da doppi strati planari. Inoltre, questo è un sistema in-vitro e quindi ha limitazioni, quali la mancanza di altre molecole di membrana che sarebbe presente in una cellula infettata e la macchina citoscheletro che regola la mobilità molecolare e la motilità cellulare. Inoltre, la dinamica e la distribuzione delle molecole, come trimeri rispetto monomeri di gp120, non può essere rappresentato fisiologicamente sul doppio strato. Tuttavia, anche con queste limitazioni, questo sistema è ancora molto utile per studiare virus-cellula o interazioni cellula-cellula, e questi metodi possono servire come guida utile per i ricercatori che ricercano immagini ad alta risoluzione per rilevare organizzazione supramolecolare che non è distinguibile nel convenzionale cellula-cellula sistema coniugato.
Divulgazioni
Gli autori dichiarano assenza di conflitto di interessi.
Riconoscimenti
Questo lavoro è stato supportato da sovvenzioni NIH AI071815 (CEH) e la tabella di marcia Nanomedicina premio Development Center PN2EY016586 (MLD).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| Il suo tag HIV gp120 | Regalo da Dr. Cho | DH12 | |
| Il suo tag HIV gp120 | Tecnologia Immune | Vari X4 o R5 tropico | |
| HSA | Williams Medical Company | 521302 | Albumina di siero umano al 25% |
| Amicon Filtri ultracentrifugo | Millipore | UFC803024 | Ultracel-30K |
| Lck Coniglio mAb | Segnalazione cellulare | 2787 | |
| p-Lck Coniglio pab | Santa Cruz Biotechnology Inc. | Sc-101728 | Tyr 394 |
| Fyn Coniglio mAb | Millipore | 04-353 | |
| Alexa Fluor 568 2 °; Ab | Molecular Probes | A11034 | Capra anti-coniglio IgG (H + L) |
| Alexa Fluor 488 | Molecular Probes | A-20000 | carbossilico succinimmidil estere |
| FCS2 Camera | Bioptechs | 060319-2-03 | |
| Microaqueduct diapositive | Bioptechs | 130119-5 | |
| 30 millimetri rotonda w / fori | Bioptechs | 1907-08-750 | 0,75 millimetri di spessore |
| Rettangolo Guarnizione | Bioptechs | 1907-1422-250 | 14x24 0,25 millimetri di spessore |
| Tygon Tubing | Bioptechs | 20202275 | 1/16 "(25 piedi) |
| Valvola a tre vie | BioRad | 7328103 | |
| Rubinetto a due vie | BioRad | 7328102 | |
| Presentazione Sticky I 0,2 Luer | Ibidi | 80168 | |
| Coprire gli occhiali | Ibidi | 10812 | |
| Siringa da 1 ml | BD | 309659 | |
| CANI-NTA | Avanti Polar Lipids | 790404C | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Vetrino coprioggetto | Bioptechs | 40-1313-0319 | 40 millimetri |
| TIRF microscopio | Nikon | ||
| ImageJ | National Institutes of Health | http://rsbweb.nih.gov/ij/~~V |
Riferimenti
- Bastiani, L., Laal, S., Kim, M., Zolla-Pazner, S. Host cell-dependent alterations in envelope components of human immunodeficiency virus type 1 virions. J. Virol. 71, 3444-3450 (1997).
- Dimitrov, D. S., Willey, R. L., Sato, H., Chang, L. J., Blumenthal, R., Martin, M. A. Quantitation of human immunodeficiency virus type 1 infection kinetics. J. Virol. 67, 2182-2190 (1993).
- Dustin, M. L. Adhesive Bond Dynamics in Contacts between T Lymphocytes and Glass-supported Planar Bilayers Reconstituted with the Immunoglobulin-related Adhesion Molecule CD58. J. Biol. Chem. 272, 15782-15788 (1997).
- Fortin, J. F., Cantin, R., Lamontagne, G., Tremblay, M. Host-derived ICAM-1 glycoproteins incorporated on human immunodeficiency virus type 1 are biologically active and enhance viral infectivity. J. Virol. 71, 3588-3596 (1997).
- Frank, I., Stoiber, H., Godar, S., Stockinger, H., Steindl, F., Katinger, H. W., Dierich, M. P. Acquisition of host cell-surface-derived molecules by HIV-1. Aids. 10, 1611-1620 (1996).
- Hioe, C. E., Bastiani, L., Hildreth, J. E., Zolla-Pazner, S. Role of cellular adhesion molecules in HIV type 1 infection and their impact on virus neutralization. AIDS Res. Hum. Retroviruses. 14, Suppl 3. S247-S254 (1998).
- Hioe, C. E., Chien, P. C., Lu, C., Springer, T. A., Wang, X. H., Bandres, J., Tuen, M. LFA-1 expression on target cells promotes human immunodeficiency virus type 1 infection and transmission. J. Virol. 75, 1077-1082 (2001).
- Jolly, C., Kashefi, K., Hollinshead, M., Sattentau, Q. J. HIV-1 cell to cell transfer across an Env-induced, actin-dependent synapse. J. Exp. Med. 199, 283-293 (2004).
- Jolly, C., Mitar, I., Sattentau, Q. J. Requirement for an intact T-cell actin and tubulin cytoskeleton for efficient assembly and spread of human immunodeficiency virus type 1. J. Virol. 81, 5547-5560 (2007).
- McDonald, D., Wu, L., Bohks, S. M., KewalRamani, V. N., Unutmaz, D., Hope, T. J. Recruitment of HIV and its receptors to dendritic cell-T cell junctions. Science. 300, 1295-1297 (2003).
- Pearce-Pratt, R., Malamud, D., Phillips, D. M. Role of the cytoskeleton in cell-to-cell transmission of human immunodeficiency virus. J. Virol. , 682898-682905 (1994).
- Rasband, W. S. ImageJ. , National Institutes of Health. Bethesda, Maryland, USA. (1997).
- Rizzuto, C. D., Sodroski, J. G. Contribution of virion ICAM-1 to human immunodeficiency virus infectivity and sensitivity to neutralization. J. Virol. 71, 4847-4851 (1997).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Vasiliver-Shamis, G., Cho, M. W., Hioe, C. E., Dustin, M. L. Human immunodeficiency virus type 1 envelope gp120-induced partial T-cell receptor signaling creates an F-actin-depleted zone in the virological synapse. J. Virol. 83, 11341-11355 (2009).
- Vasiliver-Shamis, G., Tuen, M., Wu, T., Starr, T., Cameron, T., Thomson, R., Kaur, G., Liu, J., Visciano, M., Li, H., Kumar, R., Ansari, R., Han, D., Cho, M., Dustin, M. L., Hioe, C. E. Human immunodeficiency virus type 1 envelope gp120 induces a stop signal and virological synapse formation in noninfected CD4+ T cells. J. Virol. 82, 9445-9457 (2008).
- Zhu, P., Liu, J., Bess, J., Chertova, E., Lifson, J., Grise, H., Ofek, G., Taylor, K., Roux, K. Distribution and three-dimensional structure of AIDS virus envelope spikes. Nature. 441, 847-852 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon