Method Article
Imagen del VIH-1 sobre inducida sinapsis virológica y señalización en la bicapa lipídica sintéticas
* Estos autores han contribuido por igual
En este artículo
Resumen
En este artículo se describe un método para visualizar la formación de una sinapsis virológica de VIH-1 sobre de cristal inducido por el apoyo bicapas planas de reflexión total interna de fluorescencia (TIRF) microscopía. El método también se puede combinar con la tinción de inmunofluorescencia para detectar la activación y la redistribución de las moléculas de señalización que se producen durante el VIH-1 sobre inducida por la formación de sinapsis virológicas.
Resumen
Virus de inmunodeficiencia humana tipo 1 (VIH-1) la infección se produce más eficientemente a través de célula a célula de transmisión 2,10,11. Esta célula a célula de transferencia entre células T CD4 + implica la formación de una sinapsis virológica (VS), que es un F-actina dependiente de célula-célula unión formada sobre el compromiso de VIH-1 sobre la gp120 en la célula infectada con CD4 y el receptor de quimioquinas (CKR) CCR5 o CXCR4 en la célula diana 8. Además de la gp120 y sus receptores, otras proteínas de membrana, en particular la molécula de adhesión de LFA-1 y sus ligandos, la familia ICAM, juegan un papel importante en la formación de VS y la transmisión del virus, ya que están presentes en la superficie de las células del donante infectadas por virus y las células diana, así como sobre la envoltura de VIH-1 viriones 1,4,5,6,7,13. VS formación también es acompañada por eventos de señalización intracelulares que se transducen como resultado de la gp120-compromiso de sus receptores. De hecho, recientemente hemos mostraron que las células CD4 <sup> + la interacción de las células T con gp120 induce el reclutamiento y la fosforilación de moléculas de señalización asociadas a la signalosome TCR como Lck, CD3, ZAP70, LAT, SLP-76, ITK, y 15 PLCγ.
En este artículo se presenta un método para visualizar acuerdo supramolecular y proximal a la membrana señalización de eventos que tienen lugar durante la formación de VS. Tomamos ventaja del vidrio-apoyado plana bi-capa del sistema como un modelo reduccionista para representar la superficie de células infectadas por VIH que lleven la envoltura viral gp120 y la molécula de adhesión celular ICAM-1. El protocolo describe los procedimientos generales para el seguimiento de la gp120 del VIH-1 inducida por VS montaje y eventos de la señal de activación que incluyen i) bi-capa de preparación y montaje en una celda de flujo, ii) la inyección de las células y la tinción de inmunofluorescencia para la detección de moléculas de señalización intracelular en las células que interactúan con el VIH-1 de adquisición de imágenes gp120 y la ICAM-1 en bi-capas, iii) por microscopía TIRF, unnd iv) el análisis de datos. Este sistema genera imágenes de alta resolución de la interfaz de VS más allá de lo logrado con el convencional de células-células del sistema ya que permite la detección de distintos grupos de los distintos componentes moleculares de VS, junto con las moléculas de señalización específicos de contratación de estos sub-dominios.
Protocolo
1. Etiquetado GP120
Los tintes fluorescentes utilizados en este protocolo son eficaces para la unión a las proteínas, son lo suficientemente estable para la foto-imagen de microscopía, y coinciden con las longitudes de onda de excitación de los láseres disponibles con nuestro microscopio. Estos tres criterios deben cumplirse la hora de seleccionar moléculas fluorescentes para las proteínas de marcado.
- Cambio de 6-Su etiquetados gp120 DH12 (un regalo del doctor Michael Cho, Universidad Estatal de Iowa) tampón de proteínas de PBS estéril utilizando una unidad centrífuga de filtro (30 kDa MWCO). Asegúrese gp120 concentración no es más de 1 mg / ml. Nota: 6-Su etiquetados proteínas gp120 de otras cepas X4 o R5 trópico también se han probado y están ahora disponibles comercialmente a partir de las tecnologías inmunes.
- Añadir bicarbonato de sodio pH 9,0 a la solución de proteína para obtener la concentración final de 50 mM de bicarbonato de sodio con un pH ~ 8,5.
- Añadir amina reactiva Alexa Fluor 488 (AF488) tinte fluorescente, que es dissolved en agua a un exceso molar de 10 veces. Incubar la mezcla durante 1-2 horas a temperatura ambiente en la oscuridad.
- Para eliminar el exceso de tinte, utilizar la unidad de filtro centrífugo como antes y añadir fresco PBS estéril a la columna. Repita este paso hasta que todo el colorante libre es eliminado (3-4 lavados con 4 ml de PBS). Girar hacia abajo hasta que la gp120 se concentró a aproximadamente 1 mg / ml. Nota: Extracción de tinte libre mediante diálisis o unidad de filtro centrífugo sólo funciona si el colorante es soluble en agua, o bien filtración en gel puede ser utilizado.
- Para medir la intensidad de fluorescencia por molécula de proteína (F / P) de la proteína marcada, determinar las concentraciones (en micras) del colorante fluorescente a la longitud de onda adecuada (por ejemplo, a 488 nm para AlexaFluor 488) y proteína (se utiliza un espectrofotómetro NanoDrop utilizando las etiquetas de las proteínas y de configuración) y luego dividir estos dos números que le dan la razón F / P. El mismo procedimiento se utiliza para otras proteínas y colorantes tales como la ICAM-1 y Cy5. Nota: Otros tipos de spectrophotometers puede ser utilizado para obtener la concentración de proteína y la concentración de colorante fluorescente para obtener la razón F / P si un NanoDrop no está disponible.
2. Flujo de la Asamblea de la célula y preparación de bicapa
El procedimiento general para la celda de flujo y la preparación bicapa se ha descrito en detalle previamente 14. Aquí resumimos en concreto el protocolo para preparar bicapas que contienen 6-Su etiquetados gp120 DH12 en una celda de flujo Bioptech. Para los estudios que implican virus infecciosos o células infectadas y cuando los volúmenes pequeños son necesarios debido a los reactivos limitados, una cámara desechable ibidi flujo (diapositiva pegajosa que 0,2 Luer) puede ser usada y seguido con el mismo procedimiento de preparación bi-capa en los pasos 2.4-2.9. Información para cámaras de flujo ibidi se puede obtener de la página web de la compañía, http://www.ibidi.com/service/display_material/CA_8p_EN_150dpi.pdf .
- Preparar una solución Pirhana (45 ml de ácido sulfúrico (Grado de seguimiento de metal 98%) y 15 ml de 30% de peróxido de hidrógeno) 14. Con las abrazaderas de plástico, la cubierta se desliza sumergir en la solución Pirhana durante 15 minutos.
- Traslado cubreobjetos a un vaso lleno de pica-agua purificada y lave cada uno con agua corriente durante 2 minutos (un minuto por cada lado). Coloque sobre una rejilla para secar.
- Ensamble Bioptechs FCSII cámaras como se describió previamente 14.
- Una mezcla de liposomas que contiene 12,5% de Ni 2 + lípidos quelantes se utiliza para capturar y presentar su 6-gp120 en la superficie bicapa 16. Añadir 1 l gotas de la mezcla de liposomas en la diapositiva microaqueduct sin tocar la punta de la copa. Para preparar el máximo de 5 bicapas por célula de flujo, repetir hasta 4 veces más por lo que hay cinco puntos 1μl como se muestra anteriormente 14.
- Coloque el cubreobjetos en la parte superior de los lípidos. Cubra el anillo blanco de retención con una cl de acero inoxidableAMP a la unidad de base, dar la vuelta a todo el aparato encima y sellar. Marcar la ubicación de bicapas con un marcador. Incubar durante 10 minutos a temperatura ambiente.
- Fije el tubo con llave de paso de dos vías para tubo de perfusión izquierda, como se muestra en vídeo. Generar un menisco positivo en el extremo del tubo con la llave de paso 3-forma en ella (la tubería ha sido previamente llena con solución salina tamponada con HEPES (HBS) que contenía albúmina de suero humano (HSA) (HBS / HSA: 50 ml de 10x HBS [10x HEPES solución salina tamponada: 200 mM de HEPES, pH 7,2, 1,37 M NaCl, 50 mM KCl, 7 mM de Na 2 HPO 4, 60 mM D-glucosa] 20 ml de 25x HSA, 500 l 1M CaCl 2, 1 ml de 1 M MgCl 2 y dH 2 0 a llevar un volumen total a) y el filtro con 500 ml 0.22μm filtro y está desprovista de burbujas. Conectar la tubería al tubo de perfusión derecha y empuje suavemente tampón a través de la celda de flujo.
- Bloque bicapa con ~ 300 l de caseína que contiene 100 mM NiCl 2 llenando jeringa de 1 ml y unir a la porción abierta de llave de 3 vías. Gentemente a través de empujar el almacenamiento temporal y cerca de dos llaves de paso antes de desactivar la jeringa. Incubar durante 30 min a temperatura ambiente.
- Añadir 6-Su etiquetados AF488 marcado con la gp120 (la concentración se determina como se ha descrito anteriormente en 16). Usamos ~ 250 moléculas de gp120/μm 2 para imitar la densidad local de agrupaciones Env encuentran en la superficie del virión de VIH-1 17. De manera similar, se utiliza ~ 250 moléculas / 2 micras de ICAM-1 en la bicapa de 14 como se informó anteriormente. Cargar en la celda de flujo como se hace con la caseína. Incubar durante 30 minutos en la oscuridad (cubrir con papel de aluminio) a temperatura ambiente. El mismo procedimiento se utiliza para incorporar otras proteínas tales como Su 12-etiquetados Cy5 marcado ICAM-1 sobre la bicapa.
- Lavar bicapas con 5 ml de tampón.
3. Control de Calidad a través de bicapas FRAP
Las proteínas en bicapas debe ser lateralmente difusible. Antes de añadir las células en bicapas, es importante para asegurar elmovilidad de las proteínas en la bicapa preparada. Aquí se describe una recuperación fluorescente después de photobleaching (FRAP) el método 3, que se puede realizar de forma manual en la mayoría de objetivos iluminados TIRF, epifluorescencia amplio campo, o de escaneo láser confocal de microscopios. El objetivo es campos de imagen completamente uniformes de fluorescencia en la bicapa lipídica, lejía un punto, y para supervisar el retorno de las moléculas de templar a la zona blanqueada. Una recuperación de 50% en 2 minutos puede ser aceptable. Todos los fabricantes principales de microscopio (Leica, Nikon, Olympus, Zeiss) vender sistemas objetivos TIRF sistema de iluminación que funcionan bien para esta aplicación. Aunque cada compañía proporciona variaciones de iluminación TIRF y otras características operativas, la calidad de imagen es esencialmente el mismo.
- Utilizar una intensidad de excitación baja para minimizar la decoloración. Utilice un objetivo de alta apertura numérica NA como un 1,3 a 1,45 60x 40x o 100x. Cuando se utiliza un microscopio fluorescente estándar o TIRF, para reducir los intens luzdad, poner filtros de densidad neutra en el camino de la luz de excitación. La mayoría de los sistemas de láser se puede establecer para la iluminación de baja mediante el establecimiento de un acusto óptico sintonizable filtro (AOTF) o acusto óptico divisor de haz (AOBS) con bajo voltaje.
- Grabar un "pre-blanqueo" de la imagen. Si se utiliza una cámara CCD enfriado, para compensar la luz bajo condiciones binning se puede establecer en 2x2 ó 4x4, la ganancia se puede establecer altas exposiciones, o largo (por ejemplo del orden de segundos) se pueden utilizar. Si se utiliza un confocal, la abertura del agujero de alfiler puede ser abierto, la ganancia de inserción alta, y la exploración lenta o promedio utilizado.
- Bleach un punto. Si se utiliza una fluorescencia estándar o un microscopio TIRF, eliminar todos los filtros ND para permitir la máxima intensidad de iluminación, cerrar el diafragma de campo, y exponer la muestra durante unos pocos segundos. Si se utiliza un láser confocal de barrido, establecer la máxima potencia del láser y el zoom en aproximadamente 4x a 8x para blanquear una mancha. Una advertencia para el uso confocal: no acercar demasiado alto debido a la doble capa puede ser dañada por exceexclusivamente concentrado fotones.
- En diez o quince segundos de intervalo, grabar imágenes con la misma iluminación y la configuración de grabación como en 3.1 y 3.2. Dentro de dos o tres minutos el lugar se recuperará la intensidad próxima a la de la "pre-blanqueo" de la imagen. La recuperación rápida es el signo de una bicapa de móviles con éxito. Si la mancha permanece oscura, y especialmente si el borde retiene un alto contraste, las proteínas fluorescentes son inmóviles en la bicapa y no debe ser utilizado para el experimento.
Nota: En nuestro microscopio actual, podemos entregar 0,9 mW de 641 nm de luz a una mancha circular con una superficie de 240 m 2, que blanquea ICAM fluorescente en las concentraciones típicas en menos de 4 segundos. Los lectores deben encontrar que la alineación crítica de una lámpara de Hg o Xe con blanqueo veces menos de 30 segundos es más que suficiente para realizar este ensayo en una forma repetible. También nos refieren que para hacer referencia a 3 para más detaflige.
4. La inyección de células y tinción de inmunofluorescencia
- Calentar la celda de flujo a 37 ° C (esto puede hacerse en una incubadora a 37 ° C sin CO 2 durante aproximadamente 30 min).
- Añadir activados CD4 + células T humanas (2-5x10 6 / flujo de células) en HBS / HSA ~ 400 l con una jeringa de 1 ml. Vamos a adherirse a las células de doble capa de ~ 45 minutos en el incubador a 37 ° C. Si las cámaras se utilizan ibidi, el suministro de amortiguación adicional cada 15-20 minutos.
- Fijar las células mediante la inyección de paraformaldehído al 2% e incubar durante 10 minutos a 37 ° C.
- Lave 3 veces con 1 ml de buffer de la temperatura ambiente PBS. Permeabilizar las células mediante la inyección de 0,1% de Triton X-100 durante 5 min a temperatura ambiente.
- Lave 3 veces con 1 ml de tampón PBS a temperatura ambiente (cuando el sondeo de proteínas fosforiladas, puede agregar vanadato de sodio a una concentración final de 1 mM u otro inhibidor de la fosfatasa en PBS para evitar la extracción de fosfato durante el procesamiento). Bloque utilizando caseína con suero de cabra al 5% para25 minutos a temperatura ambiente. El tipo de suero animal depende del anticuerpo secundario.
- Lave 3 veces con 1 ml de buffer de la temperatura ambiente PBS. Añadir el anticuerpo primario en ~ 300 l de tampón / flujo de células durante 30 minutos - 1 hora a temperatura ambiente. Para detectar la primera membrana proximal señal de activación, se utiliza anticuerpos específicos para fosforilados Lck (pLck), el total de Lck o de Fionia.
- Lave 3 veces con 1 ml de buffer de la temperatura ambiente PBS. Añadir apropiado anticuerpo secundario marcado con fluorescencia en tampón como se hace con el anticuerpo primario. Para nuestros experimentos, se utiliza Alexa Fluor 568-etiquetados de cabra anti-conejo secundaria. Incubar durante 20 min a temperatura ambiente. Lave 3 veces con 1 ml de solución tampón PBS.
- Nota: Es esencial disponer de una bicapa de control que se trata con sólo anticuerpo secundario (sin anticuerpo primario). Siga los pasos 4.1-4.5 y 4.6 de salto, y luego continúe con el paso 4.7. Esto determinará el nivel de la unión no específica de su anticuerpo secundario. Alternativamente, se puede utilizar directamente etiquetaed anticuerpos primarios.
5. Adquisición de imagen por microscopía TIRF
Microscopía TIRF permite la excitación de las señales fluorescentes limitados a unos 250 nm o más delgado plano en el sustrato de vidrio y la interfaz de la célula. Esto garantiza la adquisición de imágenes de únicamente las señales de la bicapa de lípido y de las membranas celulares inmediatamente aposición. Por lo tanto, sólo las moléculas en la sinapsis se va a ver. Como las imágenes TIRF sólo el área de membrana proximal en la parte inferior de la célula, las proteínas que están internalizados o redistribuido en la membrana dorsal no será detectado. A continuación, puede ser importante para adquirir imágenes adicionalmente por la norma campo amplio o microscopía confocal para determinar la acumulación o la distribución de las proteínas en la zona sináptica en comparación con los otros volúmenes de la célula.
Todos los fabricantes principales de microscopio (Leica, Nikon, Olympus, Zeiss) vender sistemas objetivos TIRF sistema de iluminación que funcionan bien para este punto de accesocación. Aunque cada compañía proporciona variaciones de iluminación TIRF y otras características operativas, la calidad de imagen es esencialmente el mismo. Cada microscopio TIRF tiene sus propios detalles de la operación, pero las reglas generales siguientes se aplican para obtener imágenes de alta resolución.
- La iluminación debe ser baja para evitar la decoloración.
- La cámara debe tener una respuesta lineal.
- La cámara debe ser capaz de obtener imágenes un amplio rango dinámico sin saturación.
- Todos los valores deben configurarse constante para los análisis cuantitativos.
6. Análisis de Datos
Para el estudio de las señales intracelulares activadas como resultado de la interacción de CD4 + células T con gp120 en la VS, los análisis cuantitativos de las imágenes TIRF se realizan para determinar si o no las moléculas de señalización intracelular como Lck y Fyn se activan y se contrató a la sinapsis 15. A continuación se describe un método sencillo de aplicar, para el análisis de la mayor parte de la imagenpaquetes de aplicaciones tales como ImageJ y Metamorph. Hemos utilizado ImageJ, que se ejecuta en Windows, Macintosh y Linux, para nuestro método aquí 12.
En el Análisis Conjunto> Medidas pestaña, seleccione las casillas de Área y el valor medio gris. Cuando usted hace una región de interés en la imagen que es un polígono o un trazado a mano alzada la forma cerrada y no Analizar Medida>, el software pondrá los datos de esta medida en una tabla de resultados. El área será en número de píxeles o en m 2. La media es la intensidad media en unidades arbitrarias. Se debe tener intensidad de fondo restado de ella. Multiplicando el fondo menos media por área devuelve la intensidad integrada de la proteína en unidades arbitrarias.
- Establecer las medidas para la media y la zona.
- Abra las imágenes de una condición experimental.
- Para cada celda, rastrear y medir la región de interés (media) y rastrear y medir una región fuera de la región de interés (al fondo).
- Cuando se hace con una condición experimental, ya sea en las mediciones de copiar y pegar en Excel o un programa de hoja de cálculo o guardar las mediciones.
- Vuelva al paso 6.2 para cada condición experimental.
- Cuando las mediciones se han completado, el cálculo de los resultados. Las fórmulas son las siguientes:
Intensidad media = media - de fondo
La intensidad media de la zona integrada = * la intensidad
7. Los resultados representativos
Para medir la activación y el reclutamiento de las iniciales proximales membrana moléculas de señalización Lck y Fyn como un resultado de la interacción con gp120 en el VS, primarios CD4 + células T humanas se introdujeron en bicapas que lleven la gp120 y la ICAM 1-15. Las células introducidas en bicapas con sólo la ICAM-1 sirvió como un control para definir los niveles basales de señalización. Speintensidad de fluorescencia específica se midió dentro del área de contacto para la gp120 células en gp120 y de ICAM-1 que contienen bicapas y dentro del área de contacto conjunto para las células que interactúan con la ICAM-1 bicapa. Un aumento de la intensidad de fluorescencia media es una señal de aumentada reclutamiento y activación de la molécula de señalización a los SV. Esto se demostró además por un incremento comparable en la intensidad de fluorescencia integrado. Si sin embargo, no hay cambio en la intensidad de fluorescencia integrado, esto indica una redistribución de la molécula de señalización.
Después de las células interactúan con bicapas que contienen gp120 e ICAM-1, el total de Lck y pLck (Y394) fueron reclutados para la interfaz VS y colocalized con gp120 (Figuras 1 y 2). La intensidad media del total Lck (fig. 1) fue mayor en la bicapa que contiene tanto la gp120 y la ICAM-1 que con ICAM-1 solo, pero los niveles de intensidad integrados (Fig. 1) fueron similares, lo que sugiere que Lck se redistribuye enun grupo central sobre células T CD4 + de unión a la gp120. Sin embargo, la cuantificación de pLck (Y394) (fig. 2) mostró que la intensidad media en gp120 y de ICAM-1 que contienen bicapas fue mayor que en ICAM-1 bicapas solos, y la intensidad integrada fue mayor en bicapas tanto con gp120 y la ICAM -1 que en ICAM-1 bicapas solos. Esto indica que mientras que los niveles totales de Lck en la interfaz son similares en las células adherirse a la gp120 y la ICAM-1 e ICAM-1 bicapas solas, la gp120 de fosforilación de unión mayor de residuo Y394 en la Lck activación de bucle. En contraste, Fionia no fue reclutado a los SV (fig. 3), como más Fionia estaba presente en el área de contacto de las células sobre ICAM-1 bicapas solo que en bicapas que contienen tanto la gp120 y la ICAM-1. Por consiguiente, se concluye que no Lck, Fionia, es la quinasa activa en la gp120 del VIH-1 inducida por VS.
Figuras: Membrana-proximal de señalización a la gp120 del VIH-1 inducida por VS. Las imágenes de células representativas de la+ gp120 ICAM-1 de dos capas (paneles superiores) y la ICAM-1 de dos capas (paneles inferiores) se muestran. Intensidades de fluorescencia de las células individuales se cuantificaron dentro de las áreas manualmente trazados de las huellas de células como se ilustra por la región marcada con la línea amarilla en la Figura 1. Cuantificación de las intensidades medias e integrado detectados por microscopía TIRF se presentan en los gráficos izquierdo y derecho, respectivamente. Un total de 30 a 350 células fueron cuantificados para cada condición. Bares = 5 m. Los datos de uno de los tres experimentos repetidos se muestran.
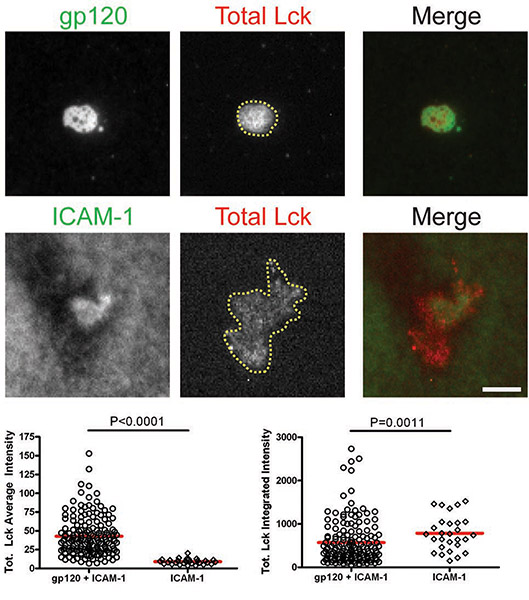
CD4 Figura 1. + Células T se introdujeron en bicapas que contienen gp120 y la ICAM-1 o ICAM 1-solo durante 45 minutos y luego se fijaron y se tiñeron para el total de Lck.

CD4 Figura 2. + Células T se ha introducido en bicapas contiene gp120 e ICAM-1 o ICAM 1-solo durante 45 minutos y luego fijadas y teñidas por pLck (Y394).
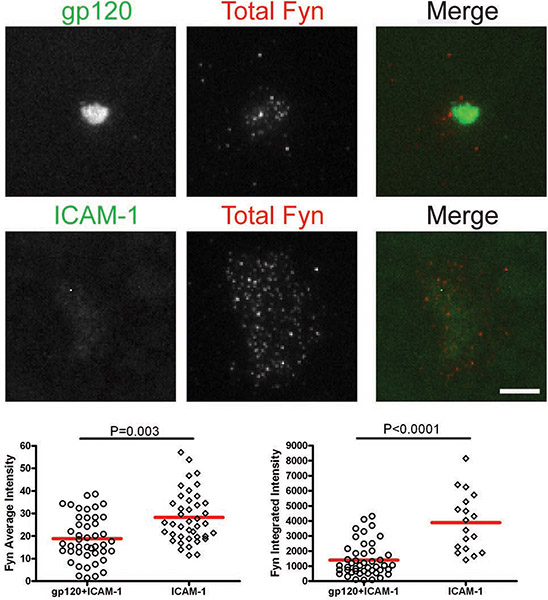
CD4 Figura 3. + Células T se introdujeron en bicapas que contienen gp120 y la ICAM-1 o ICAM 1-solo durante 45 minutos y luego se fijaron y se tiñeron para Fionia total.
Discusión
Estudios previos han VS visualizan en el sistema conjugado célula-célula, sin embargo estos estudios no proporcionan imágenes de alta resolución para visualizar las estructuras supramoleculares en la sinapsis. En nuestro laboratorio, se utilizó el vidrio apoyada sistema bicapa plana para representar la superficie de las células infectadas que expresan la gp120 envoltura del virus y la molécula de adhesión celular ICAM-1. En conjunción con microscopía TIRF, que detecta las señales de fluorescencia dentro de 100-200 nm desde la superficie del bicapa con una alta relación señal-ruido, hemos sido capaces de detectar la segregación supramolecular de la gp120 de la ICAM-1 en el VS. Además, el método estándar de inmunotinción puede aplicarse al sistema bicapa y se utiliza aquí para detectar y cuantificar la contratación específica de sesión Lck, pero no Fionia, a la zona de contacto en la gp120-SV 15. Por lo tanto, la bicapa plana ofrece un sistema experimental para imágenes de alta resolución de la interfaz de sinapsis en un plano 2D TIRF microscopia, así como los métodos de iluminación de campo amplio o confocal. Sin embargo, el sistema también tiene limitaciones como el ajuste de la movilidad ligando, fuera del plano de flexión, y las fluctuaciones de las membranas biológicas no se reproducen por bicapas planas. Además, este es un sistema in vitro y por lo tanto tiene otras limitaciones, tales como la falta de otras moléculas de la membrana que estarían presentes en una célula infectada y la maquinaria citoesqueleto que regula la movilidad molecular y la motilidad celular. Además, la dinámica y la distribución de las moléculas, tales como trímeros frente a monómeros de gp120, no podrán estar representados fisiológicamente en la bicapa. Sin embargo, aun con estas limitaciones, este sistema sigue siendo muy valiosa para el estudio del virus de las células o las interacciones célula-célula, y estos métodos pueden servir como una guía útil para los investigadores que están buscando imágenes de alta resolución para detectar la organización supramolecular que no es discernible en el sistema conjugado convencional célula-célula.
Divulgaciones
Los autores declaran no tener conflicto de intereses.
Agradecimientos
Este trabajo fue apoyado por subvenciones del NIH AI071815 (CEH) y el Premio al Desarrollo de Nanomedicina Hoja de Ruta Centro PN2EY016586 (MLD).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Su etiquetados gp120 del VIH | Regalo del Dr. Cho | DH12 | |
| Su etiquetados gp120 del VIH | Tecnología Inmune | Varios X4 o R5 trópico | |
| HSA | Williams Medical Company | 521302 | Albúmina sérica humana al 25% |
| Amicon centrífugas Filtros Ultra | Millipore | UFC803024 | Ultracel-30K |
| Lck Conejo MAB | Señalización Celular | 2787 | |
| p-Lck Rabbit pAb | Santa Cruz Biotechnology Inc. | Sc-101728 | Tyr 394 |
| Fionia Conejo MAB | Millipore | 04-353 | |
| Alexa Fluor 568 2 °; Ab | Molecular Probes | A11034 | De cabra anti-conejo IgG (H + L) |
| Alexa Fluor 488 | Molecular Probes | Una-20000 | carboxílico succinimidil éster |
| FCS2 Cámara | Bioptechs | 060319-2-03 | |
| Microaqueduct Slide | Bioptechs | 130119-5 | |
| 30mm Redonda w / agujeros | Bioptechs | 1907-08-750 | 0,75 mm de espesor |
| Rectángulo Junta | Bioptechs | 1907-1422-250 | 0,25 mm de espesor 14x24 |
| Tubo Tygon | Bioptechs | 20202275 | 1/16 "(25 pies) |
| Llave de tres vías | BioRad | 7328103 | |
| Llave de paso de dos vías | BioRad | 7328102 | |
| Slide Sticky E 0.2 Luer | Ibidi | 80168 | |
| Cubreobjetos | Ibidi | 10812 | |
| Jeringa 1ml | BD | 309659 | |
| PERROS-NTA | Avanti Polar Lipids | 790404C | |
| DOPC | Avanti Polar Lipids | 850375C | |
| Cubreobjetos | Bioptechs | 40-1313-0319 | 40mm |
| TIRF microscopio | Nikon | ||
| ImageJ | Los Institutos Nacionales de Salud | http://rsbweb.nih.gov/ij/~~V |
Referencias
- Bastiani, L., Laal, S., Kim, M., Zolla-Pazner, S. Host cell-dependent alterations in envelope components of human immunodeficiency virus type 1 virions. J. Virol. 71, 3444-3450 (1997).
- Dimitrov, D. S., Willey, R. L., Sato, H., Chang, L. J., Blumenthal, R., Martin, M. A. Quantitation of human immunodeficiency virus type 1 infection kinetics. J. Virol. 67, 2182-2190 (1993).
- Dustin, M. L. Adhesive Bond Dynamics in Contacts between T Lymphocytes and Glass-supported Planar Bilayers Reconstituted with the Immunoglobulin-related Adhesion Molecule CD58. J. Biol. Chem. 272, 15782-15788 (1997).
- Fortin, J. F., Cantin, R., Lamontagne, G., Tremblay, M. Host-derived ICAM-1 glycoproteins incorporated on human immunodeficiency virus type 1 are biologically active and enhance viral infectivity. J. Virol. 71, 3588-3596 (1997).
- Frank, I., Stoiber, H., Godar, S., Stockinger, H., Steindl, F., Katinger, H. W., Dierich, M. P. Acquisition of host cell-surface-derived molecules by HIV-1. Aids. 10, 1611-1620 (1996).
- Hioe, C. E., Bastiani, L., Hildreth, J. E., Zolla-Pazner, S. Role of cellular adhesion molecules in HIV type 1 infection and their impact on virus neutralization. AIDS Res. Hum. Retroviruses. 14, S247-S254 (1998).
- Hioe, C. E., Chien, P. C., Lu, C., Springer, T. A., Wang, X. H., Bandres, J., Tuen, M. LFA-1 expression on target cells promotes human immunodeficiency virus type 1 infection and transmission. J. Virol. 75, 1077-1082 (2001).
- Jolly, C., Kashefi, K., Hollinshead, M., Sattentau, Q. J. HIV-1 cell to cell transfer across an Env-induced, actin-dependent synapse. J. Exp. Med. 199, 283-293 (2004).
- Jolly, C., Mitar, I., Sattentau, Q. J. Requirement for an intact T-cell actin and tubulin cytoskeleton for efficient assembly and spread of human immunodeficiency virus type 1. J. Virol. 81, 5547-5560 (2007).
- McDonald, D., Wu, L., Bohks, S. M., KewalRamani, V. N., Unutmaz, D., Hope, T. J. Recruitment of HIV and its receptors to dendritic cell-T cell junctions. Science. 300, 1295-1297 (2003).
- Pearce-Pratt, R., Malamud, D., Phillips, D. M. Role of the cytoskeleton in cell-to-cell transmission of human immunodeficiency virus. J. Virol. , 682898-682905 (1994).
- Rasband, W. S. . ImageJ. , (1997).
- Rizzuto, C. D., Sodroski, J. G. Contribution of virion ICAM-1 to human immunodeficiency virus infectivity and sensitivity to neutralization. J. Virol. 71, 4847-4851 (1997).
- Vardhana, S., Dustin, M. Supported Planar Bilayers for the Formation of Study of Immunological Synapses and Kinapse. J. Vis. Exp. (19), e947-e947 (2008).
- Vasiliver-Shamis, G., Cho, M. W., Hioe, C. E., Dustin, M. L. Human immunodeficiency virus type 1 envelope gp120-induced partial T-cell receptor signaling creates an F-actin-depleted zone in the virological synapse. J. Virol. 83, 11341-11355 (2009).
- Vasiliver-Shamis, G., Tuen, M., Wu, T., Starr, T., Cameron, T., Thomson, R., Kaur, G., Liu, J., Visciano, M., Li, H., Kumar, R., Ansari, R., Han, D., Cho, M., Dustin, M. L., Hioe, C. E. Human immunodeficiency virus type 1 envelope gp120 induces a stop signal and virological synapse formation in noninfected CD4+ T cells. J. Virol. 82, 9445-9457 (2008).
- Zhu, P., Liu, J., Bess, J., Chertova, E., Lifson, J., Grise, H., Ofek, G., Taylor, K., Roux, K. Distribution and three-dimensional structure of AIDS virus envelope spikes. Nature. 441, 847-852 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados