A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
Nafion הידרופובי מלח, שונה עבור Immobilization האנזים ייצוב
In This Article
Summary
במאמר זה אתאר את הליך סינתזה אנזים שונה hydrophobically Nafion immobilization קרום ואיך לשתק חלבונים ו / או אנזימים בתוך קרום ולבדוק הפעילות הספציפיים שלהם.
Abstract
בעשור האחרון, חלה שפע של אנזימים בקשה ללא יכולת לזוז, התייצב כולל Biocatalysis, biosensors, ותאי דלק ביולוגי. 1-3 ביישומים bioelectrochemical ביותר, אנזימים או האברונים הם משותקים על משטח האלקטרודה עם שימוש של סוג כלשהו של פולימר מטריקס. זה פיגום פולימרי צריך לשמור על האנזימים יציבים ולאפשר דיפוזיה קליל של מולקולות ויונים פנימה והחוצה של מטריקס. רוב פולימרים המשמשים עבור סוג זה של חוסר תנועה מבוססים על פוליאמינים או polyalcohols - פולימרים המחקים את הסביבה הטבעית של האנזימים שהם לתמצת ולייצב את האנזים באמצעות מימן או מליטה יוניים. שיטה נוספת לייצוב אנזימים כרוכה בשימוש micelles, המכילות אזורים הידרופובי שניתן לתמצת לייצב אנזימים. 4,5 בפרט, קבוצת מינטיר פיתחה פולימר micellar מבוסס על Nafion זמינים מסחרית. 6,7 Nafionעצמו הוא פולימר micellar המאפשר דיפוזיה ערוץ בסיוע של פרוטונים קטיונים קטנים אחרים, אבל את micelles וערוצים קטנים מאוד הפולימר הוא חומצי מאוד, בשל שרשרת חומצה sulfonic לוואי, הוא שלילי עבור immobilization האנזים. עם זאת, כאשר Nafion מעורבב עם עודף של הידרופובי מלחי אמוניום אלקיל ברומיד כגון tetrabutylammonium (TBAB), את קטיונים אמוניום הרביעון להחליף את הפרוטונים ולהיות יונים נגד לקבוצות sulfonate על שרשרות פולימר לוואי (איור 1). התוצאה micelles ערוצי גדולים בתוך הפולימר המאפשרים דיפוזיה של מצעים ויונים גדולים הדרושים לתפקוד אנזימטי כגון dinucleotide nicotinamide אדנין (NAD). שונה זה Nafion פולימר נעשה שימוש כדי לשתק הרבה סוגים שונים של אנזימים, כמו גם המיטוכונדריה לשימוש biosensors ותאי דלק ביולוגי. 8-12 מאמר זה מתאר את הליך הרומן עבור ביצוע מיקרופוןellar immobilization פולימרי קרום האנזים שיכול לייצב אנזימים. סינתזה של קרום immobilization micellar האנזים, הליך משתק אנזימים בתוך הקרום, ואת מבחני ללימוד פעילות אנזימטית של אנזים מסוים משותקת מפורטים להלן.
Protocol
1. שינוי של Nafion עם מלחי אמוניום רבעוני
- לנער בקבוק ההשעיה w / v 5% Nafion במרץ על כ. 30 שניות על מנת להבטיח Nafion מושעה אחיד בתמיסה.
- פיפטה את 2 מ"ל של Nafion כעת מחדש על תנאי לתוך בקבוקון זכוכית (נפח הבקבוקון עלולים להכיל מ מ"ל 2.5 מ"ל 10).
- מדד יתר של פי 3 טוחנת (יחסית לקבוצות חומצה sulfonic על פולימר Nafion) של מלח ברומיד אלקיל אמוניום (ההמונים המתאימות מוצגות בטבלה 1) ולהוסיף את זה בקבוקון המכיל 2 מ"ל של Nafion.
- המערבולת בקבוקון בסל"ד 1500 למשך 10-15 דקות.
- יוצקים את הפתרון צמיג למגש פלסטיק במשקל המודד כ. 3 x 3 בו, ולהשתמש פיפטה להעביר כל פתרון שיורית מבקבוקון למגש במשקל.
- אפשר ממיסים את להתאדות מהסירה לשקול, משאיר צהוב / חום, סרט שקוף בתחתית מגש השקילה (Figure 2). קצב אידוי הממס צריך להיות כזה, כי זה לוקח יותר מ 6 שעות כל ממס להתאדות. אם מתאדה ממס מהר מדי, חומר לבן, קרומי יהוו במקום הסרט שקוף המעיד כי המבנה micellar של פולימר נהרס, ואתה צריך להתחיל מחדש את ההליך. אם אידוי הממס הוא איטי מדי, דה אדים עשוי להיות נחוץ, כי איטי מדי של אידוי בדרך כלל מוביל ג'ל, דביק כתום עליך להתחיל מחדש את ההליך. טווחי טמפרטורה אופיינית עבור אידוי ממס הם 20-37 ° C. התנאים בפועל עבור ייבוש הם פונקציה של הטמפרטורה והלחות היחסית בחדר, אבל חשוב להיות ייבוש איטי כדי לשמור על מבנה micelle, אבל לא איטי מדי, כדי לאפשר יצירת ג'ל.
- מלאו את הסירה במים שוקל 18m דה מיונן Ωcm (10-20 מ"ל של מים), מכסים, ולאפשר לספוג 12-24 שעות כדי להסיר עודפי אלקיל אמוניום ברומיד מלחים HBr. יוצקים (או פיפטה) את המים ולשטוף 3 פעמים עם מים די מספיק כדי למלא את המגש בכל פעם. היזהרו שלא לאבד את כל הסרט פולימר במהלך שלב זה.
- אפשר מגש במשקל לשבת חשף עד פולימר יבשה לחלוטין בשלב זה, הפולימר צריך להיות סרט פלסטיק שקוף ושברירי מעט. שוב, אם האוויר לח מאוד, דה אדים עשוי להיות נחוץ כדי להשלים את אידוי מבעוד מועד.
- בעזרת מרית, להסיר בזהירות את הסרט יבשים ממגש במשקל ולהעביר אותו לתוך צנצנת זכוכית נקייה.
- הוסף 2 מ"ל של אתנול ו -3 חרוזים ערבוב קרמיקה, ואת המערבולת במשך 4 שעות או עד הסרט פולימר הוא לגמרי מחדש על תנאי.
2. חוסר תנועה של אנזימים לתוך Nafion TBAB, שינוי מבחני פעילות
- עבור האנזים יבש, לשקול את 1-10 מ"ג של האנזים לתוך צינור microcentrifuge 1.5 מ"ל, ולהוסיף 1 מ"ל של 100 mM פוספט pH חיץ 7 כדי ליצור 1-10 מ"ג / מ"ל אנזים פתרון. FOr אנזים שנמצא פתרון, להשתמש בחומצה bicinchoninic (BCA) assay 13 כדי לקבוע את כמות החלבון, ולהוסיף הכמות המתאימה של חיץ פוספט 100 מ"מ עד להביא את ריכוז החלבון 1-10 מ"ג / מ"ל. מ"ל מ"ג / 1-10 בדרך כלל מתאים 1-50 nanomoles למ"ל.
- כדי μL 120 של 1 מ"ג / מ"ל אנזים פתרון, להוסיף 60 μL של פתרון שונה אלקיל אמוניום-Nafion, ו מערבולת למשך 10 שניות. (תערובת זו וניתן לשנותם עד למספר רב של משכפל. לשמור על יחס האנזים אל פולימר פתרון ב 02:01.)
- פיפטה 60 μL של פתרון האנזים / פולימר לתוך החלק התחתון של 3 נפרדים 1 2 cuvettes ס"מ, ולאפשר לו להתייבש במשך הלילה.
3. Assay של האנזים NAD תלוי ללא יכולת לזוז dehydrogenase
- כדי קובט, להוסיף 1.3 מ"ל של pyrophosphate 50 מ"מ נתרן (pH 8.8), 1.5 מ"ל של 15 מ"מ NAD (מוכן טרי), ו 0.1 מ"ל מים.
- מניחים את קובט על ספקטרופוטומטר UV / Vis (Evolut ThermoScientific כלומריון 260 ביו תרמו Spectronic Genesys 20) מוגדר באורך גל של 340 ננומטר.
- ספקטרומטר לאפס, ולאחר מכן להוסיף 0.1 מ"ל אתנול. מערבבים את ריאגנטים ידי בעדינות pipetting פתרון למעלה ולמטה 5 פעמים. עבור ריק, השתמש 0.1 מ"ל של מים נוספים במקום 0.1 מ"ל של אתנול.
- רשום את ספיגת ב 340 ננומטר ב 5 דקות לאחר ריאגנטים נוספו קובט ו -20 דקות אחרי. להתוות את שתי נקודות נתונים כדי לקבל מדרון שיכול לשמש לחישובים פעילות.
4. Assay של PQQ תלויי Dehydrogenases חסרי יכולת תנועה
- כדי קובט, להוסיף 1.5 מ"ל של נתרן זרחתי (pH 7.3) ו 200 μL של 600 PMS מיקרומטר.
- מניחים את קובט על ספקטרופוטומטר UV / Vis מוגדר באורך גל של 600 ננומטר ואז לאפס ספקטרומטר.
- הוספת 100 μL של DCIP 700 μL ו 200 μL של המצע של עניין (אתנול אצטילדהיד, גליצרול, גלוקוז, או glyceraldehyde), ומערבבים את ריאגנטים ידי בעדינות pipetting solutיון למעלה ולמטה 5 פעמים. עבור ריק, השתמש 200 μL של מים במקום המצע של עניין.
- רשום את ספיגת ב 600 ננומטר ב 5 דקות לאחר ריאגנטים נוספו קובט ו -20 דקות אחרי.
5. Assay של גלוקוז אוקסידאז ללא יכולת לזוז
- כדי קובט, להוסיף 2.0 מ"ל של תמיסה המכילה 0.2 מ 'P-hydroxybenzoic חומצה, אזיד הנתרן 0.02% (W / V), 128 peroxidase U, 0.3 מ"מ 4-aminoantipyrine, 1 M פוספט אשלגן, גלוקוז 50 מ"מ. מערבבים את הפתרון על ידי pipetting למעלה ולמטה 5 פעמים.
- מניחים את קובט במערכת UV / Vis ספקטרופוטומטר כדי באורך גל של 510 ננומטר.
- רשום את ספיגת ב 510 ננומטר ב 5 דקות לאחר ריאגנטים נוספו קובט ושוב 20 דקות לאחר.
6. נציג תוצאות
מבנה micellar של פולימר Nafion שונה יכול להשתבש על ידי ייבוש מלח המקורית / פולימר שיתוף casted הסרט גם FASלא. תרשים 2 מציג תערובת מלח / פולימר כי כבר התייבש כראוי והתוצאה היא סרט שקוף, חום בהיר. הסרט הזה מתייבש מהר מדי יכול לגרום, פתיתים לבנים אטומים של פולימר בשל העובדה כי תהליך הייבוש יכול להרוס את המבנה micellar.
לאחר Nafion שונה פולימר האנזים היו מעורבות ושיתוף להטיל על החלק התחתון של קובט, מבחני הפעילות האנזימטית ניתן להשתמש כדי להעריך את היציבות של האנזים בתוך הסרט פולימרי. טבלאות 2-4 assay להראות תוצאות של שני אנזימים dehydrogenase ו גלוקוז אוקסידאז משותקת לתוך שונות סרטים Nafion שונה, בהתאמה. הערה פעילות גבוהה יותר של האנזימים, כי הם חסרי יכולת תנועה לעומת אנזימים פתרון חיץ, מראה כי פולימרים Nafion שונה באמת יכול לשפר את הפעילות של אנזימים מסוימים (המכונה superactivity). אנזימים אחרים יש מגבלות התחבורה להקטין את הפעילות הספציפית שלהם כאשר לשתק אותם פולימר (כלומר cellulases ו amylases, אשר מצעים הם מקרומולקולות גדולים למדי).
40.89 מ"ג / מ"ל| מלח אמוניום הרביעון שימוש | 3 פי עודף |
| T3a (ברומיד tetrapropylammonium) | 32.37 מ"ג / מ"ל |
| TBAB (ברומיד tetrabutylammonium) | 39.19 מ"ג / מ"ל |
| TPAB (ברומיד tetrapentylammonium) | 46.01 מ"ג / מ"ל |
| TEHA (ברומיד triethylhexylammonium) | 32.37 מ"ג / מ"ל |
| TMHA (ברומיד trimethylhexylammonium) | 27.25 מ"ג / מ"ל |
| TMOA (ברומיד trimethyloctylammonium) | 30.66 מ"ג / מ"ל |
| TMDA (ברומיד trimethyldecylammonium) | 34.07 מ"ג / מ"ל |
| TMDDA (ברומיד trimethyldodecylammonium) | 37.48 מ"ג / מ"ל |
| TMTDA (ברומיד trimethyltetradecylammonium) | |
| TMHDA (ברומיד trimethylhexadecylammonium) | 44.31 מ"ג / מ"ל |
| TMODA (ברומיד trimethyloctadecylammonium) | 47.71 מ"ג / מ"ל |
טבלה 1. סכומי טטרה אלקיל מלחי אמוניום להשתמש Nafion פולימר שינוי.
| סוג Nafion | פעילות האנזים (U / g) |
| חיץ (לא פולימרי) | 16.63 ± 8.11 |
| Nafion (un-mod.) | 9.25 ± 2.21 |
| TMTDA | 3.23 ± 2.92 |
| TBAB | 3.93 ± 3.33 |
| TMDDA | 4.19 ± 1.04 |
| TMOA | 3.51 ± 1.11 |
| TMDA | 8.00 ± 4.53 |
| TMHA | 1.68 ± 1.39 |
| TMHDA | 4.83 ± 0.99 |
| TMODA | 10.45 ± 3.20 |
טבלה 2 NAD תלוי דהידרוגנז גלוקוז הפעילות משותקת נבחרים פולימרים Nafion שונה (הערה: הפעילות משותקת היא פונקציה של פעילות ספציפית הראשוני של אנזים)..
| סוג Nafion | פעילות האנזים (MU / g) |
| חיץ (לא פולימרי) | 7.18 ± 0.51 |
| Nafion (un-mod.) | 70.1 ± 0.5 |
| TMTDA | 133 ± 6 |
| TBAB | 244 ± 4 |
| TMDDA | 221 ± 6 |
| TMOA | 1.78 ± 0.63 |
| TMDA | 206 ±5 |
| TEHA | 40.1 ± 50.6 |
| TMHDA | 0 |
| TMODA | 1.45 ± 0.06 |
לוח 3 PQQ תלוי dehydrogenase פעילות גלוקוז משותקת נבחרים פולימרים Nafion שונה (הערה: הפעילות משותקת היא פונקציה של פעילות ספציפית הראשוני של אנזים)..
| סוג Nafion | פעילות האנזים (U / g) |
| חיץ (לא פולימרי) | 103.61 ± 3.15 |
| Nafion (un-mod.) | 19.93 ± 10.10 |
| TMTDA | 247.25 ± 12.49 |
| TBAB | 152.27 ± 5.29 |
| TMDDA | 262.05 ± 6.26 |
| TMOA | 129.18 ± 2.31 |
| TMDA | 141.23 ± 1.97 |
| TMHA | 131.75 ± 2.89 |
| TMHDA | 132.50 ± 1.18 |
| TMODA | 136.50 ± 0.96 |
. לוח 4 גלוקוז אוקסידאז נציג פעילות ספציפית משותקת נבחרים פולימרים Nafion שונה (הערה: הפעילות משותקת היא פונקציה של פעילות ספציפית הראשוני של אנזים).
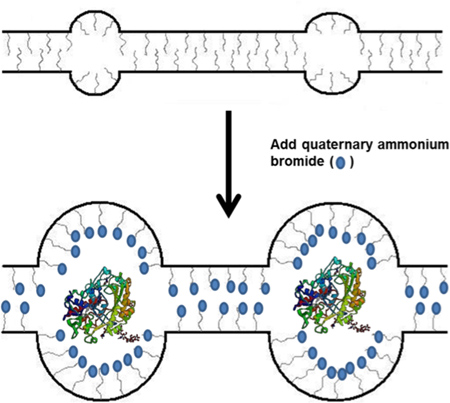
באיור 1. סכמטי של שילוב TBAB אל Nafion פולימר שימוש לאחר מכן ב immobilization האנזים.

איור 2. צילום אופטי של שיתוף השחקנים בסרטים הראשונים של Nafion ו TBAB. ייבוש איטי התשואות סרט שקוף, חום בהיר המכסה בוttom של מגש השקילה.
Access restricted. Please log in or start a trial to view this content.
Discussion
בהליך המתואר, טטרה אלקיל מלחי אמוניום משמשים לשנות Nafion מסחרי ליצור פולימרים micellar שניתן להשתמש בהם כדי לשתק ולייצב אנזימים. מבחני המתוארים הצג את הנוהל הפולימר יכול לשמש כדי לשתק מגוון רחב של אנזימים עם השמירה הגבוהה של הפעילות. אם האנזים עניין יש פעילות נמוכה מאוד או...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
המחברים מודים משרד המחקר של הצי, מועצת הברית סויה, ואת הקרן הלאומית למדע למימון.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
| Nafion | Sigma-Aldrich | 70160 | |
| ברומיד טטרה alkylammonium מלחי | Sigma-Aldrich | n / a | |
| אלכוהול דהידרוגנז | Sigma-Aldrich | A3263 | |
| Dinucleotide Nicotinamide אדנין (NAD) | Simga אולדריץ | N7004 | |
| נתרן pyrophosphate | Sigma-Aldrich | P8010 | |
| Phenazine methosulfate (PMS) | Sigma-Aldrich | P9625 | |
| 2,6-Dichloroindophenol (DCIP) | SIGMA-Aldrich | D1878 | |
| גלוקוז אוקסידאז | Sigma-Aldrich | G7141 | |
| 4-Hydroxybenzoic חומצה | Sigma-Aldrich | 240141 | |
| אזיד הנתרן | Sigma-Aldrich | S8032 | |
| Peroxidase | Sigma-Aldrich | P8375 | |
| 4-aminoantipyrine | Sigma-Aldrich | 06800 | |
| UV / Vis ספקטרופוטומטר | Thermo | אבולוציה 260 ביו או Spectronic Genesys 20 | |
| מערבולת Genie | |||
| אנליטית איזון |
References
- Calabrese-Barton, S., Gallaway, J., Atanassov, P. Enzymatic biofuel cells for implantable and microscale devices Chem. Rev. 104, 4867-4886 (2004).
- Cracknell, J. A., Vincent, K. A., Armstrong, F. A. Enzymes as Working or Inspirational Electrocatalysts for Fuel Cells and Electrolysis. Chem. Rev. 108, 2439-2461 (2008).
- Minteer, S. D., Liaw, B. Y., Cooney, M. J. Enzyme-Based Biofuel Cells. Curr. Opin. Biotechnol. 18, 228-234 (2007).
- Callahan, J. W., Kosicki, G. W. The Effect of Lipid Micelles on Mitochondrial Malate Dehydrogenase. Canadian Journal of Biochemistry. 45, 839-851 (1967).
- Martinek, K. Modeling of the Membrane Environment of Enzymes: Superactivity of Laccase Entrapped into Surfactant Reversed Micelles in Organic Solvents. Biokhimiya. 53, 1013-1016 (1988).
- Moore, C. M., Akers, N. L., Hill, A. D., Johnson, Z. C., Minteer, S. D. Improving the Environment for Immobilized Dehydrogenase Enzymes by Modifying Nafion with Tetraalkylammonium Bromides. Biomacromolecules. 5, 1241-1247 (2004).
- Schrenk, M. J., Villigram, R. E., Torrence, N. J., Brancato, S. J., Minteer, S. D. Effects of Mixture Casting Nafion with Quaternary Ammonium Bromide Salts on the Ion-Exchange Capacity and Mass Transport in the Membranes. J. Membr. Sci. 205, 3-10 (2002).
- Akers, N. L., Moore, C. M., Minteer, S. D. Development of Alcohol/O2 Biofuel Cells Using Salt-Extracted Tetrabutylammonium Bromide/Nafion Membranes to Immobilize Dehydrogenase Enzymes. Electrochim. Acta. 50, 2521-2525 (2005).
- Sokic-Lazic, D., Minteer, S. D. Citric Acid Cycle Biomimic on a Carbon Electrode. Biosens. Bioelectron. 24, 939-944 (2008).
- Arechederra, R. L., Minteer, S. D. Complete Oxidation of Glycerol in an Enzymatic Biofuel Cell. Fuel Cells. 9, 63-69 (2009).
- Germain, M., Arechederra, R. L., Minteer, S. D. Nitroaromatic Actuation of Mitochondrial Bioelectrocatalysis for Self-Powered Explosive Sensors. J. Am. Chem. Soc. 130, 15272-15273 (2008).
- Addo, P. K., Arechederra, R. L., Minteer, S. D. Evaluating Enzyme Cascades for Methanol/Air Biofuel Cells Based On NAD+-Dependent Enzymes. Electroanalysis. 22, 807-812 (2010).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150, 76-85 (1985).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved