Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Гидрофобные Солт-модифицированный Nafion для иммобилизации ферментов и стабилизации
В этой статье
Резюме
В этой статье описывается порядок синтеза гидрофобно модифицированные мембраны Nafion иммобилизации ферментов и как для иммобилизации белков и / или ферментов в мембране и проверить их конкретной деятельности.
Аннотация
За последние десять лет, произошло множество приложений для иммобилизации ферментов и стабилизировалась в том числе биокатализа, биосенсоров, и биотопливо клеток. 1-3 В большинстве биоэлектрохимические приложений, ферментов или органеллы иммобилизованных на поверхности электрода с использованием определенного типа полимерной матрицы. Этот полимер леса должны иметь стабильную и ферменты позволяют поверхностным диффузии молекул и ионов в и из матрицы. Большинство полимеров, используемых для данного типа иммобилизации на основе полиаминов или многоатомные спирты - полимеры, которые имитируют природную среду ферменты, которые они воплощают и стабилизации ферментов через водород или ионной. Другой метод для стабилизации ферментов связано с использованием мицелл, содержащих гидрофобные области, которые могут инкапсулировать и стабилизации ферментов. 4,5 В частности, группа Minteer разработала мицеллярных полимер на основе коммерчески доступных Nafion. 6,7 NafionСам мицеллярных полимера, что позволяет каналу помощью диффузии протонов и другие мелкие катионы, но мицеллы и каналов крайне малы и полимер является очень кислым из-за сульфокислоты боковых цепей, что неблагоприятно для иммобилизации ферментов. Однако, когда Nafion смешивается с более гидрофобные алкильные соли аммония, такие как тетрабутиламмония бромид (TBAB), четвертичного аммония катионов замене протонов и стать счетчик ионов сульфонатных групп на стороне полимерные цепи (рис. 1). Это приводит к большим мицелл и каналов в полимер, который позволяет для распространения больших подложках и ионов, которые необходимы для ферментативной функции, такие как никотинамидадениндинуклеотида (NAD). Это изменение Nafion полимера был использован для иммобилизации различных типов ферментов, а также митохондрий для использования в биосенсоров и биотопливных элементов. 8-12 Эта статья описывает новую процедуру принятия этого микрофонаellar полимер иммобилизации ферментов мембраны, которая может стабилизировать ферментов. Синтез мицеллярной мембранной иммобилизации фермента, процедура для иммобилизации ферментов в мембране, а анализы для изучения ферментативных удельной активности иммобилизованного фермента приведены ниже.
протокол
1. Модификация с Nafion соли четвертичного аммония
- Встряхните бутылку 5% вес / объем Nafion подвески энергично в течение ок. 30 секунд, чтобы Nafion приостановлена равномерно в растворе.
- Пипетировать из 2 мл в настоящее время повторно приостановил Nafion в стеклянный флакон (флакон объемом может содержать от 2,5 мл до 10 мл).
- Измерьте 3-кратном молярном избытке (по отношению к сульфокислоты групп на Nafion полимер) алкильных соли бромида (соответствующей массы приведены в таблице 1), и добавить к этому флакон, содержащий 2 мл Nafion.
- Vortex флакон на 1500 оборотов в минуту в течение 10-15 минут.
- Вылейте вязкий раствор в полиэтиленовый весом лоток, который измеряет ок. 3 х 3 дюйма, а также использование пипетки для передачи остаточного раствора из флакона с весом лоток.
- Позвольте растворители испаряются из весить лодку, оставляя желтый / коричневый, прозрачная пленка на нижней весом лоток (Fiрисунке 2). Скорость испарения растворителя должна быть такой, что она занимает более 6 часов для всех растворитель испаряется. Если растворитель испаряется слишком быстро, белый, твердый материал образует вместо прозрачной пленке о том, что мицеллярной структуры полимера был разрушен, и необходимо повторно запустить процедуру. Если испарение растворителя слишком медленно, де-увлажнитель может быть необходимым, потому что слишком медленное испарение обычно приводит к липким, оранжевый гель, и вы должны возобновить процедуры. Типичный диапазон температуры для испарения растворителя на 20 - 37 ° C. Реальные условия для сушки зависят от относительной влажности и температуры в помещении, но важно, что сушка медленная поддерживать мицеллы структуры, но не слишком медленно, чтобы обеспечить образование геля.
- Заполните вес лодки с 18M Ωcm деионизированной водой (10-20 мл воды), накрыть крышкой и дать впитаться в течение 12-24 часов, чтобы удалить излишки алкил аммония бромид соли и HBr. залить (или пипетки) из воды и промыть 3 раза с достаточным количеством воды DI, чтобы заполнить лоток каждый раз. Будьте осторожны, чтобы не потерять любую из полимерной пленки на этом этапе.
- Позвольте весом лоток сидеть обнаружены пока полимер полностью высохнет На данный момент, полимер должен быть четким и несколько хрупкие пленки. Опять же, если воздух очень влажный, де-увлажнитель может быть необходимо для завершения испарения в установленные сроки.
- С помощью шпателя тщательно удалить сухой пленки с весом лоток и передать его в чистый флакон стекло.
- Добавить 2 мл этанола и 3 керамических смешивания бисером, и вихрь в течение 4 часов или до полимерная пленка полностью повторно приостановлены.
2. Иммобилизации ферментов в TBAB-Modified Nafion на активность Анализы
- Для сухой фермент, отвешивать 1-10 мг фермента в 1,5 мл микроцентрифужную пробирку и добавьте 1 мл 100 мМ рН 7 фосфатный буфер, чтобы создать 1-10 мг / мл раствора фермента. ФоГ фермент, который находится в растворе, используйте bicinchoninic кислоты (BCA) анализ 13 до определения количества белка и добавить соответствующую сумму в 100 мМ фосфатного буфера довести концентрацию белка до 1-10 мг / мл. 1-10 мг / мл обычно соответствует 1-50 нмоль / мл.
- До 120 мкл 1 мг / мл раствора фермента, добавить 60 мкл алкил аммония модифицированный Nafion решение, и вихрь в течение 10 секунд. (Эта смесь может быть расширен для большого количества дубликатов. Держите фермента к раствор полимера соотношение 2:1).
- Внесите 60 мкл фермента / полимерный раствор в нижней части 3 отдельных 1 см 2 кювет, и дать высохнуть в течение ночи.
3. Анализ иммобилизованных НАД-зависимые дегидрогеназы ферментов
- В кювете, добавить 1,3 мл 50 мМ пирофосфат натрия (рН 8,8), 1,5 мл 15 мМ НАД (свежеприготовленный) и 0,1 мл воды.
- Поместите кювету в UV / Vis спектрофотометр (т.е. ThermoScientific Evolutион 260 Био и Thermo Spectronic Genesys 20) установлен в длине волны 340 нм.
- Обнулить спектрометр, а затем добавьте 0,1 мл этанола. Смешайте реагенты, осторожно пипеткой решение вверх и вниз в 5 раз. Для пустой, использовать 0,1 мл дополнительной воды вместо 0,1 мл этанола.
- Измерить абсорбцию при 340 нм в течение 5 минут после реактивы были добавлены в кювет и через 20 минут после. Сюжет в двух точках данных, чтобы получить наклон, который может быть использован для деятельности расчетов.
4. Анализ иммобилизованных PQQ-зависимых дегидрогеназ
- В кювете, добавить 1,5 мл фосфат натрия (рН 7,3) и 200 мкл 600 мкМ ПМС.
- Поместите кювету в UV / Vis спектрофотометр настроен на длину волны 600 нм, а затем нулю спектрометра.
- Добавить 100 мкл 700 мкл DCIP и 200 мкл субстрата интерес (этанола, ацетальдегида, глицерин, глюкоза, или глицеральдегид), а также смешивать реактивы, осторожно пипеткой Solutионных вверх и вниз в 5 раз. Для пустой, используйте 200 мкл воды вместо подложки интерес.
- Измерить абсорбцию при 600 нм в течение 5 минут после реактивы были добавлены в кювет и через 20 минут после.
5. Анализ иммобилизованных глюкозооксидазы
- В кювете, добавить 2,0 мл раствора, содержащего 0,2 М р-гидроксибензойной кислоты, 0,02% (вес / объем) азида натрия, 128 U пероксидаза, 0,3 мм 4-аминоантипирином, 1 М фосфата калия и 50 ммоль глюкозы. Смешайте раствор пипеткой вверх и вниз в 5 раз.
- Поместите кювету в UV / Vis спектрофотометр набор для длины волны 510 нм.
- Измерить абсорбцию при 510 нм в течение 5 минут после реактивы были добавлены в кювет и снова на 20 минут позже.
6. Представитель Результаты
Мицеллярной структуры модифицированного полимера Nafion может быть нарушена путем высушивания исходной соли / полимер со-литая пленка слишком ФАСтонн. На рисунке 2 показана соли / полимерной смеси, которая была правильно сушат в результате чего прозрачная, тонкая пленка коричневого цвета. Фильм, который высыхает слишком быстро, может привести к непрозрачные, белые хлопья полимеров в связи с тем, что процесс сушки можно уничтожить мицеллярной структуры.
После того, изменение Nafion полимеров и ферментов были смешаны и совместно бросили на дно кюветы, ферментативная активность анализов могут быть использованы для оценки стабильности ферментов в полимерную пленку. Таблицы 2-4 шоу анализ результатов двух ферментов дегидрогеназ и глюкозооксидазы иммобилизованных в различных фильмах изменение Nafion, соответственно. Обратите внимание, что высокая активность ферментов, иммобилизованных ферментов по сравнению с в буферном растворе, показали, что модифицированные полимеры Nafion действительно может повышать активность некоторых ферментов (называемых повышенная активность). Другие ферменты имеют транспортных ограничений, которые снижают их удельная активность при иммобилизации их в полимере (т.е. целлюлозы и амилазы, которые субстратов достаточно больших макромолекул).
40,89 мг / мл| Четвертичные соли аммония, используемый | 3 раза превышение |
| T3A (тетрапропиламмония бромид) | 32,37 мг / мл |
| TBAB (тетрабутиламмония бромид) | 39,19 мг / мл |
| TPAB (tetrapentylammonium бромид) | 46,01 мг / мл |
| TEHA (triethylhexylammonium бромид) | 32,37 мг / мл |
| TMHA (trimethylhexylammonium бромид) | 27,25 мг / мл |
| TMOA (trimethyloctylammonium бромид) | 30,66 мг / мл |
| TMDA (trimethyldecylammonium бромид) | 34,07 мг / мл |
| TMDDA (trimethyldodecylammonium бромид) | 37,48 мг / мл |
| TMTDA (trimethyltetradecylammonium бромид) | |
| TMHDA (trimethylhexadecylammonium бромид) | 44,31 мг / мл |
| TMODA (trimethyloctadecylammonium бромид) | 47,71 мг / мл |
Таблица 1. Суммы, тетра-алкил соли аммония, используемый для Nafion модификации полимеров.
| Тип Nafion | Активность ферментов (U / г) |
| Буфер (без полимера) | 16,63 ± 8,11 |
| Nafion (un-mod.) | 9,25 ± 2,21 |
| TMTDA | 3,23 ± 2,92 |
| TBAB | 3,93 ± 3,33 |
| TMDDA | 4,19 ± 1,04 |
| TMOA | 3,51 ± 1,11 |
| TMDA | 8,00 ± 4,53 |
| TMHA | 1,68 ± 1,39 |
| TMHDA | 4,83 ± 0,99 |
| TMODA | 10,45 ± 3,20 |
Таблица 2 NAD-зависимых дегидрогеназ глюкозы активность иммобилизованных в отдельных изменение Nafion полимеров (примечание: иммобилизованные деятельности является функцией начальной удельной активности фермента)..
| Тип Nafion | Активность ферментов (мЕд / г) |
| Буфер (без полимера) | 7,18 ± 0,51 |
| Nafion (un-mod.) | 70,1 ± 0,5 |
| TMTDA | 133 ± 6 |
| TBAB | 244 ± 4 |
| TMDDA | 221 ± 6 |
| TMOA | 1,78 ± 0,63 |
| TMDA | 206 ±5 |
| TEHA | 40,1 ± 50,6 |
| TMHDA | 0 |
| TMODA | 1,45 ± 0,06 |
Таблица 3 PQQ-зависимых дегидрогеназ глюкозы активность иммобилизованных в отдельных изменение Nafion полимеров (примечание: иммобилизованные деятельности является функцией начальной удельной активности фермента)..
| Тип Nafion | Активность ферментов (U / г) |
| Буфер (без полимера) | 103,61 ± 3,15 |
| Nafion (un-mod.) | 19,93 ± 10,10 |
| TMTDA | 247,25 ± 12,49 |
| TBAB | 152,27 ± 5,29 |
| TMDDA | 262,05 ± 6,26 |
| TMOA | 129,18 ± 2,31 |
| TMDA | 141,23 ± 1,97 |
| TMHA | 131,75 ± 2,89 |
| TMHDA | 132,50 ± 1,18 |
| TMODA | 136,50 ± 0,96 |
. Таблица 4 представителя глюкозооксидазы удельной активности иммобилизованных в отдельных изменение Nafion полимеров (примечание: иммобилизованные деятельности является функцией начальной удельной активности фермента).
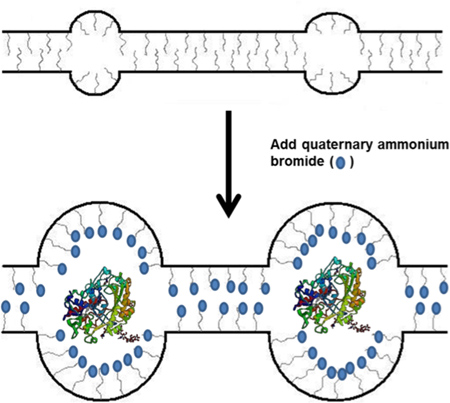
Рисунок 1. Схема включения TBAB в Nafion полимера и последующего использования в иммобилизации ферментов.

Рисунок 2. Оптическая фотография начального со-литой пленки Nafion и TBAB. Медленная сушка дает прозрачный, светло-коричневая пленка охватывающих боttom из весом лоток.
Обсуждение
В описанной процедуре, тетра-алкил соли аммония используются для изменения коммерческой Nafion создать мицеллярных полимеров, которые могут быть использованы для иммобилизации и стабилизации ферментов. Анализы описанных в порядке, показывают, что полимер может быть использован для имм?...
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы признают, Управление военно-морских исследований, Соединенные сои совета и Национального научного фонда для финансирования.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| Nafion | Sigma-Aldrich | 70160 | |
| Tetra соли алкиламмония бромид | Sigma-Aldrich | н / д | |
| Алкогольдегидрогеназы | Sigma-Aldrich | A3263 | |
| Никотинамидадениндинуклеотида (NAD) | Simga-Aldrich | N7004 | |
| Натрий пирофосфат | Sigma-Aldrich | P8010 | |
| Феназинметасульфат (PMS) | Sigma-Aldrich | P9625 | |
| 2,6-Dichloroindophenol (DCIP) | Сигналма-Aldrich | D1878 | |
| Глюкозооксидаза | Sigma-Aldrich | G7141 | |
| 4-гидроксибензойной кислоты | Sigma-Aldrich | 240141 | |
| Азид натрия | Sigma-Aldrich | S8032 | |
| Пероксидаза | Sigma-Aldrich | P8375 | |
| 4-аминоантипирином | Sigma-Aldrich | 06800 | |
| UV / Vis Спектрофотометр | Thermo | Эволюция 260 Bio или Spectronic Genesys 20 | |
| Vortex Genie | |||
| Аналитические весы |
Ссылки
- Calabrese-Barton, S., Gallaway, J., Atanassov, P. Enzymatic biofuel cells for implantable and microscale devices Chem. Rev. 104, 4867-4886 (2004).
- Cracknell, J. A., Vincent, K. A., Armstrong, F. A. Enzymes as Working or Inspirational Electrocatalysts for Fuel Cells and Electrolysis. Chem. Rev. 108, 2439-2461 (2008).
- Minteer, S. D., Liaw, B. Y., Cooney, M. J. Enzyme-Based Biofuel Cells. Curr. Opin. Biotechnol. 18, 228-234 (2007).
- Callahan, J. W., Kosicki, G. W. The Effect of Lipid Micelles on Mitochondrial Malate Dehydrogenase. Canadian Journal of Biochemistry. 45, 839-851 (1967).
- Martinek, K. Modeling of the Membrane Environment of Enzymes: Superactivity of Laccase Entrapped into Surfactant Reversed Micelles in Organic Solvents. Biokhimiya. 53, 1013-1016 (1988).
- Moore, C. M., Akers, N. L., Hill, A. D., Johnson, Z. C., Minteer, S. D. Improving the Environment for Immobilized Dehydrogenase Enzymes by Modifying Nafion with Tetraalkylammonium Bromides. Biomacromolecules. 5, 1241-1247 (2004).
- Schrenk, M. J., Villigram, R. E., Torrence, N. J., Brancato, S. J., Minteer, S. D. Effects of Mixture Casting Nafion with Quaternary Ammonium Bromide Salts on the Ion-Exchange Capacity and Mass Transport in the Membranes. J. Membr. Sci. 205, 3-10 (2002).
- Akers, N. L., Moore, C. M., Minteer, S. D. Development of Alcohol/O2 Biofuel Cells Using Salt-Extracted Tetrabutylammonium Bromide/Nafion Membranes to Immobilize Dehydrogenase Enzymes. Electrochim. Acta. 50, 2521-2525 (2005).
- Sokic-Lazic, D., Minteer, S. D. Citric Acid Cycle Biomimic on a Carbon Electrode. Biosens. Bioelectron. 24, 939-944 (2008).
- Arechederra, R. L., Minteer, S. D. Complete Oxidation of Glycerol in an Enzymatic Biofuel Cell. Fuel Cells. 9, 63-69 (2009).
- Germain, M., Arechederra, R. L., Minteer, S. D. Nitroaromatic Actuation of Mitochondrial Bioelectrocatalysis for Self-Powered Explosive Sensors. J. Am. Chem. Soc. 130, 15272-15273 (2008).
- Addo, P. K., Arechederra, R. L., Minteer, S. D. Evaluating Enzyme Cascades for Methanol/Air Biofuel Cells Based On NAD+-Dependent Enzymes. Electroanalysis. 22, 807-812 (2010).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150, 76-85 (1985).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены