A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אוסף פרוטוקול לבלב אנוש
In This Article
Summary
סרט הווידאו הזה מדגים הליך לנתיחה לעיבוד הלבלב האנושי לתוך תבניות אחסון מרובים. אוריינטציה אנטומי נשמר לאורך כל האזורים הלבלב כדי לאפשר הגדרת הרכב איון הצפיפות באזור.
Abstract
דיסקציה זה הליך הדגימה שפותח עבור רשת לעוגב תורמים הלבלב עם תוכנית (nPOD) סוכרת לתקנן הכנת הלבלב התאושש תורמי איברים מוות. הלבלב מחולק ל -3 אזורים עיקריים (ראש, גוף, זנב) ואחריו חלקים רוחביים סדרתי ברחבי המדיאלי על ציר לרוחב. חלקים מתחלפים משמשים פרפין קבוע בלוקים קפואים טריים דגימות שריד הם טחון עבור הצמד ההכנות מדגם קפואים, עם או בלי RNAse מעכבי, כי ה-DNA, RNA, או בידוד חלבון. המטרה הכללית של ההליך לנתיחה הלבלב הוא לדגום את הלבלב כולו, תוך שמירה על הכיוון אנטומי.
תא האנדוקרינית הטרוגניות מבחינת הרכב גודל איון,, ומספרים מדווח על איים אדם לעומת איים מכרסמים 1. רוב איים אדם מן הראש הלבלב, אזורי הגוף והזנב מורכבים containin אינסוליןגרם בטא תאים ואחריו פרופורציות נמוכות יותר של גלוקגון, המכיל אלפא-תאים ו somatostatin המכילים δ-תאים. פוליפפטיד המכיל תאים בלבלב PP ו גרלין המכילים תאים אפסילון גם כיום, אך במספרים קטנים. לעומת זאת, האזור מכיל אונקלי איים אשר מורכב ברובו פוליפפטיד המכיל תאים בלבלב עמ '2. אלה וריאציות אזוריות איון נובעים הבדלים התפתחותיים. הלבלב מתפתחת ניצנים הלבלב הגחון ועל הגב ב במעי הקדמי ואחרי סיבוב של הקיבה והתריסריון, המהלכים באונה הגחון ומתאחה עם הגב 3. האונה הגחון מהווה את החלק האחורי של הראש כולל את תהליך אונקלי בעוד האונה הגב מעורר שאר האיברים. וריאציה הלבלב האזורית מדווח גם באזור הזנב בעל צפיפות גבוהה יותר איון בהשוואה לאזורים אחרים באונה הגבית הנגזרות רכיבים שעברו ניוון סלקטיבית של סוכרת מסוג 1 איברים ורקמות נוספות הם התאוששו לעתים קרובות התורמים איברים וכוללים הלבלב בלוטות לימפה, טחול שאינם הלבלב בלוטות הלימפה. דוגמאות אלה הם התאוששו עם תבניות דומות של הלבלב עם תוספת של בידוד של תאים cryopreserved. כאשר התריסריון הפרוקסימלי כלול הלבלב, רירית התריסריון ניתן לאסוף עבור חוסם פרפין קפוא ותכשירים הצמד טחון קפוא.
Protocol
1. הגדרת
- לייבל הקלטות עבור אבני פרפין ידנית בעיפרון, או באופן אוטומטי עם המדפסת קלטת. כלול את מזהה התורם (CaseID), סוג הדוגמה, מספר aliquot, וכל זיהוי ייחודי נוסף (גליון מקרה, נספח 1 ).
- תווית אוקטובר תבניות כמו על קלטות עם סמן קבע. לגזור מלבנים 5-10 ס"מ של נייר אלומיניום.
- להדפיס או באופן ידני תווית עם סמן קבע את כל צלוחיות ואבובים. כלול צלוחיות מספיק דגימות עבור הצמד קצוצים צינורות קפואים עם התקשורת RPMI עבור משלוחים טריים. על צלוחיות קפואים חפוז עם RNAlater, להוסיף 1 מ"ל RNAlater כדי cryovial כל אחד.
- הגדרת לוחות הנתיחה של בטיחות ביולוגית מכסה המנוע ואת צמרות הדלפק עם מכשירים הנתיחה מעוקרות (מלקחיים, אזמלים, להבים, פדי גזה (4x4)), כמו גם קלטות ותבניות אוקטובר מסודרים לפי סדר השימוש.
- להכין אמבטיה קפוא על ידי הצבתקרח יבש בתוך קופסת קלקר בגודל בינוני (10x10 ס"מ) עד לעומק של לפחות 3 ס"מ ומוסיפים isopentane עד קרח יבש מכוסה לחלוטין.
- אופציונלי: מילוי מיכל קטן דיואר עם חנקן נוזלי.
- אם הלבלב דרוש במיקרוסקופ אלקטרונים (EM), להכין מקבע TAAB ידי הוספת 1.25 paraformaldehyde מ"ל 16%, 1.25 glutaraldehyde מ"ל 8% ו 7.5 מ"ל 0.1M PBS. הכן מקבע Lowicryl ידי הוספת 2.5 מ"ל paraformaldehyde 16% עד 7.5 מ"ל 0.1M PBS.
- להכין פתרונות המשמשים לבידוד תאים. בקבוק 500 מ"ל של DMEF (עם גלוטמין), בצע את טכניקות אספטיים תוך הוספת הבאה:
- בסרום שור עוברית (FBS): הוסף 50 מ"ל, 10% הסופי.
- פניצילין / סטרפטומיצין (עט / דלקת, 10,000 יח' / מ"ל / 10000 מיקרוגרם / מ"ל המלאי) - להוסיף 5 פן / דלקת המניות מ"ל כדי RPMI ריכוז סופי של 100 U / mL / 100ug/mL. גם להוסיף 5 מ"ל בקבוק 500 מ"ל של DPBS כאשר נעשה שימוש לקיום קשרי הלימפה או דוגמאות הטחול.
2. כוח אדם
3. הלבלב Dissection
- הסר את התריסריון והטחול ולנקות את הלבלב של שומן, כלי זרים, והעצבים באמצעות דיסקציה בוטה וחד
- מניחים את הלבלב ניקה על לוח לנתח מכוסה במגבות נייר. טובלים צמר גפן המוליך שקצהו בדיו התפשטות כחול על פני השטח הקדמי של הלבלב. למחוק את העודף.
- אופציונלי: טובלים המוליך החדש בדיו התפשטות שחור על פני השטח האחורי של הלבלב. חזור הלבלב לכיוון הרגיל עם השטח הקדמי מול prosector.
- חותכים את הלבלב ל 3 אזורים: ראש, גוף וזנב (איור 1). חותכים את הצומת בין heaד והגוף מכן לחלק את החלק הנותר ~~~HEAD=NNS חלקים שווים של הגוף והזנב.
- לשקול את כל האזור של משקולות הלבלב שיא (מקרה הבדיקות גיליון ( נספח 1 )).
- סעיף (~~~HEAD=NNS 0.5 ס"מ) כל האזור של הלבלב ב באופן רוחבי "כיכר הלחם" (איור 1).
- השתמש בסעיפים משני צמתים בין אזורים עבור דגימות טחון. בהתאם לגודל הלבלב, מדגם מאזור גוף זנב בצומת עלול להיות קשה להשיג במקרה זה את מספר אבני פרפין יכול להיות ירידה להשיג דגימות קצוצים או דוגמאות בלבד מאזור הלבלב ראש הגוף ניתן להשיג. תווית cryovials לפי ראש או גוף לציון באזור הפרוקסימלי בצומת.
- בשר טחון החלקים ולחלק שווה בשווה בין cryovials (≥ 1 גרם לכל בקבוקון). במהירות להקפיא צלוחיות ללא RNALater בחנקן נוזלי או קרח יבש - slurry isopentane מכן להעביר tOA -80 מעלות במקפיא.
- שמור על צלוחיות עם RNALater בטמפרטורת החדר במשך 30 דקות, כדי לאפשר איזון, רמיקס במהירות להקפיא בחנקן נוזלי או slurry קרח יבש isopentane מכן להעביר את המקפיא -80 ° C.
- הסרה של חלקים מתחלפים עבור פרפין וחוסם אוקטובר החל פרפין (איור 1).
- להישען על כל הסעיפים רוחביים ימינה.
- מקום ~ 1.5 x 1.5 x 0.5 ס"מ סעיפים הקלטות. אם בסעיפים רוחביים הם גדולים מדי, בחצי (איור 2b). לייבל הקלטות למחצית הקדמי כחול "" וחצי האחורי כמו "B".
- אם החלקים עדיין גדול מדי, מנותק מדי בניצב סעיף לקיצוץ הקודם (איור 2 ג). קלטות תווית לספירה באופן כיוון השעון. חתוך לחתיכות הדרושים נוספת כדי להתאים קלטות.
- מספר בלוקים ברצף בתוך האזור, החל בחלק המדיאלי ביותר.
- עבור בלוקים פרפין, עמדה גassettes כך התווית היא שמאלה במקום רקמות לתוך קלטת, שמירה על האוריינטציה שלו. המכסה סגור קלטת והעברת למיכל עם ~ 500 מ"ל 10% נייטרלי שנאגרו פורמלין (NBF). התחל קיבעון העיתוי כאשר את הקלטת האחרונה ממוקם מקבע.
- עבור בלוקים לאוקטובר, יוצקים שכבה דקה של אוקטובר מדיה לתוך תבנית prelabeled ואז להניח את רקמות עובש להיות בטוח כדי לשמור על האוריינטציה ומכסים רקמות עם אוקטובר לטבול במהירות את תבניות אוקטובר בקרח יבש - slurry isopentane דקה 1 ~. הסר slurry ומניחים על קרח יבש לאחסון זמני או -80 ° C במקפיא לאחסון ארוך טווח.
- להשיג ~~~HEAD=NNS 0.5 x 0.5 ס"מ פרוסות מצומת ראש הגוף של מיקרוסקופיה אלקטרונית (EM). מקום אחד פרוסה מקבע TAAB ו פרוסה אחר מקבע Lowicryl. אחסן את שני סוגי מקבע עם דגימות ב 4 מעלות צלזיוס במשך לפחות 48 שעות ו / או ללא הגבלת זמן עד עיבוד נוסף עבור EM.
4. , טחול לימפה הצומת Dissecולהמליץ רירית התריסריון והניתוחים
- לבודד את בלוטות הלימפה הלבלב (PLN) משומן לקצץ את כל רקמת החיבור אל הקפסולה הצומת. מקום בצלחת סטרילית התרבות התא המכיל DMEF. בהתאם המספרים הכוללים מבודדים, לחלק PLN אל aliquots עבור משלוחי טריים, isolations סלולריים cryopreserved, פרפין / או בלוקים לאוקטובר, ואת צלוחיות. בשר טחון צמתים גדולים לחתיכות לא גדולות יותר מ -0.5 ס"מ.
- בשר טחון הלבלב ללא בלוטות לימפה וטחול אל ~~~HEAD=NNS (0.5 ס"מ) לקוביות קטנות. מקום מקבע, אוקטובר מדיה, או DMEM למשלוחים מדגם טריים או isolations סלולריים cryopreserved לפי כמויות של חומרי המוצא.
- פתח את התריסריון בעדינות לנגב את רירית התריסריון נקי של ריר עם כרית גזה לח. לחתוך קטעים של רירית עבור פרפין ו / או קפואים אבני אוקטובר דגימות טחון על צלוחיות, עם ובלי RNAlater. להקפיא כמו דוגמאות אחרות.
5. לעטוף בנייר כסף אוקטובר בלוקים מראש שכותרתו אלומיניום ומניחים אבני אוקטובר ו צלוחיות בתיבות עבור אחסון לטווח ארוך ב -80 מעלות ג
6. שלח דוגמאות קבוע עבור עיבוד פרפין
- תיקון רקמות במשך 16 שעות (טווח של 20 ± 4 שעות) באמצעות מעבד פרפין אוטומטית או ידנית באמצעות תזמון. תהליך רחובות פרפין באמצעות מעבד אוטומטי ( נספח 2 ).
- שבץ סעיפים בכיוון המדויק כפי שבוצעה על ידי prosector עם תווית קלטת משמאל. להטביע את רירית התריסריון עם משטח חיתוך למטה על מנת לאפשר בדיקה של ניצב רירית כדי submucosa.
7. יש לנקות ולחטא תחומים הנתיחה. לשטוף כלים הנתיחה מחדש לחטא. מניחים רקמות שריד האדם מקבע פורמלין לאחסון כפסולת ביו. מחק פסולת ביו פי התקנות המקומיות תוך חודש.
8. לעדכן את מערכת מלאי לדוגמא
ve_title "> 9. נציג תוצאותהליך זה יהיה תהליך הלבלב האנושי שלם עם מדגם מייצג לאורך כל איבר כולל סימון של שלושה אזורים מרכזיים, כלומר, הראש, הגוף והזנב תוך 2 שעות. האזור אונקלי, נמצא באזור הראש האחורי, נכלל לנתיחה הראש. משקל הלבלב החציוני תורמים איברים ללא סוכרת היה 82.4 גרם (52.7 - 139.0 גרם). משקולות הלבלב אזוריות היו שווים כ (איור 3).
הליך זה יכול גם לאפשר את שיקומה של הלבלב כולו באמצעות שקופיות מוכתמים מן פרפין רציף וחוסם אוקטובר. בפורמטים מרובים הם ריאלי המאפשר ניצול מרבי של טכנולוגיות הנוכחיים והעתידיים. בגליון הנוכחי במקרה nPOD מסופק ( נספח 1 ) המשמש לתעד דוגמאות התאושש proc לאחר מכןessing ידי aliquot סוגים וכמויות.
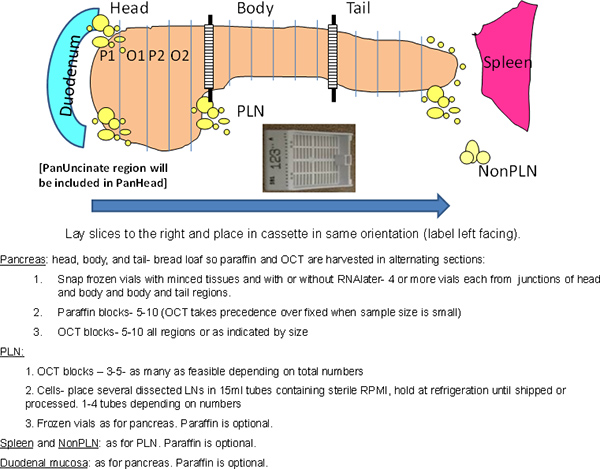
באיור 1. התוכנית הכוללת של ההליך. הלבלב כולו מעובד תוך שמירה על נטיות אנטומיים. באזור הראש ארוך בציר מעולה, נחות בשל נוכחותם של האונה הלבלב הגחון באזור האחורי הכולל את האזור אונקלי. אזור בקעו בצמתים לציין אזורים המשמשים דגימות קצוצים cryovials. P, פרפין, O, אוקטובר
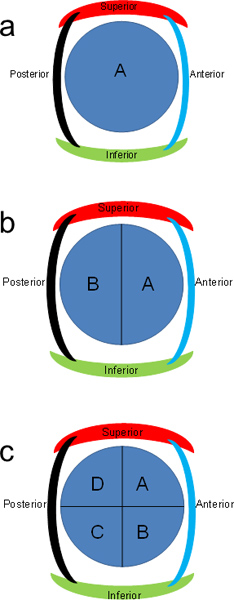
איור 2. ערכת האותיות של סעיפים הלבלב. פרוסות הלבלב רוחביים ניתן לחלק לחצאים או לרבעים ו בכתב בצורה כיוון השעון.
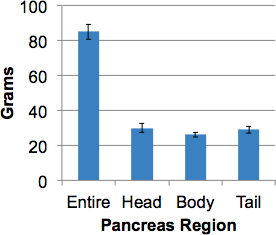
איור 3. הלבלב משקולות איברים מתורמים ללא סוכרת. אתהלבלב שלם מתורמים מבוגרים (> 17 שנים) נשקל מכן מחולקים לאזורים ומשקולות אזוריים שהתקבלו. הנתונים הם ממוצעים ± SEM (N = 15).
Discussion
מטרת נוהל זה היא להגדיר עיבוד הלבלב הרגיל יכול להיות המתואמת פני אתרים מרובים איסוף ובכך לאפשר השוואה של התוצאות שהושגו על ידי קבוצות שונות. שיטת לנתיחה מבוסס על תקן נהלי הפתולוגיה כירורגית עם צעדים נוספים ביאור האזורים הלבלב העיקריים ואחריו התוך אזוריים יחידות משנ...
Disclosures
אין ניגוד עניינים הצהיר.
Acknowledgements
המחברים מודים משפחות של תורמים איברים הרכש ארגונים העוסקים במחקר זה ומריה מרטינו ואירינה Kusmartseva לסיוע המומחה שלהם. עבודה זו מומנה על ידי Juvenile Diabetes Research Foundation (MC-T., MA) בתמיכה של רשת לעוגב תורמים הלבלב עם סוכרת.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| דיסקציה מכשירים כולל אזמלים עם 22 להבים | שונים | שונים | |
| צנטריפוגות מבחנות (15 ו - 50 מ"ל) | פישר סיינטיפיק | 05-539-5, 430828 | סטרילי |
| Cryotubes (1.8 מ"ל) | VWR בצפון אמריקה | 89004-300 | סטריליים, בר קודים אופציונליים |
| RNAlater | Ambion | AM7021 | |
| דיו פתולוגיה כירורגית | |||
| קלטות | מרצדס רפואי | CAS ECO109 | |
| 10% ניטרלי שנאגרו פורמלין | פישר סיינטיפיק | 23-245-685 | |
| אוקטובר Media הקפאת | TissueTek | 4583 | |
| תבניות | ThermoScientific | 58952 | בגדלים שונים |
| Isopentane | פישר סיינטיפיק | O3551-4 | אוקטובר מצמרר אמבטיה |
| קרח יבש | אוקטובר מצמרר אמבטיה | ||
| חנקן נוזלי בבקבוק ויסקי | הצמד cryovials הקפאת | ||
| תרבות צלחת תא (100 מ"מ) | קורנינג | 430167 | סטרילי |
| Hyclone DMEF | ThermoScientific | SH30023.01 | חנות סטרילית, בקירור, כולל גלוטמין |
| בסרום שור עוברית | Cellgro | 35-010-CV | סטריליות, aliquots קפואים חנות |
| פניצילין / סטרפטומיצין / פטריות | GIBCO | 15240-062 | סטריליות, aliquots קפואים חנות |
| הקלד 9 פרפין | ריצ'רד אלן, מדעי | 8337 | |
| 1X D-PBS | GIBCO | 14190-144 | סטרילי |
| 16% Paraformaldehyde | EM למדעים | 15710 | להפוך את החנות טרי, בקירור |
| 8% Glutaraldehyde | EM למדעים | 16019 | להפוך את החנות טרי, בקירור |
| בטיחות ביולוגית רמה 2 מכסה המנוע | שונים | ||
| נמוך במיוחד במקפיא | שונים | ||
| קלטת סאקורה מדפסת | סאקורה | ||
| סאקורה VIP300 | סאקורה | פרפין אוטומטי מעבד | |
| הטבעה פרפין תחנה | ThermoFisher |
טבלה 1. ריאגנטים ספציפיים וציוד.
References
- Brissova, M. Assessment of human pancreatic islet architecture and composition by laser scanning confocal microscopy. J. Histochem. Cytochem. 53, 1087-1097 (2005).
- Rahier, J. The pancreatic polypeptide cells in the human pancreas: the effects of age and diabetes. J. Clin. Endocrinol. Metab. 56, 441-444 (1983).
- Uchida, T., Takada, T., Ammori, B. J., Suda, K., Takahashi, T. Three-dimensional reconstruction of the ventral and dorsal pancreas: a new insight into anatomy and embryonic development. J. Hepatobiliary Pancreat. Surg. 6, 176-180 (1999).
- Wittingen, J., Frey, C. F. Islet concentration in the head, body, tail and uncinate process of the pancreas. Ann. Surg. 179, 412-414 (1974).
- Rahier, J., Goebbels, R., Henquin, J. Cellular composition of the human diabetic pancreas. Diabetologia. 24, 366-371 (1983).
- Vaught, J. An NCI perspective on creating sustainable biospecimen resources. J. Natl. Cancer Inst. Monogr. 42, 1-7 (2011).
- Gianani, R. Initial results of screening of nondiabetic organ donors for expression of islet autoantibodies. J. Clin. Endocrinol. Metab. 91, 1855-1861 (2006).
- Tauriainen, S., Salmela, K., Rantala, I., Knip, M., Hyöty, H. Collecting high-quality pancreatic tissue for experimental study from organ donors with signs of β-cell autoimmunity. Diabetes Metab. Res. Rev. 26, 585-592 (2010).
- In't Veld, P. Screening for insulitis in adult autoantibody-positive organ donors. Diabetes. 56, 2400-2404 (2007).
- Töns, H. A., Terpstra, O. T., Bouwman, E. Heterogeneity of human pancreata in perspective of the isolation of the islets of langerhans. Transplant Proc. 40, 367-369 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved