É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Protocolo de Coleta para Pâncreas Humano
Neste Artigo
Resumo
Este vídeo demonstra um processo para o processamento de dissecção pâncreas humano em formatos de armazenamento. Orientação anatómica é mantida ao longo das regiões pancreáticas para permitir a definição da composição de ilhotas regional e densidade.
Resumo
Esta dissecção e procedimento de amostragem foi desenvolvido para a Rede de Doadores de Órgãos do pâncreas com Diabetes programa (nPOD) para padronizar a preparação do pâncreas recuperado de doadores de órgãos cadáveres. O pâncreas é dividido em 3 regiões principais (cabeça, corpo, cauda), seguido por seriados transversais ao longo do eixo medial para lateral. Secções alternadas são utilizados para parafina fixo e blocos congelados frescos e amostras remanescentes são picados para encaixe preparações amostra congelada, com ou sem inibidores de RNAse, por DNA, RNA, ou o isolamento de proteínas. O objetivo geral do procedimento de dissecção pâncreas é para provar o pâncreas inteiro, mantendo a orientação anatômica.
Heterogeneidade endócrino célula em termos de composição ilhéu, tamanho e número é relatado para ilhotas humanos em comparação com ilhotas de roedores 1. A maioria dos ilhéus humanos a partir da cabeça do pâncreas, regiões do corpo e da cauda são compostos de insulina containin-g beta-células seguido por proporções inferiores de glucagon contendo ct-células e somatostatina-ô-contendo células. Células pancreáticas polipeptídeo contendo PP e células que contêm grelina epsilon também estão presentes, mas em pequenas quantidades. Em contraste, a região uncinado contém ilhotas que são principalmente compostas por células pancreáticas polipéptido contendo 2 pp. Essas variações regionais ilhotas surgem diferenças de desenvolvimento. O pâncreas desenvolve a partir das gemas pancreáticas ventral e dorsal no estômago e depois da rotação do estômago e do duodeno, os movimentos do lóbulo ventral e os fusíveis com o 3 dorsal. O lóbulo ventral forma a porção posterior da cabeça, incluindo o processo uncinado enquanto o lobo dorsal dá origem ao resto do órgão. Variação de pâncreas Regional também é relatado com a região da cauda com maior densidade de ilhota em comparação com outras regiões e os dorsais lobo derivados componentes submetidos a atrofia seletiva na diabetes tipo 1 Órgãos, tecidos e muitas vezes são recuperadas a partir dos doadores de órgãos e incluir nós pancreáticas linfáticos, baço e gânglios linfáticos não-pancreáticas. Estas amostras são recuperados com os formatos similares às utilizadas para o pâncreas com a adição de isolamento de células criopreservadas. Quando o duodeno proximal está incluído com o pâncreas, mucosa duodenal pode ser recolhida para parafina e congeladas blocos e preparações instantâneas picados congelados.
Protocolo
1. Set-up
- Cassetes de etiquetas para blocos de parafina manualmente com um lápis, ou automaticamente com uma impressora cassete. Incluir o identificador do doador (CaseID), tipo de amostra, o número de alíquota, e qualquer identificação adicional única (planilha Case, Anexo 1 ).
- Rotular moldes Oct como para cassetes com um marcador permanente. Corte retângulos de 5-10 cm de papel alumínio.
- Imprima ou manualmente etiqueta com o marcador permanente todos os frascos e tubos. Incluir frascos suficientes para amostras de encaixe picados congelados e tubos com meios RPMI para remessas frescas. Para os frascos de encaixe congelados com RNAlater, adicionar 1 mL de cada RNAlater criotubo.
- Placas de Set-up de dissecação em biossegurança capô e bancadas com instrumentos esterilizados dissecação (pinças, bisturis, lâminas, compressas de gaze (4x4)), bem como cassetes e moldes PTU dispostos em ordem de uso.
- Preparar um banho de congelação, colocandogelo seco numa caixa de isopor de tamanho médio (10x10 cm) a uma profundidade de pelo menos 3 cm e adicionar isopentano até o gelo seco é completamente coberto.
- Opcional: Encha um recipiente pequeno Dewar com nitrogênio líquido.
- Se pâncreas é necessário para microscopia electrónica (ME), preparar fixador TAAB pela adição de 1,25 mL de paraformaldeído a 16%, 1,25 mL de glutaraldeído 8%, e 7,5 mL 0,1 M PBS. Preparar fixador Lowicryl por adição de 2,5 mL de 16% de paraformaldeído e 7,5 mL 0,1 M PBS.
- Prepare soluções usadas para isolar as células. Para frasco de 500 ml de DMEF (com glutamina), siga técnicas assépticas, acrescentando o seguinte:
- Soro fetal de bovino (FBS): adicionar 50 mL, 10% final.
- Penicilina / estreptomicina (Pen / Strep, 10.000 U / mL / 10.000 ug / mL de stock) - adicionar 5 ml de caldo de Pen / Strep para RPMI para a concentração final de 100 U / mL / 100ug/mL. Também adicionar 5 ml de uma garrafa de 500 ml de DPBS, quando utilizados para a realização de gânglios linfáticos ou de amostras de baço.
2. Pessoal
- Procedimento é perfeitamente realizado com três funcionários no entanto, o procedimento pode ser realizado com um indivíduo bem treinado. Dois indivíduos podem geralmente completar o procedimento em 90 minutos. Duração real depende da quantidade de tecidos recebidos e facilidade de encontrar gânglios pancreáticos. As amostras para isolamentos de células são mantidas a 4 ° C até à conclusão da dissecção tecido, enquanto as amostras de soro são processadas em paralelo.
- Patologista, assistente de patologia, ou equivalente, um membro do pessoal experiente leva a manipulação de tecidos e executa dissecações principais, incluindo divisão (s) de cabeça do pâncreas e colheita gânglios pancreáticos. Os esforços iniciais são direcionados para pâncreas, seguido de exame de peri-pancreático gordura para os gânglios linfáticos.
- Técnico de laboratório ou equivalente pessoal-membro treinado em tecido de corte cuja principal responsabilidade é para pesar pâncreas e regiões e tecidos de acabamento para os blocos fixos ou congelada e pressão v congeladoIALS. Recebe duodeno e baço de assistente de patologia e processa esses órgãos, enquanto o assistente de patologia está processando o pâncreas.
- Membro assistente de laboratório pessoal, que auxilia os outros, incluindo blocos e rotulagem do frasco, por exemplo picagem criotubos e processamento de soro.
3. Dissecação Pancreas
- Retire o duodeno eo baço e limpar o pâncreas de gordura estranhos, vasos e nervos com dissecção romba e aguda
- Coloque o pâncreas limpos em um tabuleiro de dissecação coberta com toalhas de papel. Mergulhar um aplicador com ponta de algodão com tinta azul e propagação na superfície anterior do pâncreas. Seque o excesso.
- Opcional: Mergulhar um novo aplicador de tinta preta e propagação na superfície posterior do pâncreas. Retornar pâncreas a orientação normal com a superfície anterior de frente para patologista.
- Corte o pâncreas em 3 regiões: cabeça, corpo e cauda (Figura 1). Corte a junção entre head corpo e, em seguida, dividir o restante em partes iguais do ~ para o corpo e cauda.
- Pesar cada região do pâncreas e registro pesos (folha Caso workup ( Apêndice 1 )).
- Seção (aprox. 0,5 cm) de cada região do pâncreas em um "pão de forma" transversal forma (Figura 1).
- Use as seções de ambas as junções entre as regiões para as amostras moídas. Dependendo do tamanho do pâncreas, uma amostra a partir da região de junção do corpo da cauda-pode ser difícil de obter, caso em que o número de blocos de parafina pode ser reduzida para obter amostras de picadas ou apenas as amostras obtidas do pâncreas região cabeça-corpo pode ser obtida. Criotubos etiqueta de acordo com a cabeça ou o corpo para denotar região proximal na junção.
- Picar pedaços e dividir igualmente entre criotubos (≥ 1 grama por frasco). Rapidamente congelar os frascos sem RNALater em nitrogênio líquido ou gelo seco no - suspensão isopentano em seguida, transferir toa -80 ° C congelador.
- Manter frascos com RNALater à temperatura ambiente durante 30 minutos para permitir o equilíbrio, remix e rapidamente congelar em azoto líquido ou na suspensão de gelo seco-isopentano, em seguida, transferidos para um congelador -80 ° C.
- Remover secções alternadas de parafina e blocos OCT começando com parafina (Figura 1).
- Incline-se para todas as seções transversais para a direita.
- Coloque ~ 1,5 x 1,5 x 0,5 cm em seções as cassetes. Se as secções transversais são muito grandes, cortado em meia (Figura 2b). Cassetes de etiquetas para metade anterior azul como "A" e metade posterior como "B".
- Se as peças são ainda muito grande, cortar cada secção perpendicular ao corte anterior (Figura 2c). Cassetes de etiquetas AD no sentido horário. Corte pedaços mais forem necessárias, para caber dentro de cassetes.
- Blocos de números em seqüência dentro de região, começando com a parte mais medial.
- Para blocos de parafina, a posição cassettes forma que o rótulo é para a esquerda e local do tecido na cassete, mantendo a sua orientação. Tampa da fita estreita e transferência para um recipiente com ~ 500 ml de 10% formalina tamponada neutra (NBF). Inicie a fixação de temporização, quando a cassete último é colocado em fixador.
- Para blocos de PTU, despeje uma fina camada de outubro de mídia dentro do molde prelabeled em seguida, colocar o tecido no molde tendo a certeza de manter a orientação e cobrir o tecido com outubro Rapidamente mergulhe os moldes PTU em um gelo seco - suspensão isopentano de ~ 1 minuto. Remover a partir de pasta e local em gelo seco para o armazenamento temporário ou em -80 ° C congelador para armazenamento a longo prazo.
- Obter ~ de 0,5 x 0,5 cm fatias a partir da junção cabeça-corpo para microscopia eletrônica (ME). Fatia único lugar do fixador TAAB e outra fatia no fixador Lowicryl. Armazenar os dois tipos de fixador com amostras a 4 ° C durante pelo menos 48 horas e / ou indefinidamente até processamento posterior para EM.
4. Baço, Linfonodo dissecçãoções e do mucosa duodenal dissecções
- Isolar nodos linfáticos pancreáticas (PLN) de gordura e aparar todo o tecido conjuntivo para a cápsula de nó. Coloque no prato estéril de cultura de células contendo DMEF. Dependendo números totais isoladas, dividir PLN em alíquotas para as transferências frescas, isolamentos de células criopreservadas, parafina e / ou blocos OCT e frascos. Picar em pedaços grandes nós não maiores que 0,5 cm.
- Picar nós pancreáticas não-linfáticos e no baço em pequenos (aprox. 0,5 cm) cubos. Coloque em fixador, mídia outubro, e ou DMEM para remessas de amostras frescas ou isolamentos de células criopreservadas de acordo com os valores das matérias-primas.
- Abra o duodeno e limpe cuidadosamente a mucosa duodenal de muco limpo com uma gaze umedecida. Cortar secções da mucosa para parafina e / ou blocos congelados OCT e amostras moídas para frascos, com e sem RNAlater. Congelar como para outras amostras.
5. Quebrar blocos OCT no pré-rotulados papel alumínio e colocar blocos de PTU e frascos em caixas para armazenamento a longo prazo a -80 ° C.
6. Enviar amostras fixas de Processamento de parafina
- Fixar tecidos durante 16 horas (intervalo de 20 ± 4 horas), utilizando um processador automático de parafina ou usando temporização manual. Processo para blocos de parafina, usando um processador automático ( Apêndice 2 ).
- Incorporar secções na orientação exacta tal como é colocado pelo patologista com o rótulo da cassete para a esquerda. Incorporar a mucosa duodenal com a superfície de corte para baixo para permitir o exame da perpendicular mucosa para a submucosa.
7. Limpe as áreas de dissecação e desinfectar. Lave instrumentos de dissecção e re-esterilizar. Coloque tecidos remanescentes humanos em fixador de formalina para o armazenamento como resíduos biomédica. Descartar lixo biomédico de acordo com os regulamentos locais dentro de um mês.
8. Atualizar o sistema de inventário Amostra
ve_title "> 9. resultados representativosEste procedimento irá processar um pâncreas humano intacto com uma amostragem representativa em todo o órgão, incluindo demarcação das três grandes regiões, a saber, cabeça, corpo e cauda dentro de 2 horas. A região uncinado, encontrado na região posterior da cabeça, é incluído na dissecção cabeça. O peso médio de pâncreas de doadores de órgãos sem diabetes foi de 82,4 gramas (52,7 - 139,0 gramas). Pesos pâncreas regionais foram aproximadamente iguais (Figura 3).
Este procedimento também pode permitir a reconstrução do pâncreas inteiro usando lâminas coradas de parafina seqüencial e blocos PTU. Vários formatos são viáveis permitindo a máxima utilização de tecnologias atuais e futuras. A planilha caso atual nPOD é fornecido ( Anexo 1 ) que é utilizado para documentar as amostras recuperadas e proc subseqüenteessing por tipos de alíquotas e quantidades.
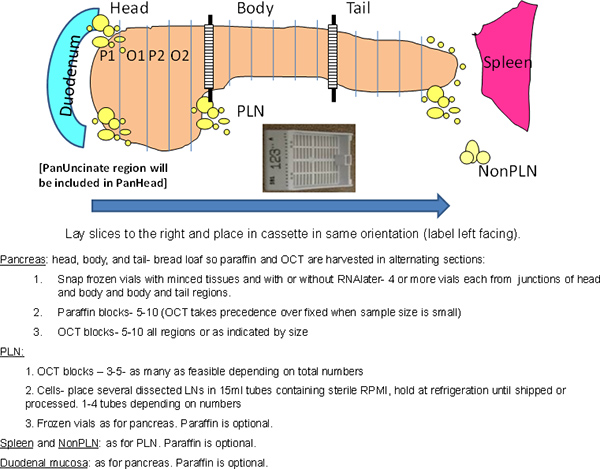
Figura 1. Esquema geral do processo. O pâncreas inteiro é processado, mantendo orientações anatômicas. A região da cabeça é mais longo do eixo superior-inferior devido à presença do lobo pancreático ventral na região posterior, que inclui a região uncinado. Área hachurada nos cruzamentos denotar regiões usadas para amostras moídas em criotubos. P, parafina, O, outubro
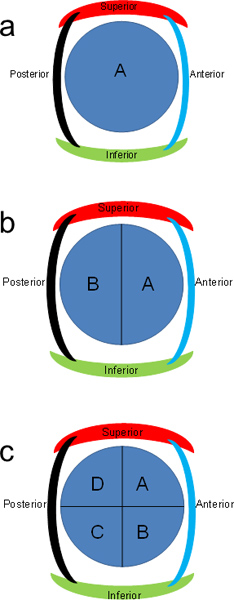
Figura 2. Esquema de letras para as secções de pâncreas. Fatias transversais do pâncreas pode ser dividido em metades ou quartos e letras no sentido horário.
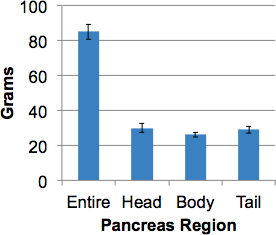
Figura 3. Pesos de pâncreas de doadores de órgãos sem diabetes. Ospâncreas intacta de doadores adultos (> 17 anos) foi pesado, em seguida, dividido em regiões e pesos regionais obtidos. Os dados são médias ± SEM (n = 15).
Discussão
O objectivo deste procedimento é definir um processamento pâncreas padrão que pode ser harmonizadas entre os locais de recolha múltiplas e, assim, permitir a comparação dos resultados obtidos por diferentes grupos. O método de dissecção é baseada no padrão cirúrgicos práticas patologia com passos adicionais para anotação das regiões mais importantes do pâncreas seguido por intra-regionais subdivisões. Padronização de métodos de processamento biospecimen é necessário para facilitar a recolha de amo...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Os autores agradecem as famílias dos doadores e as Organizações de Procura de Órgãos envolvidos na pesquisa e Martino Maria e Irina Kusmartseva para a sua assistência especializada. Este trabalho foi financiado pela Juvenile Diabetes Research Foundation (MC-T., MA), em apoio da Rede de Doadores de Órgãos do pâncreas com Diabetes.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Instrumentos de dissecção incluindo bisturis com 22 lâminas | Vário | Vário | |
| Tubos de centrífuga (15 e 50 ml) | Fisher Scientific | 05-539-5, 430828 | Estéril |
| Criotubos (1,8 ml) | VWR América do Norte | 89004-300 | Estéreis, códigos de barras opcionais |
| RNAlater | Ambion | AM7021 | |
| Tinta Patologia Cirúrgica | |||
| Cassetes | Mercedes Medical | CAS ECO109 | |
| 10% formalina tamponada neutra | Fisher Scientific | 23-245-685 | |
| Congelamento de mídia PTU | TissueTek | 4583 | |
| Moldes | ThermoScientific | 58952 | Vários tamanhos |
| Isopentano | Fisher Scientific | O3551-4 | Outubro banho frio |
| O gelo seco | Outubro banho frio | ||
| Nitrogênio líquido em frasco de Dewar | Encaixe criotubos de congelamento | ||
| Prato de cultura de células (100 mm) | Corning | 430167 | Estéril |
| Hyclone DMEF | ThermoScientific | SH30023.01 | Loja, estéril refrigerado, glutamina incluído |
| Soro Fetal Bovino | Cellgro | 35-010-CV | Estéreis, loja de alíquotas congeladas |
| Penicilina / estreptomicina / Antifungal | GIBCO | 15240-062 | Estéreis, loja de alíquotas congeladas |
| Digite 9 Parafina | Richard Allan-Científico | 8337 | |
| D-PBS 1X | GIBCO | 14190-144 | Estéril |
| Paraformaldeído 16% | EM Sciences | 15710 | Faça loja fresco, refrigerado |
| Glutaraldeído 8% | EM Sciences | 16019 | Faça loja fresco, refrigerado |
| Nível de Biossegurança 2 capa | Vário | ||
| Ultra-baixo congelador | Vário | ||
| Printer Cassete Sakura | Sakura | ||
| Sakura VIP300 | Sakura | Processador automático de parafina | |
| Estação de Inclusão em Parafina | ThermoFisher |
Tabela 1. Reagentes específicos e equipamentos.
Referências
- Brissova, M. Assessment of human pancreatic islet architecture and composition by laser scanning confocal microscopy. J. Histochem. Cytochem. 53, 1087-1097 (2005).
- Rahier, J. The pancreatic polypeptide cells in the human pancreas: the effects of age and diabetes. J. Clin. Endocrinol. Metab. 56, 441-444 (1983).
- Uchida, T., Takada, T., Ammori, B. J., Suda, K., Takahashi, T. Three-dimensional reconstruction of the ventral and dorsal pancreas: a new insight into anatomy and embryonic development. J. Hepatobiliary Pancreat. Surg. 6, 176-180 (1999).
- Wittingen, J., Frey, C. F. Islet concentration in the head, body, tail and uncinate process of the pancreas. Ann. Surg. 179, 412-414 (1974).
- Rahier, J., Goebbels, R., Henquin, J. Cellular composition of the human diabetic pancreas. Diabetologia. 24, 366-371 (1983).
- Vaught, J. An NCI perspective on creating sustainable biospecimen resources. J. Natl. Cancer Inst. Monogr. 42, 1-7 (2011).
- Gianani, R. Initial results of screening of nondiabetic organ donors for expression of islet autoantibodies. J. Clin. Endocrinol. Metab. 91, 1855-1861 (2006).
- Tauriainen, S., Salmela, K., Rantala, I., Knip, M., Hyöty, H. Collecting high-quality pancreatic tissue for experimental study from organ donors with signs of β-cell autoimmunity. Diabetes Metab. Res. Rev. 26, 585-592 (2010).
- In't Veld, P. Screening for insulitis in adult autoantibody-positive organ donors. Diabetes. 56, 2400-2404 (2007).
- Töns, H. A., Terpstra, O. T., Bouwman, E. Heterogeneity of human pancreata in perspective of the isolation of the islets of langerhans. Transplant Proc. 40, 367-369 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados