Method Article
תרבות ושיתוף התרבות של עכבר שחלות וזקיקים בשחלות
In This Article
Summary
פרוטוקול זה מתאר את התרבות העיקרית / שיתוף התרבות של רקמת השחלה עכבר, באמצעות השחלות מעכברים בילוד וזקיקים בשחלות בודדות מעכברים לפני גיל בגרות מיניים. טכניקות התרבות לתמוך בפיתוח באופן פיסיולוגי מאוד, המאפשר חקירה של ההשפעה של סוכנים חיצוניים בשחלה, ושל יחסי גומלין בין זקיקים בשחלות.
Abstract
השחלה היונקים מורכבת של זקיקים בשחלות, כל זקיק המורכב מביצית אחת מוקפת בתאים סומטיים granulosa, מצורף יחד בתוך קרום במרתף. בריכה סופית של זקיקים הוא הניחה במהלך התפתחות עוברית, כאשר ביציות במעצר meiotic ליצור קשר קרוב עם תאי granulosa שטוחים, ויצרו זקיקים בראשיתי. על ידי או זמן קצר לאחר לידה, השחלות יונקים מכילות אספקה של חייהם של זקיקים בראשיתי, שממנו נקודה זו ואילך יש שחרור קבוע של זקיקים לתוך בריכת הזקיקים גדלה.
השחלה היא נוחה במיוחד להתפתחות במבחנה, עם זקיקים גדלו באופן פיסיולוגי מאוד בתרבות. עבודה זו מתארת את התרבות של השחלות בילוד כל המכילות זקיקים בראשיתי, והתרבות של זקיקים בשחלות בודדים, שיטה שיכול לתמוך בפיתוח של זקיקים מבוגרים ועד לpreovuשלב latory, לאחר שהביציות שלהם מסוגל לעבור הפריה חוץ גופית. העבודה המתוארת כאן משתמשת במערכות תרבות כדי לקבוע כיצד השחלה מושפעת מחשיפה לתרכובות חיצוניות. גם אנו מתארים מערכת שיתוף תרבות, המאפשרת חקירה של האינטראקציות המתרחשות בין זקיקים גדלו והבריכה שאינו הצומחת של זקיקים בראשיתי.
Introduction
השחלה היונקים מורכבת מהאספקה של נקבת חיים של ביציות, כל כלול בתוך זקיק בשחלה. הזקיקים נוצרים לפני הלידה במנוחה, שלב ראשוני: פעם אחת בריכת הזקיק הוקמה, יש תנועה מתמדת והדרגתית של זקיקים מהקדמוניים לתוך בריכת הזקיק גדלה. כאשר זקיקים מתחילים לגדול, הם מפתחים בשלבים הראשוניים, שניוניים, preantral ולאחר מכן Antral, עד שהם מגיעים preovulatory, או Graafian, שלב. יש רק ביציות מזקיקי preovulatory יכולת התפתחותית מלאה, מסוגל לתמוך בהתפתחות עוברית לטווח, אם מופרה.
השחלה כבר זמן רב ידוע לפתח באופן פיסיולוגי מאוד במבחנה. זה עשוי להיות בגלל כל זקיק בשחלה המכיל בתוכו את התאים דרושים כדי לתמוך בביצית מהבמה בשלה (ובשלב זה הוא לא הצליח להשלים את חלוקת meiotic) ועד לtהוא שלב בחינה התפתחותית מוסמך (ובשלב זה יכול לתמוך בהשלמת מיוזה, הפריה וההתפתחות של עובר וכתוצאה מכך לטווח מלא).
הטבע הפיזיולוגי של התפתחות השחלה במבחנה הוביל לשימוש הנרחב בטכניקות תרבות השחלה. כתוצאה מכך, במבחנה השיטות נעשו שימוש כדי לחקור הרגולציה של פיתוח השחלה, פתולוגיה השחלות (למשל זה של תסמונת שחלות פוליציסטיות, PCOS), בדיקה של כמה השחלות / ביציות מושפעות מחשיפה לכימיקלים, וגם במטרה המעשית של קבלת ביציות fertilizable מזקיקים בשחלות בראשיתי. עד כה, האחרון הושג רק באמצעות רקמת השחלה עכבר 1, למרות שטכניקות תרבות באמצעות זקיקים מיונקים גדולים, כולל בני אדם, השתפרו מאוד בשנים האחרונות 2,3.
אנו מתארים כאן כמה שיטות תרבות באמצעות רקמת השחלה עכבר. Metho הראשוןד משתמש השחלות עכבר בילוד כל, ותומך בהיווצרות וההתפתחות המוקדמת של זקיקים בראשיתי 4. מערכת השנייה תומכת בצמיחה של זקיקים בודדים, ללא פגע משחלות preantral מאוחר לבמה preovulatory; שימוש בטכניקה זו, יכול להיות מתורבת זקיקים בנפרד, או בזוגות 5,6. לבסוף, אנו מתארים מערכת שיתוף תרבות, המשלבים את שתי הטכניקות הראשונות בשיטה המאפשרת חקירה של האינטראקציות בין גובר וזקיקים בשחלות קדמוניים 7.
תרבות של זקיקים בשחלות בשלמות פרט מאפשרת צמיחת זקיק שתיקבע ממדידות זקיק יומיות בתקופת התרבות, תוך ניתוח בינוני מאפשר חקירה של זקיק / ייצור הורמון השחלה. ניתן להשיג ניתוחי רקמות נוספים על ידי אוסף של זקיקים או רקמת השחלה בסוף התרבות, לניתוחי immunohistological / היסטולוגית או לעיבוד שלאחר מכן למשל להשיגmRNA או חלבונים.
Protocol
כל העבודה בבעלי החיים בוצעה בהתאם להנחיות מוסדיות ברישיון על ידי משרד הפנים בבריטניה (מספר רישיון פרויקט PPL 60/1726 ו60 / 4026).
הערה: בעלי חיים בית בהתאם לדרישות משפטיות בבריטניה באור 14 שעות וphotoperiod כהה 10 שעות. ניסויים בבעלי חיים התנהגות באמצעות עכברי C57Bl6J סוג בר, טאו-GFP עכברים שיש לי ביטוי בכל מקום של חלבון פלואורסצנטי ירוק (GFP) 8, ועכברים Thy1-YFP עם ביטוי מזדמן של חלבון פלואורסצנטי הצהוב (YFP) בתת-קבוצה של תאים עצביים 9: שני קווים מהונדסים גדלו על רקע C57Bl6J.
1. תנאי עבודה והכנה של מכשירים
- לבצע את כל הכנות התקשורת, והניתוחים רקמה, ועבודת התרבות בזרימה למינרית כדי להבטיח סטריליות: זה ימנע את הדרישה של התוספת של אנטיביוטיקה לתקשורת.
- אפשר תמיד תקשורת / צלחות תרבות / מנות עובר לאזןבמשך שעה לפחות 1, בתנור 37 ° C (מדיום לנתיחה / מנות עובר) או 37 מעלות צלזיוס, 5% CO 2 באינקובטור (מדיום תרבות וצלחות), לפני השימוש.
- משרים טפטפות זכוכית בפתרון 0.1% אלבומין בסרום השור (BSA) כלשעה, ולאחר מכן להשאיר לייבוש. משוך טפטפות בלהבה של מבער בונזן, כיפוף הזכוכית כפי שאתה עושה כל כך, כדי לייצר pipettes זכוכית המעוגל נמשך דק. לאחר פיפטה נמשכת, לעשות חתך נקי עם חותך זכוכית. תנור לעקר 160 מעלות צלזיוס במשך 45 דקות סביב.
הערה: חנות של טפטפות הזכוכית אלה תהיה צורך להעביר השחלות וזקיקים.
2. הכנת מדיה Dissection והתרבות
- הכן Dissection בינוני.
- לפזר 3 מ"ג / מיליליטר BSA במדיום ליבוביץ L15 ומסנן לעקר באמצעות 0.2 מיקרומטר נקבובית, מסנן קוטר 25 מ"מ.
- יילודים שחלו תרבות.
- להכין מדיום לתרבות השחלה בילוד, לעשות 1 מיליליטר של מדיום לEACהשחלה h שיהיה בתרבית. לפזר 3 מ"ג / מיליליטר BSA במדיה Essential α-מינימאלי (αMEM) ומסנן לעקר באמצעות 0.2 מיקרומטר נקבובית, מסנן קוטר 13 מ"מ לתוך צינור סטרילי.
- כדי להכין צלחות לתרבות השחלה בילוד, להוסיף 1 מיליליטר של מדיום תרבות השחלה יילודים לכל אחד (שחלה אחת לכל טוב) גם צלחת 24 גם. בעזרת מלקחיים שען סטרילי, מקום קרום פוליקרבונט אחת על גבי המדיום בכל פני השטח היטב, מבריק. UV לעקר קרומים לפני השימוש.
- זקיק תרבות.
- להכין מדיום לתרבות זקיק, מדיה Essential תוספת α-מינימאלית עם 1 IU / ml הורמון רקומביננטי זקיק אדם גירוי, 5 מיקרוגרם / מיליליטר חומצה אסקורבית ו -5% בסרום v / v שהתקבלה בעכברים נקבה בוגרים. סנן לעקר דרך 0.2 מיקרומטר נקבובית, מסנן קוטר 13 מ"מ לתוך צינור סטרילי.
- סנן לעקר שמן סיליקון דרך פילטר בקוטר 0.45 מיקרומטר נקבוביות, מ"מ 25, לתוך צינור סטרילי.
- כדי להכין PLATES, מקום 30 טיפות μl של מדיום תרבות זקיק לבאר כל תרבות שאינה רקמה שטופל צלחת עגולה היטב microtiter 96-היטב, תוך שימוש בשורה העליונה בלבד של כל צלחת (כדי לאפשר זקיקים שעברו לשורות חדשות בכל יום על פני תקופת התרבות). כיסוי בזהירות בינוני עם 70 μl של שמן סיליקון מעוקר, על מנת למנוע אידוי בינוני.
- זקיק בשחלה Co-תרבות.
- להכין מדיום לתרבות משותפת זקיק-השחלה כלתרבות זקיק בשלב 2.3.1 לעיל, מה שהופך את 1 מיליליטר של מדיום לכל שיתוף תרבות זקיק-השחלה בשלבי קמה.
- כדי להכין צלחות, להוסיף 1 מיליליטר של מדיום לבאר כל צלחת 24 גם. בעזרת מלקחיים שען סטרילי, מקום אחד קרום Nucleopore על גבי המדיום בכל פני השטח היטב, מבריק. UV לעקר קרומים לפני השימוש.
3. ילודים שחלו Dissection ותרבות
- מקום 1 מיליליטר של מדיום לנתיחה לכל מנה עובר זכוכית סטרילית.
- גורי עכבר יילודים ללקט בגילים שבין יום הלידה 0 ו -5, לקטו על ידי עריפת ראש בהתאם לתקנות משרד פנים בבריטניה.
- לתפוס את העור המכסה את דופן הבטן בעזרת זוג מלקחיים לנתיחה קנס ולעשות חתך גדול בדופן העור וגוף. משוך לפתוח את החתך כך כל הבטן חשופה. שלפוחית השתן הוא בדרך כלל צבה בשלב זה ויכול להיות ניקב לעשות נתיחה קלה יותר.
- הזז את אומץ מהדרך באמצעות מלקחיים שען. בצע את קרן הרחם משלפוחית השתן עד הכליות בכל צד. השחלה ממוקמת ממש מתחת לכליה בחלק העליון של הרחם והוא יופיע כמבנה דמוי ענן-תחת מיקרוסקופ לנתח.
- לתפוס את השחלה בעדינות עם מלקחיים שען, ולהשתמש במספריים לנתק זיקתו לרחם. העבר את זוג השחלות למאכלי עובר המכילים בינוני לנתיחה מחוממת מראש.
- לבצע נתיחת קנס של השחלות תחת מיקרוסקופ לנתיחה על sta מחומםge (37 מעלות צלזיוס). משתמש במחטי אינסולין כדי לחתוך את שק bursal וכל חומר עודף כוללים החצוצרה, עד שרק את השחלה נשארה.
- העבר את כל השחלה לתוך הבאר של צלחת תרבות מוכנה בשלב 2.2.2 לעיל, באמצעות פיפטה נמשכת דק מעוקלת זכוכית, שחלה אחת על גבי זה קרום (ראה איור 1 א). תרבות ב37 ° C, חממה 5% CO 2.
- לשנות את המדיום בכל יום שני. השתמש פיפטה להחליף 50% של המדיום בכל טוב לבינוני-גז מראש טרי: מקום קצה פיפטה בקצה של הבאר של מדיום, כדי למנוע הפרעה לממברנה.
- לשמור על תרבויות של עד 6 ימים.
- בסופו של התרבות, להקפיא בינוני ולתקן או להקפיא את השחלות אחרי שטיפה קצרה בPBS, כנדרש.
- תקן את השחלות במקבע של Bouin למשך 90 דקות לניתוח היסטולוגית, או ב 10% ניטראליים שנאגרו פורמלין למשך 90 דקות לניתוח immunohistological. Snap להקפיא את השחלות על ידי הצבת רקמה בצינור פוליפרופילן, הצבת הצינור בקרח יבש למשך 5-10 דקות לפני ההקפאה בC ° -70 לחלבון הבא או מיצוי mRNA.
4. זקיק Dissection ותרבות
- לברור נקבות עכברים ישנים 19-23 יום ולבודד את השחלות. להרטיב את הפרווה עם 70% אתנול לפני ביצוע חתכים. לצבוט את העור באמצעות מלקחיים הסתיימו בוטים ולעשות חתך גדול בבטן עם מספריים לנתיחה, חודר דרך שני העור וקיר הגוף.
- הזז את בטן מהדרך באמצעות סדרה של מכשירי נתיחה עדינה ולאתר את הרחם. בצע את הרחם עד שחלה בו ממוקם מתחת לכליה בכל צד.
- בעדינות לתפוס את השחלה בעזרת זוג המלקחיים שען, לנתק את הקובץ המצורף השחלות אל הרחם עם מספריים לנתיחה קנס. הימנע איסוף יותר מדי כרית שומן השחלות. לאסוף את השחלות ולהעביר לתוך מנות עובר המכילות בינוני לנתיחה מחוממת מראש.
- Reלהזיז את הבורסה השחלות באמצעות מחטי אינסולין כדי לחתוך את שק bursal וכל חומר עודף כוללים החצוצרה, עד שרק את השחלה נשארה. בערך לחצות כל השחלה באמצעות מחטי אינסולין.
- להעביר בזהירות כל השחלה חצי לתוך זכוכית שעון בודדת המכילה 1 מיליליטר מדיום לנתיחה. כיסוי כל זכוכית שעון עם שקופיות זכוכית כדי למנוע אידוי של מדיום וכדי להבטיח סטריליות.
- משקפיים שעון חנות המכילים חצאים השחלה בתנור 37 ° C עד צורך, אבל לבצע את הצעד הבא לנתיחה בהקדם האפשרי. בטל רקמה מאוחסנת בדרך זו ליותר משעה.
- זכוכית שעון העברה המכילה מחצית השחלה לבמת מיקרוסקופ המחומם 37 מעלות צלזיוס בזרימה למינרית. בערך לנתח השחלה לחתיכות גדולות באמצעות שתי מחטי אינסולין, על מנת לזהות זקיקים מראש Antral מאוחר כדלקמן: אלה יכילו 2-3 שכבות של תאי granulosa ויש לי קוטר של כ 180-200 מיקרומטר.
- באופן ידני לנתח את כל iזקיקי dentified באמצעות מחט אינסולין אחת ומחט דיקור 30 x 0.25 מ"מ אחד שכבר השיגה בבעל מחט. להיות זהיר כדי להסיר את רוב stroma מסביב, אבל לא לגרום נזק לlamina הבסיס של זקיקים (ראה איור 1).
- השתמש פיפטה זכוכית מעוגלת נמשכת דק להעביר בזהירות זקיקים גזורים לתוך כוס שעון איסוף המכילה בינוני לנתיחה מחוממת מראש. הקפד לשמור זקיקים בתוך קטע הקליבר הדק של פיפטה כדי למנוע אובדן של זקיקים.
- זקיקים למדוד במדויק באמצעות מצויד לתוך מיקרוסקופ לנתח graticule עינית מכוילת.
- זקיקים בחרו לתרבות רק אם הם מודדים 190 ± 10 מיקרומטר בקוטר. יתר על כן בחר זקיקים רק בריאים, כדוריים לתרבות; אלה יהיו שקופים, ללא אזורי atretic כהים, ויש לי lamina בסיס שלם, יחד עם כמה רקמות thecal מצורפים: לבטל את כל זקיקים שאינם מתאימים לתיאור זה. תשואה של בין 10-15 זקיקים לשחלה הוא טובים.
- השתמש פיפטה זכוכית מעוגלת נמשכת דק להעביר זקיק בודד לתוך הבאר של צלחת המורכבת כמו בשלב 2.3.3 לעיל. זהירות במקום הזקיק בתחתית הבאר (ולא בשכבת השמן העליונה). תרבות ב37 ° C, חממה 5% CO 2.
- זקיקי תרבות לתקופה של עד 6 ימים, נעו זקיקים למדיום חדש המכיל גם כל יום.
- הכן את השורה הבאה בצלחת 96-גם בהכנת צלחת בשלב 2.3.3 לעיל. חזור צלחת בחממה במשך שעה לפחות, כדי לאפשר איזון. העבר את הזקיקים לתוך בארות טריות של מדיום, בעזרת פיפטה זכוכית נמשכת דק.
- אם בכל נקודה בתרבות זקיקים יש להשאיר ליומיים לפני שעברנו למדיום חדש, למקם את כל זקיק במינימום של 60 μl (ולא 30 μl) טיפות של מדיום תרבות זקיק.
- כדי לאסוף נתונים על צמיחת זקיק, למדוד זקיקים יומיים, באמצעות EYgraticule epiece מצויד לתוך מיקרוסקופ לנתח. שכבת השמן תעוות מדידות של קוטר זקיק, כך תסתדר מקדם כיול להגדרה.
- בסופו של התרבות, להקפיא בינוני ולתקן או להקפיא רקמה לניתוח שלאחר מכן, כמו בשלב 3.10 לעיל.
- זקיק זקיק Co-תרבות.
- שני זקיקי תרבות יחד, לחקור אינטראקציות בין זקיקים. תרבות כאמור לעיל, אך להציב שני זקיקים צד-לצד, במגע, וב.
- הנח 100 טיפות μl של מדיום תרבות זקיק לבאר כל תרבות שאינה רקמה שטופל צלחת שטוחה היטב microtiter 96-היטב, שכיסה בינוני עם שמן סיליקון מעוקר 100 μl. אל תעביר את הזקיקים לתוך בארות טריות כמו בשלב 4.13 לעיל, אך במקום להשתמש בטיפ ג'ל עדין לשינוי של 50% של המדיום בכל יום אחר.
- על מנת לזהות את מקורות רקמות בתוך התרבות המשותפת, התרבות משותפת זקיקים כל ממקור גנטי שונה, למשל one מהשחלה של עכבר סוג בר, ואחרים מהשחלה של עכבר עם ביטוי בכל מקום של GFP. אם אתה משתמש GFP או רקמת YFP, לצמצם את החשיפה של רקמה להדליק ככל האפשר, בתרבות, ודרך שלבי קיבעון / עיבוד לאחר מכן.
הערה: זה נורמלי לשני הזקיקים לגדול יחד ליחידה אחת, 'שני-זקיק' (ראה איור 1 ג).
5. שיתוף תרבויות זקיק שחלה
- לנתח השחלות וזקיקים החוצה כמו בסעיפים 3 ו -4 לעיל.
- הנח השחלה ילוד אחד על גבי קרום, בצלחת מוכנה כמו בשלב 2.4.2 לעיל. זהירות במקום זקיק בודד במגע עם מוט אחד בשחלה בילוד, בעזרת פיפטה זכוכית מעוגלת נמשכת דק. תרבות ב-37 מעלות צלזיוס, 5% CO 2 באינקובטור עד 5 ימים.
- כדי להבחין בין מקור הרקמה בתוך התרבות המשותפת, להשתמש השחלות וזקיקים משני שונים כל כךurces, למשל אחד מעכבר סוג בר, ואחד מעכבר עם ביטוי בכל מקום של GFP.
- החלף 500 μl של מדיום יומי כמו בשלב 3.8 לעיל, אך שימוש במדיום תרבות זקיק. במהלך שיתוף התרבות, הזקיק הופך לעתים קרובות במארז ידי השחלה (1D איור).
- בסופו של התרבות, להקפיא בינוני ולתקן או להקפיא רקמה לניתוח שלאחר מכן, כמו בשלב 3.10 לעיל.
6. קיבוע, Immunocytochemistry והדמיה של רקמות בתרבית
- בסופו של תרבות, לשטוף רקמות בPBS ולהעביר 100 μl (זקיק) או 1 מיליליטר (השחלה) של 10% ניטראלי שנאגרו פורמלין, ולתקן עבור שעה 1 על קרח. לעבור 3 שוטף של 1x PBS על 4 מעלות צלזיוס.
- לimmunocytochemistry על זקיקים, העברה בין הבארות של צלחת microtiter 96-היטב עגולה היטב בעזרת פיפטה זכוכית מעוגלת נמשכת דק, עם כל שטיפות שונות המכילות גם או טיפולים.
- לimmunocytochemistry על ovaries (או השחלה זקיק שיתוף תרבויות), להטביע ב 4% agarose ג'ל וסעיף 50 מיקרומטר באמצעות vibrotome. חלקים לצוף בבארות של צלחת 24 גם ליישם שטיפות או טיפולים, הסרת עם טפטפת.
- הדמיה: להעביר סעיפי agarose שקופיות זכוכית שטוחות והר עם ההרכבה בינונית; או זקיקי העברה (או מערכות זקיק זקיק) לשקופיות זכוכית חלל והר עם לא-התקשות הרכבה בינונית. דגימות תמונה באמצעות מיקרוסקופ confocal.
תוצאות
איור 1 מציג תמונות של השחלות וזקיקים בתחילת, ובמהלך, נהלי התרבות.
איור 2 מציג תוצאות נציג של השחלות בילוד (כאן, השחלות מגורים שנולדו) נחשפו לרעלי רבייה במהלך התרבות. השחלות בילוד היו בתרבית במשך 6 ימים, ונחשפו לתרופה כימותרפית, או ציספלטין או דוקסורוביצין, ביום 2 של התרבות. בסופו של התרבות, השחלות היו קבועות, מעובד להיסטולוגיה, ושחלות אז בדקו כדי לקבוע את מספר זקיקים בשחלות בריאים ולא בריאים 4. לחלופין, ניתן לקבל הערכה מהירה יותר של זקיקים גדלו מוקדם מהתרבות של שברי השחלות, באמצעות השחלות מעכבר להביע סמן פלואורסצנטי ביצית ספציפית 10.
במהלך התרבות של זקיקים בודדים, צמיחת זקיק ניתן ללמוד בקלות על ידי מדידות יומיות ברחוב ללא מוצאture תקופה. איור 3 מציג תוצאות נציג של הצמיחה של זקיקים בתרבית בנוכחות או עדר של הורמוני gonadotrophin הורמון מגרים זקיק (FSH) והורמון luteinizing (LH) 5.
זקיק זקיק או זקיק בשחלה-שיתוף תרבות יכול לשמש כדי לחקור אינטראקציות בין זקיקים. בהתאם לרקמות והעיבוד, ניתן לקבל תמונות באמצעות בהיר שדה, הקרינה או מיקרוסקופים confocal. איור 4 מציג תוצאות נציג של תמונות משיתוף תרבויות כגון, בוחנים סוגים שונים של תאים מעורבים בתקשורת זקיק זקיק, כוללים אנדותל ותאים עצביים 7.
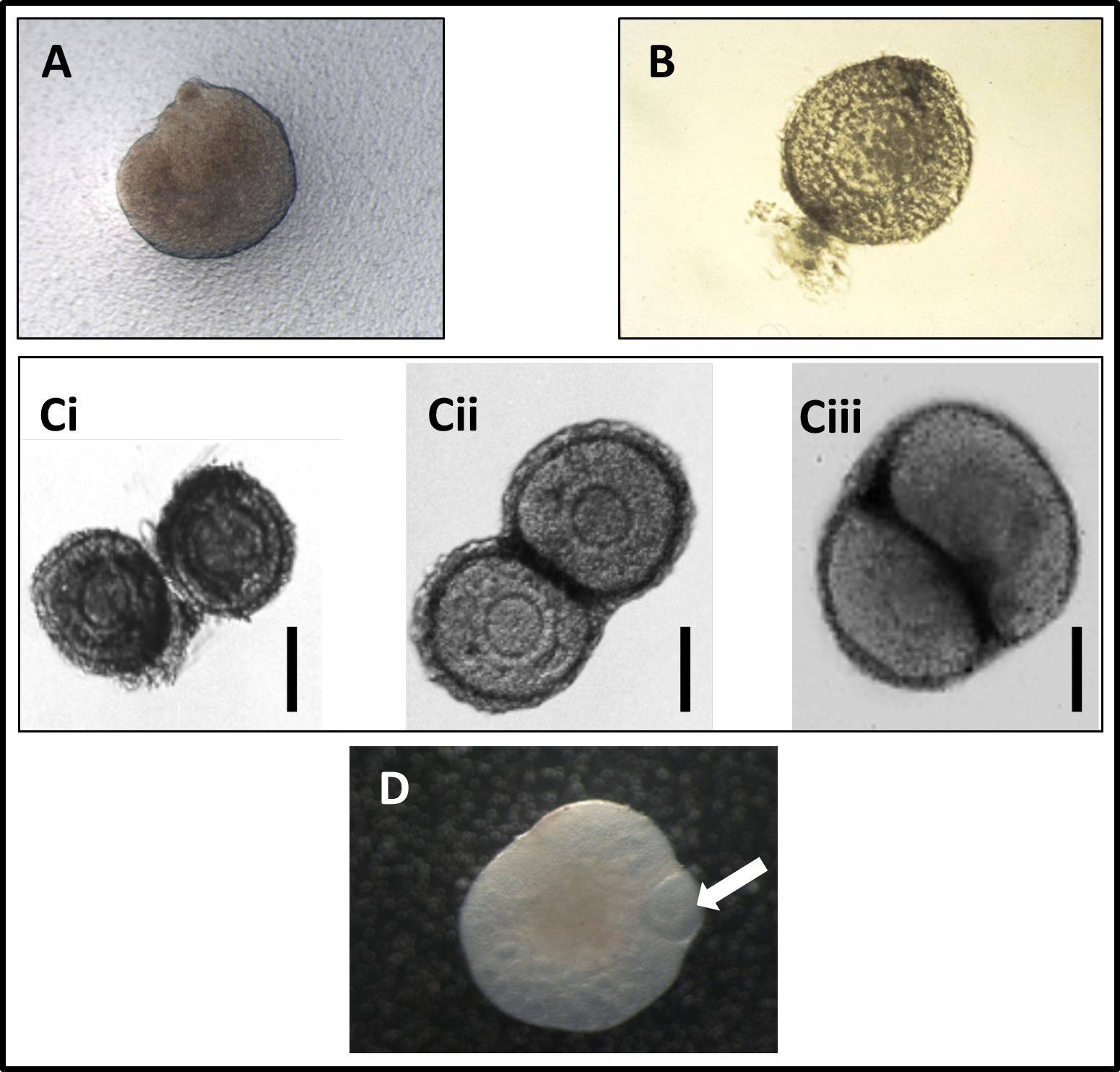
איור 1: (א) Photomicrograph של השחלה יילודים המתקבלת מעכבר ביום הלידה, הניח על קרום פוליקרבונט. (ב) Photomicrograph של טרי גזור זקיק בשחלה בריא, עם רוב של הרקמות המקיפות את סטרומה גזור משם. (C) Photomicrographs של התרבות המשותפת של שני זקיקים בשחלות בשלושה הימים הראשונים של תרבות, המראה את הקשר ההדוק שנוצר בין שני הזקיקים כתמורת התרבות (Ci: היום הראשון של תרבות; כת"ש: יום שני של תרבות; Ciii : יום שלישי של תרבות). לשכפל מאל ספירס et. 11 (ד) Photomicrograph של זקיק preantral שיתוף תרבותי ושחלה בילוד לאחר יומיים של התרבות. תמונה מראה את הזקיק הופך כמוס על ידי השחלה. חץ מראה זקיק preantral. תמונה מתוך ד"ר פדריקה לופס. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
"Src =" תרשים 2 "/> / קבצים / ftp_upload / 52,458 / 52458fig2.jpg
איור 2: השפעה של התרופות כימותרפיות ציספלטין ודוקסורוביצין על השחלות בתרבית בילוד ציספלטין ודוקסורוביצין שני להוביל לאובדן של בריאות זקיק וירידה במספרי זקיק.. ציספלטין (); (ב) דוקסורוביצין: (i) אחוז מהזקיקים בריאים (ברור); וכן (ii) מספר כולל של זקיקים (מוצל) בכל השחלה. ברים לציין מתכוונים + SEM; n = 5 עבור כל הקבוצות, כוכבים לציין הבדלים משמעותיים ביחס לשליטה (* p <0.05, ** p <0.01, *** p <0.001). לשכפל מאל מורגן et. 4
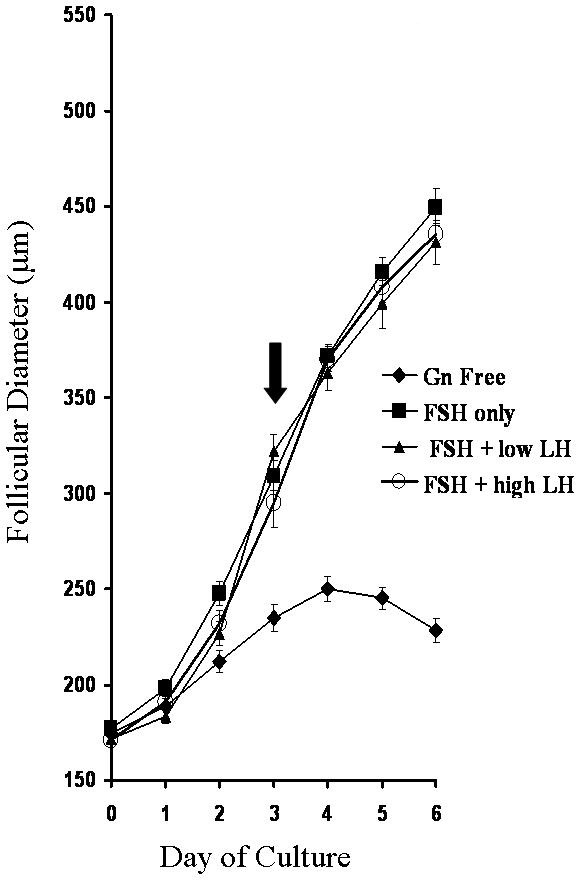
איור 3:. צמיחת שיעורים של זקיקים נחשפו לסביבות שונות gonadotrophin ערכים הם ממוצעים ± SEM (n ≥16 לכל קבוצה). חץ מציין את תחילתו של antraהיווצרות l בכל קבוצות gonadotrophin. לשכפל מאל Murray et. 5
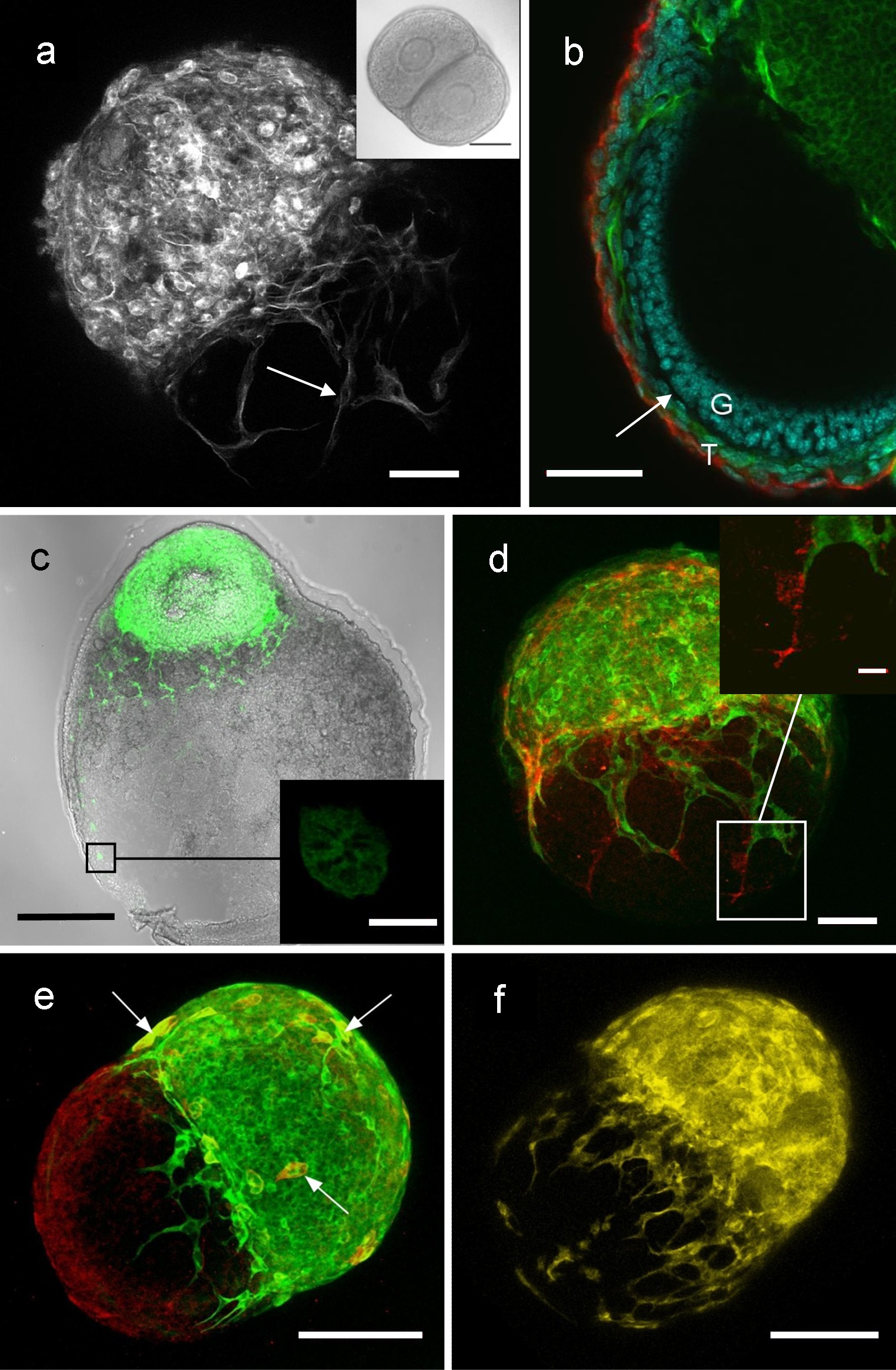
איור 4: תמונות משיתוף תרבויות זקיק זקיק ושחלת זקיק, המציגות אינטראקציות זקיק זקיק מיקרוסקופ Confocal של חלבון פלואורסצנטי ירוק זקיק (GFP) וwild-type (WT) זקיק לאחר שיתוף התרבות ((). ביטוי של GFP מוצג כאן בלבן), עם תהליכים מזקיק GFP מוצג משתרע על פני זקיק WT. חתך דרך GFP / מורכב זקיק WT הבא שיתוף תרבות (B), שהראה כי תהליכי GFP (ירוק) משקר הזקיק הסמוך הסמוך לlamina הבסיס של זקיק WT. השחלה (C) הילודים WT הבא תרבות עם מראש Antral זקיק, שהראה כי תאי GFP ותהליכים תאיים (ירוק) להביע GFP היגרודרך interstitum השחלות של השחלה בילוד. GFP / מורכב זקיק (D) WT המכיל תאי אנדותל, שמוצגים על ידי ביטוי של CD31 אנדותל סמן תא (אדום). GFP (E) / מורכב זקיק WT המכיל תאים עצביים, שמוצגים על ידי ביטוי של טובולין בטא סמן העצבי III (ראה כאן כאדום, או צהוב אם עם GFP-פעמיים שכותרתו, ירוקות). מורכב (F) YFP / WT זקיק, שבו YFP מתייחס לזקיק מעכבר Thy1-YFP שיש ביטוי מזדמן של חלבון פלואורסצנטי הצהוב (YFP: צהוב) בתת-קבוצה של תאים עצביים 9, שהראה כי תאי עצב להאריך מזקיק YFP. ברים 50 מיקרומטר (A, B, D), 100 מיקרומטר (C, E, F), 100 מיקרומטר (הבלעה ב), 10 מיקרומטר (הבלעה בC), 15 מיקרומטר (הבלעה בD). לשכפל מאל Campbell et. 7 אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של fi זהתרשים.
Discussion
אנו מתארים כאן מערכות תרבות שונות שיכול להיות מנוצלת כדי לתמוך בפיתוח של זקיקים בשחלות עכבר במבחנה, באמצעות השחלות יילודים כל המכילות רק את השלבים הראשונים זקיק, זקיקים בשחלות preantral פרט וגם שיתוף תרבויות של שתי רקמות.
תרבות של השחלות עכבר בילוד תומכת בפיתוח שחלות בשלב מוקדם, ייזום צמיחה במיוחד זקיק עד שלב הזקיק המשני. טווח גילים של עכברים בילוד יכול לשמש לתרבויות אלה, בהתאם לשלבי ההתפתחות של עניין. אם השחלות מתקבלות מעכברים שזה עתה נולד, היווצרות זקיק תהיה בעיצומו, אך עדיין לא שלם: התרבות לפחות באופן חלקי תתמוך היווצרות זקיק המשך אחרי צמיחת זקיק. לחלופין, שימוש בשחלות מעכברים סביב ימים ארבעה עד חמש של גיל (שבו היווצרות זקיק הזמן היא מלאים כבר) תוצאות בתרבות של מספר רב יותר של Folli הקדמוני וגדלcles 12. היבטים חיוביים של הטכניקה הספציפית המתוארת כאן כוללים שימוש בממברנות פוליקרבונט צפים, המאפשרות חמצון גדול יותר של הרקמה, ותרבות במדיום מאוד בסיסי ובו רק αMEM וBSA, הימנעות משימוש בתוספים לא מוגדרים כגון סרום. תרבות של כל השחלות לא נראית לתמוך בהתפתחות מעבר לשלב הזקיק המשני, עם התפתחות מאוחרת יותר הדורשת שינוי בטכניקה, כגון הנתיחה של מתחמי תא הזקיק-granulosa מהשחלה בילוד התרבותית 1.
בשלבים מאוחר יותר של התפתחות זקיק ניתן לפתח במבחנה על ידי לנתח את פרט, זקיקים מראש Antral מאוחר שלמים, שניתן לגדל בשלב preovulatory בתרבות, תוך שמירה על המבנה התל-ממדי שלהם. השימוש בזקיקים שלמים לטכניקת תרבות זו שומר על מערכת היחסים בין המרכיבים השונים זקיקים כפי שמתרחש בגוף חי. תימערכת התרבות שלהם ניתן להשתמש כדי להשיג ביציות שיכולות לתמוך הפריה והתפתחות עובר שלאחר מכן.
ניתן גם להשיג ביציות Fertilizable משחלות בילוד עכבר באמצעות פרוטוקול ראשוני תרבות הרבה כפי שתואר כאן, ואחריו שלב שני שבמהלכו מתחמי תא הביצית-granulosa גדלים במבחנה 1. מערכות אחרות המשמשות לעתים קרובות למדי היום כוללות תרבות של זקיקים או רקמה שחלה שכבר הגלום בחומר כגון הידרוג'ל אלגינט, כדי לספק תמיכה (ראה, למשל, Tagler et al. 13). חלק גדול מהמוקד של פיתוח שיטה עכשיו הוא לשפר טכניקות תרבות לשחלות וזקיקים של יונקים גדולים, במטרה לטווח הארוך של קבלת ביציות fertilisable מזקיקים ראשוניים מתוך מגוון רחב של מינים, כולל בני אדם.
בכל זמן נתון, השחלות יונקים מכילות זקיקים בטווח של שלבי התפתחות, עם interactions בין זקיקים המשפיעים על הוויסות שלהם. היבט זה של תפקוד השחלות הוא הבין היטב וקשה לבחון in vivo. השיטה הסופית המתוארת כאן משתמשת במערכות שיתוף תרבות לתמיכה בפיתוח של שלבים שונים של זקיקים במבחנה. במידת הצורך, ניתן מראש טופלו רקמות אחד או שניהם in vivo או במבחנה לתרבות המשותפת לפני. מערכות שיתוף התרבות כגון זו מספקות דרך אידיאלית שבי לבחון אינטראקציות זקיק זקיק, למשל איך גדל, זקיקי Antral להשפיע על בריכת הזקיק הקדמונית, היבטים של ביולוגיה השחלות שהוכיחו קשה לבחון עד עכשיו.
טכניקות תרבות השחלה כולם פשוטות למדי, אם כי נדרשת נתיחה זהירה, כדי למנוע נזק לרקמות מקריות. Dissection של זקיקים בודדים הוא טכניקה מיוחדת, הדורשת תרגול חוזר ונשנה לפני יכולים להיות גזורים מזקיקים בשלב הנכון משחלת שלמות וללא ניזק. זה קריטילנתח את זקיקים בודדים בזהירות, או נזק שנגרם במהלך פרוטוקול הנתיחה יכול לגרום למות זקיק בתקופת התרבות שלאחר מכן. איפה זקיקים ממוקמים ישירות לתוך הבאר של צלחות microtiter, חשוב להשתמש פלסטיק התרבות הלא-רקמה שטופל רק, כדי למזער את ציפוי של תאי thecal על הפלסטיק: אם נעשה שימוש בplasticware טופל בתרבית רקמה, הזקיקים יצרפו ל בסיס של הבאר וקרע ככל שהם גדלים. לכל עבודת שיתוף התרבות, רקמות חייבות להיות ממוקמות ישירות בקשר אחד עם השני.
הבינוני שפורט לעיל לשימוש בטכניקת תרבות הזקיק כולל תוספת של סרום עכבר. אפשר להחליף את סרום העכבר עם סרום שור עוברי, אבל רק מדי פעם קבוצות של סרה כזה יתמכו באופן מלא התפתחות זקיק לבמה preovulatory, עם סדרת בדיקות הנדרשות לזהות מקורות מתאימים. אצווה-בדיקה של FSH כן, מומלצת, כUni הבינלאומיts שבו FSH מוערך לתאם רק בגסות לצמיחת זקיק במבחנה. אם קרע הזקיק מתרחש באופן שגרתי במהלך תקופת התרבות, תשקול להחליף את חומצה אסקורבית מניות עם קבוצה חדשה.
הטכניקות אינן דורשות ציוד מיוחד במיוחד אחר מאשר מיקרוסקופים לנתח וחממות תרבית רקמה, למרות ששימוש בזרימה למינרית וטכניקה סטרילית טובה לאפשר לזקיקים בשחלות ללהיות מתורבת בהיעדר האנטיביוטיקה, כמו בשיטות שתוארו כאן. זה יכול להיות מועיל, כדי למנוע כל השפעה מזיקה פוטנציאל של אנטיביוטיקה בביציות, במיוחד אם הם להפריה הבאה תרבות. שבו לא ניתן לעבוד בסביבת סטרילית, רצוי להוסיף אנטיביוטיקה לתקשורת לנתיחה והתרבות.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Work was funded by MRC grant G1002118.
Materials
| Name | Company | Catalog Number | Comments |
| Name of the Material/Equipment | Company | Catalog Number | Comments/Description |
| Leibowitz L15 | Invitrogen | 11415049 | |
| αMEM | Invitrogen | 22571020 | Supplied as sodium bicarbonate buffered (2200 mg/L) |
| Bovine serum albumin | Sigma Aldrich | A9418 | For dissection medium |
| Bovine serum albumin | Sigma Aldrich | A3311 | For culture medium |
| Bovine serum albumin | Sigma Aldrich | A2153 | For coating glass pipettes |
| Mouse serum | - | - | Collected from cardiac puncture |
| FSH | Merck Serono | Gonal F | Batch testing is often necessary. Make up stock solution of 1IU/10µl in αMEM and store at -20°C. |
| Ascorbic acid | Sigma Aldrich | A4034 | Make up stock of 5mg/ml in αMEM and store at -20°C. |
| Silicon oil | VWR | 630064V | Dow Corning Silicone Fluid 200/50cS |
| Syringe filters (25mm, 0.2µm) | Greiner | 16532K | Cellulose acetate filter: for filtering larger (> 5mls) volumes of medium. |
| Syringe filters (13mm, 0.2µm) | Iwaki | 3032-013 | Cellulose acetate filter: for filtering smaller (< 5mls) volumes of medium |
| Syringe filters (25mm, 0.45µm) | Iwaki | 2053-025 | Cellulose acetate filter: for filtering oil. |
| Sterile tubes | Greiner | 187261 | |
| 24 well plate | Greiner | 662160 | |
| 96 well round bottom plate | Iwaki | 3875-096 | Use only non-tissue culture treated plates |
| 96 well flat bottomed well | Iwaki | 3860-096 | Use only non-tissue culture treated plates |
| Whatman nucleopore membranes | Camlab | WN/110414 | Use shiny surface up, polycarbonate, 13mm diameter, 8.0µm pore size |
| Insulin needles | BD medical supplies | 037-7606 | 0.33mm (29G) +1ml |
| Glass embryo dishes | VWR | 720-0579 | Sterilise then warm before use |
| Glass pipettes | Fisher Scientific | 10209381 | BSA coated before use |
| Gel tips | AlphaLabs | LW1103 | |
| Acupuncture needles | Acumedic LTD | 30mmx0.25 Type C | |
| Bouin’s fixative | Sigma Aldrich | HT10132-1L | |
| Formalin solution, neutral buffered, 10% | Sigma Aldrich | HT5014-120ml | |
| 1.5 ml polypropylene tubes | Greiner BioOne | 616201 |
References
- Brien, M. J., Pendola, F. L., Eppig, J. J. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol. Reprod. 68 (5), 1682-1686 (2003).
- Fortune, J. E., Yang, M. Y., Muruvi, W. The earliest stages of follicle development: follicle formation and activation. Soc. Reprod. Fertil. Suppl. 67, 203-216 (2010).
- McLaughlin, M., Kinnell, H. L., Anderson, R. A., Telfer, E. E. Inhibition of phosphatase and tensin homologue (PTEN) in human ovary in vitro results in increased activation of primordial follicles but compromises development of growing follicles. Mol. Hum. Reprod. 20 (8), 736-744 (2014).
- Morgan, S., Lopes, F., Gourley, C., Anderson, R. A., Spears, N. Cisplatin and doxorubicin induce distinct mechanisms of ovarian follicle loss; imatinib provides selective protection only against cisplatin. PLoS One. 8 (7), e70117 (2013).
- Murray, A. A., et al. Follicular growth and oocyte competence in the in vitro cultured mouse follicle: effects of gonadotrophins and steroids. Mol Hum Reprod. 14 (2), 75-83 (2008).
- Baker, S. J., Srsen, V., Lapping, R., Spears, N. Combined effect of follicle-follicle interactions and declining follicle-stimulating hormone on murine follicle health in vitro. Biol. Reprod. 65 (4), 1304-1310 (2001).
- Campbell, L., Trendell, J., Spears, N. Identification of cells migrating from the thecal layer of ovarian follicles. Cell Tissue Res. 353 (1), 189-194 (2013).
- Pratt, T., Sharp, L., Nichols, J., Price, D. J., Mason, J. O. Embryonic stem cells and transgenic mice ubiquitously expressing a tau-tagged green fluorescent protein. Dev. Biol. 228 (1), 19-28 (2000).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Maiani, E., et al. Reply to: cisplatin-induced primordial follicle oocyte killing and loss of fertility are not prevented by imatinib. Nat. Med. 18 (8), 1172-1174 (2012).
- Spears, N., Bruin, d. r., Gosden, J. P., G, R. The establishment of follicular dominance in co-cultured mouse ovarian follicles. J. Reprod. Fertil. 106 (1), 1-6 (1996).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicol. Sc. 90 (2), 500-509 (2006).
- Tagler, D., et al. Promoting extracellular matrix remodelling via ascorbic acid enhances the survival of primary ovarian follicles encapsulated in alginate hydrogels. Biotechnol. Bioeng. 111 (7), 1417-1429 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved