Method Article
文化と共培養マウスの卵巣と卵胞
要約
このプロトコルは、新生児マウスと思春期前のマウスからの個々の卵胞から卵巣を使って、マウスの卵巣組織の初代培養/共培養を説明しています。培養技術は、卵巣上の外因性薬剤の効果の研究を可能にする、高度に生理的な方法で開発を支援し、卵胞の間の相互作用の。
要約
哺乳類の卵巣は、卵胞で構成され、体細胞顆粒膜細胞に囲まれた、単一の卵母細胞からなる各卵胞は、基底膜内で一緒に囲まれた。卵胞の有限のプールが減数分裂停止中の卵母細胞は、原始卵胞を形成し、平坦化された顆粒膜細胞との密接な関係を形成する場合に、胚発生の間に敷設されている。 BYまたは出生直後に、哺乳類の卵巣は、成長する卵胞のプールに卵胞の安定したリリースがある以降、その時点から、原始卵胞の彼らの一生の供給が含まれている。
卵巣は、卵胞が文化で非常に生理的な方法で成長していると、in vitroでの開発に特に適している。この作品は、原始卵胞を含む全新生児の卵巣の文化、および個々の卵胞の文化、preovuまで未熟から卵胞の開発を支援することができる方法について説明しlatoryステージは、その後、その卵母細胞をインビトロで受精を受けることができる。ここで概説仕事は卵巣が外部化合物への暴露によって影響される方法を決定するために培養システムを使用しています。我々はまた、成長している卵胞と原始卵胞の非成長プールの間で発生する相互作用の研究を可能にする共培養系を記述する。
概要
哺乳類の卵巣は、卵母細胞の女性の生涯供給、卵胞内に含まれる各構成されています。卵胞が休止で出産前に形成され、原始段階:卵胞のプールが確立されると、成長卵胞のプールに原始卵胞からの継続的かつ漸進的な動きがある。卵胞が成長し始めると、彼らは排卵前、またはグラーフ、段階に到達するまで、彼らは、一次、二次、前胞状その後洞段階を経て発展。排卵前卵胞からわずか卵母細胞は受精した場合には、長期に胚発生をサポートすることができる完全な発育能力を持っている。
卵巣は、長いin vitroで非常に生理的な方法で開発することが知られている。これはトンまで(その時点で、その減数分裂を完了できない)が、その中に未成熟段階から卵母細胞をサポートするのに必要な細胞を含有する各卵胞にある可能性が高い彼発生的に有能な段階(それは完全に減数分裂、受精および長期に生じた胚の開発が完了したことをサポートすることができ、その時点で)。
インビトロでの卵巣発育の生理学的性質、卵巣培養技術の普及をもたらした。したがって、 インビトロ法は、(例えば、その多嚢胞性卵巣症候群、PCOSの)、化学物質への曝露の影響を受けているかの卵巣/卵母細胞の検査、また実用的な目的で、卵巣発育、卵巣病理の調節を調査するために使用されている原始卵胞から受精の卵母細胞を得た。ヒトを含む大型哺乳動物、より包を用いて培養技術は近年著しく2,3を改善しているものの、現在までに、後者は、マウスの卵巣組織1を用いてのみ達成された。
ここでは、マウス卵巣組織を使用して、いくつかの培養方法について説明します。最初のメトdは全体の新生児マウスの卵巣を使用し、原始卵胞4の形成と初期の開発をサポートしています。第二のシステムは、排卵前の段階に遅れて前胞状から個々の、無傷の卵胞の成長をサポートしています。この技術を使用して、卵胞が個別に培養し、またはペア5,6ですることができます。最後に、成長して原始卵胞7との間の相互作用の研究を可能にする方法の最初の2つの手法を組み合わせて、共培養系を記述する。
メディア分析は卵胞/卵巣ホルモン産生の調査を可能にしながら、個々の完全な卵胞の文化は、卵胞の成長は培養期間中、毎日卵胞測定から決定することができます。得るために、例えば、免疫組織学的/組織学的分析のために、または後続の処理のために、組織の分析は、培養終了時の卵胞または卵巣組織の集合によって達成することができるmRNAまたはタンパク質。
プロトコル
すべての動物の作業は、英国内務省(プロジェクトライセンス番号PPL 1726分の60と4026分の60)のライセンスを受けて施設のガイドラインに従って行った。
注:ハウス動物を14時間の光の中で英国の法的要求事項及び10時間暗の光に合わせて。野生型C57BL6Jマウスに、緑色蛍光タンパク質(GFP)8、および神経細胞9のサブセット内の黄色蛍光タンパク質(YFP)の時折の発現はThy1-YFPマウスのユビキタス発現を有するタウ-GFPマウスを用いた動物行動実験。両方のトランスジェニック系統はC57BL6Jの背景に飼育した。
1.労働条件や楽器の準備
- 無菌性を確保するために、層流フード内のすべてのメディアの準備、組織解剖、培養作業を実行します。これは、メディアへの抗生物質の添加の必要性を回避する。
- 常にメディア/培養プレート/胚の料理を平衡化することを可能に使用前に37℃のオーブンで少なくとも1時間、(解剖媒体/胚ディッシュ)、または37℃、5%CO 2インキュベーター(培養培地およびプレート)のために。
- 時間の周りのためにウシ血清アルブミン(BSA)の0.1%溶液中でガラスピペットを浸し、その後乾燥させる残す。細かく描かれた湾曲したガラスピペットを生成するために、あなたがそうするようにガラスを曲げ、ブンゼンバーナーの炎でピペットを引き出します。ピペットが引かれた後に、ガラスカッターできれいにカットをする。オーブンで約45分間160℃で滅菌する。
注:これらのガラスピペットのストアは、卵巣および卵胞を転送するために必要とされるであろう。
解剖と文化メディアの作製
- 解剖培地を調製。
- レイボビッツL15培地とフィルターで3 mg / mlのBSAを孔径0.2μm、直径25mmのフィルターを通して滅菌溶かす。
- 新生児卵巣文化。
- 新生児の卵巣培養用培地を準備するには、EACのために1mlの培地を作る培養される時間卵巣。 3ミリグラムを溶解/ mlのα-最小必須培地(αMEM)中のBSAとフィルターは滅菌チューブに0.2μmの孔径、直径13mmのフィルターを通して滅菌する。
- 新生児卵巣培養プレートを調製するために、24ウェルプレートの各ウェル(ウェル当たり1つの卵巣)に新生児卵巣培養培地1mlを加える。無菌の時計メーカーの鉗子を使用して、各ウェル中の培地の上下にポリカーボネート膜を配置し、光沢のある表面を上に。 UVは、使用する前に、膜を殺菌する。
- 卵胞文化。
- 卵胞の培養培地を調製するために、1 IU / mlの組換えヒト卵胞刺激ホルモン、5μg/ mlのアスコルビン酸および5%(v / v)の血清で補足α-最小必須培地は、成体雌性マウスから得られた。フィルタは、滅菌チューブに孔径0.2μm、直径13mmのフィルターを通して滅菌する。
- フィルタは、滅菌チューブに、孔径0.45μm、直径25mmのフィルターを通してシリコンオイルを滅菌する。
- ナンプラーを準備するにはTES、非組織培養の各ウェルに卵胞培養培地の30μlの液滴を配置する(卵胞毎日以上の新しい行に移動することができるように、各プレートの上部のみの行を使用して、96ウェルマイクロタイターラウンドウェルプレートを処理した培養期間)。慎重に培地の蒸発を防ぐために、滅菌したシリコンオイルの70μlの培地を重ねる。
- 卵胞卵巣共培養。
- 各卵胞卵巣共培養セットアップされるための培地1mlを構成する、上記のステップ2.3.1で卵胞培養用として卵胞卵巣共培養のための培地を準備します。
- プレートを調製するために、24ウェルプレートの各ウェルに1mlの培地を加える。無菌の時計メーカーの鉗子を使用して、各ウェル中の培地の上に光沢のある表面を上にして1のNucleopore膜を配置。 UVは、使用する前に、膜を殺菌する。
3.新生児卵巣解剖と文化
- 各滅菌ガラス胚皿に解剖培地の1ミリリットルを置きます。
- カル新生仔マウスは、英国内務省の規制に従って断頭によりカリング、生後0日と5歳。
- 細かい解剖鉗子のペアを使用して腹壁をカバーする皮膚をつかみ、皮膚や体壁に大きな切開する。腹部全体が露出しているので、切開を開き引き出します。膀胱は、通常、この段階では充血し、切開を容易にするために穿刺することができる。
- 時計メーカーの鉗子を使用して邪魔になら根性を移動します。各側の腎臓に膀胱までの子宮角に従ってください。卵巣は子宮の上部にあるだけで腎臓の下に配置され、解剖顕微鏡下での雲のような構造として表示されます。
- 時計メーカーの鉗子で軽く卵巣をつかみ、子宮への取り付けを切断するはさみを使用しています。予め温め解剖培地を含む胚皿に卵巣のペアを転送します。
- 加熱されたSTA上解剖顕微鏡下で卵巣の細かい解剖を実施葛(37℃)。唯一の卵巣が残るまで、ファブリキウス嚢と卵管を含む任意の余分な材料を離れてトリミングするインスリンの針を使用してください。
- 細かく描か湾曲したガラスピペットを用いて、上記ステップ2.2.2で調製した培養プレートのウェルに各卵巣を転送各膜の上部に1つの卵巣( 図1A参照 )。 37℃、5%CO 2インキュベーター内で培養。
- 一日おきに培地を変更します。膜を乱すことを避けるために培地のウェルの縁で起こるピペットチップ:予備脱気新鮮培地を各ウェルに培地の50%を交換するためにピペットを使用する。
- 最大6日間の文化を維持します。
- 文化の最後に、メディアを凍結し、必要に応じて、PBS中で短時間の洗浄後に卵巣を修正または凍結。
- 組織学的分析のために90分間ブアン固定液に卵巣を修正し、または免疫組織学的分析のために90分間、10%中性緩衝ホルマリンで。スナップは、組織を配置することによって卵巣凍結その後のタンパク質またはmRNA抽出のために-70℃で凍結する前に5〜10分間ドライアイス中でチューブを配置するポリプロピレンチューブ。
4.卵胞解剖と文化
- 19-23日齢の雌マウスを淘汰し、卵巣を分離する。すべての切開を行う前に、70%エタノールで毛皮を湿ら。平滑末端の鉗子を用いて皮膚をつまみ、皮膚や体壁の両方を貫通し、解剖ハサミを腹部に大きな切開を作る。
- 解剖楽器の細かいセットを使用して邪魔に腸を移動し、子宮を探します。各側の腎臓の下に配置され、卵巣に子宮をフォローアップ。
- 静かに時計職人鉗子のペアを使用して卵巣を把握し、細かい解剖ハサミで子宮に卵巣の添付ファイルを断つ。卵巣の脂肪パッドのあまりを集めないようにしてください。卵巣を収集し、予め温め解剖培地を含む胚皿に移す。
- リ唯一の卵巣が残るまで、ファブリキウス嚢と卵管を含む任意の余分な材料を離れてトリミングするインスリンの針を使用して、卵巣嚢を移動します。おおよそインスリン針を使用して、各卵巣を半減。
- 慎重に1ミリリットル解剖培地を含む個々の時計皿に各卵巣の半分を転送する。培地の蒸発を防止し、無菌性を確保するためにガラススライドを各時計皿を覆う。
- ストアの時計、必要になるまで37℃のオーブンで卵巣半分を含むガラスが、できるだけ早く次の解剖工程を実施する。時間以上、このように保存された組織を捨てる。
- 層流フード内で37℃で加熱した顕微鏡ステージに卵巣半分を含むトランスファー時計皿。おおよそ次のように遅くプレ胞状卵胞を識別するために、二つのインスリン針を用いて大片に卵巣を分析:これらは、顆粒膜細胞の2〜3層を含む周り180~200ミクロンの直径を有する。
- 手動で私を解剖する1インスリン針と針ホルダに固定されているもの30×0.25ミリメートルの鍼治療の針を用いてdentified卵胞。周囲の間質の大部分を除去するが、卵胞の基底膜を損傷しないように注意してください( 図1Bを参照)。
- 慎重に予め温め解剖培地を含む収集時計皿に解剖包を転送するために細かく描かれた湾曲したガラスピペットを使用してください。卵胞が失われないように、ピペットの薄い口径セクション内包を保つように注意してください。
- 解剖顕微鏡に嵌較正済み接眼目盛りを使用して正確に卵胞を測定します。
- 彼らは、直径が190±10ミクロンを測定する場合にのみ、培養のために卵胞を選択します。さらに文化のための唯一の健全な、球状の卵胞を選択します。これらは、暗い閉鎖のエリアせずに、半透明で、そしていくつかの添付包膜組織と一緒に、完全な基底膜を持ちます。この説明に適合しないすべての卵胞を破棄。 1の間の収量卵巣あたり0-15卵胞が良いです。
- 上記のステップ2.3.3のように作らプレートのウェルに、単一の卵胞を転送するために細かく描かれた湾曲したガラスピペットを使用してください。慎重に井戸の底(としない上部の油層内)で卵胞を置く。 37℃、5%CO 2インキュベーター内で培養。
- 最大6日間培養包は、毎日よく含む新鮮な培地に卵胞を移動する。
- 上記のステップ2.3.3におけるプレート調製と、96ウェルプレート内の次の行を準備します。平衡を可能にするために、少なくとも1時間インキュベーターにプレートを返します。転送微延伸ガラスピペットを用いて、培地の新鮮なウェルに包。
- 培養毛包の任意の時点で、新鮮な培地に移動する前に2日間放置する場合、60μlの卵胞培養培地(よりむしろ30μl)を液滴の最小の各卵胞を置く。
- 、卵胞の成長に関するデータを収集するのeyを使用して、毎日の卵胞を測定する解剖顕微鏡に嵌epiece目盛り。油層は、卵胞の直径の測定値を歪めるので、セットアップにキャリブレーション係数をうまくいく。
- 文化の終わりに、培地を凍結し、修正または上記のステップ3.10のように、その後の分析のための組織を凍結する。
- 卵胞卵胞共培養。
- 培養2卵胞は一緒に、卵胞の間の相互作用を調査する。培養物は、上記のように、しかし、ウェル中、接触は、2つの毛包を横並びに配置します。
- 滅菌したシリコンオイルの100μlの培地をオーバーレイ、96ウェルマイクロタイター平板ウェルプレートを処理した非組織培養の各ウェルに卵胞培養培地100μl液滴を置く。上記のステップ4.13のように新鮮なウェルに卵胞を転送するのではなく、一日おきに培地の50%を変更するには細かいゲルチップを使用しないでください。
- 共培養中の組織起源を同定するために、共培養は、例えば、oについて、異なる遺伝子源からのそれぞれを包GFPの遍在的な発現を有するマウスの卵巣からの野生型マウスの卵巣およびその他からね。 GFPまたはYFP組織を使用した場合、培養中、及びその後の固定化/処理工程を経て、できるだけ光に組織の曝露を最小限にする。
注:2包がシングル、「2-卵胞」ユニット( 図1Cを参照)に一緒に成長するのは正常です。
5.卵胞卵巣共培養
- 上記のセクション3と4のように卵巣と卵胞外を解剖。
- 上記のステップ2.4.2のように調製プレートに、膜の上に1新生児の卵巣を置きます。慎重に細かく描かれた湾曲したガラスピペットを用いて、新生児の卵巣の一方の極に接触して、単一の卵胞を置く。最大5日間37℃、5%CO 2インキュベーター内で培養。
- 共培養内の組織起源とを区別するために、そのように異なる2から卵巣の卵胞を使用urces、たとえば野生型マウスからの1、およびGFPの遍在的な発現を有するマウスからの1のために。
- 上記のステップ3.8のように毎日の培地500μlを交換したが、卵胞培養培地を使用した。共培養中に、卵胞は、多くの場合、卵巣( 図1D)によってカプセル化されてしまう。
- 文化の終わりに、培地を凍結し、修正または上記のステップ3.10のように、その後の分析のための組織を凍結する。
6.固定、免疫細胞と培養組織のイメージング
- 培養の最後に、PBSで組織を洗浄し、100μl(卵胞)または10%中性緩衝ホルマリン液1ml(卵巣)に移し、そして氷上で1時間固定する。 4℃で1×PBSの3回の洗浄を介して移動。
- 卵胞に免疫細胞化学のために、各ウェルを含む異なる洗浄または治療と、細かく描かれた湾曲したガラスピペットを用いて、96ウェルマイクロタイターラウンドウェルプレートのウェル間の転送。
- ovari上の免疫細胞化学のためにES(または卵巣卵胞共培養)は、vibrotomeを使用して50ミクロンで4%アガロースゲル及びセクションに埋め込む。 24ウェルプレートのウェル中にフロート部分をピペットで除去し、洗浄または処置を適用する。
- イメージングのために:平らなガラススライドにアガロースのセクションを転送し、マウンティング培地でマウント。または転送包(または卵胞卵胞複合体)空洞ガラススライドへと非硬化マウンティング培地でマウントします。共焦点顕微鏡を用いた画像の標本。
結果
図1は 、培養手続き中に開始時卵巣卵胞の画像を示す。
図2は (ここでは、新生児から卵巣)新生児の卵巣の代表的な結果は、培養中に、生殖毒性物質にさらさ示しています。新生児の卵巣は、培養の2日目、シスプラチンまたはドキソルビシンのいずれかを6日間培養し、化学療法薬に曝露した。培養終了時、卵巣を、固定した組織学のために処理し、卵巣、その後健康と不健康卵胞4の数を決定するために調べ。代替的に、初期の成長卵胞のより迅速な評価は、卵母細胞特異的蛍光マーカー10を発現するマウスからの卵巣を用いて、卵巣断片の培養物から得ることができる。
個々の卵胞の培養中に、卵胞の成長を容易に結膜の間、毎日の測定によって確認することができるトゥーレ期間3は、ホルモン(FSH)と黄体形成ホルモン(LH)を5卵胞刺激ホルモン、ゴナドトロピンの存在下または非存在下で培養包の成長の代表的な結果を示す。
卵胞の卵胞または卵胞卵巣共培養は、卵胞の間の相互作用を研究するために使用することができる。組織および処理に応じて、画像は、明視野、蛍光または共焦点顕微鏡を使用して得ることができる。 図4は、内皮細胞および神経細胞を含む卵胞の卵胞の通信に関与する種々の細胞型を調べ、そのような共培養からの画像の代表的な結果を示している7。
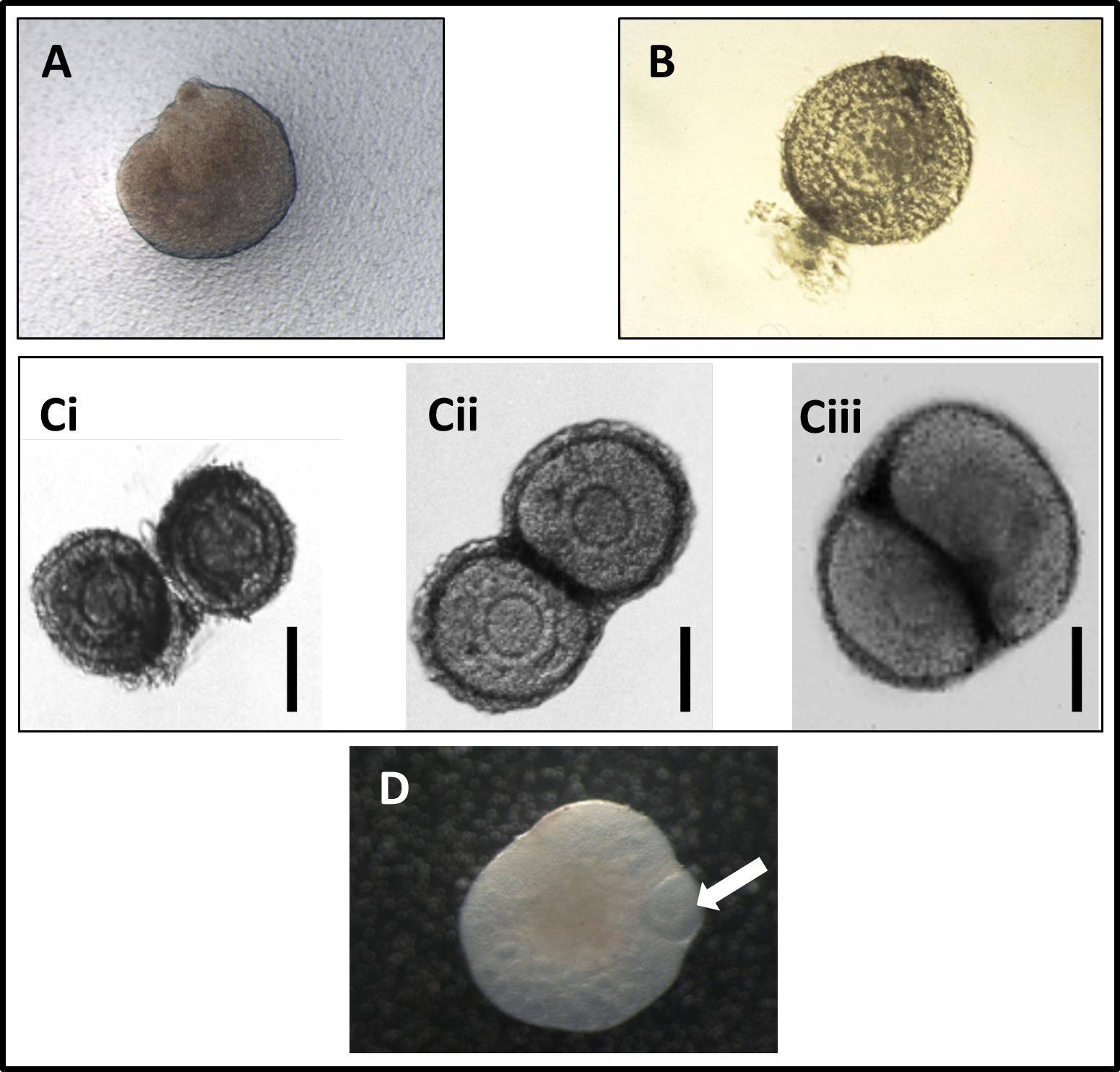
図1:誕生日当日にマウスから得られた新生児卵巣の(A)顕微鏡写真、置かポリカーボネート膜上に。切除し、周囲の間質組織のほとんどと(B)の新たに切開した健康な卵胞の顕微鏡写真。 (C)培養の最初の3日間の2卵胞の共培養の顕微鏡写真、文化が進むように、2つの卵胞の間で開発して密接な接触(CI表示:文化の最初の日を、CII:文化の二日目、CIII :文化の三日目)。スピアーズらから再生。共培養前胞状卵胞および新生児卵巣の11(D)顕微鏡写真文化の2日後。画像は卵巣によってカプセル化になるの卵胞を示しています。矢印は前胞状卵胞を示しています。博士はフェデリカロペスからの画像。 この図の拡大版をご覧になるにはこちらをクリックしてください。
グレ2 "SRC =" /ファイル/ ftp_upload / 52458 / 52458fig2.jpg "/>
図2:新生児の培養された卵巣上の化学療法薬シスプラチンとドキソルビシンの効果シスプラチンと卵胞の健康の損失と卵胞数の減少に両方のリードをドキソルビシン。。 (A)シスプラチン。 (B)ドキソルビシン:(I)不健康卵胞(クリア)の割合。と、(ii)各卵巣における卵胞の合計数(斜線)を。バーは平均±SEM示す。 nはすべてのグループ5、星た(* p <0.05、**はp <0.01、***はp <0.001)、対照に対して有意差を示す。 Morgan らから再生。4
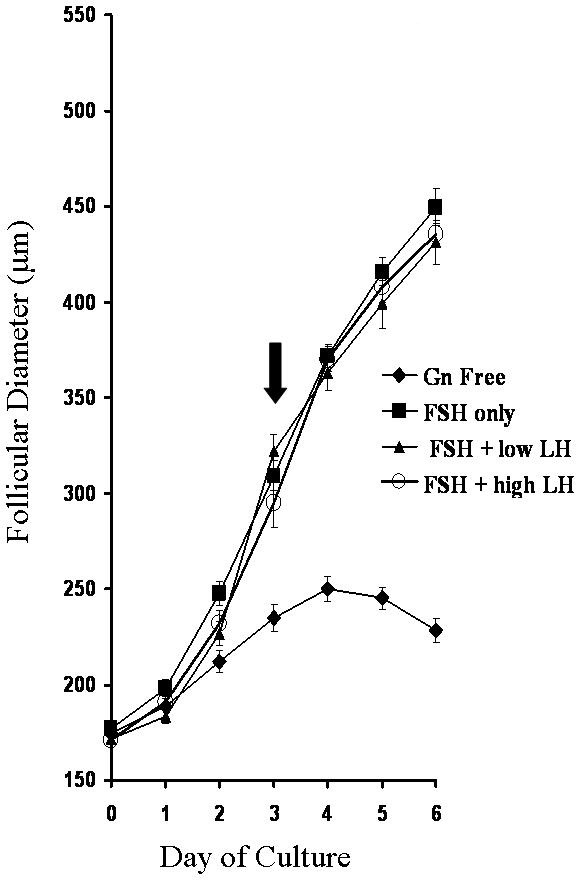
図3:別の性腺刺激ホルモン環境にさらさ卵胞の成長率の値は、平均±SEM(各群についてn個 ≥16)平均値である。矢印はantraの開始を示すすべてゴナドトロピン群におけるlの形成。マレーらから再生。5
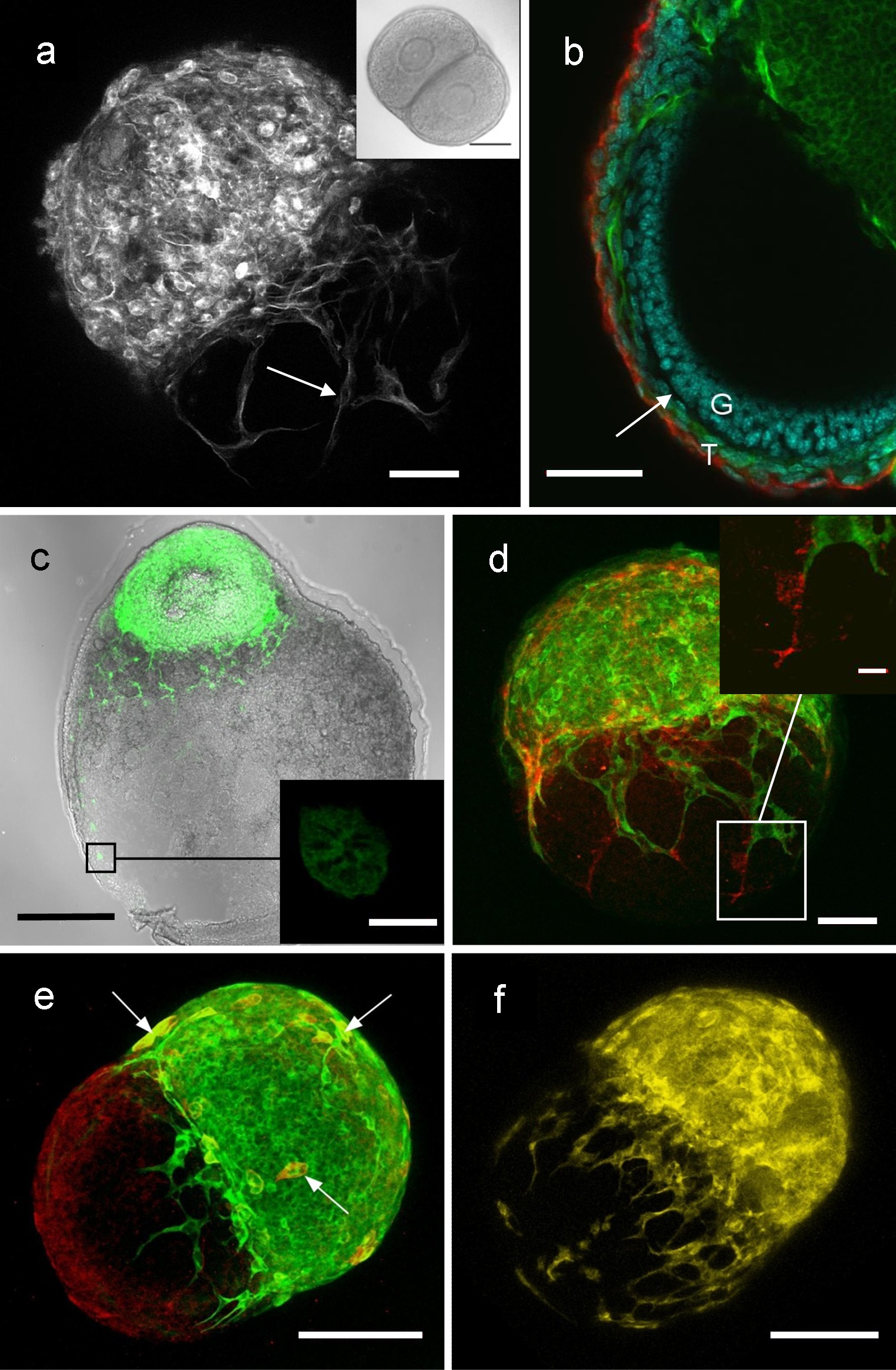
図4:卵胞の卵胞および卵巣卵胞の共培養からの画像、卵胞の卵胞の相互作用を示す(A)緑色蛍光タンパク質(GFP)、卵胞と共培養後の野生型(WT)卵胞の共焦点顕微鏡写真(。 WT包にまたがる示すGFP包からプロセスとGFP発現白でここに示されている)、。 (B)共培養以下GFP / WT包複合体を介した断面、WT包の基底層に隣接した隣接する卵胞うそからのGFPプロセス(緑)を示す。 (C)新生児WT卵巣GFP細胞および細胞プロセス(緑)が移行したことを示す、事前洞GFP発現毛包を培養し、次新生児の卵巣の卵巣interstitumを通して。 (D)GFP / WT包複合体は、内皮細胞マーカーCD31(赤)の発現によって示された内皮細胞を含む。神経マーカーのβチューブリンIIIの発現によって示される神経細胞を含む(E)GFP / WT包複合体、(GFPで二重標識した場合、緑、赤、または黄色などのようにここを参照してください)。ニューロンはYFP包から延びることを示す、神経細胞9のサブセットで:YFPは黄色蛍光タンパク質(黄色YFP)の臨時の表情を持ってはThy1-YFPマウスから卵胞を参照する(F)YFP / WT包の複合体。バーは50μm(A、B、D)、100μmの(C、E、F)、100ミクロン(Aの挿入図)、10ミクロン(C内のイラスト)、15ミクロン(D内のイラスト)。キャンベルらから再生された。7 このFiのの拡大版を表示するには、こちらをクリックしてくださいグレ。
ディスカッション
ここではまた、唯一の最も初期の卵胞段階を含む全新生児卵巣、個々の前胞状卵胞及び2つの組織の同時培養を用いて、in vitroでのマウスの卵胞の発達を支援するために利用することができる種々の培養系を記述する。
新生児マウスの卵巣の文化は、初期の卵巣の開発、二次卵胞段階まで特に卵胞の成長開始をサポートしています。新生仔マウスの年齢の範囲は、関心の発達段階に応じて、これらの培養のために使用することができる。卵巣が新生マウスから得ている場合は、卵胞形成が進行中ですが、まだ完了していないようになります。文化は、少なくとも部分的に卵胞の成長が続く継続的な卵胞の形成をサポートします。また、生後4対5日の周りのマウスから卵巣の使用(時間包形成が既に完了していることで)原始と成長フォリフォリのより多くの文化において結果クル12。ここに記載された特定の技術の有益な態様は、血清のような未定義の添加剤の使用を避け、唯一αMEM及びBSAからなる非常に基本的な媒体中でより大きな組織の酸素、および文化を許可する浮動ポリカーボネート膜、の使用を含む。全体卵巣の文化は、その後の開発はそのような培養された新生児の卵巣1から卵胞顆粒膜細胞複合体の解剖として、技術の変化を必要とし、二次卵胞の段階を超えて開発をサポートしていないようです。
卵胞の発達の後期段階では、その三次元構造を維持しながら、培養中の排卵前の段階まで成長させることができる個々の、無傷の後期プレ胞状卵胞を行う解剖によってインビトロで開発することができる。 生体内で起こるように、この培養技術のための完全な卵胞の使用は、異なる濾胞コンポーネント間の関係を維持します。ティの培養系は、受精および続く胚発生をサポートすることができる卵母細胞を得るために用いることができる。
ここに記載されるように受精した卵母細胞はまた、卵母細胞の顆粒膜細胞複合体は、インビトロ 1 に成長させた時の第二段階が続く、非常に初期の培養プロトコルを用いて、マウス新生児の卵巣から得ることができる。今日かなり頻繁に使用される他のシステムは、(例えば、Tagler ら13参照 )のサポートを提供するために、そのようなアルギン酸塩ヒドロゲルなどの材料にカプセル化された卵胞または卵巣組織の文化があります。方法開発の焦点の多くは現在、ヒトを含む種の範囲から原始卵胞からfertilisable卵母細胞を得るための長期的な目的で、大型哺乳動物の卵巣の卵胞のための培養技術を改善することである。
どの時点においても、哺乳類の卵巣はinteractioで、発達段階の範囲で卵胞が含まれているそれらの調節に影響を与えるの卵胞の間にナノ秒。卵巣機能のこの態様は、あまり理解されていないと難しいが、in vivoで検討する。ここで説明する最後の方法は、 インビトロでの卵胞の異なる段階の発達を支援するために、共培養系を使用する。必要に応じて、一方または両方の組織は、 インビボまたは共培養の前にインビトロで前処理することができる。このような共培養システムは、成長している方法、例えば、卵胞卵胞の相互作用を調べるための理想的な方法を提供し、胞状卵胞は原始卵胞プール、今まで調べることが困難であることが判明している卵巣生物学の側面に影響を与える。
慎重な切開が偶発的組織損傷を避けるために必要であるが、全体卵巣培養技術は、非常に単純である。個々の卵胞の解剖は、右の段階で卵胞が卵巣無傷で損傷を受けていないから解剖される前に反復練習を必要とする、特殊な技術である。それは非常に重要です慎重に個々の卵胞を切開する、または解剖プロトコル中持続ダメージは、その後の培養期間中卵胞死をもたらすことができます。組織培養処理したプラスチック容器が使用される場合、卵胞に付着する:卵胞がマイクロタイタープレートのウェル内に直接配置されている場合、それは、プラスチック上莢膜細胞の下方めっき最小にするために、唯一の非組織培養処理したプラスチックを使用することが重要であるウェルのベースと破裂彼らが成長するにつれて。すべての共培養の作業のために、組織は互いに直接接触して配置されなければならない。
卵胞培養技術に使用するための上で詳述した培地は、マウス血清の添加を含む。これは、ウシ胎児血清、マウス血清を置換することが可能であるが、このような血清の時折のバッチは完全に適切なソースを識別するのに必要なバッチテストを、排卵前のステージに卵胞の発達を支援する。 FSHのバッチテストは、国際ユニとして、ことをお勧めいたしますFSHが評価されたことにより、TSは、in vitroでの卵胞の成長にのみ粗相関する。卵胞破裂が日常的培養期間中に発生した場合、新鮮なバッチで、株式アスコルビン酸を置き換えることを検討してください。
層流フードを使用すると、良好な滅菌技術は、卵胞がここに記載された方法と同様に、抗生物質の非存在下で培養されることを可能にも技術は、顕微鏡および組織培養インキュベーター解剖以外、特に特別な装置を必要としない。これは、培養後に受精される場合は特に、卵母細胞に抗生物質の潜在的な有害な影響を避けるために、役立つことができる。それは無菌環境で作業することはできない場合、それは解剖と文化メディアに抗生物質を追加することをお勧めします。
開示事項
The authors have nothing to disclose.
謝辞
Work was funded by MRC grant G1002118.
資料
| Name | Company | Catalog Number | Comments |
| Name of the Material/Equipment | Company | Catalog Number | Comments/Description |
| Leibowitz L15 | Invitrogen | 11415049 | |
| αMEM | Invitrogen | 22571020 | Supplied as sodium bicarbonate buffered (2200 mg/L) |
| Bovine serum albumin | Sigma Aldrich | A9418 | For dissection medium |
| Bovine serum albumin | Sigma Aldrich | A3311 | For culture medium |
| Bovine serum albumin | Sigma Aldrich | A2153 | For coating glass pipettes |
| Mouse serum | - | - | Collected from cardiac puncture |
| FSH | Merck Serono | Gonal F | Batch testing is often necessary. Make up stock solution of 1IU/10µl in αMEM and store at -20°C. |
| Ascorbic acid | Sigma Aldrich | A4034 | Make up stock of 5mg/ml in αMEM and store at -20°C. |
| Silicon oil | VWR | 630064V | Dow Corning Silicone Fluid 200/50cS |
| Syringe filters (25mm, 0.2µm) | Greiner | 16532K | Cellulose acetate filter: for filtering larger (> 5mls) volumes of medium. |
| Syringe filters (13mm, 0.2µm) | Iwaki | 3032-013 | Cellulose acetate filter: for filtering smaller (< 5mls) volumes of medium |
| Syringe filters (25mm, 0.45µm) | Iwaki | 2053-025 | Cellulose acetate filter: for filtering oil. |
| Sterile tubes | Greiner | 187261 | |
| 24 well plate | Greiner | 662160 | |
| 96 well round bottom plate | Iwaki | 3875-096 | Use only non-tissue culture treated plates |
| 96 well flat bottomed well | Iwaki | 3860-096 | Use only non-tissue culture treated plates |
| Whatman nucleopore membranes | Camlab | WN/110414 | Use shiny surface up, polycarbonate, 13mm diameter, 8.0µm pore size |
| Insulin needles | BD medical supplies | 037-7606 | 0.33mm (29G) +1ml |
| Glass embryo dishes | VWR | 720-0579 | Sterilise then warm before use |
| Glass pipettes | Fisher Scientific | 10209381 | BSA coated before use |
| Gel tips | AlphaLabs | LW1103 | |
| Acupuncture needles | Acumedic LTD | 30mmx0.25 Type C | |
| Bouin’s fixative | Sigma Aldrich | HT10132-1L | |
| Formalin solution, neutral buffered, 10% | Sigma Aldrich | HT5014-120ml | |
| 1.5 ml polypropylene tubes | Greiner BioOne | 616201 |
参考文献
- Brien, M. J., Pendola, F. L., Eppig, J. J. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol. Reprod. 68 (5), 1682-1686 (2003).
- Fortune, J. E., Yang, M. Y., Muruvi, W. The earliest stages of follicle development: follicle formation and activation. Soc. Reprod. Fertil. Suppl. 67, 203-216 (2010).
- McLaughlin, M., Kinnell, H. L., Anderson, R. A., Telfer, E. E. Inhibition of phosphatase and tensin homologue (PTEN) in human ovary in vitro results in increased activation of primordial follicles but compromises development of growing follicles. Mol. Hum. Reprod. 20 (8), 736-744 (2014).
- Morgan, S., Lopes, F., Gourley, C., Anderson, R. A., Spears, N. Cisplatin and doxorubicin induce distinct mechanisms of ovarian follicle loss; imatinib provides selective protection only against cisplatin. PLoS One. 8 (7), e70117 (2013).
- Murray, A. A., et al. Follicular growth and oocyte competence in the in vitro cultured mouse follicle: effects of gonadotrophins and steroids. Mol Hum Reprod. 14 (2), 75-83 (2008).
- Baker, S. J., Srsen, V., Lapping, R., Spears, N. Combined effect of follicle-follicle interactions and declining follicle-stimulating hormone on murine follicle health in vitro. Biol. Reprod. 65 (4), 1304-1310 (2001).
- Campbell, L., Trendell, J., Spears, N. Identification of cells migrating from the thecal layer of ovarian follicles. Cell Tissue Res. 353 (1), 189-194 (2013).
- Pratt, T., Sharp, L., Nichols, J., Price, D. J., Mason, J. O. Embryonic stem cells and transgenic mice ubiquitously expressing a tau-tagged green fluorescent protein. Dev. Biol. 228 (1), 19-28 (2000).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Maiani, E., et al. Reply to: cisplatin-induced primordial follicle oocyte killing and loss of fertility are not prevented by imatinib. Nat. Med. 18 (8), 1172-1174 (2012).
- Spears, N., Bruin, d. r., Gosden, J. P., G, R. The establishment of follicular dominance in co-cultured mouse ovarian follicles. J. Reprod. Fertil. 106 (1), 1-6 (1996).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicol. Sc. 90 (2), 500-509 (2006).
- Tagler, D., et al. Promoting extracellular matrix remodelling via ascorbic acid enhances the survival of primary ovarian follicles encapsulated in alginate hydrogels. Biotechnol. Bioeng. 111 (7), 1417-1429 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved