Method Article
Culture et co-culture de souris ovaires et follicules ovariens
Dans cet article
Résumé
Ce protocole décrit la culture primaire / co-culture de tissu ovarien de la souris, en utilisant des ovaires de souris nouveau-nées et des follicules ovariens provenant de souris individuelles prépubères. Les techniques de culture de soutenir le développement d'une manière hautement physiologique, ce qui permet étude de l'effet d'agents extrinsèques sur l'ovaire, et des interactions entre les follicules ovariens.
Résumé
L'ovaire de mammifère est composé de follicules ovariens, chaque follicule constitué d'un seul ovocyte entouré de cellules de la granulosa somatiques, enfermé dans un ensemble membrane basale. Une piscine fini de follicules est prévue au cours du développement embryonnaire, lorsque ovocytes en arrêt de la méiose forment une association étroite avec les cellules granuleuses aplaties, formant follicules primordiaux. Par naissance ou peu après, les ovaires de mammifères contiennent l'approvisionnement de leur durée de vie de follicules primordiaux, après quel point il ya une libération régulière de follicules dans la piscine folliculaire croissante.
L'ovaire est particulièrement favorables au développement in vitro, avec des follicules en croissance d'une manière hautement physiologique dans la culture. Cet ouvrage décrit la culture d'ovaires néonatales entières contenant follicules primordiaux, et la culture de follicules ovariens individuels, une méthode qui peut soutenir le développement des follicules d'un immature jusqu'à la preovurégle- stade, après quoi leurs ovocytes sont capables de subir une fécondation in vitro. Le travail présenté ici utilise des systèmes de culture afin de déterminer comment l'ovaire est affectée par l'exposition à des composés externes. Nous décrivons également un système de co-culture, qui permet d'étudier les interactions qui se produisent entre follicules en croissance et la piscine de non-croissance des follicules primordiaux.
Introduction
L'ovaire de mammifère est composé de durée de vie de l'approvisionnement d'une femelle d'ovocytes, chaque contenu dans un follicule ovarien. Les follicules sont formés avant la naissance au repos, l'étape primordiale: une fois la piscine du follicule est établi, il ya un mouvement continuel et progressive des follicules de la primordiale dans la piscine de follicule en croissance. Comme les follicules commencent à se développer, ils développent à travers les étapes primaires, secondaires, préantraux puis antraux, jusqu'à ce qu'ils atteignent le pré-ovulatoire ou Graaf, étape. Seuls les ovocytes de follicules préovulatoires ont pleine compétence au développement, en mesure de soutenir le développement embryonnaire à terme, si fécondé.
L'ovaire est connu depuis longtemps de mettre au point de façon hautement physiologique in vitro. Ceci est probablement dû à chaque follicule ovarien contenant en son sein des cellules nécessaires pour soutenir un ovocyte immature de l'étape (à quel point il est incapable de terminer sa division méiotique) par l'intermédiaire de til stade de développement compétente (à quel point il peut soutenir pleinement l'achèvement de la méiose, la fertilisation et le développement de l'embryon qui en résulte à terme).
La nature physiologique de développement ovaire in vitro a conduit à une large utilisation de techniques de culture d'ovaire. Par conséquent, les méthodes in vitro ont été utilisées pour étudier la régulation du développement de l'ovaire, de la pathologie ovarienne (par exemple celle du syndrome des ovaires polykystiques, SOPK), l'examen de la façon dont les ovaires / ovocytes sont affectés par l'exposition à des produits chimiques, et aussi avec le but pratique de l'obtention des ovocytes fécondables de follicules ovariens primordiaux. À ce jour, celui-ci a été réalisé en utilisant uniquement la souris tissu ovarien 1, bien que les techniques de culture en utilisant les follicules de grands mammifères, y compris les humains, ont grandement amélioré au cours des dernières années 2,3.
Nous décrivons ici plusieurs méthodes de culture à l'aide de tissu ovarien de la souris. La première méthod utilise ovaires de souris néonatales entiers, et soutient la formation et le développement précoce des follicules primordiaux 4. Le deuxième système prend en charge la croissance des follicules ovariens individuels, intactes de la fin du préantral à l'étape pré-ovulatoire; en utilisant cette technique, les follicules peuvent être cultivées individuellement, par paires ou 5,6. Enfin, nous décrivons un système de co-culture, en combinant les deux premières techniques dans une méthode qui permet d'étudier les interactions entre la culture et les follicules ovariens primordiaux 7.
Culture des follicules ovariens intactes individuelles permet la croissance du follicule à être déterminé à partir des mesures quotidiennes de follicules au cours de la période de culture, tandis que l'analyse permet d'étudier moyen de follicule / ovaire production d'hormones. D'autres analyses de tissus peuvent être obtenus par une collection de follicules ou le tissu ovarien à la fin de la culture, pour des analyses histologiques / ou immunohistologiques pour un traitement ultérieur, par exemple pour obtenirl'ARNm ou de protéines.
Protocole
Tous les travaux des animaux a été effectuée conformément aux directives institutionnelles sous licence par le Home Office du Royaume-Uni (numéro de licence du projet PPL 60/1726 et 60/4026).
Remarque: animaux Maison conformément aux exigences légales du Royaume-Uni dans une lumière 14 h et 10 h photopériode sombre. Mener des expériences sur les animaux utilisant des souris de C57BL6J de type sauvage, les souris Tau-GFP qui ont une expression ubiquitaire de la protéine fluorescente verte (GFP) 8, et les souris Thy1-YFP avec l'expression occasionnelle de la protéine fluorescente jaune (YFP) dans un sous-ensemble de cellules neuronales neuf: deux lignées transgéniques ont été élevés sur un fond C57BL6J.
1. Conditions de travail et préparation des instruments
- Effectuer la préparation de tous les médias, les dissections de tissus, et le travail de la culture dans une hotte à flux laminaire pour assurer la stérilité: cela évite l'exigence de l'ajout d'antibiotiques aux médias.
- Toujours autoriser les médias / plaques de culture / plats d'embryons se équilibrerpendant au moins une heure, dans un four à 37 ° C (milieu de dissection / plats d'embryon) ou 37 ° C, 5% de CO 2 incubateur (milieu de culture et plaques), avant l'utilisation.
- Faire tremper pipettes de verre dans une solution à 0,1% de sérum albumine bovine (BSA) pendant environ une heure, puis laisser sécher. Tirez pipettes dans la flamme d'un brûleur Bunsen, plier le verre comme vous le faites, pour produire des pipettes en verre incurvées finement dessinés. Après la pipette est tiré, faire une coupe nette avec un coupe-verre. Stériliser four à 160 ° C pendant environ 45 min.
REMARQUE: Un magasin de ces pipettes en verre seront nécessaires pour transférer les ovaires et les follicules.
2. Préparation de la dissection et Culture Media
- Préparer Dissection moyenne.
- Dissoudre 3 mg / ml de BSA dans du milieu L15 Leibowitz et stériliser par filtration à travers un pore de 0,2 um, un filtre de 25 mm de diamètre.
- Néonatale Ovaire Culture.
- Pour préparer le milieu de la culture de l'ovaire néonatal, faire 1 ml de milieu pour each ovaire qui sera mis en culture. Dissoudre 3 mg / ml de BSA dans du α-milieu essentiel minimum (aMEM) et stériliser par filtration à travers un pore de 0,2 um, un filtre de 13 mm de diamètre dans un tube stérile.
- Pour préparer des plaques pour la culture de l'ovaire néonatal, ajouter 1 ml de milieu de culture néonatale ovaire dans chaque puits (un ovaire par puits) d'une plaque de 24 puits. En utilisant des pinces stériles horloger, placer une membrane de polycarbonate sur le dessus de la moyenne dans chaque puits de surface, brillant vers le haut. UV stériliser membranes avant utilisation.
- Follicule Culture.
- Pour préparer le milieu de culture de follicules, milieu essentiel minimal supplément α-1 avec UI / ml d'hormone folliculo-humain recombinant stimulant, 5 ug / ml d'acide ascorbique et 5% v / v de sérum obtenu à partir de souris femelles adultes. Stériliser par filtration à travers un pore de 0,2 um, un filtre de 13 mm de diamètre dans un tube stérile.
- Stériliser par filtration de l'huile de silicium à travers un filtre de 0,45 um pores, diamètre 25 mm, dans un tube stérile.
- Pour préparer plaTES, placez 30 gouttes ul de milieu de culture des follicules dans chaque puits d'une culture non-tissu traité 96 puits Microplaque ronde ainsi, en utilisant uniquement la rangée supérieure de chaque plaque (pour permettre follicules à être déplacés dans de nouvelles lignes chaque jour plus la période de culture). Superposer soigneusement milieu avec 70 ul d'huile de silicone stérilisée, pour empêcher l'évaporation milieu.
- Folliculo-ovaire Co-culture.
- Préparer le milieu de co-culture folliculo-ovaire que pour la culture du follicule à l'étape 2.3.1 ci-dessus, faisant jusqu'à 1 ml de milieu pour chaque co-culture folliculo-ovaire étant mis en place.
- Pour préparer des plaques, ajouter 1 ml de milieu dans chaque puits d'une plaque à 24 puits. En utilisant des pinces stériles horloger, placer une membrane Nucleopore sur le dessus de la moyenne dans chaque puits de surface, brillant vers le haut. UV stériliser membranes avant utilisation.
3. néonatale Ovaire Dissection et de la culture
- Placer 1 ml de milieu de dissection dans chaque boîte d'embryon de verre stérile.
- souriceaux nouveau-nés âgés de Cull jour postnatal 0 et 5, l'abattage par décapitation selon la réglementation UK Home Office.
- Saisir la peau qui recouvre la paroi abdominale à l'aide d'une paire de fines pinces à dissection et faire une grande incision dans la paroi de la peau et le corps. Tirez ouvrir l'incision de sorte tout l'abdomen est exposé. La vessie est généralement engorgé à ce stade et peut être percé pour faire la dissection plus facile.
- Déplacez les tripes de la façon dont l'aide de pinces de horloger. Suivre les cornes utérines de la vessie vers les reins de chaque côté. L'ovaire est situé juste en dessous du rein au sommet de l'utérus et apparaîtra comme une structure semblable à un nuage sous un microscope de dissection.
- Saisissez l'ovaire délicatement avec une pince horloger, et utiliser des ciseaux pour couper son attachement à l'utérus. Transférer la paire d'ovaires dans des plats d'embryons contenant du milieu de dissection préchauffé.
- Effectuer dissection fine des ovaires sous un microscope de dissection sur une sta chaufféege (37 ° C). Utiliser des aiguilles d'insuline pour rogner le sac de la bourse et de tout excès de matériau dont la trompe de Fallope, jusqu'à ce que l'ovaire reste.
- Transférer chaque ovaire dans le puits d'une plaque de culture préparé dans l'étape 2.2.2 ci-dessus, en utilisant une pipette en verre incurvée finement dessinée, un ovaire au-dessus de chaque membrane (voir la figure 1A). Culture dans un 37 ° C, 5% de CO 2 incubateur.
- Changer le support tous les deux jours. Utiliser une pipette d'échanger 50% du milieu dans chaque puits de pré-gazés milieu frais: placer la pointe de la pipette sur le bord du puits de milieu pour éviter de perturber la membrane.
- Maintenir cultures jusqu'à six jours.
- À la fin de la culture, de geler moyen et fixer ou de geler ovaires après un bref lavage dans PBS, comme l'exige.
- Fixer ovaires dans le fixateur de Bouin pendant 90 min pour l'analyse histologique, ou 10% du formol tamponné neutre pendant 90 min pour l'analyse immunohistochimique. Aligner geler ovaires par le tissu plaçant dansun tube en polypropylene, en plaçant le tube dans de la glace sèche pendant 5 à 10 min avant de le congeler à -70 ° C pour la protéine ou l'extraction ultérieure de l'ARNm.
4. folliculo Dissection et de la culture
- Cull souris femelles âgées de 19 à 23 jours de et isoler les ovaires. Mouiller la fourrure avec 70% d'éthanol avant de faire des incisions. Pincer la peau en utilisant une pince extrémités franches et de faire une grande incision dans l'abdomen avec des ciseaux de dissection, pénétrant à travers la peau et la paroi du corps.
- Déplacez l'intestin de la route en utilisant un ensemble plus fine des instruments de dissection et de localiser l'utérus. Suivre l'utérus jusqu'à l'ovaire, qui est situé au-dessous du rein, de chaque côté.
- Saisir délicatement l'ovaire en utilisant une paire de pinces horloger, rompre le ovaires attachement à l'utérus avec des ciseaux fins de dissection. Éviter de recueillir trop de coussinet adipeux de l'ovaire. Recueillir les ovaires et transférer dans des plats d'un embryon contenant du milieu de dissection préchauffé.
- Rédéplacer la bourse ovarienne en utilisant des aiguilles d'insuline pour rogner le sac de la bourse et de tout excès de matériau dont la trompe de Fallope, jusqu'à ce que l'ovaire reste. Environ réduire de moitié chaque ovaire en utilisant des aiguilles d'insuline.
- Soigneusement transférer chaque demi-ovaire dans un verre de montre individuel contenant 1 ml de milieu de dissection. Couvrir chaque verre de montre avec une lame de verre pour empêcher l'évaporation de milieu et d'assurer la stérilité.
- verres de montre de magasin contenant moitiés ovaire dans un four à 37 C ° jusqu'à ce que nécessaire, mais réaliser l'étape de dissection suivante dès que possible. Jeter tissus stocké de cette manière pendant plus d'une heure.
- Transfert verre de montre contenant une moitié de l'ovaire à un étage de microscope chauffé à 37 ° C sous une hotte à flux laminaire. Environ disséquer ovaire en gros morceaux à l'aide de deux aiguilles d'insuline, afin d'identifier les follicules pré-antraux fin de la façon suivante: il se agit contiennent 2-3 couches de cellules de la granulosa et ont un diamètre de l'ordre de 180 à 200 um.
- Disséquer manuellement tout iindéterminés follicules en utilisant une aiguille à l'insuline et une aiguille d'acupuncture 0,25 x 30 mm qui a été fixée dans un porte-aiguille. Veillez à éliminer la plupart du stroma entourant, mais éviter d'endommager la lame basale des follicules (voir la figure 1B).
- Utiliser une pipette en verre incurvé finement dessiné pour transférer attentivement follicules disséqués dans un verre de montre collecte contenant du milieu de dissection préchauffé. Veillez à garder les follicules dans la section de fin calibre de pipette pour éviter de perdre follicules.
- follicules Mesurer avec précision en utilisant un réticule de l'oculaire calibré monté dans un microscope à dissection.
- Sélectionnez follicules pour la culture que se ils mesurent 190 ± 10 m de diamètre. Sélectionnez d'autres seulement, les follicules sphériques sains pour la culture; elles sont translucides, sans zones sombres atrétiques, et ont une lame basale intacte, avec un peu de tissu thécale joint: jetez les follicules qui ne correspondent pas à cette description. On obtient un rendement compris entre 10-15 follicules par ovaire est bon.
- Utiliser une pipette en verre incurvé finement dessiné pour transférer un seul follicule dans le puits d'une plaque constituée comme à l'étape 2.3.3 ci-dessus. Placez soigneusement dans le follicule le fond du puits (et non dans la couche d'huile supérieure). Culture dans un 37 ° C, 5% de CO 2 incubateur.
- follicules Culture pour un maximum de six jours, se déplaçant follicules dans un milieu frais et contenant tous les jours.
- Préparer la prochaine ligne de la plaque à 96 ainsi que dans la préparation de la plaque à l'étape 2.3.3 ci-dessus. Plaque Retour à l'incubateur pendant au moins une heure, pour permettre un équilibrage. Transfert follicules dans les puits de milieu frais, en utilisant une pipette en verre finement élaboré.
- Si à tout moment dans la culture follicules doivent être laissés pendant deux jours avant d'emménager dans un milieu frais, placer chaque follicule dans un minimum de 60 pi (plutôt que 30 pi) gouttelettes de milieu de culture de follicule.
- Pour recueillir des données sur la croissance du follicule, mesurer follicules quotidienne, en utilisant un eyepiece réticule monté dans un microscope à dissection. La couche d'huile fausser les mesures de diamètre du follicule, donc travailler sur le coefficient d'étalonnage pour le set-up.
- À la fin de la culture, de geler moyen et fixer ou geler les tissus pour une analyse ultérieure, comme dans l'étape 3.10 ci-dessus.
- Folliculo-follicule Co-culture.
- Culture follicules deux ensemble, pour étudier les interactions entre les follicules. La culture comme ci-dessus, mais deux follicules placer côte-à-côte, en contact, dans un puits.
- Passer gouttelettes de 100 ul de milieu de culture de follicules dans chaque puits d'une culture non tissulaire traitée microtitrage à 96 puits de plaque plate et, recouvrant milieu avec 100 ul d'huile de silicone stérilisée. Ne pas transférer follicules dans les puits fraîches comme dans l'étape 4.13 ci-dessus, mais au lieu d'utiliser une pointe de gel amende à changer 50% de la moyenne tous les deux jours.
- Afin d'identifier l'origine des tissus au sein de la co-culture, la co-culture de follicules chacun une source génétique différente, par exemple oNE de l'ovaire d'une souris de type sauvage, et l'autre de l'ovaire d'une souris avec une expression ubiquitaire de la GFP. Si l'on utilise la GFP ou YFP tissu, de minimiser l'exposition du tissu à la lumière, autant que possible, au cours de la culture, et à travers les étapes de fixation / traitement par la suite.
NOTE: Il est normal que les deux follicules grandissent ensemble dans une seule unité 'deux follicule' (voir figure 1C).
5. folliculo-Ovaire Co-Cultures
- Disséquer les ovaires et les follicules sur que dans les sections 3 et 4 ci-dessus.
- Placer une ovaire néonatale sur une membrane, dans une plaque préparée comme dans l'étape 2.4.2 ci-dessus. Placez délicatement un seul follicule en contact avec un des pôles de l'ovaire néonatale, à l'aide d'une pipette en verre incurvé finement dessinée. Culture dans un 37 ° C, 5% de CO 2 incubateur pour jusqu'à 5 jours.
- Afin de distinguer l'origine des tissus au sein de la co-culture, utiliser les ovaires et les follicules de deux différent poururces, par exemple une souris d'un type sauvage, et l'un d'une souris avec une expression ubiquitaire de la GFP.
- Remplacer 500 ul de milieu tous les jours comme à l'étape 3.8 ci-dessus, mais en utilisant un milieu de culture de follicules. Au cours de co-culture, le follicule devient souvent encapsulé par l'ovaire (figure 1D).
- À la fin de la culture, de geler moyen et fixer ou geler les tissus pour une analyse ultérieure, comme dans l'étape 3.10 ci-dessus.
6. Fixation, Immunocytochimie et imagerie du tissu cultivé
- À la fin de la culture, lavez le tissu dans du PBS et transfert à 100 pi (follicule) ou 1 ml (ovaire) de 10% du formol tamponné neutre, et fixer pendant 1 heure sur de la glace. Déplacez-vous dans trois lavages de 1x PBS à 4 ° C.
- Pour immunocytochimie sur les follicules, transfert entre puits d'une plaque de microtitration ronde et 96 puits en utilisant une pipette en verre incurvée finement dessiné, avec chaque puits contenant différents lavages ou traitements.
- Pour immunocytochimie sur Ovaries (ou follicule ovaire-co-cultures), intégrer dans un gel d'agarose à 4% et à l'article 50 um en utilisant un vibrotome. des sections de flotter dans le puits d'une plaque à 24 puits à appliquer des lavages ou traitements, retirer avec une pipette.
- Pour l'imagerie: transférer sections agarose sur des lames de verre plat et monter avec un milieu de montage; ou des follicules de transfert (ou complexes folliculo-follicule) à lames de verre de la cavité et monter avec non-durcissement milieu de montage. spécimens d'image en utilisant un microscope confocal.
Résultats
Figure 1 montre des images des ovaires et de follicules au début et pendant la présentation, les procédures de culture.
La figure 2 montre des résultats représentatifs d'ovaires néonatales (ici, les ovaires de nouveau-nés) exposés à des toxiques pour la reproduction pendant la culture. Ovaires néonatales ont été cultivées pendant 6 jours, et exposés à un médicament de chimiothérapie, cisplatine ou la doxorubicine, le jour 2 de la culture. A la fin de la culture, les ovaires ont été fixés, traités pour l'histologie et les ovaires ont ensuite examiné pour déterminer le nombre de follicules ovariens sains et malsains 4. Alternativement, une évaluation plus rapide des follicules en croissance début peut être obtenu à partir de la culture de fragments ovariens, en utilisant les ovaires d'une souris exprimant un marqueur fluorescent spécifique dix-ovocyte.
Au cours de la culture des follicules individuels, la croissance du follicule peut être facilement déterminée par des mesures par jour pendant le culture période. La figure 3 montre des résultats représentatifs de la croissance des follicules cultivées en présence ou en l'absence d'hormones gonadotrophines hormone folliculo-stimulante (FSH) et l'hormone lutéinisante (LH) 5.
Folliculo-follicule ou folliculo-ovaire co-culture peuvent être utilisés pour étudier les interactions entre les follicules. Selon le tissu et le traitement, les images peuvent être obtenus en utilisant fond clair, fluorescence ou microscopie confocale. La figure 4 montre des résultats représentatifs d'images à partir de ces co-cultures, l'examen des différents types de cellules impliquées dans la communication folliculo-follicule, y compris les cellules endothéliales et des cellules neuronales 7.
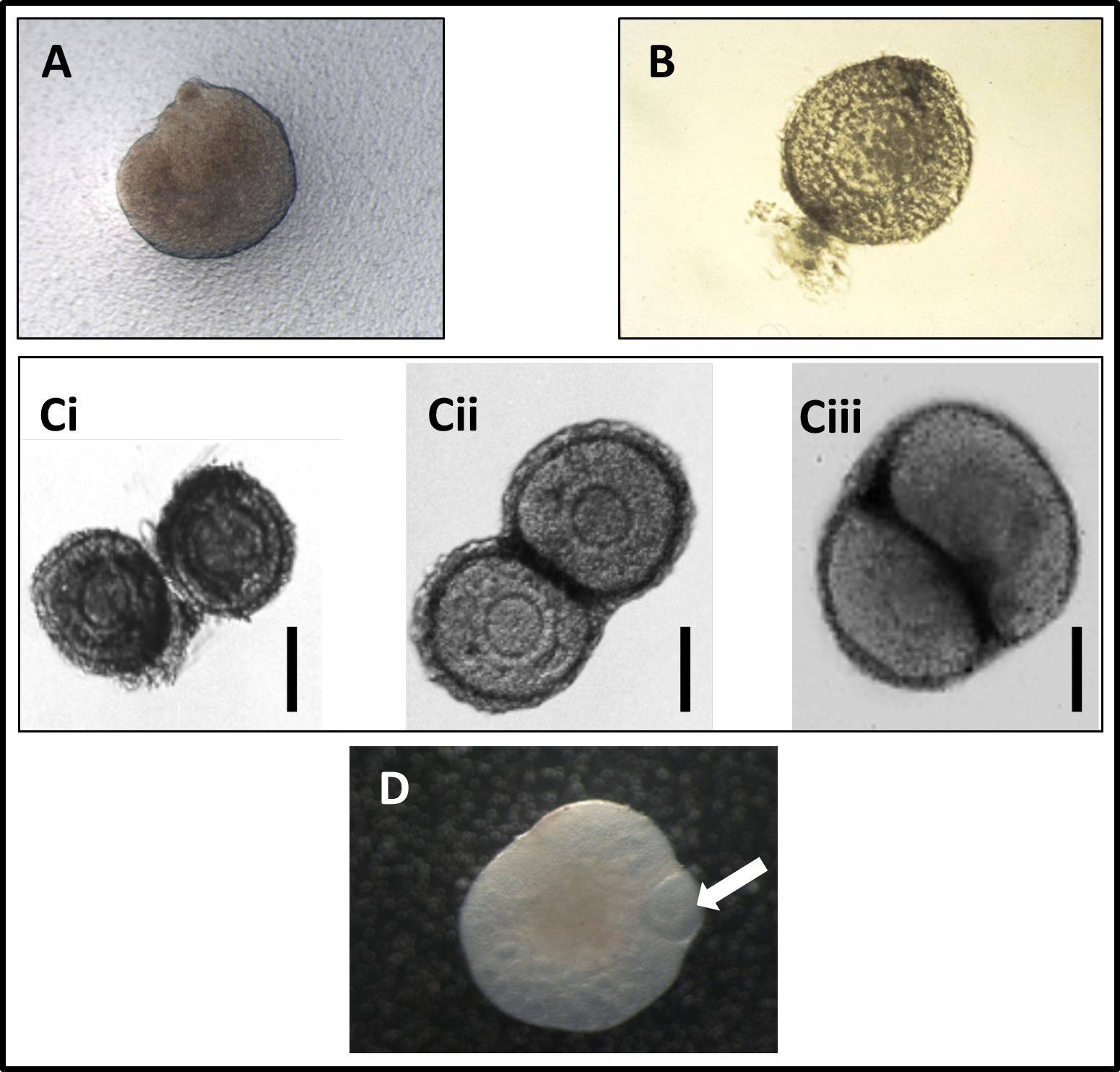
Figure 1: (A) une photomicrographie d'un ovaire néonatal obtenu à partir d'une souris le jour de la naissance, placé sur une membrane de polycarbonate. (B) Photomicrographie fraîchement disséqué follicule ovarien sain, avec la plupart des tissus du stroma entourant disséquée. (C) Photomicrographies de co-culture de deux follicules ovariens au cours des trois premiers jours de culture, montrant le contact étroit qui se développe entre les deux follicules que le produit de la culture (CI: premier jour de la culture; Cii: deuxième journée de la culture; Ciii : troisième jour de la culture). Reproduit de Spears et al. 11 (D) Photomicrographie de co-cultivées follicule préantral et de l'ovaire néonatal après deux jours de culture. L'image montre le follicule devenir encapsulé par l'ovaire. La flèche indique follicule préantral. Image de Dr Federica Lopes. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
gure 2 "src =" / files / ftp_upload / 52458 / 52458fig2.jpg "/>
Figure 2: Effet des médicaments de chimiothérapie cisplatine et doxorubicine sur ovaires culture néonatales cisplatine et doxorubicine à la fois conduire à la perte de la santé du follicule et une diminution du nombre de follicules.. (A) cisplatine; (B) Doxorubicine: (i) Pourcentage des follicules malsains (effacer); et (ii) le nombre total de follicules (ombragée) dans chaque ovaire. Bars désignent moyenne + SEM; n = 5 pour tous les groupes, les étoiles représentent des différences significatives par rapport au témoin (* p <0,05, ** p <0,01, *** p <0,001). Reproduit de Morgan et al. 4
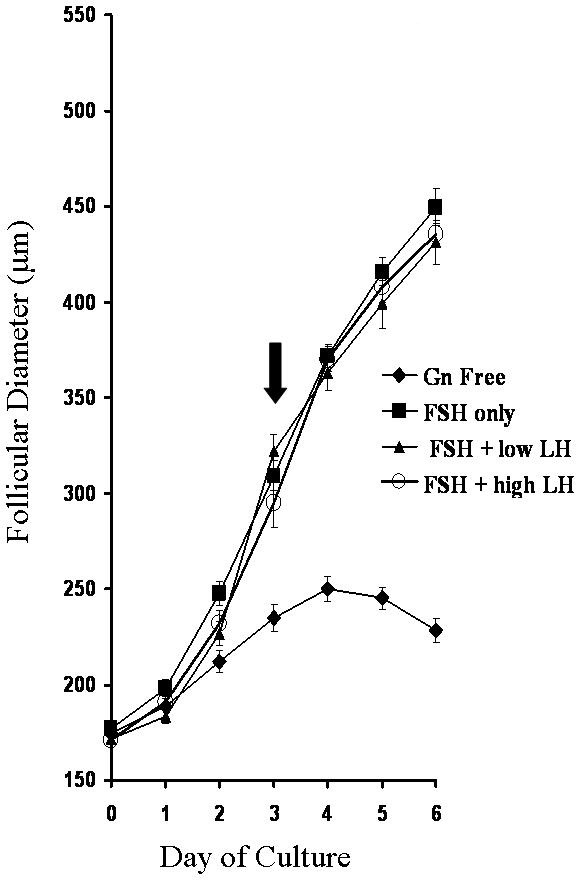
Figure 3: Taux de croissance. Follicules exposés à différents environnements de gonadotrophines valeurs sont la moyenne ± SEM (n ≥16 pour chaque groupe). La flèche indique le début de antral la formation dans tous les groupes de gonadotrophines. Reproduit de Murray et al. 5
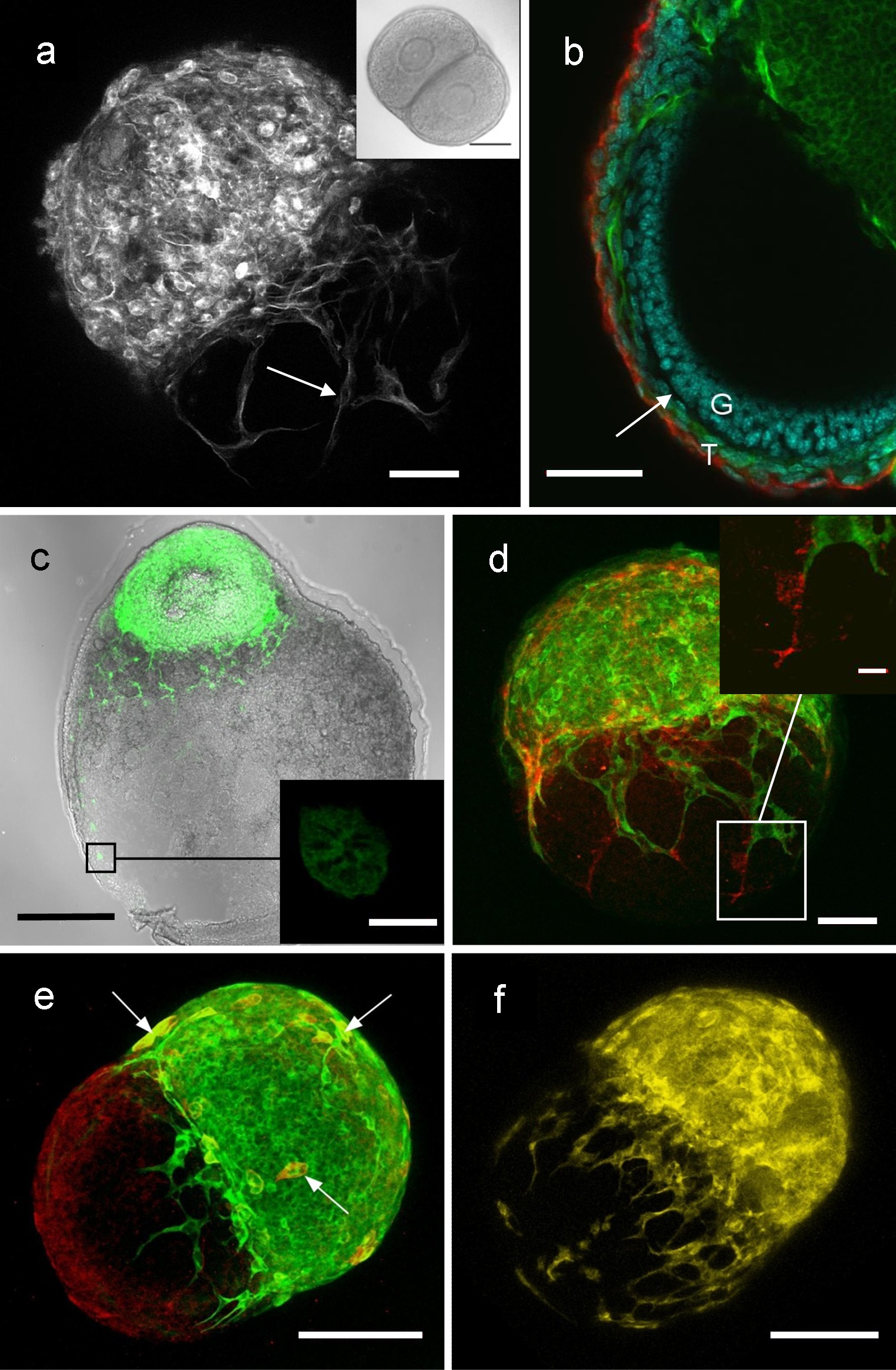
Figure 4: Images de folliculo-follicule et de l'ovaire-follicule co-cultures, montrant les interactions folliculo-follicule (A) de micrographie confocale d'une protéine fluorescente verte (GFP) du follicule et un de type sauvage (WT) follicule après co-culture (. expression de la GFP montré ici en blanc), avec des processus provenant du follicule GFP montré étendant sur le follicule WT. (B) Coupe transversale à travers un / complexe du follicule WT GFP suite à la co-culture, montrant que les processus de GFP (vert) provenant du follicule mensonge attenant à côté de la lame basale du follicule WT. (C) néonatale WT ovaire suivante culture avec une GFP exprimant follicule, montrant que les cellules GFP et processus cellulaires (vert) pré-antrale ont migrépar l'intermédiaire du interstitum ovarienne de l'ovaire néonatal. (D) GFP / le complexe du follicule WT contenant les cellules endothéliales, montré par l'expression de CD31 endothéliale de marqueur de cellules (rouge). (E) GFP / complexe du follicule WT contenant des cellules neuronales, représentés par l'expression de marqueur neuronal bêta tubuline III (voir ici que le rouge, le jaune ou si la double marqué avec la GFP, vert). Complexe du follicule (F) YFP / WT, où YFP se réfère à follicule d'une souris Thy1-YFP qui a l'expression occasionnelle de la protéine fluorescente jaune (YFP: jaune) dans un sous-ensemble de cellules neuronales 9, montrant que les neurones se étendent à partir du follicule YFP. Bars 50 um (A, B, D), 100 um (C, E, F), 100 um (en médaillon en A), 10 um (en médaillon en C), 15 um (encart dans D). Reproduit de Campbell et al. 7 Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Nous décrivons ici les différents systèmes de culture qui peuvent être utilisés pour soutenir le développement des follicules ovariens de souris in vitro, en utilisant des ovaires néonatales entières contenant seulement les stades premiers du follicule, follicules ovariens préantraux individuels et également co-cultures des deux tissus.
Culture d'ovaires de souris néonatale précoce soutient le développement ovarien, l'initiation de la croissance folliculaire en particulier jusqu'au stade de follicule secondaire. Un éventail d'âges de souris néonatales peut être utilisée pour ces cultures, selon les stades de développement d'intérêt. Si les ovaires sont obtenus à partir des souris nouveau-nés, la formation de follicules sera en cours, mais pas encore achevé: la culture soutiendra au moins partiellement la formation de follicules suite suivie par la croissance du follicule. Alternativement, l'utilisation des ovaires de souris autour de quatre à cinq jours d'âge (par lequel la formation de follicules de temps est déjà complets) résultats dans la culture d'un plus grand nombre de folli primordiale et croissantecles 12. Aspects bénéfiques de la technique spécifique décrit ici comprennent l'utilisation de membranes de polycarbonate flottants, ce qui permet une meilleure oxygénation du tissu, et la culture dans un milieu très basique constitué de seulement aMEM et BSA, ce qui évite l'utilisation d'additifs non définis tels que le sérum. Culture des ovaires ensemble ne semble pas soutenir le développement au-delà du stade de follicule secondaire, avec le développement ultérieur nécessitant une modification de la technique, telles que la dissection de complexes cellulaires folliculo-granulosa de l'ovaire néonatal culture 1.
Les étapes ultérieures de développement des follicules peuvent être développées in vitro en disséquant out individuel, les follicules pré-antraux fin intactes, qui peut être cultivé à l'étape pré-ovulatoire dans la culture tout en maintenant leur structure tridimensionnelle. L'utilisation de follicules intacts pour cette technique de culture maintient la relation entre les différents composants folliculaires qui se produit in vivo. This système de culture peut être utilisé pour obtenir des ovocytes qui peuvent soutenir la fécondation et le développement embryonnaire ultérieur.
Fertilisables ovocytes peuvent également être obtenus à partir d'ovaires de souris néonatales en utilisant un protocole de culture initial autant que décrite ici, suivie par une seconde étape au cours de laquelle les complexes de cellules de la granulosa-ovocytes sont cultivés in vitro 1. D'autres systèmes utilisés aujourd'hui assez fréquemment comprennent la culture de follicules ou le tissu ovarien qui a été encapsulés dans un matériau tel que l'hydrogel d'alginate, pour fournir un appui (voir, par exemple, Tagler et al. 13). Une grande partie du centre du développement de la méthode est maintenant d'améliorer les techniques de culture pour les ovaires et les follicules de grands mammifères, avec l'objectif à long terme d'obtenir des ovocytes fécondable de follicules primordiaux à partir d'un éventail d'espèces, y compris les humains.
À tout moment, les ovaires de mammifères contiennent follicules à une gamme de stades de développement, avec INTERACTIONSns entre follicules affectant leur réglementation. Cet aspect de la fonction ovarienne est mal comprise et difficile à examiner in vivo. La dernière méthode décrite ici utilise des systèmes de co-culture pour soutenir le développement des différentes étapes de follicules in vitro. Si nécessaire, une ou les deux tissus peuvent être pré-traitées in vivo ou in vitro de co-culture préalable. Systèmes de co-culture comme celui offrent un moyen idéal pour examiner les interactions folliculo-follicule, par exemple, comment la croissance, follicules antraux affectent la piscine de follicules primordiaux, aspects de la biologie de l'ovaire qui se sont avérées difficiles à examiner jusqu'à présent.
Techniques de culture d'ovaires entiers sont assez simples, bien dissection minutieuse est nécessaire pour éviter des dommages aux tissus accidentelle. Dissection des follicules individuels est une technique spécialisée, nécessitant la pratique répétée avant follicules au bon moment peuvent être disséqués de l'ovaire intact et en bon état. Il est essentielà disséquer les follicules individuels avec soin, ou dommages subis pendant le protocole de dissection peut entraîner la mort follicule pendant la période de culture ultérieure. Lorsque les follicules sont placées directement dans le puits de plaques de microtitrage, il est important de ne utiliser que des matières plastiques culture non tissulaire traités, afin de minimiser le placage vers le bas de cellules thécales sur les matières plastiques: si la culture de tissus plasticware traitée est utilisée, les follicules se attacher à la base du puits et la rupture à mesure qu'ils grandissent. Pour tout travail de co-culture, les tissus doivent être placés directement en contact avec l'autre.
Le milieu indiqué ci-dessus pour une utilisation dans la technique de culture de follicule comprend l'ajout de sérum de souris. Il est possible de remplacer le sérum de souris avec du sérum de veau fœtal, mais seulement occasionnellement lots de sérums tels soutiendra pleinement le développement des follicules au stade pré-ovulatoire, avec lot d'essais requis pour identifier des sources appropriées. Lot-test de FSH est également conseillé, comme l'Uni internationalts par lequel FSH est évaluée corrélat seulement grossièrement à la croissance du follicule in vitro. Si la rupture du follicule se produit régulièrement au cours de la période de culture, envisager de remplacer l'acide ascorbique stock avec un nouveau lot.
Les techniques ne nécessitent pas de matériel particulier spécialisée autres que les microscopes de dissection et les incubateurs de culture de tissu, bien que l'utilisation d'une hotte à flux laminaire et une bonne technique stérile permettre aux follicules ovariens à être cultivées en l'absence d'antibiotiques, comme dans les procédés décrits ici. Cela peut être utile, pour éviter tout effet néfaste potentiel des antibiotiques sur les ovocytes, en particulier si elles doivent être fécondé la culture suivante. Lorsqu'il ne est pas possible de travailler dans un environnement stérile, il est conseillé d'ajouter des antibiotiques pour la dissection et la culture des médias.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Work was funded by MRC grant G1002118.
matériels
| Name | Company | Catalog Number | Comments |
| Name of the Material/Equipment | Company | Catalog Number | Comments/Description |
| Leibowitz L15 | Invitrogen | 11415049 | |
| αMEM | Invitrogen | 22571020 | Supplied as sodium bicarbonate buffered (2200 mg/L) |
| Bovine serum albumin | Sigma Aldrich | A9418 | For dissection medium |
| Bovine serum albumin | Sigma Aldrich | A3311 | For culture medium |
| Bovine serum albumin | Sigma Aldrich | A2153 | For coating glass pipettes |
| Mouse serum | - | - | Collected from cardiac puncture |
| FSH | Merck Serono | Gonal F | Batch testing is often necessary. Make up stock solution of 1IU/10µl in αMEM and store at -20°C. |
| Ascorbic acid | Sigma Aldrich | A4034 | Make up stock of 5mg/ml in αMEM and store at -20°C. |
| Silicon oil | VWR | 630064V | Dow Corning Silicone Fluid 200/50cS |
| Syringe filters (25mm, 0.2µm) | Greiner | 16532K | Cellulose acetate filter: for filtering larger (> 5mls) volumes of medium. |
| Syringe filters (13mm, 0.2µm) | Iwaki | 3032-013 | Cellulose acetate filter: for filtering smaller (< 5mls) volumes of medium |
| Syringe filters (25mm, 0.45µm) | Iwaki | 2053-025 | Cellulose acetate filter: for filtering oil. |
| Sterile tubes | Greiner | 187261 | |
| 24 well plate | Greiner | 662160 | |
| 96 well round bottom plate | Iwaki | 3875-096 | Use only non-tissue culture treated plates |
| 96 well flat bottomed well | Iwaki | 3860-096 | Use only non-tissue culture treated plates |
| Whatman nucleopore membranes | Camlab | WN/110414 | Use shiny surface up, polycarbonate, 13mm diameter, 8.0µm pore size |
| Insulin needles | BD medical supplies | 037-7606 | 0.33mm (29G) +1ml |
| Glass embryo dishes | VWR | 720-0579 | Sterilise then warm before use |
| Glass pipettes | Fisher Scientific | 10209381 | BSA coated before use |
| Gel tips | AlphaLabs | LW1103 | |
| Acupuncture needles | Acumedic LTD | 30mmx0.25 Type C | |
| Bouin’s fixative | Sigma Aldrich | HT10132-1L | |
| Formalin solution, neutral buffered, 10% | Sigma Aldrich | HT5014-120ml | |
| 1.5 ml polypropylene tubes | Greiner BioOne | 616201 |
Références
- Brien, M. J., Pendola, F. L., Eppig, J. J. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol. Reprod. 68 (5), 1682-1686 (2003).
- Fortune, J. E., Yang, M. Y., Muruvi, W. The earliest stages of follicle development: follicle formation and activation. Soc. Reprod. Fertil. Suppl. 67, 203-216 (2010).
- McLaughlin, M., Kinnell, H. L., Anderson, R. A., Telfer, E. E. Inhibition of phosphatase and tensin homologue (PTEN) in human ovary in vitro results in increased activation of primordial follicles but compromises development of growing follicles. Mol. Hum. Reprod. 20 (8), 736-744 (2014).
- Morgan, S., Lopes, F., Gourley, C., Anderson, R. A., Spears, N. Cisplatin and doxorubicin induce distinct mechanisms of ovarian follicle loss; imatinib provides selective protection only against cisplatin. PLoS One. 8 (7), e70117 (2013).
- Murray, A. A., et al. Follicular growth and oocyte competence in the in vitro cultured mouse follicle: effects of gonadotrophins and steroids. Mol Hum Reprod. 14 (2), 75-83 (2008).
- Baker, S. J., Srsen, V., Lapping, R., Spears, N. Combined effect of follicle-follicle interactions and declining follicle-stimulating hormone on murine follicle health in vitro. Biol. Reprod. 65 (4), 1304-1310 (2001).
- Campbell, L., Trendell, J., Spears, N. Identification of cells migrating from the thecal layer of ovarian follicles. Cell Tissue Res. 353 (1), 189-194 (2013).
- Pratt, T., Sharp, L., Nichols, J., Price, D. J., Mason, J. O. Embryonic stem cells and transgenic mice ubiquitously expressing a tau-tagged green fluorescent protein. Dev. Biol. 228 (1), 19-28 (2000).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Maiani, E., et al. Reply to: cisplatin-induced primordial follicle oocyte killing and loss of fertility are not prevented by imatinib. Nat. Med. 18 (8), 1172-1174 (2012).
- Spears, N., Bruin, d. r., Gosden, J. P., G, R. The establishment of follicular dominance in co-cultured mouse ovarian follicles. J. Reprod. Fertil. 106 (1), 1-6 (1996).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicol. Sc. 90 (2), 500-509 (2006).
- Tagler, D., et al. Promoting extracellular matrix remodelling via ascorbic acid enhances the survival of primary ovarian follicles encapsulated in alginate hydrogels. Biotechnol. Bioeng. 111 (7), 1417-1429 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon