Method Article
Культура и Co-Культура мыши яичников и фолликулов в яичниках
В этой статье
Резюме
Этот протокол описывает первичной культуры / со-культуры ткани яичника мыши, используя яичников новорожденных мышей и отдельных фолликулов яичника от препубертатном мышей. Методы поддержки культуры развития в очень физиологическом уровне, что позволяет исследовать влияние внешних агентов на яичнике, а взаимодействия между фолликулов.
Аннотация
Яичников млекопитающих состоит из фолликулов яичников, каждый фолликул, состоящий из одного ооцита, окруженного соматических клеток гранулезы, заключенный вместе в базальной мембране. Конечная бассейн фолликулов были заложены в период эмбрионального развития, когда ооциты в остановку мейоза образуют тесную связь с плоскими клетками гранулезы, образуя первичные фолликулы. По или вскоре после рождения, яичники млекопитающих содержат запас их жизни в изначальных фолликулов, из которых точка года есть устойчивый выпуск фолликулов в растущую фолликулярной бассейн.
Яичников особенно подходит для развития в пробирке, с фолликулами растет в очень физиологическом уровне в культуре. Эта работа описывает культуру целых новорожденных яичников, содержащих первичные фолликулы, и культура отдельных фолликулов, метод, который может поддержать развитие фолликулов из незрелых через к preovulatory стадии, после чего их ооциты способны пройти искусственного оплодотворения. Работа, изложенная здесь использует системы культуры, чтобы определить, как яичник зависит от воздействия внешних соединений. Мы также описать систему совместного культура, которая позволяет исследовать взаимодействие, которое происходит между ростом фолликулов и без растущего числа первичных фолликулов.
Введение
Яичников млекопитающих состоит из самки жизни поставку ооцитов, каждый из которых находится в пределах фолликула яичника. Фолликулы формируются еще до рождения на Приюте, изначальная стадия: когда фолликул бассейн Установлено, есть постоянное и постепенное движение фолликулов из изначальной в растущий фолликул бассейн. Как фолликулы начинают расти, они развивают в начальных, средних, preantral, а затем антральных стадиях, пока они не достигнут преовуляторных или Graafian, этап. Только ооциты из преовуляторных фолликулов имеют полный компетенции развитием, в состоянии поддерживать эмбриональное развитие в перспективе, если оплодотворена.
Яичник Давно известно, развиваться в высокой физиологической образом в пробирке. Это, вероятно, будет из-за каждого фолликула, содержащего внутри себя клетки, необходимые для поддержки яйцеклетки из незрелой стадии (в этот момент он не в состоянии завершить свою деления мейоза), через ТОн развитием компетентным этап (в этот момент он может полностью поддерживать завершение мейоза, оплодотворения и развития эмбриона в результате к перспективе).
Физиологический характер развития яичников в пробирке привело к широкому использованию яичника методов культивирования. Следовательно, методы в пробирке были использованы для изучения регуляции развития яичников, рак яичников, патологии (например, что из синдрома поликистозных яичников, СПКЯ), проверка того, как яичники / ооциты зависит от воздействия химических веществ, а также с практической целью получение оплодотворению яйцеклетки из первичных фолликулов. На сегодняшний день, последняя была достигнута только с помощью мыши ткани яичника 1, хотя методы культивирования с использованием фолликулы из крупных млекопитающих, включая человека, значительно улучшилась в последние годы 2,3.
Здесь мы опишем несколько методов культивирования с использованием мыши ткани яичника. Первый метоd использует целые новорожденных яичники мыши, и поддерживает образование и раннее развитие первичных фолликулов 4. Вторая система поддерживает рост отдельных, нетронутых фолликулов с конца preantral к преовуляторного этапе; с помощью этой техники, фолликулы можно культивировать в отдельности, или в парах 5,6. Наконец, мы опишем систему совместного культивирования, сочетающий в себе первые два метода в метод, который позволяет исследовать взаимодействия между ростом и первичных фолликулов 7.
Культура отдельных интактных фолликулов в яичниках позволяет рост фолликула быть определена из ежедневных измерений фолликула в период культуры, в то время как средний анализ позволяет исследовать фолликула / яичников выработку гормонов. Дальнейший анализ ткани может быть достигнуто посредством сбора фолликулов яичника или ткани в конце культуры, для гистологических анализов / иммуногистологических или для последующей обработки, например, для получениямРНК или белка.
протокол
Все для животных работа была выполнена в соответствии с ведомственным руководящим принципам по лицензии Министерство внутренних дел Великобритании (номер лицензии проект закона о госзакупках 60/1726 и 60/4026).
Внимание: дом животных в соответствии с требованиями законодательства Великобритании в 14 ч света и 10 ч темноты светового дня. Проводить эксперименты на животных с использованием C57Bl6J мышей дикого типа, Тау-GFP мышей, которые имеют повсеместное выражение зеленого флуоресцентного белка (GFP) 8, и Thy1-YFP мышей с периодическим выражения желтого флуоресцентного белка (YFP) в подгруппе нервных клеток 9: как трансгенные линии были выведены на фоне C57Bl6J.
1. Условия работы и подготовка инструменты
- Выполните все подготовительные СМИ, ткани вскрытия и культуры работы в ламинарном потоке для обеспечения стерильности: это позволяет избежать требования добавлением антибиотиков для средств массовой информации.
- Всегда разрешать СМИ / культура пластин / блюда эмбрионов, чтобы уравновеситьпо крайней мере, 1 ч, в 37 ° C духовку (рассечение среды / эмбрионов посуда) или 37 ° C, 5% CO 2 инкубаторе (культуральной среды и пластины), до использования.
- Замочите стеклянные пипетки в 0,1% -ном растворе бычьего сывороточного альбумина (БСА) в течение приблизительно часа, а затем оставить до полного высыхания. Потяните пипетки в пламени горелки Бунзена, гибка стекла, как это сделать, чтобы произвести мелко нарисованные изогнутым стеклом пипетки. После пипетки втягивается, чтобы чистый срез с резаком стекла. Печь стерилизации при 160 ° С в течение примерно 45 мин.
ПРИМЕЧАНИЕ: магазин из этих стеклянных пипеток будут необходимы для передачи яичников и фолликулов.
2. Подготовка Вскрытие и медиакультуры
- Подготовка Dissection Medium.
- Растворите 3 мг / мл БСА в среде L15 Лейбович и фильтр стерилизуют через 0,2 мкм поры, 25 мм диаметром фильтра.
- Неонатальный яичников культуры.
- Чтобы подготовить среду для новорожденных яичников культуры, сделать 1 мл среды для ВАСч яичника, которые можно культивировать. Растворите 3 мг / мл БСА в α-минимальной поддерживающей медиа (αMEM) и фильтр стерилизуют через 0,2 мкм поры, 13 мм диаметром фильтра в стерильную пробирку.
- Чтобы подготовить листы для новорожденных яичников культуры, добавляют 1 мл новорожденных яичника культуральной среды в каждую лунку (одна яичника на лунку) в 24-луночный планшет. Использование стерильных часовщик щипцов, положите одну из поликарбоната мембраны на вершине среды в каждую лунку, блестящей поверхности вверх. УФ стерилизации мембраны перед использованием.
- Фолликулостимулирующий культуры.
- Чтобы подготовить среду для фолликула культуры, добавки α-минимальной поддерживающей среды с 1 МЕ / мл рекомбинантного человеческого фолликулостимулирующего гормона, 5 мкг / мл аскорбиновой кислоты и 5% об / об сыворотки, полученной от взрослых самок мышей. Фильтр стерилизуют через 0,2 мкм поры, 13 мм диаметром фильтра в стерильную пробирку.
- Фильтр стерилизуют силиконовое масло через 0,45 мкм пор, фильтр 25 мм в диаметре, в стерильную пробирку.
- Чтобы подготовить плаTES, разместить 30 мкл капли фолликула культуральной среды в каждую лунку в культуре ткани, не обрабатывают микротитровальных круглым-луночного планшета 96-а, с использованием только верхний ряд каждой пластины (чтобы позволить фолликулы, которые будут перемещены в новые строки каждый день в течение Период культура). Тщательно наложить среда с 70 мкл стерилизованной силиконового масла, чтобы предотвратить испарение среды.
- Фолликулостимулирующий яичников Co-культура.
- Подготовка среды для фолликулостимулирующего яичников совместного культивирования, как и для фолликула культуры в шаге 2.3.1 выше, составляя 1 мл среды для каждого фолликула-яичник совместно культуры создаются.
- Для приготовления пластины, добавить 1 мл среды в каждую лунку 24-луночного планшета. Использование стерильных часовщик щипцов, положите одну нуклеопорные мембрану в верхней части среды в каждую лунку, блестящей поверхности вверх. УФ стерилизации мембраны перед использованием.
3. новорожденных яичников Вскрытие и культура
- Поместите 1 мл рассечение среды в каждой стерильной стеклянной эмбриона блюдо.
- отбирать новорожденных щенков мыши в возрасте от послеродовой день 0 и 5, выбраковка путем обезглавливания в соответствии с правилами Британского МВД.
- Возьмитесь за оболочку, покрывающую брюшную стенку с помощью пары тонких рассечение пинцетом и сделать большой разрез в коже и стенке тела. Выдвиньте разрез так весь живот подвергается. Мочевого пузыря, как правило, наливается на данном этапе и могут быть проколоты, чтобы сделать рассечение проще.
- Перемещение кишки из пути, используя часовщик щипцами. Последующие рогов матки, из верхнего мочевого пузыря в почки на каждой стороне. Яичник расположен чуть ниже почки в верхней части матки и появится в виде облака, как структуры под микроскопом рассекает.
- Возьмитесь яичник осторожно часовщик щипцов и использовать ножницы, чтобы разорвать свою привязанность к матке. Передача пара яичников в эмбриональных блюд, содержащих подогретого рассечение среды.
- Выполните точную рассечение яичников под микроскопом рассечение на нагретой ГНАGE (37 ° С). Использовать инсулин иглы Отрезать бурсы мешок и излишки материала, включая маточную трубу, пока только яичник не остается.
- Передача каждого яичника в лунку планшета для культуры, полученного на стадии 2.2.2 выше, с использованием мелко обращается изогнутую стеклянную пипетку, один яичник на вершине каждой мембраны (см фиг.1А). Культура в 37 ° C, 5% СО 2 инкубатора.
- Изменение среды каждый второй день. Используйте пипетку для обмена 50% от среды, в каждую лунку предварительно газом свежей средой: Место пипетки на краю колодца среде, чтобы избежать нарушения мембраны.
- Поддержание культуры до 6 дней.
- В конце культуры, заморозить среднего и исправить или заморозить яичники после краткого стирки в PBS, как это требуется.
- Закрепить яичников в фиксаторе Буэна в течение 90 мин для гистологического анализа, или в 10% нейтральном забуференном формалине в течение 90 мин для иммуногистохимического анализа. Привязать заморозить яичники путем размещения ткани вполипропиленовую трубку, поместив трубку в сухом льду в течение 5-10 мин перед замораживанием при -70 ° С для последующего извлечения белка или мРНК.
4. Фолликулостимулирующий Вскрытие и культура
- Cull 19-23 день самкам мышей и изолировать яичники. Смочите шерсть с 70% этанола до внесения каких-либо разрезов. Ущипнуть кожу с помощью тупыми щипцами и сделать большой разрез в брюшной полости с рассечение ножницами, проникая через как кожи, так и стенки тела.
- Перемещение кишечник в сторону, используя тонкую набор рассечение инструментов и найдите матки. Последующие матку до яичника, который расположен ниже почек на каждой стороне.
- Осторожно держа яичник с помощью пары часовщика щипцов, разорвать привязанность яичников в матку с мелкими ножницы рассечение. Избегайте сбора слишком много яичников жировой ткани. Сбор яичники и передачи в эмбрион блюд, содержащих подогретого рассечение среды.
- Репереместить яичников Бурса, применяющих инсулин иглы Отрезать бурсы мешок и излишки материала, включая маточную трубу, пока только яичник не остается. Примерно вдвое каждом яичнике, применяющих инсулин иглы.
- Тщательно передачи каждом яичнике половину в отдельный часовым стеклом, содержащим 1 мл рассечение среды. Обложка каждого часового стекла с стекло для предотвращения испарения среды и обеспечения стерильности.
- Магазин часовые стекла, не содержащие яичников половинки в 37 ° C духовке до нужен, но выполнять следующий шаг рассечение как можно скорее. Отменить ткани хранится таким образом в течение более часа.
- Передача часы стекло, содержащее яичника половину 37 ° C этапе подогревом микроскопа в капюшоне ламинарного потока. Грубо рассекают яичника на крупные куски с помощью двух игл инсулина, с тем чтобы определить поздно предварительно антральных фолликулов в следующем: они содержат 2-3 слоев зернистых клеток и имеют диаметр около 180-200 мкм.
- Вручную рассекать из любого гdentified фолликулы с помощью одного инсулина иглу и один 30 х 0,25 мм акупунктуры иглы, которые были закреплены в держателе иглы. Быть осторожным, чтобы удалить большую часть окружающей стромы, но не повредить базальной пластинки фолликулов (см фиг.1В).
- Используйте мелко обращается изогнутые стеклянную пипетку, чтобы тщательно передачи расчлененные фолликулов в сборный часовым стеклом, содержащим подогретого рассечение среды. Будьте осторожны, чтобы сохранить фолликулы в разделе тонкой калибра пипетки, чтобы избежать потери фолликулов.
- Измерение фолликулов точно, используя калиброванный окуляр координатную сетку устанавливают в рассекает микроскопом.
- Выбор фолликулы для культуры только тогда, когда они измеряют 190 ± 10 мкм в диаметре. Далее выбираем только здоровые, сферических фолликулов в области культуры; они будут полупрозрачными, без темных атретических районах, а также иметь неповрежденную базальную пластинку, наряду с некоторыми прилагается дурального ткани: отказаться от любых фолликулы, которые не соответствуют этому описанию. Выход между 10-15 фолликулов в яичнике хорошо.
- Используйте мелко обращается изогнутым стеклом пипетки для передачи одного фолликула в лунку планшета составил, как и в шаге 2.3.3 выше. Осторожно поместите фолликул в нижней части скважины (не в верхнем слое масла). Культура в 37 ° C, 5% СО 2 инкубатора.
- Культура фолликулы до 6 дней, двигаясь фолликулов в лунку, содержащую свежую среду каждый день.
- Подготовьте следующую строку в 96-луночного планшета и в подготовке пластины на этапе 2.3.3 выше. Вернуться пластину инкубатора, по крайней мере час, чтобы уравновешивание. Трансфер фолликулов в свежие лунки среде, используя тонко нарисованный стеклянную пипетку.
- Если в любой момент в культуре фолликулы, чтобы быть оставлен в течение двух дней, прежде чем перейти в свежую среду, разместить каждый фолликул в минимальном количестве 60 мкл (вместо 30 мкл) капелек фолликул культуральной среде.
- Для сбора данных по росту фолликулов, измерения фолликулы ежедневно, используя еуepiece сетка установлена в рассекает микроскопом. Масляный слой будет искажать измерения диаметра фолликулов, так отработать калибровочный коэффициент для настройки.
- В конце культуры, заморозить среднего и исправить или заморозить ткани для последующего анализа, а на этапе 3,10 выше.
- Фолликулостимулирующий фолликул Co-культура.
- Культура два фолликула вместе, чтобы исследовать взаимодействие между фолликулов. Культура, как указано выше, но разместить два фолликула бок-о-бок, в контакте, в хорошо.
- Поместите 100 мкл капель фолликула культуральной среды в каждую лунку в культуре ткани, не обрабатывают 96-луночных микротитрационных плоский-луночного планшета, наложение среду с 100 мкл стерилизованной силиконового масла. Не передать фолликулов в свежие лунки, как в шаге 4,13 выше, но вместо этого использовать наконечник тонкой гель изменить 50% среды каждый день.
- Для того чтобы определить происхождение тканей в пределах совместного культивирования, совместное культивирование фолликулов друг от другого генетического источника, например, Oпе из яичника дикого типа мыши, и другой из яичника мыши с вездесущей выражения GFP. При использовании GFP или YFP ткани, свести к минимуму воздействие на ткани, чтобы зажечь как можно больше, во время культивирования, и через ряд шагов, фиксация / обработки в дальнейшем.
ПРИМЕЧАНИЕ: Это нормально для двух фолликулы расти вместе в один "два фолликула" блока (рис 1в).
5. фолликул яичника сокультурах
- Проанализируйте яичников и фолликулов, как в разделах 3 и 4 выше.
- Разместите один новорожденных яичник на вершине мембраны, в тарелке, полученного, как в шаге 2.4.2 выше. Осторожно поместите один фолликул в контакте с одним полюсом новорожденных яичника, используя тонко нарисованный изогнутую стеклянную пипетку. Культура в 37 ° C, 5% CO 2 инкубаторе в течение до 5 дней.
- Для того, чтобы различать ткани происхождения, в со-культуры, воспользуйтесь яичников и фолликулов из двух различных такurces, например один из мыши дикого типа, и один из мышей с повсеместной экспрессии GFP.
- Замените 500 мкл среды ежедневно, как в шаге 3,8 выше, но с использованием фолликул культуральной среде. В совместной культуре, фолликул часто становится инкапсулированы яичника (рис 1D).
- В конце культуры, заморозить среднего и исправить или заморозить ткани для последующего анализа, а на этапе 3,10 выше.
6. Фиксация, Иммуноцитохимия и изображений культивируемых тканей
- В конце культуры, мыть ткани в PBS и передачи 100 мкл (фолликул) или 1 мл (яичника) в 10% нейтральном формалине с буфером, и фиксации в течение 1 часа на льду. Перемещение по 3 промывками 1x PBS при 4 ° С.
- Для иммуногистохимии на фолликулов, переход между лунки микротитрационного круглым-луночный планшет в 96-луночный с помощью тонко обращается изогнутую стеклянную пипетку, с каждой лунке, содержащей различных промывок или лечения.
- Для иммуноцитохимии на OvariES (или яичника фолликул-со-культуры), вставлять в 4% -ном агарозном геле и раздел на 50 мкм с использованием vibrotome. Поплавок секции в лунки 24-луночного планшета для применения промывки или обработки, удаление с помощью пипетки.
- Для визуализации: передать агарозном разделы плоских стеклах и смонтировать с монтажной среды; или передачи фолликулы (или фолликул фолликула комплексы) в стеклах полости и крепление с неотвердевающей крепления среду. Образцы изображений с помощью конфокальной микроскопии.
Результаты
На рисунке 1 показана изображения яичников и фолликулов в начале и в ходе процедур культуры.
Рисунок 2 показывает репрезентативные результаты новорожденных яичников (здесь, яичников новорожденных щенков), находящегося репродуктивных токсикантов в процессе культивирования. Неонатальные яичников культивировали в течение 6 дней, и подвергают воздействию химиотерапии препарата, либо цисплатин или доксорубицин, на 2-й день культуры. В конце культуры, яичников были зафиксированы, обработаны для гистологического и яичников затем исследовали, чтобы определить число здоровых и нездоровых овариальных фолликулов 4. С другой стороны, в более быстром оценка ранних растущих фолликулов может быть получено из культуры яичников фрагментов, используя яичники от мыши, экспрессирующие ооцита конкретных флуоресцентный маркер 10.
Во время культивирования отдельных фолликулов, рост фолликула может быть легко установлено путем ежедневных измерений во время кульПериод ра. Рисунок 3 показывает репрезентативные результаты роста фолликулов, культивированных в присутствии или отсутствии гонадотропин гормонов фолликулостимулирующего гормона (ФСГ) и лютеинизирующий гормон (ЛГ) 5.
Фолликулостимулирующий фолликул или фолликулостимулирующего яичников совместно культуры могут быть использованы для изучения взаимодействия между фолликулов. В зависимости от ткани и обработки изображения может быть получено с использованием светлого поля, флуоресценции или конфокальной микроскопы. Рисунок 4 показывает репрезентативные результаты изображений из таких совместных культурах, рассматривая различные типы клеток, участвующих в фолликулостимулирующего фолликула связи, в том числе эндотелиальных и нейронных клеток 7.
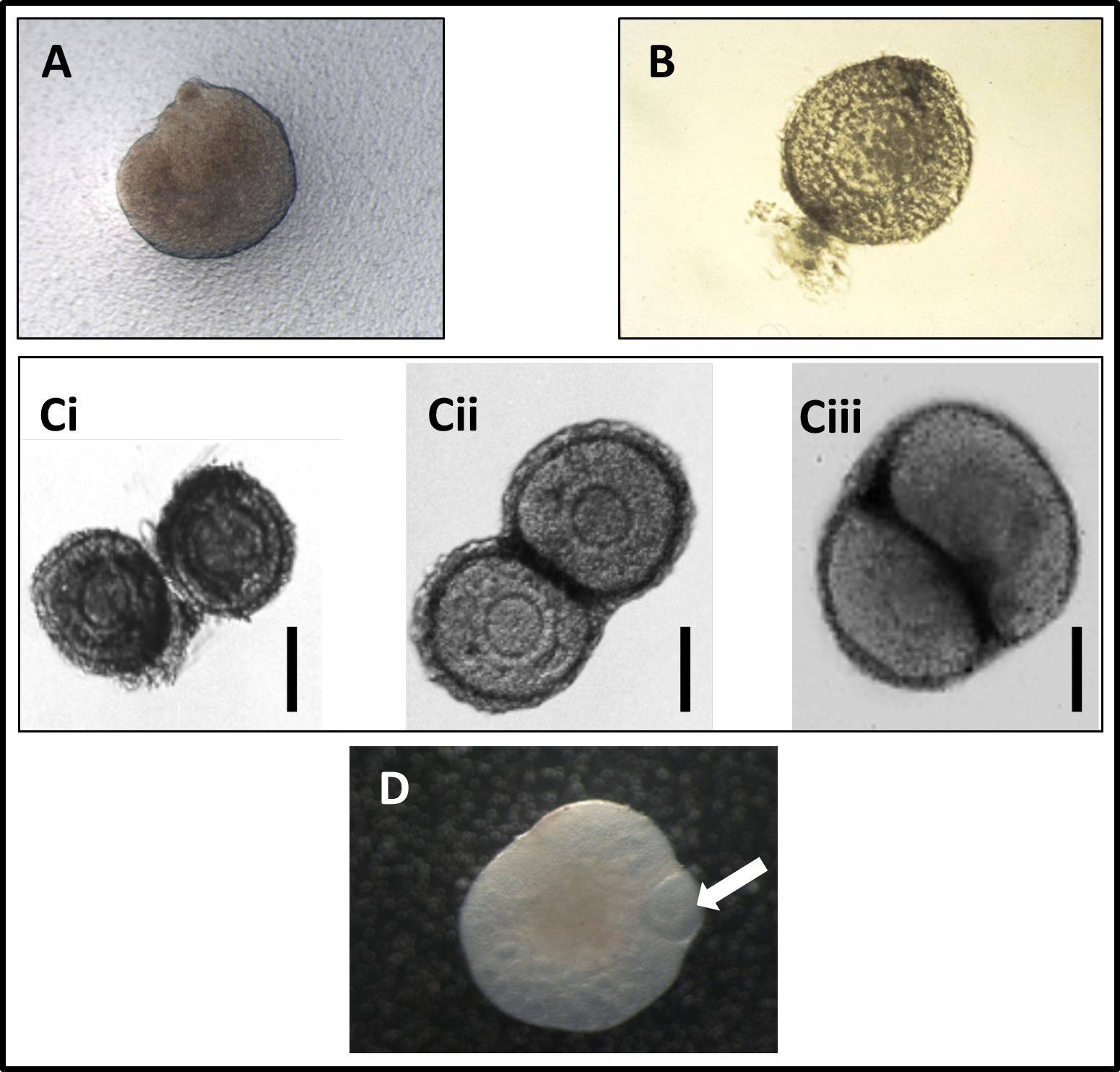
Рисунок 1: (А) Микрофотография новорожденных яичника, полученного от мыши в день рождения, помещен на поликарбонатную мембрану. (B) Микрофотография недавно расчлененный здоровый фолликула яичника, причем большинство из окружающего стромы ткани отсечен. (C) Микрофотографии совместного культивирования двух фолликулов яичников в течение первых трех дней культуры, показывающие тесную связь, которая возникает между двумя фолликулов, как культура выручки (ДИ: первый день культуры; CII: второй день культуры; C-III : третий день культуры). Воспроизводится по Спирс и др. 11 (D) Микрофотография со-культурный preantral фолликула и новорожденных яичника после двух дней культуры. Изображение показывает фолликул становится заключено в яичнике. Стрелка показывает preantral фолликул. Изображение от Доктора Федерика Лопес. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
цифра 2 "SRC =" / файлы / ftp_upload / 52458 / 52458fig2.jpg "/>
Рисунок 2: Влияние химиотерапии препаратами цисплатин и доксорубицин на новорожденных культивируемых яичников цисплатин и доксорубицин оба ведут к потере здоровья фолликула и сокращение численности фолликула.. () Цисплатин; (B) Доксорубицин: (я) Процент нездоровых фолликулов (CLEAR); и (II) Общее количество фолликулов (заштрихованы) в каждом яичнике. Бары обозначения означает + сем; N = 5 для всех групп, звезды обозначают существенные различия по сравнению с контролем (* р <0,05, ** р <0,01, *** р <0,001). Воспроизводится по Моргана и др. 4
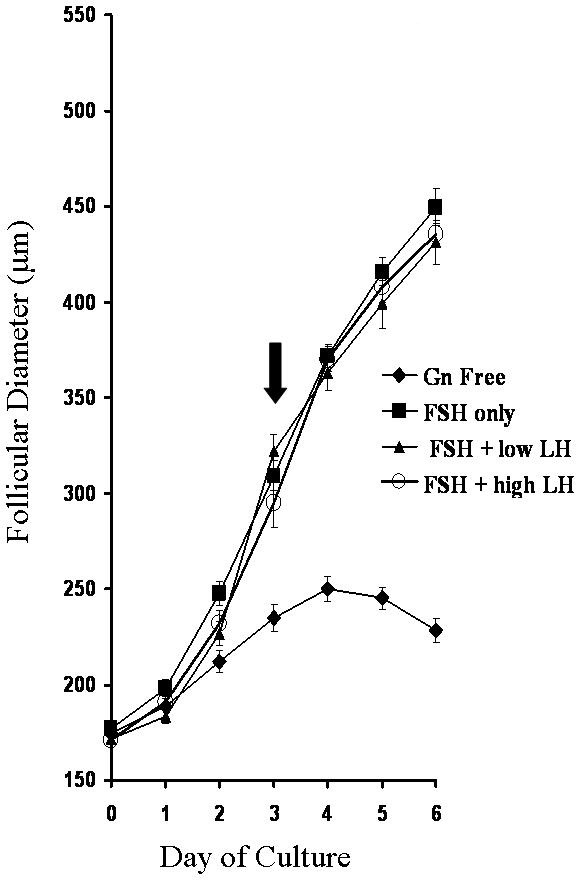
Рисунок 3:. Темпы роста фолликулов, подвергшихся воздействию различных гонадотропина условиях приведены средние значения ± SEM (п ≥16 для каждой группы). Стрелка указывает на начало ANTRAформирование л во всех гонадотропин групп. Воспроизводится с Мюррей и др. 5
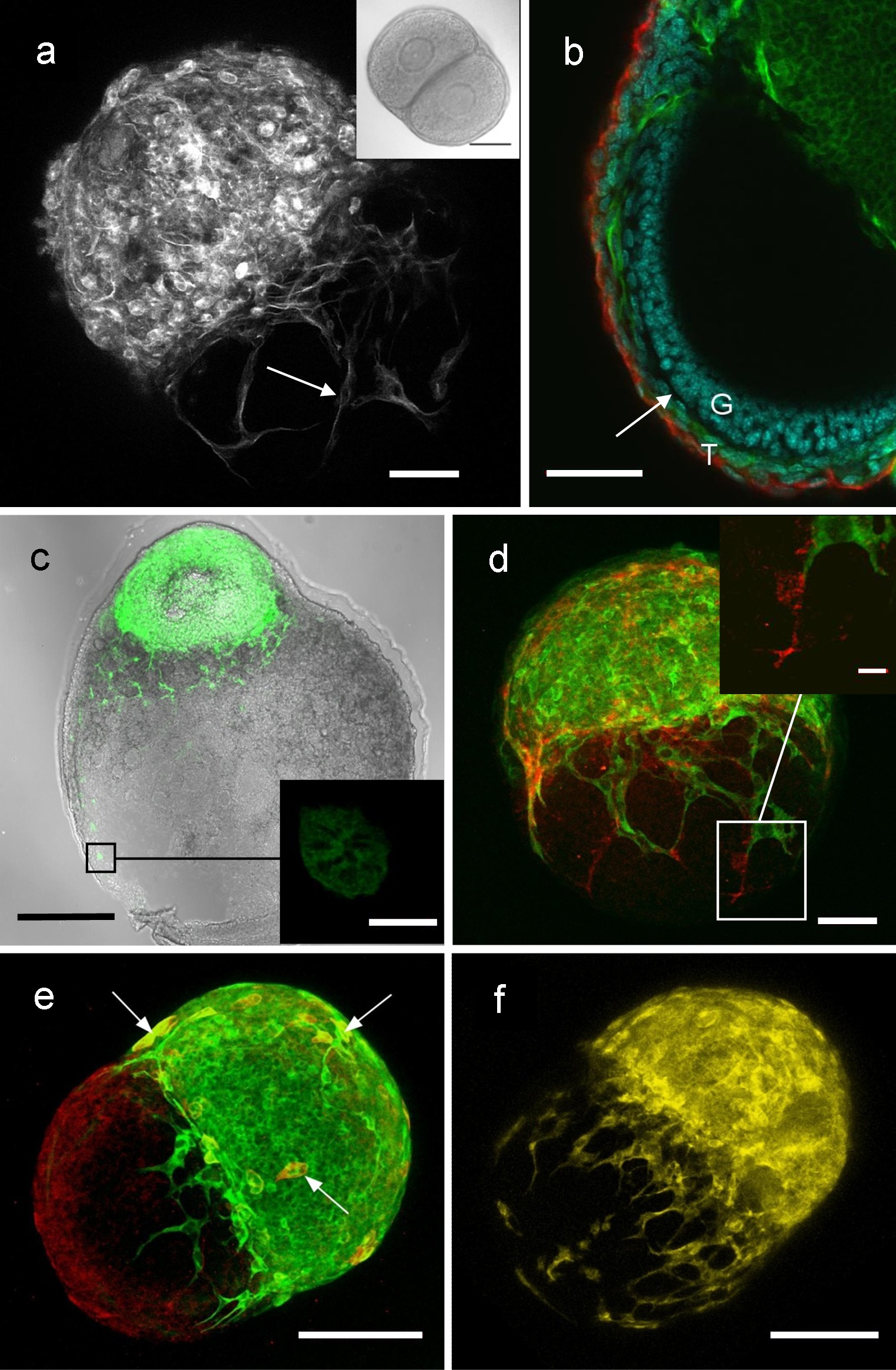
Рисунок 4: Изображения из фолликулостимулирующего фолликула и яичников фолликул-со-культур, показывающие фолликулостимулирующего фолликула взаимодействия (А) конфокальной микроскопический снимок зеленого флуоресцентного белка (GFP), фолликулостимулирующего и дикого типа (WT) фолликула после совместного культивирования (. GFP выражение показано здесь в белом), с процессами из GFP фолликула показаны проходящими над фолликула WT. (В) Сечение через GFP / фолликула комплекса WT после совместного культуры, показывая, что GFP процессов (зеленые) от прилегающей фолликулов лежат прилегающей к базальной пластинки фолликула мас. (C) новорожденных WT яичников после культуру с предварительно антральных GFP-экспрессирующих фолликул, показывая, что GFP клетки и клеточные процессы (зеленый) мигрироваличерез яичников interstitum неонатального яичника. (D) GFP / фолликула комплекс WT, содержащий эндотелиальные клетки, показанные выражения эндотелиальных клеток маркера CD31 (красный). (E) GFP / фолликула комплекс WT, содержащий нервных клеток, показанные выражения нейронального маркера бета тубулина III (см здесь как красный, или в виде желтого если дважды помечены GFP, зеленый). Фолликул комплекс (F) YFP / WT, где YFP относится к фолликул от мыши Thy1-YFP, который имеет случайный экспрессии желтого флуоресцентного белка (YFP: желтый) в подмножестве нервных клеток 9, показывают, что нейроны проходят от фолликула YFP. Бары 50 мкм (А, В, D), 100 мкм (С, Е, F), 100 мкм (вставка в A), 10 мкм (вставка в C), 15 мкм (вставка в D). Воспроизводится с Кэмпбелл и др. 7 Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого Fiфигура.
Обсуждение
Мы описываем здесь различные системы культуры, которые могут быть использованы для поддержки развития мыши фолликулов яичников в пробирке, используя целые новорожденных яичники, содержащие только самые ранние этапы фолликула, индивидуальные preantral фолликулов, а также со-культур двух тканей.
Культура новорожденных яичников мыши выступает за скорейшее развития яичников, особенно фолликула начало роста до второй стадии фолликула. Диапазон возрасте от новорожденных мышей могут быть использованы для этих культур, в зависимости от стадии развития, представляющих интерес. Если яичники получают из новорожденных мышей, формирование фолликула будет на ходу, но еще не завершен: культура, по крайней мере частично поддерживает формирование постоянного фолликула с последующим ростом фолликула. Кроме того, использование яичников мышей вокруг четырех до пяти дней возраста (с помощью которых формирование время фолликул уже завершена) результаты в культуре большего числа изначальной и растущей FOLLICles 12. Полезные аспекты конкретного метода, описанного здесь, включают в себя использование плавающей поликарбонатные мембраны, которые позволяют более оксигенации ткани, и культуру в очень щелочной среде, состоящей из единственного αMEM и BSA, избегая использования неопределенных добавок, таких как сыворотка. Культура всей яичников, кажется, не для поддержки развития за пределами вторичной стадии фолликула, с последующим развитием требующие изменения в технике, например, рассечение фолликул-клеток гранулезы комплексов из культуральной новорожденных яичника 1.
На более поздних стадиях развития фолликула могут быть разработаны в пробирке путем вскрытия индивидуальные, нетронутых поздно предварительно антральных фолликулов, которые могут быть выращены в преовуляторного этапе в культуре, сохраняя их трехмерную структуру. Использование интактных фолликулов по этой методике культуральной поддерживает связь между различными фолликулярных компонентов, как это происходит в естественных условиях. Тхис системой культуры могут быть использованы для получения ооцитов, которые могут поддерживать оплодотворение и последующее развитие эмбрионов.
Оплодотворению ооциты могут быть также получены из мышиного новорожденных яичников с использованием первоначальной протокол много, как описано здесь, культуру, за которым следует второй этап, во время которого ооцит-клеток гранулезы комплексы, выращенные в пробирке 1. Другие системы, используемые в настоящее время довольно часто включают в себя культуру фолликулов яичника или ткани, который был инкапсулированных в материал, такой как альгинат гидрогель, чтобы обеспечить поддержку (см, например, Tagler др. 13). Большая часть внимания разработке метода состоит в повышении методы культуры в яичниках и фолликулов крупных млекопитающих, с долгосрочной целью получения fertilisable ооцитов из примордиальных фолликулов от ряда видов, включая человека.
В любой момент времени, яичников млекопитающих содержат фолликулы в диапазоне стадиях развития, с interactioнс между фолликулов, влияющих на их регулирования. Этот аспект функции яичников плохо понимают и трудно изучить в естественных условиях. Последний метод, описанный здесь использует систему взаимоотношений культуры, чтобы поддержать развитие различных этапах фолликулов в пробирке. При необходимости, один или оба ткани могут быть предварительно обработаны в естественных условиях или в пробирке до совместного культивирования. Сотрудничество культуры системы, такие как это обеспечить идеальный способ, в котором для изучения фолликула фолликула взаимодействия, например, как растет, антральных фолликулов влияет на изначальную фолликула бассейн, аспекты яичников биологии, которые оказались трудно не рассмотреть до сих пор.
Целые яичников методы культуры довольно просты, хотя при внимательном рассечение требуется, чтобы избежать случайных повреждений тканей. Вскрытие отдельных фолликулов специализированная техника, требующая повторной практики, прежде чем фолликулы в нужное стадии можно разрезать из яичника не повреждена. Очень важно,чтобы рассекать из отдельных фолликулов с осторожностью, или ущерб, понесенный во время протокола вскрытия может привести к фолликула смерти во время последующего периода культивирования. Там, где фолликулы расположены непосредственно в лунку микротитрационных планшетах, важно использовать только без тканевой культуры обработанных пластмасс, чтобы свести к минимуму нанесение вниз гнойный клеток на пластике: при использовании культуры ткани обрабатывают Пластик, фолликулы будет приложить к База скважины и разрыв, как они растут. Для всех со-культуры работы, ткани должны быть расположены в непосредственном контакте друг с другом.
Среду описано выше для использования в технике культивировани фолликулов включает добавление мышиной сыворотки. Можно заменить сыворотки мыши с эмбриональной бычьей сыворотки, но только случайные партии такой сыворотки будет полностью поддерживать развитие фолликула в преовуляторного стадии, с пакетной проверки необходимо определить подходящие источники. Batch-тестирование ФСГ Кроме того, целесообразно, как Международный UniTS, с помощью которого ФСГ оценивается коррелируют только грубо роста фолликулов в пробирке. Если разрыв фолликула обычно происходит во время периода культивирования, рассмотреть вопрос о замене акции аскорбиновую кислоту с новой партией.
Методы не требуют специального оборудования, особенно, кроме рассекающих микроскопов и тканевой культуры инкубаторов, хотя использование колпака с ламинарным потоком и хорошей стерильных позволить фолликулы, чтобы культивировать в отсутствие антибиотиков, как в способах, описанных здесь. Это может быть полезно, чтобы избежать возможной отрицательное влияние антибиотиков на ооциты, в особенности, если они будут оплодотворены после культуры. Там, где это не возможно, чтобы работать в стерильной среде, желательно добавлять антибиотики, чтобы рассечение и питательных сред.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Work was funded by MRC grant G1002118.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of the Material/Equipment | Company | Catalog Number | Comments/Description |
| Leibowitz L15 | Invitrogen | 11415049 | |
| αMEM | Invitrogen | 22571020 | Supplied as sodium bicarbonate buffered (2200 mg/L) |
| Bovine serum albumin | Sigma Aldrich | A9418 | For dissection medium |
| Bovine serum albumin | Sigma Aldrich | A3311 | For culture medium |
| Bovine serum albumin | Sigma Aldrich | A2153 | For coating glass pipettes |
| Mouse serum | - | - | Collected from cardiac puncture |
| FSH | Merck Serono | Gonal F | Batch testing is often necessary. Make up stock solution of 1IU/10µl in αMEM and store at -20°C. |
| Ascorbic acid | Sigma Aldrich | A4034 | Make up stock of 5mg/ml in αMEM and store at -20°C. |
| Silicon oil | VWR | 630064V | Dow Corning Silicone Fluid 200/50cS |
| Syringe filters (25mm, 0.2µm) | Greiner | 16532K | Cellulose acetate filter: for filtering larger (> 5mls) volumes of medium. |
| Syringe filters (13mm, 0.2µm) | Iwaki | 3032-013 | Cellulose acetate filter: for filtering smaller (< 5mls) volumes of medium |
| Syringe filters (25mm, 0.45µm) | Iwaki | 2053-025 | Cellulose acetate filter: for filtering oil. |
| Sterile tubes | Greiner | 187261 | |
| 24 well plate | Greiner | 662160 | |
| 96 well round bottom plate | Iwaki | 3875-096 | Use only non-tissue culture treated plates |
| 96 well flat bottomed well | Iwaki | 3860-096 | Use only non-tissue culture treated plates |
| Whatman nucleopore membranes | Camlab | WN/110414 | Use shiny surface up, polycarbonate, 13mm diameter, 8.0µm pore size |
| Insulin needles | BD medical supplies | 037-7606 | 0.33mm (29G) +1ml |
| Glass embryo dishes | VWR | 720-0579 | Sterilise then warm before use |
| Glass pipettes | Fisher Scientific | 10209381 | BSA coated before use |
| Gel tips | AlphaLabs | LW1103 | |
| Acupuncture needles | Acumedic LTD | 30mmx0.25 Type C | |
| Bouin’s fixative | Sigma Aldrich | HT10132-1L | |
| Formalin solution, neutral buffered, 10% | Sigma Aldrich | HT5014-120ml | |
| 1.5 ml polypropylene tubes | Greiner BioOne | 616201 |
Ссылки
- Brien, M. J., Pendola, F. L., Eppig, J. J. A revised protocol for in vitro development of mouse oocytes from primordial follicles dramatically improves their developmental competence. Biol. Reprod. 68 (5), 1682-1686 (2003).
- Fortune, J. E., Yang, M. Y., Muruvi, W. The earliest stages of follicle development: follicle formation and activation. Soc. Reprod. Fertil. Suppl. 67, 203-216 (2010).
- McLaughlin, M., Kinnell, H. L., Anderson, R. A., Telfer, E. E. Inhibition of phosphatase and tensin homologue (PTEN) in human ovary in vitro results in increased activation of primordial follicles but compromises development of growing follicles. Mol. Hum. Reprod. 20 (8), 736-744 (2014).
- Morgan, S., Lopes, F., Gourley, C., Anderson, R. A., Spears, N. Cisplatin and doxorubicin induce distinct mechanisms of ovarian follicle loss; imatinib provides selective protection only against cisplatin. PLoS One. 8 (7), e70117 (2013).
- Murray, A. A., et al. Follicular growth and oocyte competence in the in vitro cultured mouse follicle: effects of gonadotrophins and steroids. Mol Hum Reprod. 14 (2), 75-83 (2008).
- Baker, S. J., Srsen, V., Lapping, R., Spears, N. Combined effect of follicle-follicle interactions and declining follicle-stimulating hormone on murine follicle health in vitro. Biol. Reprod. 65 (4), 1304-1310 (2001).
- Campbell, L., Trendell, J., Spears, N. Identification of cells migrating from the thecal layer of ovarian follicles. Cell Tissue Res. 353 (1), 189-194 (2013).
- Pratt, T., Sharp, L., Nichols, J., Price, D. J., Mason, J. O. Embryonic stem cells and transgenic mice ubiquitously expressing a tau-tagged green fluorescent protein. Dev. Biol. 228 (1), 19-28 (2000).
- Feng, G., et al. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-51 (2000).
- Maiani, E., et al. Reply to: cisplatin-induced primordial follicle oocyte killing and loss of fertility are not prevented by imatinib. Nat. Med. 18 (8), 1172-1174 (2012).
- Spears, N., Bruin, d. r., Gosden, J. P., G, R. The establishment of follicular dominance in co-cultured mouse ovarian follicles. J. Reprod. Fertil. 106 (1), 1-6 (1996).
- Desmeules, P., Devine, P. J. Characterizing the ovotoxicity of cyclophosphamide metabolites on cultured mouse ovaries. Toxicol. Sc. 90 (2), 500-509 (2006).
- Tagler, D., et al. Promoting extracellular matrix remodelling via ascorbic acid enhances the survival of primary ovarian follicles encapsulated in alginate hydrogels. Biotechnol. Bioeng. 111 (7), 1417-1429 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены