Method Article
Mass spectrometric גישות לחקר מבנה חלבון ואינטראקציות באבקות Lyophilized
* These authors contributed equally
In This Article
Summary
Here, we present detailed protocols for solid-state amide hydrogen/deuterium exchange mass spectrometry (ssHDX-MS) and solid-state photolytic labeling mass spectrometry (ssPL-MS) for proteins in solid powders. The methods provide high-resolution information on protein conformation and interactions in the amorphous solid-state, which may be useful in formulation design.
Abstract
מימן אמיד / החלפת דאוטריום (ssHDX-MS) ותיוג photolytic צד שרשרת (ssPL-MS) ואחריו ניתוח ספקטרומטריה יכולים להיות בעל ערך לאפיון הניסוחים lyophilized של תרופות חלבון. תיוג ואחרי עיכול מפרקי חלבונים מתאים מאפשר מבנה החלבון והאינטראקציות להיות ממופים עם רזולוציה ברמה-peptide. מאז חלבון אלמנטים מבניים התייצבו על ידי רשת של קשרים כימיים מהראשיות-הרשתות וצד-שרשרות של חומצות אמינו, תיוג ספציפי של אטומים בשאריות חומצת אמינו מספק תובנה המבנה והמבנה של החלבון. בניגוד לשיטות שגרתיות משמשות ללמוד חלבונים במוצקים lyophilized (למשל, FTIR), ssHDX-MS וssPL-MS לספק מידע כמותי וספציפי לאתר. התאגדות דאוטריום ופרמטרים הקינטית המידה יכולה להיות קשורה במהירות ובאיטיות להחלפת בריכות אמיד (מהיר N, N איטי) וישירות משקף את מעלותרי של קיפול חלבונים ומבנה בניסוחי lyophilized. תיוג photolytic יציב אינו עובר בחזרה לבורסה, יתרון על פני ssHDX-MS. כאן, אנו מספקים פרוטוקולים מפורטים לשני ssHDX-MS וssPL-MS, באמצעות מיוגלובין (Mb) כחלבון מודל בניסוחי lyophilized המכילים גם trehalose או סורביטול.
Introduction
תרופות חלבון הן המגזר בעל הצמיחה המהירה ביותר של תעשיית הביו-פרמצבטיקה ומציעות טיפולים חדשים ומבטיחים לטיפול במחלות סוררות בעבר, כוללים הפרעות הורמונליות, סרטן ומחלות אוטואימוניות 1. בשינה 2012, שוק biotherapeutics העולמי הגיע 138,000,000,000 $ והוא צפוי להגיע 179,000,000,000 $ על ידי השינה 2018 2. החלבונים הם גדולים יותר ושבירים יותר מתרופות מולקולה קטנה קונבנציונליות ולכן הם רגישים יותר לסוגים רבים של השפלה 3. כדי להבטיח חיי מדף ויציבות נאותים, תרופות חלבון לעתים קרובות כפי שנוסחו lyophilized (כלומר, מיובש בהקפאה) אבקות מוצקות. עם זאת, חלבון, עדיין עשוי לעבור השפלה במצב המוצק, במיוחד אם המבנה המקורי שלו לא נשמר במהלך 4,5 תהליך lyophilization. הבטחת המבנה שנשמר היא אפשרית רק אם יש שיטות אנליטיות שיכולה לחקור קונפורמציה חלבון במצב המוצק עם sufficienהרזולוציה t.
ספקטרוסקופיה NMR 6 וקריסטלוגרפיה רנטגן 7 הן שיטות הרזולוציה גבוהה הנפוצה המשמשות להערכת מבנה חלבון במוצקים גבישיים ופתרון 8. בגלל האופי של חומרים בלתי פעיל ושיטות העיבוד משמשות, ניסוחים חלבון lyophilized הם בדרך כלל אמורפי ולא גבישים 9. חוסר האחידות וסדר מיקרוסקופי הופך את הטכניקות שהוזכרו לעיל מעשיים עבור חלבונים במוצקים אמורפיים. ספקטרוסקופיית פורה (FTIR) 10, ספקטרוסקופיית ראמאן 11 וספקטרוסקופיה אינפרא אדום הקרובה (NIR) 12 היו בשימוש באופן קבוע על ידי תעשיית הביו-פרמצבטיקה להשוות מבנה שניוני באבקות lyophilized לזה של המבנה-פתרון של המדינה האם. עם זאת, שיטות אלה הן ברזולוציה נמוכה, ורק יכולות לספק מידע על שינויים הגלובליים במבנה משני. אפיון מבני של מצב מוצק באמצעות FTIRהראה גם 13,14 החלש או מתאם 15 עני עם יציבות אחסון לטווח ארוך. מגבלות אלו מדגישות את הצורך בשיטות ברזולוציה גבוהה מתאימות לזהות הפרעות מבניות של חלבונים במצב המוצק.
תיוג כימי יחד עם proteolysis וניתוח ספקטרומטריה התפתח גישה רבת עוצמה לניטור מבנה חלבון ואינטראקציות מולקולריות בתמיסה מימית. בפיתוח תרופות, HDX-MS שמש במשך מיפוי epitope באינטראקציות אנטיגן-נוגדן 16,17, כדי למפות אינטראקציות קולט סמים 18, כדי לפקח על ההשפעות של שינויים, שלאחר translational בקונפורמציה של תרופות חלבון 19, וכדי להשוות וריאציה אצווה לתצווה בפיתוח biosimilars 20. באופן דומה, ligands photoactivatable כבר משמש לזיהוי מטרות תרופה ולקבוע זיקה וספציפיות של תגובות בין תרופתי קולט 21,22 מחייבת. לדוארספקטרומטריית Xtend היישום של שיטות אלה לניסוחי lyophilized, הקבוצה שלנו פיתחה מצב מוצק המוני חילופי דאוטריום המימן (ssHDX-MS) וספקטרומטר מסת תיוג photolytic מצב מוצק (ssPL-MS) ללמוד תצורות חלבון ואינטראקציות חומר לא פעילות בדגימות lyophilized עם רזולוציה גבוהה.
בשני ssHDX-MS וssPL-MS, החלבון מתויג תחת תנאי תגובה אידיאליים במוצקים lyophilized, ולאחר מכן הדגימות מחדש ונותחו על ידי ספקטרומטריית מסה עם או בלי עיכול מפרקי חלבונים. ssHDX-MS מספק מידע על חשיפת שרשרת העיקרית לאדי דאוטריום, בעוד ssPL-MS מספק מידע על הסביבה של רשתות בצד (איור 1). שתי שיטות ובכך יכולות לספק מידע משלים לגבי קונפורמציה חלבון במצב המוצק. כאן, אנו מספקים פרוטוקול כללי ללימוד חלבונים במוצקים lyophilized באמצעות ssHDX-MS וssPL-MS (איור 2), תוך שימוש בMb כחלבון מודל. אנחנו מראים את היכולת של שתי שיטות ללהבחין בהבדלים בניסוחים עם שני חומרים בלתי פעילים שונים.
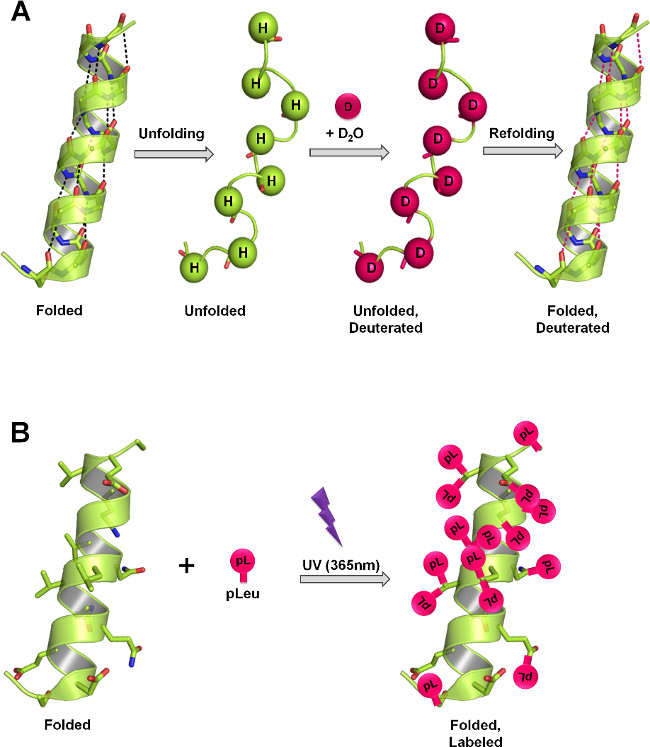
איור 1:. מבנה חלבון מידת ssHDX וssPL במוצקים lyophilized באמצעות מנגנוני תיוג שונים (א) בHDX, אמיד עמוד השדרה מימנים חליפין עם דאוטריום כפונקציה של מבנה החלבון ו- D 2 O נגישות. במצב המוצק, השיעור ומטבע זר דאוטריום המידה תלויה ברמה של D 2 O וספיחה, ניידות חלבון (התגלגלות וקפל שוב את האירועים) והטבע של החומרים לא הפעילים קיימים במטריצה המוצקה. (ב) בPL, קרינת UV ב365 ננומטר יוזם את הקמתה של קרבן תגובת ביניים מהקבוצה הפונקציונלית diazirine של pLeu והוכנס אינו ספציפי לכל אג"ח XH (x = כל אטום) או, מודעהטוליפ אין על פני אג"ח = C C בסביבתו הקרובה. במצב המוצק, השיעור ושל תיוג המידה תלויה בריכוז המקומי סוכן התיוג של, זמן הקרנה, מבנה חלבון והטבע של חומרים לא פעילים קיימים במטריצה המוצקה. לוחות A ו- B להראות התיוג התיאורטי המרבי שיכול להתרחש על עמוד השדרה וצד-רשתות בהתאמה בחלבון.
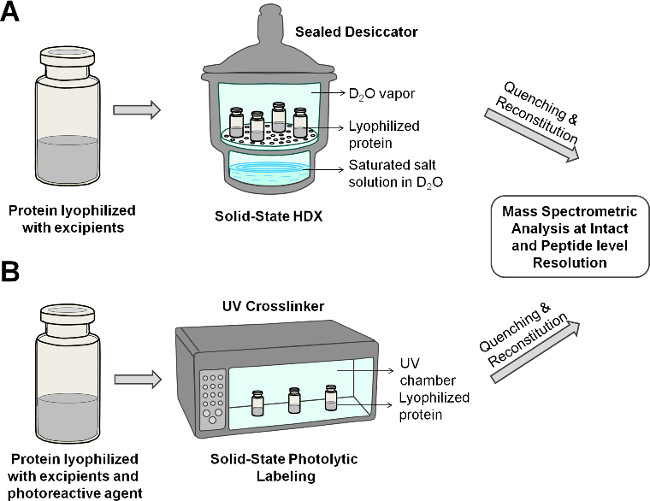
איור 2: מצב מוצק מראה סכמטי HDX-MS () וPL-MS (B) לחלבון בניסוח lyophilized.
Protocol
1. לדוגמא הכנה וlyophilization
- Dialyze הנפח הנדרש של מניות פתרון Mb נגד חיץ ומסנן מתאים דרך פילטר סטרילי 0.22 מיקרומטר.
- הכן את הנפח הנדרש של חומרים בלתי פעיל ותמונה-לאוצין (חומצת L-2-אמינו-4,4-עזי-pentanoic; pLeu) פתרונות מניות במאגר מתאים. סנן את מניית הפתרונות דרך פילטר סטרילי 0.22 מיקרומטר.
- הכן ניסוחים כפי שמוצג בטבלה 1 באמצעות מניות הפתרונות של חלבון, חומרים בלתי פעיל, pLeu, וחיץ.
- דגימות סינון דרך מסנן סטרילי 0.22 מיקרומטר כדי להסיר כל חלקיקים שנוצרו בשלב 1.3. מלא את הדגימות בנפרד כ0.2 מיליליטר לתוך צלוחיות זכוכית 2 מיליליטר. השתמש בבקבוקוני זכוכית שהם שקופים לקרינת UV (365 ננומטר) אור כדי להפעיל pLeu במחקרי ssPL-MS.
- בקבוקוני עומס בlyophilizer וליזום lyophilization על ידי עיצוב מחזור lyophilization מתאים.
- כאן, להקפיא דגימות ב -40 מעלות צלזיוס, ואחריועל ידי ייבוש ראשוני תחת ואקום (70 mTorr) בשעה C ° -35 לשעה 12 וייבוש המשני של 25 מעלות צלזיוס במשך שעה 12. אחר מחזורי lyophilization ושיטות ייבוש (למשל, ספריי ייבוש) עשוי לשמש גם.
- למילוי הבקבוקונים המכילים דגימות lyophilized עם חנקן לפני הסגירה.
| ניסוחים | הרכב (מ"ג / מיליליטר) לפני lyophilization | ||||
| Mb | Trehalose | סורביטול | ג pLeu | אשלגן, פוספט, pH 7.4 | |
| MBT | 1.7 | 3.4 | - | - | 0.4 |
| MBS | 1.7 | - | 3.4 | - | 0.4 |
| MBT + pLeu ב | 1.7 | 3.4 | - | 14.3 x 10 -3 ל1.43 | 0.4 |
| MBS + pLeu ב | 1.7 | - | 3.4 | 14.3 x 10 -3 ל1.43 | 0.4 |
טבלת 1:... הרכב של ניסוחים Mb lyophilized פורמולציות המשמשת למחקר ssHDX-MS פורמולציות ב משמשת למחקר ssPL-MS L-2-אמינו-4,4-azipentanoic חומצת ג או תמונה-לאוצין (pLeu). pLeu בחמישה ריכוזים שונים (14.3 x 10 -3 ל1.43 מ"ג / מיליליטר) המתאימים ל1x, 10x, 20x, 50x ו100x יחסי עודף טוחנת לMb היו שיתוף lyophilized עם ניסוחים MBT MBS ו.
2. ssHDX-MS לחלבון שלמים
- הוספת כמות שתרווה (~ 440 גר ') של K 2 CO 3-200 מיליליטר של D 2 O previously ממוקם בתא התחתון של ייבוש. לאטום את ייבוש האוויר חזק ולאפשר לו לאזן בשעה 5 מעלות צלזיוס עד לחות יציבה יחסית (RH) של ~ הוא הגיע 43%. ניתן להשיג ערכי RH אחרים של עניין על ידי בחירת פתרונות מלח רווי שונים 23,24.
- ליזום תגובות ssHDX על ידי הצבת בקבוקונים הסירו את מכסה המכילים חלבון lyophilized בתא העליון של הייבוש. לאטום את ייבוש אוויר חזק ולדגור על 5 מעלות צלזיוס, כדי לאפשר HDX להתרחש (איור 2 א).
- לאסוף דגימות ssHDX בזמנים שונים בשלושה עותקים. על הניסוחים Mb, לאסוף דגימות בתשע נקודות זמן 1, 2, 4, 8, 16, 32, 56, 92 ו -144 שעות.
- מכסה את הבקבוקונים מייד לאחר הנסיגה מהייבוש ולהרוות את תגובות הבזק על ידי הקפאת הבקבוקונים בחנקן נוזלי. בקבוקוני חנות ב -80 ° C עד ניתוח ספקטרומטריה.
- ניתוח דגימות באמצעות spectrom כרומטוגרפיה נוזלית-מסה ברזולוציה גבוהה מתאיםשיטת etry (LC-MS). עיצוב או לרכוש מערכת LC קירור מתאימה כדי למזער בחזרה לבורסה במהלך ניתוח מדגם. השתמש בהגדרה של יחידת קירור טור ושיטת LC-MS דיווחה 25 בעבר.
הערה: מאחר ששער חליפין פרוטון אמיד תלוי בpH וטמפרטורה, deuterons התאגד בחלבון יכול להחליף עם הווה מימן בשלב הנייד ("תמורה בחזרה"), וגרם לאובדן של מידע. למרות pH חומצי (pH 2.5) של חיץ להרוות וממסים HPLC יכול למזער בחזרה לבורסה, במידה רבה, הפחתת הטמפרטורה (≤0 ° C) באמצעות מערכת קירור העמודה מתאימה נוסף יכול להגן על החלבון מן חזרה לבורסה . - חבר את לולאת המדגם ומלכודת חלבון לשסתום ששולט באופן אוטומטי את תהליך desalting וelution. כייל את ספקטרומטר המסה על ידי הזרקת תערובת כוונון ריכוז הנמוך TOF לספקטרומטר המסה בטווח מ '/ z של 200-3,200. משותקטור פפסין וטור אנליטי אינם נדרשים לניתוח חלבון שלם.
- הגדר את הטמפרטורה במערכת הקירור ל≤0 ° C ולהמתין למערכת להגיע לטמפרטורת הפעלה יציבה של ~ 0 ° C.
- מהירות העברת הדגימות מ-80 ° C לחנקן נוזלי לניתוח ספקטרומטריה. בעזרת מלקחיים, למשוך בזהירות כל בקבוקון מחנקן נוזלי ולגבש מחדש את המדגם על ידי הוספת נפח מסוים של חיץ להרוות קר כקרח המכיל 0.2% חומצה פורמית (FA) (pH 2.5) ומתנול 5% במים לבקבוקון.
- לתכנת HPLC מתאים ושיטת ספקטרומטר מסה באמצעות תוכנת השליטה. על הניסוחים Mb, מדגם desalt מכיל 20 pmol Mb במלכודת חלבון דקות 1.7 עם אצטוניטריל 5%, 95% מים וחומצה פורמית 0.1% (FA), וelute באמצעות שיפוע עלה ל אצטוניטריל 80%, 20% מים ו -0.1 % FA ב3.3 דקות. לאסוף ספקטרה ההמונית על פני הטווח מ '/ z 200-3,200.
- כדי לקבוע את המסה של שלםחלבון, לרכוש נתונים למדגם undeuterated חלבון (כלומר, חלבון לא נתון לssHDX) בתמיסה מימית בשיטה של שלב 2.9.
- השג את ההמונים של דגימות undeuterated וdeuterated ידי deconvoluting ספקטרום הגלם באמצעות תוכנת ניתוח נתונים. כאן, כדי לקבוע את טווח המסה ל15,000-18,000 Da, הרזולוציה ההמונית ל1.0 דא, וגובה השיא של 90% לחישוב המסה של Mb.
- לחשב את מספר deuterons התאגד בחלבון שלם (כאן, Mb) על ידי הפחתת המסה של חלבון undeuterated מהמסה של חלבון deuterated בכל נקודת זמן החלפה.
- לחשב את דאוטריום אחוזים הספיגה ביחס למקסימום התיאורטי באמצעות המשוואה הבאה (משוואה 1)
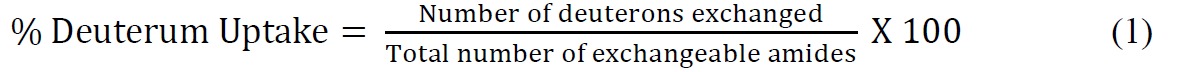
שבו מספר כולל של אורגניות חיבור להחלפה = מספר הכולל של חומצות אמינו - מספר שאריות פרולין - 2 ("2" חשבונות לN-קבוצת מסוף אמינו ומימן אמיד שעוברים בחזרה לבורסה מהירה). - להתאים את הנתונים הקינטית ssHDX באמצעות משוואה מעריכית מתאימה. משוואת biexponential (משוואה 2) היא בדרך כלל הפשוטה ביותר שנותן מענה סביר לנכון את נתוני ssHDX. במחקר זה, לMBT MBS ו, להתאים את הנתונים למודל biexponential אשר מקצה deuterons להחלפה "מהיר" ו- "איטי" בריכות.
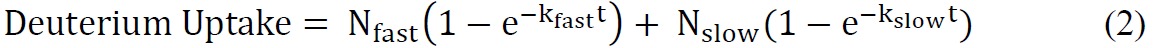
כאשר N מהיר ואיטי N הוא מספר אורגני חיבור להחלפה ב" מהיר "ו" איטי" החלפת בריכות, בהתאמה, וk מהיר ואיטי k הוא קבוע קצב מסדר הראשון קשור בשתי בריכות.
3. ssHDX-MS לחלבון בפפטיד הרמה
- בצע ssHDX על ידי ביצוע צעדים 2.1-2.8, בשינויים הבאים בשלב 2.6. חבר את col פפסין המשותקטור ה ועמודה אנליטיים לשסתום כפי שדווחו בעבר 25 ולהחליף את מלכודת החלבון מחוברת לשסתום עם מלכודת פפטיד. כייל את ספקטרומטר המסה על ידי קביעת המסה לחייב יחס הנע בין 100 ל -1700.
הערה: במהלך שלב הכינון מחדש (שלב 2.8), סוכן צמצום הסוכן וdenaturing יכול להיכלל במאגר להרוות כדי להקל על עיכול פפסין של חלבונים עם אג"ח דיסולפיד (למשל, נוגדנים חד-שבטיים). - לתכנת HPLC מתאים ושיטת ספקטרומטר מסה באמצעות תוכנת השליטה. על הניסוחים Mb, לעכל דגימות המכילות 20 pmol Mb מקוון עם פפטידים FA, מלכודת וdesalt 0.1% לדקות 1.7 עם אצטוניטריל 10%, 90% מים ו -0.1% FA במלכודת פפטיד. Elute הברים על הטור אנליטיים עם עלייה הדרגתית לאצטוניטריל 60%, 40% מים ו -0.1% FA ב 4.0 דקות. לרכוש ספקטרה ההמונית על פני הטווח מ '/ z 100-1,700.
- זהה את שברים פפטי על ידי ניתוח MS / MS שלמדגם חלבון undeuterated. השתמש בתוכנת ספקטרומטריית מסה כדי להשוות המונים ניסיוניים של יוני בר פפטיד להמונים החזויים של שברי פפטיד במסד נתונים מותאמים אישית. הגדר המוני נקודה (לדוגמא 10 עמודים לדקה) חתוכה לזהות המונים עם שגיאה נמוכה. לפפטידים מתאימים, להכין רשימה המורכבת מהרצף (i) פפטיד, (ii) המדינה אחראית, וכן (iii) זמן שמירה.
- השתמש ברשימה שנוצרה בשלב 3.3 כדי למפות ולקבוע את המספר הממוצע של deuterons המשולב עבור כל פפסין לעכל בר. זו יכולה להיות מושגת על ידי שימוש בתוכנת ניתוח נתונים מתאים HDX-MS 24.
- כדי לחשב את ספיגת דאוטריום אחוזים וכדי להתאים את הנתונים הקינטית ssHDX עבור כל אחד מהברים פפטי, בצע את הפעולות 2.13 ו2.14. במחקר זה, נתונים הקינטית HDX לכל אחד משישה פפסין אינו מיותר לעכל שברים מניסוחי MBT MBS והותאמו למודל biexponential עמותה (משוואה 2).
4. ssPL-MS Pro עבור שלמיםחלבון
- כדי להתחיל את תגובת photolytic תיוג, המתג ראשון בcrosslinker UV ולאפשר המנורות להתחמם במשך 5 דקות. ודא שמקור UV מצויד במנורות של אורך גל 365 ננומטר כדי להפעיל את קבוצת diazirine של pLeu.
זהירות: לעולם אל תפתח את הדלת של crosslinker UV כאשר המנורות דולקות. להגן על עיניים ועור כתוצאה מחשיפה לאור UV אם המקור אינו סגור על ידי דלת זכוכית UV-מגן. - כבה את crosslinker UV לפני שפתח את הדלת. ברגע שהמנורות כבויות, uncap הבקבוקונים המכילים את ניסוח lyophilized ולמקם אותם בתוך חדר crosslinker UV כפי שמוצג באיור 2. מקרין את הדגימות עם אור UV במשך 40 דקות.
- לבצע ניסויי שליטה על ידי ביצוע צעד 4.1-4.3 עבור דגימות (i) lyophilized ללא pLeu ומים (ii) דגימות lyophilized עם pLeu מחדש ב.
- כובע ולאחסן את הבקבוקונים ב -20 ° C עד לניתוח ספקטרומטריה.
- Reconstitאוטה דגימות מוצקות על ידי הוספת נפח מתאים של מים הכיתה ספקטרומטריית מסה מזוקקים כדי להביא את הריכוז 2 מיקרומטר.
- כדי להתחיל ניתוח מדגם, בצע את שלבי 2.6 ו -2.9.
הערה: מאחר בחזרה לבורסה היא לא בעיה עם תיוג קוולנטיים, ssPL-MS אינו דורש מערכת קירור מיוחדת LC. - כדי לקבוע את מסת יליד החלבון, לרכוש נתונים למדגם חלבון שלא היה נתון לssPL ידי ביצוע שלב 2.9. השג את ההמונים של דגימות ללא תווית ומסומנות על ידי deconvoluting ספקטרום הגלם כמוסבר בשלב 2.11.
- לחשב את מספר pLeu התאגד באמצעות הנוסחא הבאה:
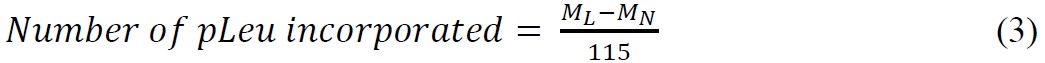
שבו L M הוא המסה של חלבון שכותרתו, M N הוא המסה של חלבון יליד ו -115 היא המסה הממוצעת (Da) הוסיף לחלבון היליד הבא התאגדות pLeu יחידה. שים לב שתגובת התיוג מתרחשת עם האובדן דואר של N 2 (28 Da). מסת monoisotopic של pLeu היא 143.07. - לחשב את האחוזים של אוכלוסיות חלבון עם מספרים שונים של תוויות באמצעות גבהים שיא מchromatograms היון שחולץ.

שבו "אני" מציין את מספר התוויות, PH אני מציין את גובה השיא עבור i L החלבון שכותרתו וPH u מציין את גובה השיא של החלבון ללא תווית כפי שנצפה על ידי ספקטרומטריית מסה.
5. ssPL-MS לחלבון ברמת פפטיד
- בצע ssPL על ידי ביצוע צעדים 4.1-4.4.
- לניתוח רמת פפטיד, מחדש דגימות מוצקות במאגר אמוניום ביקרבונט (100 מ"מ, pH 8.0).
- לאחר הכינון מחדש, לערבב את פתרון חלבון שכותרתו עם טריפסין בשעה 10: 1 יחס טוחנת של חלבון לטריפסין ולדגור על 60 מעלות צלזיוס למשך 16 שעות.
- להרוות את התגובה על ידי הוספת 0.1% FAבמים למדגם להניב ריכוז סופי עד 2 חלבון מיקרומטר.
- חבר את מדגם לולאה, מלכודת פפטיד ועמודה אנליטיים לשסתום הקשורים במערכת HPLC.
- לתכנת HPLC מתאים ושיטת ספקטרומטר מסה באמצעות תוכנת השליטה. על הניסוחים Mb, להזריק 20 pmol של החלבון מתעכל לתוך לולאת המדגם, וdesalt פפטידים במלכודת פפטיד דקות 1.5 עם אצטוניטריל 5%, 95% מים ו -0.1% FA, ואחריו elution בעמודה אנליטית עם שיפוע להגדיל ל -55% אצטוניטריל, 45% מים ו -0.1% FA ב -22 דק '. לאסוף ספקטרה ההמונית על פני הטווח מ '/ z 100-1,700.
- הכן רשימת מסה תיאורטית לפפטיד-pLeu adducts באמצעות כלי מקוון כגון ExPASy 26 עם מספרים של pLeu מחושבים בעבר מניתוח החלבון שלם. כולל לפחות 4 החמיצו שסעים. שים לב שתגובת התיוג מתרחשת עם האובדן של N 2. לכן, המסה של adduct פפטיד-pLeu = המוני של ניסיון ללא תוויתפפטיד ptic + n (מסה של pLeu) - n (מסה של N 2), שבו "n" הוא מספר pLeu המשולב.
הערה: אם הניתוח ההמוני של חלבון שלם הראה עד שלוש אוכלוסיות שכותרתו של חלבון, לשקול עד שלוש תוויות pLeu אפשריות לפפטיד. לפפטיד עם מסה של 1000 Da, המסה התיאורטית של adduct פפטיד-pLeu עם 1 התאגדות pLeu תהיה 1,000 + 1 (143) - 1 (28) = 1,115 Da. באופן דומה, ההמונים התיאורטי של פפטיד-pLeu adducts עם 2 pLeu, 3 pLeu, וכו 'יהיה 1,230 Da, 1,345 Da, וכו', בהתאמה. - השתמש בתוכנת הניתוח ההמונית כדי להתאים את רשימת המסה התיאורטית שנוצרה בשלב 5.7 עם ההמונים נצפו בניסוי. הגדר המוני נקודה (לדוגמא, 50 עמודים לדקה) חתוכה לזהות המונים עם שגיאה נמוכה.
- לפפטידים מתאימים, לקבוע את המספר האמיתי של pLeu התאגד באמצעות הנוסחא תחת צעד 4.8 (משוואה 3), שבו L M וM N הוא המוני כותרתופפטיד ילידים, בהתאמה.
תוצאות
כאן, ssHDX-MS וssPL-MS היו בשימוש כדי לחקור את ההשפעה של חומרים בלתי פעילים באינטראקציות קונפורמציה ומצב המוצק של תצורות Mb lyophilized. הריכוזים של חלבון וחומרים בלתי פעילים ששמשו במחקר זה מוצגים בטבלת 1. נציגי תוצאות מניתוח ssHDX-MS וssPL-MS של Mb lyophilized מתקבל על ידי הבא הפרוטוקולים מעל מוצגים.
ספיגת דאוטריום ברמת חלבון שלמה
ssHDX-MS הוא מסוגל להבחין בין הניסוחים Mb ברמה שלמה. ספקטרה ההמונית deconvoluted של Mb ללא פגע הבא 144 שעות של ssHDX מMBS הניסוח הראתה ספיגת דאוטריום גדולה מניסוח MBT (איור 3 א). בממוצע, MBS הראה ספיגת דאוטריום 46% יותר מאשר MBT (טבלה 2).
איור 3: ssHDX-MS לMb שלם: (א) ספקטרום המוני Deconvoluted של Mb ללא פגע deuterated מניסוחי MBT (קו מוצק) וMBS (קו מקווקו) הבא 144 שעות של ssHDX. הספקטרום ההמוני deconvoluted של Mb ללא פגע undeuterated מוצג גם (קו מקווקו). (ב) קינטיקה ssHDX לMb ללא פגע בניסוחי MBT (קו מוצק) וMBS (קו מקווקו). במהלך ssHDX הזמן היה מצויד למשוואה עבור עמותת מעריכי שני שלב באמצעות גרף Pad Prism גרסת תוכנת 5 (n = 3, ± SD).
קינטיקה deuteration לMBS שלם וMBT דומה בנקודות זמן מוקדמות (1-4 שעות), אבל MBS הראה גדילת חילופי דאוטריום עם עלייה בזמן (8-144 שעות) (איור 3). הדבר מצביע על החשיבות של בחירת נקודות זמן ארוכה יותר לssHDX בתנאי RH וטמפרטורה נמוכים יותר. כמו כן, תהליך הספיחה ודיפוזיה 2 O D עשוי להשפיע על השיעור של ssHDX בפו המוקדם הזמןints. המחקרים הקודמים שלנו הראו כי ספיחת לחות בssHDX תושלם בתקופה של שעות, ויש לו תרומה מינימאלית להחליף קינטיקה מעבר לכך זמן. השיעור ומטבע זר במידה שנצפה לכן אינו פשוט אמצעים של D 2 O adsorbtion 27,28. הברים הקטנים השגיאה באיור 3, המצביעים על סטיות תקן משלוש דגימות ssHDX-MS עצמאיות, עולים כי הניסוי הוא מאוד לשחזור.
| דאוטריום הספיג (%) ב | ג המהיר N | k ג המהיר | ג האיטי N | k ג האיטי | |
| MBT | 15.9 ± 0.5 | 13.1 (0.8) | 0.43 (0.03) | 11.0 (0.9) | 0.019 (0.001) |
| MBS | 23.2 ± 0.5 | 15.4 (0.7) | 0.49 (0.04) | 19.2 (0.6) | 0.024 (0.002) |
| % השינוי ד | 46% | 18% | 14% | 75% | 26% |
טבלה 2:. מדדי כמותיים של ספיגת דאוטריום במחקרי ssHDX של ניסוחים Mb ראה טבלה 1 להרכב ספיגת דאוטריום אחוזים ב ביחס למקסימום תיאורטי על ידי Mb ללא פגע אחרי 144 שעות של HDX ב 5 מעלות צלזיוס, 43% לחות יחסית (n = 3. , פרמטרים ממוצעים ± SD). ג נקבעו על ידי רגרסיה ליניארית של נתונים קינטית ssHDX-MS. כמובן זמן של חילופי דאוטריום לMb שלם היה מצויד למודל עמותת biexponential (Eqn. 2). ערכים בסוגריים סטיות התקן של הפרמטרים רגרסיה. ד השינוי באחוזים במדידות היו calcul ated כמו 100 x [(ערך מMBS - הערך מMBT) / (ערך מMBT)].
הפרמטרים רגרסיה (מהיר N, N איטי, k מהיר ואיטי k) לקינטיקה ספיגת דאוטריום לMBT MBS ומוצגים בטבלה 2. למרות ערכים מהירים ואיטיים N N גדולים יותר לMBS מ MBT, הבדלים בN האיטי ערכים היו גדולים יותר מהבדלים בערכים מהירים N. באופן ספציפי, הערך המהיר N הוא רק 18% יותר מאשר בMBS MBT, ואילו הערך האיטי N הוא 75% יותר מאשר בMBS MBT. הדבר מצביע על כך את הערכים איטיים N הקטנים יותר בMBT יכולים להיות בגלל השימור גבוה יותר של מבנה Mb או הגנה של קבוצות אמידי בחומרים בלתי פעילים שנחשפים לD 2 O בMBS. עם זאת, המנגנונים מפורטים אינם מובן באופן ברור. קבועי קצב (k מהיר ואיטי k) עבור שני הניסוחים דומים מאוד.
= "Jove_content" ילדה> ספיגת דאוטריום ברמת פפטיד
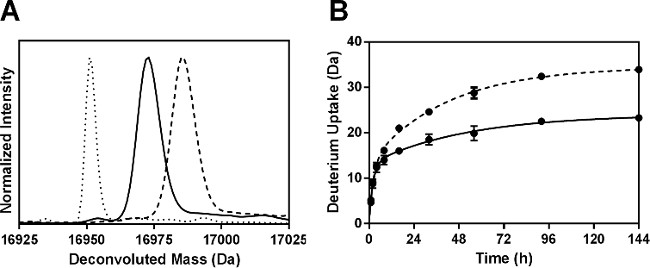
בעקבות עיכול פפסין, כולל של 52 פפטידים זוהו. שישה שברים שאינם המתאימים למיותרים של רצף Mb 100% שמשו לניתוח דיווח כאן. ניתן להשיג מידע נוסף על ידי שימוש שבברים חופפים, כפי שדווח על ידי הקבוצה שלנו בעבר 24. ספיגת דאוטריום אחוזים לכל פפטיד חושב והתוצאות מדגימות 144 שעות זממו (איור 4 א). קינטיקה HDX לשישה שברים פפטי הראתה התנהגות biexponential (איור 4), עולה בקנה אחד עם תת-אוכלוסיות של אטומי מימן אמיד שעברו תמורה "מהירה" ו" איטי ".
איור 4: ssHDX-MS לMb ברמת פפטיד: (א) ספיגת דאוטריום אחוזים במשך 6 שאינו reduשברים פפטי ndant מMb בניסוחי MBT (אפור) וMBS (לבן) הבאים 144 שעות של HDX. קינטיקה (B) ssHDX לשישה שברים פפטי אינם מיותרים מMb בניסוחי MBT (קו מוצק) וMBS (קו מקווקו). במהלך ssHDX הזמן היה מצויד למשוואה עבור עמותת מעריכי שני שלב באמצעות גרף Pad Prism גרסת תוכנת 5 (n = 3, ± SD).
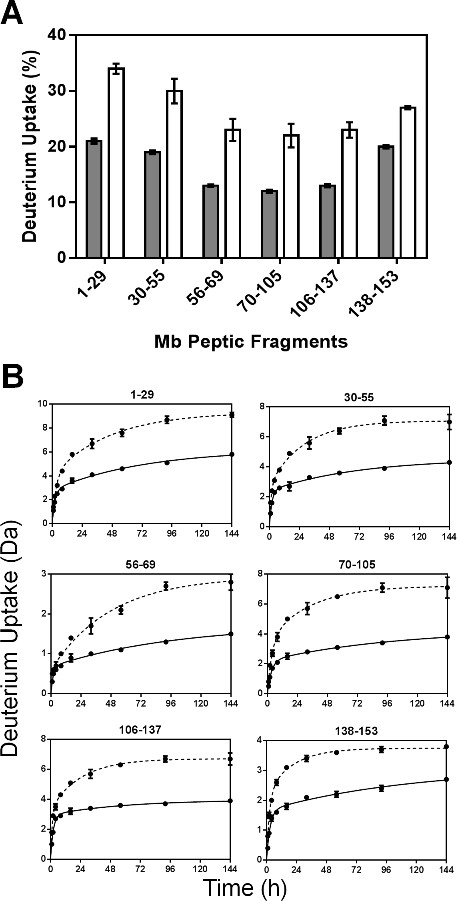
פרמטרים רגרסיה לפפטידים nonredundant מוצגים באיור 5. כקבועי קצב המותאמים לברי פפטיד אינם קבועים שיעור הממוצע אורגניים חיבור בודד, קבועי קצב שנצפו לברים פפטי לא יכולים להיות קשורים באופן ליניארי לאלו של החלבון שלם. הערכים מהירים N עבור רוב שברים פפטי (למעט 56-69 בר) בMBS ניסוחים היו מעט גדולים יותר מאלה בMBT (איור 5 א). באופן דומה, הערכים מהירים k בדרך כלל הראו הבדל קטן בין formulations ובאזורים שונים של מולקולת Mb (איור 5). עם זאת, הערכים איטיים איטיים וk N לMBS הם גדולים יותר באופן משמעותי בכל הברים מאשר לMBT (איור 5 ג ו5D). הגידול הניכר בk האיטי וN האיטי לMBS עשוי לשקף ניידות רבה יותר של קבוצות אמידי בבריכות "איטיות" החלפה.
איור 5: פרמטרים הקינטית ssHDX לפפטידים פפטי Mb: N מהיר (א), k המהיר (B), N האיטי (C) וk ערכים איטיים (D) המתקבלים מרגרסיה ליניארית של נתונים קינטית ssHDX-MS לשישה פפטידים פפטי אינם מיותרים מMb בניסוחי MBT (אפור) וMBS ( לבן) (n = 3, ± SE).
תיוג photolytic ברמת חלבון שלם
Mb מוקרן בנוכחות 20x pLeu העודף נוצר Mb-pLeu adducts מרובה, כפי שזוהה על ידי LC-MS (איור 6 א). ספקטרום deconvoluted לMBT מוקרן במשך 40 דקות עם 20x pLeu הראה עד 3 תוויות עם התוספת של 115, 230 וDa 345 למסה של Mb ללא תווית. MBS מוקרן באופן דומה עם 20x pLeu הראה פחות ספיגת pLeu ברמה שלמה, עם עד 2 אוכלוסיות שכותרתו זוהו על ידי LC-MS.
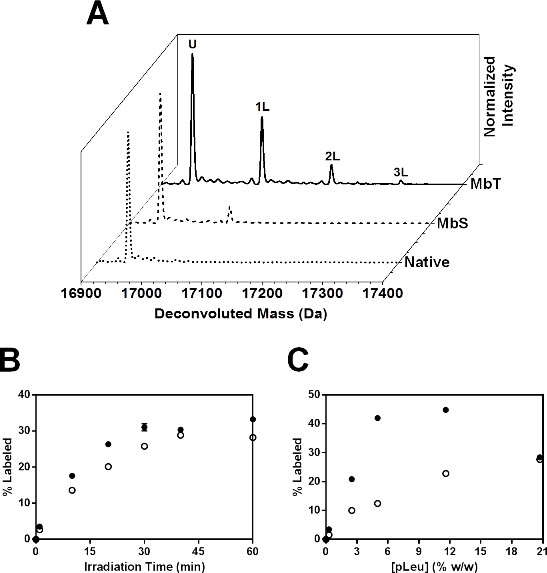
איור 6: ssPL-MS לMb שלם: (א) ספקטרום המוני Deconvoluted לMBT (קו מוצק) וMBS (קו מקווקו) שכותרתו עם 20x עודף (5% w / w) pLeu. ספקטרום המוני Deconvoluted של Mb ילידים (Mb lyophilized ומוקרן בהעדר pLeu) מוצג כקו המקווקו. U מציין אוכלוסייה של חלבון שנותרה ללא תווית לאחר הקרנה. אוכלוסיות של חלבון נושא 1, 2 ו -3 תוויות pLeu מיוצגות כ1 ליטר, 2L ו3L בהתאמה. קינטיקה (B) ssPL-MS לMb ללא פגע בניסוחי MBT (מעגלים סגורים) וMBS (עיגולים פתוחים) כפונקציה של ריכוז pLeu. כל הדגימות היו מוקרנים במשך 40 דקות. ברים שגיאה נמצאים בסימנים. (C) קינטיקה ssPL-MS לMb ללא פגע בניסוחי MBT (מעגלים סגורים) וMBS (עיגולים פתוחים) lyophilized ומוקרן בנוכחות 100x pLeu העודף (20.7% w / w) כפונקציה של זמן הקרנה. ברים שגיאה נמצאים בסימנים.
במחקרים הקינטית, אחוזים של חלבון שכותרתו גדלו באופן אקספוננציאלי עבור שני MBS MBT ועם זמן הקרנת הגדלת (איור 6). MBS הראה פחות ספיגת pLeu מ MBT בכל פעם שקרינה. שני הניסוחים הופיעו להגיע לרמה של 40 דקות. לפיכך, מחקר הקינטית יכול להיות לנו eful כדי לקבוע את משך ההקרנה הדרושה כדי להשיג הפעלת pLeu מלאה. קינטיקה התיוג נחקרו גם כפונקציה של ריכוז pLeu (איור 6 ג). אחוזים מהחלבון שכותרתו גדלו עם ריכוז pLeu עבור שני MBS MBT ו. עם זאת, ב20.7% w / w pLeu, MBT הראה ירידה בספיגת pLeu. זה יכול להיות בגלל ההרחקה של pLeu מפני שטח של החלבון בריכוז גבוה pLeu. לפיכך, יש לבצע מחקר עם משתנה ריכוז של pLeu כדי לבחור את ריכוז pLeu המתאים המאפשר תיוג מספיק על פני השטח החלבון ללא הדרת פני השטח. במחקר זה, 20x pLeu העודף נבחר למחקרים נוספים ברמה-peptide.
הכוללים ירידה בתיוג נצפה עבור MBS מציע נגישות צד שרשרת עניה למטריצה המכילה pLeu. זה עולה בקנה אחד עם שינוי קונפורמציה בנוכחות סורביטול כי תוצאות תיוג מופחת.
תוכן "> תיוג photolytic ברמת פפטידבהתבסס על מחקרי תיוג חלבון שלמים, 20x pLeu העודף נבחר כדי להשוות MBT MBS וברמת פפטיד. דגימות שכותרתו היו מתעכלים עם טריפסין ונותחו על ידי LC-MS. סך של 40 פפטידים המקביל לשל רצף Mb 100% אותרו עבור דגימות MBT MBS ו. בחלק מהמקרים, עיכול tryptic עשוי לספק כיסוי רצף חלבון מוגבל אם שאריות ליס ו / או Arg מסומנים בכבדות. כדי לשפר את כיסוי רצף, תערובת של טריפסין וchymotrypsin ניתן להשתמש כדי לעכל את החלבון שכותרתו.
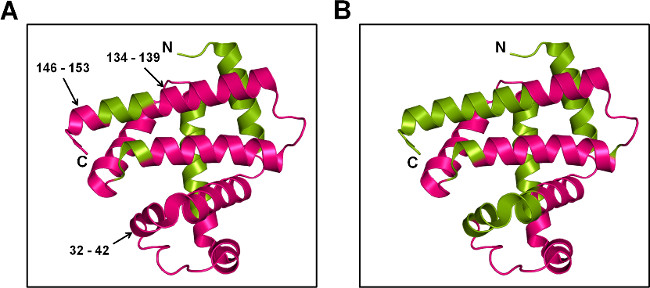
איור 7: ssPL-MS לMb ברמת פפטיד: ייצוג קריקטורה של Mb שכותרתו עם 20x pLeu העודף (5% w / w) בנוכחות trehalose () וסורביטול (B). החלבון שכותרתו היה מתעכל עם trypsin ופפטידים שכותרתו מופו על המבנה הגבישי של Mb (PDB מזהה 1WLA). אזורי שכותרתו וללא תווית בצבע ארגמן וירוק, בהתאמה.
ssPL-MS עם עיכול טריפסין מספק מידע איכותי על פפטידים להיות מתויגים. בהתחשב באוכלוסיות שכותרתו השונות ברמה שלמה, המנגנון המופקר של תיוג pLeu והבדלים ביעילות יינון של פפטידים שכותרתו וללא תווית, שקשה להשיג מדדי כמותיים לssPL-MS לאחר עיכול. עם זאת, המידע האיכותי עדיין יכול לספק תובנה שינויי קונפורמציה חלבון ברמת פפטיד. במחקר זה, ניסוחים שני MBT MBS והראו ספיגת pLeu פני רוב שטח החלבון. בהשוואה לMBS, שברי פפטיד 32-42, 134-139 ו146-153 מMBT הראו תיוג pLeu (איור 7). הדבר מצביע על כך בצד-השרשרות של חומצות אמינו אלה חשופות לpLeu, כסלילים בregio אלהns הם שלמים במטריצת MBT. בניגוד לכך, ההגנה מפני תיוג pLeu במטריצת MBS עולה בקנה אחד עם הפרעות מבניות באזורים אלה.
בסך הכל, התוצאות מssHDX-MS וssPL-MS מצביעות על כך שהשיטות יכולות לספק מידע ברמה-peptide ברזולוציה גבוהה משלים על עמוד השדרה (ssHDX-MS) וצד-שרשרת (ssPL-MS) השפעות חשיפה וחומר לא פעיל בניסוחי חלבון lyophilized .
Discussion
מספר מחקרים הראו כי הסביבה המקומית בדגימות lyophilized משפיעה פירוק חלבונים 5,29,30. עם זאת, הקמת מערכת יחסים ישירים בין מבנה חלבון ויציבות במצב המוצק לא הייתה אפשרית בשל חוסר שיטות אנליטיות ברזולוציה גבוהה. היישום של שיטות קיימות ברזולוציה גבוהה כגון HDX וPL לאבקות lyophilized דורש שינוי של פרוטוקולי פתרון ופרשנות נתונים זהירים. HDX-MS וPL-MS אומצו ברציפות לפקח על תצורות חלבון במצב המוצק. התוצאות שהוצגו כאן ובמקומות אחרים 27,28,31-33 הדגימו את היכולת של שיטות אלה כדי לפקח קונפורמציה חלבון עם רזולוציה גבוהה בסביבה המוצקה. למרות שהשלבים הקריטיים בניתוח הנתונים אינם משתנים מתיוג בפתרון 34-36, שיקולים חשובים בעת התקנה ניסיונית ופרשנות נתונים נדרשים לחמי מצב מוצקתיוג cal.
בחירה של מגיב התיוג חייבת להיות מבוססת על גודל ומנגנון של תיוג. הגודל הקטן של דאוטריום מאפשר את עמוד השדרה פפטיד שחקר בקלות, ואילו הגודל גדול יחסית של pLeu מגביל תיוג לצד הרשתות. שני ssHDX וssPL לא מראים העדפה לכל חומצת אמינו, כך שהתיוג תלוי רק בעמוד השדרה וצד-שרשרת חשיפה למטריצה. לחקור ביעילות תצורות חלבון במצב מוצק, הגורמים החיצוניים המשפיעים על תהליך התיוג חייבים להיות מבוקרים בקפידה. הסכום הכולל ואת הפריסה המרחבית של סוכן תיוג במוצקים lyophilized שונה מתמיסות מימיות.
בssHDX, הסכום של D 2 O במטריצה המוצקה עשוי להשפיע על השיעור של חלבון התגלגלות (או התגלגלות חלקי), מקפלים, וחילופי דאוטריום. זה לא המקרה עם הפתרון HDX, שבמדגם החלבון בדרך כלל מדולל עם נפח מספיק של D 2 O.סינון קפדני של ההשפעות של לחות בשיעור ssHDX יכול ליידע את הבחירה של תנאי RH אידיאליים. כדי לשלוט בקצב ספיחת לחות ולמנוע קריסה של האבקה בניסוחים המכילים חומרים בלתי פעיל hygroscopic (למשל סוכרוז וtrehalose), ssHDX עשויה להתבצע בתנאי קירור (2-8 מעלות צלזיוס). המחקר הקודם שלנו על השפעות לחות הראה גדילת שיעור והיקף של חליפין עם עלייה בתכולת לחות, כצפוי. בחלק גדול מהעבודה שלנו, RH ביניים של 43% ב -5 ° C הוכיח להיות אידיאלי להבחין ניסוחים בזמן סביר 24. התגובה מתבצעת בדרך כלל עד שתגיע לרמה. הדבר מבטיח כי ספיחת הלחות ודיפוזיה לתוך מוצק לא שולטים בקצב HDX. השימוש בגדלי מדגם מוצקים קטנים עם מראש lyophilization נפח של ≤2 מיליליטר גם מסייע להבטיח כי ספיחת אדי D 2 O היא למעשה מלאה בתחילת תקופת החליפין. למרות ssHDX-MS מספקמידע כמותי על קונפורמציה של חלבון במצב מוצק, יש תנאים מסוימים שבם פרשנות של נתונים אינן יכולה להתבסס אך ורק על מחקר ssHDX לבד. זה אפשרי כי ספיגת דאוטריום ירד נצפתה במדגם (בהשוואה לקבוצת ביקורת) יכולה להיות בגלל השימור גבוה יותר של מבנה חלבון או הכמות המשמעותית של אגרגטים חלבון בדגימה. במקרה כזה, פרשנות של נתונים ssHDX דורשת תוצאות משיטות משלימות אחרות. הרחבת שיא בספקטרום המוני deuterated נצפתה במשך כמה ניסוחים Mb 27,28. זה יכול להיות בגלל גורמים שונים כמו הנוכחות של אוכלוסיית חלבון מקופלת באופן חלקי, ההטרוגניות המרחבית במדגם, או הדרגתיים המרחבית בריכוז D 2 O. עם זאת, גורמים אלה לא הבחינו בssHDX-MS וזקוק לחקירה נוספת.
כssPL-MS הוא חדש יחסית בהשוואה לשיטות אחרות, למידה מתמשכת abאת היישומים ואת מגבלותיו נדרש. בssPL, התמונה צולבת-מקשר הוא lyophilized עם החלבון. חוסר הלחות מגביל את הניידות של רכיבים בתוך המטריצה המוצקה, וההרפיה המבנית החלקית שעלולות להתרחש עם ספיחת לחות בssHDX אינה תופעה בssPL. זה מגביל תיוג בssPL לסביבה הקרובה של התמונה צולבת-מקשר. עם זאת, בניגוד לHDX-MS, ניתוח MS / MS של החלבון הנקרא קוולנטית יכול לספק מידע מבני ברמת שאריות. מאז תיוג ssPL הוא קוולנטיים ובלתי הפיך, חזרה בורסה אינה מתרחשת וניתן להכין דגימות וניתחו ללא חשש לאובדן של תווית. כדי להקל על דיפוזיה של סוכן תיוג ולשפר את יעילות תיוג במוצקה-מטריצה, ssPL ניתן לבצע עם הגדלת% RH. ספיגת pLeu גם ניתן לשפר על ידי הגדלת הריכוז של סוכן photoreactive. היחס טוחנת של חלבון לpLeu יכול להיות מגוון לפי צורך. באופן כללי, עודף 100x טוחנת של pLeu לפרוחלבון יבטיח תיוג הולם. עם זאת, ריכוז pLeu גבוה עלול לגרום לאובדן של מבנה שליישונים במטריצה המוצקה. לפיכך, בנוסף לקינטיקה תיוג והרכב ניסוח, בחירה של ריכוז pLeu חייבת גם להיות מבוססת על שמירה על השלמות מבנית של חלבון. כpLeu nonselectively תוויות XH (כאשר X = C, N, O) קבוצה, ייתכן שחומרים בלתי פעיל עם אתרי תיוג דומים יכולים להשפיע על הרמה של תיוג חלבון מאוד. ההתערבות של חומרים בלתי פעילים בזמינות pLeu לתיוג חלבון עדיין לא מאופיינת. זה ידוע שהקרבן שנוצר מהפעלת diazirine לא שאריות ספציפי, אולם מחקר אחד מדווח הטיה כלפי ASP וGlu 36. אמנם זה טוב ללמוד על אינטראקציות שאריות ספציפיות, מידע פפטיד-הרמה הוא גם שימושי וניתן להשתמש בם כדי לעצב חומרים בלתי פעילים לחסום אזורים עם חשיפה גבוהה מטריצה במצב המוצק. ssPL-MS מספק מידע איכותי מפורט, אולםנתונים כמותיים צריכים להשיג ומדדים חזקים צריכים להיות מפותחים כדי לנתח הבדלי ניסוח פני מגוון רחב של מערכות lyophilized.
השימוש בתווית שאריות ספציפיות בשילוב עם ניתוח MS / MS יכול לשפר עוד יותר את הרזולוציה לרמת חומצות אמינו. ריאגנטים תיוג כגון 2,3-butanedione לתייג Arg, נגזרי -hydroxysuccinimide N נגזרי -alkylmaleimide ליס וN לCys יכול לשמש כדי למפות בדיוק אינטראקציות מולקולריות באבקת lyophilized. עם זאת ריאגנטים אלה הם pH תלוי והתגובות לא יכולות להיות מבוקרות היטב כתיוג photolytic במצב מוצק. גישה חלופית היא לשלב התמונה צולבת-מקשר לתוך רצף החלבון עם השימוש בקווי auxotrophic תא, מוטגנזה מכוונת או derivatization שרשרת צד.
מחקרי ssHDX-MS וssPL-MS הקודמים שלנו הראו כי תיוג של חלבון תלוי באופי וכמות חומרים בלתי פעילהמשמש 24,27,28,31-33,37,38. ssHDX-MS של Mb שיתוף lyophilized עם hydrochloride guanidine (Gdn.HCl) הראה ספיגת דאוטריום גדולה מMb במשותף עם lyophilized נמוך משקל מולקולרי סוכרים 32. במחקר שssPL-MS נפרד, Mb שיתוף lyophilized עם Gdn.HCl הראה הגנה טובה יותר מתיוג photolytic מ Mb עם סוכרוז 33. יתר על כן, מדידות כמותיות מssHDX-MS כבר מתאם גבוה עם היציבות של חלבון במהלך אחסון לטווח ארוך 28. מחקרים אלו מצביעים על כך שssHDX או ssPL של חלבון משקף את היקף ההחזקה מבנית של החלבון באבקת lyophilized. אנו מאמינים כי השמירה על מבנה המשני באבקות lyophilized מספקת סביבה נוחה לתיוג שרשרת צד עם pLeu והגנה של מימן אמיד מחילופי דאוטריום. עם זאת, השוואה מפורטת של התוכן אינפורמטיבי מהשיטות הללו צריכה להתבצע בעתיד. למרות הקמת השירות של ssHDX-MS וssPL-MSככלי מיון ניסוח סופו של דבר יהיה עליו להיות מיושמים על חלבונים רבים, תוצאות מהמחקרים האחרונים שלנו תומכת באימוץ הרחב יותר שלה. עם התפתחות נוספת, שיטות אלו צפויים להיות שימושיים נרחב לאפיון ניסוחים חלבון מצב מוצק בתעשיית הביו-פרמצבטיקה.
Disclosures
The authors declare that they have no competing financial interests.
Acknowledgements
The authors gratefully acknowledge financial support from NIH R01 GM085293 (PI: E. M. Topp) and from the College of Pharmacy at Purdue University.
Materials
| Name | Company | Catalog Number | Comments |
| Equine myoglobin | Sigma-Aldrich | M0630-5G | |
| D-(+)-Trehalose dihydrate | Sigma Aldrich | #T9531 | |
| D-Sorbitol | Sigma Aldrich | #240850 | |
| L-Photo-leucine | Thermo Scientific | #22610 | |
| Potassium phosphate monobasic | Sigma-Aldrich | #P0662 | |
| Potassium phosphate dibasic | Sigma-Aldrich | #P3786 | |
| Deuterium Oxide | Cambridge Isotope Laboratories | #DLM-4-PK | Alternate (Cat. No.: 151882, Sigma-Aldrich) |
| Immobilized pepsin | Applied Biosystems | #2-3132-00 | |
| Trypsin | Promega | #V511A | Chymotrypsin (Cat. No.: #V1062, Promega) can be additionally used |
| Water, Optima LC/MS grade | Fisher Chemical | #7732-18-5 | |
| Acetonitrile | Sigma-Aldrich | #34998 | |
| Formic acid | Thermo Scientific | #28905 | |
| ESI-TOF Calibrant | Agilent Technologies | #G1969-85000 | Highly flammable liquid |
| Protein microtrap | Michrom Bioresources | TR1/25108/03 | |
| Peptide microtrap | Michrom Bioresources | TR1/25109/02 | |
| Analytical column | Agilent Technologies | Zorbax 300SB-C18 | |
| Freeze dryer | VirTis AdVantage Plus | ||
| Stratalinker equipped with five 365 nm lamps | Stratagene Corp. | Stratalinker 2400 | |
| HPLC | Agilent Technologies | 1200 series LC | Refrigerated LC system for HDX-MS |
| ESI-qTOF MS | Agilent Technologies | 6520 qTOF | |
| HDExaminer (HDX-MS data analysis software) | Sierra Analytics | http://www.massspec.com/HDExaminer.html |
References
- Lawrence, S. Billion dollar babies--biotech drugs as blockbusters. Nat. Biotechnol. 25 (4), 380-382 (2007).
- . . Global Markets and Manufacturing Technologies for Protein Drugs. , BIO021D (2013).
- Lai, M. C., Topp, E. M. Solid-state chemical stability of proteins and peptides. J. Pharm. Sci. 88 (5), 489-500 (1999).
- Carpenter, J. F., Pikal, M. J., Chang, B. S., Randolph, T. W. Rational design of stable lyophilized protein formulations: some practical advice. Pharm. Res. 14 (8), 969-975 (1997).
- Carpenter, J. F., Chang, B. S., Garzon-Rodriguez, W., Randolph, T. W. Rational design of stable lyophilized protein formulations: theory and practice. Pharm. Biotechnol. 13, 109-133 (2002).
- Wüthrich, K. Protein structure determination in solution by NMR spectroscopy. J. Biol. Chem. 265 (36), 22059-22062 (1990).
- Ilari, A., Savino, C. Protein structure determination by x-ray crystallography. Methods. Mol. Biol. 452, 63-87 (2008).
- Brunger, A. T. X-ray crystallography and NMR reveal complementary views of structure and dynamics. Nat. Struct. Biol. 4, 862-865 (1997).
- Yu, L. Amorphous pharmaceutical solids: preparation, characterization and stabilization. Adv Drug. Deliv. Rev. 48 (1), 27-42 (2001).
- Manning, M. C. Use of infrared spectroscopy to monitor protein structure and stability. Expert. Rev. Proteomics. 2 (5), 731-743 (2005).
- Grohganz, H., Gildemyn, D., Skibsted, E., Flink, J. M., Rantanen, J. Rapid solid-state analysis of freeze-dried protein formulations using NIR and Raman spectroscopies. J. Pharm. Sci. 100 (7), 2871-2875 (2011).
- Bai, S., Nayar, R., Carpenter, J. F., Manning, M. C. Noninvasive determination of protein conformation in the solid state using near infrared (NIR) spectroscopy. J. Pharm. Sci. 94 (9), 2030-2038 (2005).
- Pikal, M. J., et al. Solid state chemistry of proteins: II. The correlation of storage stability of freeze-dried human growth hormone (hGH) with structure and dynamics in the glassy solid. J. Pharm. Sci. 97 (12), 5106-5121 (2008).
- Wang, B., Tchessalov, S., Cicerone, M. T., Warne, N. W., Pikal, M. J. Impact of sucrose level on storage stability of proteins in freeze-dried solids: II. Correlation of aggregation rate with protein structure and molecular mobility. J. Pharm. Sci. 98 (9), 3145-3166 (2009).
- Schule, S., Friess, W., Bechtold-Peters, K., Garidel, P. Conformational analysis of protein secondary structure during spray-drying of antibody/mannitol formulations. Eur. J. Pharm. Biopharm. 65 (1), 1-9 (2007).
- Baerga-Ortiz, A., Hughes, C. A., Mandell, J. G., Komives, E. A. Epitope mapping of a monoclonal antibody against human thrombin by H/D-exchange mass spectrometry reveals selection of a diverse sequence in a highly conserved protein. Protein. Sci. 11 (6), 1300-1308 (2002).
- Coales, S. J., Tuske, S. J., Tomasso, J. C., Hamuro, Y. Epitope mapping by amide hydrogen/deuterium exchange coupled with immobilization of antibody, on-line proteolysis, liquid chromatography and mass spectrometry. Rapid. Commun. Mass. Spectrom. 23 (5), 639-647 (2009).
- Pacholarz, K. J., Garlish, R. A., Taylor, R. J., Barran, P. E. Mass spectrometry based tools to investigate protein-ligand interactions for drug discovery. Chem. Soc. Rev. 41 (11), 4335-4355 (2012).
- Houde, D., Peng, Y., Berkowitz, S. A., Engen, J. R. Post-translational modifications differentially affect IgG1 conformation and receptor binding. Mol. Cell. Proteomics. 9 (8), 1716-1728 (2010).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. J. Pharm. Sci. 100 (6), 2071-2086 (2011).
- Dorman, G., Prestwich, G. D. Using photolabile ligands in drug discovery and development. Trends. Biotechnol. 18 (2), 64-77 (2000).
- Robinette, D., Neamati, N., Tomer, K. B., Borchers, C. H. Photoaffinity labeling combined with mass spectrometric approaches as a tool for structural proteomics. Expert. Rev. Proteomics. 3 (4), 399-408 (2006).
- Greenspan, L. Humidity fixed points of binary saturated aqueous solutions. Journal of Research of the National Bureau of Standards. 81A (1), 8 (1977).
- Sophocleous, A. M., Zhang, J., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 1. Exchange mapping. Mol. Pharm. 9 (4), 718-726 (2012).
- Keppel, T. R., Jacques, M. E., Young, R. W., Ratzlaff, K. L., Weis, D. D. An efficient and inexpensive refrigerated LC system for H/D exchange mass spectrometry. J. Am. Soc. Mass. Spectrom. 22 (8), 1472-1476 (2011).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic. Acids. Res. 31 (13), 3784-3788 (2003).
- Sophocleous, A. M., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 2. Exchange kinetics. Mol. Pharm. 9 (4), 727-733 (2012).
- Moorthy, B. S., Schultz, S. G., Kim, S. G., Topp, E. M. Predicting Protein Aggregation during Storage in Lyophilized Solids Using Solid State Amide Hydrogen/Deuterium Exchange with Mass Spectrometric Analysis (ssHDX-MS). Mol. Pharm. 11 (6), 1869-1879 (2014).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203 (1-2), 1-60 (2000).
- Sarciaux, J. M., Mansour, S., Hageman, M. J., Nail, S. L. Effects of buffer composition and processing conditions on aggregation of bovine IgG during freeze-drying. J. Pharm. Sci. 88 (12), 1354-1361 (1999).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Characterizing protein structure in amorphous solids using hydrogen/deuterium exchange with mass spectrometry. Anal. Biochem. 366 (1), 18-28 (2007).
- Sinha, S., Li, Y., Williams, T. D., Topp, E. M. Protein conformation in amorphous solids by FTIR and by hydrogen/deuterium exchange with mass spectrometry. Biophys. J. 95 (12), 5951-5961 (2008).
- Iyer, L. K., Moorthy, B. S., Topp, E. M. Photolytic labeling to probe molecular interactions in lyophilized powders. Mol. Pharm. 10 (12), 4629-4639 (2013).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. J. Vis. Exp. (81), e50839 (2013).
- Kaltashov, I. A., Bobst, C. E., Abzalimov, R. R. H/D exchange and mass spectrometry in the studies of protein conformation and dynamics: is there a need for a top-down approach. Anal. Chem. 81 (19), 7892-7899 (2009).
- Jumper, C. C., Schriemer, D. C. Mass spectrometry of laser-initiated carbene reactions for protein topographic analysis. Anal. Chem. 83 (8), 2913-2920 (2011).
- Li, Y., Williams, T. D., Topp, E. M. Effects of excipients on protein conformation in lyophilized solids by hydrogen/deuterium exchange mass spectrometry. Pharm. Res. 25 (2), 259-267 (2008).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Trehalose and calcium exert site-specific effects on calmodulin conformation in amorphous solids. Biotechnol. Bioeng. 97 (6), 1650-1653 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved