Method Article
質量分析は、凍結乾燥粉末中のタンパク質の構造と相互作用を研究するためのアプローチ
要約
Here, we present detailed protocols for solid-state amide hydrogen/deuterium exchange mass spectrometry (ssHDX-MS) and solid-state photolytic labeling mass spectrometry (ssPL-MS) for proteins in solid powders. The methods provide high-resolution information on protein conformation and interactions in the amorphous solid-state, which may be useful in formulation design.
要約
質量分析に続くアミド水素/重水素交換(ssHDX-MS)及び側鎖光分解標識(SSPL-MS)は、タンパク質治療薬の凍結乾燥製剤を特徴付ける貴重であることができる。適切なタンパク質分解消化に続いてラベリングは、タンパク質の構造との相互作用は、ペプチドレベルの分解能でマッピングされることを可能にする。タンパク質ので、構造要素は、主鎖、およびアミノ酸、アミノ酸残基の原子の特異的標識タンパク質の構造とコンフォメーションへの洞察を提供するの側鎖の化学結合のネットワークにより安定化される。凍結乾燥された固体( 例えば 、FTIR)でタンパク質を研究するために使用される日常的な方法とは対照的に、ssHDX-MSとのSspI-MSで定量し、サイト固有の情報を提供する。重水素取り込み動態パラメータの程度は急速にゆっくりと(N 速い 、 遅い N)アミドプールを交換することに関連して直接度を反映することができる凍結乾燥製剤中のタンパク質の折りたたみ及び構造のREE。安定した光分解ラベリングは、バック交換、ssHDX-MSを上回る利点を受けない。ここでは、トレハロースまたはソルビトールのいずれかを含有する凍結乾燥製剤中のモデルタンパク質としてミオグロビン(Mbの)を使用して、ssHDX-MSとのSspI-MSの両方についての詳細なプロトコルを提供する。
概要
タンパク質薬剤は、バイオ医薬品業界の最も急速に成長している分野であり、ホルモン障害、癌および自己免疫疾患1を含む以前に難治性疾患のための有望な新しい治療法を提供しています。 2012年には、世界的なバイオ治療薬市場は1380億ドルに達し、2018年2によって1790億ドルに達すると予想されている。タンパク質は、従来の低分子薬より大きく、より壊れやすく、そのように劣化3、多くの種類の影響を受けやすくなります。十分な貯蔵寿命および安定性を確保するために、タンパク質薬剤は、多くの場合( すなわち 、凍結乾燥)凍結乾燥のような固体粉末製剤化される。しかし、タンパク質は、まだその本来の構造は凍結乾燥プロセスの4,5中に保存されていない場合は特に、固体状態で分解を受けることがあります。構造が保持されていることを保証するsufficienで固体でタンパク質コンフォメーションを調べることができる分析方法がある場合にのみ可能であるTの解像度。
NMR分光法6およびX線結晶7は、溶液と結晶性固体8のタンパク質構造を評価するために一般的に使用される高解像度の方法である。なぜなら賦形剤及び使用する処理方法の性質のため、凍結乾燥タンパク質製剤は、通常は非晶質ではなく、9結晶質である。均質性と微視的秩序の欠如は、非晶質固体中のタンパク質のための上記の技術は非現実的になります。フーリエ変換赤外分光法(FTIR)10に変換ラマン分光法11と近赤外分光法(NIR)12は、定期的に天然の液状態の構造のものに凍結乾燥粉末中のタンパク質の二次構造を比較するためにバイオ医薬品業界で使用されてきた。しかしながら、これらの方法は、低解像度であり、唯一の二次構造の全体的な変化に関する情報を提供することができる。 FTIRを用いた固体構造解析長期保存安定性に弱い13,14または貧しい15相関のいずれかを示している。これらの制限は、固体中のタンパク質の構造的摂動を同定するのに適した高解像度の方法の必要性を強調している。
タンパク質分解および質量分析と連結化学的標識は、水溶液中のタンパク質の構造および分子間相互作用をモニタリングするための強力なアプローチとして登場した。医薬品開発においては、HDX-MSは、タンパク質薬剤19のコンホメーションの翻訳後修飾の効果をモニターするために、受容体-薬物相互作用18をマッピングし、及び比較するために、抗原-抗体相互作用16,17におけるエピトープマッピングのために使用されているバイオシミラー20の開発にバッチ間の変動。同様に、光活性化可能なリガンドは、薬物標的を同定するために、薬剤-受容体相互作用21,22の結合親和性および特異性を決定するために使用されている。 EにXTEND凍結乾燥製剤に、これらの方法の応用、我々のグループが開発した固体水素重水素交換質量分析(ssHDX-MS)及び固体光分解標識化質量分析法(SSPL-MS)は、凍結乾燥されたサンプル中のタンパク質のコンフォメーションおよび賦形剤との相互作用を研究する高解像度。
ssHDX-MSとのSspI-MSの両方において、タンパク質は、凍結乾燥された固体中の理想的な反応条件下で、標識され、次いで、サンプルを再構成し、またはタンパク質分解性消化せずに質量分析法によって分析される。 SSPL-MSは、側鎖( 図1)の環境に関する情報を提供しながらssHDX-MSは、重水素蒸気に主鎖曝露に関する情報を提供する。二つの方法は、このように固体タンパク質コンフォメーションについての補足情報を提供することができる。ここでは、Mbのように使用して、ssHDX-MSとのSspI-MS( 図2)を用いて凍結乾燥した固形物中のタンパク質を研究するための一般的なプロトコルを提供モデルタンパク質。我々は2つの異なる賦形剤との配合物の違いを区別するための二つの方法の能力を示す。
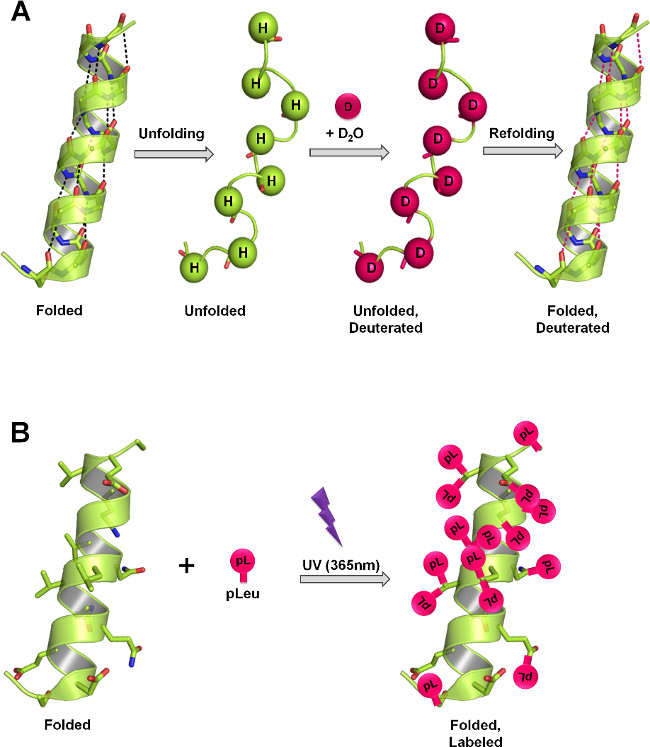
図1:異なる標識メカニズムを通して凍結乾燥固体中ssHDXとSSPLメジャータンパク質構造(A)HDX、タンパク質構造およびDの関数2 Oアクセシビリティとして重水素骨格アミド水素交換で。固体では、重水素交換の速度および程度は、D 2 O吸着、タンパク質の移動度(イベントを展開し、リフォールディング)および固体マトリックス中に存在する賦形剤の性質のレベルに依存。 (B)PLでは、365nmのUV照射はpLeuのジアジリン官能基の反応性中間体カルベンの生成を開始し、任意のXH結合(Xは任意の原子を=)、または広告に非特異的に挿入されているそのすぐ近くにC = C結合を越えDED。固体では、標識化の速度および程度は、ローカルの標識剤の濃度、照射時間、タンパク質の構造および固体マトリックス中に存在する賦形剤の性質に依存する。パネルAおよびBは、タンパク質中のそれぞれ骨格および側鎖に発生することが理論上の最大の標識を示す。
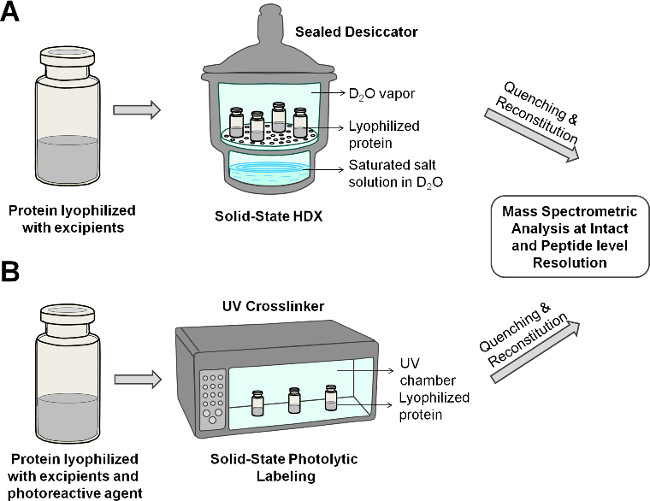
図2:凍結乾燥製剤中のタンパク質の回路図を示す固体HDX-MS(A)及びPL-MS(B)。
プロトコル
1.試料の調製および凍結乾燥
- 0.22μmの滅菌フィルターを通して、適切な緩衝液およびフィルタに対してMbのストック溶液の必要量を透析。
- 賦形剤および光ロイシンの所要容積の準備(L-2-アミノ-4,4- AZI - ペンタン酸; pLeu)適切な緩衝液でストック溶液。 0.22μmの滅菌フィルターを通してストック溶液をフィルタリングします。
- タンパク質、賦 形剤、pLeu、および緩衝液のストック溶液を用いて、表1に示すように製剤を調製する。
- ステップ1.3に形成された任意の粒子を除去する、0.22μmの滅菌フィルターを通してフィルター試料。 2ミリリットルのガラス製バイアルに0.2ミリリットルとして別個のサンプルを充填する。 SSPL-MS研究にpLeuを活性化するために、UV(365 nm)の光に対して透明であるガラスバイアルを使用してください。
- 凍結乾燥機でバイアルをロードし、適切な凍結乾燥サイクルを設計することによって、凍結乾燥を開始する。
- ここでは、-40℃でサンプルを凍結が続く12時間および12時間、25℃で二次乾燥のため-35℃で真空(70トル)の下で一次乾燥による。他の凍結乾燥サイクル及び乾燥方法( 例えば噴霧乾燥)を用いてもよい。
- キャッピングの前に窒素で凍結乾燥試料を含むバイアルのバックフィル。
| 処方物 | 組成(mg / ml)で、凍結乾燥の前に | ||||
| Mbの | トレハロース | ソルビトール | pLeu C | カリウム、リン酸、pH7.4中 | |
| MBT A | 1.7 | 3.4 | - | - | 0.4 |
| のMBS A | 1.7 | - | 3.4 | - | 0.4 |
| MBT + pLeu B | 1.7 | 3.4 | - | 14.3×10 -3〜1.43 | 0.4 |
| MBS + pLeu B | 1.7 | - | 3.4 | 14.3×10 -3〜1.43 | 0.4 |
表1:のSspI-MS研究のために使用される凍結乾燥されたMBの製剤の組成 ssHDX-MS研究のために使用される製剤は、bは製剤のC L-2-アミノ-4,4- azipentanoic酸または光ロイシン(pLeu)。 Mbの1倍にするために対応する5つの異なる濃度(14.3×10 -3〜1.43 mg / ml)で少なくともpLeu、10倍、20倍、50倍および100倍モル過剰のMBTおよびMBS製剤と同時凍結乾燥した。
無傷タンパク質2. ssHDX-MS
- D 2 O previouslのK 2 CO 3〜200ミリリットルの飽和量(〜440グラム)を追加しますyはデシケーターの下部コンパートメントに配置。気密デシケータを密封し、43%に達する〜の安定した相対湿度(RH)まで5℃で平衡化させる。関心のある他のRH値は、異なる飽和塩溶液23,24を選択することによって得ることができる。
- デシケーターの上部コンパートメントで凍結乾燥されたタンパク質を含有するキャップを外したバイアルを配置することによってssHDX反応を開始する。デシケーターを気密に密封し、HDXは、( 図2A)が発生することを可能にするために5℃でインキュベートする。
- 三重で様々な時間でssHDXサンプルを収集します。 Mbの製剤について、9時間点1、2、4、8、16、32、56、92および144時間後にサンプルを収集する。
- すぐにデシケーターから撤退した後、バイアルに蓋をし、液体窒素中でバイアルを凍結フラッシュによって反応をクエンチした。質量分析まで-80℃で保存バイアル。
- 適当な高解像度の液体クロマトグラフィー - 質量spectromを使用したサンプルを分析etry(LC-MS)法。サンプル分析中にバック交換を最小限にするために、適切な冷蔵LCシステムを設計または購入。カラム冷凍装置のセットアップを使用して、LC-MS法は、以前に25を報告した。
NOTE:アミドプロトンの交換速度は、pHおよび温度に依存するので、タンパク質に組み込ま重陽子は、移動相中に存在する水素(「バック交換」)と交換する情報の損失を引き起こすことができる。クエンチ緩衝液およびHPLC溶媒の酸性pH(pHは2.5)温度を下げ、大部分のバック交換を最小限に抑えることができたが(≤0℃)、さらにバック交換からタンパク質を保護することができる適切な列冷凍システムにより。 - サンプルループとタンパク質トラップが自動的に脱塩および溶出プロセスを制御するバルブに接続します。 200-3,200のm / z範囲内の質量分析計にTOF低濃度調整ミックスを注入することにより、質量分析計を較正する。固定化したペプシンカラムおよび分析カラムは、インタクトなタンパク質の解析のために必要とされない。
- °Cを≤0及び〜0℃の安定した動作温度に到達するためにシステムを待機する冷蔵システム内の温度を設定する。
- すぐに質量分析のために液体窒素に-80℃からサンプルを転送します。鉗子を使用して、慎重に液体窒素から各バイアルを撤回し、バイアルに0.2%ギ酸(FA)の水(pHは2.5)および5%メタノールを含む氷冷クエンチ緩衝液の特定のボリュームを追加することにより、サンプルを再構成する。
- プログラム制御ソフトウェアを使用して適切なHPLCおよび質量分析法。 Mbの製剤、5%アセトニトリルで1.7分間、タンパク質トラップ20ピコモルメガビットを含む脱塩サンプルを、95%の水および0.1%ギ酸(FA)、および勾配を用いて溶出し、80%アセトニトリル、20%水および0.1に増加3.3分で%FA。 m / z範囲200-3,200にわたって質量スペクトルを収集します。
- そのままの質量を測定するために、タンパク質は、工程2.9の方法を使用して水溶液中に( すなわち 、タンパク質ssHDXが施されていない)非重水素化タンパク質試料のデータを取得する。
- データ分析ソフトウェアを使用して生のスペクトルをデコンボリューションすることにより、非重水素化および重水素化サンプルの質量を取得します。ここで、15,000-18,000 Daを、1.0 Daの質量分解能、Mbの質量を計算するための90%のピーク高質量範囲を設定する。
- 各交換時点での重水素化タンパク質の塊から非重水素化タンパク質の質量を差し引くことにより無傷タンパク質(ここでは、MB)に組み込まれた重陽子の数を計算します。
- 以下の式(式1)を用いて、理論上の最大パーセント重水素取り込みを相対的に算出する
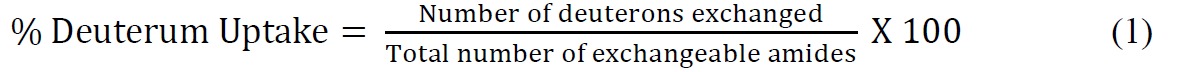
交換可能なアミド=アミノ酸の総数のどこ総数 - プロリン残基の数 - N- 2( "2"アカウント迅速なバック交換を受ける末端アミノ基とアミド水素)。 - 適切な指数方程式を使ってssHDX動態データを取り付けます。 biexponential式(式2)は、通常ssHDXデータへの合理的なフィット感を提供することが最も簡単です。本研究では、MBTおよびMBSのために、「高速」と「遅い」のプールを交換するために重陽子を割り当てbiexponentialモデルにデータをフィット。
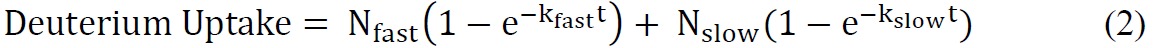
ここで、N及びN 速い遅いの 「高速」に交換可能なアミドの数であり、それぞれ、プールを交換する「遅い」、および高速 kおよび遅い kはつのプールに関連付けられた一次速度定数である。
ペプチドレベルでのタンパク質について3. ssHDX-MS
- ステップ2.6で以下のように変更し、ステップ2.8から2.1に従うことによってssHDXを実行します。固定化ペプシンCOLを接続以前に25とペプチドトラップをバルブに接続タンパク質トラップを交換する報告されているようにUMNとバルブに分析カラム。 100から1700の範囲の質量対電荷比を設定することにより、質量分析計を較正する。
注:再構成ステップ(ステップ2.8)中、還元剤および変性剤は、ジスルフィド結合( 例えば 、モノクローナル抗体)を有するタンパク質のペプシン消化を容易にするために、クエンチ緩衝液中に含めることができる。 - プログラム制御ソフトウェアを使用して、適切なHPLCおよび質量分析方法。 Mbの製剤については、0.1%FA、10%アセトニトリル、90%水およびペプチドトラップ中の0.1%FA 1.7分間トラップおよび脱塩ペプチドとオンライン20pmolのメガビットを含むサンプルを消化する。 4.0分で60%アセトニトリルまでの勾配の増加、40%の水および0.1%FAと分析カラム上に断片を溶出する。 m / z範囲100-1,700にわたって質量スペクトルを取得します。
- のMS / MS分析により消化断片を同定タンパク質試料を重水素化。カスタムデータベースにおけるペプチド断片の予測大衆にペプチド断片イオンの実験的な質量を比較するために質量分析ソフトウェアを使用してください。低エラーで大衆を識別するために、大量のカットオフ点( 例えば 、10 ppm)を設定します。ペプチドが一致した場合、(i)のペプチド配列、(ii)の充電状態、及び(iii)の滞留時間から成るリストを準備。
- フラグメントを消化各ペプシンのために組み込まれた重陽子の平均数をマッピングし、決定するために、ステップ3.3で生成されたリストを使用してください。これは、適切なHDX-MSデータ解析ソフトウェア24を使用することによって達成することができる。
- %の重水素の取り込みを計算し、消化断片のそれぞれについて、ssHDX動的データに合うように、ステップ2.13と2.14に従ってください。本研究では、6つの非冗長ペプシンのそれぞれがMBTおよびMBSの製剤からの断片を消化するためのHDX動態データはbiexponential相関モデル(式2)に適合させた。
無傷のプロ4. SSPL-MSTEIN
- UVクロスリンカー上の光分解標識反応、最初のスイッチを開始し、ランプが5分間のウォームアップできるようにする。 UV源はpLeuのジアジリングループをアクティブにするために、波長365nmのランプが装備されていることを確認します。
注意:ランプが点灯しているときのUV架橋剤のドアを開けないでください。ソースは、UV保護ガラスドアで囲まれていない場合は、UV光への暴露から目や肌を保護します。 - ドアを開ける前に、UVクロスリンカーをオフにします。ランプがオフされると、凍結乾燥製剤を含むバイアルをuncap及び図2Bに示すように、UV架橋チャンバ内に置く。 40分間UV光を試料に照射される。
- pLeuせずに凍結乾燥(I)のサンプルに対して4.3にステップ4.1に従うことによって制御実験を行うと、(ii)pLeuで凍結乾燥した試料は、水で再構成。
- キャップは、質量分光分析まで-20℃でバイアルを保存して。
- Reconstit2μMに濃度をもたらすために、質量分析グレードの蒸留水の適切な量を追加することによって、固体試料をウテ。
- サンプル分析を開始するには、手順2.6および2.9に従ってください。
注:バック交換は共有結合標識の問題ではないので、SSPL-MSは、特別な冷蔵LCシステムを必要としません。 - タンパク質の天然の質量を決定するために、ステップ2.9に従ってSSPLが施されていないタンパク質試料のデータを取得する。ステップ2.11で説明したように生のスペクトルをデコンボリューションすることで、非標識及び標識された試料の質量を取得します。
- pLeuの数は以下の式を使用して組み込まれて計算する:
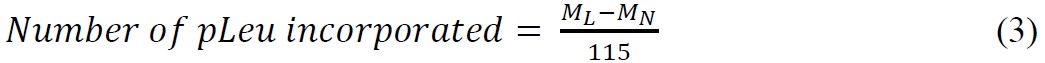
M Lは 、標識されたタンパク質の質量、M、Nは 、天然タンパク質と115の質量である平均質量(Daが)単一pLeu取り込み以下の天然タンパク質に付加される。標識反応が目に発生することに注意してくださいN 2(28 Da)での電子の損失。 pLeuのモノアイソトピック質量は143.07である。 - 抽出イオンクロマトグラムからピーク高さを使用して、ラベル数の異なるタンパク質集団の割合を計算します。

「i」は、ラベルの数を表し、PH iは、質量分析により観察されるようにuが非標識タンパク質のピーク高さを意味する標識タンパク質L iとPHのピーク高さを意味する。
ペプチドレベルでのタンパク質について5. SSPL-MS
- ステップ4.4に4.1に従うことによってSSPLを実行します。
- ペプチドレベルの分析のために、重炭酸アンモニウム緩衝液(100mM、pH8.0)中で固体試料を再構成。
- トリプシンと16時間60℃でインキュベートし、タンパク質のモル比1:再構成した後、10でトリプシンで標識されたタンパク質溶液を混合する。
- 0.1%FAを添加することにより反応をクエンチサンプルを水中で2μMタンパク質最終濃度を得た。
- サンプルループ、ペプチドトラップと分析カラムをHPLCシステムにリンクバルブに接続します。
- プログラム制御ソフトウェアを使用して適切なHPLCおよび質量分析法。 Mbの製剤のために、勾配を分析カラムで溶出し、5%アセトニトリル、95%水および0.1%FA 1.5分間ペプチドトラップ内のペプチドをサンプルループに消化されたタンパク質の20ピコモルを注入し、脱塩22分で55%アセトニトリル、45%水および0.1%FAを増やす。 m / z範囲100-1,700にわたって質量スペクトルを収集します。
- そのような以前に完全なタンパク質分析から算出しpLeuの番号ExPASy 26のようなオンラインツールを使用して、ペプチド- pLeu付加物の理論上の質量リストを準備します。少なくとも4の切断を逃し含めます。標識反応は、N 2の損失に発生することに注意してください。したがって、ペプチド - pLeu付加物の質量=未標識のtryの質量PTICペプチド+ n個(pLeuの質量) - nは「n」が組み込まpLeuの数であり、(N 2の質量)。
注:完全なタンパク質の質量分析は、タンパク質の3ラベル集団に現れた場合には、ペプチドごとに3つの可能なpLeuラベルまで検討してください。 1(28)= 1115ダ - 千ダの質量を有するペプチドの場合は、1 pLeuの取り込みを有するペプチド - pLeu付加物の理論質量は千+ 1(143)になります。同様に、 など 2 pLeu、3 pLeu、ペプチド- pLeu付加物の理論上の質量はそれぞれ、 など 1230ダ、1345ダ、だろう。 - 実験的に観察された質量のステップ5.7で生成された理論上の質量リストに一致する質量分析ソフトウェアを使用してください。低エラーで大衆を識別するために、大量のカットオフ点( 例えば 、50 ppm)を設定します。
- ペプチドが一致した場合、pLeuの実際の数がM LとM、Nは標識の質量であるステップ4.8(式3)、下の式を使用して組み込まれるかを決定それぞれ天然ペプチド。
結果
ここで、ssHDX-MSとのSspI-MSは、凍結乾燥されたMBの形成のコンホメーションおよび固体の相互作用に対する賦形剤の影響を研究するために使用されている。この研究で使用したタンパク質および賦形剤の濃度を表1に示す。上記のプロトコルが提示される以下によって得られる凍結乾燥MbからssHDX-MSとのSspI-MS分析からの代表的な結果。
無傷のタンパク質レベルでの重水素の取り込み
ssHDX-MSは、完全なレベルでMbの製剤との間で区別することができる。製剤のMBSからssHDXの144時間後の無傷のMbののデコンボリューション質量スペクトルは、製剤MBT( 図3A)よりも大きな重水素の取り込みを示した。平均では、MBSは、MBT( 表2)より46%大きい重水素取り込みを示した。
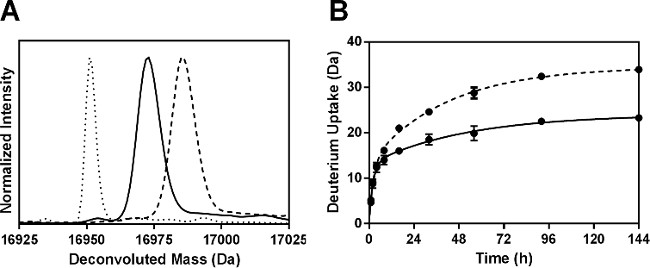
図3:ssHDX-MSインタクトMbのための:製剤からの重水素インタクトメガビットの(A)のデコンボリューション質量スペクトルは、MBT(実線)及びMBS(破線)ssHDXの144時間の後。非重水素化インタクトメガビットのデコンボリューション質量スペクトルはまた、(点線)を示している。 (B)の配合物中の無傷のMbのためssHDX動態MBT(実線)及びMBS(破線)。 ssHDXの時間経過(平均±SD、n = 3)のグラフパッドプリズムソフトウエアバージョン5を使用して、二位相指数関数的会合のための方程式に当てはめた。
無傷のMBSとMBT用重水素速度論は、初期の時点(1-4時間)で類似しているが、MBは、時間の増加とともに増加した重水素交換(8から144時間)( 図3B)を示した。これは、低いRHおよび温度条件下でssHDXに時間点を選択することの重要性を示唆している。また、D 2 O収着および拡散プロセスが早期に経口でssHDXの速度に影響を与える可能性整数。我々の以前の研究はssHDXにおける吸湿は時間で完了し、この時間を超えて反応速度を交換する最小の寄与を有することが示されている。為替の観察された速度と程度は、したがって、単にD 2 O adsorbtion 27,28の措置ではありません。三つの独立しssHDX-MSサンプルからの標準偏差を示す図3Bの小さなエラーバーは、実験の再現性が高いことを示している。
| 重水素取り込み(%)B | N 速い C | 高速の C k個 | N 遅い C | 遅い C k個 | |
| MBT A | 15.9±0.5 | 13.1(0.8) | 0.43(0.03) | 11.0(0.9) | 0。019(0.001) |
| のMBS A | 23.2±0.5 | 15.4(0.7) | 0.49(0.04) | 19.2(0.6) | 0.024(0.002) |
| %の変化dの | 46% | 18パーセント | 14% | 75パーセント | 26% |
表2:Mbの製剤のssHDX研究における重水素の取り込みの定量的尺度は、組成物については表1を参照して、理論的最大のbパーセント重水素取り込みを相対的に無傷のMbのことでHDXの144時間後に5°C、43%RH(n = 3の時。 、ssHDX-MS動態データの非線形回帰により決定される平均±SD)。Cのパラメータ。無傷のMbのための重水素交換の時間経過をbiexponential相関モデル(式2)に装着した。括弧内の値は回帰パラメータの標準誤差である。Dの測定値の変化率は計算学会でしたated 100×として[(MBSから値 - MBTからの値)/(MBTからの値)]。
MBTおよびMBSのための重水素の取り込み速度の回帰パラメータは、(N、高速 、Nが遅い 、 速い kおよび遅い k個) を表2に示す。N 早く N 遅い値がMBTよりMBS、N 遅いの違いのために大きくなっているものの値がN 速い値の違いよりも大きかった。 N 遅い値がMBTよりもMBSを75%以上であるのに対し、具体的には、N 速い値は、MBTよりもMBSでわずか18%大きい。これはMBT小さくN 遅い値によるMBSでD 2 Oに曝露される賦形剤によるMbの構造またはアミド基の保護の高い保持し得ることを示唆している。しかし、詳細なメカニズムは明確に理解されていない。両方の製剤についての速度定数(kは、高速と低速 kは)は非常に類似している。
ペプチドレベルでの重水素の取り込み
ペプシン消化後、52ペプチドの合計を同定した。 Mbの配列の100%に対応する6つの非冗長フラグメントはここで報告され、分析のために使用した。以前に24我々のグループによって報告された付加情報は、重複断片を用いることによって得ることができる。各ペプチドについての%重水素取り込みを算出し、144時間のサンプルからの結果( 図4A)をプロットした。 6消化性フラグメントのためのHDX動態は"速い"と"遅い"交換を受けてアミド水素の亜集団と一致して、( 図4B)biexponential挙動を示した。
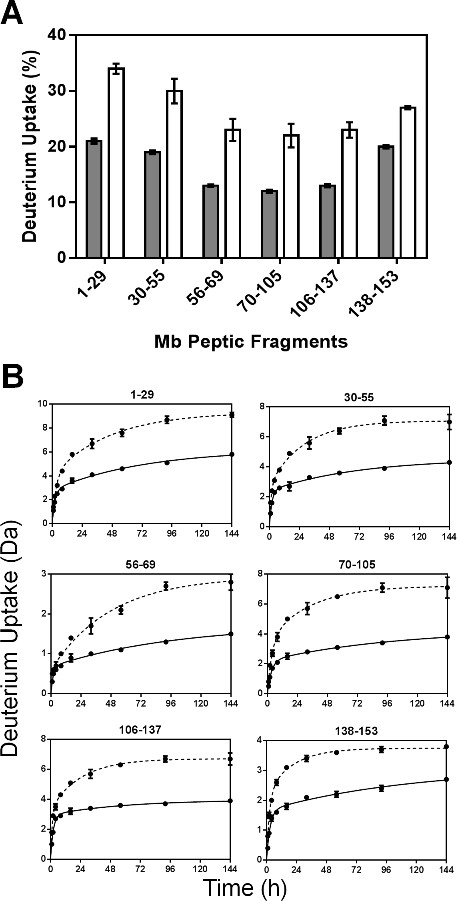
図4:ペプチドレベルでのMbのためのssHDX-MS:6非のReduのための(A)パーセント重水素の取り込みndant消化性製剤MBT(グレー)でMBからの断片およびHDXの144時間後MBS(白)。製剤中のMBから6非冗長消化性フラグメント(B)ssHDX動態MBT(実線)およびMBS(破線)。 ssHDXの時間経過(平均±SD、n = 3)のグラフパッドプリズムソフトウエアバージョン5を使用して、二位相指数関数的会合のための方程式に当てはめた。
非冗長ペプチドに対する回帰パラメータは、 図5に示されている。ペプチドフラグメントフィット速度定数は、個々のアミドの平均速度定数ではないので、消化フラグメントについて観察された速度定数は、直線的に無傷のタンパク質のためのものに関連することができない。製剤のMBS中(フラグメント56-69除く)消化性フラグメントのほとんどのためのN 速い値は、MBT( 図5A)のものよりもわずかに大きかった。同様に、K 速い値は一般formulatioの間にはほとんど差が認められたナノ秒とMbの分子の異なる領域( 図5B)。しかし、MBSのためのN ゆっくりとk 遅い値がMBT( 図5C及び5D)のためのよりすべてのフラグメントで有意に大きい。 MBSのために遅い N ゆっくりとkのかなりの増加は、「遅い」の交換プール中のアミド基の大きな移動度を反映することができる。
図5:ssHDX運動Mbの消化性ペプチドのためのパラメータ:N 速い (A)、(B)に 速い kはN 遅い (C)との配合物(灰色)MBTおよびMBSでメガビットから6つの非冗長消化ペプチドをssHDX-MS動的データの非線形回帰から得遅い (D)値をk個(白)(N = 3、±SE)。
無傷のタンパク質レベルでの光分解ラベリング
LC-MS( 図6A)によって検出されたMbは、複数Mbの-pLeu付加物を形成し、20倍過剰pLeuの存在下で照射した。 MBTのためのデコンボリューションスペクトルは20倍pLeuで40分間照射の非標識メガビットの質量115、230及び345 DAの追加で3ラベルに現れた。 20倍pLeuと同様に照射MBSはLC-MSにより検出し、最大2標識された集団と、無傷のレベル未満pLeuの取り込みを示した。
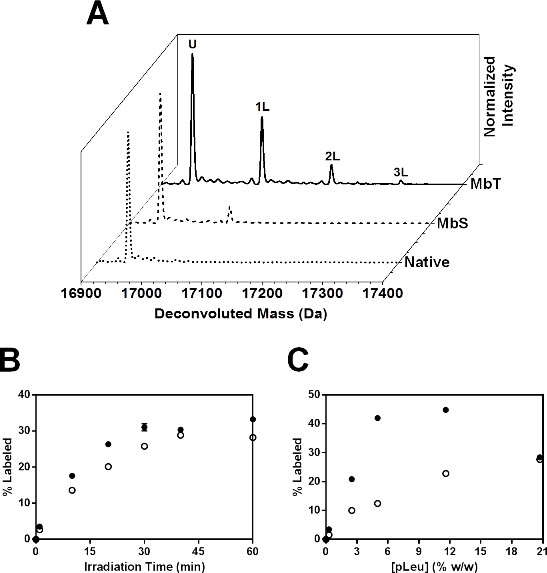
図6:SSPL-MSインタクトMbのための:MBT(実線)と20倍過剰の標識されたMBS(破線)は(A)のデコンボリューション質量スペクトルpLeu(の5%w / w)である。ネイティブMB(Mbが凍結乾燥し、pLeuの不在で照射)のデコンボリューション質量スペクトルは、点線で示されている。U の照射後の非標識のままタンパク質の人口を示している。 1、2及び3 pLeuラベルを運ぶタンパク質の集団は、それぞれ1L、2L及び3Lとして表される。製剤中の無傷のMbのための(B)のSspI-MS動態MBT(黒丸)とpLeu濃度の関数としてMBS(白丸)。すべての試料を40分間照射した。エラーバーは記号の範囲内である。凍結乾燥及び照射時間の関数としての100倍過剰pLeu(20.7%w / w)の存在下で照射製剤MBT(黒丸)における無傷Mbのための(C)のSspI-MS動態およびMBS(白丸)。エラーバーは記号の範囲内である。
動態研究では、標識されたタンパク質の割合が増加し、照射時間( 図6B)とMBTおよびMBSの両方に対して指数関数的に増加した。 MBSは、すべての照射時間でMBT未満pLeuの取り込みを示した。両方の製剤は、40分でプラトーに達するように見えた。このように、動力学的研究は、私たちすることができ完全pLeu活性化を得るために必要な照射時間を決定するeful。標識化の動態もpLeu濃度( 図6C)の関数として調べた。標識タンパク質の割合はMBTおよびMBSの両方のpLeu濃度と共に増加した。しかし、20.7%w / wのpLeuで、MBTはpLeu取り込みの減少を示した。これは、高pLeu濃度でタンパク質の表面からpLeuの排除に起因し得る。したがって、pLeuの濃度を変化させた研究では、表面排除することなく、タンパク質表面全体で十分なラベル付けを可能にし、適切なpLeu濃度を選択するために実施すべきである。本研究では、20倍過剰pLeuはさらに、ペプチドレベルの研究のために選択した。
全体的には、MBSのために観察された標識がpLeuを含む行列に貧しい側鎖のアクセシビリティを示唆して減少した。これは、縮小ラベリングをもたらすソルビトールの存在下でのコンフォメーション変化と一致している。
コンテンツ ">ペプチドレベルでの光分解ラベリングインタクトなタンパク質標識研究に基づいて、20倍過剰pLeuペプチドレベルでMBTおよびMBSを比較するために選択した。標識された試料は、トリプシンで消化し、LC-MSにより分析した。 Mbの配列の100%に相当する40ペプチドの総量は、MBTおよびMBS試料について検出された。 Lysおよび/またはArg残基が強く標識されている場合、一部のケースでは、トリプシン消化は、制限されたタンパク質配列のカバレッジを提供することができる。配列カバー率を向上させるために、トリプシンおよびキモトリプシンの混合物は、標識されたタンパク質を消化するために使用することができる。
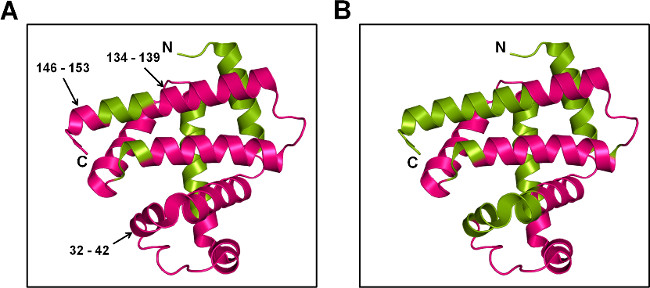
図7:ペプチドレベルでのMBのためのSspI-MS:Mbの漫画の表現はトレハロース(A)及びソルビトール(B)の存在下で、20倍過剰pLeu(5%重量/重量)で標識した。標識タンパク質はtrypsiで消化し、nおよび標識ペプチドメガビットの結晶構造(PDB ID 1WLA)へマッピングした。標識および非標識領域は、それぞれ、マゼンタと緑に着色されている。
トリプシン消化とSSPL-MSは、標識されているペプチドに関する定性的な情報を提供します。無傷のレベルで異なる標識集団与え、pLeu標識および標識および非標識ペプチドのイオン化効率の差の無差別機構は、それが消化後のSspI-MSのための定量的な指標を得ることは困難である。しかし、定性的な情報がまだペプチドレベルでのタンパク質立体構造変化への洞察を提供することができます。本研究では、MBTおよびMBS両方の製剤は、タンパク質表面の大部分にわたってpLeuの取り込みを示した。 MBS、ペプチドフラグメント32-42と比較した場合、MBTから134-139および146から153はpLeu標識( 図7)を示した。これは、これらのレジオでヘリックスとして、これらのアミノ酸の側鎖がpLeuにさらされていることを示唆しているNSはMBTマトリックスに無傷である。対照的に、MBSマトリックスにおけるpLeu標識からの保護は、これらの領域における構造的摂動と一致している。
全体として、ssHDX-MSとのSspI-MSの結果は、方法は、バックボーン(ssHDX-MS)と、凍結乾燥タンパク質製剤中の側鎖(SSPL-MS)露光および賦形剤の影響についての補完的な高分解能ペプチドレベルの情報を提供することができることを示唆している。
ディスカッション
いくつかの研究は、凍結乾燥試料中のローカル環境は、タンパク質分解5,29,30に影響を及ぼすことを示唆している。しかし、固体状態のタンパク質の構造と安定性との間の直接的な関係を確立することにより、高分解能の分析方法がないために可能ではなかった。凍結乾燥粉末のようなHDXとPLのような既存の高解像度の方法の適用は、ソリューション·プロトコルと慎重なデータ解釈の変更を必要とする。 HDX-MS及びPL-MSは、連続固体状態のタンパク質コンフォメーションを監視するために採用されている。ここで、他の場所27,28,31-33示す結果は、固体環境で高解像度のタンパク質コンフォメーションをモニタするこれらの方法の能力を実証した。データ解析における重要なステップは、溶液中で34-36標識から変化しないものの、実験およびデータ解釈の間に重要な考慮事項は、固体ケミに必要とされるCALラベリング。
標識試薬の選択は、ラベルのサイズとメカニズムに基づいている必要があります。 pLeuの比較的大きなサイズは、側鎖に標識化を制限するのに対して、重水素の小さなサイズは、ペプチド骨格を容易に調べることができます。標識は、マトリックス主鎖と側鎖の暴露にのみ依存するようにssHDXとSSPL両方は、任意のアミノ酸のための好みを示さない。効果的に固体中のタンパク質立体構造をプローブに、ラベリング処理に影響を与える外部要因を慎重に制御しなければならない。凍結乾燥された固体中の合計量と標識剤の空間分布は、水性溶液とは異なる。
ssHDXでは、固体マトリックス中のD 2 Oの量は、タンパク質のアンフォールディングの割合(または部分的なアンフォールディング)リフォールディング、および重水素交換に影響を及ぼし得る。これは、タンパク質試料は、通常、D 2 Oの十分な容積に希釈した溶液HDX、の場合ではありませんssHDX速度に対する水和の影響を注意深くスクリーニング理想RH条件の選択を通知することができる。吸湿速度を制御し、吸湿性の賦形剤( 例えば 、スクロースおよびトレハロース)を含有する製剤中に粉末の崩壊を避けるために、ssHDXは冷蔵条件下(2~8℃)で行うことができる。予想通りの水和効果に関する我々の以前の研究では、水分含有量の増加との交換の速度および程度の増加を示した。我々の研究の多くでは、5℃で43%の中間RHは、妥当な時間内に24の製剤を区別するのが理想的であることが証明された。プラトーに達するまで、反応は通常行われる。これは固体への水分の吸着と拡散がHDX速度を制御しないことを保証します。 ≤2ミリリットルの凍結乾燥前体積の小さな固体試料サイズの使用はまた、D 2 O蒸気収着早期交換期間中に本質的に完全であることを保証するのに役立つ。しかしssHDX-MSが提供する固体中のタンパク質の立体構造に関する定量的情報、データの解釈は完全に一人でssHDXの研究に基づいてすることができない一定の条件があります。これは、(対照と比較した場合)サンプルで観察された減少した重水素の取り込みは、タンパク質の構造または試料中に存在するタンパク質凝集物のかなりの量のより高い保持力に起因する可能性がある。このような場合には、ssHDXデータの解釈は、他の補完的な方法からの結果を必要とする。重水素化質量スペクトルのピークの広がりは数Mb製剤27,28のために観察された。これは、D 2 Oの濃度で試料中に部分的に折り畳まれたタンパク質の集団、空間的不均一性の存在、または空間的変化など様々な要因に起因する可能性がある。しかし、これらの要因はssHDX-MSで区別していなかったと、さらなる調査が必要である。
他の方法と比較した場合のSspI-MSは、比較的新しいもののように、継続的な学習ABそのアプリケーションと限界外に必要とされる。 SSPLでは、光架橋剤は、タンパク質を凍結乾燥する。水分の不足は、固体マトリックス内のコンポーネントの移動を制限し、ssHDXで水分収着で発生する可能性のある部分構造緩和がSSPLで現象ではない。これは、光架橋剤のすぐ近くにSSPL中の標識を制限します。しかし、HDX-MSとは異なり、共有結合的に標識されたタンパク質のMS / MS分析は残留レベルの構造的情報を提供することができる。 SSPL標識は、共有結合的および不可逆的であるため、バック交換が発生せず、試料を調製し、ラベルの喪失を心配することなく分析することができる。標識剤の拡散を促進し、固体マトリックス中の標識効率を向上させるために、SSPLが増加%RHで行うことができる。 pLeu取り込みはまた、光反応剤の濃度を増加させることによって改善することができる。必要に応じてpLeuに対するタンパク質のモル比を変化させることができる。一般的には、プロにpLeuの100倍モル過剰テインは、適切なラベル付けを保証します。しかし、高pLeu濃度は、固体マトリックス中のタンパク質の三次構造の喪失をもたらし得る。従って、標識化動態および処方物に加えて、pLeu濃度の選択は、タンパク質の構造的完全性を維持することに基づいていなければならない。 pLeu非選択的にラベルXH(X = C、N、O)基としては、類似の標識部位を有する賦形剤が大いにタンパク質標識のレベルに影響を与えることが可能である。タンパク質標識用pLeuの可用性における賦形剤の干渉はまだ特徴付けされるべきである。これは、ジアジリン活性化から生成されたカルベンは残基特異的ではないことが知られている、しかし、ある研究では、AspおよびGlu 36の方にバイアスを報告します。その残留物を、特異的相互作用について学ぶのが良いが、ペプチドレベルの情報も有用であり、固体状態での高いマトリックス曝露領域をブロックするための賦形剤を設計することができる。 SSPL-MSは、しかし、詳細な定性的な情報を提供します定量的データを取得する必要があり、強固なメトリックは、凍結乾燥された種々のシステム全体での製剤の違いを分析するために開発される必要がある。
MS / MS分析と組み合わせた残基特異的標識の使用は、アミノ酸レベルの解像度を向上させることができる。 2,3-ブタンジオンなどの標識試薬は、ArgがCysからLysおよびN -alkylmaleimide誘導体用のNヒドロキシスクシンイミド誘導体を正確に凍結乾燥粉末中の分子の相互作用をマッピングするために使用することができる標識する。しかし、これらの試薬は、pH依存性であり、反応は、固体で光分解標識として十分に制御できない場合があります。別のアプローチは、栄養要求性細胞株、部位特異的変異誘発または側鎖誘導体を用いてタンパク質配列に光架橋剤を組み込むことである。
我々の以前のssHDX-MSとのSspI-MS研究は、タンパク質の標識は、賦形剤の性質および量に依存することが示されている24,27,28,31-33,37,38を使用していました。メガビットのssHDX-MSは、塩酸グアニジン(Gdn.HCl)で凍結乾燥共同Mbは低分子量の糖32と共凍結乾燥よりも重水素取り込みを示した。個別のSSPL-MSの研究では、MbのGdn.HClとの共凍結乾燥し、ショ糖33 MBより光分解ラベリングからより大きな保護を示した。さらに、ssHDX-MSからの定量的な測定は、非常に長期の記憶装置28中のタンパク質の安定性と相関している。これらの研究は、タンパク質のssHDXまたはSSPL凍結乾燥粉末中のタンパク質の構造保持の程度を反映することを示唆している。私たちは、凍結乾燥粉末中の二次構造の保持が側鎖pLeuによる標識と重水素交換からアミド水素の保護のための良好な環境を得たと判断している。しかしながら、これらの方法の有益なコンテンツの詳細な比較は、将来的に行う必要がある。 ssHDX-MSとSSPL-MSの有用性を確立するものの製剤のスクリーニングツールとしてそれは多くのタンパク質に適用されることを最終的に必要になります、私たちの最近の研究の結果は、その広い採用をサポートしています。さらなる発展に伴い、これらの方法は、バイオ医薬品業界に固体タンパク質製剤を特徴付けるために広く有用であると期待される。
開示事項
The authors declare that they have no competing financial interests.
謝辞
The authors gratefully acknowledge financial support from NIH R01 GM085293 (PI: E. M. Topp) and from the College of Pharmacy at Purdue University.
資料
| Name | Company | Catalog Number | Comments |
| Equine myoglobin | Sigma-Aldrich | M0630-5G | |
| D-(+)-Trehalose dihydrate | Sigma Aldrich | #T9531 | |
| D-Sorbitol | Sigma Aldrich | #240850 | |
| L-Photo-leucine | Thermo Scientific | #22610 | |
| Potassium phosphate monobasic | Sigma-Aldrich | #P0662 | |
| Potassium phosphate dibasic | Sigma-Aldrich | #P3786 | |
| Deuterium Oxide | Cambridge Isotope Laboratories | #DLM-4-PK | Alternate (Cat. No.: 151882, Sigma-Aldrich) |
| Immobilized pepsin | Applied Biosystems | #2-3132-00 | |
| Trypsin | Promega | #V511A | Chymotrypsin (Cat. No.: #V1062, Promega) can be additionally used |
| Water, Optima LC/MS grade | Fisher Chemical | #7732-18-5 | |
| Acetonitrile | Sigma-Aldrich | #34998 | |
| Formic acid | Thermo Scientific | #28905 | |
| ESI-TOF Calibrant | Agilent Technologies | #G1969-85000 | Highly flammable liquid |
| Protein microtrap | Michrom Bioresources | TR1/25108/03 | |
| Peptide microtrap | Michrom Bioresources | TR1/25109/02 | |
| Analytical column | Agilent Technologies | Zorbax 300SB-C18 | |
| Freeze dryer | VirTis AdVantage Plus | ||
| Stratalinker equipped with five 365 nm lamps | Stratagene Corp. | Stratalinker 2400 | |
| HPLC | Agilent Technologies | 1200 series LC | Refrigerated LC system for HDX-MS |
| ESI-qTOF MS | Agilent Technologies | 6520 qTOF | |
| HDExaminer (HDX-MS data analysis software) | Sierra Analytics | http://www.massspec.com/HDExaminer.html |
参考文献
- Lawrence, S. Billion dollar babies--biotech drugs as blockbusters. Nat. Biotechnol. 25 (4), 380-382 (2007).
- . . Global Markets and Manufacturing Technologies for Protein Drugs. , BIO021D (2013).
- Lai, M. C., Topp, E. M. Solid-state chemical stability of proteins and peptides. J. Pharm. Sci. 88 (5), 489-500 (1999).
- Carpenter, J. F., Pikal, M. J., Chang, B. S., Randolph, T. W. Rational design of stable lyophilized protein formulations: some practical advice. Pharm. Res. 14 (8), 969-975 (1997).
- Carpenter, J. F., Chang, B. S., Garzon-Rodriguez, W., Randolph, T. W. Rational design of stable lyophilized protein formulations: theory and practice. Pharm. Biotechnol. 13, 109-133 (2002).
- Wüthrich, K. Protein structure determination in solution by NMR spectroscopy. J. Biol. Chem. 265 (36), 22059-22062 (1990).
- Ilari, A., Savino, C. Protein structure determination by x-ray crystallography. Methods. Mol. Biol. 452, 63-87 (2008).
- Brunger, A. T. X-ray crystallography and NMR reveal complementary views of structure and dynamics. Nat. Struct. Biol. 4, 862-865 (1997).
- Yu, L. Amorphous pharmaceutical solids: preparation, characterization and stabilization. Adv Drug. Deliv. Rev. 48 (1), 27-42 (2001).
- Manning, M. C. Use of infrared spectroscopy to monitor protein structure and stability. Expert. Rev. Proteomics. 2 (5), 731-743 (2005).
- Grohganz, H., Gildemyn, D., Skibsted, E., Flink, J. M., Rantanen, J. Rapid solid-state analysis of freeze-dried protein formulations using NIR and Raman spectroscopies. J. Pharm. Sci. 100 (7), 2871-2875 (2011).
- Bai, S., Nayar, R., Carpenter, J. F., Manning, M. C. Noninvasive determination of protein conformation in the solid state using near infrared (NIR) spectroscopy. J. Pharm. Sci. 94 (9), 2030-2038 (2005).
- Pikal, M. J., et al. Solid state chemistry of proteins: II. The correlation of storage stability of freeze-dried human growth hormone (hGH) with structure and dynamics in the glassy solid. J. Pharm. Sci. 97 (12), 5106-5121 (2008).
- Wang, B., Tchessalov, S., Cicerone, M. T., Warne, N. W., Pikal, M. J. Impact of sucrose level on storage stability of proteins in freeze-dried solids: II. Correlation of aggregation rate with protein structure and molecular mobility. J. Pharm. Sci. 98 (9), 3145-3166 (2009).
- Schule, S., Friess, W., Bechtold-Peters, K., Garidel, P. Conformational analysis of protein secondary structure during spray-drying of antibody/mannitol formulations. Eur. J. Pharm. Biopharm. 65 (1), 1-9 (2007).
- Baerga-Ortiz, A., Hughes, C. A., Mandell, J. G., Komives, E. A. Epitope mapping of a monoclonal antibody against human thrombin by H/D-exchange mass spectrometry reveals selection of a diverse sequence in a highly conserved protein. Protein. Sci. 11 (6), 1300-1308 (2002).
- Coales, S. J., Tuske, S. J., Tomasso, J. C., Hamuro, Y. Epitope mapping by amide hydrogen/deuterium exchange coupled with immobilization of antibody, on-line proteolysis, liquid chromatography and mass spectrometry. Rapid. Commun. Mass. Spectrom. 23 (5), 639-647 (2009).
- Pacholarz, K. J., Garlish, R. A., Taylor, R. J., Barran, P. E. Mass spectrometry based tools to investigate protein-ligand interactions for drug discovery. Chem. Soc. Rev. 41 (11), 4335-4355 (2012).
- Houde, D., Peng, Y., Berkowitz, S. A., Engen, J. R. Post-translational modifications differentially affect IgG1 conformation and receptor binding. Mol. Cell. Proteomics. 9 (8), 1716-1728 (2010).
- Houde, D., Berkowitz, S. A., Engen, J. R. The utility of hydrogen/deuterium exchange mass spectrometry in biopharmaceutical comparability studies. J. Pharm. Sci. 100 (6), 2071-2086 (2011).
- Dorman, G., Prestwich, G. D. Using photolabile ligands in drug discovery and development. Trends. Biotechnol. 18 (2), 64-77 (2000).
- Robinette, D., Neamati, N., Tomer, K. B., Borchers, C. H. Photoaffinity labeling combined with mass spectrometric approaches as a tool for structural proteomics. Expert. Rev. Proteomics. 3 (4), 399-408 (2006).
- Greenspan, L. Humidity fixed points of binary saturated aqueous solutions. Journal of Research of the National Bureau of Standards. 81A (1), 8 (1977).
- Sophocleous, A. M., Zhang, J., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 1. Exchange mapping. Mol. Pharm. 9 (4), 718-726 (2012).
- Keppel, T. R., Jacques, M. E., Young, R. W., Ratzlaff, K. L., Weis, D. D. An efficient and inexpensive refrigerated LC system for H/D exchange mass spectrometry. J. Am. Soc. Mass. Spectrom. 22 (8), 1472-1476 (2011).
- Gasteiger, E., et al. ExPASy: The proteomics server for in-depth protein knowledge and analysis. Nucleic. Acids. Res. 31 (13), 3784-3788 (2003).
- Sophocleous, A. M., Topp, E. M. Localized hydration in lyophilized myoglobin by hydrogen-deuterium exchange mass spectrometry. 2. Exchange kinetics. Mol. Pharm. 9 (4), 727-733 (2012).
- Moorthy, B. S., Schultz, S. G., Kim, S. G., Topp, E. M. Predicting Protein Aggregation during Storage in Lyophilized Solids Using Solid State Amide Hydrogen/Deuterium Exchange with Mass Spectrometric Analysis (ssHDX-MS). Mol. Pharm. 11 (6), 1869-1879 (2014).
- Wang, W. Lyophilization and development of solid protein pharmaceuticals. Int. J. Pharm. 203 (1-2), 1-60 (2000).
- Sarciaux, J. M., Mansour, S., Hageman, M. J., Nail, S. L. Effects of buffer composition and processing conditions on aggregation of bovine IgG during freeze-drying. J. Pharm. Sci. 88 (12), 1354-1361 (1999).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Characterizing protein structure in amorphous solids using hydrogen/deuterium exchange with mass spectrometry. Anal. Biochem. 366 (1), 18-28 (2007).
- Sinha, S., Li, Y., Williams, T. D., Topp, E. M. Protein conformation in amorphous solids by FTIR and by hydrogen/deuterium exchange with mass spectrometry. Biophys. J. 95 (12), 5951-5961 (2008).
- Iyer, L. K., Moorthy, B. S., Topp, E. M. Photolytic labeling to probe molecular interactions in lyophilized powders. Mol. Pharm. 10 (12), 4629-4639 (2013).
- Hentze, N., Mayer, M. P. Analyzing protein dynamics using hydrogen exchange mass spectrometry. J. Vis. Exp. (81), e50839 (2013).
- Kaltashov, I. A., Bobst, C. E., Abzalimov, R. R. H/D exchange and mass spectrometry in the studies of protein conformation and dynamics: is there a need for a top-down approach. Anal. Chem. 81 (19), 7892-7899 (2009).
- Jumper, C. C., Schriemer, D. C. Mass spectrometry of laser-initiated carbene reactions for protein topographic analysis. Anal. Chem. 83 (8), 2913-2920 (2011).
- Li, Y., Williams, T. D., Topp, E. M. Effects of excipients on protein conformation in lyophilized solids by hydrogen/deuterium exchange mass spectrometry. Pharm. Res. 25 (2), 259-267 (2008).
- Li, Y., Williams, T. D., Schowen, R. L., Topp, E. M. Trehalose and calcium exert site-specific effects on calmodulin conformation in amorphous solids. Biotechnol. Bioeng. 97 (6), 1650-1653 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved