Method Article
גישת העכבר עגול החלון לototoxic סוכן משלוח: מהיר וטכניקה אמינה גרימת ניוון תא שבלול
In This Article
Summary
Various methods exist for introducing ototoxic agents to the cochleae of animal models. Presented is a surgical protocol for delivery of ototoxic agents to the round window niche. The procedure is reliable, creates targeted intra-cochlear lesions, and avoids mechanical damage to the microarchitecture. Examination of cochlear self-repair/regeneration is possible.
Abstract
Investigators have utilized a wide array of animal models and investigative techniques to study the mammalian auditory system. Much of the basic research involving the cochlea and its associated neural pathways entails exposure of model cochleae to a variety of ototoxic agents. This allows investigators to study the effects of targeted damage to cochlear structures, and in some cases, the self-repair or regeneration of those structures. Various techniques exist for delivery of ototoxic agents to the cochlea. When selecting a particular technique, investigators must consider a number of factors, including the induction of inadvertent systemic toxicity, the amount of cochlear damage produced by the surgical procedure itself, the type of lesion desired, animal survivability, and reproducibility/reliability of results. Currently established techniques include parenteral injection, intra-peritoneal injection, trans-tympanic injection, endolymphatic sac injection, and cochleostomy with perilymphatic perfusion. Each of these methods has been successfully utilized and is well described in the literature; yet, each has various shortcomings. Here, we present a technique for topical application of ototoxic agents directly to the round window niche. This technique is non-invasive to inner ear structures, produces rapid onset of reliably targeted lesions, avoids systemic toxicity, and allows for an intra-animal control (the contra-lateral ear). Results stemming from this approach have helped deeper understanding of auditory pathophysiology, cochlear cell degeneration, and regenerative capacity in response to an acute injury. Future investigations may use this method to conduct interventional studies involving gene therapy and stem cell transplantation to combat hearing loss.
Introduction
חוקרים השתמשו במגוון רחב של מודלים של בעלי חיים כדי ללמוד את התפקוד התקין של מערכת השמיעה, כמו גם את הפתופיזיולוגיה של אובדן שמיעה. מודלים אלה הם גם מאוד שימושיים לביצוע מחקרי התערבות נגד תהליכים פתולוגיים שונים ומשמשים כבסיס ליישומי translational בבני אדם. עבור רוב המחקר מעורב השבלול והמסלולים השמיעתיים הקשורים אליו, במידה מסוימת של נזק או שיבוש חייבת להיות הציגה את המערכת. לעתים קרובות, הנזק מכוון בכוונה כדי ליצור נגע ספציפי, המאפשר לחוקרים לבחון את ההשפעה של נגע שעל תפקוד תקין, כמו גם את יכולת השבלול להתאושש מזה. בעת בחירת דגם מסוים של בעלי חיים ו / או טכניקה (ים) להחדרת נזק, מספר גורמים יש לקחת בחשבון על מנת להשיג את התוצאות הטובות ביותר האפשרית. מודלים של בעלי חיים שונים עשויים להגיב באופן שונה להתערבויות, ואילו השפעות הישירות ועקיפות של טכניקה יכולות להיותלחלוטין מזיק לתוצאה הרצויה. ברוב המקרים, פרוטוקול הנזק באוזן הפנימי האידיאלי יהיה למנוע רעילות מערכתית, במהירות ובאופן אמין לייצר נזק, ליצור נגע מדויק ועקבי, ולהיות לשרוד כדי לאפשר מחקר נוסף של שינויים תפקודיים, תאיים ומולקולריים. באופן אידיאלי, שיטות אלה היו גם לשמר את שיפועי מייקרו-ארכיטקטורה ואלקטרוכימיים העדינים של השבלול למידה המרבית האפשרית.
עד כה, חוקרים הצליחו בהקמת מספר הטכניקות כדי לגרום לפגיעה באוזן פנימית. רוב אלה כרוכים חושפים את השבלול לסוכן ototoxic או מערכתי או באמצעות גישה ניתוחית. טכניקות כוללות הזרקת parenteral, הזרקה תוך הצפק, הזרקת טרנס-התוף, הזרקת שק endolymphatic, וcochleostomy עם זלוף perilymphatic. טכניקות אלה היו בשימוש כדי להציג מגוון רחב של סוכני ototoxic, כגון פורוסמיד, גנטמיצין, ouabain, וheptanol. 1-5בעוד מוצלח ביצירת נגעי שבלול ספציפיים, הטכניקות לעיל גם הכירו את מגבלות. זריקות מערכתיות יכולות להיות רעילות מאוד לבעלי החיים ועשויות להיות קשורה עם עלבונות שבלול לא מכוון ותוצאות לא עקביות. החסרון האחרון גם נקשר עם זריקות טרנס-התוף. טכניקות כגון cochleostomy וזלוף perilymphatic, בעוד מסוגל גרימת נגעים מהירים ואמינים ביותר, הן באופן ישיר פולשנית למבנה אוזן פנימי ותפקוד. רבים מהגישות הכירורגיות קשורים גם עם רמה גבוהה של קושי טכני ועשויים לדרוש עוזבים חפצים זרים בבעלי החיים, כגון infuser micropump. 2-4,6-8 אין טכניקה אחת היא ללא חסרונות, וחוקרים צריכים לבחור שיטות בזהירות כדי שיתאימו לצרכימים הניסיוניים שלהם. כאן אנו מתארים, בפירוט, טכניקת יישום חלון הנישה העגולה (RWN) למסירה אקטואלית של סוכני ototoxic בעכברים בוגרים.
אינטרנט אלחוטיתיארו ראשון על ידי אח הוזמן אל בשנת 1998 בזמן לימודי ההשפעה של גנטמיצין על ניוון תא שיער חושי במודל עופות, טכניקה זו נמצאה מסוגלת לייצר נגעים באופן משמעותי יותר אמין יותר מאשר יישום גנטמיצין מערכתי, תוך הימנעות הרעילויות כרוכות בכך. 9 מאז, מספר חוקרים אחרים, כוללים המעבדה שלנו, ניצל את הטכניקה הזו להצלחה גדולה. בשנת 2004, Heydt et al. התאים אותו למודל של עכברים ותיארו יכולת משופרת לשלוט בגודל נגע על ידי מילוי RWN עם ספוג ג'לטין נספג ספוג בריכוזים שונים של גנטמיצין. 10 Palmgren et al., בשנת 2010, חקרו את השפעות ototoxic של בטא-bungarotoxin, חזק אלמנט בארס של הטיוואנית התאגדו ארגז, על ידי יישום צורה מימית שלו לRWN של חולדות מבוגרות. 11 בנוסף, מספר המחקרים קודמים מהמעבדה שלנו ניצל את גישת חלון העגולה כדי לחקור את ההשפעות של ototoxic furosemidדואר, ouabain, וheptanol. 5,6,12-15 תוצאות של מחקרים אלה הוכיחו את החשיבות של נוזל שבלול והומאוסטזיס יון בשמיעה נורמלית, גילה יכולת שגשוג תאים בגנגליון הספירלה וקיר לרוחב שבלול, וקדם את ההבנה שלנו הקשורות לגיל אובדן שמיעה.
הגישה הבאה כרוכה בניתוח בגישה לאוזן התיכונה דרך חתך postauricular וunroofing החלקי של הבולה התוף הגרמית. זה מאפשר לחשיפה מצוינת של RWN והקרום שסוכן ototoxic נבחר ניתן להחיל באופן ישיר. הסוכן הנוזלי אז בריכות בחלולות כמו הכוס-של RWN (או לאט מנקז מנישא ספוג ג'לטין רווי נספג ארוז בתוך RWN) ומפזר דרך הממברנה החלון העגולה לתוך חלל perilymphatic של פרוזדור השבלול. אין cochleostomy הישיר נעשה בגישה זו. יתרונות של שיטה זו כוללים שימור של אוזן הפנימית מייקרו-ארכיטקטורה, הימנעותרעילות מערכתית, קצבה של אוזן שליטת הפנים-חיה, הופעה מהירה של השפעה, ניוון סלקטיבית בסוגים מסוימים של תאי שבלול (למשל., סוג אני ספירלה נוירונים גנגליון עם חשיפת ouabain וסוג השבלול השני fibrocytes הנגרם על ידי הטיפול בheptanol), ותוצאות לשחזור / אמינות. טכניקה זו יכולה להיות מיושמת עם כמה שינויים בין מיני מכרסמים אחרים, כוללים חולדות, חזירי ים, וגרבילים. חסרונות כוללים עקומה תלולה טכנית למידה וההגבלה היחסית של עלבון ototoxic שמוגבלת לנקודה אחת בזמן.
Protocol
כל ההיבטים של מחקר בבעלי החיים נערכו בהתאם להנחיות הוועדה מוסדית טיפול בבעלי חיים והשימוש המתאים. כל הליכי הניסוי בבעלי החיים בעלי חוליות שתוארו כאן אושרו על פי ההנחיות של האוניברסיטה הרפואית של הוועדה (MUSC) מוסדי הטיפול בבעלי חיים ושימוש של דרום קרוליינה (IACUC).
בחירת 1. דגם
- לשמור על מודל החיה בביבר רעש נמוך עם מטפל שיגרתי לפרוטוקולים מוסדיים עד מוכן לשימוש. במחקר בבעלי החיים מתקנים (ARFs), לשמור על יציבות רטט, רעש דעיכת, תאורה יומית, חלל הכנה, גימורי משטח, איטום ואטים, ואוורור העומד בסטנדרטים NIH.
הערה: הנחיות (NIH) המכונים הלאומי לבריאות לARFs ותחזוקה של ביבר רעש נמוך ניתן לעיין בכתובת: http://www.orf.od.nih.gov/PoliciesAndGuidelines/BiomedicalandAnimalResearchFacilitiesDesignPoliciesandGuidelines/ - לכל הניסויים, להשתמש באוזן ימין כאוזן הניסיונית. האוזן השמאלית משמשת כשליטת הפנים-חיה, והוא לא שינה בניתוח.
- בדוק את בעלי החיים המודל מראש אופרטיביים לסימנים של דלקת אוזן התיכונה או חיצונית. פוטנציאל סימנים עשויים לכלול ניקוז של נוזל או מוגלה מהאוזן, רקמה מודלקת פינה, ו / או עייפות של בעלי החיים. זה הוא יוצא דופן, אבל אם ציין, להימנע מניתוח נוסף וטיפול בבעלי החיים כראוי.
2. נהלים לפני ניתוח
- להרדים את החיה דקות 30 לפני ניתוח וכל הליכים ניתוחיים באמצעות הזרקה תוך הצפק (IP) של קטמין (100 מ"ג / קילוגרם IP) וxylazine (20 מ"ג / קילוגרם IP). להשלים הרדמה כנדרש, כמו להישפט על ידי רפלקס הבוהן קמצוץ חיובי, עם מינון נמוך של קטמין (25 מ"ג / קילוגרם IP) וxylazine (5 מ"ג / קילוגרם IP). לקבוע מינון בהתאם לפרוטוקולים אפשרו מוסדי לעכברים עם התאמות מתאימות גיל במינון.
- בדקו ים מלאedation של המודל. בדקו שלב מטוס 3 של הרדמה לשלמות של הפרוטוקול המתואר בסימן קצב נשימה רגיל, רפלקסים חוסר ליישר רפלקס (בעכברים), וחוסר הדוושה וpalpebral (הבוהן קמצוץ). לשמור על בעלי החיים ברמה זו של הרדמה. זה הוא בעל חשיבות עליונה למזעור כאב ותנועה תוך ניתוחית, דימום, ודליפה של נוזלי ביניים במהלך ניתוח.
- לשמור על טמפרטורת הגוף של בעל החיים ב37.5 מעלות צלזיוס עם כרית חימום לולאה סגורה.
- לנהל שיכוך כאבים באמצעות הזרקה תת עורית של עצירות. לספק עצירות (0.1 מ"ג / קילוגרם SQ פעם 30 דקות לפני הניתוח) כשיכוך כאבים כדי למזער את אי נוחות כירורגית. מינון בסיס וחלופות מתאים למודל שנבחר על פרוטוקולים שאושרו מוסדי. שימוש באנטיביוטיקה הוא לא הכרחי אם טכניקת aseptic טובה כבר התאמן. בעלי החיים מקבלים שיכוך כאבים שלאחר ניתוח, אם יש סימנים של כאב ומצוקה.
- בצע phבדיקות לפני ניתוח ysiologic. ביצוע בדיקות שמיעה תגובת גזע המוח (ABR) ו / או מוצר עיוות בדיקת פליטת optoacoustic (DPOAE) שני קדם-אופרטיבי ורק לפני להקריב של בעלי החיים משמש כמדידה אובייקטיבית להשפעתו של סוכן ototoxic נבחר על השמיעה של העכבר.
3. הכנה ומיקום כירורגי
- לעקר את כל המכשירים מראש אופרטיבי לתקנים מוסדיים. הכן מכשירים ותחום כירורגית באופן עקבי, סטרילי, ומאורגן, כדי למנוע מאמץ מיותר ותנועה במהלך ההליך. מכשירים טיפוסיים הנדרשים כולל מספריים לנתח חדים, כמה זוגות מלקחיים מתכתיים עם הטיפים של צורף, בחירת otologic, מגרדת otologic, ויחידה דו קוטבית electrocautery (איור 1).
- הכן ולעקר פתילות נייר עשויה מlabwipes מראש על ידי חיתוך פיסה משולשת קטנה של לנגב (~ 0.7 x 1.25 בx 1.75 ב) וסובב אותו בחוזקה בין האגודל והאצבע של יד אחת (~ 1.25 ב). יצירת פתיל חוזקה מעוותת, דק מאוד היא בעל חשיבות עליונה להצלחה של ההליך. הכן כולל של 15-20 פתילות לפני הניתוח (איור 2).
- השתמש במקדח שיניים ללנקב במהירות את העצם של הבולה התוף בצורה מבוקרת. שימוש בשיני מקדח יד מונעת חגורה עם טיפ 1 מ"מ או 2 מחודד עדיפה. מיקרוסקופ ניתוחי יש צורך להשלים את הפרוטוקול. (ראה שלב 4.7)
- טרום לצייר 0.2 מיליליטר של תמיסה מימית המכילה את סוכן ototoxic נבחר לתוך מזרק טוברקולין 1 מיליליטר עם 28 G, מחט 1/2 ". ירידה בדרך כלל 1 (~ 10 μl) של הסוכן היא מספיק כדי למלא את RWN העכבר לחלוטין. מתכתי, מחט מזרק קצה קהה מקלה את המסירה של הסוכן תוך מניעת נזק לבסיס מבנים על ידי קצה שיפוע חד. לגרש את כל אוויר בתוך המזרק כמו בועות יכולות בטעות למלא RWN ו / או למנוע ראוייישום של הסוכן לחלון העגול עצמו.
- הסר פרווה מהעור לאחר אוזן באמצעות קוצץ טיפוח חשמלי. הסר פרווה באזור המשתרע מקמט auriculo-כאפאליך rostrally לcaudally חגורת כתפיים. להאריך הסרת שיער מהגב, קו האמצע sagittal לזווית הלסת רוחבית. הסרת פרווה נכונה היא בעל חשיבות עליונה לשמירה על שדה ניתוח נקי וברור. בעדינות לצחצח קטעים מהאתר כירורגי שנועד.
- לעקר עור של אזור מוכן לפרוטוקולים מוסדיים. החל בטאדין (povidone / יוד) לסירוגין עם אתנול המריחה באופן מעגלי למשך 2 דקות. סוכנים אחרים ניתן להחליף בהתאם להנחיות מוסדיות.
- מניחים את החיה על משטח שטוח כדי לשמור על מיקום גוף קבוע במהלך ההליך. השתמש בכרית חימום קטנה ממוקמת מתחת לגוף על גבי הפלטפורמה לשלוט בטמפרטורת גוף במהלך ההליך כדי לשמור על טמפרטורת הגוף של בעל החיים ב36-38 מעלות צלזיוס. אל אובהrheat בעלי החיים כמו זה עלול להוביל למיתון עד נזק חמור בעור ו / או המתת חסד מוקדמת.
- לאבטח את ראשו של בעל החיים באמצעות מנגנון בעל בלוק נשיכה / ראש. לנצל 0.5 סנטימטר על ידי גוש ביס 2 סנטימטר במכונה מפליז עם 2-4 חורים בקוטר מ"מ קדח דרכו במרווחים של 5 מ"מ לאורך ציר זמן. פתח את הפה של החיה סביב המתקן הזה ולהתאים את השיניים החותכות העליונות המרכזיות לאחד החורים בהתאם לגודל של החיה. בעדינות להדק מהדק קטן על dorsum של החוטם של בעל החיים כדי להחזיקו במקום (איור 3).
- ודא שבעל בלוק / ראש הביס מחובר בנוקשות למרכז זרוע בצורת U לבטא (איור 3). Secure מוט רחב 1cm לזרוע השמאלית של "U" ולהשתמש במוט כמשענת ראש בצד שמאל (בצד ימין הוא תמיד בצד האופרטיבי).
- ברגע מאובטח היטב בבעל הראש, לסובב את העכבר למיקום פַּחֶסֶת רוחב עזב. מקם את carefu הגוףlly על פני השטח ההפעלה השטוח כדי להבטיח שהיא תהיה יציבה לאורך כל ההליך ולמנוע לחץ מיותר על torsional חוליות צוואר.
- מקם מיקרוסקופ מסוגל 4x, 10x, והגדלת 20x על שדה הניתוח. ודא שמיקרוסקופ יכול לשמור על מיקומה באופן דיבורית כמו זה הוא אידיאלי עבור הפרוטוקול כירורגית בשני הידיים בהמשך.
- הנח יחידת כויה המאפשר דו קוטבית עם יד החתיכה של תכשיטי קנס היטה בעמדה שהיא זמין באופן מיידי לסיוע בצריבה של כלי דם קטנים ונתיחה של רקמה. זה יכול להיות גם צורך צריך להיות דימום כבד נתקל.
4. גישה ניתוחית
- בהגדלה מיקרוסקופית, להשתמש במספריים חדים או סכין אזמל כדי ליצור חתך postauricular 1-1.5 סנטימטר, כ 6-8 הזנב מ"מ לקפל auriculocephalic. בעכבר הבוגר, חתך מקו אמצע הגברוחבי לנקודה קרובה הזווית של לסת תחתונה הוא נאות. להימנע בזהירות חיתוך עמוק לשמר מבנים וכלי דם בסיסי.
- לנהל נתיחה בוטה זהירה דרך שכבת השומן תת עורי שיכול להיות בעובי משתנה. שומן ניתן להסיר בבטחה במידת צורך לחשיפה משופרת. קח בזהירות בעת לנתח בכיוון הגחון-המדיאלי כוריד הצוואר החיצוני חוצה אזור זה ונזק למבנה זה עלול לגרום לכמויות גדולות של איבוד דם והצפה של התחום כירורגית. לשלוט בכל דימום מוגזם עם ספוגים נספגים ג'לטין ו / או כדורי צמר גפן. השתמש כויה דו קוטבית לדימום כבד.
- ברגע ששכבת השומן מחולקת כראוי, לחשוף את שרירי צוואר הרחם. הערה חשוב מבנים כוללים גוף הגדול שריר של cleidomastoideus המרכזי בתחום הניתוחי החשוף, וריד הצוואר החיצוני ventrally, ורקמת הפרוטיד rostrally שמעל הזווית של לסת תחתונה. ציון דרך חשובה היא branc עצב קטןh (של עצב XI גולגולת) שעוטף את הקצה האחורי / גב של cleidomastoideus להאריך rostrally לעבר פינה (איור 4).
- בעדינות לחזור בי גוף שריר cleidomastoideus בכיוון אחורי / גב (איורים 4, 5). בעדינות לחלק את fascia השקוף העוטף את גוף השרירים. באופן דומה, בעדינות לחזור בי הפרוטיד ווריד הצוואר חיצוני בכיוון ההפוך (קדמי / הגחון) (איור 5).
- עם נסיגה טובה של גוף שריר cleidomastoideus, הכיפה המבריקה של periosteum הבולה התוף תגיע לעין (איור 6). בהיבט הזנב של הבולה, החדרת שרירים צוואר רחם עמוק יותר, sternomastoideus, תיכנס לתצוגה (איור 6). לשמר את עצב הפנים, שהופך לגלוי בגב וההיבט מקורי של כיפת הבולה. הנח מפשק שמירה עצמית (טיטניום סטרילי shaft-- משובץ בסיליקון חד פעמילהדביק) לפני הקידוח.
- בעזרת טכניקה בשתי ידיים, בעדינות לחלק את periosteum הבולה עם דיאתרמיה דו קוטבית לחשוף את העצם שמתחת. בעזרת מלקחיים או מגרדת otologic, בעדינות לרומם ולדחוף את periosteum בכיוון פריפריה לחשוף נרחב כיפת הבולה.
הערה: שלב 4.6 הוא קריטי על מנת למקסם את המבט כירורגית של חלל האוזן התיכון. לנצל טיפול ברקמות רכות מוקפד ועדין, כדי למנוע דימום ו / או דליפה של נוזל ביניים לתוך חלל הבולה לאחר קידוח. - עם כיפת בולה נחשפה כראוי, לקדוח חור טייס 2 מ"מ דרך עצם הבולה עם מקדחה כירורגית שיניים בין שולי הזנב של הכיפה והקו בעליל האטום (המייצג את התוף) המשתרע על פני ההיבט מקורי של הבולה (איור 7). דואג לקדוח רק דרך עצם לשמר מבנים בסיסיים, כגון עורק stapedial. לקדוח חור טייס שני סמוך כדי להקל בלתי קירוי של עצם הבולה ( איור 7).
- בעזרת זוג המלקחיים הקצה של צורף, uncap עצם הבולה בגב וכיוון הזנב (איור 8). הסר את העצם באופן הדרגתי בהגדלה גבוהה. אין לנקב את עורק stapedial, הנמצא ישירות מתחת לכובע הבולה, כדימום מעורק זה עלולה לפגוע בהליך. למזער את כמות העצם הוסרה כדי למנוע כניסת נוזלים מוגזמת לאוזן התיכונה תוך שהוא מאפשר להדמיה מצוינת וגישה לחלון הנישה העגולה (איור 8).
5. עגול חלון יישום של ototoxic סוכן
- לבצע התאמות סיבוביות עדינות לבעל הראש להביא RWN ישר לעיני. RWN ממוקם בדרך כלל בגב והיבט הזנב של חלל האוזן התיכון ומופיע כindention כמו כוס-של עצם כמוסת otic. ברוב המקרים, את עורק stapedial פועל 1-2 מ"מ הגחון / מקורי לזה. RWN יכול לפעמים להיות TUCked שולי תחת זוות החריפה של כיפת הבולה. במקרים כאלה, מיקום זהיר של הראש של החיה הוא בעל חשיבות עליונה.
- שימוש בפתילות הנייר שהוכנו לפני ניתוח, להסיר את כל הנוזל הגלוי באוזן התיכונה ועד עצם RWN יבש דמיין.
שים לב: זהו השלב הקריטי ביותר של כל הפרוטוקול, כ~ 10 μl (1 טיפה) של סוכן ototoxic להחיל RWN בקלות יכולה להיות מדולל בנוזל זה.
- שימוש בפתילות הנייר שהוכנו לפני ניתוח, להסיר את כל הנוזל הגלוי באוזן התיכונה ועד עצם RWN יבש דמיין.
- תחת הגדלה המרבית, להשתמש במחט בקוטר קנס על מזרק טוברקולין 1 מיליליטר להחיל טיפה אחת (~ 10 μl) של סוכן ototoxic ישירות לRWN, ממלא אותו לחלוטין. יש להיזהר שלא לשבש את עורק stapedial ולבחון מקרוב להחלפת השתקפות אור קטנה בבסיס של נישה יבשה עם המניסקוס נוזל עמום ומעורפל כמו מחוון שהנישה מתמלאת כראוי.
- לאפשר הסוכן לנוח בתוך RWN לזמן חשיפה של כ -10 דקות. אחרי זה, w לחלוטיןאיכס את הסוכן ולהחליף אותו עם יישום חדש מאותו הסוכן. לקבוע חזרות של יישום על פי מפרט סוכן. זמן חשיפה כולל בהליך זה נע בדרך כלל בין 30 עד 60 דקות.
- בסופו של ההליך, פתיל לחלוטין משם סוכן פעם האחרונה ולהחיל סוכן טרי לRWN. השאר את הבולה הסירה את המכסה ולהשתמש במלקחיים כדי לסגור את הרקמות הרכות על האתר כירורגית.
- לאטום אתר כירורגית ברמה של העור עם 4-0, תפר monofilament אינו נספג. מניחים את החיה בכלוב התאוששות / תחנה. לפקח על המצב הקליני של בעלי החיים לאחר הניתוח באופן קבוע. לשמור על בעלי החיים בתנאי הסביבה מתאימים, כוללים דיור עם מצעים רכים ותוספי מזון רך, כדי למזער את הלחץ. לקבוע נהלי עתיד ותנאים שלאחר ניתוח על פי פרוטוקולי IACUC המוסדיים.
- להשתמש בפרוטוקולי IACUC מוסדיים לעקר מכשירים לפני השימוש בבעלי החיים הבאים. לאפשר לזמן קירור ראוי בין שימוש מכשיר.
6. נהלים לאחר ניתוח וקציר רקמות שבלול
- כפי שמתואר בשלב 2.5, לבצע בדיקה פיזיולוגית של שמיעה לאחר הניתוח בנקודות רצויות ולפני להקריב. בצע את ההליכים לאחר ניתוח על פי מטרות ניסוי. להקריב בעלי החיים בכל יום לאחר ניתוח רצוי.
- על הרדמה מלאה באמצעות הזרקת IP, כנדרש לפרוטוקולי IACUC מוסדיים, להקריב בעלי החיים. בעזרת מספריים חדים, לערוף חיה רק הזנב לעורף. חדות לפתוח את הכספת של גולגולת עם מספריים לאורך הגב וקו אמצע הגחון והתפשט באופן נרחב. בעדינות לגרוף את רקמת מוח כדי לחשוף את העצמות הזמניות.
הערה: מספר הנהלים לחקירה של שינויים שלאחר חשיפה בשבלול יכול להסתעף מנקודה זו ויהיה מוזכר בסעיף הדיון. לקבוע את שיטת החקירה relevan ביותרלא למטרות הניסוי. אם מיקרוסקופ אלקטרונים מתוכנן לאחר השבלול הם מחולק, להשתמש צנתור מראש לתקן את הרקמות. זה מעבר להיקף של הדיון הזה וכבר מכוסה בעומק במקום אחר. 13 - חותך את העצמות הזמניות מחוץ לבסיס הגולגולת עם המספריים והניחו מייד בפתרון מקבע. לטבול את העצמות ישירות בparaformaldehyde 4% עבור 1.5 שעות ב RT. צג זמן קיבעון, כמשך זמן ארוך יותר יכול להגביל את התוצאה של ניתוח היסטולוגית בצעדים מאוחר יותר. Decalcify גזור עצמות לתקופה משתנה של זמן באמצעות טבילה בחומצת 1 מ"מ Ethylenediaminetetraacetic (EDTA).
תוצאות
במחקר שנערך לאחרונה על ידי סטיבנס et al ניצול הפרוטוקול לעיל, עכברי CBA / CaJ מבוגרים משני המינים נחשפו באמצעות חלון דיפוזיה העגולה לheptanol. 15 Heptanol הוא בלתי-מצמד צומת פער ידוע לייצר ממוקדים, פגיעת ההשבה לתאים של קיר לרוחב שבלול. מטרת המחקר הייתה לייצר מודל אמין לנזק שבלול ממוקד, המאפשר לחקירה של התחדשות לאחר ניתוח של כל גורמים שנפגעו. ספי שמיעה ניתוחי פוסט טרום ניתוחיים ושימשו כנקודת קצה פונקציונלית. מיקרוסקופית וטכניקות צביעת immunohistochemical שמשו ללמוד שינויים מורפולוגיים. עליות משמעותיות בסף ABR נצפו בעכברים שטופל heptanol (איור 9). בעלי החיים שליטת קבלת ניתוח דמה, עם משלוח של תמיסת מלח במקום heptanol, לא הפגינו משמרות סף משמעותיות בכל תדרים נבדקים.
Immunostaining נגד תיקון כלפי פניםערוץ אשלגן (Kir) 4.1 שימשו כשיטת עקיפה להמחשת נזק / התאוששות של מבני שבלול. זה הוכיח הבדלים מאוד לשחזור בין אוזני טיפול ושליטה. עוצמת צביעה בסך הכל הייתה במידה ניכרת ירד בvascularis stria (STV) ובין fibrocytes של רצועת הספירלה (SLF) 1-3 ימים לאחר חשיפת heptanol, המציין כמויות גדולות של נזק ממוקד לאזורים אלה. חלה ירידה מסוימת בעוצמת 4.1 צביעת קיר, באזורים מהסוג השני והסוג הרביעי SLFs (איור 10) וSTV (איור 11). עדות לשלמות שיבשו גרעינית ועיבוי כרומוזומליות / שלפוחיות אופייניות לאפופטוזיס הסלולרי נתפסה גם על counterstains הגרעיני באזורים אלה שבלול (איור 10). אזורי Vacuolated של קיר, 4.1 מכתימים נפתרו במידה ניכרת ב7 ימים ונעדרו לחלוטין בגיל 14 ימים. כאשר 4.1 עוצמת צביעת הקיר, הייתה לכמת בתחומי STV, אוזניים טופלו הפגינו initiשוקת אל ואחרי שינוי משמעותי (p <0.05) חזרה לכיוון עוצמת שליטה 7 ימים לאחר חשיפת heptanol (איור 12).
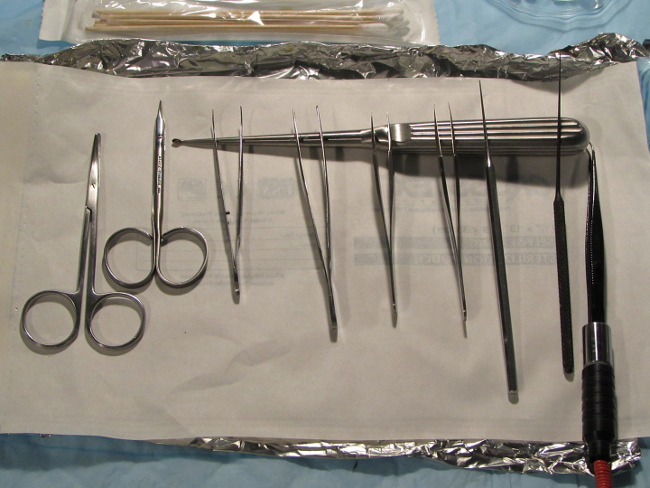
מכשיר 1. איור להגדיר. תיאור של הגדרה טרום ניתוחית של מכשור. כל הציוד צריך להיות נגיש בקלות בתחום ניתוח סטרילי. מכשור טיפוסי כולל 2 מספריים חדים לנתיחה, 2-3 ישר ו / או מלקחיים של Jeweler קצה המעוגל עם מגרדות אוזן, מרים otologic פיר מעוגל (מאוחר יותר הוחלף עם רוזן מרים - לא מוצג), ויחידת אלקטרו-כויה עם המלקחיים של Jeweler קצה המעוגל בסדר כיסוי ראש. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2. אספקה כירורגי. אספקה נוסף לשמירה על איכות סביבת RWN. מגזרות labwipe מעוקרות להיווצרות פתיל נייר (משמאל), נייר בנוי היטב פתילות עשויים ממגבונים מעוקרים מעבדה (במרכז), ו -4 כדורי כותנה מ"מ (מימין) משמש כדי לנגב את נוזלים עודפים והצפת דם בחלון הנישה העגולה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 3. בעל ראש בעלי חיים. תמונה המתארת את בעל הראש ובלוק נשיכה. החורים בבלוק להתאים ולאבטח את השיניים החותכות העליונות המרכזיות. מהדק מתהדק בעדינות על חוטם הגב כדי לאבטח את בעלי החיים במקום. שימוש בבעל ראש הוא קריטי עבור outc כירורגית מוצלחשת. באופן אידיאלי, זה צריך להיות מסוגל לסובב על הציר מקורי, הזנב של החיה כדי לייעל צפיות כירורגית של הבולה במהלך ההליך. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
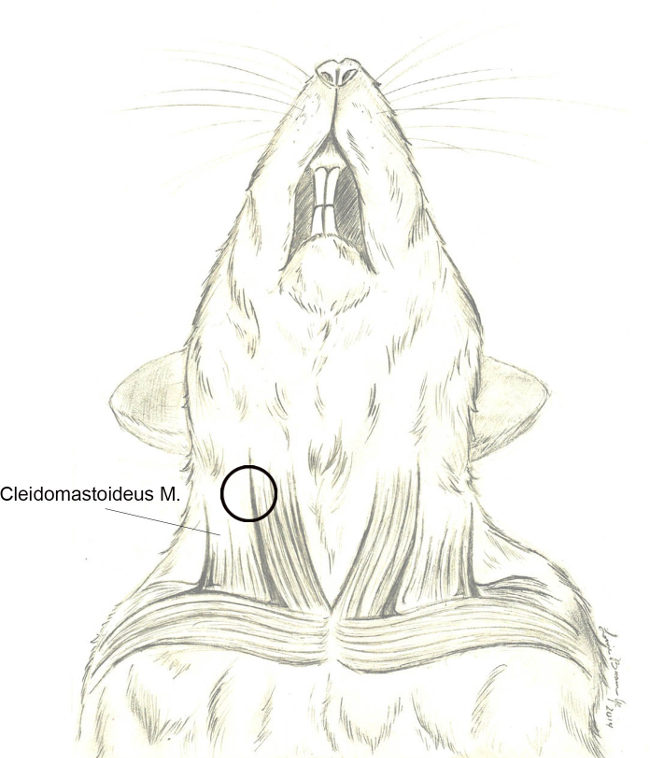
איור 4. מ 'Cleidomastoideus.. גרף סכמטי המתאר את האנטומיה הבסיסית של שרירי צוואר רחם המכרסמים והקשר שלה עם וריד הצוואר החיצוני. שריר cleidomastoideus הוא השריר הכי המזוהה בקלות בגישה הניתוחית. שחרורו של fascia העוטף אחרי נסיגה אחורית / גב של גוף השריר ינחה נתיחה כירורגית כלפי הבולה התוף (העיגול שחור). אנא לחץ כאן לצפייה באלגרסת arger של נתון זה.
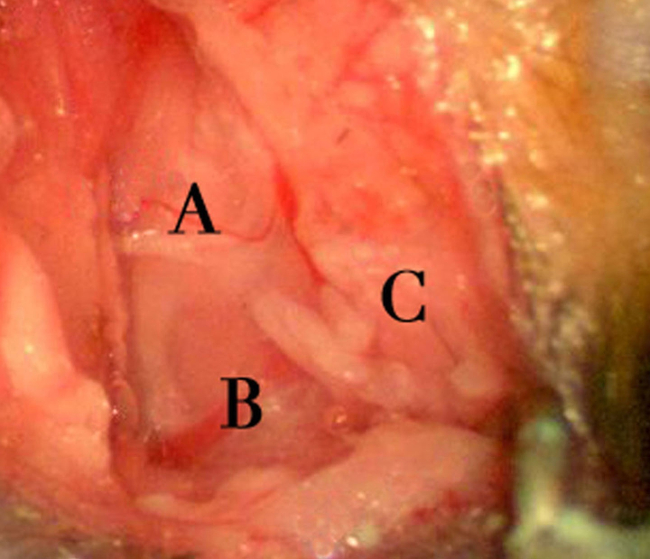
איור 5. אזור חשיפה כירורגית. מתאר את החשיפה לאחר הנתיחה דרך שכבות שומן תת עורי עורי ו. ציוני דרך מבניות של פתק כוללים סניף של XI עצב גולגולת שמעל שריר cleidomastoideus (), וריד הצוואר החיצוני (B), ורקמה חשופה הפרוטיד (C). סניף XI עצב הגולגולת קשור לעתים קרובות עם כלי שיט קטנים וחייב להיות מחולק לפני ההליך. מימין לשמאל בתמונה מתאימה לציר מקורי, הזנב של החיה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
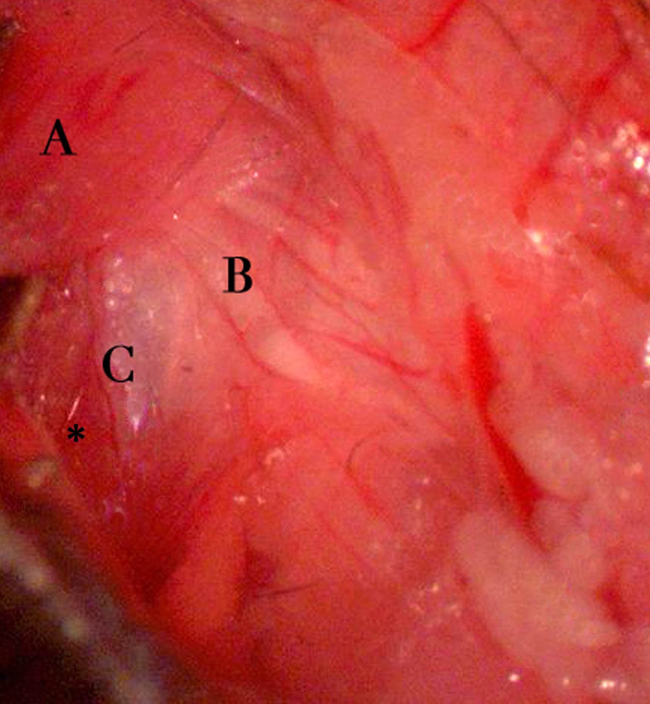
איור 6. חשיפת buLLA. חשיפה של הבולה התוף לאחר נסיגה של cleidomastoideus ומבנים סמוכים. ציוני דרך בולטים ניתן למנות גוף שריר cleidomastoideus () בא לידי ביטוי בדיעבד / dorsally, עצב הפנים (ב '), והכיפה המבריקה של periosteum התוף הבולה (C). כמו כן, שים לב לכניסה של שריר sternomastoideus בהיבט הזנב השמאלי של הבולה התוף (הכוכבית). נוכחותו של עצב הפנים בהיבט הגב ומקורי של הבולה היא ציון דרך קריטית לזיהוי נכון של הבולה. מימין לשמאל בתמונה מתאימה לציר מקורי, הזנב של החיה. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
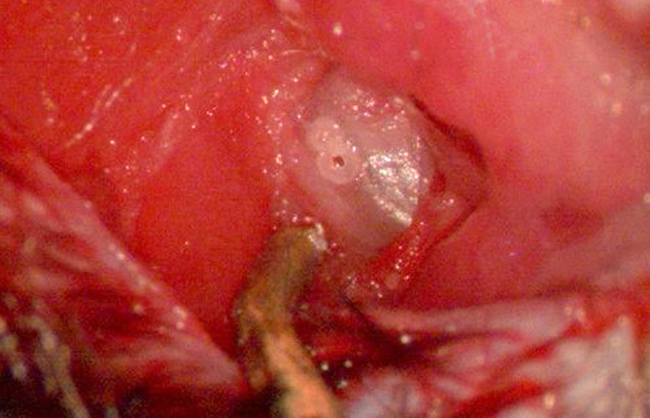
איור 7. חשיפת חלון נישה עגולה אני. תמונה המתארת את tympaהבולה NIC נחשפה במלואו לאחר הנתיחה של periosteum שמעליה. חור הטייס ממוקם הטוב ביותר בנקודה באמצע הדרך בין קצה הזנב של כיפת הבולה וקו עדין אטום דמיין בתוך ההיבט מקורי הבולה (המייצגת את התוף). חור טייס שני, סמוך עשוי להקל בלתי קירוי קל יותר של עצם הבולה. הימנעות מקידוח עמוק יש לנקוט כדי לא לפגוע בעורק stapedial הבסיסי. האובייקט בחלק התחתון של התמונה הכהה, המתכתי הוא מפשק רקמות רכות טיטניום. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 8. חשיפת חלון עגול נישה השנייה. בולה הסירה את מכסת התוף עם חשיפה של הנישה העגולה חלון (חץ) ועורק stapedial (מבנה אדום1-2 מ"מ לרוחב הנישה) כפי שנצפה בהגדלה 20x. הנישה לעתים קרובות מטילה תחובה מתחת לזווית החדה שהוקמה על ידי כיפת הבולה עם הקפסולה otic בהיבט הזנב של הכיפה. זה הכרחי כי הדמיה מלאה של הנישה תושג לפני היישום של סוכן ototoxic או הפתילה. הסרת עצם מופרזת במהלך היא פתחה גם יש להימנע כנוזל / דם ביניים נטה להציף את החלל כאשר חורים גדולים נוצרו. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 9. נציגי תוצאות -. ספים (ABR) הפסד Heptanol מושרה שמיעה והתאוששות ממוצעות הבדיקה ABR (dB SPL) זממו כפונקציה של PIP הטוןתֶדֶר. מדידות מקובצים לפי מראש חשיפה (שחורה-בקרה) ויום שלאחר ניתוח (POD) 1, 7, ו -14 (אדום). ברים שגיאה מייצגים SEM. איור מחדש זמם מאל סטיבנס et. 2014. 15 אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
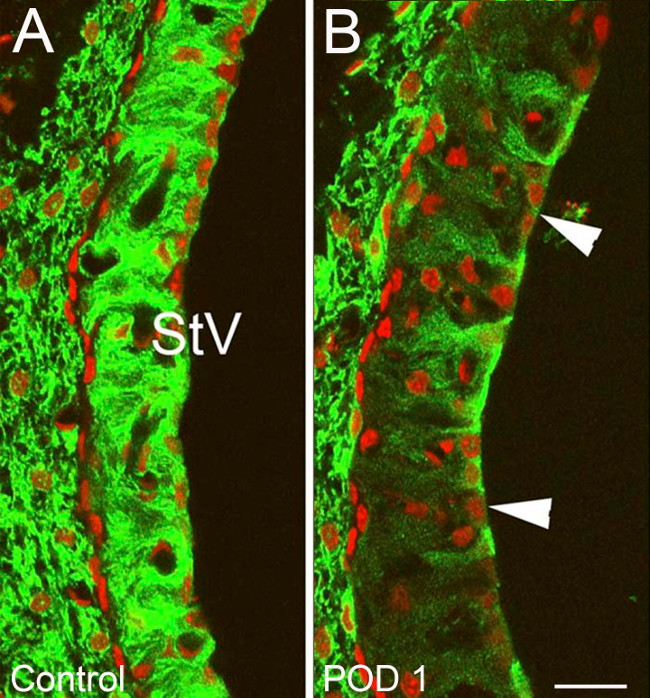
איור 10. נציגי תוצאות - ממוקדות נזק שבלול לאחר חשיפת חלק heptanol I. שינויים באשלגן פנימי מיישר (Kir) ערוץ 4.1 צביעה בתוך vascularis stria (STV) של אוזניים שטופלו בheptanol ולשלוט אוזניים. () רגיל Kir 4.1 מכתים אופייניים לאוזני שליטה עם זיקה חזקה לתא strial Kir 4.1 (ירוק). אוזן (ב) טיפול בPOD1. אזורי vacuolized הגדולים של decrזיקה הקלה Kir 4.1 נתפסות בתוך STV (ראשי חץ), יחד עם ירידה הכוללת בעצמה 4.1 מכתימה STV Kir. גרעינים counterstained עם יוד propidium (אדום) (ב). בר סולם = 15 מיקרומטר. איור מחדש זמם מסטיבנס et al, 2014 15 אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
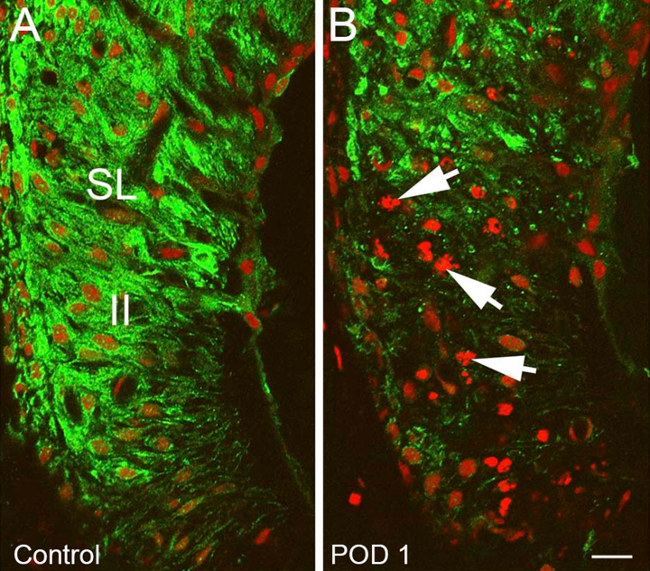
איור 11. נציגי תוצאות - ממוקדות נזק שבלול לאחר חשיפת חלק heptanol השנייה שינויים ברצועת הספירלה (SL) של אוזן טופלה heptanol לעומת שליטת אוזן.. הכתמה () רגיל Kir 4.1 (ירוק) בתוך SL הטיפוסי של אוזן שליטה בשנייה fibrocytes סוג המופיע נורמלי ספירלת רצועה (II). (ב) לא Heptanolאוזן reated עם ירידה ניכר בעוצמת 4.1 צביעת קיר, באזור של השני fibrocytes סוג ספירלת רצועה, שיבוש גרעיני ועיבוי כרומוזומליות / שלפוחיות בקנה אחד עם אפופטוזיס (חיצים). גרעינים counterstained עם יוד propidium (אדום). בר סולם = 15 מיקרומטר. איור מחדש זמם מסטיבנס et al, 2014 15 אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
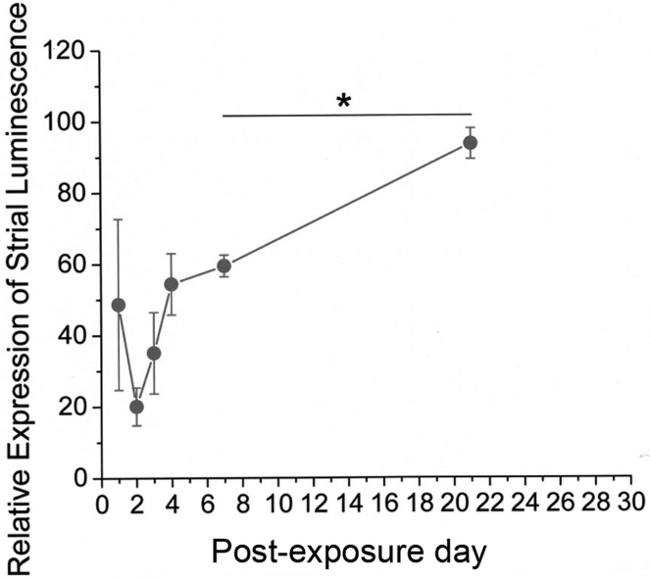
12. תוצאות איור נציג -. שחזור של עוצמת מכתים שבלול בעקבות חשיפת heptanol ממוצעת בהירות היחסית של קיר, 4.1 מכתים זממה כפונקציה של יום לאחר החשיפה. בהירות יחסית תחושב כקיר, 4.1 בעוצמה רעיוני תחת מיקרוסקופ confocal בפינוק heptanolאוזני אד נלקחו כאחוז מאותו הדבר באוזני שליטה. נתונים POD14-28 הערה הם אספו כנקודה אחת על העקומה. חוגים מוצקים מייצגים ערכים ממוצעים ואילו ברים שגיאה מייצגים סטיית התקן של הממוצע. התאוששות משמעותית של בהירות ביחס הודגמה בין 7 POD ומועדים מאוחרים יותר (עמ 'מבחן t של הסטודנט <0.05, כוכבית). איור מחדש זמם מסטיבנס et al., 2014 15 אנא לחצו כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
תוצאות הפרוטוקול והנציג שתוארו לעיל התקבלו במודל של עכברי CBA / CaJ כולל שני המינים. זן טהור זה מבוסס היטב כסטנדרט "שמיעה טובה" ומודל "הזדקנות נורמלית" בשמיעת מחקר. 16-23 תיאור של שימוש בפרוטוקול זה במודלים של יונקים אחרים הוא מעבר להיקף של הטקסט הזה. הקורא צריך לציין, עם זאת, כי יישום טכניקת RWN מציעה מספר יתרונות ללימוד האוזן הפנימית היונקים. מבין אלה, הבולטים ביותר הוא שזה ימנע שיבוש ישיר של המבנה האנטומי העדין והדרגתיות ביוכימיים שקיימים בתוך הקירות של הקפסולה otic. יש נהלים כגון cochleostomy וההשתלה של משאבות עירוי הנטייה להפר ישירות מבני אוזן פנימיים מובילים למשמרות סף קבועות; עובדה שיש לקחת בחשבון בעת ניתוח תוצאות. שיבוש של מבני קיר לרוחב שבלול ידי metho פולשניתDS יכול גם להגביל את השימוש בסוכני ototoxic כגון פורוסמיד או heptanol, שספציפי אזור של השפעה מוגבלת למיקום זה. 15,24 גישות לא פולשנית אלטרנטיביות כגון הזרקת טרנס-התוף והזרקת parenteral כבר סובלים מתוצאות ולא אמינות / או רעילות מערכתית למודל החיה. שיטת יישום זה הוכיחה את עצמו להימנע משני חסרונות אלה, להשגת רמה של עקביות מתקרבת לזה של השיטות פולשניות יותר שנדונו לעיל.
יתרונות נוספים של שיטה זו כוללים היא התחולה רחבה שלה למספר מודלים של בעלי חיים וההיתכנות לשלב תשתיות מעבדה קיימות. לגבי האחרון, אין חומרים כימיים או כימיקלים מיוחדים נדרשים מלבד הסוכנים, ההרדמה ומשככי כאבי ototoxic בחרו. סוכני ototoxic מנוצלים בדרך כלל בריכוז קבוע ומעורבים במספיק נפח גדול של פתרון (5 מיליליטר) ליימשכו זמן רב לשקולing כל יישום משתמש כ -10 μl (בעכברים). לפיכך, לאחר הרכש הראשוני של ציוד ומכשירים, חוקרים חופשיים יחסית מהכנת פתרון זמן רב או החלפה תכופה של חומרים. טכניקה זו מציעה גם הפחתה בזמן ניתוח, אשר עשוי להיות משמעותיים בהשוואה להליכים הכרוכים בהשתלה של משאבות עירוי perilymphatic או cochleostomies. עם הגיע לרמה של מיומנות טכנית, זמן הסיום הממוצע שלנו מחתך ראשוני לסגירה היה בדרך כלל 20 דקות לשעה 1.5 תלוי באורך של החשיפה הרצויה לסוכן ototoxic. שלושה או ארבעה ניתוחים עשויים בקלות להסתיים ביום אחד, ומאפשרים להתייעלות ופוטנציאל גבוה להשגת תוצאות מוצלחות. כפי שתואר לעיל, טכניקה זו יכולה גם להיות מיושמת בקלות למגוון רחב של מודלים של מכרסמים הכוללים עכברים, חולדות, חזירי ים וגרבילים.
מגבלות של שיטה זו מרוכזות עלבינוני עקומה למידה תלולה דרושה כדי לשלוט בה וירידה בתוצאות הצפויות עד למיומנות טכנית. כפי שנדונו ביתר פירוט בהמשך, טעויות קטנות בגישה הניתוחית או ההדמיה מספקת של התחום כירורגית כמעט תמיד יובילו לתוצאה גרועה. ממצאים עדינים שטירון עלול להיכשל להכיר, כגון גישה תת מילימטר עבה בועת אוויר חסימה של סוכן הקרום העגול חלון או נוזל ביניים דילול הסוכן, לקחת את הזמן כדי להעריך ולפתח את כישורי פסיכו נדרשו לתקן אותם. עם זאת, עם ביצועים חוזרים ונשנים של ההליך המכשולים הללו בקלות להתגבר ומהווים אתגר טכני פחות מרתיע לחוקרים מחלק מהשיטות חודרניות האמורות. לבסוף, טכניקה זו קשורה למגבלה ביחס שפציעת שבלול יכולה להיגרם רק בנקודה אחת בזמן במהלך החשיפה כירורגית. זה ניתן להתגבר במידה מסוימת, על ידי מילוי RWN עם ספוג ג'לטין נספג ספוג בסוכן כפי שתואר על ידי Heydt et al. 10 ספוג ג'לטין נספג יהיה ממחזר לאורך זמן, אך יכול לאפשר לתקופה ארוכה יותר מהחשיפה הוא בר השגה באמצעות יישום של תמיסה מימית לבד.
על מנת לממש את חוקר היתרונות מלאים של טכניקה זו ולהימנע מכל מלכודות, זה קריטי להכיר את שני אלמנטים קריטיים של טכניקה זו: 1) לשמור על ההדמיה של חלל האוזן התיכון וRWN באופן עקבי; ו 2) יכולת לשמור תחום כירורגית חופשי של נוזל ו / או דם ביניים. בהשגת לשעבר של אלה, חשיבותו של ראש-בעל נכון לא יכולה להיות הדגישה-על. קיבעון מאובטח של הראש של החיה מבטיח נוף יציב מתחת למיקרוסקופ; החשיבות שהופכת להיות ברורה בקלות כאשר מכשור עדין בצורה קיצונית משנה את מיקומם של מבנים בהגדלה. שעות טובותבעל EAD שניתן לסובב על הציר מקורי, הזנב של החיה גם מאפשר שינויים דינמיים חשובים בקו של החוקר של אתר. לעתים קרובות, כמה מילימטרים של סיבוב על ציר זה יכול להיות ההבדל בין ההדמיה של RWN ויזואליזציה של רק עצם כמוסת otic. היכולת לשנות את התצוגה כל הזמן היא גם בעל חשיבות עליונה להבטחת נוזל ביניים הוסר כראוי ממעמקי הנישה וגם כי סוכן ototoxic הוסר באופן מלא בין יישומים כפי שנדון בחלק 5. בניסיון, הדם, ההתעבות, או נוזל ביניים שלנו שנכנס לחלל האוזן התיכון היכולת להתערב בניסוי כולו. הדבר אינו מפתיע, שכן הכמות הקטנה של סוכן ototoxic להחיל חלון העגול (~ 10 μl) בקלות יכולה להיות מדוללת על ידי באים במגע עם אף כמויות קטנות של נוזל זר. מסיבה זו, לנתיחה כירורגית מוקפדת, פתיחה וכלת טיפין טיפין של הבולה התוף וpreservat זהירהיון של עורק stapedial הוא בבחינת תוצאות ניסוי מוצלחות.
אם השלבים הקריטיים מעל הם נצפו ותוצאות צפויות עדיין לא הושגו, פתרון בעיות צריכה להתחיל. מניסיוננו, הוא לעתים קרובות מועיל לבצע וריאציות משפטם של שני אלמנטים פרוצדורליים. הראשון הוא לשנות את התדירות שבה סוכן ototoxic מתחדש בחלון העגול. בהתאם לסוכן בשימוש, הכולל זמן חשיפה הוא בין 30 דקות ושעה 1, עם הפתילה מלאה והחלפה הבאה של הסוכן כל 10 דקות. אם חשיפה לתקופות קצרות יותר, להגדיל את החשיפה כוללת עשוי לאפשר הסוכן יותר זמן כדי לפזר על פני חלון הקרום העגול. חשיפה וreplenishing נוספים עשויות גם לעזור כדי למנוע דילול רצוי של סוכן ototoxic על ידי דם, התעבות, או ביניים כפי שפורטו לעיל. זהירות יש לשמור בעת שימוש בגישה זו, עם זאת, כפי שהוא נוטה להגדיל את הסיכון של היסח דעתly נפגע עורק stapedial ו / או החדרת נוזל ביניים לRWN.
טכניקה זו היא משמעותית במה שהיא מציעה לחקירות של פיזיולוגיה ופתופיזיולוגיה שבלול. טכניקה זעיר פולשנית מאפשרת מחקר מפורט של תהליכים ביוכימיים עדינים והייתה בבחינת בקידום המחקר שלנו במטרה להעריך פוטנציאל התחדשות שבלול. 12,24 גישה ניתוחית זו וחשיפה גם הוא לשחזר פני מגוון רחב של טכניקות שלוחה אחרות, ותוצאות מוצלחות באמצעות זה שיטה דווחו במחקרים של השתלת תאי גזע שבלול. 14 רבים נותר עלומה על השבלול, עם זאת, טכניקה זו, יחד עם הארסנל הרחב יותר זמין לחוקרים, תסייע בצמצום פער הידע הזה.
Disclosures
לא מתחרה אינטרסים כלכליים. יש המחברים אין לחשוף.
Acknowledgements
This work was supported by National Institutes of Health (NIH) Grant number: NIH P50DC00422 (H.L.); NIH R01DC12058 (H.L.). This work also benefitted from the South Carolina Clinical and Translational Research Institution (SCTR) Clinical and Translational Science Award (NIH/NCRR UL1RR029882). The funders had no role in study design, data collection, and/or analysis. The authors would like to thank Lonnie E. Brown Jr. for his artistic and graphic contributions.
Materials
| Name | Company | Catalog Number | Comments |
| 1-Heptanol 98% | Sigma-Aldrich | H2805 | PubChem Substance ID 24895536 |
| Ketaset Injectable | Patterson Veterinary | 07-803-6637 | Concentrate 100mg/ml |
| (Ketamine HCl) | 10 ml | Schedule CIII controlled substance | |
| Anased Injectable | Lloyd Laboratories | NADA# 139-236 | Concentrate 20mg/ml |
| Buprenex Injectable | Patterson Veterinary | 07-850-2280 | Concentrate 0.3 mg/ml |
| (Buprenorphine HCl) | 5 ampules per box | Schedule CIII controlled substance | |
| Betadine Skin Prep Solution | Medline | MDS093941 | 1 Quart screw top bottle |
| 0.9% Sterile Saline | Variable | For mixing solutions and injections | |
| Operating Microscope | Carl Zeiss | 32192 | |
| Controlled Acoustics Environment Sound Booth | Industrial Acoustics Company | ||
| Surgical Head Holder | Custom Made – | Please see Figure 3 | |
| Medical University of South Carolina | |||
| Neck Soft-Tissue Retractor (Wire Speculum, Titanium) 1.75 inch | World Precision Instruments | 555801L | Maximum spread 20 mm |
| Embedded in disposable putty to affix dynamically to head holder | |||
| 90N Dental Belt Driven Hand Drill | Emesco | Vintage Item | |
| Scalpel Handle Size 6 | Bard-Parker | MEDC-011990 | |
| #15c Stainless Steel Surgical Scalpel Blade | Bard-Parker | SKU: 097-7215 | 50 Blades/Box |
| Via ACE Surgical Supply Code | |||
| Straight Tip Jewelers Forceps | Bernell | MIL17304 | |
| Iris Scissors Curved | Medline | DYND04026 | |
| Iris Scissors Straight | Medline | DYND04025 | |
| Stevens Tenotomy Scissors Straight | Medline | MDG3222111 | |
| Rosen Ear Needle Straight Shaft, Lightly Curved Tip | MytaMed | Item# 6.56.00 | Figure 1 demonstrates angled shaft picks. This was later substituted for the Rosen picks |
| Rosen Ear Needle Straight Shaft, Strongly Curved Tip | MytaMed | Item# 6.56.01 | |
| Kimwipes Delicate Task Wipers | Kimtech Science | CODE 34155 | White, Size 4.4x8.4 Inch. Cut to triangles and rolled into fine tip wicks. |
| House Ear Curette, 6” shaft, light angle | Medline | MDG0396486 | |
| Gelfoam (absorbable gelatin sponge) Size 100 | Medline | IIS34201 | Substitutions may be made |
| Cotton pellets #3 4 mm | Richmond | Manufacturer Code 100108 | |
| ElectroSurgical Unit 100 E M/M | Elmed | List No. 52-5770 | Bipolar and Monopolar Capable |
| 1cc U-100 Insulin Syringe 28G, 0.5” length needle | BD | Product Number: 329410 | Optional for delivery of Ototoxic agent |
| 23G, blunt tip, 1” length needle | Kendall | Product Code 8881202397 | For controlled delivery of Ototoxic agent with less risk of damaging stapedial artery |
| Surgical Mask | U-line | S-10478 | |
| Exam Grade Nitrile Surgical Gloves | U-line | S-12549 | |
| Precision Hair Clippers | Wahl | Multiple models may be substituted | |
| 5-0 Nylon black monofilament suture on PC-1 13 mm 3/8 circle needle | Ethilon | 1855G | Substitutions may be made. |
| Instant Sealing Sterilization Pouch | Fisher | 01-812054 | |
| Dry Sterilizer | ROBOZ | Germinator TM 500 |
References
- Kimura, R. S., Iverson, N. A., Southard, R. E. Selective lesions of the vestibular labyrinth. The Annals of otology, rhinology, and laryngology. 97, 577-584 (1988).
- Dodson, H. C. Loss and survival of spiral ganglion neurons in the guinea pig after intracochlear perfusion with aminoglycosides. Journal of neurocytology. 26, 541-556 (1997).
- Wanamaker, H. H., Gruenwald, L., Damm, K. J., Ogata, Y., Slepecky, N. Dose-related vestibular and cochlear effects of transtympanic gentamicin. The American journal of otology. 19, 170-179 (1998).
- Lee, K. S., Kimura, R. S. Effect of ototoxic drug administration to the endolymphatic sac. The Annals of otology, rhinology, and laryngology. 100, 355-360 (1991).
- Schmiedt, R. A., Okamura, H. O., Lang, H., Schulte, B. A. Ouabain application to the round window of the gerbil cochlea: a model of auditory neuropathy and apoptosis. Journal of the Association for Research in Otolaryngology : JARO. 3, 223-233 (2002).
- Schmiedt, R. A., Lang, H., Okamura, H. O., Schulte, B. A. Effects of furosemide applied chronically to the round window: a model of metabolic presbyacusis. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, 9643-9650 (2002).
- Suzuki, M., Kikuchi, T., Ikeda, K. Endocochlear potential and endolymphatic K+ changes induced by gap junction blockers. Acta oto-laryngologica. 124, 902-906 (2004).
- Chen, Z., Mikulec, A. A., McKenna, M. J., Sewell, W. F., Kujawa, S. G. A method for intracochlear drug delivery in the mouse. Journal of neuroscience methods. 150, 67-73 (2006).
- Husmann, K. R., Morgan, A. S., Girod, D. A., Durham, D. Round window administration of gentamicin: a new method for the study of ototoxicity of cochlear hair cells. Hearing research. 125, 109-119 (1998).
- Heydt, J. L., Cunningham, L. L., Rubel, E. W., Coltrera, M. D. Round window gentamicin application: an inner ear hair cell damage protocol for the mouse. Hearing research. 162, 65-74 (2004).
- Palmgren, B., Jin, Z., Ma, H., Jiao, Y., Olivius, P. beta-Bungarotoxin application to the round window: an in vivo deafferentation model of the inner ear. Hearing research. 265, 70-76 (2010).
- Lang, H., Schulte, B. A., Schmiedt, R. A. Effects of chronic furosemide treatment and age on cell division in the adult gerbil inner ear. Journal of the Association for Research in Otolaryngology : JARO. 4, 164-175 (2003).
- Lang, H., Schulte, B. A., Schmiedt, R. A. Ouabain induces apoptotic cell death in type I spiral ganglion neurons, but not type II neurons. Journal of the Association for Research in Otolaryngology : JARO. 6, 63-74 (2005).
- Lang, H., et al. Transplantation of mouse embryonic stem cells into the cochlea of an auditory-neuropathy animal model: effects of timing after injury. Journal of the Association for Research in Otolaryngology : JARO. 9, 225-240 (2008).
- Stevens, S. M., et al. Heptanol application to the mouse round window: a model for studying cochlear lateral wall regeneration. Otolaryngology--head and neck surgery : official journal of American Academy of Otolaryngology-Head and Neck Surgery. 150, 659-665 (2014).
- Zheng, Q. Y., Johnson, K. R., Erway, L. C. Assessment of hearing in 80 inbred strains of mice by ABR threshold analyses. Hearing research. 130, 94-107 (1999).
- Hequembourg, S., Liberman, M. C. Spiral ligament pathology: a major aspect of age-related cochlear degeneration in C57BL/6 mice. Journal of the Association for Research in Otolaryngology : JARO. 2, 118-129 (2001).
- Ohlemiller, K. K., Gagnon, P. M. Apical-to-basal gradients in age-related cochlear degeneration and their relationship to 'primary' loss of cochlear neurons. The Journal of comparative neurology. 479, 103-116 (2004).
- Tadros, S. F., D'Souza, M., Zhu, X., Frisina, R. D. Apoptosis-related genes change their expression with age and hearing loss in the mouse cochlea. Apoptosis : an international journal on programmed cell death. 13, 1303-1321 (2008).
- Souza, M., Zhu, X., Frisina, R. D. Novel approach to select genes from RMA normalized microarray data using functional hearing tests in aging mice. Journal of neuroscience. 171, 279-287 (2008).
- Tang, X., et al. Age-related hearing loss: GABA, nicotinic acetylcholine and NMDA receptor expression changes in spiral ganglion neurons of the mouse. Neuroscience. 259, 184-193 (2014).
- Borkholder, D. A., Zhu, X., Frisina, R. D. Round window membrane intracochlear drug delivery enhanced by induced advection. Journal of controlled release : official journal of the Controlled Release Society. 174, 171-176 (2014).
- Tadros, S. F., D'Souza, M., Zhu, X., Frisina, R. D. Gene expression changes for antioxidants pathways in the mouse cochlea: relations to age-related hearing deficits. PloS one. 9, e90279(2014).
- Lang, H., et al. Sox2 up-regulation and glial cell proliferation following degeneration of spiral ganglion neurons in the adult mouse inner ear. Journal of the Association for Research in Otolaryngology : JARO. 12, 151-171 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved