Method Article
L'approche de la souris ronde-fenêtre pour ototoxiques Delivery Agent: Un rapide et fiable Technique d'incitation à Cochlear dégénérescence cellulaire
Dans cet article
Résumé
Various methods exist for introducing ototoxic agents to the cochleae of animal models. Presented is a surgical protocol for delivery of ototoxic agents to the round window niche. The procedure is reliable, creates targeted intra-cochlear lesions, and avoids mechanical damage to the microarchitecture. Examination of cochlear self-repair/regeneration is possible.
Résumé
Investigators have utilized a wide array of animal models and investigative techniques to study the mammalian auditory system. Much of the basic research involving the cochlea and its associated neural pathways entails exposure of model cochleae to a variety of ototoxic agents. This allows investigators to study the effects of targeted damage to cochlear structures, and in some cases, the self-repair or regeneration of those structures. Various techniques exist for delivery of ototoxic agents to the cochlea. When selecting a particular technique, investigators must consider a number of factors, including the induction of inadvertent systemic toxicity, the amount of cochlear damage produced by the surgical procedure itself, the type of lesion desired, animal survivability, and reproducibility/reliability of results. Currently established techniques include parenteral injection, intra-peritoneal injection, trans-tympanic injection, endolymphatic sac injection, and cochleostomy with perilymphatic perfusion. Each of these methods has been successfully utilized and is well described in the literature; yet, each has various shortcomings. Here, we present a technique for topical application of ototoxic agents directly to the round window niche. This technique is non-invasive to inner ear structures, produces rapid onset of reliably targeted lesions, avoids systemic toxicity, and allows for an intra-animal control (the contra-lateral ear). Results stemming from this approach have helped deeper understanding of auditory pathophysiology, cochlear cell degeneration, and regenerative capacity in response to an acute injury. Future investigations may use this method to conduct interventional studies involving gene therapy and stem cell transplantation to combat hearing loss.
Introduction
Des chercheurs ont utilisé un large éventail de modèles animaux pour étudier la fonction normale du système auditif ainsi que la pathophysiologie de la perte d'audition. Ces modèles sont également très utiles pour la réalisation d'études d'intervention contre les divers processus pathologiques et servent de base pour les applications de translation sur des sujets humains. Pour la plupart des recherches impliquant la cochlée et ses voies auditives associés, un certain degré de dommage ou de perturbation doit être introduit dans le système. Souvent, le dommage est visé intentionnellement pour créer une lésion spécifique, permettant aux enquêteurs d'étudier l'effet de cette lésion sur la fonction normale, ainsi que la capacité cochléaire à récupérer. Lors de la sélection d'un modèle particulier de l'animal et / ou technique (s) d'introduction des dommages, un certain nombre de facteurs doivent être considérés pour atteindre les meilleurs résultats possibles. Divers modèles animaux peuvent réagir différemment à des interventions, tandis que les effets directs et indirects d'une technique peuvent êtreentièrement délétère pour le résultat souhaité. Dans la plupart des cas, l'intérieure protocole de lésions de l'oreille idéal serait d'éviter la toxicité systémique, rapidement et de manière fiable les dommages produire, de créer une lésion précise et cohérente, et être de survivre afin de permettre une étude plus approfondie des changements fonctionnels, cellulaires et moléculaires. Idéalement, ces méthodes pourraient également préserver les gradients électrochimiques microarchitecture et délicates de la cochlée à la plus grande mesure possible.
À ce jour, les enquêteurs ont réussi à établir un certain nombre de techniques pour induire des lésions de l'oreille interne. La plupart de celles-ci entraînent l'exposition de la cochlée à un agent ototoxique soit par voie systémique ou par voie chirurgicale. Les techniques comprennent l'injection parentérale, injection intrapéritonéale, l'injection trans-tympanique, l'injection de sac endolymphatique et périlymphatique cochléostomie avec perfusion. Ces techniques ont été utilisées pour introduire une diversité d'agents ototoxiques, tels que le furosémide, la gentamicine, l'ouabaïne, et heptanol. 5/1Bien réussi à créer des lésions cochléaires spécifiques, les techniques ci-dessus aussi ont reconnu les limites. Injections systémiques peuvent être hautement toxiques pour l'animal et peuvent être associés à des insultes cochléaires imprévues et des résultats incohérents. Ce dernier inconvénient a également été associée à des injections trans-tympaniques. Des techniques telles que cochléostomie et la perfusion périlymphatique, tandis que capable d'induire des lésions rapides et hautement fiables, sont directement invasive à la structure de l'oreille interne et de la fonction. Beaucoup des approches chirurgicales sont également associés à un haut degré de difficulté technique et peuvent exiger de laisser des objets étrangers dans l'animal, comme une boule de micropompe. 2-4,6-8 Aucune technique est libre de lacunes, et les enquêteurs doivent choisir méthodes soigneusement pour répondre à leurs besoins expérimentaux. Ici, nous décrivons en détail, la fenêtre ronde (RWN) technique d'application pour la livraison d'agents ototoxiques d'actualité chez la souris adulte.
Fiabord décrit par Husmann et al, en 1998, en étudiant l'effet de la gentamicine sur sensoriel dégénérescence des cellules ciliées dans un modèle aviaire, cette technique a été trouvé être capable de produire des lésions significativement plus fiables que l'application de la gentamicine systémique, tout en évitant les toxicités associées. 9 Depuis, certain nombre d'autres enquêteurs, y compris notre laboratoire, ont utilisé cette technique à un grand succès. En 2004, Heydt et al. adapté à un modèle de souris et décrit une capacité accrue pour contrôler la taille de la lésion en remplissant le RWN avec absorbable éponge de gélatine trempées à des concentrations de gentamicine ou moins. 10 Palmgren et al., en 2010, ont étudié les effets ototoxiques de bêta-bungarotoxine, un puissant élément dans le venin des Taiwanais bagué caisse, en appliquant une forme aqueuse de celui-ci à l'RWN de rats adultes. 11 En outre, un certain nombre d'études antérieures de notre laboratoire ont utilisé l'approche de la fenêtre ronde pour étudier les effets ototoxiques de furosémidee, ouabaïne, et heptanol. 5,6,12-15 résultats de ces études ont démontré l'importance de fluide cochléaire et l'homéostasie d'ions sur une audition normale, découvert cellule capacité proliférative dans le ganglion spiral et paroi latérale cochléaire, et permis de mieux comprendre liée à l'âge de la perte d'audition.
L'approche suivante consiste à accéder chirurgicalement l'oreille moyenne par une incision rétro-auriculaire et découverture partielle de la bulle tympanique osseuse. Cela permet une excellente exposition de l'RWN et membrane à laquelle un agent ototoxique sélectionné peut être appliqué directement. L'agent liquide, puis des piscines dans le creux en forme de cuvette de la RWN (ou lentement draine d'un absorbable support gélatine éponge saturée emballé dans le RWN) et diffuse à travers la membrane de fenêtre ronde dans l'espace périlymphatique du vestibule cochléaire. Aucune cochléostomie directe est faite dans cette approche. Les avantages de cette technique sont la préservation de l'oreille interne microarchitecture, l'évitementde toxicité systémique, l'allocation d'un contrôle auditif intra-animal, l'apparition rapide de l'effet, la dégénérescence sélective dans certains types de cellules cochléaire (par ex., de type I spirale neurones du ganglion avec l'exposition ouabaïne et le type cochléaire II de fibrocytes induites par le traitement de l'heptanol), et des résultats reproductibles / fiables. Cette technique peut être appliquée avec quelques modifications entre autres espèces de rongeurs, y compris les rats, les cobayes, et les gerbilles. Les inconvénients comprennent une courbe d'apprentissage abrupte technique et la limitation relative de l'insulte ototoxiques qui est contraint à un seul point dans le temps.
Protocole
Tous les aspects de la recherche sur les animaux ont été menées en conformité avec les lignes directrices de la Commission institutionnelle soin et l'utilisation des animaux approprié. Toutes les procédures expérimentales sur des animaux vertébrés décrites ici ont été approuvés en vertu des lignes directrices de l'Université médicale de Comité (MUSC) Institutionnel soin et l'utilisation des animaux de la Caroline du Sud (IACUC).
1. Sélection du modèle
- Maintenir le modèle animal dans un vivarium de faible bruit avec gardiennage de routine par des protocoles institutionnels jusqu'à utilisation. Dans la recherche de l'animal (des installations ARF), maintenir la stabilité des vibrations, le bruit d'amortissement, l'éclairage diurne, l'espace de préparation, finitions de surface, d'étanchéité et de calfeutrage, et la ventilation qui répondent aux normes NIH.
Nota: National Institutes of Health (NIH) des lignes directrices pour ARF et le maintien d'un faible vivarium de bruit peuvent être révisées à: http://www.orf.od.nih.gov/PoliciesAndGuidelines/BiomedicalandAnimalResearchFacilitiesDesignPoliciesandGuidelines/ - Pour toutes les expériences, utiliser l'oreille droite que l'oreille expérimentale. L'oreille gauche sert de contrôle intra-animaux et n'a pas modifié chirurgicalement.
- Inspectez l'animal modèle pré-opératoire des signes d'infection de l'oreille moyenne ou externe. Signes potentiels peuvent inclure le drainage du fluide ou du pus de l'oreille, le tissu enflammé pavillon de l'oreille, et / ou de la léthargie de l'animal. Ceci est inhabituel, mais si noté, en outre éviter la chirurgie et de traiter l'animal de manière appropriée.
2. Les procédures pré-opératoires
- Anesthésier l'animal 30 min avant l'intervention chirurgicale et les procédures périopératoires via intrapéritonéale (IP) injection de kétamine (100 mg / kg IP) et de xylazine (20 mg / kg IP). Supplément anesthésie selon les besoins, tel que jugé par un réflexe pincement pincement positif, avec une dose plus faible de kétamine (25 mg / kg IP) et de xylazine (5 mg / kg IP). Déterminer dosage en conformité avec les protocoles acceptés sur le plan institutionnel pour les souris avec l'âge des ajustements appropriés de la dose.
- Vérifiez completedation du modèle. Vérifiez pour un plan de 3 étapes de l'anesthésie pour l'intégralité du protocole décrit marquée par un taux de respiration régulière, un manque de réflexe de redressement (chez la souris), et le manque de pédale et palpébrale (TOE-pincement) réflexes. Maintenir l'animal à ce niveau de l'anesthésie. Ceci est primordial pour la minimisation de la douleur et le mouvement peropératoire, saignements, et la fuite de fluides interstitiels pendant la chirurgie.
- Maintenir la température du corps de l'animal à 37,5 ° C avec un tampon de chauffage à boucle fermée.
- Administrer l'analgésie par injection sous-cutanée de la buprénorphine. Livrer la buprénorphine (0,1 mg / kg SQ fois 30 min avant la chirurgie) que l'analgésie pour minimiser l'inconfort chirurgicale. Dosage et alternatives base appropriée pour le modèle choisi sur les protocoles approuvés institutionnellement. Antibiotiques utilisation ne soit pas nécessaire si une bonne technique aseptique a été pratiqué. Les animaux reçoivent une analgésie post-opératoire, si il ya des signes de douleur et de détresse.
- Effectuer phessais ysiologic préopératoire. Exécution du tronc cérébral (ABR) test auditif et / ou un produit de distorsion des tests d'émissions optoacoustic (DPOAE) à la fois en pré-opératoire et juste avant le sacrifice de l'animal sert une mesure objective de l'effet de l'agent ototoxiques choisie sur l'audience de la souris.
3. Préparation chirurgicale et positionnement
- Stériliser tous les instruments de pré-opératoire par les normes institutionnelles. Préparer les instruments chirurgicaux et domaine d'une manière cohérente, stérile, et organisé pour éviter des efforts inutiles et de mouvement pendant la procédure. Les instruments typiques tenus comprend des ciseaux de dissection pointus, plusieurs paires de pinces métalliques avec les conseils de bijoutier, un pic otologique, une curette otologique, et une unité de l'électrocoagulation bipolaire (Figure 1).
- Préparer et stériliser mèches de papier fabriqué à partir labwipes à l'avance en coupant une petite pièce triangulaire de la lingette (~ 0,7 po x 1,25 po x 1.75) et en tournant fermement entre le pouce et l'index d'une main (~ 1,25). Création d'un torsadées mèche, extrêmement mince est primordiale pour le succès de la procédure. Préparer un total de 15-20 mèches avant la chirurgie (Figure 2).
- Utilisez une fraise de dentiste pour perforer rapidement l'os de la bulle tympanique d'une manière contrôlée. Utilisation d'une perceuse à main dentaire à entraînement par courroie avec un embout 1 ou 2 mm conique est préférable. Un microscope opératoire est nécessaire de compléter le protocole. (voir l'étape 4.7)
- Pré-tirer 0,2 ml d'une solution aqueuse contenant l'agent ototoxiques sélectionnée dans une seringue de 1 ml de tuberculine avec un 28 G, 1/2 'aiguille. Typiquement, une goutte (~ 10 pi) de l'agent est suffisante pour remplir complètement le RWN de la souris. Un métallique, émoussé aiguille pointe de la seringue facilite la délivrance de l'agent, tout en empêchant les dommages aux structures sous-jacentes par une pointe conique pointu. Expulser l'air intérieur de la seringue sous forme de bulles peuvent remplir par inadvertance le RWN et / ou empêcher le bonapplication de l'agent à la fenêtre ronde elle-même.
- Retirer la fourrure de la peau post-auriculaire aide de tondeuses de toilettage électriques. Retirer la fourrure dans une zone allant de l'enclave auriculo-céphalique rostralement à la caudale de la ceinture scapulaire. Elargir l'épilation de la dorsale, la ligne médiane sagittale à l'angle mandibulaire latéralement. Élimination correcte de la fourrure est primordiale pour maintenir un champ opératoire propre et claire. Brosser coupures du site chirurgical destiné doucement.
- Stériliser la peau de la zone préparée conformément aux protocoles institutionnels. Appliquer la bétadine (povidone / iode) en alternance avec de l'éthanol par voie topique d'une manière circulaire pendant 2 min. D'autres agents peuvent être substitués par des directives institutionnelles.
- Placez l'animal sur une surface plane pour maintenir constant le positionnement du corps pendant la procédure. Utiliser un petit coussin chauffant placé sous le corps sur la plate-forme pour contrôler la température du corps pendant la procédure afin de maintenir la température du corps de l'animal à 36-38 ° C. Ne pas overheat l'animal, car cela pourrait conduire à légère à de graves lésions cutanées et / ou l'euthanasie précoce.
- Fixer la tête de l'animal au moyen d'un dispositif de retenue bloc de morsure / tête. Utiliser un 0,5 cm par 2 cm bloc de morsure usiné laiton avec 2-4 trous mm de diamètre percés à travers elle à intervalles de 5 mm le long de l'axe de temps. Ouvrez la bouche de l'animal autour de cet appareil et monter les incisives centrales supérieures dans l'un des trous selon la taille de l'animal. Serrer doucement une petite pince sur le dos du museau de l'animal pour le maintenir en place (Figure 3).
- Assurez-vous que le titulaire bloc / de la tête de morsure est rigidement relié au centre d'un bras articulé en forme de U (Figure 3). De garantir une large tige 1cm sur le bras gauche de la «U» et utilisez la tige comme un appui-tête du côté gauche (le côté droit est toujours le côté opérationnel).
- Une fois solidement fixé dans le support de la tête, tourner la souris à une position décubitus latéral gauche. Placez le savou du corpslly sur la surface de travail plane pour assurer qu'elle sera stable tout au long de la procédure et d'éviter les contraintes de torsion excessive sur les vertèbres cervicales.
- Positionner un microscope opératoire capable de 4x, 10x, 20x grossissement et sur le champ opératoire. Vérifiez que le microscope peut maintenir sa position dans un mode mains-libres que ce qui est idéal pour le protocole chirurgical à deux mains discuté ci-dessous.
- Placez une unité de cautérisation bipolaire compatible avec la pièce à main de fine embout bijoutier dans une position qui est immédiatement disponible pour l'assistance dans la cautérisation de petits vaisseaux et la dissection du tissu. Ce peut également être nécessaire devrait être saignements plus abondants rencontré.
4. Approche chirurgicale
- Sous grossissement microscopique, utiliser des ciseaux pointus ou une lame de scalpel pour créer une incision rétro-auriculaire 1-1,5 cm, environ 6-8 mm caudale au pli auriculocephalic. Chez la souris adulte, une incision de la ligne médiane dorsalelatéralement à un point près de l'angle de la mandibule est adéquate. Eviter soigneusement couper profondément pour préserver les structures vasculaires sous-jacentes.
- Mener dissection minutieuse à travers la couche de graisse sous-cutanée qui peut être d'épaisseur variable. Fat peut être retiré en toute sécurité si nécessaire à l'amélioration de l'exposition. Prenez garde en disséquant dans une direction ventrale médiale que la veine jugulaire externe traverse cette région et les dommages à cette structure peut causer de grandes quantités de perte de sang et les inondations du champ opératoire. Contrôler les saignements excessifs avec des éponges de gélatine absorbables et / ou des boulettes de coton. Utilisez cautérisation bipolaire pour des saignements plus abondants.
- Une fois la couche de graisse est correctement divisé, exposer la musculature cervicale. Remarque structures importantes, y compris le grand corps musculaire des cleidomastoideus centrale dans le domaine de la chirurgie exposée, la veine jugulaire externe ventre, et le tissu recouvrant la parotide rostralement l'angle de la mandibule. Une étape importante est une petite Branc nerveuseh (du nerf crânien XI) qui entoure le bord postérieur / dorsale de la cleidomastoideus d'étendre rostralement vers le pavillon de l'oreille (Figure 4).
- Rétracter doucement le corps cleidomastoideus musculaire dans une direction postérieure / dorsale (figures 4, 5). Diviser délicatement le fascia transparente enveloppant le corps musculaire. D'une manière similaire, rétracter doucement la parotide et la veine jugulaire externe dans la (antérieure / ventral) en direction opposée (figure 5).
- Avec une bonne rétraction du corps cleidomastoideus musculaire, le dôme brillant de la bulle tympanique périoste entrera en vue (figure 6). A la partie caudale de la bulle, l'insertion d'un muscle profond col de l'utérus, l'sternomastoideus, entrera en vue (figure 6). Préserver le nerf facial, qui devient visible à la dorsale et l'aspect rostrale de la coupole de la bulle. Placer un écarteur auto-retenue (titane stérile shaft-- intégré dans silicone jetablecoller) avant le forage.
- Avec une technique à deux mains, doucement diviser le périoste de bulle par diathermie bipolaire pour exposer l'os sous-jacent. En utilisant une pince ou une curette otologique, élever doucement et poussez le périoste dans une direction périphérique à largement exposer le dôme de bulle.
Nota: L'étape 4.6 est essentiel pour maximiser la vue chirurgical de l'espace de l'oreille moyenne. Utiliser la manipulation minutieuse et doux tissu doux pour éviter les saignements et / ou de fuite de liquide interstitiel dans la cavité de la bulle après le forage. - Sur un dôme de bulle correctement exposée, percer un trou pilote de 2 mm dans l'os de la bulle avec une perceuse chirurgicale dentaire entre la marge caudale de la coupole et la ligne visiblement opaque (représentant la membrane tympanique) étendant à travers l'aspect rostrale de la bulle (Figure 7). Prenez soin de ne percer à travers l'os de préserver des structures sous-jacentes, telles que l'artère stapédienne. Percez un second trou pilote à proximité pour faciliter l'ONU de la toiture de l'os de la bulle ( Figure 7).
- En utilisant une paire de pointes des pinces de bijoutier, décapsuler l'os de la bulle dans une dorsale et direction caudale (figure 8). Retirer l'os de façon fragmentaire à fort grossissement. Ne pas percer l'artère stapédienne, qui se trouve directement sous le bouchon de bulle, comme des saignements de cette artère peut compromettre la procédure. Réduire la quantité d'os retiré pour empêcher l'entrée excessive de liquide dans l'oreille moyenne, tout en permettant une excellente visualisation et l'accès à la fenêtre ronde (figure 8).
5. ronde Fenêtre de l'application de l'agent ototoxique
- Faire des ajustements subtils à rotation le support de tête pour amener le RWN carrément en vue. Le RWN se trouve généralement à l'aspect dorsal et caudal de l'espace de l'oreille moyenne et apparaît comme un renfoncement en forme de coupelle de la capsule otique osseuse. Dans la plupart des cas, l'artère stapédienne fonctionne 1-2 mm ventrale / rostrale à cela. Le RWN peut parfois être tucked périphérique sous une angulation aiguë de la coupole de la bulle. Dans de tels cas, le positionnement minutieux de la tête de l'animal est primordiale.
- Utiliser les mèches de papier préparés préopératoire, enlever tout le liquide visible dans l'oreille moyenne et RWN jusqu'à l'os sec est visualisée.
Note: Ceci est l'étape la plus critique de l'ensemble du protocole, comme ~ 10 pi (1 goutte) d'agent ototoxiques appliqué à la RWN peut facilement être dilué par ce fluide.
- Utiliser les mèches de papier préparés préopératoire, enlever tout le liquide visible dans l'oreille moyenne et RWN jusqu'à l'os sec est visualisée.
- Sous grossissement maximum, utiliser une aiguille de calibre fin sur un 1 ml seringue à tuberculine d'appliquer une goutte (~ 10 pi) de l'agent ototoxiques directement à la RWN, le remplir complètement. Prenez soin de ne pas perturber l'artère stapédienne et observer de près pour le remplacement d'une petite réflexion de la lumière à la base d'une niche à sec avec un ménisque de fluide ternes et brumeux comme un indicateur que la niche se remplit correctement.
- Laisser l'agent de se reposer dans le RWN pour environ 10 min temps d'exposition. Après cela, complètement wbeurk sur l'agent et la remplacer par une nouvelle application du même agent. Déterminer répétitions d'application selon les spécifications de l'agent. Le temps d'exposition total de cette procédure est généralement comprise entre 30 et 60 min.
- À la fin de la procédure, complètement évacuer l'agent une dernière fois et d'appliquer l'agent frais au RWN. Laissez la bulle non plafonné et utiliser des pinces pour fermer les tissus mous sur le site chirurgical.
- Sceller site chirurgical au niveau de la peau avec un 4-0, non absorbable suture monofilament. Placez l'animal dans une cage de récupération / station. Surveiller l'état clinique de l'animal régulièrement après l'opération. Maintenir l'animal dans des conditions d'environnement appropriées, y compris le logement avec une literie douce et la supplémentation avec des aliments mous, de minimiser le stress. Déterminer les futures procédures et conditions post-opératoires selon les protocoles institutionnels IACUC.
- Utilisez protocoles institutionnels IACUC pour stériliser instruments avant de l'utiliser sur l'animal suivant. Prévoir une période de refroidissement approprié entre l'utilisation de l'instrument.
6. Procédures postopératoires et récolte de tissus Cochlear
- Comme décrit dans l'étape 2.5, effectuer des tests physiologiques de l'audition après l'opération à des points désirés et avant le sacrifice. Exécuter les procédures postopératoires selon les objectifs expérimentaux. Sacrifier l'animal sur un jour postopératoire souhaitée.
- Après anesthésie générale par injection IP, tel que requis par les protocoles institutionnels IACUC, sacrifier l'animal. Avec des ciseaux pointus, décapiter animaux juste caudale à l'occiput. Fortement ouvrir la voûte crânienne avec des ciseaux le long de la dorsale et ventrale et médiane largement répandu. Évider délicatement le tissu cérébral pour exposer l'os temporal.
Remarque: Un certain nombre de procédures d'enquête des modifications post-exposition dans la cochlée peut se ramifier à partir de ce point et sera mentionné dans la section de discussion. Déterminer la méthode d'enquête le plus pertinent aux buts expérimentaux. Si la microscopie électronique est prévue après la cochlée sont sectionnés, utiliser cathétérisme cardiaque pré-fixer le tissu. Ceci est au-delà de la portée de cette discussion et a été couvert en profondeur ailleurs. 13 - Couper les os temporaux de la base du crâne avec les ciseaux et immédiatement placé dans la solution de fixation. Plongez os directement dans 4% de paraformaldehyde pendant 1,5 heure à température ambiante. Surveiller le temps de fixation, qu'une plus longue durée peut limiter le résultat de l'analyse histologique à des étapes ultérieures. Détartrage disséqué os pendant une période de temps variable par immersion dans 1 mM d'acide éthylène diamine (EDTA).
Résultats
Dans une étude récente menée par Stevens et al utilisant le protocole ci-dessus, les souris adultes ABC / CaJ des deux sexes ont été exposés par la fenêtre de diffusion ronde pour heptanol. 15 Heptanol est un écart de jonction non-coupleur connu pour produire ciblée, des blessures recouvrable aux cellules de la paroi latérale cochléaire. Le but de l'étude était de produire un modèle fiable pour dommages cochléaires ciblée, permettant d'enquête de la régénération post-chirurgicale de tous les éléments endommagés. Les seuils d'audition pré-opératoire et post-chirurgicales servi de point de terminaison fonctionnelle. Microscopie et techniques de coloration immunohistochimique ont été utilisés pour étudier les changements morphologiques. Des augmentations significatives des seuils ABR ont été observés chez des souris de heptanol-traitée (figure 9). Les animaux témoins recevant une intervention chirurgicale fictive, avec la livraison d'une solution saline au lieu de heptanol, ne montrent pas de changements significatifs à tout seuil fréquence testée.
Immunocoloration contre un redressement vers l'intérieurcanal potassique (Kir) 4.1 servi comme une méthode indirecte pour la visualisation des dommages / récupération des structures cochléaires. Cela a démontré des différences hautement reproductibles entre traitement et de contrôle oreilles. Intensité globale de coloration a été nettement diminué au sein de la strie vasculaire (VUT) et parmi fibrocytes du ligament spiral (SLF) 1-3 jours après l'exposition de l'heptanol, désignant grandes quantités de dégâts ciblés à ces domaines. Il y avait une diminution de l'intensité particulière dans Kir 4.1 de coloration dans les domaines de SLFs type II et IV (figure 10) et STV (Figure 11). Preuve de l'intégrité nucléaire perturbé et la condensation chromosomique / bulles typiques de l'apoptose cellulaire a également été vu sur contre-colorants nucléaires dans ces zones cochléaires (figure 10). Vacuolés zones de Kir 4.1 coloration nettement résolus à 7 jours et étaient absents entièrement à 14 jours. Lorsque Kir 4.1 intensité de la coloration a été quantifiée dans les domaines de StV, oreilles traités ont démontré une initial cuve suivie par un changement significatif (p <0,05) en arrière vers l'intensité de commande 7 jours après heptanol exposition (Figure 12).
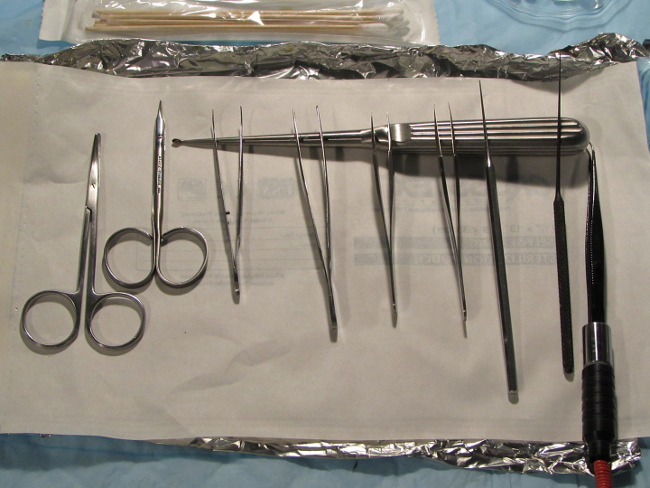
Figure 1. Configuration de l'instrument. Représentation de pré-chirurgicale set-up de l'instrumentation. Tout le matériel doit être facilement accessible dans le champ opératoire stérile. L'instrumentation typique comprend 2 ciseaux pointus de dissection, 2-3 droite et / ou une pince de incurvée pointe bijoutier avec les curettes auriculaires, arbre courbé choix otologiques (plus tard substitué par Rosen ramasse - non représenté), et une unité électro-cautérisation avec une pince de bien incurvée pointe bijoutier bandeau. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. fournitures chirurgicales. Des fournitures supplémentaires pour maintenir l'environnement RWN. Découpes de labwipe stérilisés pour la formation papier mèche (à gauche), le papier hermétiquement formé mèches fabriqués à partir de lingettes stérilisés de laboratoire (centre), et 4 granules mm de coton (à droite) sont utilisées pour essuyer l'excès de liquide et les inondations de sang dans la niche de fenêtre ronde. S'il vous plaît cliquer sur ici pour voir une version plus grande de cette figure.

Figure 3. support de la tête des animaux. Image illustrant le support de tête et de bloc de morsure. Les trous dans le bloc en forme et fixer les incisives centrales supérieures. Une pince est doucement serré sur le museau dorsale pour sécuriser l'animal en place. Utilisation d'un support de tête est critique pour outc chirurgicale réussieome. Idéalement, cela devrait être capable de tourner autour de l'axe de rostrale-caudale de l'animal afin d'optimiser vues chirurgicales de la bulle lors de la procédure. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
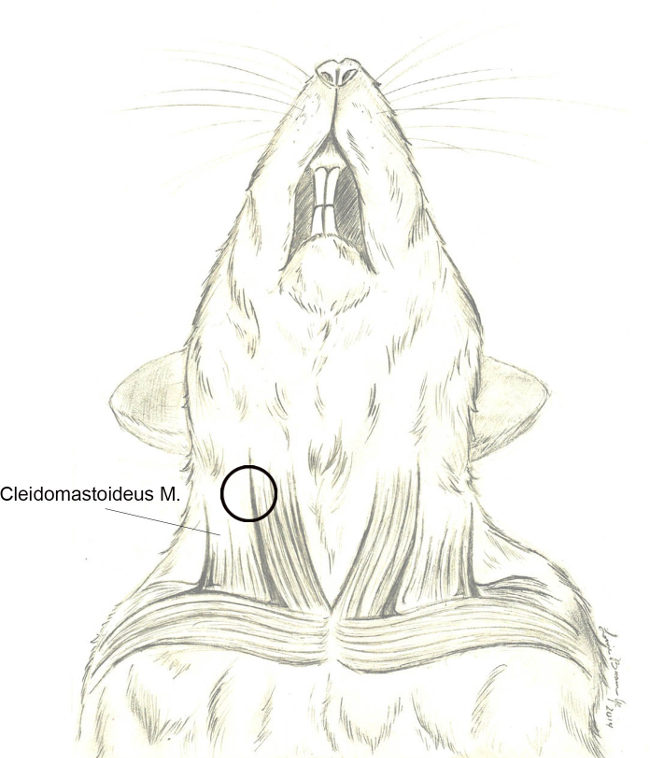
Figure 4. Cleidomastoideus m.. Graphique schématique illustrant l'anatomie de base du rongeur musculature cervicale et son association avec la veine jugulaire externe. Le muscle cleidomastoideus est le muscle le plus facilement identifiés lors de l'approche chirurgicale. Libération de l'aponévrose enveloppante suivie postérieure / dorsale rétraction du corps musculaire se diriger vers la dissection chirurgicale bulle tympanique (cercle noir). S'il vous plaît cliquer ici pour voir alVersion Arger de ce chiffre.
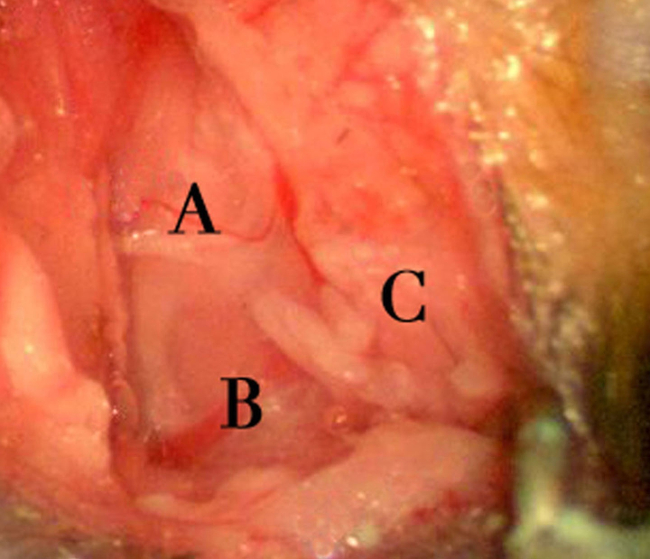
Figure 5. Zone d'exposition chirurgicale. Représente l'exposition après dissection à travers les couches adipeuses sous-cutanées et cutanés. Repères structurels de la note incluent une branche du nerf crânien XI recouvrant le muscle cleidomastoideus (A), la veine jugulaire externe (B), et de tissu de la parotide exposée (C). Le nerf crânien XI branche est souvent associée à un petit navire et doit être divisé avant de procéder. De droite à gauche sur l'image correspond à l'axe de rostrale-caudale de l'animal. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
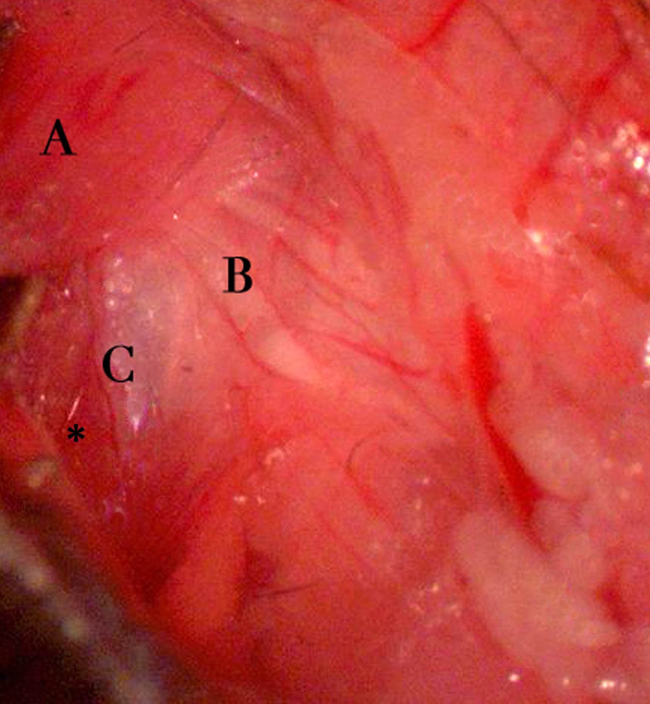
Figure 6. L'exposition de la BUlla. L'exposition de la bulle tympanique après la rétraction de la cleidomastoideus et les structures environnantes. Sites remarquables incluent le corps cleidomastoideus musculaire (A) reflète arrière / le dos, le nerf facial (B), et le dôme brillant du périoste de bulle tympanique (C). Notez également l'insertion du muscle sternomastoideus à la partie caudale gauche de la bulle tympanique (astérisque). La présence du nerf facial à la face dorsale et rostrale de la bulle est un point de repère essentiel pour l'identification précise de la bulle. De droite à gauche sur l'image correspond à l'axe de rostrale-caudale de l'animal. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
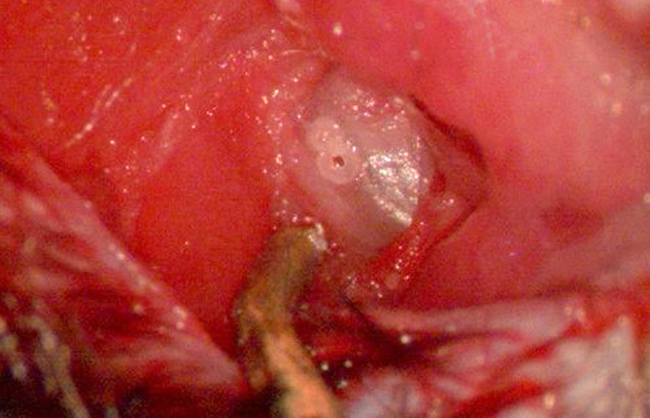
Figure 7. Exposer niche de fenêtre ronde I. Image illustrant l'tympanic bulle entièrement exposé après dissection du périoste recouvrant. Le trou est le mieux placé au point à mi-chemin entre le bord extrême de la coupole de la bulle et une ligne opaque subtile visualisé dans le aspect rostrale la bulle (représentant la membrane tympanique). Un deuxième trou pilote, adjacente peut faciliter facile non-toiture de l'os de la bulle. Prévention de forage profond devrait être prise afin de ne pas blesser l'artère stapédienne sous-jacent. Le noir, objet métallique au fond de l'image est l'écarteur titane des tissus mous. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 8. Exposer niche de fenêtre ronde II. Bulle tympanique Uncapped avec l'exposition de la niche de fenêtre ronde (flèche) et l'artère stapédienne (rouge structure1-2 mm latéralement à la niche) tel que vu sous un grossissement de 20x. La niche établit souvent dans une position repliée sous l'angle aigu formé par le dôme de bulle avec la capsule otique à la partie caudale de la coupole. Il est impératif que la visualisation complète de la niche être réalisé avant l'application de l'agent ototoxiques ou mèche. Élimination osseuse excessive lors de déplafonnement devrait également être évitée car le liquide interstitiel / sang a tendance à inonder la cavité lorsque de grands trous ont été créés. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.

Figure 9. Les résultats représentatifs -. Heptanol perte d'audition induite et récupération moyenne réponse du tronc cérébral (ABR) seuils (dB SPL) tracés en fonction de la tonalité pipla fréquence. Les mesures sont regroupées en fonction de pré-exposition (noir-Control) et le jour post-opératoire (POD) 1, 7 et 14 (rouge). Les barres d'erreur représentent SEM. Figure a été ré-tracée à partir Stevens et al. 2014. 15 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
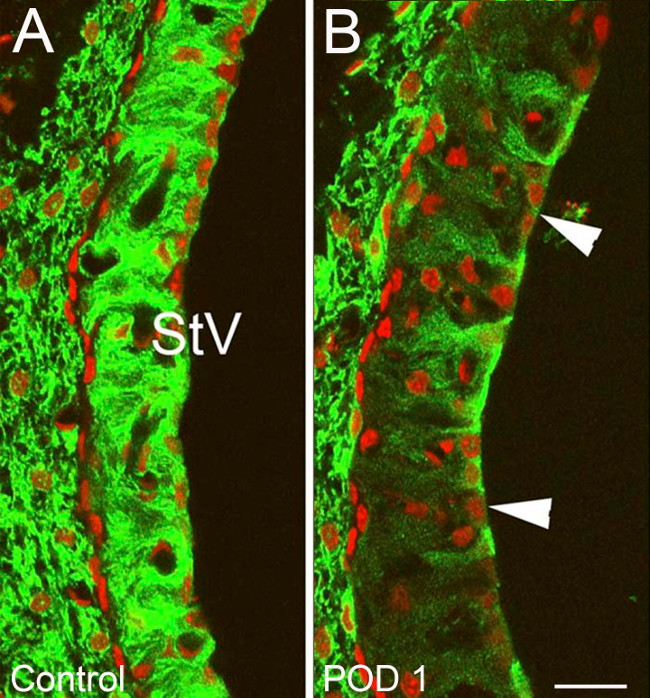
Figure 10. Les résultats représentatifs - ciblés dommages cochléaires après l'exposition de heptanol partie I. Les changements de potassium Inner Rectifier (Kir) Canal 4.1 coloration au sein de la strie vasculaire (STV) de oreilles traitées avec heptanol et contrôler les oreilles. (A) Normale Kir 4.1 coloration typique des oreilles de contrôle avec une forte affinité cellulaire strial Kir 4.1 (vert). (B) l'oreille de traitement sur POD1. Les grandes zones de vacuolisées dimassouplies Kir 4.1 affinité sont vus dans l'StV (pointes de flèche) avec une diminution globale StV Kir 4.1 intensité de la coloration. Les noyaux sont contre-colorées avec l'iodure de propidium (rouge) (B). La barre d'échelle = 15 um. Figure a été ré-tracée à partir Stevens et al, 2014. 15 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
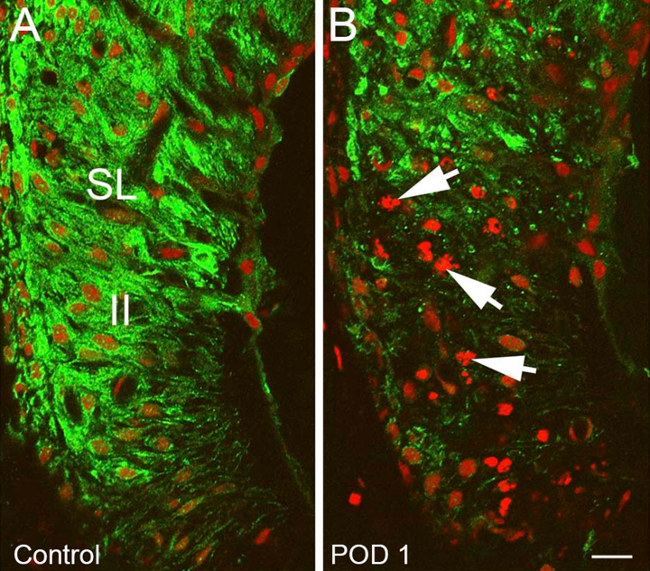
Figure 11. Les résultats représentatifs - ciblés dommages cochléaires après l'exposition de la partie II heptanol changements dans le ligament spiral (SL) de heptanol oreille traitée par rapport à contrôler l'oreille.. (A) Normale Kir 4.1 coloration (vert) dans le SL typique de contrôle oreille avec Type d'apparence normale II fibrocytes ligament spirale (II). (B) Heptanol tréé oreille avec une diminution marquée de l'intensité Kir 4.1 de coloration dans le domaine de type II fibrocytes ligament spirale, la perturbation nucléaire et chromosomal condensation / bulles compatibles avec l'apoptose (flèches). Les noyaux sont contre-colorées avec l'iodure de propidium (rouge). La barre d'échelle = 15 um. Figure a été ré-tracée à partir Stevens et al, 2014. 15 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
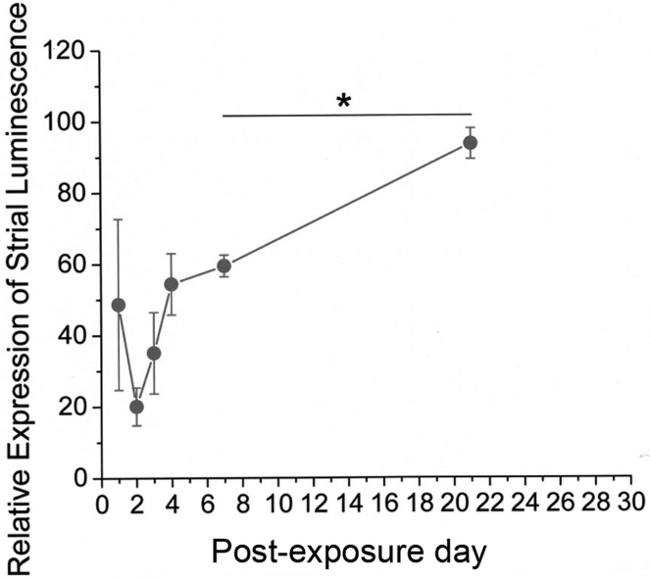
Figure 12. Les résultats représentatifs. - Récupération de cochléaire intensité de coloration après une exposition de heptanol luminance moyenne relative de Kir 4.1 coloration tracée en fonction de la journée post-exposition. Luminance relative est calculée comme Kir 4.1 intensité de réflexion en microscopie confocale en heptanol régaloreilles ed pris comme un pourcentage de la même dans les oreilles de commande. Remarque Les données sont regroupées POD14-28 comme un seul point sur la courbe. Les cercles pleins représentent les valeurs moyennes tandis que les barres d'erreur représentent l'erreur standard de la moyenne. Une reprise significative de luminance relative a été démontrée entre POD 7 et des dates ultérieures (test t de Student de p <0,05), Asterisk. Figure a été ré-tracée à partir Stevens et al., 2014. 15 S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Les résultats de protocole et représentatives décrites ci-dessus ont été obtenus dans un modèle de souris CBA / CaJ y compris les deux sexes. Cette souche consanguine est bien établi comme une norme "bonne audience» et le modèle «normal de vieillissement" dans la recherche d'audition. 16-23 Description de l'utilisation de ce protocole dans d'autres modèles de mammifères est au-delà de la portée de ce texte. Le lecteur doit noter, cependant, que la technique d'application RWN offre plusieurs avantages à l'étude de l'oreille interne des mammifères. Parmi ceux-ci, le plus notable est qu'il évite la perturbation directe de la structure anatomique délicate et gradients biochimiques qui existent dans les murs de la capsule otique. Les procédures telles que cochléostomie et l'implantation de pompes à perfusion ont la propension à violer directement les structures de l'oreille interne conduisant à des changements permanents de seuil; un fait qui doit être pris en considération lors de l'analyse des résultats. Perturbation des structures latérales cochléaires murales par métho invasiveds peut également limiter l'utilisation d'agents ototoxiques tels que le furosémide ou heptanol, dont la zone spécifique de l'effet est limité à cet endroit. 15,24 approches non invasives alternatives telles que l'injection trans-tympanique et injection parentérale ont été en proie à des résultats peu fiables et / ou de toxicité systémique pour le modèle animal. Cette méthode d'application a prouvé pour éviter à la fois de ces lacunes, la réalisation d'un niveau de cohérence se rapprochant de celui des méthodes plus invasives décrites ci-dessus.
Autres avantages de cette technique comprennent est sa large applicabilité à un certain nombre de modèles animaux et de la faisabilité d'intégrer dans une infrastructure de laboratoire existant. En ce qui concerne ce dernier, pas de réactifs ou de produits chimiques spécialisés sont nécessaires à part les agents ototoxiques, des anesthésiques, des analgésiques et choisis. Agents ototoxiques sont généralement utilisés à une concentration fixe et mélangés dans un volume assez important de la solution (5 ml) pour durer de longues périodes de temps envisagering chaque application utilise environ 10 pi (chez la souris). Ainsi, après l'achat initial de fournitures et d'instruments, les enquêteurs sont relativement libres de temps de préparation de la solution ou le remplacement fréquent des matériaux. Cette technique offre également des réductions de temps opératoire, qui peut être significative par rapport aux procédures impliquant une implantation de pompes à perfusion périlymphatiques ou cochleostomies. Après avoir atteint un niveau de compétence technique, notre délai moyen d'incision initiale à la fermeture était typiquement 20 min à 1,5 h en fonction de la durée de l'exposition souhaitée pour l'agent ototoxiques. Trois ou quatre chirurgies peuvent facilement être complété en une seule journée, ce qui permet d'accroître l'efficacité et accroître le potentiel pour obtenir de bons résultats. Comme décrit ci-dessus, cette technique peut également être facilement appliquée à une variété de modèles de rongeurs, y compris les rats, les souris, les cobayes et les gerbilles.
Limites de cette méthode sont centrées sur lamodérément courbe d'apprentissage abrupte nécessaire pour le maîtriser et une diminution des résultats attendus jusqu'à la compétence technique est atteint. Comme on le verra plus en détail ci-dessous, de petites erreurs au cours de l'approche chirurgicale ou la visualisation insuffisante du champ opératoire seront presque toujours conduire à un mauvais résultat. Conclusions subtiles qu'un novice peut ne pas reconnaître, comme un sous-millimètre d'épaisseur bulle d'air bloquant l'accès de l'agent à la membrane de fenêtre ronde ou liquide interstitiel dilution de l'agent, prenez le temps d'apprécier et de développer les habiletés psychomotrices nécessaires pour les corriger. Cependant, avec une performance répétée de la procédure de ces obstacles sont facilement surmontés et constituent un défi technique moins intimidant aux enquêteurs que quelques-unes des méthodes invasives susmentionnés. Enfin, cette technique est associée à la limitation relative qui blessures cochléaire ne peut être induite à un seul point dans le temps au cours de l'exposition chirurgicale. Ceci peut être surmonté dans une certaine mesure, En remplissant le RWN avec absorbable éponge de gélatine trempées dans l'agent comme il a été décrit par Heydt et al. 10 L'éponge de gélatine absorbable se résorber au fil du temps, mais peut permettre une période d'exposition plus longue que ce qui est possible grâce à l'application d'une solution aqueuse seul.
Pour un enquêteur pour réaliser tous les avantages de cette technique et d'éviter les pièges, il est essentiel de reconnaître les deux éléments essentiels de cette technique: 1) maintenir constamment la visualisation de l'espace de l'oreille moyenne et RWN; et 2) la capacité de garder champ chirurgical exempte de fluide et / ou de sang interstitielle. Pour atteindre le premier de ceux-ci, l'importance d'un porte-tête appropriée ne peut pas être surestimée. Fixation sûre de la tête de l'animal assure une vue stable sous le microscope; l'importance de ce qui devient vite évident lorsque l'instrumentation subtile change radicalement le positionnement des structures sous grossissement. Un bon htitulaire de l'EAD qui peut tourner autour de l'axe rostrale-caudale de l'animal facilite aussi les changements dynamiques importantes dans la ligne de vue de l'enquêteur. Souvent, quelques millimètres de rotation autour de cet axe peuvent signifier la différence entre la visualisation de la RWN et la visualisation de l'os que la capsule otique. La capacité de changer constamment de vue est également primordiale pour assurer le liquide interstitiel est correctement retiré du fond de la niche et également que l'agent ototoxiques est entièrement retiré entre les applications tel que discuté dans la partie 5. Dans notre expérience, le sang, la condensation ou le liquide interstitiel qui entre dans l'espace de l'oreille moyenne a la capacité d'interférer avec l'expérience entière. Cela ne surprend pas, car la petite quantité d'agent ototoxiques appliqué à la fenêtre ronde (~ 10 pi) peut facilement être dilué en entrant en contact avec même de petits volumes de fluide étrangère. Pour cette raison, la dissection chirurgicale méticuleuse, déplafonnement fragmentaire de la bulle tympanique et PRESEVAT attentionion de l'artère stapédienne sont équivaut à un succès des résultats expérimentaux.
Si les étapes critiques ci-dessus sont respectées et les résultats attendus ne sont pas encore atteints, dépannage doit commencer. Dans notre expérience, il est souvent utile pour effectuer un essai variations de deux éléments de procédure. La première consiste à modifier la fréquence à laquelle l'agent ototoxique est reconstitué dans la fenêtre ronde. En fonction de l'agent utilisé, le temps d'exposition totale est comprise entre 30 min et 1 heure, avec évacuation complète et le remplacement ultérieur de l'agent toutes les 10 min. Si l'exposition pour de courtes durées, augmenter l'exposition globale peut permettre à l'agent plus de temps pour diffuser à travers la membrane de fenêtre ronde. Exposition supplémentaires et le réapprovisionnement peuvent aussi aider à éviter une dilution non désirée de l'agent ototoxiques par le sang, la condensation, ou interstitielle comme discuté ci-dessus. La prudence devrait être maintenu en utilisant cette approche, cependant, car il tend à augmenter le risque d'inadvertanceLy blesser l'artère stapédienne et / ou d'introduire le liquide interstitiel à l'RWN.
Cette technique est important dans ce qu'il offre aux enquêtes de la physiologie cochléaire et la physiopathologie. Cette technique mini-invasive permet étude détaillée des processus biochimiques délicates et a été revient dans la poursuite de nos recherches visant à évaluer le potentiel régénératif cochléaire. 12,24 Cette approche chirurgicale et l'exposition est également reproduite à travers une variété d'autres techniques de ramification, et de bons résultats en utilisant cette méthode ont été rapportés dans les études de l'implantation cochléaire sur les cellules souches. 14 Il reste encore beaucoup à découvrir sur la cochlée, cependant, cette technique, avec l'arsenal plus large à la disposition des enquêteurs, aidera à réduire cet écart de connaissances.
Déclarations de divulgation
Pas de compétition intérêts financiers. Les auteurs ont rien à révéler.
Remerciements
This work was supported by National Institutes of Health (NIH) Grant number: NIH P50DC00422 (H.L.); NIH R01DC12058 (H.L.). This work also benefitted from the South Carolina Clinical and Translational Research Institution (SCTR) Clinical and Translational Science Award (NIH/NCRR UL1RR029882). The funders had no role in study design, data collection, and/or analysis. The authors would like to thank Lonnie E. Brown Jr. for his artistic and graphic contributions.
matériels
| Name | Company | Catalog Number | Comments |
| 1-Heptanol 98% | Sigma-Aldrich | H2805 | PubChem Substance ID 24895536 |
| Ketaset Injectable | Patterson Veterinary | 07-803-6637 | Concentrate 100mg/ml |
| (Ketamine HCl) | 10 ml | Schedule CIII controlled substance | |
| Anased Injectable | Lloyd Laboratories | NADA# 139-236 | Concentrate 20mg/ml |
| Buprenex Injectable | Patterson Veterinary | 07-850-2280 | Concentrate 0.3 mg/ml |
| (Buprenorphine HCl) | 5 ampules per box | Schedule CIII controlled substance | |
| Betadine Skin Prep Solution | Medline | MDS093941 | 1 Quart screw top bottle |
| 0.9% Sterile Saline | Variable | For mixing solutions and injections | |
| Operating Microscope | Carl Zeiss | 32192 | |
| Controlled Acoustics Environment Sound Booth | Industrial Acoustics Company | ||
| Surgical Head Holder | Custom Made – | Please see Figure 3 | |
| Medical University of South Carolina | |||
| Neck Soft-Tissue Retractor (Wire Speculum, Titanium) 1.75 inch | World Precision Instruments | 555801L | Maximum spread 20 mm |
| Embedded in disposable putty to affix dynamically to head holder | |||
| 90N Dental Belt Driven Hand Drill | Emesco | Vintage Item | |
| Scalpel Handle Size 6 | Bard-Parker | MEDC-011990 | |
| #15c Stainless Steel Surgical Scalpel Blade | Bard-Parker | SKU: 097-7215 | 50 Blades/Box |
| Via ACE Surgical Supply Code | |||
| Straight Tip Jewelers Forceps | Bernell | MIL17304 | |
| Iris Scissors Curved | Medline | DYND04026 | |
| Iris Scissors Straight | Medline | DYND04025 | |
| Stevens Tenotomy Scissors Straight | Medline | MDG3222111 | |
| Rosen Ear Needle Straight Shaft, Lightly Curved Tip | MytaMed | Item# 6.56.00 | Figure 1 demonstrates angled shaft picks. This was later substituted for the Rosen picks |
| Rosen Ear Needle Straight Shaft, Strongly Curved Tip | MytaMed | Item# 6.56.01 | |
| Kimwipes Delicate Task Wipers | Kimtech Science | CODE 34155 | White, Size 4.4x8.4 Inch. Cut to triangles and rolled into fine tip wicks. |
| House Ear Curette, 6” shaft, light angle | Medline | MDG0396486 | |
| Gelfoam (absorbable gelatin sponge) Size 100 | Medline | IIS34201 | Substitutions may be made |
| Cotton pellets #3 4 mm | Richmond | Manufacturer Code 100108 | |
| ElectroSurgical Unit 100 E M/M | Elmed | List No. 52-5770 | Bipolar and Monopolar Capable |
| 1cc U-100 Insulin Syringe 28G, 0.5” length needle | BD | Product Number: 329410 | Optional for delivery of Ototoxic agent |
| 23G, blunt tip, 1” length needle | Kendall | Product Code 8881202397 | For controlled delivery of Ototoxic agent with less risk of damaging stapedial artery |
| Surgical Mask | U-line | S-10478 | |
| Exam Grade Nitrile Surgical Gloves | U-line | S-12549 | |
| Precision Hair Clippers | Wahl | Multiple models may be substituted | |
| 5-0 Nylon black monofilament suture on PC-1 13 mm 3/8 circle needle | Ethilon | 1855G | Substitutions may be made. |
| Instant Sealing Sterilization Pouch | Fisher | 01-812054 | |
| Dry Sterilizer | ROBOZ | Germinator TM 500 |
Références
- Kimura, R. S., Iverson, N. A., Southard, R. E. Selective lesions of the vestibular labyrinth. The Annals of otology, rhinology, and laryngology. 97, 577-584 (1988).
- Dodson, H. C. Loss and survival of spiral ganglion neurons in the guinea pig after intracochlear perfusion with aminoglycosides. Journal of neurocytology. 26, 541-556 (1997).
- Wanamaker, H. H., Gruenwald, L., Damm, K. J., Ogata, Y., Slepecky, N. Dose-related vestibular and cochlear effects of transtympanic gentamicin. The American journal of otology. 19, 170-179 (1998).
- Lee, K. S., Kimura, R. S. Effect of ototoxic drug administration to the endolymphatic sac. The Annals of otology, rhinology, and laryngology. 100, 355-360 (1991).
- Schmiedt, R. A., Okamura, H. O., Lang, H., Schulte, B. A. Ouabain application to the round window of the gerbil cochlea: a model of auditory neuropathy and apoptosis. Journal of the Association for Research in Otolaryngology : JARO. 3, 223-233 (2002).
- Schmiedt, R. A., Lang, H., Okamura, H. O., Schulte, B. A. Effects of furosemide applied chronically to the round window: a model of metabolic presbyacusis. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, 9643-9650 (2002).
- Suzuki, M., Kikuchi, T., Ikeda, K. Endocochlear potential and endolymphatic K+ changes induced by gap junction blockers. Acta oto-laryngologica. 124, 902-906 (2004).
- Chen, Z., Mikulec, A. A., McKenna, M. J., Sewell, W. F., Kujawa, S. G. A method for intracochlear drug delivery in the mouse. Journal of neuroscience methods. 150, 67-73 (2006).
- Husmann, K. R., Morgan, A. S., Girod, D. A., Durham, D. Round window administration of gentamicin: a new method for the study of ototoxicity of cochlear hair cells. Hearing research. 125, 109-119 (1998).
- Heydt, J. L., Cunningham, L. L., Rubel, E. W., Coltrera, M. D. Round window gentamicin application: an inner ear hair cell damage protocol for the mouse. Hearing research. 162, 65-74 (2004).
- Palmgren, B., Jin, Z., Ma, H., Jiao, Y., Olivius, P. beta-Bungarotoxin application to the round window: an in vivo deafferentation model of the inner ear. Hearing research. 265, 70-76 (2010).
- Lang, H., Schulte, B. A., Schmiedt, R. A. Effects of chronic furosemide treatment and age on cell division in the adult gerbil inner ear. Journal of the Association for Research in Otolaryngology : JARO. 4, 164-175 (2003).
- Lang, H., Schulte, B. A., Schmiedt, R. A. Ouabain induces apoptotic cell death in type I spiral ganglion neurons, but not type II neurons. Journal of the Association for Research in Otolaryngology : JARO. 6, 63-74 (2005).
- Lang, H., et al. Transplantation of mouse embryonic stem cells into the cochlea of an auditory-neuropathy animal model: effects of timing after injury. Journal of the Association for Research in Otolaryngology : JARO. 9, 225-240 (2008).
- Stevens, S. M., et al. Heptanol application to the mouse round window: a model for studying cochlear lateral wall regeneration. Otolaryngology--head and neck surgery : official journal of American Academy of Otolaryngology-Head and Neck Surgery. 150, 659-665 (2014).
- Zheng, Q. Y., Johnson, K. R., Erway, L. C. Assessment of hearing in 80 inbred strains of mice by ABR threshold analyses. Hearing research. 130, 94-107 (1999).
- Hequembourg, S., Liberman, M. C. Spiral ligament pathology: a major aspect of age-related cochlear degeneration in C57BL/6 mice. Journal of the Association for Research in Otolaryngology : JARO. 2, 118-129 (2001).
- Ohlemiller, K. K., Gagnon, P. M. Apical-to-basal gradients in age-related cochlear degeneration and their relationship to 'primary' loss of cochlear neurons. The Journal of comparative neurology. 479, 103-116 (2004).
- Tadros, S. F., D'Souza, M., Zhu, X., Frisina, R. D. Apoptosis-related genes change their expression with age and hearing loss in the mouse cochlea. Apoptosis : an international journal on programmed cell death. 13, 1303-1321 (2008).
- Souza, M., Zhu, X., Frisina, R. D. Novel approach to select genes from RMA normalized microarray data using functional hearing tests in aging mice. Journal of neuroscience. 171, 279-287 (2008).
- Tang, X., et al. Age-related hearing loss: GABA, nicotinic acetylcholine and NMDA receptor expression changes in spiral ganglion neurons of the mouse. Neuroscience. 259, 184-193 (2014).
- Borkholder, D. A., Zhu, X., Frisina, R. D. Round window membrane intracochlear drug delivery enhanced by induced advection. Journal of controlled release : official journal of the Controlled Release Society. 174, 171-176 (2014).
- Tadros, S. F., D'Souza, M., Zhu, X., Frisina, R. D. Gene expression changes for antioxidants pathways in the mouse cochlea: relations to age-related hearing deficits. PloS one. 9, e90279(2014).
- Lang, H., et al. Sox2 up-regulation and glial cell proliferation following degeneration of spiral ganglion neurons in the adult mouse inner ear. Journal of the Association for Research in Otolaryngology : JARO. 12, 151-171 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon