Method Article
תכנון, אריזה, משלוח של רטרו CRISPR כייל גבוה ו Lentiviruses באמצעות Stereotaxic הזרקת
In This Article
Summary
מערכת CRISPR / Cas9 מציעה את הפוטנציאל להפוך הגנום ממוקד עריכה נגישה ובמחיר סביר לקהילה המדעית. פרוטוקול זה נועד להדגים כיצד ליצור וירוסים אשר מפסיד יוצאים גן של עניין באמצעות מערכת CRISPR / Cas9, ואז מזריקים אותם stereotaxically לתוך מוח העכבר הבוגר.
Abstract
Replication defective lentiviruses or retroviruses are capable of stably integrating transgenes into the genome of an infected host cell. This technique has been widely used to encode fluorescent proteins, opto- or chemo-genetic controllers of cell activity, or heterologous expression of human genes in model organisms. These viruses have also successfully been used to deliver recombinases to relevant target sites in transgenic animals, or even deliver small hairpin or micro RNAs in order to manipulate gene expression. While these techniques have been fruitful, they rely on transgenic animals (recombinases) or frequently lack high efficacy and specificity (shRNA/miRNA). In contrast, the CRISPR/Cas system uses an exogenous Cas nuclease which targets specific sites in an organism's genome via an exogenous guide RNA in order to induce double stranded breaks in DNA. These breaks are then repaired by non-homologous end joining (NHEJ), producing insertion and deletion (indel) mutations that can result in deleterious missense or nonsense mutations. This manuscript provides detailed methods for the design, production, injection, and validation of single lenti/retro virus particles that can stably transduce neurons to express a fluorescent reporter, Cas9, and sgRNAs to knockout genes in a model organism.
Introduction
כדי ללמוד את הבסיס של פיזיולוגיה נורמלית והפתולוגיה מחלה, יש צורך לתמרן ביטוי גנים בדיוק אורגניזמים מודל. עבור אורגניזמים מודל יונקים, זה הוא מרוכז בעיקר על היצירה והפיתוח של עכברים מהונדסים שבו מרכיב גנטי של ריבית מוקף אתרים מוכרים על ידי recombinase. זה יכול לגרום מניפולציה אתר ספציפי של גנים ולצדו אלה. אמנם זה כבר אסטרטגיה מוצלחת, זה זמן ומשאבים רבים; למשל, יצירת חיים מהונדסים משולשים שיבטאו גן floxed, recombinase Cre, ואת גן כתב Cre דורשת הזדווגויות ואימות מרובות. לעומת זאת, הזרקת stereotaxic של שכפול חלקיקים נגיפיים פגומים קידוד חלבון פלואורסצנטי ואת recombinase לתוך חית גן floxed אינו מחייבים גנוטיפ מורכב או אסטרטגיות רבייה 1. יתר על כן, אם חלבון פלואורסצנטי ו Cre להביע וירוס הוא שיתוף מוזרק עם enco וירוס שנידינג חלבון פלואורסצנטי שונה, אז זה מספק שליטה בתוך הרקמות עבור המניפולציה הגנטית הממוקדת. בעוד אסטרטגיה זו עדיין דורש את השימוש בבעלי חיים עקום, אסטרטגיות מבוססות RNA בתיווך ויראלי לעקוף את הצורך חיות טרנסגניות. לדוגמא, הזרקת stereotaxic של וירוסים שכפולים מחסרת המקודדים חלבון פלואורסצנטי ו RNA מכבנה קצרה (shRNA) יכולה להשתמש מכונית RNAi אנדוגני של התא כדי לגרום לירידה חזקה לפרוטוקול של גן של עניין. עם זאת, אסטרטגיות shRNA לייצר דפיקה ומורדות גן עדין ופעמים רבות תוצאת פנוטיפים הסלולר צנוע 2. בעוד למטה דפיקה עשוי להיות רלוונטי יותר פיסיולוגי לטיפול באין גן הטרוזיגוטיים, חוסן הירד שלה לעומת פסק דפיקה אינו אידיאלי עבור גילוי פנוטיפי של גנים חדשים.
טכניקה שלישית שנוצרה לאחרונה, CRISPR (באשכולות קבוע Interspaced חזור קצר Palindromic) / Cas9 (CRISPR הקשוריםחלבון 9) מערכת, מסתמך על הביטוי הן של RNA אקסוגניים קטן אנזים חיתוך DNA. המערכת CRISPR / Cas9 הותאמה ממערכת החיסון פרוקריוטים אשר פיתחו שיטה לזיהוי זרים, פולשים DNA מפני וירוסים ותוכנות מיקוד זה שעומד לעבור פירוק באמצעות האנזים Cas9 3,4. טכניקת עריכת הגנום עצמה זה יכול לשמש ליצירת מחיקות ממוקדות, הוספות, ומוטציות; ואת הפרוטוקול הבא מתאר כיצד לבצע מחיקות בתוך גן של עניין על מנת המפסיד יוצא ביטויו vivo. אנזים Cas9 חייב לבוא לידי ביטוי עם RNA מדריך הומולוגי אל האזור של עניין ורציף עם RNA פיגום. נוק של גן באמצעות טכניקה זו דורש מיקוד Cas9 לאזור מסוים בגנום באמצעות RNAs מדריך הסינטטי (sgRNA), ואת גרימת הפסקות גדילים כפולות (DSBs) באתר של עניין. DSBs אלה הם תוקנו לאחר מכן על ידי מכונות לתיקון תאים אנדוגני באמצעות הצטרפותו קצה שאינם הומולוגיים (NHEJ) אשר leמודעת indels שעשוי לייצר מוטציות missense או שטויות ולכן יכול ליצור פסד של ביטוי חלבון פונקציונלי 5. מכיוון שהמערכת הזו מייצרת שינויים גנומיים, זה רק דורש את הביטוי החולף של Cas9 ו sgRNA. עם זאת, רצוי אינדיקטור ניאון יציב כדי לזהות תאים וצאצאיהם המנוהלים באופן זה.
יש Lenti- ו רטרווירוסים היתרון של שילוב הדנ"א של עניין ביציבות לתוך התאים המארחים המקיימות ביטוי לטווח ארוך מועברים לתאי הבת במהלך מיטוזה. פרוטוקול זה מתאר את העיצוב והייצור של שני סוגים של שכפול פגום, רטרווירוסים כייל גבוה: חלקיקי lentiviral נגזרות וירוס הכשל החיסוני האנושי (lentivirus) ואלה המבוססים על וירוס murine מאלוני לוקמיה (רטרו-וירוס). בעוד שני הנגיפים הללו מסוגלים לתמוך יציבה מביעה של transgenes הגדול, חלקיקי retroviral יכולים לשלב רק לתוך הגנום duחלוקת תא טבעת עם השפלה של מעטפת הגרעין, ולכן יכולה לשמש ככלי לתייג ולידת עדכני תאי 6. בעוד lentiviruses יש מוניטין של להיות נמוכה יחסית כייל 7, מתודולוגיה זו, ובכלל זה שימוש קפאין 8 במהלך איסוף ויראלי, מייצרת כותרות שגרתי של 10 9 ו -10 10 חלקיקים / מ"ל. יתרון נוסף של lenti- ו רטרווירוסים הוא הסובלנות מוסיף מאוד גדול. האוסף של הפרוטוקולים הבאים מתאר את הליך תכנון lenti או רטרו-וירוס קידוד כתב ניאון, sgRNAs, ו Cas9 כדי לנצל את המערכת CRISPR / Cas9 לשנות DNA וכן להביע חלבון פלואורסצנטי.
עכבר נוירוכירורגיה stereotaxic היא שיטת ערך להזרקת וירוסי in vivo ללמוד מורפולוגיה, פונקציה, וקישוריות של נוירונים נגועים. זיהום ויראלי בנוירונים יכול לשמש כדי לתפעל רמות ביטוי על פני תקופה ממושכת של טיםדואר, כגון במהלך התפתחות, וביטוי ניתן לשלוט במדויק על ידי השימוש במערכות שונות סמים מושרים וביטוי ספציפי מונע Cre. פרוטוקול מסוים זה מסביר כיצד להזריק וירוס בעת sgRNA ו Cas9 כדי המפסיד יוצא גן של עניין במוח של עכבר בוגר. עכברים להתאושש מהר מאוד מהליך זה וביטוי של transgene ויראלי ניתן לראות בתוך ההזרקה 48 שעות. עם זאת, הביטוי fluorophore מופיע להגדיל במשך שבועות וכתוצאה מכך רמות מקסימלי בסמוך 3 שבועות לאחר ההדבקה. עכברים לעבור הזרקת stereotaxic ויראלי יכול לשמש התנהגות, אלקטרופיזיולוגיה, או מחקרים מורפולוגיים. בסך הכל, המטרה של נהלים אלה היא להדגים כיצד מפסיד יוצא גן במוח העכבר הבוגר באמצעות ניתוח stereotaxic ו וירוס להביע sgRNA ספציפי Cas9.
Protocol
משפט ואתיקה: כל הפרוטוקולים אושרו על ידי טיפול בבעלי חי הבטיחות הביולוגית והמוסדי מוסדיים Dartmouth ועדת שימוש הוועדות הבוחנות.
1. פרוטוקול עיצוב Strand מדריך (sgRNA) עבור CRISPR / Cas9 רטרו-וירוס
הערה: ישנם אתרי אינטרנט ללא כוונת רווח רב שיכולים לשמש ליצירת sgRNAs למקד גן של עניין (https://benchling.com/ ו http://crispr.mit.edu/). מטרת פרוטוקול זה היא לעצב להזמין oligos התקוע יחיד מרוכל מסחרי, כי הם מרותקים לזה. אוליגו annealed זה יהיה ligated לתוך וקטור העברת PXL. ראה וידאו משלים 1 דוגמה של sgRNAs עיצוב בעזרת Benchling.
- השתמש אתר אינטרנט המוקדש לעיצוב sgRNAs.
הערה: לדוגמה, המזינים קידוד / רצף exonic מן בסמוך לנקודת ההתחלה של הגן של עניין לתוך האתר יפיק sgRNA 20 נוקליאוטידים. השתמש רצף 20 נוקליאוטידים sgRNA לעצב את השכל אוליגו אנטי תחושההים שהוזמן כדי ליצור את sgRNA. - לאחר יצירת sgRNA, להעתיק את הרצף הזה לתוך מעבד תמלילים. הוספת G (גואנין) לתחילת רצף sgRNA 20 נוקליאוטידים במסמך אם זה לא כבר להתחיל עם אחד (כלומר, רצף sgRNA נוקלאוטיד G-20). הדבר נחוץ כדי להבטיח שעתוק טוב את האמרגן U6.
- לתעד את המשלים השני של רצף עכשיו 20-21 נוקליאוטידים זה. לקבלת אוליגו תחושה, להוסיף "CACC" עד הסוף '5 של רצף במסמך (כלומר, CACC-G-20 נוקליאוטידים רצף sgRNA). סככה זה תשמש ולקשור את הרצף לתוך וקטור PXL.
- לקבלת אוליגו antisense, להוסיף AAAC עד 5 הסוף '. השתמש סככה זה ולקשור את הרצף לתוך וקטור PXL.
- השג את oligos השכל antisense. לאחר קבלת oligos, לעשות 100 מיקרומטר במניות באמצעות DNAse מים בחינם. מערבבים יחד 10 μl כל אחת 100 מיקרומטר oligos השכל antisense עם 4 μl של 10x חוד חוצץ 2, ו -16 μl של מים.
הערה: הם לא צריכים דף טיהור או 5'phosphorylation (כמו סככות BbsI שאינן תואמים קצוות מלוכדים).- תביאו 200 מ"ל מים לרתיחה בכוס 500 מ"ל, ואז לצוף הצינור המכיל תערובת זו בבעל "מצוף" קצף. לאפשר למים מגניבים לאט מ 95 מעלות צלזיוס למשך 2 שעות בטמפרטורת חדר.
- לדלל את תערובת annealed-אוליגו כעת 1: 1,000 במים סטריליים ולהשתמש מייד הקשירה הבאה או לאחסן את התגובה הנותרים ב -20 ° C.
- תקציר PXL, נגזר וקטור PX330, עם אנזים הגבלת BbsI ב 37 מעלות צלזיוס למשך 2 שעות. השתמש תגובה 40 μl המכיל 2 מיקרוגרם של PXL, 4 μl של 10x 2 חוד חוצץ, 1 μl של Bbs1 ומים איזון. נושא את PXL מתעכל כדי טיהור ג'ל שיגרתית באמצעות ערכה מסחרית. ודא כי התשואה היא ~ 8.5 מוצר kB.
- באמצעות ערכת קשירה מסחרית, ולקשור 1 μl של 1: 1,000oligos-annealed עם 50 ng של מתעכל ג'ל מטוהרים-PXL. להפוך את מוצר הקשירה לתוך רקומבינציה מוסמכת הלוקה E. coli (חוד 5-אלפא, יעילות subcloning). להקרין את transformants לנוכחות של המדריך הנכון על ידי רצפי DNA פלסמיד.
- לעכל את U6, מדריך גדיל, ואלמנטים פיגום RNA (sgRNA) מתוך PXL באמצעות אנזימי הגבלה BstB1 ו Pac1 ולקשור לתוך עמוד השדרה ויראלי פלורסנט חלבון-T2a-Cas9 מתעכל עם אותו אנזימי הגבלה. להפוך את מוצר הקשירה (יעילות מקסימלית של 5 אלפא חוד). פלסמידים עמוד שדרת ויראלי פלורסנט חלבון-T2a-Cas9 הם פלסמידים עותק נמוכים ולכן פרוטוקולים נמוכים עותק חייבים לשמש.
הערה: sgRNA השני יכול להיות מוצג באופן דומה על ידי עיכול פאצ'י של אחר פלסמיד PXL מדריך גדיל ו ligated לתוך Pac1 מתעכל phosphatase-מעיים עגל מטופלים עמוד השדרה ויראלי כבר המכיל את גדיל המדריך הראשון. טיפול phosphatase של פלסמיד העברת ויראלי יעזורלצמצם את מספר transformants מן-הקשירה העצמית של פלסמידים שאינו מכילים את המדריך השני. - רצף לאמת את הכנת פלסמיד מקסי הסופית באמצעות ערכת הכנת מקסי Xtra Nucleobond ואורז אותו לתוך וירוס באמצעות "פרוטוקול רטרו / Lentiviral הפקה - שיטת CaPO4" הבא.
2. כן 293FT / 293GP תאים עבור Transfection (רטרו / ייצור Lentiviral - שיטת CaPO4)
- (יום 1) במהירות להפשיר 1 בקבוקון של תאים לכל צלחת תרבות 10 ס"מ תא באמבט המים 37 מעלות צלזיוס. אריזה lentiviral, השתמש 293FT תאים. אריזה retroviral, השתמש 293GP (איסור פרסום / pol) תאים.
- פיפטה כל-תאים מופשרים מהצינור קריו לתוך צינור חרוטי 15 מ"ל ולהוסיף 2 מ"ל של מדיום של Dulbecco Modified של מחומם מראש CO 2 equilibrated השלמה Iscove.
- תאי צנטריפוגה במשך 5 דקות ב 500 XG כדי גלולים. לשאוב supernatant ו resuspend התא גלולה ב 10 מ"ל של שלמה האםהמפרצון של Modified הבינוני של Dulbecco. פלייט התאים על צלחת תרבית תאים 10 ס"מ. דגירת תאי הלילה ב 37 מעלות צלזיוס חממת פחמן דו חמצני 5%.
- (יום 2) 24 שעות לאחר ציפוי, לשנות תקשורת על הצלחת על ידי aspirating התקשורת הקיימת והוסיף 10 מיליליטר של מחומם מראש בינוני של Dulbecco Modified של Iscove לצלחת.
- (יום 3-4) 24-48 שעות לאחר שינוי התקשורת ופעם התאים הופכים ומחוברות, לפצל את התאים confluency של 2.5-3.0 x 10 6 תאים / צלחת (10 צלחת ס"מ).
- כדי לפצל את התאים, לשאוב את התקשורת לשטוף את הצלחת עם 5 מ"ל של PBS. הוסף 1 מ"ל של טריפסין 0.25% לצלחת לדגור על 37 מעלות צלזיוס עד שהתאים להרים את הצלחת. הוסף 0.5 מ"ל של מדיום של Dulbecco Modified של Iscove לנטרל את התגובה טריפסין 0.25% ו פיפטה את התאים לתוך צינור 1.5 מ"ל.
- ספין התאים ב XG 500 במשך 5 דקות. Resuspend התאים 1 מ"ל של מדיום של Dulbecco Modified של Iscove. לדלל 1081; l תאי 90 μl של PBS. ספירת התאים או באמצעות hemocytometer או נגד תא אוטומטי. Re-צלחת 2.5-3.0 x 10 6 תאים / צלחת עם בינוני של Dulbecco Modified של שלמה Iscove.
הערה: תא יהיה ~ 50% ומחוברות 24-34 שעות לאחר הציפוי. Transfect התאים כאשר הם ~ 50% ומחוברות.
3. (יום 5) Transfection CaPO4 וגביית ויראלי חלקיקים
- שנה את hr תקשורת 2 לפני transfection ידי aspirating התקשורת הקיימת והוסיף 10 מיליליטר של המדיום של Dulbecco Modified של מחומם מראש Iscove. ודא כי יש בדיוק 10 מ"ל של התקשורת בצלחת 10 ס"מ.
- כן ריאגנטים transfection עבור 2 מנות באמצעות 2, צינורות קלקר תחתיים עגול 5 מיליליטר. לייבל הצינור הראשון "DNA" ואת הצינור השני "2X HBS". התאם את הריכוז של ה- DNA כדי 1μg / μl טריס-EDTA ב- pH 7.4.
- עבור lentiviruses, להוסיף לאט 20 μl של וקטור ההעברה (להלן: viral מבנה של עניין), 13 μl של CMVdelta8.9, 9 μl של-g VSV, 860 μl של כיתה ביולוגיה מולקולרית H 2 O, ו 100 μl של 2.5 M CaCl 2 אל הצינור הראשון ( "DNA") בעת הקשה ברציפות על הצינור לערבב.
- עבור רטרווירוסים, להשמיט את הפלסמיד CMVdelta8.9. הוסף 20 μl וקטור העברה, 15 μl VSV-G, 860 μl ביולוגיה מולקולרית כיתה H 2 O, ו 100 μl 2.5 M CaCl 2 אל צינור שכותרתו "DNA".
- הוסף 1 מ"ל של תמיסת מלח HEPES שנאגרו 2x (pH 7.0; pH זה הוא קריטי) אל הצינור שכותרתו "2X HBS".
- לאט לאט מוסיפים את תכולת 1 מ"ל של הצינור "DNA" אל הצינור "2X HBS", טיפה אחת בכל פעם. ברציפות לחץ על צינור "2X HBS" עם האצבע המורה או אצבע באמצע תוך הוספת תוכן של הצינור "DNA". שימו לב שלפוחית Capo 4 לכאורה לאחר כל טיפה. דגירה צינור בחושך במשך 30 דקות בטמפרטורת החדר.
- הוסף 1 מ"ל של transfection בטיפות איטי על כל צלחת תא 10 ס"מ, ואז דגירה לילה בשעה 37 ° C.
- (יום 6) חלף תקשורת עם 8 מיליליטר של FBS הבינוני + 0.5% ו -40 קפאין מ"ג של Dulbecco Modified של Iscove / 100 מיליליטר תקשורת. אם וקטור ההעברה מכיל בסמן פלורסנטי, אז ביטוי fluorophore מציין transfection מוצלח.
- (יום 7) איסוף התקשורת המכיל חלקיקים נגיפיים על ידי בעזרת פיפטה סרולוגיות 10 מ"ל ו לוותר לתוך צינור חרוטי 50 מ"ל. אחסן את צינור חרוטי 50 מ"ל ב 4 מעלות צלזיוס. הוסף 8 מ"ל של התקשורת FBS 0.5% על כל צלחת.
- (יום 8) שוב, לאסוף את המדיה המכילה חלקיקים נגיפיים ולשלב עם הקציר של היום הקודם בצינור חרוטי 50 מ"ל.
ריכוז וטיהור 4. של הווירוס
- בצע פתרון גליקול 5x פוליאתילן 6000 על ידי הוספת 40% פוליאתילן גליקול 6000 ו -1.5 M NaCl כדי DDH 2 O. חיטוי הפתרוןהמחזור הנוזלי במשך 45 דקות ב 121 מעלות. לאט ומערבבים הפתרון כאשר הקירור.
הערה: הפתרון יתחיל מעונן ולאחר מכן יתברר כפי שהוא מתקרר. - צנטריפוגה צינור חרוטי 50 מ"ל המכיל שני אוספים של supernatant ויראלי XG ב 2000 במשך 10 דקות כדי גלולה חומר מסיס. לטהר את תקשורת ויראלי ידי סינון דרך 0.45 מיקרומטר מסנן מזרק נמוך חלבון מחייב (PES או PVDF).
- להוסיף פוליאתילן גליקול 5x 6000 פתרון למדיה (הריכוז הסופי צריך להיות פוליאתילן גליקול 8% 6000 ו -0.3 M NaCl). מערבבים על ידי היפוך הצינור מספר פעמים (לא מערבולת). דגירת פתרון פוליאתילן גליקול ויראלי המכיל ב 4 מעלות צלזיוס למשך 12 שעות או יותר, רמיקס מדי פעם.
- (יום 9) צנטריפוגה פתרון פוליאתילן גליקול ויראלי המכיל 2,500 XG במשך 45 דקות. סר וזורק supernatant ספין שוב במשך 2 דקות. שוב, להסיר ולסלק supernatant.
- Resuspend את הכדור על ידי הוספת 320 μl שלמלח סטרילית שנאגרו פוספט (320 μl הוא 1/100 ה מנפח המקורי של התקשורת ויראלי המכיל שנאספו) דגירה לילה ב 4 מעלות צלזיוס. לחלופין, resuspend גלולה בטמפרטורת החדר על כיסא נדנדה במשך 30 דקות.
- לאחר בדיקה חוזרת של השעיית גלולה, aliquot הנגיף (5-10 μl לכל 0.5 מ"ל צינור) ולהקפיא aliquots ב -80 ° C (להקפיא ההפשרה או אחסון ב 4 ° C תפחית את כייל דרמטי).
- כייל את הווירוסים באמצעות פרוטוקולים סטנדרטיים, כלומר, לבצע שורת דילול על צלחת 6-גם של תאי HEK293T באופן ידני לספור מושבות פלורסנט 48 שעות מאוחר יותר.
5. יעילות בדיקה של וירוס CRISPR
הערה: שיבוטים רצף באמצעות השלבים הבאים כדי לבדוק לייצור הפסקות פעמיים גדיל תוקן על ידי NHEJ תוך שימוש בתאי עכבר Neuro2A. זה יש יתרון על פני מבחני מודד בכך שהוא יכול לשמש כדי לקבוע את אחוז תאים ששונו ואופישל indels הנובע NHEJ.
- מעיל צלחת תרבית תאים 3.5 ס"מ עם תערובת חלבונים דביקות כגון matrigel בדילול 1:50 ב Modified של Iscove Dulbecco של בינוני ו דגירה במשך 30 דקות ב 37 מעלות צלזיוס. לשאוב את תערובת חלבוני קרישי צלחת תאי Neuro2A.
- אחרי התאים Neuro2A להגיע ל -50% המפגש, מוסיפים את CRISPR Lentivirus או רטרו-וירוס על ריבוי של זיהום של 10 (כלומר, 10 חלקיקים נגיפיים לכל תא).
הערה: תאי Neuro2A אינן כפי חביבות להדבקה, וזאת הן HEK293 תאים, ובכך, יחיד זיהום לא יגרום 100% של התאים להידבק עם lentivirus. יתר על כן, רטרו-וירוס רק מדביק חלוקת התאים ולכן גם לא לגרום לזיהום 100%. על מנת להשיג שיעור 100% ליד של זיהום, תוספת של וירוס ניתן לחזור על ימים מרובים, פיצול התא לפי צורך. לחלופין, תאים חיוביים פלורסנט ניתן לבודד באמצעות מופעל קרינת מיון תא. thדואר הדרך היעילה ביותר להשיג שיעור זיהום 100% עם lentiviruses הוא לבצע יחיד זיהום ואחריו בידוד FACS. לקבלת רטרווירוס, לבצע 4 סיבובים של זיהום 24 שעות זה מזה אחרי ידי בידוד FACS כדי להבטיח 100% הזיהום. - לאחר ההדבקה של התאים עבור 1 בשבוע, להרחיב את תאי המפגש ליד על צלחת 10 סנטימטרים, לשאוב את התקשורת, לשטוף את הצלחת עם 5 מיליליטר של תמיסת מלח פוספט שנאגר. הוסף 1 מ"ל של טריפסין 0.25% ו לדגור על 37 מעלות צלזיוס עד שהתאים להרים את הצלחת. הוסף 0.5 מ"ל של מדיום של Dulbecco Modified של Iscove לנטרל את התגובה 0.25% טריפסין ו פיפטה את התאים לתוך צינור 1.5 מ"ל ו גלולה התאים ב XG 500 במשך 5 דקות.
- כדי לבודד DNA, להוסיף 100 μl של אשלגן 50 מ"מ, מחדש להשעות את התאים, לדגור על 95 ° צלזיוס למשך 5 דקות. לנטרל את הפתרון באמצעות 10 μl של 1 M טריס, pH = 8.0.
- PCR להגביר את האזור איגוף באזור הגנומי ממוקד על ידי CRISPR sgRNAבאמצעות ~ 300 ננוגרם של DNA שבודד בשלב 5.5 באמצעות תערובת אמן PCR איכות גבוהה 4.
- הפעל את תגובת PCR על ג'ל 2.5% agarose ג'ל לטהר את שהבר בגודל המתאים באמצעות ערכת ג'ל לניקוי כגון ערכת חילוץ DNA ג'ל. ולקשור לתוך וקטור שיבוט PCR כגון קל-pGEM-T והופך 9 תאים מוסמכים.
- 24 שעות מאוחר יותר, להוסיף 2 מ"ל של מרק LB לתוך 15 מ"ל צינורות עגול תחתית וכן אנטיביוטי מתאים (אמפיצילין, neomycin, וכו '). לחסן את הצינור עם מושבה מסוימת בעזרת טיפ או לולאת פיפטה סטרילית כדי לבחור מושבה אחת מן-צלחת LB. להרחיב ולפתח את המושבה על ידי רועד את הצינור ב 250 סל"ד ו -37 מעלות צלזיוס למשך 24 שעות. חזור על כמה מושבות כמו רצוי.
- באמצעות ערכת מיני-prep, לבודד DNA מן E. coli ורצף עם פריימרים שנועדו להגביר את שטח הגן הממוקד ידי sgRNA כדי לנתח את אזור Cas9 של גנום העכבר.
6. פרוטוקול הזרקת Stereotaxic עבור עכבר למבוגרים
- היכונו כירורגיה
הערה: חשוב לשמור על תנאים סטריליים במהלך ניתוחי הישרדות. מטרה זו מושגת בפרוטוקול זה על ידי חום ומטהר את כלי הניתוח, באמצעות בבטאדין לחטא את הזריקה, והוספת משחה אנטיביוטית לאתר החתך לאחר שהוא נסגר. כמו כן, חשוב להשתמש בכפפות סטריליות וכן מעוקרים ביסודיות, באזור הניתוח ייעודי.- מכשור לכירורגיה מחממים לעקר לפני השימוש על ידי מעוקר או או מעקר חרוז חם משתמש. הכן בחדר ההתאוששות ואזור הניתוח על ידי הפעלת כריות חימום כדי לשמור על טמפרטורת הגוף במהלך הניתוח וההתאוששות. הרכב את התרגיל המשמש ליצירת חורים בגולגולת להזרקה.
- טען 4 μl של וירוס לתוך מחט הזריקה ידי הסגת וירוס ישירות מהצינור PCR סטרילי. בקצרה להסיר את aliquot ויראלי מקרח. לשמור על וירוסבתוך המזרק בטמפרטורת החדר למשך לא יותר מ 1 hr לפני הזריקה.
7. הזרקת Stereotaxic
- ודאו האוורור אל סוויטת הניתוח פתוח כדי להבטיח זרימת אוויר נאותה. הכן את העכבר לניתוח על ידי הרדמה עם isoflurane 4% בתא אינדוקציה. בעקבות הרדמה, לגלח את הראש כדי להכין את הזריקה.
- מניחים את העכבר המכשיר stereotaxic באמצעות פינצטה להעביר למטה הלשון הצידה. הכנס את בר הביס לתוך פה עד ששיני טיפה לחריץ, ואז לאבטח את סורגי האוזן. ודא כי הגוף של העכבר נמצא על כרית החימום והאף ממוקם חרטומו. isoflurane 4% ישיר לתוך חרטומו. אשר הרדמה על ידי צובט את הרגל עם פינצטה והבטיח שאין רפלקס בהלה.
- החל דמעות מלאכותיות כדי לשמן את העיניים. סיום הכנת הזריקה ידי בניקוי הראש המגולח עם סיבובים לסירוגין של povidone-יוד לידוקאין.
- באמצעות אזמל, לחתוך חתך קטן יחד במרכז הקרקפת. לייבש את הגולגולת עם מי חמצן ומימן ספוגית במידת הצורך כדי לעזור לדמיין גבחת.
- באמצעות היקף הניתוחים, אתר גבחת על הגולגולת ומקום קצה המקדח על גבחת. אפס (או רשום) את קואורדינטות stereotactic הדיגיטליות על x, y, z והמטוסים.
- על מנת להבטיח כי הראש הוא ברמה על מקורי זנב ציר ה- Y, למקם את המקדח על למבדה וליישר את הראש, כך z לתאם שווה בערך בשנייה גבחת ו למבדה.
- על מנת להבטיח כי הראש הוא ברמה על ציר ה- x, למקם את המקדח כדי למבדה y = 1/2. ודא כי z לתאם שווה ל 1 מ"מ בכל צד (x = +/- 1 מ"מ) של תפר sagittal. התאם את הגולגולת אם יש הבדל של z-לתאם ב 1mm שמאלה וימינה של למבדה.
- מניח את התרגיל על הקואורדינטות הרצויות. עבור gyrus המשוננת, יש להשתמש לתאםסאי = -1.9 מ גבחת ו- x = +/- 1.1. לפני קידוח, מנמיכים את isoflurane עד 2%, אז לאט ובזהירות, לקדוח דרך הגולגולת.
- לאחר קידוח כל החורים, לצרף את-מזרק מלא על המכשיר stereotaxic. ראייה למרכז את המזרק מעל החור לאפס את z לתאם את הגולגולת.
- לאט לאט להוריד את מזרק Z- עומק עמוק. עבור gyrus המשוננת, במעמקי z הם -2.5, -2.4, ו -2.3. בגין הזרקה בשיעור של 0.25 μl / min באמצעות מזרק stereotaxic.
- לאחר הזריקה תושלם ב Z-עומק הנמוך ביותר, לחכות 1 דקות, ולאחר מכן להעלות למשנהו לתאם ולהתחיל הזרקת שוב. ממשיך את הדפוס הזה עד שכל קואורדינטות z ההזרקה מוזרקות. חכה 2 דקות לפני הסרת המזרק לאחר הזריקה האחרונה.
הערה: אין תופעות לוואי כבר ציינו על הרקמה על ידי הזרקה עד 2 μl של נגיף לכל אונה במוח העכבר.
- לאחר הזריקה תושלם ב Z-עומק הנמוך ביותר, לחכות 1 דקות, ולאחר מכן להעלות למשנהו לתאם ולהתחיל הזרקת שוב. ממשיך את הדפוס הזה עד שכל קואורדינטות z ההזרקה מוזרקות. חכה 2 דקות לפני הסרת המזרק לאחר הזריקה האחרונה.
- הזרקה חזור על בולשים אחרים.
- לאחר ההזרקה, להסיר את העכבר מהמכשיר stereotaxic תפר את הקרקפת עם 6-0 תפרים משי. החל לידוקאין ו קרם אנטי בקטריאלי על הפצע.
- להזריק 0.8-1.0 מ"ל סליין + Ketoprofen (3-5 מ"ג / ק"ג) על ידי ניתוב IP לנהל את הכאב. אז במקום עכבר לתוך בחדר התאוששות מחומם. אין להשאיר את החיה ללא השגחה עד שהוא שב להכרתו מספיק כדי לשמור שכיבה sternal. אל תשלח את החיה בחברת חיות אחרות, עד שהיא התאוששה לחלוטין.
- בימים שלאחר הניתוח, לשקול את העכבר יומי ולספק מזון ופינוקים רכים. בדקו פצע לציין את המצב / התנהגות הכללית.
- בעקבות הזרקת stereotaxic, העכברים יכולים להיות מורדם עבור הכנת פרוסת אלקטרופיזיולוגיה 1 או perfused והמוח שלהם הוסרו, פרוס, ומוכתם באמצעות אימונוהיסטוכימיה לניתוח 10.
תוצאות
בעקבות "פרוטוקול עיצוב Strand מדריך (sgRNA) עבור CRISPR / Cas9 רטרו-וירוס", oligos מיקוד רצף מסוים מוכנסים לתוך וקטור שיבוט PXL במורד הזרם של האמרגן hU6 או במורד של פיגום RNA מדריך שימוש באתרי שיבוט BbsI (איור 1, שלב 1). SgRNA זה הוא נכרת אז מן PXL ו מוכנס לתוך עמוד השדרה pRubi באמצעות אתרי BstBI ו פאצ'י (איור 1, שלב 2). לבסוף, אחר sgRNA משובטים לתוך PXL ניתן למקם במורד הזרם של המדריך הראשון pRubi-Guide1 (איור 1, שלב 3), מיקוד לאזור אחר של הגן והגדלת הסיכוי בנוקאאוט דרך NHEJ. אימות של המבנים הנכונים צריכה להיקבע על ידי ניתוח רצף. ברגע מבנה זה הוא עשה, זה יכול להיות ארוז לתוך וירוס בעקבות "פרוטוקול רטרו / Lentiviral Production- CaPO4 שיטה". אריזה מוצלחת אושר על ידי זיהום של וירוס לתוך HEK293 תאים כדי titer נirus. אם אין ביטוי fluorophore אז הנראה אירעה שגיאה במהלך האריזה של הנגיף.
איור 2 הוא תוצאת נציג של 2 רטרווירוסים, GFP אחד להביע ואת mCherry לבטא אחרים, שיתוף מוזרק לתוך gyrus המשוננת של עכבר בילוד (7 ימים) צלם 21 ימים לאחר הזרקה. תיוג של נוירונים עם mCherry או GFP מאפשר הערכה מורפולוגית של מניפולציות גנטיות שונות באותה רקמה, שבו וירוס אחד יכול להביע CRISPR / Cas9 בתיווך KO ואת וירוס בקרה אחרים, להביע fluorophore בלבד. הזרקת Stereotaxic מאפשרת סלקטיביות אנטומיים מדויקות כפי שהודגם על ידי הזיהום הדיסקרטי של קואורדינטות המיועדות, gyrus המשוננת. כשמנתחים חלקים במוח לזיהום, חשוב לשמור הרקמה שמסביב עד שהוא נחוש כי האזור האנטומי הנכון היה נגוע. אם אין כל סימן של זיהום, אז זה אפשרי כי ההזרקה התרחשה אזור שכנהד ניתן לזהות בסעיפים שמסביב. זה גם יכול להיות מועיל כדי לאתר את מסלול מחט למצוא באזור ההזרקה המדויק. וירוסי Pseudotyped VSVG לעתים רחוקות פרושים של השולים של gyrus המשוננת כאשר הוא מוזרק in vivo, נוטה להתפשט לאורך תאי מדביק ציר המקוריים / זנב לאורך gyrus המשוננת כולו, כמו מנותח על ידי שחזור 3D (איור 3).
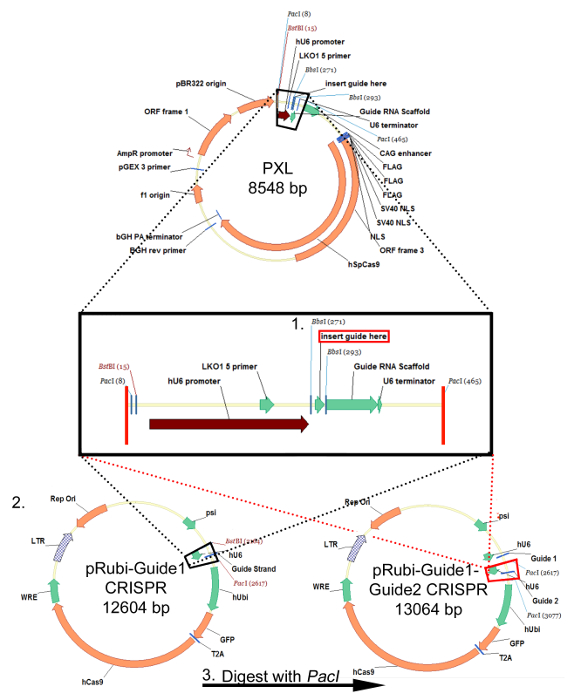
איור 1:. האסטרטגיה שיבוט עבור פלסמיד pRubi-Guide1-Guide2-CRISPR retroviral אסטרטגיה זו היא זהה עבור פלסמידים lentiviral מבוססי FU. oligos sgRNA הם annealed ונוסף PXL באמצעות אתרי שיבוט BsbI. לאחר רצף על מנת להבטיח כי sgRNA מוכנס לתוך בהצלחה PXL, לעכל את הפלסמיד עם BstBI ו פאצ'י. את הכנס כי הוא נשר (קופסא שחורה) הוא משובטים מכן לתוך ב ויראלי בחזרהאחד (שחור מנוקד קווים) pRubi-Guide1 CRISPR. SgRNA שני גם יכול להיות מוכנס לתוך PXL ולעכל החוצה באמצעות האנזים פאצ'י. זה הוא משובטים מכן לתוך וקטור CRISPR pRubi-Guide1 (קווים מקווקווים אדום) באמצעות אתר פאצ'י. הפלסמיד כתוצאה מכן מכיל שני גדילי מדריך כמו גם אלמנטים ויראלי הצורך, יזמים, ו fluorophores. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
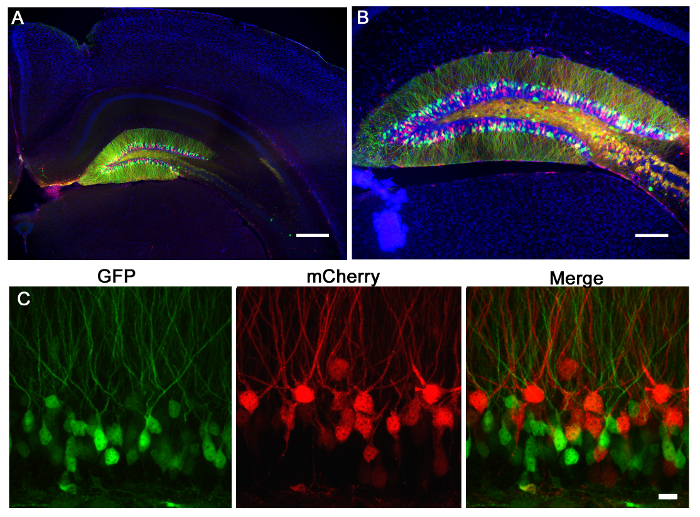
איור 2:. הזרקת retroviral של gyrus משוננת עכבר Retroviruses להביע mCherry (אדום) או GFP (ירוק) הוזרקו gyrus משוננת של עכבר P7. 21 ימים לאחר מכן העכברים היו perfused ואת המוח מחולק ומוכתם עבור GFP ו mCherry. (א) תמונת ניאון רחב בתחום 5X מציגה את יחסי הציבורecision של זריקת gyrus המשוננת ואת הספציפיות של נוירונים גרגיר gyrus משוננים תיוג. המורפולוגיה של ההיפוקמפוס ניתן לראות באמצעות מכתים DAPI (הכחול). סרגל קנה מידה מודד 200 מיקרומטר. (ב) תמונה ניאון 10X רחב בתחום מוכיח כי lentiviruses כייל גבוה אלה להדביק מספר גדול של תאים מורפולוגיה אשר ניתן לגשת דרך ביטוי fluorophore. סרגל קנה מידה מודד 100 מיקרומטר. וירוסים (C) להביע GFP או mCherry היו שיתוף מוזרקים לתוך gyrus המשוננת. באמצעות מערכת של רטרווירוסים, אפשר להשתמש וירוס אחד לעשות מניפולציה גנטית כזו מאופיינת GFP ועוד מניפולציה בסימן mCherry, ולאחר מכן להעריך את השינויים יחידים או כתוסף בשל כל וירוס. סרגל קנה מידה מודד 10 מיקרומטר.
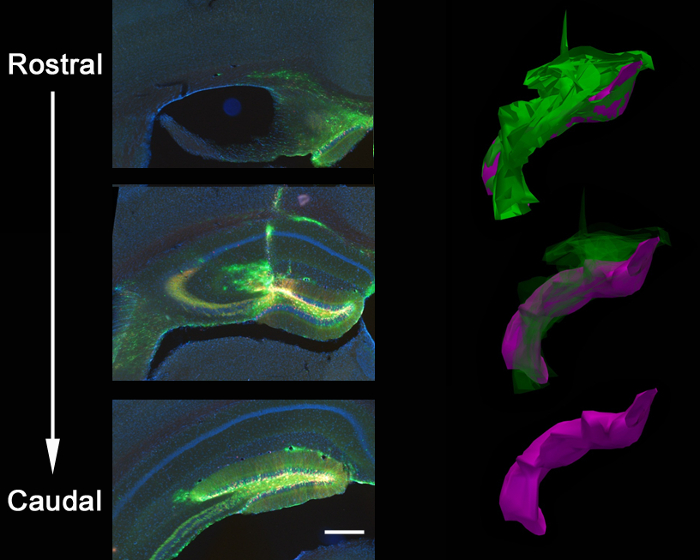
איור 3:. האנטומי התפשטות הזרקת lentiviral coinjection Stereotaxic של וירוס ה- GFP-shPten ו וירוס מלא mCherry לתוך המוח של אדם מבוגר PTEN loxP / + העכבר הביא התפשטות ויראלית לאורך הציר המקורי / זנב כולו של gyrus המשוננת של ההיפוקמפוס. הדבר בא לידי ביטוי שחזור 3D של מידת ההזרקה שבו נסגרה קווי מתאר של ההתפשטות ויראלית אותרו למעלה מ -21 קטעי סדרתי (Z = 50 מיקרומטר / קטע) באמצעות תוכנת שחזור. העתקים קונטור היו מיושרים אז כדי ליצור את תמונות 3D עבור כימות היקף. סה"כ התפשטות ויראלית מוצגת בירוק (נפח = 54,730,800 מיקרומטר 3) וממרח משונן-מקומי מוצג סגול (נפח = 27,275,200 מיקרומטר 3). הווירוס מתפשט לאורך מסלול המחט ואת כפיס המוח בצומת של מסלול מחט בנוסף ממלא את ציר הזנב / המקורי של gyrus המשוננת. סרגל קנה מידה מודד 200 מיקרומטר.
les / ftp_upload / 53,783 / 53783video1frame.jpg "/>
משלימה וידאו 1. עיצוב של sgRNAs לשבט לתוך עמוד השדרה retroviral ו lentiviral.
ב RNA מדריך סינתטי זה למשל עיצוב (sgRNA), רצף הגנום של CHD8 העכבר להוריד מאתר צמח השדה. קודון ההתחלה ומבנה אקסון הם דמיינו אז וקטור NTI. זה מאפשר לנו להעתיק את האזור הגנומי סביב אקסון הקידוד הראשון וזן רצף זה לתוך Benchling. Benchling מאפשר לנו לדמיין כל sgRNAs הפוטנציאל באזור. יתר על כן, לאחר המציינת את האזור הגנומי יש לנו קלט, Benchling יראה לנו ציונים על-היעד מחוץ היעד עבור כל RNA מדריך. המשתמש יכול ולאחר מכן בחר את הרנ"א מדריך עם עשרות מאזני וחוץ-היעד הגבוה ביותר. אנא לחץ כאן כדי לצפות בסרטון זה. (לחץ לחיצה ימנית כדי להוריד.)
Discussion
ישנם כמה שלבים קריטיים שחשובים אריזת ויראלי מוצלחת. Cell בריאות היא קריטית לפני ובמהלך transfection, כמו תאים בריאים יפחיתו את כמות הנגיף מיוצרת מאוד. אם transfection ואריזה מצליחים, אז 100% של התאים צריכים לבטא את fluorophore והתאים צריך להקים syncytium פונקציונלי. בשלב 3.2.4, הקשה על הצינור הוא הכרחי transfection-כייל גבוה ביעילות, ואת ה- pH של תמיסת מלח HEPES שנאגרו חייב להיות מדויק. Maxi-preps המייצרים פלסמידים הדרושים אריזה ויראלי חייב להיות טהור מאוד. עד כה, זה מועיל כדי אתנול לזרז את elution DNA הסופי מחדש להשעות במאגר טריס-EDTA. זה גם מאוד חשוב להפחית את כמות בסרום עד 2% או פחות בתקשורת כי קפאין מתווסף ביום 6 (שלב 3.4) לפני אוסף ויראלי. אם בסרום לא מצטמצם, אז הנגיף המטוהר הסופי יכיל כמות רצויה של prot בסרוםעין. שימוש פוליאתילן גליקול 6000 כאשר מזרזים חלקיקים הנגיפיים כולל הכרח ultracentrifugation. כמו כן, חשוב לציין כי וירוסים המכיל Cas9 CRISPR בדרך כלל יש כייל סביב פי 10 פחות וירוסים אך ורק המכיל fluorophore.
עבור הניתוח stereotaxic, השימוש בחומרי הרדמה נשאפים מאפשר שליטה מהירה ומדויקת או התודעה של החיה לעומת הרדמה בזריקות ומאפשר הרדמה על פני טווח גילאים גדול. חשוב מאוד לשמור על מכשירי ניתוח נקי וסטרילי, יחד עם מיקוד לשחזור דורש המיקום המדויק של הראש. ודא שאין התנדנדות או גלגול של הראש במכשיר stereotaxic וכי הגולגולת מרגישה במקומו. זה יכול להיות שימושי כדי לאפשר הגולגולת להתייבש כדי למצוא את התפרים כדי לקבוע את הקואורדינטות stereotaxic. כמו כן, שיעור ונפח לכל stereotaxic לתאם צריך להיקבע באופן אמפירי.
טכניקה זו המגביל כי ההתפשטות של lenti- או רטרו-וירוס מוגבלת, במיוחד בהשוואת וירוסי adeno קשור (AAVs) .לכן, וירוסים אלה הם בעלי ערך כאשר מדביקים אזור במוח בדיד, אך לא עבור זיהום כולל קשור AAVs המשמש ניתוח התנהגות בבעלי חיים. שימוש קפאין בפרוטוקול זה מגדיל מאוד את כייל של וירוסים אלה, אך הם עדיין לא גבוהים כמו titers מושגת באריזת AAV. כמו כן, שילוב יציב הוא רק יתרון ביטוי fluorophore, כמו CRISPR / Cas9 טפסי עריכות גנומי יציבים גם כאשר transfected זמני ויתכן כי על-הולך ביטוי Cas9 ו sgRNA עשוי בסופו של דבר לייצר את השפעות היעד. הביטוי חולף מערכת CRISPR / Cas9 עם AAVs מספיקה כדי לייצר שינויים גנומית מופצים ברחבי חלוקות תא, לעומת זאת, ביטוי fluorophore לא יישמר.
יצירת lenתדהמה ו רטרווירוסים ניצול מערכת CRISPR / Cas9 יהיה להקנות את היכולת למקד כל גן הרומן במגוון רחב של אורגניזמים. היעילות של עריכת גן נראית תלוי ברצף של RNA מדריך מיקוד מחשוף Cas9. זה כבר נקבע באופן אמפירי כי בין 10% ו -80% של שיבוטים מכילים indels לאחר רצף נגועים בתאי Neuro2A. זהו כיום ידועים אם תדרי indel מחושבים בתאי Neuro2A הם שיקוף של אלה בנוירונים. מדריך תוכנות עיצוב RNA כגון Benchling חברה כוללות ציון "על היעד" שעשויה להיות מסוגל לחזות את היעילות של רצף מטרה נתון. באיזו מידה "על היעד" כגון ציונים הם צרכימים ואמינים להיקבע באופן אמפירי בנוירונים ותא-סוגים אחרים כמערכת CRISPR-Cas9 הופך יושם באופן נרחב יותר.
Lentivirus מבוסס ייצור חיים מהונדס כבר variably מוצלח עם דיווחים כי transgenes נמסר lentivirus להפוך סיlenced 11. עריכת גן CRISPR בתיווך של ה- DNA עשויה להיות מועברת דרך הקו ניבט ליצור מודלים של בעלי חיים שלמים. לפיכך, עריכת גנומי יציבה עשויה להיות ברת השגה למרות והשתקת fluorophores ויראלית נמסר transgenes Cas9. זה עשוי לספק פלטפורמה יעילה עבור שינויים גנומית ממוקדים. משלוח ויראלי של מערכת CRISPR / Cas9, ואילו מעתה אין צורך האורגניזם המהונדס, הוא משלים טכניקות אלה. לדוגמה, הזרקת חלקיקים נגיפיים כגון לתוך חיים מהונדס תרכובת inducibly מבטא opto- או הכימותרפיה הגנטי תלוי Cre ו Cre transgenes אמור להקל מחקרים מורכבים לתוך מערכת היחסים בין מניפולציות גנטיות הפעילות העצבית. דוגמה שנייה היא לספק אלה חלקיקים נגיפיים Cas9 / sgRNA לתוך בנוקאאוט מותנה בניסיון למסך אינטראקציות גן-גן. לבסוף, אחר מסלול מרגש של מחקר זה הוא ההקרנה של פנוטיפים ותרכובות טיפוליות תאים שמקורם בחולה, אשר יכולהלשמש כדי לאמת ולגלות רשתות גנטיות כי הם שיבשו במחלות שונות.
Disclosures
החוקרים אין לי מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי נין להעניק R01MH097949 ואת Autism Speaks פיילוט גרנט 7359 כדי BWL ואת Instrumentation משותף דימות אופטי נוריס כותנה Cancer Center גרנט P30CA023108.
Materials
| Name | Company | Catalog Number | Comments |
| List of Cell Culture Reagents | |||
| 293FT cell line | Life Technologies | R700-07 | For Lentivirus |
| 293GP cell line | Clontech | 631458 | For Retrovirus |
| Iscove's Modification of DMEM (IMDM) | Corning | 10-016-CV | Complete IMDM with 10% FBS, 1% NEAA, 1% L-Gln, and 1% P/S |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| MEM Nonessential Amino Acids (NEAA) | Corning | 25-025-CI | |
| L-Glutamine solution, 100x (L-Gln) | Corning | 25-005-CI | |
| Pennicillin/Streptomycin solution, 100x (P/S) | Corning | 30-002-CI | |
| Polystyrene 10 cm plate | USA Scientific | CC7682-3394 | |
| Trypsin EDTA 1x | Corning | 25-053-CI | |
| List of Transfection Reagents | |||
| 5 ml polystyrene tubes | Fisher Scientific | 352054 | |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Scientific | C69-500 | Make a 2.5 M solution in ddH2O |
| Sodium Chloride (NaCl) | Fisher Scientific | S271-3 | |
| HEPES | Fisher Scientific | BP2939-100 | |
| Sodium phosphate dibasic (Na2HPO4) | Fisher Scientific | S369-500 | |
| 2x HEPES Buffered Saline (HBS) | 500 ml: 8.2 g NaCl, 5.95 g HEPES, 0.106 g Na2HPO4, pH 7.01 (exact!) | ||
| Caffeine | Sigma-Aldrich | C0750-5G | |
| 0.22 µM syringe filter unit | EMD Millipore | SLGV033RS | |
| 0.45 µM syringe filter unit | EMD Millipore | SLHP033RS | |
| 60 cc L/L Syringe | Med-Vet International | MV60CCLL | |
| 50 ml Conical Tube | Corning | 352098 | |
| polyethylene glycol 6000 (PEG 6000) | Millipore | 528877 | |
| (10x) Phosphate Buffered Saline (PBS) | National Diagnostics | CL-253 | |
| 0.5 ml microcentrifuge tubes | USA Scientific | 1605-0000 | |
| Matrigel | Fisher Scientific | CB-40230A | |
| 6-well plate | Fisher Scientific | 353046 | |
| Paraformaldehyde | Fisher Scientific | AC41678-5000 | |
| Donor Horse Serum | Cellgro | 35-030-CV | |
| TritonX-100 | Sigma-Aldrich | X100-500ML | |
| 10 ml serological pipette | Fisher Scientific | 357551 | |
| anti-GFP, rabbit, 488 conjugate | Invitrogen | A21311 | |
| Stereotaxic Surgery Reagents | |||
| Vet-Syringe vet use T.B. Syringe only 1 cc Luer slip T.B. 100/bx | Med-Vet International | 1CCVLS | |
| Isoflurane | |||
| Stainless Steel Scalpel Blades, #10, 100-pk | Med-Vet International | JOR580S | |
| artificial tear ointment | Med-Vet International | RXPARALUBE-O | |
| PVP PrepSolution | Med-Vet International | HPIV108208H | |
| normal saline | Med-Vet International | DYND500MLSH | |
| cotton tipped applicators | Med-Vet International | CTA6 | |
| Triple antibiotic ointment | Med-Vet International | RXTRIP-OI15 | |
| MONOJECT® Needles Soft Pack 25 g x 5/8" | Med-Vet International | 25058 | |
| 6-0 silk sutures | Med-Vet International | MV-711 | |
References
- Williams, M. R., DeSpenza, T., Li, M., Gulledge, A. T., Luikart, B. W. Hyperactivity of newborn Pten knock-out neurons results from increased excitatory synaptic drive. J Neurosci. 35 (3), 943-959 (2015).
- Luikart, B. W., et al. Pten knockdown in vivo increases excitatory drive onto dentate granule cells. J Neurosci. 31 (11), 4345-4354 (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 32 (4), 347-355 (2014).
- Luikart, B. W., et al. miR-132 mediates the integration of newborn neurons into the adult dentate gyrus. PLoS One. 6 (5), e19077 (2011).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Fricano, C. J., et al. Fatty acids increase neuronal hypertrophy of Pten knockdown neurons. Front Mol Neurosci. 7, 30 (2014).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis?. Physiol Genomics. 31 (2), 159-173 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved