Method Article
Concepção, embalagem, entrega e de alto título CRISPR retro e lentivírus via estereotáxica Injection
Neste Artigo
Resumo
O sistema / Cas9 CRISPR oferece o potencial para fazer genoma segmentado edição acessível e disponível para a comunidade científica. Este protocolo destina-se a demonstrar como criar vírus que vai nocaute um gene de interesse utilizando o sistema / Cas9 CRISPR, e depois injetá-las estereotáxicamente no cérebro do rato adulto.
Resumo
Replication defective lentiviruses or retroviruses are capable of stably integrating transgenes into the genome of an infected host cell. This technique has been widely used to encode fluorescent proteins, opto- or chemo-genetic controllers of cell activity, or heterologous expression of human genes in model organisms. These viruses have also successfully been used to deliver recombinases to relevant target sites in transgenic animals, or even deliver small hairpin or micro RNAs in order to manipulate gene expression. While these techniques have been fruitful, they rely on transgenic animals (recombinases) or frequently lack high efficacy and specificity (shRNA/miRNA). In contrast, the CRISPR/Cas system uses an exogenous Cas nuclease which targets specific sites in an organism's genome via an exogenous guide RNA in order to induce double stranded breaks in DNA. These breaks are then repaired by non-homologous end joining (NHEJ), producing insertion and deletion (indel) mutations that can result in deleterious missense or nonsense mutations. This manuscript provides detailed methods for the design, production, injection, and validation of single lenti/retro virus particles that can stably transduce neurons to express a fluorescent reporter, Cas9, and sgRNAs to knockout genes in a model organism.
Introdução
Para estudar a base da fisiologia normal e patologia da doença, há uma necessidade de manipular com precisão a expressão de genes em organismos modelo. Para os organismos modelo mamífero, isto é, em grande parte centrado sobre a criação e desenvolvimento de ratinhos transgénicos em que um elemento genético de interesse é flanqueado por sítios reconhecidos por uma recombinase. Isto pode resultar em um sítio específico manipulação destes genes flanqueados. Embora esta tenha sido uma estratégia bem sucedida, é tempo e recursos intensivos; por exemplo, a criação de um animal transgénico tripla que expressam um gene floxed, a recombinase Cre e um gene repórter Cre requer múltiplos cruzamentos e validação. Em contraste, a injecção estereotáxica de replicação de partículas virais defeituosas que codificam uma proteína fluorescente e a recombinase num animal gene floxed não requer estratégias de melhoramento 1 genotipagem ou complexo. Além disso, se uma proteína fluorescente e Cre que expressa vírus é co-injectado com um segundo vírus ENCOding uma proteína fluorescente diferente, então isso fornece um controle dentro do tecido para a manipulação genética alvo. Embora esta estratégia ainda exige o uso de animais knock-in, estratégias de ARN baseado viralmente mediadas contornar a necessidade de animais transgénicos. Por exemplo, a injecção estereotáxica de vírus deficientes na replicação que codificam uma proteína fluorescente e um ARN de gancho de cabelo curto (shRNA) pode utilizar endógena máquinas ARNi da célula para resultar em uma redução potente da transcrição de um gene de interesse. No entanto, as estratégias de shRNA produzir genes sutil knock-baixos, muitas vezes resultando em modestos fenótipos celulares 2. Enquanto um knock-down pode ser mais fisiologicamente relevante para a disfunção do gene heterozigótica, a sua robustez diminuiu em comparação com um knock-out não é ideal para a descoberta de novos genes fenotípica.
Uma terceira técnica que surgiu recentemente, o CRISPR (cluster regularmente espaçadas Repita Palindromic Short) / Cas9 (CRISPR-associadoproteína 9) do sistema, baseia-se na expressão de tanto um pequeno RNA exógeno e um enzima corte o ADN. O sistema / Cas9 CRISPR foi adaptado a partir do sistema imunitário evoluiu procariotas que um método de identificação externa, invadir o ADN de vírus e orientando-o para a degradação através da enzima Cas9 3,4. Esta técnica poderosa edição genoma pode ser utilizado para a criação de deleções, inserções, segmentados e mutações; e o seguinte protocolo irá descrever como fazer deleções no gene de interesse, a fim de knockout a sua expressão in vivo. A enzima Cas9 deve ser expressa com uma guia de ARN homólogo à região de interesse e contígua com um ARN de andaime. Knockout de um gene utilizando esta técnica requer a segmentação Cas9 para uma região específica do genoma, utilizando ARN de orientação sintéticos (sgRNA), e indução de quebras de cadeia dupla (DSB) no sítio de interesse. Estes LAP são então reparado pela maquinaria celular reparação endógena via não homóloga-end juntar (NHEJ) que leanúncio para indels que podem produzir missense ou sem sentido mutações e pode, portanto, criar uma perda de expressão da proteína funcional 5. Uma vez que este sistema produz alterações genómicas, que exige apenas a expressão transiente do Cas9 e sgRNA. No entanto, é desejável que um indicador fluorescente estável para identificar as células e a sua progenia manipuladas deste modo.
Lenti- retrovírus e tem a vantagem de integrar de forma estável de ADN de interesse em células hospedeiras que mantêm a expressão de longo prazo e são passados para baixo para as células filhas durante a mitose. Este protocolo descreve a concepção e produção de dois tipos de replicação defeituosa, retrovírus título elevado: o vírus da imunodeficiência humana partículas lentivirais derivados (lentivírus) e aqueles baseados em vírus Maloney da leucemia de murino (retrovírus). Embora ambos estes vírus são capazes de suportar estáveis que expressam transgenes de grandes, as partículas retrovirais só pode integrar-se no genoma dudivisão celular anel com a degradação do envelope nuclear, e, portanto, pode ser usado como uma ferramenta para etiquetar e células data de nascimento 6. Enquanto lentivírus têm uma reputação de ser relativamente baixo título 7, esta metodologia, incluindo o uso de cafeína 8 durante a coleta viral, rotineiramente produz títulos de 10 9 e 10 10 partículas / ml. Outra vantagem de lenti- e retrovírus é a tolerância para muito grandes inserções. O seguinte conjunto de protocolos descreve o procedimento para a concepção de um Lenti ou retrovírus que codifica um repórter fluorescente, sgRNAs, e Cas9 para utilizar o sistema / Cas9 CRISPR para modificar o ADN, bem como expressar uma proteína fluorescente.
Rato neurocirurgia estereotáxica é um método valioso para injetar vírus in vivo para estudo da morfologia, função e conectividade dos neurônios infectados. A infecção viral nos neurónios podem ser usadas para manipular os níveis de expressão ao longo de um período prolongado de timE, tal como ao longo do desenvolvimento, e a expressão pode ser controlada com precisão através da utilização de vários sistemas indutíveis drogas e expressão específica orientada Cre. Este protocolo particular explica como injetar um vírus expressando uma sgRNA e Cas9 para nocautear um gene de interesse no cérebro de um rato adulto. Os ratinhos recuperam muito rapidamente a partir deste procedimento e a expressão do transgene viral pode ser visto dentro de pós-injecção de 48 horas. No entanto, a expressão fluoróforo parece aumentar ao longo de semanas, resultando em níveis máximos próximos por 3 semanas pós-infecção. Os ratos que sofrem de injecção estereotáxica viral pode ser utilizada para o comportamento, electrofisiologia, ou estudos morfológicos. No geral, o objectivo destes procedimentos é demonstrar como a nocaute um gene no cérebro do rato adulto usando cirurgia estereotáxica e um vírus expressando um sgRNA específico e Cas9.
Protocolo
Declaração de Ética: Todos os protocolos foram aprovados pelos Dartmouth Institucional de Biossegurança e Institucional Animal Care e do Comitê Use conselhos de revisão.
1. Protocolo para a concepção de um Guia Strand (sgRNA) para CRISPR / Cas9 Retrovirus
NOTA: Existem muitos sites sem fins lucrativos que podem ser usados para gerar sgRNAs para atingir um gene de interesse (https://benchling.com/ e http://crispr.mit.edu/). O objetivo deste protocolo é para projetar e encomendar oligos de cadeia simples a partir de um fornecedor comercial, que são recozidos para o outro. Este oligo recozido será ligado no vector de transferência PXL. Ver vídeo suplementar 1 para um exemplo de concepção sgRNAs usando Benchling.
- Use um site dedicado à concepção sgRNAs.
NOTA: Por exemplo, inserindo uma sequência de codificação / exônico de perto do início do gene de interesse para o site irá gerar um sgRNA 20 nucleótidos. Use a sequência sgRNA 20 nucleotídeos para projetar o sentido e anti-sentido oligos que serão ordenados para criar o sgRNA. - Depois de gerar o sgRNA, copie essa seqüência em um processador de texto. Adicionar uma G (guanina) para o início da sequência de nucleótidos sgRNA 20 no documento se não já começar com um (ou seja, G-20 sequência de nucleótidos sgRNA). Isto é necessário para assegurar uma boa transcrição fora do promotor U6.
- Documentar o complemento reverso desta 20-21 sequência de nucleotídeos agora. Para o oligo sentido, adicionar "CACC" para a extremidade 5 'da sequência no documento (ou seja, CACC-G-20 sequência de nucleótidos sgRNA). Esta saliência será usado para ligar a sequência no vector PXL.
- Para o oligo anti-sentido, adicionar AAAC à extremidade 5 '. Use esta saliência para ligar a sequência no vector PXL.
- Obter os oligos de sentido e anti- sentido. Depois de receber os oligos, fazer 100? M stocks usando DNAse água livre. Misture 10 uL cada uma das 100 uM sentido e anti-oligos com 4 μl de 10x tampão de 2 NEB, e 16 ul de água.
NOTA: Eles não precisam de purificação página ou 5'phosphorylation (como as saliências BBSI são extremos coesivos não compatíveis).- Levar 200 ml de água a ferver em um copo de 500 ml, em seguida, o tubo de flutuar contendo esta mistura na forma de uma espuma titular "flutuador". Permitir que a água se arrefecer lentamente desde 95 ° C durante 2 h à temperatura ambiente.
- Dilui-se a mistura de oligo-recozido agora 1: 1000 em água estéril e usar imediatamente na seguinte ligadura ou armazenar a reacção restante à temperatura de -20 ° C.
- Digest PXL, um derivado PX330 vector, com o enzima de restrição Bbsl a 37 ° C durante 2 h. Use uma reação de 40 mL contendo 2 mg de PXL, 4 ul de tampão 10X NEB 2, 1 jul de Bbs1 e água equilíbrio. Submeter o-PXL digerido a purificação em gel de rotina, utilizando um kit comercial. Certifique-se que o rendimento é de ~ 8,5 produto kB.
- Utilizando um kit de ligação comercial, ligadura 1 ul de 1: 1000recozidos-oligos com 50 ng do digerido e purificado em gel-PXL. Transformar o produto de ligação em recombinação competente deficiente E. coli (NEB 5-alfa, subclonagem de eficiência). Peneirar os transformantes quanto à presença do guia correcta por sequenciação de ADN de plasmídeo.
- Digerir o U6, guia do fio, e elementos de andaime de ARN (sgRNA) de pxl utilizando enzimas de restrição e BstB1 PAC1 e ligar no esqueleto viral proteína-T2A-Cas9 fluorescente digerido com as mesmas enzimas de restrição. Transformar o produto de ligação (NEB 5-alfa eficiência máxima). As fluorescentes plasmídeos backbone viral proteína T2A-Cas9 são baixos plasmídeos de cópia e protocolos, assim, baixa de cópia deve ser utilizado.
NOTA: Uma segunda sgRNA pode ser introduzido de forma semelhante por digestão PacI de outro plasmídeo PXL guia de fio e ligado no Pac1 digerido e fosfatase de intestino de vitela tratada esqueleto viral já contendo a primeira cadeia de guia. tratamento fosfatase do plasmídeo de transferência viral vai ajudarreduzir o número de transformantes a partir da auto-ligação dos plasmídeos que não contêm o segundo guia. - Sequência de verificar o plasmídeo e maxi final de preparação utilizando o kit maxi prep Nucleobond Xtra e empacotá-lo em um vírus usando o seguinte "Protocolo para Retro / Lentivirus Produção - Método CaPO4".
2. Prepare 293FT / 293GP células para transfecção (Retro / Lentivirus Produção - Método CaPO4)
- (Dia 1) rapidamente descongelar uma ampola de células por placa de cultura de 10 centímetros de células num banho de água a 37 ° C. Em relação às embalagens de lentivírus, usar 293FT células. Para embalagens retroviral, use 293GP (gag / pol) células.
- Pipetar todas as células descongeladas a partir do tubo de crio para um tubo de 15 ml e adiciona-se 2 ml da pré-aquecido CO 2-equilibrada completa Meio de Dulbecco Modificado por Iscove.
- centrifugar células durante 5 minutos a 500 xg para sedimentar. Aspirar o sobrenadante e ressuspender o sedimento celular em 10 ml de completa estáenseada de meio de Dulbecco modificado. Placa as células numa placa de cultura celular de 10 cm. Incubam-se as células durante a noite a 37 ° C numa incubadora de dióxido de carbono a 5%.
- (Dia 2) 24 horas após o plaqueamento, mudar de suporte na placa por aspiração os meios existentes e adicionando 10 ml de pré-aqueceu-se meio de Iscove modificado por Dulbecco para a placa.
- (Dia 3-4) 24-48 h após a mudança de meio e uma vez que as células se tornam confluentes, dividir as células até uma confluência de 2,5-3,0 x 10 6 células / placa (placa de 10 cm).
- Para dividir as células, aspirar os meios e lava-se a placa com 5 ml de PBS. Adicionar 1 ml de tripsina a 0,25% para a placa e incubar a 37 ° C até as células levantar a placa. Adicionar 0,5 ml de meio de Iscove modificado por Dulbecco para neutralizar a reacção de tripsina a 0,25% e pipeta as células para um tubo de 1,5 ml.
- Rodar as células a 500 xg durante 5 min. Ressuspender as células em 1 ml de meio de Dulbecco modificado por Iscove. diluir 1081; l de células em 90 ul de PBS. Contar as células usando tanto um hemocitômetro ou contador de células automatizado. Re-placa de 2,5-3,0 x 10 6 células / placa com meio de Dulbecco modificado de Iscove completa.
NOTA: As células serão ~ 50% confluentes 24-34 h após o plaqueamento. Transfectar as células quando estas são ~ 50% confluentes.
3. (Dia 5) CaPO4 transfecção e Viral coleção de partículas
- Alterar a hora de mídia 2 antes da transfecção por aspiração dos meios de comunicação existentes e adicionando 10 ml de pré-aquecido meio de Dulbecco modificado por Iscove. Certifique-se que há exatamente 10 ml de mídia na placa de 10 cm.
- Prepare os reagentes de transfecção para 2 pratos com 2, 5 ml tubos de poliestireno de fundo redondo. Rotular o primeiro tubo "DNA" e o segundo tubo "2X HBS". Ajustar a concentração de ADN a 1 jig / mL em Tris-EDTA a pH 7,4.
- Para lentivírus, adicione lentamente 20 l de vector de transferência (The Viral construto de interesse), 13 ul de CMVdelta8.9, 9 ul de VSV-G, 860 ul de biologia molecular da classe de H 2 O, e 100 uL de 2,5 M de CaCl2 para o primeiro tubo ( "ADN"), enquanto continuamente rosca no tubo para misturar.
- Para retrovírus, omitir o plasmídeo CMVdelta8.9. Adicionar 20 ul de vector de transferência, 15 ul de VSV-G, 860 ul Molecular Biology Grade H2O, e 100 uL de 2,5 M de CaCl2 ao tubo marcado "ADN".
- Adicionar 1 ml de solução salina tamponada com HEPES 2x (pH 7,0; este valor de pH é absolutamente crítico) para o tubo rotulado "2X HBS".
- Adiciona-se lentamente 1 ml dos conteúdos do tubo de "ADN" para o tubo "2X HBS", uma gota de cada vez. Continuamente tocar no tubo "2X HBS" com o dedo indicador ou meio ao adicionar o conteúdo do tubo de "ADN". Observe aparentes Capo 4 vesículas após cada gota. Incubar o tubo no escuro durante 30 min à temperatura ambiente.
- Adicionar 1 ml de transfecção em gotas lentas para cada placa de células de 10 cm, em seguida, incubar durante a noite a 37 ° C.
- (Dia 6) substituir a mídia com 8 ml de modificação Médio + 0,5% de FBS por Dulbecco Iscove e 40 mg de cafeína / 100 ml de meio. Se o vector de transferência contém um marcador fluorescente, em seguida, expressão fluoróforo indica uma transfecção bem sucedida.
- (Dia 7) Recolha a mídia que contém as partículas virais usando um 10 ml pipeta sorológica e dispensar em um tubo de 50 ml. Armazenar o tubo de 50 ml a 4 ° C. Adicionar 8 mL de 0,5% de meio de FBS a cada placa.
- (Dia 8) Mais uma vez, recolher a mídia contendo as partículas virais e combinar com o dia anterior a colheita no tubo de 50 ml.
4. Concentração e purificação do vírus
- Adicione uma solução de 5x polietilenoglicol 6000 por adição de 40% de polietileno glicol 6.000 e 1,5 M de NaCl para DDH 2 O. Autoclave a solução sobreo ciclo líquido durante 45 min a 121 ° C. misture lentamente a solução quando o resfriamento.
NOTA: A solução vai começar nublado e, em seguida, tornar-se claro como esfria. - Centrifuga-se o tubo cónico de 50 ml contendo ambos os conjuntos de sobrenadante virai a 2000 xg durante 10 min de modo a sedimentar o material insolúvel. Purificar a mídia viral por filtração através de um filtro de seringa de ligação 0,45 baixa proteína (PES ou PVDF).
- Adicionar 5x solução de polietilenoglicol 6000 a meios (A concentração final deve ser de 8% de polietileno glicol 6.000 e 0,3 M de NaCl). Misture invertendo o tubo várias vezes (não vortex). Incubar a solução de polietileno-glicol virai contendo a 4 ° C durante 12 ou mais horas, remistura ocasionalmente.
- (Dia 9) Centrifugar a solução contendo polietilenoglicol viral em 2500 xg durante 45 min. Retirar e descartar o sobrenadante e girar novamente por 2 min. Mais uma vez, remover e descartar o sobrenadante.
- Ressuspender o sedimento através da adição de 320 ul desolução salina tamponada com fosfato estéril (320 uL é 1/100 do volume original de meio contendo virais recolhidos) e incubar durante a noite a 4 ° C. Opcionalmente, ressuspender o sedimento à temperatura ambiente num agitador rotativo durante 30 min.
- Depois de re-suspender o sedimento, alíquota do vírus (5-10 ul por tubo 0,5 ml) e congelar alíquotas a -80 ° C (congelamento descongelamento ou de armazenamento a 4 ° C irá reduzir drasticamente o título).
- Titule a vírus, utilizando protocolos padrão, isto é, executar uma série de diluições numa placa de 6 poços de células HEK293T e contar manualmente colónias fluorescente 48 horas mais tarde.
5. Teste de Eficácia do vírus CRISPR
NOTA: clones sequência utilizando os seguintes passos para testar a produção de quebras de cadeia dupla reparados por NHEJ utilizando as células do rato Neuro2A. Isto tem a vantagem em relação aos ensaios de inspector na que podem ser usados para determinar a percentagem de células que tenham sido modificadas e a naturezados indels resultantes de NHEJ.
- Revestimento de Matrigel, tal como um prato de cultura de células de 3,5 centímetros com uma mistura gelatinosa proteína diluídas a 1:50 em meio de Dulbecco modificado de Iscove e incubar durante 30 min a 37 ° C. Aspirar a mistura de proteína gelatinosa e placa das células Neuro2A.
- Após as células Neuro2A atingir 50% de confluência, adicionar o CRISPR lentivírus ou Retrovirus a uma multiplicidade de infecção de 10 (ou seja, 10 partículas virais por célula).
NOTA: As células Neuro2A não são tão amável à infecção como são células HEK293, assim, uma única infecção não irá resultar em 100% das células estarem infectados com o lentivírus. Além disso, o retrovírus infecta apenas as células em divisão e, por conseguinte, também não irá resultar em 100% de infecção. A fim de atingir uma taxa de cerca de 100% de infecção, a adição de vírus pode ser repetido em vários dias, a separação das células, conforme necessário. Alternativamente, as células fluorescentes positivas podem ser isoladas utilizando activadas por fluorescência de células-ordenação. ºe meio mais eficaz para alcançar uma taxa de infecção de 100% com um lentivírus é executar uma única infecção seguido por isolamento de FACS. Para um retrovírus, execute 4 rodadas de infecção de 24 horas de intervalo e siga pelo isolamento FACS para assegurar% infecção 100. - Depois de infectar as células durante 1 semana, a expandir-se as células até à confluência em perto de uma placa de 10 cm, aspirar os meios de comunicação, e lava-se a placa com 5 ml de solução salina tamponada com fosfato. Adicionar 1 ml de 0,25% de tripsina e incubar a 37 ° C até as células levantar a placa. Adicionar 0,5 ml de meio de Iscove modificado por Dulbecco para neutralizar a reacção de tripsina a 0,25% e pipeta as células para um tubo de 1,5 ml e sedimentar as células a 500 xg durante 5 min.
- Para isolar o DNA, adicionar 100 ul de hidróxido de potássio a 50 mM, re-suspender as células, e incuba-se a 95 ° C durante 5 min. Neutraliza-se a solução com 10 ml de Tris 1 M, pH = 8,0.
- Amplificar por PCR a região que flanqueia a região genómica alvo de CRISPR sgRNAusando ~ 300 ng de DNA isolado no passo 5.5 utilizando uma PCR de alta fidelidade mestre mistura 4.
- Executar a reacção de PCR num gel de agarose a 2,5% e o gel de purificar o fragmento de tamanho apropriado utilizando um kit de purificação em gel, tais como kit de recuperação de ADN em gel. Ligadura para um vector de clonagem de PCR, tais como pGEM-T-Easy e transformada em células competentes de 9.
- 24 horas mais tarde, adicionar 2 ml de caldo LB em um tubos de 15 ml com fundo redondo, bem como o antibiótico apropriado (ampicilina, neomicina, etc.). Inocular o tubo com uma colónia individual, utilizando uma ponta de pipeta estéril ou loop para selecionar uma única colónia do LB-placa. Expandir e crescer a colónia por agitação do tubo a 250 RPM e 37 ° C durante 24 h. Repita o procedimento para o maior número de colónias como desejado.
- Utilizando um kit de mini-prep, isolar o ADN a partir da E. coli e a sequência com os iniciadores desenhados para amplificar a região do gene alvo pelo sgRNA, a fim de analisar a região Cas9 alvo do genoma do rato.
6. estereotáxica Protocolo Injection para o Mouse Adulto
- Prepare-se para a cirurgia
NOTA: É importante manter condições estéreis durante cirurgias de sobrevivência. Isto é realizado neste protocolo pelo calor esterilização dos instrumentos cirúrgicos, utilizando betadine para esterilizar o local da injecção, e adicionando pomada antibiótica para o local da incisão depois de ser fechado. É também importante a utilização de luvas estéreis, bem como, uma área de cirurgia dedicado completamente esterilizado.- Equipamentos para a cirurgia Esterilize de calor antes de ser utilizado por qualquer autoclave ou esterilizador usando talão quente. Prepare câmara de recuperação e área de cirurgia, girando sobre almofadas de aquecimento para manter a temperatura do corpo durante a cirurgia e recuperação. Montar a broca utilizada para criar buracos no crânio para injecção.
- Carga 4 ul de vírus na agulha de injeção, retirando o vírus diretamente do tubo de PCR estéril. Resumidamente remover a alíquota viral de gelo. Manter o vírusna seringa à temperatura ambiente durante não mais do que 1 hora antes da injecção.
7. estereotáxica Injection
- Confirme se a ventilação para a suíte cirurgia é aberta para garantir fluxo de ar adequado. Prepare o mouse para a cirurgia por anestesia com 4% de isoflurano em uma câmara de indução. Após a anestesia, raspar a cabeça para preparar o local da injeção.
- Posicione o mouse no instrumento estereotáxico, usando uma pinça para mover a língua para baixo e para o lado. Insira o bar mordida na boca até os dentes cair no slot, em seguida, fixe as barras de ouvido. Certifique-se de que o corpo do rato é a almofada de aquecimento e o nariz está situado no cone de nariz. isoflurano directo de 4% para o cone do nariz. Confirmar a anestesia por beliscar o pé com uma pinça e garantir que não há reflexo de sobressalto.
- Aplicar lágrimas artificiais para lubrificar os olhos. Concluir a preparação do local da injecção limpando a cabeça raspada com a alternância de ciclos de povIdone-iodo e lidocaína.
- Usando um bisturi, corte pequena incisão ao longo do centro do couro cabeludo. Seque o crânio com um peróxido de swab e hidrogênio se necessário para ajudar a visualizar bregma.
- Usando um escopo de dissecação, localize bregma no crânio e coloque a ponta da broca na bregma. Zero (ou registro) as coordenadas estereotáxicas digitais nos planos x, ye z.
- A fim de garantir que a cabeça é o nível no rostral para caudal do eixo y, colocar a broca em lambda e nivelar a cabeça de modo que a coordenada z é aproximadamente igual em ambos bregma e lambda.
- A fim de assegurar que o nível de cabeça é no eixo dos x, colocar a broca para y = 1/2 lambda. Certifique-se de que a coordenada z é igual a 1 mm em cada lado (x = +/- 1 mm) da sutura sagital. Ajustar o crânio, se existe uma diferença na coordenada z a 1 mm para a esquerda e para a direita de lambda.
- Coloque a broca sobre as coordenadas desejadas. Para o giro denteado, use a coordenarSY = -1,9 de bregma e X = +/- 1,1. Antes da perfuração, abaixe o isoflurano a 2%, em seguida, lentamente e com cuidado, perfurar o crânio.
- Depois de perfurar todos os buracos, apor a-cheia no instrumento estereotáxico. Visualmente centralizar a seringa sobre o buraco e zero a coordenada z para o crânio.
- Lentamente, abaixe a seringa mais profunda z profundidade. Para o giro denteado, as profundidades Z são -2,5, -2,4, -2,3 e. Comece a injecção a uma taxa de 0,25 mL / min, utilizando um injector de estereotáxico.
- Após a injeção é completa em menor profundidade Z, aguarde 1 min, em seguida, levantar para o próximo coordenar e começar a injeção novamente. Continue este padrão até que todas as coordenadas z-injecção são injetados. Espera 2 min antes de retirar a seringa após a última injecção.
NOTA: Nenhum efeito adverso foi observado no tecido através da injeção de até 2 ul de vírus por hemisfério no cérebro do rato.
- Após a injeção é completa em menor profundidade Z, aguarde 1 min, em seguida, levantar para o próximo coordenar e começar a injeção novamente. Continue este padrão até que todas as coordenadas z-injecção são injetados. Espera 2 min antes de retirar a seringa após a última injecção.
- injeção de repetição para outros furos.
- Após a injeção, retire o rato do instrumento estereotáxico e suturar o couro cabeludo com 6-0 seda. Aplicar lidocaína e um creme anti-bacteriana para a ferida.
- Injectar 0,8-1,0 ml de solução salina + cetoprofeno (3-5 mg / kg) por via IP para controlar a dor. Em seguida, coloque o mouse na câmara de recuperação aquecida. Não deixe o animal sem supervisão até que tenha recuperado a consciência suficiente para manter decúbito esternal. Não devolver o animal para a companhia de outros animais até que ele se recuperou totalmente.
- Nos dias seguintes à cirurgia, pesam o mouse diário e fornecer o alimento macio e guloseimas. Verifique ferida e observe a condição / comportamento geral.
- Após a injecção estereotáxica, os ratos podem ser sacrificados para a fatia prep eletrofisiologia 1 ou perfundidos e seus cérebros removidos, cortados e corados via imuno-histoquímica para análise 10.
Resultados
Seguindo o "Protocolo para a concepção de um Guia Strand (sgRNA) para CRISPR / Cas9 Retrovirus", são inseridos os oligos alvo uma sequência particular no vector PXL clonagem a jusante do promotor hU6 e a jusante de um andaime de ARN guia utilizando os locais de clonagem Bbsl (Figura 1, passo 1). Este sgRNA é então excisada do PXL e inserido na coluna vertebral pRubi utilizando os locais PacI e BstBI (Figura 1, Passo 2). Finalmente, um outro sgRNA clonado PXL pode ser colocado a jusante do primeiro guia em pRubi-Guide1 (Figura 1, Passo 3), tendo como alvo uma outra área do gene e aumentar as chances de um nocaute via NHEJ. Verificação das construções de correcção deve ser determinada por análise da sequência. Uma vez que esta construção é feito, que pode ser empacotado em um vírus seguindo o "Protocolo para Retro / Lentivirus produção- Método CaPO4". embalagem bem sucedida é confirmada pela infecção de vírus em células HEK293, a fim de titular a vIrus. Se não houver nenhuma expressão fluoróforo então provavelmente houve um erro durante o acondicionamento do vírus.
A Figura 2 é um resultado representativo de 2, um retrovírus que expressa GFP e a outra expressando mCherry, co-injectados no giro dentado de rato neonatal (7 dias de idade) e fotografada 21 dias pós-injecção. A marcação de neurónios com mCherry ou GFP permite a avaliação morfológica de várias manipulações genéticas no mesmo tecido, em que um vírus podem expressar um CRISPR / Cas9 mediada KO e a outra um vírus de controlo, que expressam apenas um fluoróforo. injecção estereotáxica permite selectividade anatómica precisa, como demonstrado pela infecção discreta das coordenadas destinadas, no giro dentado. Ao analisar secções do cérebro para a infecção, é importante para manter o tecido circundante até que seja determinado que a região anatómica correcta foi infectado. Se não houver nenhum sinal de infecção, então é possível que a injecção ocorreu em um uma região vizinhad pode ser identificado nas secções vizinhas. Também pode ser útil para localizar o percurso da agulha para encontrar a região exacta de injecção. Vírus pseudotipados VSVG raramente se espalha para fora das margens do giro dentado, quando injectado in vivo, e tendem a espalhar-se as células infectar eixo rostral / caudal ao longo de todo o giro denteado, tal como analisado por reconstrução 3D (Figura 3).
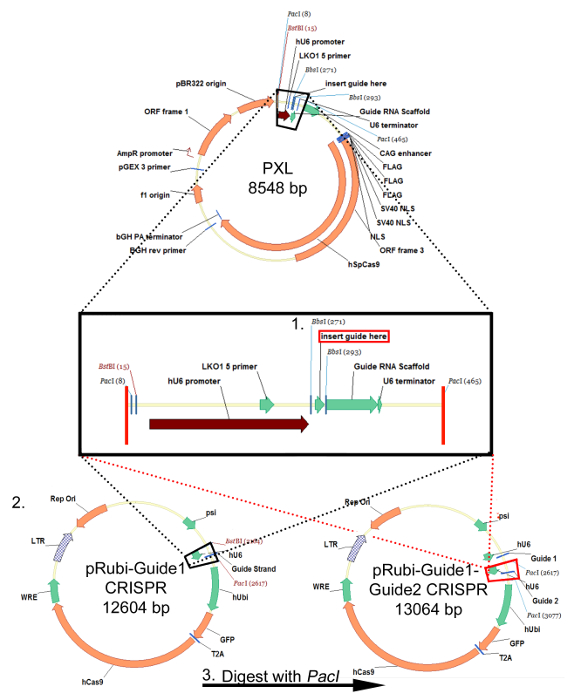
Figura 1:. Estratégia de clonagem para o plasmídeo pRubi-Guide1-Guide2-CRISPR retroviral Esta estratégia é idêntico para os plasmídeos lentivirais baseados-FU. oligos sgRNA são recozidos e inserido PXL utilizando os locais de clonagem BSBI. Após sequenciação para assegurar que o sgRNA é inserido com sucesso em PXL, digerir o plasmídeo com BstBI e PacI. A inserção que é deixado cair fora (caixa preta) é então clonado na parte traseira b viralum (preto linhas pontilhadas) pRubi-Guide1 CRISPR. Um segundo sgRNA também pode ser inserido PXL e digerido usando a enzima PacI. Este é então clonado no vector CRISPR pRubi-Guide1 (vermelho linhas pontilhadas), utilizando o local PacI. O plasmídeo resultante, em seguida, contém ambos os fios de guia, bem como os elementos virais necessárias, promotores e fluoróforos. Por favor clique aqui para ver uma versão maior desta figura.
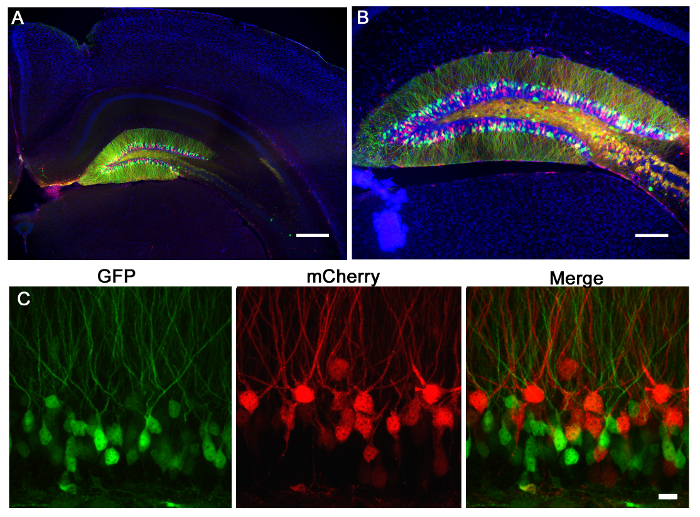
Figura 2:. Retroviral de injecção do giro dentado do rato Os retrovírus que expressam mCherry (vermelho) ou GFP (verde) foram injectados no giro dentado de um ratinho P7. 21 dias mais tarde, os ratinhos foram perfundidos e os cérebros seccionados e corados para GFP e mCherry. (A) Uma imagem fluorescente de campo amplo 5X mostra o PRECISÃO da injeção giro denteado e a especificidade da rotulagem dentados neurônios giro granulares. A morfologia do hipocampo pode ser visto através do DAPI (azul) coloração. Barra de escala mede 200 um. (B) Uma imagem fluorescente 10X de campo amplo demonstra que estes lentivírus alto título infectar um grande número de células cuja morfologia pode ser acessado via expressão fluoróforo. Barra de escala mede 100 mm. (C) Os vírus expressando GFP ou mCherry foram co-injectado no giro dentado. Utilizando um sistema de retrovírus, pode-se usar um vírus para fazer uma manipulação genética marcada por GFP e outra manipulação marcado por mCherry, e depois avaliar as mudanças individuais ou aditivos devido a cada vírus. Barra de escala mede 10 mm.
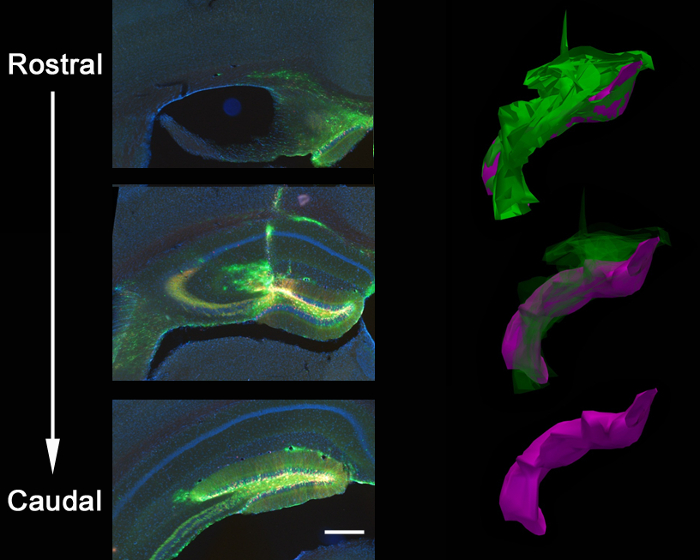
Figura 3:. Propagação anatômica de injecção lentiviral coinjection estereotáxica de um vírus GFP-shPten e um controle de vírus mCherry no cérebro de um adulto Pten loxP / rato + resultou num propagação virai ao longo do eixo rostral toda / caudal do giro dentado do hipocampo. Isto é mostrado de uma reconstrução 3D da extensão da injecção em que fechada contornos da propagação virai foram traçados ao longo de 21 secções em série (z = 50 um / secção), usando software de reconstrução. Os traçados de contorno foram então alinhados para gerar as imagens 3D para quantificação volume. Propagação viral total é mostrado em verde (volume = 54.730.800 mm 3) e disseminação localizada-denteado é mostrado em roxo (volume = 27.275.200 mm 3). O vírus propaga-se ao longo do percurso da agulha e do corpo caloso, na intersecção da pista de agulha além de preencher o eixo rostral / caudal do giro dentado. Barra de escala mede 200 um.
les / ftp_upload / 53783 / 53783video1frame.jpg "/>
Suplementar vídeo 1. Projeto de sgRNAs para clonar no backbone retroviral e lentiviral.
Neste exemplo de design RNA guia sintética (sgRNA), a sequência genômica de CHD8 mouse é baixado do NCBI. O códon de iniciação e da estrutura exão são então visualizados em Vector NTI. Isso nos permite copiar a região genômica em torno do primeiro exão de codificação e entrar nesta seqüência em Benchling. Benchling nos permite visualizar todos os sgRNAs potenciais na região. Além disso, depois de indicar a região genômica temos entrada, Benchling vai nos mostrar as pontuações on-alvo e fora do alvo para cada RNA guia. O usuário pode então selecionar a RNA guia com as maiores pontuações dentro e fora do alvo. Por favor clique aqui para ver este vídeo. (Botão direito do mouse para baixar).
Discussão
Existem alguns passos críticos que são importantes para o empacotamento viral bem sucedida. saúde celular é fundamental antes e durante a transfecção, as células saudáveis irá reduzir muito a quantidade de vírus produzida. Se a transfecção e embalagens são bem sucedidos, em seguida, 100% das células devem expressar o fluoróforo e as células devem formar um sincício funcional. No passo 3.2.4, tocando o tubo é necessário para a transfecção de título elevado de forma eficiente, e o pH da solução salina tamponada com HEPES deve ser exacta. Os maxi-preps que produzem os plasmídeos necessários para embalagem viral deve ser extremamente puro. Até este ponto, é útil para o etanol precipitar a eluição DNA final e re-suspensão em tampão Tris-EDTA. É também muito importante para reduzir a quantidade de soro de 2% ou menos, em que os meios de comunicação a cafeína é adicionado a no Dia 6 (passo 3.4) antes da recolha viral. Se o soro não é reduzida, em seguida o vírus purificado final irá conter uma quantidade indesejável de prot soroein. O uso de polietileno glicol 6000, quando precipitar as partículas virais exclui a necessidade de ultracentrifugação. É também importante notar que as CRISPR contendo vírus Cas9 tipicamente têm um título de cerca de 10 vezes menos do que os vírus que contêm exclusivamente um fluoróforo.
Para a cirurgia estereotáxica, o uso de anestesia inalatória permite um controle rápido e preciso ou a consciência do animal em comparação com anestésicos injetáveis e permite que a anestesia sobre uma faixa etária maior. É muito importante para manter os instrumentos cirúrgicos limpos e esterilizados, e segmentação reproduzível requer um posicionamento preciso da cabeça. Certifique-se de que não há lançamento ou de rolamento da cabeça no instrumento estereotáxico e que o crânio sente firmemente no lugar. Pode ser útil para permitir o crânio para secar, a fim de encontrar as suturas para determinar as coordenadas estereotáxicas. Além disso, a taxa e o volume de cada estereotáxico coordenar deve ser determinada empiricamente.
Esta técnica é limitativo na medida em que a propagação de um retrovírus ou lenti- é restrito, especialmente quando comparado com os vírus adeno-associados (AAV) .Portanto, estes vírus são valiosos quando infectam uma região do cérebro discreta, mas não para a infecção geral associado com AAV utilizado para análise comportamental em animais. O uso de cafeína no presente protocolo aumenta consideravelmente o título destes vírus, mas ainda não são tão elevados como os titulos conseguidos no empacotamento de AAV. Além disso, a integração estável apenas uma vantagem da expressão fluoróforo, como CRISPR / Cas9 forma edições genómicas estáveis mesmo quando transitoriamente transfectadas e é possível que em curso expressão do Cas9 sgRNA e podem, eventualmente, produzir efeitos fora do alvo. A expressão transiente do sistema / Cas9 CRISPR com AAV é suficiente para produzir alterações genómicas que se propagam ao longo de divisões celulares, no entanto, não irá ser mantida expressão fluoróforo.
Criação de lenti- e retrovírus utilizando o sistema CRISPR / Cas9 irá conferir a capacidade de ter como alvo qualquer novo gene em uma ampla variedade de organismos. A eficiência de edição gene parece ser dependente da sequência do ARN alvo a guia de clivagem Cas9. Foi determinado empiricamente que entre 10% e 80% dos clones contêm indels após sequenciação infectadas células Neuro2A. É atualmente desconhecido se freqüências InDel calculados em células Neuro2A refletem aqueles em neurônios. Guia de software de criação de ARN, tal como Benchling agora incluem uma avaliação "on-alvo" que pode ser capaz de prever a eficácia de uma determinada sequência alvo. Até que ponto tais resultados "no alvo" são necessidades confiáveis para ser empiricamente determinados em neurônios e outros tipos celulares como o sistema CRISPR-Cas9 se torne mais amplamente implementadas.
produção animal transgénico baseado em lentivírus tem sido variavelmente bem sucedido com relatos de que os transgenes entregou-lentivírus se tornar silenced 11. CRISPR de genes mediada edição de ADN pode ser passada através da linha germinativa para gerar modelos animais completos. Assim, a edição genômica estável pode ser viável, apesar do silenciamento de fluoróforos virais entregue e transgenes Cas9. Isto pode fornecer uma plataforma eficiente para alterações genômicas alvejados. A entrega viral do sistema / Cas9 CRISPR, embora não exija organismos transgénicos, é complementar a estas técnicas. Por exemplo, a injecção de tais partículas virais em um animal transgénico que expressa composto indutivelmente Cre e Cre opto dependente ou quimio-transgenes genética deve facilitar estudos de complexos sobre a relação entre as manipulações genéticas e actividade neuronal. Um segundo exemplo é o de proporcionar estas partículas virais Cas9 / sgRNA em um nocaute condicional numa tentativa para pesquisar as interacções do gene para o gene. Finalmente, uma outra rota emocionante da pesquisa é a triagem de fenótipos e compostos terapêuticos em células do paciente derivada, que podeser utilizados para validar e descobrir redes genéticas que são rompidas em várias doenças.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Este trabalho foi apoiado pela Ninh conceder R01MH097949 ea Autism Speaks Pilot Grant 7359 para BWL eo Norris Cotton Cancer Center óptico de imagem Instrumentação Shared Grant P30CA023108.
Materiais
| Name | Company | Catalog Number | Comments |
| List of Cell Culture Reagents | |||
| 293FT cell line | Life Technologies | R700-07 | For Lentivirus |
| 293GP cell line | Clontech | 631458 | For Retrovirus |
| Iscove's Modification of DMEM (IMDM) | Corning | 10-016-CV | Complete IMDM with 10% FBS, 1% NEAA, 1% L-Gln, and 1% P/S |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| MEM Nonessential Amino Acids (NEAA) | Corning | 25-025-CI | |
| L-Glutamine solution, 100x (L-Gln) | Corning | 25-005-CI | |
| Pennicillin/Streptomycin solution, 100x (P/S) | Corning | 30-002-CI | |
| Polystyrene 10 cm plate | USA Scientific | CC7682-3394 | |
| Trypsin EDTA 1x | Corning | 25-053-CI | |
| List of Transfection Reagents | |||
| 5 ml polystyrene tubes | Fisher Scientific | 352054 | |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Scientific | C69-500 | Make a 2.5 M solution in ddH2O |
| Sodium Chloride (NaCl) | Fisher Scientific | S271-3 | |
| HEPES | Fisher Scientific | BP2939-100 | |
| Sodium phosphate dibasic (Na2HPO4) | Fisher Scientific | S369-500 | |
| 2x HEPES Buffered Saline (HBS) | 500 ml: 8.2 g NaCl, 5.95 g HEPES, 0.106 g Na2HPO4, pH 7.01 (exact!) | ||
| Caffeine | Sigma-Aldrich | C0750-5G | |
| 0.22 µM syringe filter unit | EMD Millipore | SLGV033RS | |
| 0.45 µM syringe filter unit | EMD Millipore | SLHP033RS | |
| 60 cc L/L Syringe | Med-Vet International | MV60CCLL | |
| 50 ml Conical Tube | Corning | 352098 | |
| polyethylene glycol 6000 (PEG 6000) | Millipore | 528877 | |
| (10x) Phosphate Buffered Saline (PBS) | National Diagnostics | CL-253 | |
| 0.5 ml microcentrifuge tubes | USA Scientific | 1605-0000 | |
| Matrigel | Fisher Scientific | CB-40230A | |
| 6-well plate | Fisher Scientific | 353046 | |
| Paraformaldehyde | Fisher Scientific | AC41678-5000 | |
| Donor Horse Serum | Cellgro | 35-030-CV | |
| TritonX-100 | Sigma-Aldrich | X100-500ML | |
| 10 ml serological pipette | Fisher Scientific | 357551 | |
| anti-GFP, rabbit, 488 conjugate | Invitrogen | A21311 | |
| Stereotaxic Surgery Reagents | |||
| Vet-Syringe vet use T.B. Syringe only 1 cc Luer slip T.B. 100/bx | Med-Vet International | 1CCVLS | |
| Isoflurane | |||
| Stainless Steel Scalpel Blades, #10, 100-pk | Med-Vet International | JOR580S | |
| artificial tear ointment | Med-Vet International | RXPARALUBE-O | |
| PVP PrepSolution | Med-Vet International | HPIV108208H | |
| normal saline | Med-Vet International | DYND500MLSH | |
| cotton tipped applicators | Med-Vet International | CTA6 | |
| Triple antibiotic ointment | Med-Vet International | RXTRIP-OI15 | |
| MONOJECT® Needles Soft Pack 25 g x 5/8" | Med-Vet International | 25058 | |
| 6-0 silk sutures | Med-Vet International | MV-711 | |
Referências
- Williams, M. R., DeSpenza, T., Li, M., Gulledge, A. T., Luikart, B. W. Hyperactivity of newborn Pten knock-out neurons results from increased excitatory synaptic drive. J Neurosci. 35 (3), 943-959 (2015).
- Luikart, B. W., et al. Pten knockdown in vivo increases excitatory drive onto dentate granule cells. J Neurosci. 31 (11), 4345-4354 (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 32 (4), 347-355 (2014).
- Luikart, B. W., et al. miR-132 mediates the integration of newborn neurons into the adult dentate gyrus. PLoS One. 6 (5), e19077 (2011).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Fricano, C. J., et al. Fatty acids increase neuronal hypertrophy of Pten knockdown neurons. Front Mol Neurosci. 7, 30 (2014).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis?. Physiol Genomics. 31 (2), 159-173 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados