Method Article
デザイン、パッケージング、および定位注射を介して高力価CRISPRレトロウイルスおよびレンチウイルスの配信
要約
CRISPR / Cas9システムは、科学界にターゲットを絞ったゲノム編集がアクセス可能で、手頃な価格にする可能性を提供しています。このプロトコルは、CRISPR / Cas9システムを使用して、目的の遺伝子をノックアウトしてから、成体マウスの脳に定位的にそれらを注入するウイルスを作成する方法を実証することを意図しています。
要約
Replication defective lentiviruses or retroviruses are capable of stably integrating transgenes into the genome of an infected host cell. This technique has been widely used to encode fluorescent proteins, opto- or chemo-genetic controllers of cell activity, or heterologous expression of human genes in model organisms. These viruses have also successfully been used to deliver recombinases to relevant target sites in transgenic animals, or even deliver small hairpin or micro RNAs in order to manipulate gene expression. While these techniques have been fruitful, they rely on transgenic animals (recombinases) or frequently lack high efficacy and specificity (shRNA/miRNA). In contrast, the CRISPR/Cas system uses an exogenous Cas nuclease which targets specific sites in an organism's genome via an exogenous guide RNA in order to induce double stranded breaks in DNA. These breaks are then repaired by non-homologous end joining (NHEJ), producing insertion and deletion (indel) mutations that can result in deleterious missense or nonsense mutations. This manuscript provides detailed methods for the design, production, injection, and validation of single lenti/retro virus particles that can stably transduce neurons to express a fluorescent reporter, Cas9, and sgRNAs to knockout genes in a model organism.
概要
正常な生理機能および疾患病理学の基礎を研究するために、正確にモデル生物における遺伝子発現を操作する必要があります。興味の遺伝的要素はリコンビナーゼによって認識部位によって隣接された哺乳類のモデル生物では、これは主に作成およびトランスジェニックマウスの開発に集中しています。これは、これらの隣接遺伝子の部位特異的な操作をもたらすことができます。これが成功戦略となっているが、それは時間と資源集約的です。例えば、flox化遺伝子、Creリコンビナーゼ、とのCreレポーター遺伝子を発現し、トリプルトランスジェニック動物を作成すると、複数の交配と検証が必要です。これとは対照的に、複製の定位注射は、flox化遺伝子動物に蛍光タンパク質およびリコンビナーゼをコードする欠損ウイルス粒子は、複雑なジェノタイピングや繁殖戦略1を必要としません。さらに、蛍光タンパク質とCreを発現するウイルスは、第二のウイルスENCOと同時注入された場合鼎異なる蛍光タンパク質、これは、標的遺伝子操作のための内組織制御を提供します。この戦略はまだノックイン動物の使用を必要とするが、ウイルス媒介性のRNAベースの戦略は、トランスジェニック動物の必要性を回避します。例えば、蛍光タンパク質および短ヘアピンRNA(shRNA)をコードする複製欠損ウイルスの定位注射は、目的の遺伝子の転写の強力な減少をもたらすことが、細胞の内因性RNAi機構を使用することができます。しかし、shRNAの戦略は、多くの場合、控えめな細胞の表現型2で得られた微妙な遺伝子ノックダウンを生成します。ノックダウンは、より生理学的に関連するヘテロ接合体遺伝子の機能不全のためかもしれないが、ノックアウトと比較して減少した堅牢性は、新規遺伝子の表現型の発見のための理想的ではありません。
最近浮上している第3の技術、CRISPR(クラスタ化された定期的にショート回文繰り返しをInterspaced)/ Cas9(CRISPR関連タンパク質9)システムは、小型の外因性RNAとDNA切断酵素の両方の発現に依存しています。 CRISPR / Cas9システムは、ウイルスからのDNAに侵入し、Cas9酵素3,4を経由して、分解のためにそれをターゲットに、外国人を同定する方法を進化させ、原核生物の免疫系から適応されました。この強力なゲノム編集技術が標的欠失、挿入、および突然変異の作成のために使用することができます。そして以下のプロトコルは、 生体内でその発現をノックアウトするために、目的の遺伝子に欠失を作成する方法の概要を示します。Cas9酵素は、足場のRNAと関心領域に相同と連続したガイドRNAで表現されなければなりません。この技術を用いて遺伝子のノックアウトは、合成ガイドRNA(sgRNA)を使用して、ゲノム中の特定の領域にCas9をターゲットにし、目的の部位に二本鎖切断(DSB)を誘導が必要です。これらのDSBは、非相同末端結合(NHEJ)はルを経由して、内因性の細胞修復機構により修復されますミスセンスまたはナンセンス変異を生成することができるので、機能的なタンパク質発現5の損失を作成することができますインデルに広告。このシステムはゲノム変化を生成するので、それだけでCas9とsgRNAの一過性の発現を必要とします。しかし、この方法で操作安定蛍光細胞を同定するための指標とその子孫のために望ましいです。
Lenti-およびレトロウイルスを安定的に長期発現を維持し、有糸分裂時に娘細胞に受け継がれている宿主細胞に目的のDNAを統合するという利点を有します。このプロトコルは、設計不良複製、高力価のレトロウイルスの2種類の製造が記載されている:ヒト免疫不全ウイルス由来のレンチウイルス粒子(レンチウイルス)およびマウスマロニー白血病ウイルス(レトロウイルス)に基づくもの。これらのウイルスの両方が大きな導入遺伝子の発現する安定をサポートすることが可能であるが、レトロウイルス粒子は、ゲノムデュに統合することができます従って、核膜の分解、およびと環細胞分裂を標識するためのツールおよび出生日付セル6として使用することができます。レンチウイルスは、ウイルス収集中のカフェイン8の使用を含む比較的低力価図7に示すように 、この方法論、との評判がありますが、日常的に10 9〜10 10粒子/ mlの力価を生成します。 lenti-およびレトロウイルスのもう一つの利点は、非常に大きな挿入するための許容範囲です。プロトコルの次のコレクションには、DNAを変更するだけでなく、蛍光タンパク質を発現するCRISPR / Cas9システムを利用するために蛍光レポーター、sgRNAs、およびCas9をコードするレンチウイルスまたはレトロウイルスを設計するための手順の概要を説明します。
マウス定位脳神経外科は、形態、機能、および感染したニューロンの接続性を研究するために、in vivoでウイルスを注入するための貴重な方法です。ニューロンにおけるウイルス感染は、TIMの長期間にわたって発現レベルを操作するために使用することができますこのような開発全体としてE、および発現は、正確に、種々の薬物誘導性システムの使用及び特定のCre駆動発現によって制御することができます。この特定のプロトコルは、成体マウスの脳に目的の遺伝子をノックアウトするsgRNAとCas9を発現するウイルスを注入する方法を説明します。マウスは、この手順から非常に迅速に回復し、ウイルス導入遺伝子の発現は、48時間後の注射の中を見ることができます。しかし、蛍光団式が3週間後の感染によってほぼ最大レベルが得られ週間にわたって増加するように見えます。ウイルス定位注射を受けたマウスは、行動、電気生理学、または形態学的研究のために使用することができます。全体的に、これらの手順の目的は、定位手術や特定sgRNAとCas9を発現するウイルスを使用して、成体マウスの脳内の遺伝子をノックアウトする方法を実証することです。
プロトコル
倫理声明:すべてのプロトコルは、ダートマス制度バイオセーフティ・機関動物実験委員会審査委員会によって承認されました。
CRISPR / Cas9レトロウイルスのためのガイドストランド(sgRNA)を設計するための1プロトコル
注:(https://benchling.com/とhttp://crispr.mit.edu/)目的の遺伝子を標的とするsgRNAsを生成するために使用することができ、多くの非営利ウェブサイトがあります。このプロトコルの目的は、互いにアニーリングされている商用ベンダーから一本鎖オリゴを設計し、注文することです。このアニーリングオリゴPXLトランスファーベクター中に連結されます。 Benchlingを使用して設計sgRNAsの例については、補足ビデオ1を参照してください。
- sgRNAsの設計に専用のウェブサイトを使用してください。
注:たとえば、ウェブサイトに目的の遺伝子の先頭付近から符号化/エキソン配列を入力すると、20ヌクレオチドsgRNAを生成します。センスおよびアンチセンスオリゴを設計するために20ヌクレオチドsgRNA配列を使用sgRNAを作成するために注文することになりますの。 - sgRNAを生成した後、ワードプロセッサにこのシーケンスをコピーします。それはすでに1( すなわち、G-20ヌクレオチドsgRNA配列)で始まっていない場合は、文書内の20ヌクレオチドsgRNA列の先頭をG(グアニン)を追加します。これは、U6プロモーターからの良好な転写性を確保する必要があります。
- この今20-21塩基配列の逆相補を文書化します。センスオリゴについて、文書( すなわち、CACC-G-20ヌクレオチドsgRNA配列)で配列の5 '末端に「CACC "を追加します。このオーバーハングはPXLベクター中に配列を連結するために使用されます。
- アンチセンスオリゴは、5 '末端にAAACを追加します。 PXLベクターに配列を連結するために、このオーバーハングを使用します。
- センスおよびアンチセンスオリゴを取得します。オリゴを受け取った後、DNアーゼを含まない水を使用して、100μMストックを作ります。 4μと一緒に10μlの100μMセンスおよびアンチセンスオリゴの各ミックス10×NEBバッファー2、および水の16μlにリットル。
注:(のBbsIオーバーハングは、非互換性の粘着末端であるように)彼らは、ページの精製または5'phosphorylationを必要としません。- フォーム「フローター」ホルダーに、この混合物を含むチューブをフロートその後、500ミリリットルのビーカーで沸騰に水200mlを持参してください。室温で2時間、95℃から水がゆっくりと冷却させます。
- 滅菌水で千を、次のライゲーションですぐに使用するか、または-20℃で残りの反応を保存:今アニールオリゴミックス1を希釈します。
- 2時間、37℃でのBbsI制限酵素で消化PXL、PX330ベクトル誘導体。 PXLの2μgの、10×NEBバッファー2、BBS1とバランスの水の1μlと4μLを含む40μlの反応を使用してください。市販のキットを使用してルーチンゲル精製に消化-PXLを施します。収率は〜8.5 kBの製品であることを確認してください。
- 千:商業ライゲーションキットを用いて、1の1μLを連結消化し、ゲル精製-PXL 50ngのでアニールオリゴ。有能な組み換え欠損E.にライゲーション産物を変換大腸菌 (NEB 5-α、サブクローニング効率)。プラスミドのDNA配列決定により正しいガイドの存在について形質転換体をスクリーニングします。
- BstB1とPAC1制限酵素を使用してPXLのうちU6、ガイド鎖、およびRNA足場要素(sgRNA)を消化し、同じ制限酵素で消化された蛍光タンパク質-T2A-Cas9ウイルスバックボーンに連結します。ライゲーション産物(NEB 5-αの最大効率)を形質転換。蛍光タンパク質-T2A-Cas9ウイルスバックボーンプラスミドは、低コピープラスミドであり、したがって、低コピープロトコルを使用する必要があります。
注:第sgRNAは、同様に別のPXLガイド鎖プラスミドのPacIで消化によって導入され、PAC1に連結することができるが消化し、子ウシ腸ホスファターゼは、すでに最初のガイド鎖を含むウイルスバックボーンを治療しました。ウイルストランスファープラスミドのホスファターゼ処理を助けます第二のガイドを含まないプラスミドの自己連結からの形質転換体の数を減らします。 - シーケンスは、Nucleobondエクストラマキシプレップキットを使用して、最終プラスミドとマキシプレップを確認し、次の「レトロ/レンチウイルス生産のためのプロトコル - CaPO4法」を使用して、ウイルスにそれをパッケージ化します。
2.トランスフェクションのために293FT / 293GP細胞を調製(レトロ/レンチウイルス生産 - CaPO4法)
- (1日目)迅速に37℃の水浴中で10cmの細胞培養プレート当たりの細胞の1バイアルを解凍します。レンチウイルスパッケージングのために、293FT細胞を使用しています。レトロウイルスパッケージングのために、293GP(ギャグ/ POL)細胞を使用しています。
- ピペットクライオチューブから解凍した細胞のすべての15ミリリットルコニカルチューブにし、予め温めておいたCO 2平衡化し、完全なイスコフ改変ダルベッコ培地の2ミリリットルを追加します。
- 500×gで5分間遠心細胞をペレット化します。です上清を吸引し、完全な10mlに細胞ペレットを再懸濁入り江のはダルベッコ培地を修正しました。 10cmの細胞培養皿に細胞をプレート。 5%炭酸ガスインキュベーター内で37℃で一晩細胞をインキュベートします。
- (2日目)メッキ後24時間は、既存のメディアを吸引し、プレートに予め温めておいたイスコフ改変ダルベッコ培地の10ミリリットルを追加することによって、プレート上のメディアを変更します。
- メディアの変更後(日3-4)24〜48時間、細胞がコンフルエントになった後、2.5〜3.0×10 6細胞/プレート(10cmプレート)のコンフルエントに細胞を分割します。
- 細胞を分割培地を吸引し、PBS 5mlでプレートを洗浄します。プレートに0.25%トリプシンの1ミリリットルを加え、細胞がプレートを持ち上げまで37℃でインキュベートします。 0.25%トリプシン反応を中和し、1.5mlチューブに細胞をピペットするイスコフ改変ダルベッコ培地の0.5ミリリットルを追加します。
- 5分間、500×gで細胞をスピン。イスコフ改変ダルベッコ培地1mlに細胞を再懸濁します。 10を希釈81; PBS90μlの中の細胞のリットル。血球計数器または自動セルカウンターのいずれかを用いて細胞を数えます。完全イスコフ改変ダルベッコ培地で再プレート2.5から3.0×10 6細胞/プレート。
注:細胞は、播種後〜50%コンフルエント24-34時間になります。彼らは〜50%コンフルエントである場合に細胞をトランスフェクション。
3.(5日目)CaPO4トランスフェクションおよびウイルス粒子コレクション
- 既存のメディアを吸引し、予め温めておいたイスコフ改変ダルベッコ培地の10ミリリットルを添加することにより、トランスフェクション前にメディア2時間を変更します。 10cmプレート内のメディアの正確に10ミリリットルがあることを確認してください。
- 2、5ミリリットル丸底ポリスチレンチューブを使用して、2皿のためのトランスフェクション試薬を準備します。第1のチューブ「DNA」と第二の管「2X HBSを "ラベルを付けます。 pH7.4でのTris-EDTA中/μLを1μgのために、DNAの濃度を調整します。
- レンチウイルスの場合は、ゆっくりとトランスファーベクター20μlの(ザビラを追加第1のチューブ(「DNA」)への関心のリットルコンストラクト)、CMVdelta8.9の13μlを、VSV-Gの9μlを、分子生物学グレードのH 2 Oの860μlの、および2.5 M CaCl 2を100μlの連続タッピングしながら、チューブに混合します。
- レトロウイルスの場合は、CMVdelta8.9プラスミドを省略します。 「DNA」というラベルの付いたチューブに20μlのトランスファーベクター、15μlのVSV-G、860μlの分子生物学グレードH 2 O、および100μlの2.5 MのCaCl 2を追加します。
- 2×HEPES緩衝生理食塩水の1ミリリットル加える(pHは7.0を、このpHは絶対的に重要である)「2X HBS」というラベルの付いたチューブに。
- ゆっくりと、「2X HBS」チューブに一度に1滴 "DNA"チューブの1ミリリットル内容を追加します。 "DNA"チューブの内容を追加しながら継続的にインデックスまたは中指で「2X HBS」チューブをタップします。各ドロップした後に見かけたCaPO 4小胞を観察します。室温で30分間、暗所で管をインキュベートします。
- その後、37℃で一晩インキュベート、各10cmの細胞プレートにゆっくりと液滴中のトランスフェクションの1ミリリットルを追加します。
- (6日目)イスコフ改変ダルベッコ培地+ 0.5%FBSおよび40mgのカフェイン/ 100ミリリットルのメディアの8ミリリットルでメディアを交換してください。トランスファーベクターは、蛍光マーカーが含まれている場合、フルオロフォアの発現はトランスフェクションの成功を示しています。
- (7日目)は、10ミリリットルの血清学的ピペットを使用してウイルス粒子を含む培地を収集し、50mlコニカルチューブに分注します。 4℃で50ミリリットルコニカルチューブに保管してください。各プレートに0.5%FBS培地の8ミリリットルを追加します。
- (8日目)再び、ウイルス粒子を含む培地を収集し、50mlコニカルチューブに、前日の収穫と組み合わせます。
4.濃度およびウイルスの精製
- ddH 2 Oに40%のポリエチレングリコール6000および1.5 MのNaClを添加することによって5倍ポリエチレングリコール6000溶液を作ります上のソリューションをオートクレーブ121℃で45分間、液体サイクル。冷却時にゆっくりと溶液を混合。
注:解決策は曇っ開始し、それが冷えると明らかになるだろう。 - 不溶性物質をペレット化するために、10分間、2000×gでウイルス上清の両方のコレクションを含む50mlコニカルチューブを遠心します。 0.45μmの低タンパク質結合シリンジフィルター(PESまたはPVDF)を通して濾過することによりウイルスのメディアを精製します。
- 5Xポリエチレングリコールをメディアに6000溶液を加える(最終濃度は8%ポリエチレングリコール6000及び0.3MのNaClであるべきです)。チューブを数回(ない渦を行う)転倒混和します。時折リミックス、12またはそれ以上の時間、4℃でポリエチレングリコール溶液を含むウイルスをインキュベートします。
- (9日目)遠心45分間2,500×gでのポリエチレングリコール溶液を含むウイルス。削除し、上清を破棄し、再度2分間スピン。再び、上清を除去し、廃棄します。
- 320μLを加えることによりペレットを再懸濁滅菌リン酸緩衝生理食塩水(320μLを採取媒体を含むウイルスの元の体積の1/100)で、4℃で一晩インキュベートします。必要に応じて、30分間ロッカー上で室温でペレットを再懸濁。
- ペレットを再懸濁した後、一定分量ウイルス(5-10μlを0.5ミリリットル当たりチューブ)とは、-80°C(劇的に力価を減少させる4℃で解凍やストレージを凍結)でアリコートを凍結します。
- 標準的なプロトコルを使用してウイルス力価、 すなわち、HEK293T細胞を6ウェルプレートに希釈系列を実行し、手動で48時間後の蛍光コロニーを数えます。
CRISPRウイルスの5テスト効能
注:マウスのNeuro2a細胞を用いNHEJにより修復二重鎖切断の生産のためにテストするには、以下の手順を使用して、シーケンスクローン。改変された細胞の割合および性質を決定するために使用することができるという測量アッセイよりも利点を有していますNHEJから生じるインデルの。
- 例えば、マトリゲル等のコートゼラチン状タンパク質混合物この3.5 cmの細胞培養皿は、イスコフ改変ダルベッコ培地で1:50に希釈し、37℃で30分間インキュベートします。ゼラチン状のタンパク質混合物を吸引し、のNeuro2a細胞をプレー。
- Neuro2a細胞が50%コンフルエンスに達した後、10の感染多重度でCRISPRレンチウイルスまたはレトロウイルスを追加する( すなわち、細胞あたり10ウイルス粒子)。
注:HEK293細胞であるとしてのNeuro2a細胞が感染するなどの愛想はない、したがって、単一の感染は、レンチウイルスに感染している細胞の100%にはなりません。さらに、レトロウイルスは分裂細胞に感染し、したがって、また、100%感染にはなりません。感染のほぼ100%の割合を達成するために、ウイルスの添加は、必要に応じて細胞を分割、複数の日に繰り返すことができます。あるいは、蛍光陽性細胞は、蛍光活性化セルソーティングを用いて単離することができます。目レンチウイルスと100%の感染率を達成するために、電子の最も効果的な方法は、FACS分離、続いて単一の感染を行うことです。レトロウイルスについては、24時間離れて、感染の4ラウンドを行い、100%の感染を確実にするために、FACS分離によって従います。 - 1週間細胞を感染した後、10cmプレート上でほぼコンフルエンスまで細胞を増殖培地を吸引し、リン酸緩衝生理食塩水5mlでプレートを洗浄します。 0.25%トリプシンの1ミリリットルを加え、細胞がプレートを持ち上げまで37℃でインキュベートします。 0.25%トリプシン反応を中和し、1.5mlチューブに細胞をピペットし、5分間500×gで細胞をペレットにイスコフ改変ダルベッコ培地の0.5ミリリットルを追加します。
- 細胞を再懸濁し、95でインキュベート、50 mMの水酸化カリウムの100μlを添加、DNAを単離します 5分間°C。 1 Mトリス、pH値= 8.0の10μLを用いて溶液を中和します。
- PCRは、CRISPR sgRNAによって標的ゲノム領域に隣接する領域を増幅します使用して〜DNAの300 ngが高忠実度PCRマスターミックス4を用いて、ステップ5.5で単離しました。
- このようなゲルDNA回収キットとして2.5%アガロースゲル及びゲルのゲル精製キットを使用して適切な大きさの断片を精製のPCR反応を実行します。 pGEM-T-容易などのPCRクローニングベクターに連結し、コンピテントセル9に変身。
- 24時間後、15ミリリットル丸底チューブだけでなく、適切な抗生物質(アンピシリン、ネオマイシン、 など )にLBブロスの2ミリリットルを追加します。 LB-プレートから単一コロニーを選択するために、滅菌したピペットチップやループを使用して、個々のコロニーをチューブを接種します。 24時間250 RPM、37℃でチューブを振盪することによりコロニーを展開し、成長します。必要な数のコロニーを繰り返します。
- ミニプレップキットを用いて、 大腸菌からDNAを単離しますcoliおよびマウスゲノムのCas9標的領域を分析するためにsgRNAによって標的遺伝子の領域を増幅するために設計されたプライマーを有する配列。
成体マウス6.定位注入プロトコル
- 手術の準備
注:それは生存の手術中に無菌状態を維持することが重要です。これは、熱が、手術ツールの滅菌注射部位を滅菌するためにベタジンを用いて、それを閉じた後、切開部位に抗生物質軟膏を追加することによって、このプロトコルで達成されます。滅菌手袋だけでなく、徹底的に滅菌、専用の手術領域を使用することも重要です。- 熱オートクレーブ処理または使用したホットビーズ滅菌器のいずれかによって、使用前に手術ツールを殺菌。手術と回復の間に体温を維持するために加熱パッドをオンにして回収室と手術領域を準備します。注射のための頭蓋骨に穴を作成するために使用されるドリルを組み立てます。
- 負荷無菌PCRチューブから直接ウイルスを回収することにより、注射針へのウイルスの4μlの。簡単に言うと氷からのウイルスのアリコートを削除します。ウイルスを維持します注射の前にわずか1時間、室温でシリンジインチ
7.定位注射
- 手術スイートに換気が適切な空気の流れを確保するために開いていることを確認してください。誘導室中4%イソフルランで麻酔により手術のためにマウスを準備します。麻酔後、注射部位を準備するために頭を剃ります。
- 舌を下に移動し、ピンセットを使用し、側に定位固定装置内でマウスを置きます。歯がスロットにドロップするまで、耳のバーを固定した後、口の中に一口棒を挿入します。マウスの本体は加熱パッド上にあり、鼻はノーズコーンに位置していることを確認してください。ノーズコーンへの直接4%イソフルラン。ピンセットで足をつまんと全く驚愕反射が存在しないことを確実にすることによって、麻酔を確認してください。
- 目を潤滑するために人工涙液を適用します。 POVのラウンドを交互に剃った頭を拭き取ることにより、注射部位の準備を完了ドン - ヨウ素とリドカイン。
- メスを使用して、頭皮の中心に沿って小さな切開をカット。ブレグマを視覚化するために、必要に応じて綿棒と過酸化水素との頭蓋骨を乾燥させます。
- 解剖スコープを使用して、頭蓋骨のブレグマを見つけて、ブレグマ上のドリルの先端を配置します。ゼロ(またはレコード)デジタル定位は、x、y、z平面上の座標。
- ヘッドは、y軸を尾側吻側ためのレベルであることを確実にするために、ラムダのドリルビットを配置し、z座標ブレグマとラムダの両方でほぼ等しくなるようにヘッドを水平。
- ヘッドは、x軸上のレベルであることを確実にするために、Y = 1/2ラムダにドリルビットを配置します。 z座標れていることを確認すると、各側に1ミリメートル矢状縫合の(X = +/- 1ミリメートル)で等しいです。ラムダの左右に1ミリメートルでのz座標に差がある場合には頭蓋骨を調整します。
- 希望する座標上でドリルを置きます。歯状回の場合は、座標を使用しますSY =ブレグマから-1.9であり、x = +/- 1.1。掘削する前に、ゆっくりと慎重に、頭蓋骨をドリルスルー、2パーセントにイソフルランを下げます。
- すべての穴を開けた後、定位固定装置に充填されたシリンジを固定。視覚的に穴の上に注射器を中心に、zは頭蓋骨の座標を0に設定します。
- ゆっくりと最も深いZ深度に注射器を下げます。歯状回では、zの深さが-2.5、-2.4、および-2.3です。定位注射器を用いて、0.25マイクロリットル/分の速度で注入を開始します。
- 注入後、再び次の座標と開始注射に上げ、1分待ってから、最低のZ-深さで完了です。すべてのz注入座標が注入されるまで、このパターンを続けます。最後の注射後、注射器を取り外す前に、2分を待ちます。
注:悪影響はマウスの脳半球あたりのウイルスの2μlにまで注入することによって、組織に指摘されていません。
- 注入後、再び次の座標と開始注射に上げ、1分待ってから、最低のZ-深さで完了です。すべてのz注入座標が注入されるまで、このパターンを続けます。最後の注射後、注射器を取り外す前に、2分を待ちます。
- 他のボアホールを繰り返し注入。
- 注入後、定位固定装置からマウスを削除し、6-0絹縫合糸で頭皮を縫合。創傷にリドカインおよび抗細菌クリームを適用します。
- 痛みを管理するためのIP経路を介して0.8〜1.0ミリリットル生理食塩水+ケトプロフェン(3-5ミリグラム/キログラム)を注入します。その後、加熱された回収室にマウスを置きます。それは胸骨横臥位を維持するのに十分な意識を取り戻したまで無人の動物を放置しないでください。それは完全に回復するまで他の動物の会社に動物を返しません。
- 手術後の日に、毎日マウスを計量し、柔らかい食べ物やお菓子を提供しています。傷をチェックして、一般的な条件/態度を注意してください。
- 定位注射後、マウスをスライスプレップ電気生理学1のために安楽死させ、又は灌流し、その脳を取り出し、スライスした、と分析10のために免疫組織化学を経由して染色することができます。
結果
特定の配列を標的とするオリゴが下流hU6プロモーターのPXLクローニングベクターに挿入し、のBbsIクローニング部位を用いて、ガイドRNA足場の下流ている、「CRISPR / Cas9レトロウイルスのためのガイドストランド(sgRNA)を設計するための議定書」に続いて( 図1、ステップ1)。このsgRNAは次にPXLから切り出し、をBstBIおよびPacI部位( 図1、ステップ2)を用いてpRubi骨格に挿入されます。最後に、別のsgRNAはPXLにクローニングされた遺伝子の別の領域を標的とし、NHEJを介してノックアウトのチャンスを増やす、pRubi-参照編1( 図1、ステップ3)における第一ガイドの下流に配置することができます。正しい構築物の確認は、配列分析によって決定されるべきです。この構築が行われると、それは「レトロ/レンチウイルス生産 - CaPO4法のプロトコル」以下のウイルスにパッケージングすることができます。成功したパッケージは、Vを滴定するために、HEK293細胞へのウイルスの感染によって確認されますirus。全く蛍光団式が存在しない場合は、可能性の高いウイルスのパッケージング中にエラーが発生しました。
図2は、GFPおよび他の発現しmCherryをを発現する1つの、新生児マウスの歯状回に同時注入し、2レトロウイルスの代表的な結果である(7日齢)と注射後21日画像化しました。 mCherryをまたはGFPを持つ神経細胞の標識は、1つのウイルスは単独で蛍光団を発現し、CRISPR / Cas9 KOおよび他のコントロールウイルスを媒介を表現することができ、同じ組織内の様々な遺伝子操作の形態学的評価を可能にします。定位注射が意図座標、歯状回の個別の感染によって示されるように、正確な解剖学的選択性を可能にします。感染のために脳切片を分析する場合、正しい解剖学的領域が感染されたと判定されるまで、周囲の組織を維持することが重要です。感染の兆候がない場合は、注入は、隣接領域ANに発生する可能性がありますdは周囲のセクションで同定することができます。また、正確な注入領域を見つけるために、針のトラックを見つけることが役に立ちます。 VSVG偽型ウイルスはほとんどin vivoで注射した場合、歯状回の余白の外に広がっていない、と3D再構成により分析し、全体の歯状回に沿って細胞を感染吻側/尾側軸( 図3)に沿って拡散する傾向があります。
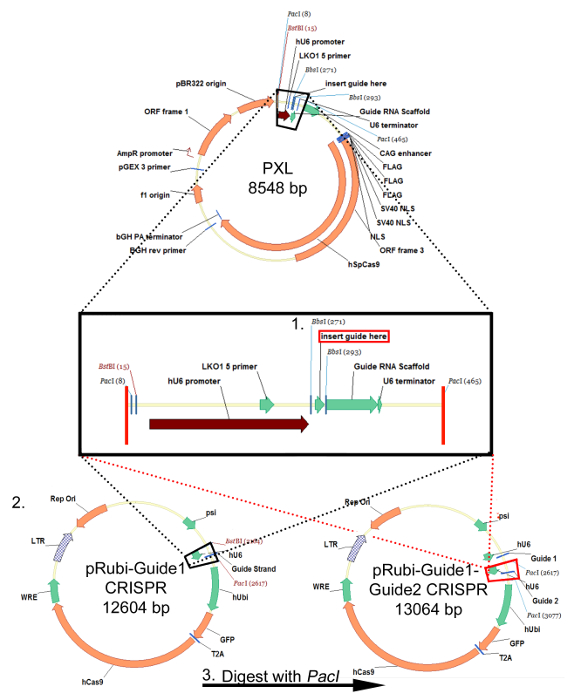
図1:レトロウイルスpRubi-参照編1-Guide2-CRISPRプラスミドのためのクローニング戦略は、この戦略は、FUベースのレンチウイルスプラスミドで同じです。 sgRNAオリゴをアニールし、BsbIクローニング部位を用いPXLに挿入されます。 sgRNAが正常PXLに挿入されることを保証するために配列決定した後、 をBstBIおよびPacIでプラスミドを消化。 (ブラックボックス)をドロップアウトされるインサートは、その後、ウイルスのバックB中にクローニングされ、1(黒の線を点在)pRubi-参照編1 CRISPR。第sgRNAもPXLに挿入およびPacI酵素を用いて消化することができます。次に、これをPacI部位を使用してpRubi-参照編1のCRISPRベクトル(赤点線)にクローニングされています。得られたプラスミドは、その後、ガイドストランドと同様に必要なウイルス要素、プロモーター、およびフルオロフォアの両方が含まれています。 この図の拡大版をご覧になるにはこちらをクリックしてください。
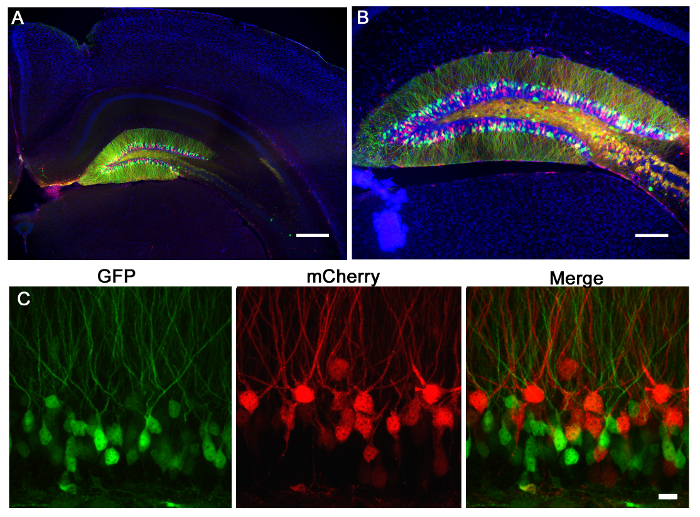
図2:mCherryを(赤)またはGFP(緑色)を発現するマウスの歯状回のレトロウイルス注射レトロウイルスは、P7マウスの歯状回に注入しました。 21日後、マウスを灌流し、脳を切片にし、GFPとmCherryを染色しました。 (A)5X広視野蛍光画像は、広報を示しています歯状回の注射と歯状回顆粒ニューロンを標識の特異性のecision。海馬の形態はDAPI(青)染色を介して見ることができます。スケールバーは200μmで測定します。 (B)10×広視野蛍光画像は、これらの高力価のレンチウイルスは、形態フルオロフォアの発現を介してアクセスすることができる多数の細胞に感染することを示しています。スケールバーは100μmを測定します。 GFPまたはmCherryをを表す(C)ウイルスは、歯状回に同時注入しました。レトロウイルスのシステムを使用して、1は、GFPとmCherryをすることによってマークされ、別の操作によってマーク1遺伝子操作を行うために1つのウイルスを使用し、その後に起因各ウイルスへの単一または添加変化を評価することができます。スケールバーは10μmで測定します。
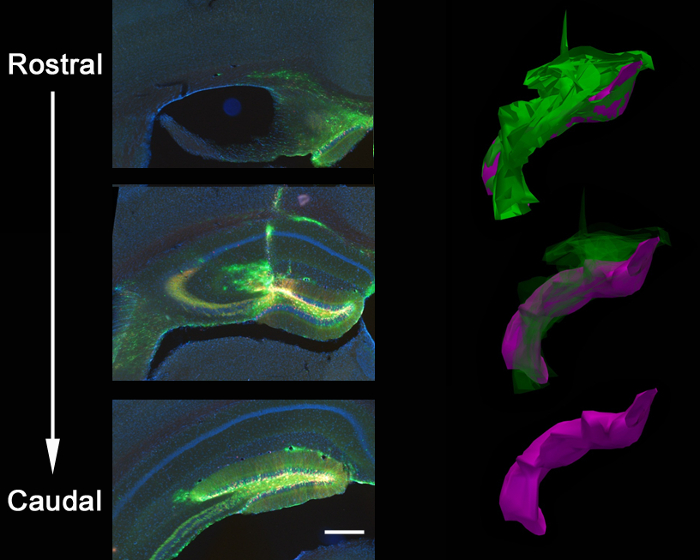
図3:レンチウイルス注射の解剖学的広がり定位共射出。大人のPTEN のloxP / +マウスの脳へのGFP-shPtenウイルスとmCherryを制御ウイルスのは、海馬の歯状回の全体の吻側/尾側軸に沿って、ウイルスの拡散をもたらしました。これは、ウイルスの拡散の輪郭が再構築ソフトウェアを使用して21連続切片(Z = 50ミクロン/セクション)にトレースされた閉じた注入の程度の3D再構築に示されています。輪郭追跡は、ボリュームの定量化のための3D画像を生成するように整列させました。合計ウイルスの拡散は、緑色(ボリューム= 54730800μmの3)に示されており、座局在スプレッドは紫(ボリューム= 27275200μmの3)に示されています。ウイルスは、針トラックと歯状回の吻側/尾側軸を埋めることに加えて、針トラックの交差点で脳梁に沿って広がります。スケールバーは200μmで測定します。
レ/ ftp_upload / 53783 / 53783video1frame.jpg "/>
レトロウイルスおよびレンチウイルスバックボーンにクローニングするsgRNAsの補足ビデオ1.デザイン。
この合成ガイドRNA(sgRNA)設計例では、マウスCHD8のゲノム配列は、NCBIからダウンロードされます。開始コドンおよびエキソン構造は、その後、ベクターNTIで可視化されています。これは、私たちは第1コーディングエクソン周りのゲノム領域をコピーして、Benchlingにこのシーケンスを入力することができます。 Benchlingは、私たちは地域のすべての潜在的なsgRNAsを可視化することができます。さらに、我々は、入力を持つゲノム領域を示す後、Benchlingは私たちに各ガイドRNAのためのターゲットオンとオフターゲットスコアが表示されます。次に、ユーザは、最高のオンとオフターゲットスコアのガイドRNAを選択することができます。 このビデオを見るにはこちらをクリックしてください。 (ダウンロードするには、右クリックします。)
ディスカッション
成功したウイルスのパッケージングのために重要であるいくつかの重要なステップがあります。不健康な細胞が大幅に生成されたウイルスの量を減少させるように、細胞の健康は、トランスフェクション前との間に重要です。トランスフェクションおよびパッケージングが成功した場合、100%の細胞は、フルオロフォアを発現するはずであり、細胞が機能的なシンシチウムを形成すべきです。ステップ3.2.4では、チューブをタップすると、効率的に高い力価のトランスフェクションのために必要であり、HEPES緩衝生理食塩水のpHは正確でなければなりません。ウイルスのパッケージングに必要なプラスミドを生成マキシプレップは非常に純粋である必要があります。この点に、最終的なDNAの溶出を沈殿させ、トリスEDTA緩衝液に再懸濁エタノールと便利です。カフェインは、ウイルス回収の前に6日目(ステップ3.4)上に追加されていることを培地中で2%以下に血清の量を低減することも非常に重要です。血清が減少しない場合、最終的な精製されたウイルスは、血清PROTの望ましくない量を含有するであろうEIN。ウイルス粒子を沈殿させるポリエチレングリコール6000の使用は、超遠心分離の必要性を除外しています。ウイルスを含むCas9のCRISPRは、通常、単独で蛍光団を含むウイルスよりも倍少ない10周りの力価を持っていることに注意することも重要です。
定位手術のために、吸入麻酔の使用は、注射麻酔薬と比較して、迅速かつ正確な制御または動物の意識を可能にし、より大きな年齢範囲にわたって麻酔を可能にします。清潔で無菌手術器具を維持するために非常に重要であり、かつ再現性のターゲティングは、ヘッドの正確な位置決めを必要とします。定位固定装置内や頭蓋骨が所定の位置にしっかりと感じている頭部のないピッチングやローリングがないことを確認してください。頭蓋骨の定位座標を決定するために、縫合糸を見つけるために乾燥させるのに有用であり得ます。また、座標定位それぞれのレートとボリュームは、経験的に決定されるべきです。
この手法は、(のAAV).Thereforeアデノ随伴ウイルスと比較した場合にlenti-またはレトロウイルスの広がりは、特に、制限されている離散的な脳領域に感染する際に、これらのウイルスは貴重であるが、全体的に感染のためのAAVに関連付けられていないという点で制限されています動物における行動分析に使用しました。このプロトコルにおけるカフェインの使用が大幅にこれらのウイルスの力価を増加させ、彼らはまだAAVパッケージングで達成力価ほど高くはありません。 CRISPR / Cas9が一過性にトランスフェクトした場合でも安定したゲノム編集を形成し、Cas9とsgRNAの、継続式は最終的にオフターゲット効果を生む可能性があるとしても、安定した統合は、蛍光団式の唯一の利点です。 AAVとのCRISPR / Cas9システムは、細胞分裂全体に伝播されたゲノムの変化を生成するのに十分である一過性発現は、しかし、蛍光体の発現が維持されることはありません。
LENの作成CRISPR / Cas9システムを利用ディーおよびレトロウイルスが生物の多種多様な任意の新規遺伝子を標的化する能力を付与します。遺伝子編集の効率がCas9切断をターゲティングガイドRNAの配列に依存するように思われます。経験的クローンの10%〜80%が感染のNeuro2a細胞を配列決定した後、インデルを含むことが決定されています。のNeuro2a細胞で計算さインデル周波数はニューロンのものを反映しているかどうか現時点では不明です。このようなBenchlingように、ガイドRNAの設計ソフトウェアは現在、所定の標的配列の効率を予測することができるかもしれない「オンターゲット」のスコアが含まれます。どの程度そのような「オンターゲット」のスコアには、CRISPR-Cas9システムは、より広く実装になると、経験的に、ニューロンおよび他の細胞型で決定される信頼性が必要です。
レンチウイルスベースのトランスジェニック動物の生産は、レンチウイルス配信の導入遺伝子は、Siとなっていることを報告して可変に成功しています11を lenced。 DNAのCRISPR介在遺伝子編集全体の動物モデルを生成するために生殖系列を介して通過することができます。したがって、安定したゲノム編集は、ウイルス送達フルオロフォアおよびCas9導入遺伝子のサイレンシングにもかかわらず、達成可能であってもよいです。これは、標的ゲノム変化のための効率的なプラットフォームを提供することができます。 CRISPR / Cas9系のウイルス送達、トランスジェニック生物を必要としないが、これらの技術に相補的です。例えば、誘導的に遺伝子操作と神経活動との関係の中に複雑な研究を促進すべきであるのCreとのCre依存オプトまたは化学遺伝導入遺伝子を発現する化合物のトランスジェニック動物に、そのようなウイルス粒子を注入します。第二の例は、遺伝子 - 遺伝子相互作用をスクリーニングする試みで、条件付きノックアウトにこれらCas9 / sgRNAウイルス粒子を提供することです。最後に、本研究のもう一つの刺激的なルートは、患者由来の細胞における表現型と治療化合物のスクリーニングは、どの缶です検証し、様々な疾患で破壊された遺伝子ネットワークを発見するために使用されます。
開示事項
著者らは、開示することは何もありません。
謝辞
この作品は、R01MH097949を付与し、自閉症はBWLとノリスコットンがんセンター光イメージング共有計装グラントP30CA023108にパイロットグラント7359スピークスNINHによってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| List of Cell Culture Reagents | |||
| 293FT cell line | Life Technologies | R700-07 | For Lentivirus |
| 293GP cell line | Clontech | 631458 | For Retrovirus |
| Iscove's Modification of DMEM (IMDM) | Corning | 10-016-CV | Complete IMDM with 10% FBS, 1% NEAA, 1% L-Gln, and 1% P/S |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| MEM Nonessential Amino Acids (NEAA) | Corning | 25-025-CI | |
| L-Glutamine solution, 100x (L-Gln) | Corning | 25-005-CI | |
| Pennicillin/Streptomycin solution, 100x (P/S) | Corning | 30-002-CI | |
| Polystyrene 10 cm plate | USA Scientific | CC7682-3394 | |
| Trypsin EDTA 1x | Corning | 25-053-CI | |
| List of Transfection Reagents | |||
| 5 ml polystyrene tubes | Fisher Scientific | 352054 | |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Scientific | C69-500 | Make a 2.5 M solution in ddH2O |
| Sodium Chloride (NaCl) | Fisher Scientific | S271-3 | |
| HEPES | Fisher Scientific | BP2939-100 | |
| Sodium phosphate dibasic (Na2HPO4) | Fisher Scientific | S369-500 | |
| 2x HEPES Buffered Saline (HBS) | 500 ml: 8.2 g NaCl, 5.95 g HEPES, 0.106 g Na2HPO4, pH 7.01 (exact!) | ||
| Caffeine | Sigma-Aldrich | C0750-5G | |
| 0.22 µM syringe filter unit | EMD Millipore | SLGV033RS | |
| 0.45 µM syringe filter unit | EMD Millipore | SLHP033RS | |
| 60 cc L/L Syringe | Med-Vet International | MV60CCLL | |
| 50 ml Conical Tube | Corning | 352098 | |
| polyethylene glycol 6000 (PEG 6000) | Millipore | 528877 | |
| (10x) Phosphate Buffered Saline (PBS) | National Diagnostics | CL-253 | |
| 0.5 ml microcentrifuge tubes | USA Scientific | 1605-0000 | |
| Matrigel | Fisher Scientific | CB-40230A | |
| 6-well plate | Fisher Scientific | 353046 | |
| Paraformaldehyde | Fisher Scientific | AC41678-5000 | |
| Donor Horse Serum | Cellgro | 35-030-CV | |
| TritonX-100 | Sigma-Aldrich | X100-500ML | |
| 10 ml serological pipette | Fisher Scientific | 357551 | |
| anti-GFP, rabbit, 488 conjugate | Invitrogen | A21311 | |
| Stereotaxic Surgery Reagents | |||
| Vet-Syringe vet use T.B. Syringe only 1 cc Luer slip T.B. 100/bx | Med-Vet International | 1CCVLS | |
| Isoflurane | |||
| Stainless Steel Scalpel Blades, #10, 100-pk | Med-Vet International | JOR580S | |
| artificial tear ointment | Med-Vet International | RXPARALUBE-O | |
| PVP PrepSolution | Med-Vet International | HPIV108208H | |
| normal saline | Med-Vet International | DYND500MLSH | |
| cotton tipped applicators | Med-Vet International | CTA6 | |
| Triple antibiotic ointment | Med-Vet International | RXTRIP-OI15 | |
| MONOJECT® Needles Soft Pack 25 g x 5/8" | Med-Vet International | 25058 | |
| 6-0 silk sutures | Med-Vet International | MV-711 | |
参考文献
- Williams, M. R., DeSpenza, T., Li, M., Gulledge, A. T., Luikart, B. W. Hyperactivity of newborn Pten knock-out neurons results from increased excitatory synaptic drive. J Neurosci. 35 (3), 943-959 (2015).
- Luikart, B. W., et al. Pten knockdown in vivo increases excitatory drive onto dentate granule cells. J Neurosci. 31 (11), 4345-4354 (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 32 (4), 347-355 (2014).
- Luikart, B. W., et al. miR-132 mediates the integration of newborn neurons into the adult dentate gyrus. PLoS One. 6 (5), e19077 (2011).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Fricano, C. J., et al. Fatty acids increase neuronal hypertrophy of Pten knockdown neurons. Front Mol Neurosci. 7, 30 (2014).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis?. Physiol Genomics. 31 (2), 159-173 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved