Method Article
Design et emballage, et de livraison de titre élevé CRISPR Retro et lentivirus via stéréotaxique Injection
Dans cet article
Résumé
Le système / cas9 CRISPR offre la possibilité de faire éditer génome ciblé accessible et abordable pour la communauté scientifique. Ce protocole vise à démontrer comment créer des virus qui Knockout un gène d'intérêt en utilisant le système / cas9 CRISPR, puis les injecter stéréotaxique dans le cerveau de souris adulte.
Résumé
Replication defective lentiviruses or retroviruses are capable of stably integrating transgenes into the genome of an infected host cell. This technique has been widely used to encode fluorescent proteins, opto- or chemo-genetic controllers of cell activity, or heterologous expression of human genes in model organisms. These viruses have also successfully been used to deliver recombinases to relevant target sites in transgenic animals, or even deliver small hairpin or micro RNAs in order to manipulate gene expression. While these techniques have been fruitful, they rely on transgenic animals (recombinases) or frequently lack high efficacy and specificity (shRNA/miRNA). In contrast, the CRISPR/Cas system uses an exogenous Cas nuclease which targets specific sites in an organism's genome via an exogenous guide RNA in order to induce double stranded breaks in DNA. These breaks are then repaired by non-homologous end joining (NHEJ), producing insertion and deletion (indel) mutations that can result in deleterious missense or nonsense mutations. This manuscript provides detailed methods for the design, production, injection, and validation of single lenti/retro virus particles that can stably transduce neurons to express a fluorescent reporter, Cas9, and sgRNAs to knockout genes in a model organism.
Introduction
Pour étudier la base de la physiologie normale et la pathologie de la maladie, il existe un besoin de manipuler avec précision l'expression génique dans des organismes modèles. Pour les organismes modèles de mammifères, cela est largement centré sur la création et le développement de souris transgéniques dans lequel un élément génétique d'intérêt est flanqué par des sites reconnus par une recombinase. Cela peut se traduire par une manipulation spécifique au site de ces gènes flanqués. Bien que cela ait été une stratégie réussie, il est temps et beaucoup de ressources; par exemple, la création d'un animal transgénique triple qui expriment un gène floxés, la recombinase Cre, et un gène rapporteur Cre nécessite plusieurs accouplements et de validation. En revanche, l'injection stéréotaxique de replication de particules virales défectueuses codant pour une protéine fluorescente et la recombinase dans un gène animal floxés ne nécessite pas génotypage complexes ou des stratégies de sélection 1. En outre, si une protéine fluorescente et exprimant Cre virus est co-injecté avec un second virus de encoding une protéine fluorescente différente, alors cela fournit un contrôle dans des tissus pour la manipulation génétique ciblée. Bien que cette stratégie nécessite encore l'utilisation d'animaux knock-in, les stratégies à base d'ARN à médiation par un virus contournent la nécessité d'animaux transgéniques. Par exemple, l'injection stéréotaxique de virus à replication déficiente codant pour une protéine fluorescente et un ARN en épingle à cheveux (shRNA) peut utiliser la machinerie d'ARNi endogène de la cellule à entraîner une réduction efficace de la transcription d'un gène d'intérêt. Cependant, les stratégies shRNA produisent gènes subtile knock-downs entraînant souvent phénotypes cellulaires modestes 2. Alors qu'un knock-down peut être plus physiologiquement pertinents pour le dysfonctionnement du gène hétérozygote, sa robustesse diminué par rapport à un knock-out est pas idéal pour la découverte phénotypique de nouveaux gènes.
Une troisième technique qui a récemment vu le jour, le CRISPR (en cluster régulièrement intercalées Repeat Palindromique Short) / cas9 (CRISPR-associéprotéine 9) du système, repose sur l'expression à la fois d'un petit ARN exogène et une enzyme coupant l'ADN. Le système / cas9 CRISPR a été adapté du système immunitaire procaryote qui a évolué une méthode d'identification étrangère, envahissant l' ADN de virus et de ciblage pour une dégradation par l'enzyme cas9 3,4. Cette technique de montage du génome puissant peut être utilisé pour créer des deletions, des insertions ciblées, et des mutations; et le protocole suivant décrira comment faire des suppressions dans un gène d'intérêt dans le but de KO son expression in vivo. L'enzyme cas9 doit être exprimée avec un ARN guide homologue à la région d'intérêt et contiguë à un ARN d'échafaudage. Knockout d'un gène en utilisant cette technique nécessite le ciblage cas9 à une région spécifique du génome en utilisant ARN guides synthétiques (ARNsg), et d'induire des cassures double brin (DSB) à un site d'intérêt. Ces DSB sont ensuite réparés par la machinerie cellulaire de réparation endogène par l'intermédiaire non homologue fin de rejoindre (NHEJ) qui leannonce à indels qui peuvent produire des faux - sens ou mutations non - sens et peut donc créer une perte d'expression de protéine fonctionnelle 5. Étant donné que ce système produit des altérations génomiques, il ne nécessite que l'expression transitoire de la cas9 et ARNsg. Cependant, il est souhaitable qu'un indicateur fluorescent stable pour identifier les cellules et leur descendance manipulés de cette manière.
Lenti- et les retrovirus présentent l'avantage d'intégrer de manière stable l'ADN d'intérêt dans des cellules hôtes qui maintiennent une expression à long terme et sont transmis aux cellules filles lors de la mitose. Ce protocole décrit la conception et la production de deux types de réplication défectueuse, retrovirus à titre élevé: le virus de l'immunodéficience humaine particules lentiviraux dérivés (lentivirus) et celles basées sur murin virus Maloney leucémie (retrovirus). Bien que ces deux virus sont capables de supporter l'expression stable de grandes transgènes, les particules rétrovirales ne peuvent intégrer dans le génome dula division cellulaire en anneau avec la dégradation de l'enveloppe nucléaire, et peut donc être utilisé comme un outil d'étiqueter et de cellules date de naissance 6. Alors que les lentivirus ont la réputation d'être relativement faible titre 7, cette méthodologie, y compris l'utilisation de la caféine 8 lors de la collecte virale, produit régulièrement des titres de 10 9 et 10 10 particules / ml. Un autre avantage de lenti- et retrovirus est la tolérance pour les très grands inserts. La collection suivante des protocoles décrit la procédure pour la conception d'un lenti ou retrovirus codant pour un rapporteur fluorescent, sgRNAs et cas9 pour utiliser toutes les CRISPR système / cas9 pour modifier l'ADN ainsi que d'exprimer une protéine fluorescente.
Souris neurochirurgie stéréotaxique est une méthode utile pour injecter des virus in vivo pour étudier la morphologie, la fonction et la connectivité des neurones infectés. L'infection virale dans les neurones peuvent être utilisés pour manipuler les niveaux d'expression sur une longue période de teme, par exemple au cours du développement et de l'expression peut être contrôlée avec précision par l'utilisation de divers systèmes inductibles par des médicaments et la Cre expression spécifique entraînée. Ce protocole particulier explique comment injecter un virus exprimant un ARN sg cas9 et de knock-out d'un gène d'intérêt dans le cerveau d'une souris adulte. Les souris récupèrent très rapidement de cette procédure et l'expression du transgène viral peut être vu à l'intérieur après l'injection de 48 heures. Cependant, l'expression fluorophore semble augmenter au cours des semaines conduisant à des niveaux proches maximales de 3 semaines après l'infection. Les souris qui subissent une injection stéréotaxique virale peuvent être utilisés pour le comportement, électrophysiologie, ou des études morphologiques. Dans l'ensemble, le but de ces procédures est de démontrer comment knockout un gène dans le cerveau de souris adulte en utilisant la chirurgie stéréotaxique et un virus exprimant un ARN sg spécifique et cas9.
Protocole
Déclaration éthique: Tous les protocoles ont été approuvés par les Dartmouth institutionnel de biosécurité et institutionnel de protection des animaux et l'utilisation du Comité des commissions d'examen.
1. Protocole pour la conception d'un guide de Strand (ARNsg) pour CRISPR / cas9 Rétrovirus
NOTE: Il existe de nombreux sites à but non lucratif qui peuvent être utilisés pour générer des sgRNAs pour cibler un gène d'intérêt (https://benchling.com/ et http://crispr.mit.edu/). L'objectif de ce protocole est de concevoir et de commander oligos simple brin à partir d'un fournisseur commercial qui sont recuite à l'autre. Cet oligonucléotide annelé sera ligaturé dans le vecteur de transfert de PXL. Voir la vidéo supplémentaire 1 pour un exemple de sgRNAs conception utilisant Benchling.
- Utilisez un site dédié à la conception sgRNAs.
NOTE: Par exemple, l'entrée d'une / séquence exonique de codage de près du début du gène d'intérêt dans le site va générer un ARN sg de 20 nucléotides. Utiliser la séquence d'ARN sg 20 nucléotidique pour concevoir le sens et anti-sens oligo-s qui sera commandé pour créer l'ARN sg. - Après avoir généré l'ARN sg, copiez cette séquence dans un traitement de texte. Ajouter un G (guanine) au début de la séquence d'ARN sg 20 nucléotidique dans le document , si elle ne commence pas déjà avec une ( par exemple, G-20 séquence nucléotidique ARNsg). Cela est nécessaire pour assurer une bonne transcription hors du promoteur U6.
- Documenter le complément inverse de la séquence 20-21 maintenant nucléotidique. Pour l'oligo sens, ajouter "CACC" à l' extrémité 5 'de la séquence dans le document (ie, CACC-G-20 séquence d'ARN sg de nucléotides). Ce surplus sera utilisé pour ligaturer la séquence dans le vecteur PXL.
- Pour l'oligonucléotide anti-sens, ajouter AAAC à l'extrémité 5 '. En utilisant ce débord pour ligaturer la séquence dans le vecteur PXL.
- Obtenir les sens et antisens oligos. Après avoir reçu les oligos, faire 100 uM des stocks en utilisant DNAse eau libre. Mélanger 10 ul chacun des 100 uM sens et antisens oligos avec 4 μl de 10x tampon NEB 2, et 16 pi d'eau.
NOTE: Ils ne nécessitent pas la page de purification ou 5'phosphorylation (comme les surplombs Bbsl sont des extrémités cohésives non-compatibles).- Apportez 200 ml d'eau à ébullition dans un bêcher de 500 ml, puis flotter le tube contenant ce mélange dans un support en mousse "floater". Laisser l'eau refroidir lentement à partir de 95 ° C pendant 2 heures à la température ambiante.
- Diluer le maintenant recuite-oligo mélange 1: 1 000 dans de l'eau stérile et utiliser immédiatement dans la ligature suivante ou stocker la réaction restant à -20 ° C.
- Digest pXL, un dérivé du vecteur de PX330, avec l'enzyme de restriction Bbsl à 37 ° C pendant 2 heures. Utiliser une réaction de 40 pi contenant 2 pg de pXL, 4 pi de 10 x tampon NEB 2, 1 pi de BBS1 et en eau. Soumettre le pXL-digérée à une purification sur gel de routine à l'aide d'un kit commercial. Assurez-vous que le rendement est d'environ 8,5 kB produit.
- En utilisant un kit de ligature commerciale, ligaturer 1 pi de 1: 1000recuits-oligos avec 50 ng de digérées et gel-pXL purifié. Transformer le produit de ligature dans la recombinaison compétente déficiente E. coli (NEB 5-alpha, l' efficacité sous - clonage). Cribler les transformants pour détecter la présence du guide correctes par séquençage de l'ADN du plasmide.
- Digest U6, guide de brin, et des éléments d'échafaudage ARN (ARN sg) sur pXL utilisant BstB1 et PAC1 enzymes de restriction et ligaturer dans la protéine-T2A-cas9 squelette viral fluorescent digéré avec les mêmes enzymes de restriction. Transformer le produit de ligature (NEB 5-alpha efficacité maximale). La protéine fluorescente T2A-cas9 plasmides sont des plasmides squelette viral faible nombre de copies et les protocoles de copie ainsi faibles doivent être utilisées.
REMARQUE: Un deuxième ARNsg peut être introduit de manière similaire par PacI digestion d'un autre pXL Guide brin plasmidique et ligaturé dans le PAC1 digéré et d'intestin de veau phosphatase traité squelette viral contenant déjà le premier brin de guide. le traitement de la phosphatase du plasmide de transfert viral aideraréduire le nombre de transformants à partir de l'auto-ligature des plasmides ne contenant pas le deuxième guide. - Séquence vérifier le plasmide et maxi finale de préparation en utilisant le kit de préparation maxi Nucleobond Xtra et emballer dans un virus utilisant le "Protocole pour Retro / Lentiviral Production - CaPO4 Méthode" suivant.
2. Préparer 293FT / 293GP cellules pour Transfection (Retro / Lentiviral Production - CaPO4 Méthode)
- (Jour 1) décongeler rapidement 1 flacon de cellules par 10 cm plaque de culture cellulaire dans un bain d'eau à 37 ° C. Pour l'emballage lentiviral, utilisez 293FT cellules. Pour l'emballage retroviral, utilisez 293GP (gag / pol) cellules.
- Pipeter toutes les cellules décongelées à partir du tube cryogénique dans un tube conique de 15 ml et ajouter 2 ml d'préchauffée CO 2-équilibré complet milieu de Dulbecco modifié d'Iscove.
- Centrifuger les cellules pendant 5 min à 500 xg à granulés. Aspirer le surnageant et remettre le culot cellulaire dans 10 ml de complète Estcrique de modification de Dulbecco. Plaque les cellules sur une boîte de culture cellulaire de 10 cm. Incuber les cellules pendant une nuit à 37 ° C dans un incubateur à dioxyde de carbone à 5%.
- (Jour 2) 24 heures après placage, changer les médias sur la plaque par aspiration les médias existants et en ajoutant 10 ml de pré-chauffé du milieu de Dulbecco modifié par Iscove à la plaque.
- (Jour 3-4) 24-48 heures après le changement de support et une fois que les cellules deviennent confluentes, divisé les cellules à une confluence de 2,5-3,0 x 10 6 cellules / plaque (10 cm plaque).
- Pour diviser les cellules, aspirez les médias et laver la plaque avec 5 ml de PBS. Ajouter 1 ml de trypsine à 0,25% à la plaque et incuber à 37 ° C jusqu'à ce que les cellules se soulèvent la plaque. Ajouter 0,5 ml de milieu de Dulbecco modifié par Iscove pour neutraliser la réaction de trypsine à 0,25% et une pipette les cellules dans un tube de 1,5 ml.
- Faites tourner les cellules à 500 xg pendant 5 min. Remettre en suspension les cellules dans 1 ml de milieu de Dulbecco modifié par Iscove. Diluer 1081; l de cellules dans 90 ul de PBS. Compter les cellules en utilisant soit un hémocytomètre ou compteur de cellules automatisé. Re-plaque 2,5-3,0 x 10 6 cellules / plaque avec milieu de Dulbecco modifié de Iscove complet.
NOTE: Les cellules seront ~ 50% de confluence 24-34 heures après placage. Transfecter les cellules quand elles sont confluentes à environ 50%.
3. (Jour 5) CaPO4 Transfection et Viral Collection de particules
- Changer les médias 2 h avant la transfection par aspiration les médias existants et en ajoutant 10 ml de pré-chauffé milieu de Dulbecco modifié de Iscove. Assurez-vous que il y a exactement 10 ml de milieu de la plaque de 10 cm.
- Préparer les réactifs de transfection pour 2 plats en utilisant 2, 5 ml à fond rond tubes en polystyrène. Etiqueter le premier tube "ADN" et le second tube "2X HBS". Ajuster la concentration d'ADN à 1 ug / ul dans du Tris-EDTA à pH 7,4.
- Pour lentivirus, ajouter lentement 20 pl de vecteur de transfert (le viral construction d'intérêt), 13 pi de CMVdelta8.9, 9 ul de VSV-G, 860 ul de la biologie moléculaire de grade H 2 O et 100 ul de 2,5 M de CaCl2 dans le premier tube ( «ADN») tout en appuyant de façon continue sur le tube pour mélanger.
- Pour retrovirus, omettre le plasmide CMVdelta8.9. Vecteur ajouter 20 ul de transfert, 15 ul de VSV-g, 860 ul de grade biologie moléculaire H 2 O et 100 ul de 2,5 M de CaCl2 au tube marqué "ADN".
- Ajouter 1 ml de solution saline tamponnée par HEPES 2x (pH 7,0, ce pH est absolument critique) au tube étiqueté «2X HBS».
- ajouter lentement le 1 ml du contenu du tube "ADN" au tube "2X HBS", une goutte à la fois. appuyez en continu le tube "2X HBS" avec l'index ou le majeur tout en ajoutant le contenu du tube "ADN". Observer apparents CAPO 4 vésicules après chaque goutte. Incuber le tube dans l'obscurité pendant 30 min à température ambiante.
- Ajouter 1 ml de la transfection dans des gouttelettes lentes à chaque plaque de cellules de 10 cm, puis incuber pendant une nuit à 37 ° C.
- (Jour 6) Remplacer les médias avec 8 ml de modification moyenne + 0,5% de FBS de Dulbecco d'Iscove et 40 mg de caféine / 100 ml de milieu. Si le vecteur de transfert contient un marqueur fluorescent, puis expression fluorophore indique une transfection réussie.
- (Jour 7) Recueillir les médias contenant les particules virales en utilisant une pipette de 10 ml sérologiques et distribuer dans un tube conique de 50 ml. Stocker le 50 ml tube conique à 4 ° C. Ajouter 8 ml de 0,5% de FBS à chaque plaque.
- (Jour 8) Encore une fois, de recueillir les médias contenant les particules virales et combiner avec la récolte de la veille dans le 50 ml tube conique.
4. La concentration et la purification du virus
- Faire un glycol 6000 solution 5x polyéthylène en ajoutant 40% de polyéthylène glycol 6000 et 1,5 M de NaCl à DDH 2 O. Autoclave la solution surle cycle de liquide pendant 45 min à 121 ° C. Lentement, mélanger la solution lors du refroidissement.
NOTE: La solution va commencer trouble puis devenu clair comme il se refroidit. - Centrifuger le tube conique de 50 ml contenant à la fois des collections de surnageant viral à 2000 g pendant 10 min afin de sédimenter la matière insoluble. On purifie le support viral par filtration à travers un filtre à seringue de 0,45 um liaison à basse teneur en protéines (en PES ou PVDF).
- Ajouter 5x polyéthylène glycol 6000 solution aux médias (La concentration finale doit être de 8% de polyéthylène glycol 6000 et 0,3 M de NaCl). Mélanger en retournant le tube plusieurs fois (ne pas vortexer). Incuber la solution contenant virale polyéthylène glycol à 4 ° C pendant 12 ou plusieurs heures, remixer occasionnellement.
- (9 jours) Centrifuger la solution contenant du polyéthylène glycol virale à 2500 g pendant 45 min. Retirer et jeter le surnageant et tourner à nouveau pendant 2 min. Encore une fois, enlever et jeter le surnageant.
- Resuspendre le culot par addition de 320 ul deune solution saline tamponnée au phosphate stérile (320 pi est de 1/100 e du volume initial des médias contenant virales collectées) et incuber une nuit à 4 ° C. Eventuellement, resuspendre le culot à température ambiante sur une bascule pendant 30 min.
- Après la remise en suspension du culot, aliquote du virus (5-10 ul par 0,5 ml tube) et congeler des aliquotes à -80 ° C (gel dégel ou de stockage à 4 ° C va considérablement réduire le titre).
- Titer les virus utilisant des protocoles standards, à savoir, effectuer une série de dilution sur une plaque de 6 puits de cellules HEK293T et compter manuellement colonies fluorescentes 48 heures plus tard.
5. Test d'efficacité du virus de CRISPR
NOTE: clones de séquence en utilisant les étapes suivantes pour tester la production de cassures double-brin réparés par NHEJ en utilisant les cellules Neuro2A de la souris. Ceci présente l'avantage par rapport aux dosages d'arpenteur en ce qu 'il peut être utilisé pour déterminer le pourcentage de cellules qui ont été modifiées ainsi que la naturedes indels résultant de NHEJ.
- Manteau de 3,5 cm de boîte de culture cellulaire avec un mélange de protéines gélatineux tels que matrigel dilué à 1:50 dans milieu de Dulbecco modifié par Iscove et incuber pendant 30 min à 37 ° C. Aspirer le mélange de protéines et de la plaque gélatineuse les cellules Neuro2A.
- Après que les cellules Neuro2A atteignent 50% de confluence, ajouter le CRISPR lentivirus ou retrovirus à une multiplicité d'infection de 10 (soit 10 particules virales par cellule).
NOTE: les cellules Neuro2A ne sont pas aussi aimable à l'infection sont des cellules HEK293, par conséquent, une seule infection ne sera pas le résultat dans 100% des cellules infectées par le lentivirus. En outre, le retrovirus infecte seulement la division des cellules et donc également pas conduire à 100% d'infection. Afin d'atteindre un taux proche de 100% de l'infection, l'addition du virus peut être répété sur plusieurs jours, le fractionnement des cellules selon les besoins. Alternativement, les cellules positives fluorescentes peuvent être isolées en utilisant la fluorescence de cellules activées par le tri. the moyen le plus efficace pour atteindre un taux d'infection de 100% avec un lentivirus est d'effectuer une seule infection suivie par FACS isolement. Pour un retrovirus, effectuer 4-tours d'infection 24 heures d'intervalle et suivre par FACS isolement pour assurer 100% d'infection. - Après l'infection des cellules pour 1 semaine, développez les cellules à confluence sur une plaque de 10 cm, aspirez les médias, et laver la plaque avec 5 ml de solution saline tamponnée au phosphate. Ajouter 1 ml de trypsine à 0,25% et on incube à 37 ° C jusqu'à ce que les cellules se soulèvent la plaque. Ajouter 0,5 ml de milieu de Dulbecco modifié par Iscove pour neutraliser la réaction de trypsine à 0,25% et une pipette les cellules dans un tube de 1,5 ml et culot les cellules à 500 xg pendant 5 min.
- Pour isoler l'ADN, ajouter 100 pi de mM d'hydroxyde de potassium 50, remettre en suspension les cellules, et incuber à 95 ° C pendant 5 min. Neutraliser la solution en utilisant 10 pi de Tris 1 M, pH = 8,0.
- Amplifier par PCR la région flanquant la région génomique ciblée par le CRISPR ARNsgen utilisant ~ 300 ng de l'ADN isolé à l' étape 5.5 en utilisant une PCR haute fidélité master mix 4.
- Exécuter la réaction de PCR sur un gel d'agarose à 2,5% et un gel de purifier le fragment de taille appropriée en utilisant un kit de purification de gel tel qu'un kit de récupération d'ADN sur gel. Ligaturer dans un vecteur de clonage par PCR tel que pGEM-T-easy et se transforment en cellules compétentes 9.
- 24 heures plus tard, ajouter 2 ml de bouillon LB dans un 15 ml tubes à fond rond, ainsi que l'antibiotique approprié (ampicilline, la néomycine, etc.). Inoculer le tube avec une colonie individuelle en utilisant une pointe de pipette ou une boucle stérile pour sélectionner une seule colonie de la LB-plaque. Développer et faire croître la colonie en secouant le tube à 250 RPM et 37 ° C pendant 24 heures. Répétez l'opération pour autant de colonies que désiré.
- Utilisant un kit de mini-préparation, d' isoler l' ADN à partir de E. coli et une séquence avec des amorces conçues pour amplifier la région du gène ciblé par l'ARN sg afin d'analyser la région cas9 ciblée du génome de la souris.
6. Protocole d'injection stéréotaxique pour la souris adulte
- Préparez-vous pour la chirurgie
NOTE: Il est important de maintenir des conditions stériles pendant les chirurgies de survie. Ceci est accompli dans ce protocole par la chaleur de stérilisation des instruments chirurgicaux, en utilisant la bétadine pour stériliser le site d'injection, et l'ajout d'une pommade antibiotique au site d'incision après sa fermeture. Il est également important d'utiliser des gants stériles, ainsi que, une zone de chirurgie dédié soigneusement stérilisés.- des outils de chirurgie Stériliser de chaleur avant l'utilisation soit par autoclavage ou une perle chaude à l'aide stérilisateur. Préparer chambre de récupération et la surface de la chirurgie en tournant sur un coussin chauffant pour maintenir la température du corps pendant l'intervention chirurgicale et la récupération. Assembler le foret utilisé pour créer des trous dans le crâne pour injection.
- Charge 4 ul de virus dans l'aiguille d'injection en retirant le virus directement à partir du tube stérile PCR. Retirez brièvement la partie aliquote virale de la glace. Maintenir le virusdans la seringue à température ambiante pendant au plus 1 h avant l'injection.
7. stéréotaxique Injection
- Vérifiez que la ventilation à la suite de la chirurgie est ouverte pour assurer l'écoulement de l'air. Préparer la souris pour la chirurgie en anesthésiant avec 4% d'isoflurane dans une chambre d'induction. Après l'anesthésie, de se raser la tête pour préparer le site d'injection.
- Placez la souris dans l'instrument stéréotaxique en utilisant des pinces pour déplacer la langue vers le bas et sur le côté. Insérez la barre de morsure dans la bouche jusqu'à ce que les dents tombent dans la fente, puis fixez les barres d'oreilles. Assurez-vous que le corps de la souris est sur le coussin chauffant et le nez est situé dans le cône de nez. Direct 4% d'isoflurane dans le cône de nez. Confirmer l'anesthésie en pinçant le pied avec des pincettes et en assurant qu'il n'y a pas de sursaut réflexe.
- Appliquer des larmes artificielles pour lubrifier les yeux. Terminer la préparation du site d'injection en tamponnant la tête rasée avec des tours alternés de povIdone l'iode et de la lidocaïne.
- L'utilisation d'un scalpel, couper petite incision le long centre du cuir chevelu. Sécher le crâne avec un écouvillon et de peroxyde d'hydrogène si nécessaire pour aider à visualiser bregma.
- L'utilisation d'un champ de dissection, localiser bregma sur le crâne et placez la pointe du foret sur bregma. Zéro (ou enregistrement) les coordonnées numériques stéréotaxiques sur les x, y et z des avions.
- Afin de veiller à ce que la tête est de niveau sur le rostrale à caudale y-axe, placez le foret sur lambda et le niveau de la tête de sorte que la coordonnée z est à peu près égale à la fois bregma et lambda.
- Afin d'assurer que la tête est au niveau de l'axe x, placer le trépan à y = 1/2 lambda. Assurez-vous que la coordonnée z est égale à 1 mm de chaque côté (x = +/- 1 mm) de la suture sagittale. Ajustez le crâne s'il y a une différence dans la coordonnée z à 1mm à gauche et à droite de lambda.
- Placez le foret sur les coordonnées souhaitées. Pour le gyrus denté, utilisez les coordonnéessy = -1.9 de bregma et x = +/- 1.1. Avant de percer, abaisser le isoflurane à 2%, puis lentement et avec précaution, percer à travers le crâne.
- Après avoir percé tous les trous, fixer la seringue remplie sur l'instrument stéréotaxique. Centrer visuellement la seringue sur le trou et zéro la coordonnée z le crâne.
- Abaissez lentement la seringue au plus profond z profondeur. Pour le gyrus denté, les profondeurs z sont -2.5, -2.4 et -2.3. Commencer l'injection à un débit de 0,25 ul / min à l'aide d'un injecteur stéréotaxique.
- Après l'injection est terminée au plus bas Z-profondeur, attendre 1 min, puis soulevez à la prochaine coordonner et recommencer injection. Continuez ainsi jusqu'à ce que toutes les coordonnées z-injection sont injectés. Attendre 2 min avant de retirer la seringue après la dernière injection.
NOTE: Aucun effet indésirable n'a été noté sur le tissu en injectant jusqu'à 2 pi de virus par hémisphère dans le cerveau de la souris.
- Après l'injection est terminée au plus bas Z-profondeur, attendre 1 min, puis soulevez à la prochaine coordonner et recommencer injection. Continuez ainsi jusqu'à ce que toutes les coordonnées z-injection sont injectés. Attendre 2 min avant de retirer la seringue après la dernière injection.
- Répéter l'injection pour d'autres trous de forage.
- Après l'injection, retirez la souris de l'instrument stéréotaxique et suturer le cuir chevelu avec 6-0 sutures de soie. Appliquer Lidocaine et une crème anti-bactérienne à la plaie.
- Injecter 0,8-1,0 ml de solution saline + kétoprofène (3-5 mg / kg) par voie IP pour gérer la douleur. Ensuite, placez la souris dans la chambre de récupération chauffée. Ne pas laisser l'animal sans surveillance jusqu'à ce qu'il ait repris connaissance suffisante pour maintenir décubitus sternale. Ne pas retourner l'animal à la compagnie d'autres animaux jusqu'à ce qu'il ait complètement récupéré.
- Dans les jours suivant la chirurgie, peser la souris quotidienne et de fournir des aliments mous et des friandises. Vérifiez la plaie et noter l'état général / comportement.
- Après l' injection stéréotaxique, la souris peut être euthanasié pour une tranche de préparation électrophysiologie 1 ou perfusé et leur cerveau enlevé, en tranches, et colorées par immunohistochimie pour l' analyse 10.
Résultats
Après le «Protocole pour la conception d' un guide de volet (ARN sg) pour CRISPR / cas9 Retrovirus" oligos ciblant une séquence particulière sont insérés dans le vecteur PXL de clonage en aval du promoteur de hU6 et en aval d'un échafaudage d'ARN de guidage en utilisant les sites de clonage Bbsl (figure 1, étape 1). Cette ARNsg est ensuite excisé de PXL et inséré dans le squelette pRubi utilisant les sites BstBI et PacI (Figure 1, étape 2). Enfin, un autre ARNsg cloné dans PXL peut être placé en aval du premier guide en pRubi-Guide1 (Figure 1, étape 3), en ciblant une autre zone du gène et d' augmenter les chances d'un knock - out via NHEJ. Vérification des constructions correctes doit être déterminée par une analyse de séquence. Une fois que cette construction est faite, elle peut être conditionnée dans un virus qui suit le «Protocole pour Retro / Lentiviral Production- CaPO4 Méthode". l'emballage est alors confirmée par une infection du virus dans les cellules HEK293, afin de titrer le virus. S'il n'y a pas d'expression fluorophore puis il y a probablement une erreur lors de l'emballage du virus.
La figure 2 est un résultat représentatif de 2 retrovirus, exprimant une GFP , et l'autre exprimant mCherry, co-injecté dans le gyrus denté de souris néonatale (7 jours-old) et imagée 21 jours après l'injection. Étiquetage des neurones avec mCherry ou GFP permet une évaluation morphologique des diverses manipulations génétiques dans le même tissu, où l'on peut exprimer un virus CRISPR / cas9 médiation KO et l'autre un virus témoin exprimant uniquement un fluorophore. injection stéréotaxique permet une sélectivité anatomique précise comme démontré par l'infection discrète des coordonnées prévues, le gyrus denté. Lors de l'analyse des coupes de cerveau à l'infection, il est important de maintenir le tissu environnant jusqu'à ce qu'il soit déterminé que la région anatomique correcte a été infecté. S'il n'y a aucun signe d'infection, alors il est possible que l'injection a eu lieu dans une région voisine d'und peut être identifié dans les sections voisines. Il peut également être utile pour localiser la piste de l'aiguille pour trouver la région d'injection exacte. Virus pseudotypés VSVG rarement répartis sur les marges du gyrus denté lorsqu'il est injecté in vivo, et ont tendance à se propager sur les cellules de l' axe infectant rostrales / caudale le long de la totalité de gyrus denté, analysé par la reconstruction 3D (Figure 3).
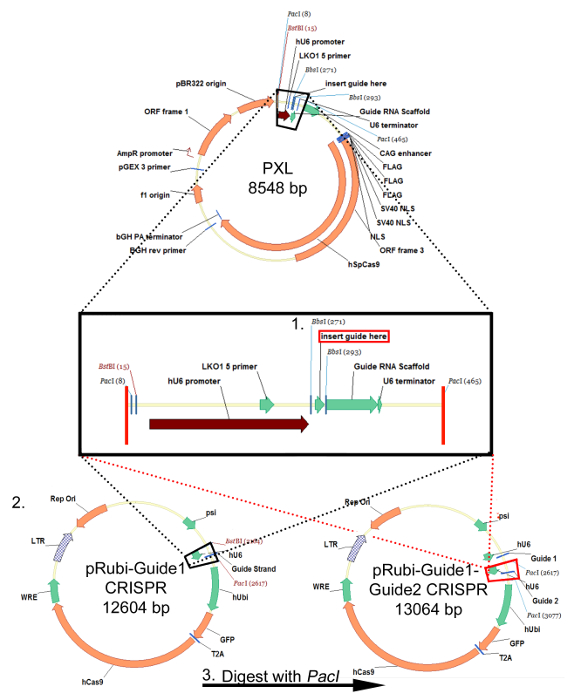
Figure 1:. Stratégie de clonage du plasmide pRubi-Guide1-Guide2-rétroviral Cette stratégie CRISPR est identique pour les plasmides à base lentiviraux-FU. oligos annelés et ARNsg sont insérés dans PXL en utilisant les sites de clonage BsbI. Après séquençage pour garantir que l'ARN sg est inséré avec succès dans PXL, digérer le plasmide par BstBI et Pacl. L'insert qui est abandonné (boîte noire) est ensuite cloné dans le b retour viraleun (noir pointillés) pRubi-Guide1 CRISPR. Un deuxième ARNsg peut également être inséré dans PXL et digéré à l' aide de l'enzyme Pacl. Il est ensuite cloné dans le vecteur CRISPR pRubi-Guide1 (rouge pointillé) en utilisant le site Pacl. Le plasmide résultant contient alors les deux brins de guidage, ainsi que les éléments viraux nécessaires, les promoteurs, et fluorophores. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
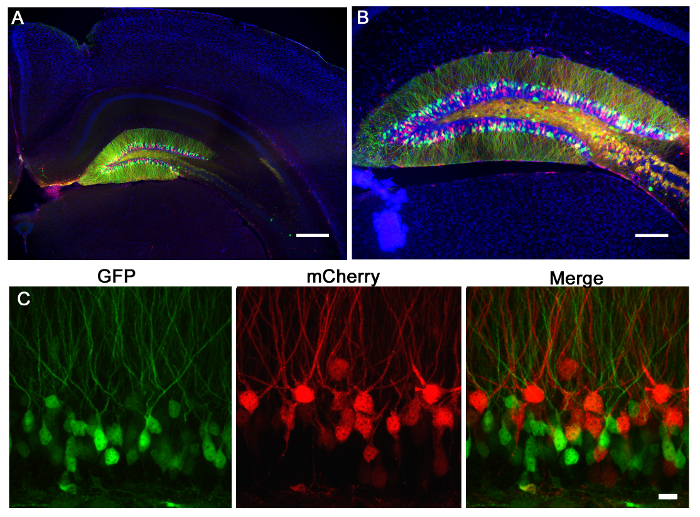
Figure 2:. Injection rétrovirale du gyrus denté de souris retrovirus exprimant mCherry (rouge) ou GFP (vert) ont été injectés dans le gyrus denté de souris p7. 21 jours plus tard, les souris ont été perfusées et les cerveaux sectionnés et colorés pour la GFP et mCherry. (A) Un grand champ image fluorescente 5X montre la prECISION de l'injection du corps godronné et la spécificité des neurones granulaires du gyrus denté étiquetage. La morphologie de l'hippocampe peut être vu par l'intermédiaire du Dapi (bleu) coloration. Barre d'échelle mesure 200 um. (B) Une image fluorescente 10X grand champ montre que ces lentivirus haute titer infectent un grand nombre de cellules dont la morphologie est accessible via l' expression de fluorophore. Barre d'échelle mesure 100 um. (C) Les virus exprimant la GFP ou mCherry ont été co-injectées dans le corps godronné. En utilisant un système de retrovirus, on peut utiliser un virus pour faire une manipulation génétique marquée par la GFP et une autre manipulation marquée par mCherry, puis évaluer les changements simples ou additifs en raison de chaque virus. Barre d'échelle mesure 10 um.
Figure 3:. Propagation Anatomical d'injection lentiviral coinjection stéréotaxique d'un virus GFP shPten et un virus témoin mCherry dans le cerveau d'un adulte PTEN loxP / + souris a entraîné une propagation virale sur la totalité rostrale / axe caudale du corps godronné de l'hippocampe. Ceci est illustré dans une reconstruction 3D de l'ampleur de l'injection dans laquelle contours fermés de la propagation virale ont été retrouvés plus de 21 sections de série (Z = 50 um / section) en utilisant un logiciel de reconstruction. Les tracés de contours sont ensuite alignés pour générer les images 3D pour le volume de quantification. Propagation virale totale est représenté en vert (volume = 54730800 pm 3) et la propagation dentelé localisée est représentée en violet (volume = 27275200 pm 3). Le virus se propage le long de la piste de l'aiguille et le corps calleux à l'intersection de la piste de l'aiguille, en plus de remplir l'axe rostrale / caudale du gyrus denté. Barre d'échelle mesure 200 um.
les / ftp_upload / 53783 / 53783video1frame.jpg "/>
Supplemental Vidéo 1. Conception de sgRNAs pour cloner en squelette rétroviral et lentiviral.
Dans cet ARN guide synthétique (ARNsg) Exemple de conception, la séquence génomique de la souris CHD8 est téléchargé à partir du NCBI. Le codon d'initiation et de la structure de l'exon sont ensuite visualisées dans Vector NTI. Cela nous permet de copier la région génomique autour du premier exon codant et entrons dans cette séquence dans Benchling. Benchling nous permet de visualiser tous les sgRNAs potentiels dans la région. En outre, après avoir indiqué la région génomique nous avons entrée, Benchling va nous montrer les scores sur cible et hors-cible pour chaque ARN guide. L'utilisateur peut alors sélectionner l'ARN guide avec les meilleurs scores en ligne et hors-cible. S'il vous plaît cliquez ici pour voir cette vidéo. (Faites un clic droit pour télécharger.)
Discussion
Il y a quelques étapes essentielles qui sont importantes pour l'emballage viral réussie. la santé cellulaire est essentiel avant et pendant la transfection, comme des cellules malsaines permettra de réduire considérablement la quantité de virus produite. Si la transfection et l'emballage sont couronnées de succès, puis 100% des cellules doit exprimer le fluorophore et les cellules doivent former un syncytium fonctionnel. Dans l'étape 3.2.4, tapotant le tube est nécessaire pour titre élevé transfection efficace, et le pH de la solution saline tamponnée HEPES doit être exacte. Les maxi-préparations qui produisent les plasmides nécessaires pour l'emballage virale doivent être extrêmement pure. À ce point, il est utile d'éthanol précipiter l'élution finale d'ADN et remettre en suspension dans un tampon Tris-EDTA. Il est également très important de réduire la quantité de sérum à 2% ou moins dans les médias que la caféine est ajoutée à la Journée 6 (étape 3.4) avant la collecte virale. Si le sérum ne soit pas réduite, puis le virus purifié finale contiendra une quantité indésirable de prot sériqueein. L'utilisation de polyéthylène glycol 6000 lorsque précipitant les particules virales exclut la nécessité d'ultracentrifugation. Il est également important de noter que les virus contenant cas9 CRISPR ont généralement un titre d'environ 10 fois moins de virus contenant uniquement un fluorophore.
Pour la chirurgie stéréotaxique, l'utilisation de l'anesthésie par inhalation permet un contrôle rapide et précis ou la conscience de l'animal par rapport aux anesthésiques injectables et permet une anesthésie sur une plus grande tranche d'âge. Il est très important de garder les instruments chirurgicaux propres et stériles, et le ciblage reproductible nécessite un positionnement précis de la tête. Assurez-vous qu'il n'y a pas de tangage ou de roulis de la tête dans l'instrument stéréotaxique et que le crâne se sent bien en place. Il peut être utile pour permettre le crâne de sécher afin de trouver les points de suture pour déterminer les coordonnées stéréotaxiques. En outre, le débit et le volume pour chaque stéréotaxique coordonner devraient être déterminées empiriquement.
Cette technique est limite en ce que la propagation d'un lenti- ou retrovirus est limitée, surtout lorsqu'on les compare à des virus adéno-associés (AAV) .Par conséquent, ces virus sont utiles lorsqu'il infecte une région du cerveau discrète, mais pas pour l'infection globale associée à AAV utilisé pour l'analyse du comportement chez les animaux. L'utilisation de la caféine dans ce protocole augmente considérablement le titre de ces virus, mais ils ne sont toujours pas aussi élevé que les titres obtenus dans un emballage de AAV. En outre, l'intégration stable est seulement un avantage de l'expression du fluorophore, comme CRISPR / cas9 forme des modifications génomiques stables même lorsque transfectées de manière transitoire et il est possible que l'expression continue de l'ARN sg cas9 et peut éventuellement produire des effets hors cible. L'expression transitoire du système CRISPR / cas9 avec AAV est suffisante pour produire des changements génomiques qui se propagent à travers les divisions cellulaires, cependant, l'expression de fluorophore ne sera pas maintenue.
Création de lenet ti- retrovirus utilisant le système CRISPR / cas9 vont conférer la capacité de cibler n'importe quel gène nouveau dans une grande variété d'organismes. L'efficacité de la modification génétique semble être dépendante de la séquence de l'ARN guide ciblant le clivage cas9. Il a été déterminé de manière empirique, entre 10% et 80% des clones contiennent indels après séquençage des cellules infectées Neuro2A. Il est actuellement impossible de savoir si les fréquences indel calculées dans les cellules Neuro2A reflètent ceux dans les neurones. Guide des logiciels de conception d'ARN tels que Benchling incluent maintenant un score "sur cible" qui peut être en mesure de prédire l'efficacité d'une séquence cible donnée. Dans quelle mesure ces scores "sur-cible» sont des besoins fiables pour être déterminées empiriquement dans les neurones et d'autres types de cellules que le système CRISPR-cas9 devient plus largement mis en œuvre.
la production d'animaux transgéniques à base de lentivirus a été variablement réussie avec les rapports que les transgènes de lentivirus livré deviennent silenced 11. CRISPR édition de gène à médiation par de l'ADN peut être passé à travers la lignée germinale pour générer des modèles animaux entiers. Ainsi, l'édition génomique stable peut être réalisable malgré le silence des fluorophores viraux-rendu et transgènes cas9. Cela peut fournir une plate-forme efficace pour les modifications génomiques ciblées. La livraison virale du système / cas9 CRISPR, tout en ne nécessitant des organismes transgéniques, est complémentaire à ces techniques. Par exemple, l'injection de ces particules virales dans un animal transgénique composé qui exprime inductible Cre et Cre opto dépendante ou chimio-génétique transgènes devrait faciliter les études complexes dans la relation entre les manipulations génétiques et l'activité neuronale. Un second exemple est de livrer ces particules virales cas9 / ARNsg dans un knock-out conditionnel dans une tentative pour dépister les interactions gène-gène. Enfin, une autre voie passionnante de cette recherche est la projection des phénotypes et des composés thérapeutiques dans les cellules dérivées patient, qui peutêtre utilisé pour valider et découvrir les réseaux génétiques qui sont perturbés dans diverses maladies.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par le NINH accorder R01MH097949 et Autism Speaks pilote Grant 7359 à BWL et le Norris Cotton Cancer Center Imaging Optical Shared Instrumentation Grant P30CA023108.
matériels
| Name | Company | Catalog Number | Comments |
| List of Cell Culture Reagents | |||
| 293FT cell line | Life Technologies | R700-07 | For Lentivirus |
| 293GP cell line | Clontech | 631458 | For Retrovirus |
| Iscove's Modification of DMEM (IMDM) | Corning | 10-016-CV | Complete IMDM with 10% FBS, 1% NEAA, 1% L-Gln, and 1% P/S |
| Fetal Bovine Serum (FBS) | Corning | 35-011-CV | |
| MEM Nonessential Amino Acids (NEAA) | Corning | 25-025-CI | |
| L-Glutamine solution, 100x (L-Gln) | Corning | 25-005-CI | |
| Pennicillin/Streptomycin solution, 100x (P/S) | Corning | 30-002-CI | |
| Polystyrene 10 cm plate | USA Scientific | CC7682-3394 | |
| Trypsin EDTA 1x | Corning | 25-053-CI | |
| List of Transfection Reagents | |||
| 5 ml polystyrene tubes | Fisher Scientific | 352054 | |
| Calcium Chloride Dihydrate (CaCl2) | Fisher Scientific | C69-500 | Make a 2.5 M solution in ddH2O |
| Sodium Chloride (NaCl) | Fisher Scientific | S271-3 | |
| HEPES | Fisher Scientific | BP2939-100 | |
| Sodium phosphate dibasic (Na2HPO4) | Fisher Scientific | S369-500 | |
| 2x HEPES Buffered Saline (HBS) | 500 ml: 8.2 g NaCl, 5.95 g HEPES, 0.106 g Na2HPO4, pH 7.01 (exact!) | ||
| Caffeine | Sigma-Aldrich | C0750-5G | |
| 0.22 µM syringe filter unit | EMD Millipore | SLGV033RS | |
| 0.45 µM syringe filter unit | EMD Millipore | SLHP033RS | |
| 60 cc L/L Syringe | Med-Vet International | MV60CCLL | |
| 50 ml Conical Tube | Corning | 352098 | |
| polyethylene glycol 6000 (PEG 6000) | Millipore | 528877 | |
| (10x) Phosphate Buffered Saline (PBS) | National Diagnostics | CL-253 | |
| 0.5 ml microcentrifuge tubes | USA Scientific | 1605-0000 | |
| Matrigel | Fisher Scientific | CB-40230A | |
| 6-well plate | Fisher Scientific | 353046 | |
| Paraformaldehyde | Fisher Scientific | AC41678-5000 | |
| Donor Horse Serum | Cellgro | 35-030-CV | |
| TritonX-100 | Sigma-Aldrich | X100-500ML | |
| 10 ml serological pipette | Fisher Scientific | 357551 | |
| anti-GFP, rabbit, 488 conjugate | Invitrogen | A21311 | |
| Stereotaxic Surgery Reagents | |||
| Vet-Syringe vet use T.B. Syringe only 1 cc Luer slip T.B. 100/bx | Med-Vet International | 1CCVLS | |
| Isoflurane | |||
| Stainless Steel Scalpel Blades, #10, 100-pk | Med-Vet International | JOR580S | |
| artificial tear ointment | Med-Vet International | RXPARALUBE-O | |
| PVP PrepSolution | Med-Vet International | HPIV108208H | |
| normal saline | Med-Vet International | DYND500MLSH | |
| cotton tipped applicators | Med-Vet International | CTA6 | |
| Triple antibiotic ointment | Med-Vet International | RXTRIP-OI15 | |
| MONOJECT® Needles Soft Pack 25 g x 5/8" | Med-Vet International | 25058 | |
| 6-0 silk sutures | Med-Vet International | MV-711 | |
Références
- Williams, M. R., DeSpenza, T., Li, M., Gulledge, A. T., Luikart, B. W. Hyperactivity of newborn Pten knock-out neurons results from increased excitatory synaptic drive. J Neurosci. 35 (3), 943-959 (2015).
- Luikart, B. W., et al. Pten knockdown in vivo increases excitatory drive onto dentate granule cells. J Neurosci. 31 (11), 4345-4354 (2011).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339 (6121), 819-823 (2013).
- Ran, F. A., et al. Genome engineering using the CRISPR-Cas9 system. Nat Protoc. 8 (11), 2281-2308 (2013).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat Biotechnol. 32 (4), 347-355 (2014).
- Luikart, B. W., et al. miR-132 mediates the integration of newborn neurons into the adult dentate gyrus. PLoS One. 6 (5), e19077 (2011).
- Nasri, M., Karimi, A., Allahbakhshian Farsani, M. Production, purification and titration of a lentivirus-based vector for gene delivery purposes. Cytotechnology. 66 (6), 1031-1038 (2014).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Fricano, C. J., et al. Fatty acids increase neuronal hypertrophy of Pten knockdown neurons. Front Mol Neurosci. 7, 30 (2014).
- Park, F. Lentiviral vectors: are they the future of animal transgenesis?. Physiol Genomics. 31 (2), 159-173 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon