Method Article
גישה פשוטה ויעילה לבנות וקטורי וירוס Vaccinia Mutant
* These authors contributed equally
In This Article
Summary
וירוס Vaccinia (VV) כבר בשימוש נרחב במחקר ביו ושיפור בריאות האדם. מאמר זה מתאר שיטה פשוטה ויעילה, מאוד לערוך את הגנום VV באמצעות מערכת CRISPR-Cas9.
Abstract
The CRISPR-associated endonuclease Cas9 can edit particular genomic loci directed by a single guide RNA (gRNA). The CRISPR/Cas9 system has been successfully employed for editing genomes of various organisms. Here we describe a protocol for editing the vaccinia virus (VV) genome in the cytoplasm of VV-infected CV-1 cells using the RNA-guided Cas9. RNA-guided Cas9 induces double-stranded DNA breaks facilitating homologous recombination efficiently and specifically in the targeted site of VV and a transgene can be incorporated into these sites by homologous recombination. By using a site-specific homologous vector with transgene(s), a N1L gene-deleted VV with the red fluorescence protein (RFP) gene incorporated in this region was generated with a successful recombination efficiency 10 times greater than that obtained from the conventional homologous recombination method. This protocol demonstrates successful use of RNA-guided Cas9 system to generate mutant VVs with enhanced efficiency.
Introduction
וירוס Vaccinia (VV) הוא וירוס DNA עטוף השייכת למשפחת poxvirus ו מילאה תפקיד מכריע אחד ההישגים הגדולים ביותר ברפואה של מיגור האבעבועות השחורות. בעידן-מיגור הפוסט של אבעבועות שחורות, VV פותח כוקטור להעברת גנים עבור חיסונים נגד האיידס ומחלות זיהומיות אחרות 1-7 על ידי החדרת גנים של פתוגנים שונים לתוך וקטורי VV. VV גם נעשה שימוש נרחב כווקטור עבור חיסוני סרטן 8-14 במיוחד לפיתוח של שכפול וירוס vaccinia oncolytic במיקוד הגידול. על מנת ליצור וקטור חיסון יעיל עם סלקטיביות משופרת עבור תאים סרטניים, שינויים בתוך הגנום הויראלי נדרשים, כולל מחיקות הגן או הקדמה של גנים טיפוליים.
עם התפתחות טכנולוגיית ה- DNA והבנה טובה יותר של הביולוגיה המולקולרית וירולוגיה, החדרת דנ"א זר לתוך VV היה במקור להשיגד באמצעות רקומבינציה הומולוגי (HR) בשנת 1980 15. שיטה זו היא עדיין בשימוש נרחב לבניית וקטורי VV. מבוא של ההנדסה הגנטית מושג באמצעות וקטור הסעות עבור HR, אשר משלב מחדש עם הגנום VV בתאים טרום נגוע. עם זאת, שיטה זו הוכיחה להיות יעיל מאוד (פחות מ -1% הומולוגיים יעיל 16) ולעתים קרובות תוצאה היא כניסה אקראית של סמן מבחר לאזורים הלא ממוקד ו / או אובדן של הסמן על הרחבת וירוס.
היעילות של הומולוגיים DNA להוספת DNA אקסוגני על לוקוסים הגנומי ניתן לשפר באופן דרמטי בנוכחות הפסקות פעמיים גדיל (DSBs) 17. לכן, הטכנולוגיה שיכול לגרום DSBs ב לוקוסי היעד בעל פוטנציאל גדול עבור הנדסת הגנום של VV.
המערכת שפותחה לאחרונה CRISPR-Cas9 נראית מבטיחה עבור מפעילת DSBs בכל אזור גן VV. CRISPR-Cas9 הוא RNA-nuclease מודרך המעורבים חסינות אדפטיבית נגד פאגים הפולשים חומרים גנטיים זרים אחרים 18-20. ישנן שלוש מערכות CRISPR-קאש במגוון מינים של חיידקים 21. מערכת מסוג II CRISPR-קאש נעשה שימוש נרחב עבור עריכת הגנום של תאים איקריוטיים ווירוסים גדול. זה מורכב של endonuclease Cas9 מודרך-RNA (מ סטרפטוקוקוס pyogenes) חברה RNA מדריך יחיד (sgRNA) ואת טרנס-הפעלת crRNA (tracrRNA) 22-24. המתחם Cas9 / sgRNA מזהה את רצף הגנום של 20 נוקליאוטידים משלימים שקדמו מוטיב הסמוך 5'-NGG-3 'Protospacer (PAM) רצף בתאי יונקים 22, 23. זה כבר נעשה שימוש בהצלחה לייצור יעיל של תאים מהונדסים גנטית, וירוסים ומודלים של בעלי חיים 22-32.
מערכת CRISPR-Cas9 הוכיחה להיות כלי יעיל עבור הגנום מיקוד בשילוב עם הומולוגיים בציטופלסמה של VV נגוע תא CV-1ים כדי לייצר וירוסים vaccinia מוטציה 33, 34. על מנת להאריך את התחולה הפוטנציאלית של שיטה זו, אנו מציגים מידע מפורט על המתודולוגיה של מערכת זו. הפרוטוקול המתואר יכול לשמש כדי ליצור VV מוטציה עם מחיקת גן מסוימת ו / או לחמש את נגיף המוטציה עם transgene טיפולית.
Protocol
1. הכנת היעד רנ"א Cas9 בונה וקטור תורם תיקון
- שיבוט של gRNAs
- עיצוב רצף יעד המדריך-RNA מיקוד גן N1L של וירוס vaccinia בעקבות העיקרון כאמור 25. יישר את רצף היעד מדריך-RNA נגד הגנום של הנגיף vaccinia (במקרה זה, זן ליסטר של וירוס vaccinia) כדי לשלול כל רצפי היעד gRNA מחוץ היעד.
- לסנתז ולשכפל oligos gRNA לתוך וקטור שיבוט gRNA כפי שתואר לעיל 25. אשר את הרצף של כל gRNA בודד הווקטור שהתקבל על ידי סנגרתי רצף 33. שם שהתקבל gRNA לבנות כמו gRNA N2 33.
הערה: מטרת אתר gRNA הוא בתוך גן N1L, והוא באיזור שבין הזרוע הימנית ושמאלית הזרוע כי מכסה וקטור תורם תיקון (ראה איור 1).
- לשבט את גן Cas9 חסר אות הלוקליזציה הגרעינית (NLS) לתוךpST1374 וקטור לייעד את המבנה כמו PST-Cas9 33.
הערה: כל וקטור שיבוט ביטוי יונק יכול לשמש לבניית וקטור ביטוי Cas9. - בניית וקטור תורם תיקון עבור HR
- השתמש גן N1L של VV כפי לאזור המיקוד של שינוי 33. ודא כי האורכים של הזרועות על ימין ועל שמאל הם כ 500-600 נ"ב כל, ומשני צדיה של אזור היעד.
הערה: זרוע הזרוע / שמאל ימין יכולה להכיל עד 50 חפיפה נ"ב עם אזור היעד (ראה איור 1). - Clone וקטור תורם התיקון באזור N1L כפי שתואר לעיל 33, 34 ו לייעד וקטור תורם התיקון כמו PT-N1L.
הערה: ראה איור 1 עבור וקטור תורם תיקון ובאזור היעד שלה. אזורים אחרים של VV עשויים להיות ממוקדים באמצעות באזור (גנים) -specific gRNA (הים) ו וקטור תורם תיקון ספציפי לאזור. כל וקטור שיבוט יכול לשמש לבניית וקטור תורם תיקון. - הרחבת פלסמיד
- להפוך את הפלסמיד לתוך כימית מוסמכות E. coli פי הוראות היצרן. לטהר את הפלסמיד באמצעות ערכת חילוץ פלסמיד בהתייחסו פרוטוקול המסופק על ידי היצרן.
2. תאים מתזמנים (יום 1)
- שמור על תאים CV-1 (פיברובלסטים כליות קוף) ב בינוני של הנשר שונה של Dulbecco (DMEM) בתוספת 5% בסרום שור העובר (FBS), 100 פניצילין U / mL, ו- 100 מיקרוגרם / סטרפטומיצין מ"ל, ב 37 מעלות צלזיוס עם 5% CO 2.
- Trypsinize CV-1 תאים הנמצאים 80-90% ומחוברות
- הסר את מדיום תרבית תאים מבקבוק T-175 המכיל תאי CV-1. שוטפים את monolayer עם 5 מ"ל של PBS סטרילי כדי להסיר בסרום שיורית לשאוב PBS. להוסיף 2.5 מ"ל 1 × פתרון טריפסין-EDTA כדי לכסות את התאים ומניחים את הבקבוק ב -37 חממה מעלות צלזיוס למשך כ 5 דקות כדי לסייע ניתוק התא.
- לְהוֹסִיף10 מ"ל של מדיום תרבית תאים (ראה שלב 2.1) להשעות את התאים על ידי פעולה פיפטה בעדינות. ספירת המספרים הסלולרי באמצעות hemocytometer.
- זריעת תאים 6 צלחות היטב
- Seed 2 × 10 5 CV-1 התאים 2 מ"ל של מדיום תרבית תאים לתוך הבאר כל צלחת 6-גם יום לפני transfection.
הערה: צעד צנטריפוגה נוסף כדי להסיר טריפסין אינה נדרשת.
- Seed 2 × 10 5 CV-1 התאים 2 מ"ל של מדיום תרבית תאים לתוך הבאר כל צלחת 6-גם יום לפני transfection.
3. Transfection של Cas9 פלסמיד ו gRNA פלסמיד (יום 2)
- Transfect CV-1 תאים (מוכן בשלב 2.2.3.1) עם 0.5 מיקרוגרם PST-Cas9 פלסמיד ו 0.5 מיקרוגרם פלסמיד gRNA N2 באמצעות מגיב transfection פי הוראות היצרן.
- דגירה התאים למשך 24 שעות באינקובטור (37 ° C עם 5% CO 2), ולאחר מכן להחליף את מדיום עם 2 מ"ל של מדיום תרבית תאים טרי (כמתואר בשלב 2.1).
4. זיהום של CV-1 תאים ו- V תורם ההסעותEctor Transfection עבור HR (יום 3)
- לדלל את הנגיף עמוד השדרה VVL15 עם תרבית תאים בינוניים DMEM לריכוז של 2 × 10 5 pfu / מ"ל. 24 שעות לאחר transfection של פלסמידים Cas9 ו gRNA, להוסיף 100 μL של הנגיף בדילול לבאר כל התאים CV-1 transfected.
- 2 h זיהום פוסט-וירוס, transfect וקטור התורם הסעות 1.0 מיקרוגרם לתוך התאים שנדבקו VVL15 עבור HR באמצעות מגיב transfection בהתאם להוראות היצרן. מניחים את התאים transfected בתוך 37 ° C חממה עם 5% CO 2 למשך 24 שעות.
5. קציר וירוס רקומביננטי (יום 4)
- לאחר 24 שעות של transfection עם וקטור תורם הסעות עבור HR בשלב 4.2, לנתק את תאי CV-1 transfected באמצעות מגרד תא. אסוף את ההשעיה התא לתוך cryovial ולאחסן ב -80 ° C לשימוש עתידי.
הערה: לקנח כל שפיכת תרבית תאים בינונית עם חיטוי מייד ונגבה שוב עם 70% ethanol.
6. טיהור של VV השתנה (סיבוב ראשון)
- ביום 1, זרע 15 6 צלחות גם עם 3 × 10 5 CV-1 תאים בכל טוב.
- ביום 2, להפשיר את ההשעיה תא קפוא משלב 5.1 באמבט מים ב 37 מעלות צלזיוס במשך 3 דקות ו מערבולת cryovials במרץ למשך 30 שניות כדי להשיג lysate התא מבלי להסיר פסולת התא.
- להדבקת 6-גם צלחת אחת של תאים CV-1, לדלל 1 μL של lysate תא עם 3 מ"ל של DMEM ולהוסיף 0.5 מ"ל של lysate התא מדולל לבאר כל צלחת 6-היטב, על גבי מדיה כבר מתנה. להדביק את כל 6 הצלחות היטב מוכנות בשלב 6.1.
הערה: הסרת תאים פסולת אינו נדרש. - לאחר יומיים של זיהום (כלומר, ביום 4), לזהות הפלאק RFP חיובי תחת מיקרוסקופ פלואורסצנטי באמצעות 10X עדשה אובייקטיבי לתייג את הפלאק מתחת לצלחת באמצעות עט סימון על ידי מקיפים את מיקום פלאק.
הערה: ראה איור 3 עבור לוחית RFP חיובי נציג.- הכן שישה cryovials שכותרתו המכיל 200 μL סרום ללא בינוני תרבית תאים DMEM להרים שישה לוחות שונים RFP חיובי. לשאוב את מדיום תרבית תאים מבאר עם לוחית שכותרתו (ים) (שלב 6.3). צרף טיפ 200 μL כדי פיפטה P200, להגדיר את עוצמת ב 30 μL ולקחת ~ 10 בינוני μL תרבית תאים מן cryovial אחד.
- החזק את לחצן לדחוף פיפטה מבלי לשחרר את המדיום ולהשתמש הקצה לשרוט את האזור של פלאק אחד שכותרתו. שחרר את לחצן פיפטה לדחוף להרים את התאים מנותקים ולהעביר אותו לתוך cryovial המכיל 190 μL של סרום ללא DMEM.
- קח עוד 10 בינוני μL מהבקבוקון עם התאים השרוטים (לאחר השלב האחרון) לחזור על התהליך של להרים אותו פלאק RFP חיובי שלוש פעמים לאסוף כמה שיותר תאים שרוטים ככל האפשר. להעביר את כל התאים לתוך באותו הבקבוקון ולאחסן את הבקבוקון ב -80 מעלות צלזיוס.
הערה: לחלופין, להקפיא את cryovials על קרח יבש במשך 10 דקות אם בסיבוב השני של טיהור מתבצע מיד.
7. טיהור של VV השתנה (סיבוב שני)
- זרע 3 × 10 5 CV-1 תאים לבאר כל שש 6 צלחות היטב בתרבות התאים למשך 24 שעות.
- להפשיר את cryovials הקפוא (משלב 6.3.3) ב 37 ° C אמבט מים במשך 3 דקות, ואז מערבולת cryovials במרץ למשך 30 שניות כדי להשיג lysate תא.
- הוסף 0.5 μL של lysate התא המעורב אחד טוב של צלחת 6 באר. להדביק צלחת 6-גם אחד לכל פלאק. דגירת צלחות VV הנגועה 6-גם על 37 מעלות צלזיוס עם 5% CO 2 על 2 ימים (טיהור פלאק סיבוב שנייה). לאחר מכן חזר בסעיף 6.3.
הערה: יותר משישה לוחות RFP חיובי ניתן לאסוף; שתיים או יותר 6 צלחות גם יכולות לשמש לניקוי של כל פלאק.
- הוסף 0.5 μL של lysate התא המעורב אחד טוב של צלחת 6 באר. להדביק צלחת 6-גם אחד לכל פלאק. דגירת צלחות VV הנגועה 6-גם על 37 מעלות צלזיוס עם 5% CO 2 על 2 ימים (טיהור פלאק סיבוב שנייה). לאחר מכן חזר בסעיף 6.3.
8. סבב נוסף של לוחית פורהfication
- Carry על שלושה עד חמישה סבבים של טיהור נוסף הבאים באותו פרוטוקול כמתואר בשלב 7 עד שכל הפלאק נוצר פלאק חיובי אחד להיראות כאילו RFP חיובי תחת מיקרוסקופ.
הערה: זה פלאק אז נחשב טהור. - לאחר פלאק הוא טהור (איור 4, כל התאים הנגועים המבטאים RFP), למסוק לוחית חיובית לתוך cryovial ולאחסן ב -80 ° C, כמתואר בסעיף 6.3. בדוק את הלוחית בעקבות הפרוטוקול המתואר בשלב 9 ו -10.
9. הרחב את לוחית מטוהרים (ים)
- זרע 3 × 10 5 CV-1 תאים לבאר כל יום 6-גם צלחת אחת לפני ההדבקה בנגיף.
- ההפשרה cryovial קפוא לעומת 8.2 באמבט מים 37 מעלות צלזיוס במשך 3 דקות כדי להשיג lysate התא. מוסיפים את כל lysate (מבלי להסיר פסולת התא) לתוך אחד טוב של צלחת 6-גם של תאים CV-1 (זורעים בשלב 9.1). דגירת תאי CV-1 הנגוע ב 37 מעלות צלזיוס עם 5CO% 2 עד 3 ימים.
- הרחב הכל הפלאק המטוהרים (לפחות שלושה לוחות).
הערה: בפעם זיהום משתנה בין 1-3 ימים, תלוי כמות הנגיף lysate.
- הרחב הכל הפלאק המטוהרים (לפחות שלושה לוחות).
- קציר תאי VV הנגוע באמצעות מגרד תא כאשר יותר מ -50 תאי% להראות השפעת cytopathic שנצפתה במיקרוסקופ (תאים מעוגלים, בקלות מנותקת RFP חיובית). אוספים את התאים מנותקים יחד עם תרבית תאים בינוניים לתוך צינור 15 מ"ל.
- גלולת התאים על ידי צנטריפוגה ב 300 גרם במשך 3 דקות. הסר את supernatant ולשמור התא גלולה ב -80 ° C עד לשימוש נוסף או להשתמש התא גלולה מיד צעד 10.
אימות 10. של שינוי של Mutant VV שימוש PCR
- חלץ VV DNA מן התא גלולה מוכן בשלב 9.3.1 באמצעות ערכת מיצוי DNA בעקבות פרוטוקול של היצרן. Elute DNA עם 200 μL של מים מזוקקים פעמיים.
הערה: משתמש מחצית מהמחזור של הגלולה לחלץ דנ"א לשמור את שאר לייצור ויראלי אם השיבוט מאומת כמכיל השינוי / ההכנסה הנכונה. - אימות של המחיקה של הגן N1L ואת החדרת הגן RFP לאזור N1L.
- להגביר קטע DNA פרש גן N1L (L025) ואת פריימרים L026 גן באמצעות תוכנן נגד גן N1L. להגביר את הגן RFP באמצעות פריימרים -specific RFP. להגביר קטע DNA שליטה פורש A52R ידי PCR באמצעות פריימרים ספציפיים A52R.
הערה: ראה רשימה של חומרי פריימרים ספציפיים.- בצעו את PCR באמצעות ערכת תערובת אמן PCR. הגדר 25 μL של תגובת PCR באמצעות 2 μL של תבנית ה- DNA, לפגל את תגובת PCR ב 94 מעלות צלזיוס למשך 2 דקות, ולאחר מכן להפעיל 30 מחזורים של PCR ביצוע השלבים הבאים: לפגל את ה- DNA ב 94 מעלות צלזיוס למשך 15 שניות, ואז לחשל פריימרים על תבניות DNA ב 52 מעלות צלזיוס למשך 15 שניות להאריך את תגובת PCR ב 72 מעלות צלזיוס למשך 30 שניות.
- להגביר קטע DNA פרש גן N1L (L025) ואת פריימרים L026 גן באמצעות תוכנן נגד גן N1L. להגביר את הגן RFP באמצעות פריימרים -specific RFP. להגביר קטע DNA שליטה פורש A52R ידי PCR באמצעות פריימרים ספציפיים A52R.
- לפתור את מוצרי ה- PCR באמצעות ג'ל 1% agarose 33. ללכוד את התמונה ג'ל באמצעות doc ג'ל UV. אם N1L PCR שלילי PCRs A52R ו RFP הוא חיוביים, אז פלאק השתנה באופן נכון באזור N1L.
- השתמש גן N1L של VV כפי לאזור המיקוד של שינוי 33. ודא כי האורכים של הזרועות על ימין ועל שמאל הם כ 500-600 נ"ב כל, ומשני צדיה של אזור היעד.
תוצאות
לבנייה של וקטור VV חדש, נקודת מוצא המפתח היא לתכנן ולבנות וקטור הסעות תורמות שיכול למקד לאזור מסוים של הגנום. במחקר זה, הגן VV N1L שימש מטרה למשל. הקלטת של וקטור ההסעות התורמות עבור רקומבינציה ובאזור הממוקד VV מוצגת באיור 1. על מנת לשפר את היעילות של רקומבינציה ההומולוגי, פלסמידים להביע Cas9 וכן N1L ספציפי gRNA היו שיתוף transfected לתוך CV -1 תאים 48 שעות לפני הביצוע ההומולוגי 33. יום אחד (24 שעות) לאחר transfection, RFP התבטאה התאים CV-1 (איור 2). לאחר הדבקה של תאי CV-1 עם lysate כולו מן הומולוגי (השלב 5),-RFP החיובית ושלטים שליליים הן נצפו תאי CV-1 (איור 3). בעקבות פרוטוקול הטיהור תאר, שותף פלאק טהור ULD להתקבל לאחר 3-5 סיבובים של טיהור. כפי שניתן לראות בתרשים 4, כל הפלאק לאחר הדבקה עם lysate תא נגזר לוחית טהורה בוירוס vaccinia המוטציה הציג אות RFP. כדי לברר אם המוטציה הטהורה VV היה השינוי הגנטי הנכון, PCR שמשה כדי לאשר את העדר של גן N1L הממוקד, כפי שמוצג באיור 5. PCR של הנגיף השונה הראה איתות חיובית עבור RFP ו אות נעדרה במשך N1L ( איור 5 AG ליין), ואילו תוצאות PCR של N1L עבור הווירוס המלא (CTR) עם אזור N1L שלם הן חיוביות. שברי DNA שליטת A52R היו חיוביים עבור כל הווירוסים רקומביננטי ונגיף Ctr. יעילות HR פלאק RFP החיובי היא 100% (6/6) בניסוי הזה (זה היה עד 94% בעבודה הקודמת 34). השיטה המתוארת במסמך זה שפרה את יעילות רקומבינציה ידי יותר מ -100 לקפל לעומת פרוטוקולים קונבנציונליים 33, 34.
התוכן "FO: keep-together.within-page =" 1 ">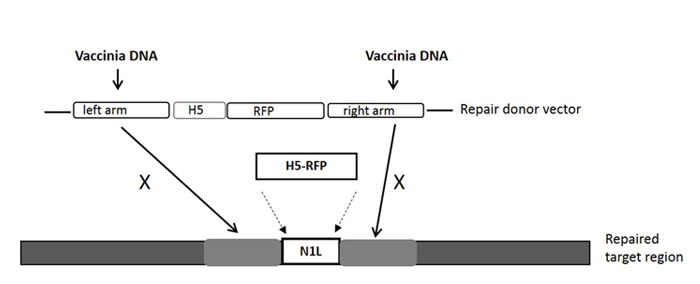
איור 1:. הקלטת של וקטור ההסעות התורמות עבור הומולוגיים, ואת האזור בגנום VV מכרז גן סמן הטיהור הוא מונע על ידי אמרגן H5. וקטור התורם תיקון מיקוד תוצאות באזור N1L בגן RFP השתלבותה לאזור N1L לאחר הומולוגיים. "X" מציין את הרצף ההומולוגי וקטור תורם התיקון שיחליף אותו הרצף על הגנום וירוס vaccinia. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
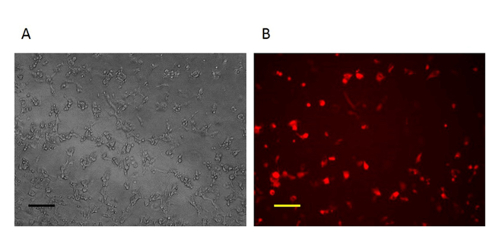
איור 2:. הדמיה של תאים 1 CV יום אחד לאחר הומולוגיים יום אחד after הומולוגי, את התאים נגועים עם VV ו transfected ידי וקטור תורם תיקון הם RFP חיובי ת:. בניגוד שלב תמונה (100X הגדלה המקורי) B:. תמונת מיקרוסקופ פלואורסצנטי (100X הגדלה המקורי). סרגל קנה מידה = 50 מיקרומטר. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
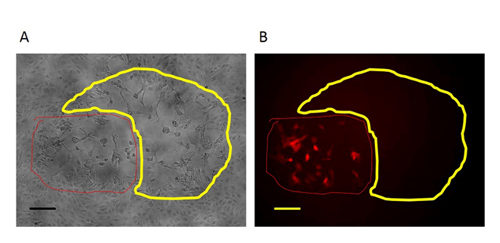
איור 3:. לוחית RFP-חיובית הטיהור בסיבוב הראשונה של וירוס מוטנטי הטיהור בסיבוב הראשון של נגיף המוטציה, שלט RFP-חיובי (מסומן בעיגול עם קו אדום) עם המחיקה באזור היעד מוקף הפלאק נוצר על ידי סוג הווירוס פרוע (מסומן בעיגול עם קו צהוב) ת:. בניגוד שלב תמונה (100X הגדלה המקורי) B:. קרינת micrתמונת oscopy (100X הגדלה המקורי). סרגל קנה מידה = 50 מיקרומטר. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
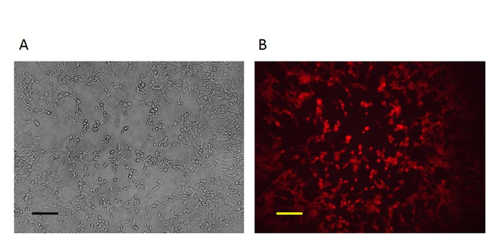
איור 4:. המוטציה הטהורה VV לאחר 3-5 סיבובים של טיהור, הפלאק טהור התקבל כל הפלאק היה RFP חיובי ת:. בניגוד שלב תמונה (100X הגדלה המקורי) B:. תמונת מיקרוסקופ פלואורסצנטי (100X הגדלה המקורי) . סרגל קנה מידה = 50 מיקרומטר. לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
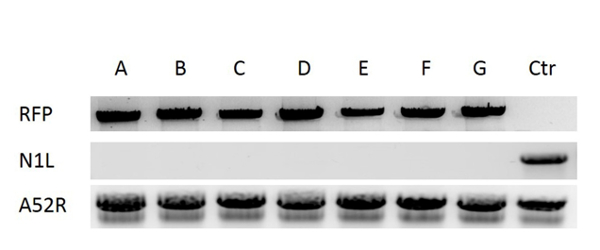
איור 5: Verification של מוטציה הטהור VV. DNA היה שחולץ מן VV נגוע CV-1 תאים. את המחיקה של אזור היעד N1L אומת על ידי PCR באמצעות פריימרים N1L, החדרת RFP לתוך אזור N1L אושרה על ידי ה- PCR באמצעות פריימרים RFP. Lanes AF מתאימה שישה לוחות מטוהרים, ליין G הוא שלט שליטה עם מחיקת N1L אומתה בעבודה קודמת 33, ליין Ctr (שליטה) הוא וירוס vaccinia הסוג הבר (עם אזור N1L ללא פגע). A52R גן היה מוגבר כמו הגן המלא עבור כל הדגימות. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
ישנן שתי מטרות עיקריות לגבי השינוי של VV למטרות טיפוליות. אחת היא למחוק גן מסוים, כגון קינאז thymidine גן (TK) כדי להחליש וירוס לשימוש טיפולי אנטי סרטניים. השני הוא לחמש VV עם גן טיפולי רצוי (כגון GM-CSF) או גן סמן (כגון גן בלוציפראז). השג אחת משני אלה כרוך את המחיקה של אזור היעד / גן. שיטת קשירה הישירה DNA 35 ותמונת אופן אריזה במבחנה ב -36 שמשו בעבר כדי ליצור וירוסי vaccinia מוטציה עם שינויי גן TK. עם זאת, שיטות אלו מוגבלות יישום לגבי המוטציה של אזורים אחרים בגנום בשל חוסר אתרי אנזים הגבלה ייחודיים על פני הגנום. הגישה הנוכחית ליצירת מוטצית VV כרוכה transfection של וקטור הסעות (תורם) עם סמן בחירה (RFP או GFP) לתוך CV-1 תאי שעות לאחר הדבקה עם VV להשפיע על incorporati ההומולוגיng סמן הבחירה לאזור היעד. מבחר לוחות סמן חיובי ואחריו-transfection פוסט h 24 טיהור שלהם. תהליך טיהור פלאק יכול להימשך עד 10 סיבובים, אחרון 3-4 שבועות ולעתים קרובות מוביל וירוסים רקומביננטי רצויים עם סמני מבחר מוכנס באזורים מחוץ היעד. פעמיים גדיל DNA הפסקות יכול לגרום הומולוגיים ביעילות בתאי יונקים 37, ועל ידי רתימת מנגנון זה את האפקטיביות של יצירת VV מוטציה ניתן לשפר לאין ערוך. מערכת gRNA מונחה Cas9 הועסקה בהצלחה בעריכה הגנום ומשפרת את היעילות של הומולוגיים באורגניזמים איקריוטיים 22, 25. לאחרונה, בתאים המארח את הגנומים של אדנו וסוג לי הרפס סימפלקס נערכו על ידי gRNA מונחה Cas9 מערכת 24. הוכח לאחרונה כי מערכת CRISPR Cas9 הוא כלי רב עוצמה עבור ביעילות עריכת הגנום VV ובניית וקטור VV דווקא משום שהביעגן מסוים.
שניהם N1L gRNA מונחה Cas9 ואת הומולוגיים המסורתית (HR) השיטה הביאה אירועים HR מוצלח באותו אתר היעד של N1L. מעניין, עם זאת gRNA מונחה HR Cas9 המושרה ברמות גבוהות הרבה יותר של יעילות מאשר שיטת HR המסורתית. לפיכך, השימוש של gRNA מונחה Cas9 מבטל את הצורך לטהר כמה הפלאק להשיג VVS מוטציה. בעבודה זו, אנו שיפרה בצורה משמעותית את היעילות ואת מסגרת הזמן עבור דור של מוטנטים VV באמצעות מערכת Cas9 gRNA מונחה 33. מן ראוי לציין כי צעד קריטי אחד להשגת יעילות גבוהה של הומולוגיים הוא transfect תאי CV-1 עם פלסמידים להביע Cas9 ואת gRNA במשך 24 שעות לפני הביצוע הומולוגי הקונבנציונלית. מרווח 24 שעות מאפשר Cas9 ו gRNA להתבטא ברמה סבירה. יתר על כן, רצף gRNA מיקוד גן מסוים עשוי צריך להיות מותאם כפי שמצאנו כי gRNA השונה רצפי tגן argeting N1L מגוון יעילותם 33, 34.
המגבלה עבור CRISPR / Cas9 ב VV עריכה היא השיעור הנמוך של הפלאק RFP החיובי בסיבוב הראשון של רקומבינציה. כדי להשיג כמות מספקת של הפלאק RFP חיובי המכיל וירוס רקומביננטי, בדרך כלל לפחות עשר צלחות 6-גם נדרשות, מה שהופך בסיבוב הראשון הקרנה מייגעת. לפיכך, יש עדיין צורך לייעל את הפרוטוקול להתגבר על מגבלה זו.
גודלו הקטן של הפלאק RFP חיובי הוא עוד בעיה פוטנציאלית, אשר בשל נפח גבוה של lysate להשתמש כדי להדביק צלחת 6 באר. כדי להתגבר על זה, נפח קטן יותר של lysate יש להשתמש כדי להדביק צלחת 6-גם להשיג הפלאק RFP חיובי בגודל גדול יותר. באמצעות נפח קטן יותר של lysate תאפשר גם להפרדה טובה יותר של פלאק RFP חיובי מאלה RFP-שלילי. כתוצאה מכך פחות סיבובים של טיהור פלאק נדרשים להשיג הפלאק RFP חיובי טהור.
Off-יעד השפעות הן תמיד בעיה רצויה בעריכת גן. CRISPR-Cas9 הוכיח השפעות חוץ-היעד. עם זאת, עם תכנון זהיר של gRNA, מחוץ היעד תופעות ניתן להימנע בעת עריכת VV הגנום 33, 34. זהו יתרון מסוים של שימוש במערכת Cas9 gRNA מונחה לעריכת הגנום של VV. בהינתן הבטחות של VV, באמצעות מערכת CRISPR / Cas9 תאיץ את התפתחות VVS מוטציה למחקר ביורפואי ברפואה translational. בנוסף, מערכת כזו גם תזרז תגליות בביולוגיה של תא, כגון דיסקציה של מסלולי האיתות שמוצגים VV עבור תנועתיות תקטין המבוססת שלה.Disclosures
Authors have no competing financial interests.
Acknowledgements
This work was supported by The MRC DPFS grant (MR/M015696/1) and Ministry of Sciences and Technology of China (2013DFG32080).
Materials
| Name | Company | Catalog Number | Comments |
| Plasmid #41824 | 41824 | Addgene | gRNA cloning vector |
| pST1374 | 13426 | Addgene | Cas9 cloning vector |
| pGEMT easy | A1360 | promega | repair donor vector cloning |
| One Shot TOP10 Chemically Competent E. coli | C4040-10 | Invitrogen | transformation |
| QIAprep Spin Miniprep Kit | 27106 | Qiagen | plasmid extraction |
| Dulbecco’s Eagle’s Medium (DMEM) | 11965-092 | Life Technologies | cell culture medium |
| fetal bovine serum (FBS) | SH30088.03HI | Hyclone | cell culture serum |
| penicillin, streptomycin | 15070-063 | Thermo Scientific | antibiotics |
| Effectene | 301425 | Qiagen | transfection |
| Thermo Scientific Nalgene Cryogenic vial; 2.0 mL | W-06754-96 | Thermo Scientific | collect virus |
| fluorescence microscope | Olympus BX51 Fluorescence | Olympus | find RFP-positive plque |
| DNeasy Blood & Tissue Kit | 69506 | Qiagen | DNA extraction |
| Extensor Long PCR ReddyMix Master Mix | AB-0794/B | Thermo Scientific | PCR reagent |
| 10 cm culture dish | Z688819-6EA | sigma | cell culture |
| 6-well plate | Z707759 | sigma | cell culture |
| cell scraper | C5981 | sigma | scrap cells |
| 1x Trypsin-EDTA solution | T4299 | sigma | trypsinize cells |
| Virkon | 95015661 | Anachem Ltd | desinfectant |
| Falcon tube | CLS430791-500EA | Sigma | hold cell suspension |
| N1L forward 5’-TATCTAGCAATGGACCGT-3’ | Sigma | PCR primer | |
| N1L reverse 5’-CCGAAGGTAGTAGCATGGA-3' | Sigma | PCR primer | |
| A52R forward 5’-ATAGGATTGTGTGCATGC-3’ | Sigma | PCR primer | |
| A52R reverse 5’-TTGCGGTATATGTATGAGGTG-3’ | Sigma | PCR primer | |
| RFP forward 5’- GCTACCGGACTCAGATCCA-3’ | Sigma | PCR primer | |
| RFP reverse 5’-CGCCTTAAGATACATTGATGAG-3’ | Sigma | PCR primer | |
| Argarose | A7431 | Sigma | resolve PCR product |
| G:BOX F3 | G:BOX F3 | Syngene | UV gel doc |
References
- Baroudy, B. M., Venkatesan, S., Moss, B. Incompletely base-paired flip-flop terminal loops link the two DNA strands of the vaccinia virus genome into one uninterrupted polynucleotide chain. Cell. 28, 315-324 (1982).
- Madigan, M. T., Martinko, J. M., Parker, J., Brock, T. D. Brock biology of microorganisms, 9th edn. , Prentice Hall. Upper Saddle River, NJ. (2000).
- Cooney, E. L., et al. Safety of and immunological response to a recombinant vaccinia virus vaccine expressing HIV envelope glycoprotein. Lancet. 337, 567-572 (1991).
- Mackett, M., Yilma, T., Rose, J. K., Moss, B. Vaccinia virus recombinants: expression of VSV genes and protective immunization of mice and cattle. Science. 227, 433-435 (1985).
- Legrand, F. A., et al. Induction of potent humoral and cell-mediated immune responses by attenuated vaccinia virus vectors with deleted serpin genes. J Virol. 78, 2770-2779 (2004).
- Panicali, D., Davis, S. W., Weinberg, R. L., Paoletti, E. Construction of live vaccines by using genetically engineered poxviruses: biological activity of recombinant vaccinia virus expressing influenza virus hemagglutinin. Proc Natl Acad Sci. 80, 5364-5368 (1983).
- Wiktor, T. J., et al. Protection from rabies by a vaccinia virus recombinant containing the rabies virus glycoprotein gene. Proc Natl Acad Sci. 81, 7194-7198 (1984).
- Gallucci, S., Matzinger, P. Danger signals: SOS to the immune system. Curr Opin Immunol. 13, 114-119 (2001).
- Matzinger, P. The danger model: a renewed sense of self. Science. 296, 301-305 (2002).
- Guo, Z. S., Bartlett, D. L. Vaccinia as a vector for gene delivery. Expert Opin Biol Ther. 4, 901-917 (2004).
- Kwak, H., Horig, H., Kaufman, H. L. Poxviruses as vectors for cancer immunotherapy. Curr Opin Drug Discov Devel. 6, 161-168 (2003).
- Tysome, J. R., et al. Lister strain of vaccinia virus armed with endostatin-angiostatin fusion gene as a novel therapeutic agent for human pancreatic cancer. Gene Ther. 16, 1223-1233 (2009).
- Kirn, D. H., Wang, Y., Liang, W., Contag, C. H., Thorne, S. H. Enhancing poxvirus oncolytic effects through increased spread and immune evasion. Cancer Res. 68, 2071-2075 (2008).
- Park, B. H., et al. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 9, 533-542 (2008).
- Panicali, D., Paoletti, E. Construction of poxviruses as cloning vectors: insertion of the thymidine kinase gene from herpes simplex virus into the DNA of infectious vaccinia virus. Proc Natl Acad Sci. 79, 4927-4931 (1982).
- Ball, L. A. High-frequency homologous recombination in vaccinia virus DNA. J Virol. 61, 1788-1795 (1987).
- Rouet, P., Smih, F., Jasin, M. Introduction of double-strand breaks into the genome of mouse cells by expression of a rare-cutting endonuclease. Mol Cell Biol. 14, 8096-8106 (1994).
- Jansen, R., Embden, J. D., Gaastra, W., Schouls, L. M. Identification of genes that are associated with DNA repeats in prokaryotes. Mol Microbiol. 43, 1565-1575 (2002).
- Brouns, S. J., et al. Small CRISPR RNAs guide antiviral defense in prokaryotes. Science. 321, 960-964 (2008).
- van der Oost, J., Jore, M. M., Westra, E. R., Lundgren, M., Brouns, S. J. CRISPR-based adaptive and heritable immunity in prokaryotes. Trends Biochem Sci. 34, 401-407 (2009).
- Jinek, M., et al. Structures of Cas9 endonucleases reveal RNA-mediated conformational activation. Science. 343, 1247997(2014).
- Cong, L., et al. Multiplex genome engineering using CRISPR/Cas systems. Science. 339, 819-823 (2013).
- Jinek, M., et al. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337, 816-821 (2012).
- Bi, Y., et al. High-efficiency targeted editing of large viral genomes by RNA-guided nucleases. PLoS Pathog. 10, 1004090(2014).
- Mali, P., et al. RNA-guided human genome engineering via Cas9. Science. 339, 823-826 (2013).
- Yang, L., et al. Optimization of scarless human stem cell genome editing. Nucleic Acids Res. 41, 9049-9061 (2013).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31, 827-832 (2013).
- Ran, F. A., et al. Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity. Cell. 154, 1380-1389 (2013).
- Niu, Y., et al. Generation of gene-modified cynomolgus monkey via Cas9/RNA-mediated gene targeting in one-cell embryos. Cell. 156, 836-843 (2014).
- Yin, H., et al. Genome editing with Cas9 in adult mice corrects a disease mutation and phenotype. Nat Biotechnol. 32, 551-553 (2014).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Ma, Y., et al. Generating rats with conditional alleles using CRISPR/Cas9. Cell Res. 24, 122-125 (2014).
- Yuan, M., et al. Efficiently editing the vaccinia virus genome by using the CRISPR-Cas9 system. J Virol. 89, 5176-5179 (2015).
- Yuan, M., et al. A marker-free system for highly efficient construction of vaccinia virus vectors using CRISPR Cas9. Mol Ther Methods Clin Dev. 2, 15035(2015).
- Merchlinsky, M., Moss, B. Introduction of foreign DNA into the vaccinia virus genome by in vitro ligation: recombination-independent selectable cloning vectors. Virology. 190, 522-526 (1992).
- Timiryasova, T. M., Chen, B., Fodor, N., Fodor, I. Construction of recombinant vaccinia viruses using PUV-inactivated virus as a helper. Biotechniques. 31, 534-540 (2001).
- Johnson, R. D., Jasin, M. Double-strand-break-induced homologous recombination in mammalian cells. Biochem Soc Trans. 29, 196-201 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved