Method Article
העשרה Phosphopeptide בשילוב עם ספקטרומטר מסה ללא תווית כמותיים כדי לחקור את Phosphoproteome סרטן הערמונית
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר הליך כדי לחלץ ולהעשיר את phosphopeptides סרטן הערמונית שורות תאים או רקמות עבור ניתוח של phosphoproteome באמצעות פרוטאומיקס מבוססי ספקטרומטר מסה.
Abstract
Phosphoproteomics כרוך המחקר בקנה מידה גדול של חלבונים phosphorylated. זירחון חלבונים היא שלב קריטי משעולים רבים של התמרה חושית אות ו בחוזקה מוסדר על ידי kinases ו- phosphatases. לכן, אפיון של phosphoproteome עשוי לספק תובנות לגבי זיהוי מטרות הרומן סמנים ביולוגיים לטיפול oncologic. ספקטרומטר מסה מספק דרך כדי לזהות ולכמת ברחבי העולם אלפי אירועים ייחודיים זירחון. עם זאת, phosphopeptides נפוצים הרבה פחות מאשר הלא-phosphopeptides, ביצוע ניתוח הביוכימי מאתגרת יותר. כדי להתגבר על מגבלה זו, נדרשים שיטות להעשרת phosphopeptides לפני הניתוח ספקטרומטר מסה. אנו מתארים הליך כדי לחלץ לעכל חלבונים מרקמות להניב פפטידים, ואחריו העשרה phosphotyrosine (pY), שימוש מבוסס על נוגדנים פפטידים phosphoserine/תראונין (pST) ו/או טיטניום דו-חמצני (TiO2)-מבוסס שיטת העשרה. אחרי הכנת הדוגמא ספקטרומטר מסה, אנחנו לאחר מכן לזהות ולכמת phosphopeptides באמצעות כרומטוגרפיה נוזלית-ספקטרומטריית ותוכנות אנליזה.
Introduction
מקרים חדשים של 165,000 משוער ותמותה 29,000 כ תתרחש ב-2018 עקב סרטן הערמונית, המייצג את הסרטן הנפוץ ואת הסיבה המובילה השניה של מוות מסרטן בגברים ארצות הברית1. בשלבים המוקדמים של סרטן הערמונית הם מאוד לטפל בה עם כריתה או קרינה טיפול המחלה איברים-מוגבל, איפה שיעור הישנות עשר שנים בין 20% ל- 40% עבור חולים שעברו הערמונית, בין 30% ל- 50% עבור חולים אשר מקבלים קרינה טיפול2. כי סרטן הערמונית מסתמך על אנדרוגן איתות לצמיחה, סירוס כירורגי וכימיים טיפולים מועסקים גם לחולים בסיכון גבוה. עם זאת, נסיגה מתרחשת כאשר הסרטן כבר לא מגיב אנדרוגן מניעת טיפול כפי שמעידים הישנות הביוכימי, איפה אנטיגן ספציפי הערמונית בסרום עולה שוב. בשלב זה בהתקדמות, גרורות לעיתים קרובות זוהו גם כן. בשלב מתקדם זה, הנקרא סרטן הערמונית גרורתי סירוס עמידים, מייצג את הטופס קטלניים של המחלה איפה הפרוגנוזה זמן חציון ההישרדות של פחות משנתיים3. כמה אפשרויות טיפול הזמינות בהמחלה בשלב מאוחר, כולל antiandrogens הדור השני כגון enzalutamide ו abiraterone, וכן מבוססי taxane כימותרפיה כמו דוסטקסול. למרות הטיפולים, המחלה לעיתים קרובות מתקדמת. לכן, בגילוי ופיתוח של סיבוכיה נחוצים לשפר את הטיפול של חולי סרטן הערמונית עם מחלה מתקדמת.
ספקטרומטר מסה (MS)-גישות מבוססות מספקים ניתוח גלובלית של פרוטאום דרך הגילוי של מאות עד אלפי פפטיד analytes4. בפרט, גילוי פרוטאומיקס, הידוע גם בשם נתונים תלויי רכישה (DDA), יכולות להניב את זיהוי, כימות של אלפי פפטידים4,5. גילוי מבוססי MS פרוטאומיקס יכול מאפשרת עוד יותר לתוך פרוטאומיקס מלמעלה למטה, שבו מאופיינים חלבונים שלמים, מלמטה למעלה (המכונה גם רובה) פרוטאומיקס, איפה פפטידים מנותחים לאפיין חלבונים5. לפיכך, רובה פרוטאומיקס, צעד proteolysis מארלסקה הכנת הדוגמא שלפני הניתוח MS כדי לדבוק החלבונים לתוך פפטידים. בסוף, מתבצע חיפוש במסד הנתונים כדי למפות את פפטידים בחזרה החלבונים לצורך זיהוי. ללא תווית כמו גם וכן מספר איזוטופ-תיוג [למשל, איזוטופ יציב תיוג על ידי חומצות אמינו בתרבות תא (SILAC)] שיטות ניתן להשוות באופן כמותי פפטידים בין דגימות6,7. בעוד טכניקות תיוג איזוטופ הם תקן הזהב, שיטות ללא תווית הדגימו דומה כמת accuracies8,9 ויש פשרות השוואה בין רגישות, ירידה לפרטים10. כימות ללא תווית מספק כיסוי גדול וההיתרים השוואות בין דוגמאות נוספות רבות, ואילו על פי תווית מוגבלים על ידי עלות ו ריבוב קיבולות6,7,8.
יתר על כן, רובה MS יכול גם לשמש לחקור שינויים post-translational (PTMs) כגון זרחון11. בשל אופיו stoichiometric התחתון של phosphopeptides לעומת סך פפטידים, מועסקים מספר שיטות להעשרת עבור phosphopeptides, כולל נוגדן מבוססי immunoprecipitation של פפטידים phosphotyrosine (pY), טיטניום דיאוקסיד (TiO2 ), והוא מתאושש זיקה מתכת כרומטוגרפיה (IMAC)5,12. כי זירחון חלבונים היא שלב מפתח רבים התא איתות מסלולים, רובה phosphoproteomics מאפשר לחוקרים לחקור התא איתות לשינויים סוגי סרטן שונים, כולל השד13, הערמונית14, כליות15, השחלות,16,17 כדי להבין טוב יותר סרטן ביולוגיה, וכן לזיהוי פוטנציאלים חדשים לטיפול.
שיטה זו phosphoproteomic רובה ללא תווית היה בנוי ומעודן העבודות הקודמות בהתבסס על19,2018,קבוצת Graeber. פרוטוקול זה מתחיל לתאר את החילוץ עיכול חלבונים ו phosphoproteins מרקמות לתוך פפטידים. אנחנו מכן פירוט העשרת של פפטידים pY באמצעות נוגדנים ספציפיים phosphotyrosine TiO2. אנו מתארים גם את העשרת של פפטידים phosphoserine/תראונין (pST) באמצעות חזק קטיון (SCX) ואחריו TiO2. פרוטוקול זה מסכם עם הגשת דגימות מתקן MS ושימוש של MS ניתוח תוכנה כדי לזהות ולכמת phosphopeptides ו- phosphoproteins המתאימים שלהם. היישום של פרוטוקול זה יכול להרחיב מעבר סרטן הערמונית סרטן ושדות אחרים מחוץ אונקולוגיה.
Protocol
ניסויים באמצעות גידולים xenograft היו אושרה על ידי רוטגרס אוניברסיטת אכפת חיה מוסדיים שימוש הוועדה כפי שנקבע הלאה תחת הקווים המנחים של מכוני הבריאות הלאומיים.
1. חלבון החילוץ
- להכין מאגר פירוק (טבלה 1). (אמצעי האחסון תלוי במספר הדגימות להיות נקצרו.) עבור במבחנה דגימות תאים, להמשיך לצעוד 1.2. עבור רקמת הגידול, להמשיך לצעוד 1.3.
-
קציר תאים
- לאסוף את התאים צינור חרוטי 50 מ ל, לסובב אותם ב 700 g x עבור 5 דקות ב 4 º C. למחוק את תגובת שיקוע ולשמור בגדר על קרח. חזור על שלב זה עבור כל המנות לאסוף את התאים לתוך גלולה אחת. (בדרך כלל, כ-5 מנות 15-ס"מ כמעט confluent של תאים יש צורך 5 מ"ג של חלבון, אך זה עשוי להיות תלוי על הקו תא וצריך לקבוע מדעית על ידי כל חוקר).
- רחץ בגדר עם 30 מ של צונן באגירה פוספט תמיסת מלח (PBS) ו ספין-700 g x עבור 5 דקות ב 4 ° C לפני כ רפה בעברית, טוב, מגניב. להוסיף 1.5 מ של פירוק מאגר לכל 5 מ"ג חלבון נהגה בגדר התא. Pipet למעלה ולמטה כמה פעמים. דלג לשלב מס ' 1.4.
-
קצירת רקמות
- שוקל את הגידול ולהוסיף 2 מ של פירוק כקרח המאגר עבור כל 100 מ ג של רקמות במבחנה תרבות. (בדרך כלל, 50 עד 150 מ ג של משקל רטוב רקמות נדרש.)
- Homogenize באמצעות lysate מהמגן כף יד או benchtop (דופק 2 x 15 s.) לנקות את מהמגן לפני המדגם הראשון, בין דגימות באמצעות אקונומיקה 10%, 70% אתנול ומים יונים ברצף.
- כדי להפחית את alkylate, מחממים את הדגימות homogenized ב 95 מעלות צלזיוס במשך 5 דקות. אז מגניב אותם על קרח למשך 15 דקות. על קרח, sonicate ה-x 3 lysate (כלומר, במשך 30 s עם 60 s הפסקות בין פולסים). המדגם אינו יכול להיות צמיגה או הגושיים בשלב זה. מחממים את lysate ב 95 ° C 5 דקות21.
- צנטריפוגה lysate ב sonication באותו צינור באמצעות רוטור דלי הנדנדה ב g 3,500 x-15 מעלות במשך 15 דקות לאסוף את תגובת שיקוע וזורקים בגדר.
- לקבוע ריכוז החלבון על ידי ביצוע וזמינותו ברדפורד22. במידת הצורך, לדלל את lysate עד 5 מ"ג/מ"ל עם מאגר פירוק. אחסן אותו ב-20 ° C.
הערה: הניסוי ניתן להשהות כאן. להקפיא את הדגימות ב-80 מעלות צלזיוס ולהמשיך במועד מאוחר יותר.
2. lysate עיכול
- לדלל את הדגימה 12-fold באמצעות 100 מ מ טריס (ה-pH = 8.5) כדי להפחית את כמות guanidinium. לדלל כל הדגימות באותו אמצעי אחסון כדי למזער את ההשפעות של עיכול לא שיוויוני. שמור µg 12.5 של מעוכל lysate כדי לאשר אותה ג'ל שהוכתמו Coomassie23.
- 5 מ"ג של חלבון, להוסיף 10 µg של Lysyl Endopeptidase (Lys-C), דגירה זה בטמפרטורת החדר במשך 5-6 ה pH התאם ל 8.0 על-ידי הוספת 1 מ' untitrated טריס (pH ~ 11).
- להכין 1 מ"ג/מ"ל של L-1-tosylamido-2-phenylethyl chloromethyl קטון (TPCK)-טיפול טריפסין 1 מ"מ HCl (עם 20 מ מ CaCl2). הוסף את טריפסין ביחס טריפסין: חלבון מטריים, דגירה זה ב 37 מעלות צלזיוס במשך 3 שעות.
- הוסף את אותה כמות של טריפסין טריים כמו שלב 2.3. דגירה זה ב 37 מעלות צלזיוס למשך הלילה.
- שמור µg 12.5 של מתעכל lysate כדי לאשר עיכול מלאה ג'ל שהוכתמו Coomassie23.
3. היפוך פאזה החילוץ
- להקליט את העוצמה lysate. לסנן את הדגימה באמצעות מסנן 15 mL 10 kDa הקיצוץ. Centrifuge המדגם-3500 x g באמצעות הרוטור דלי סווינג (או g x 3,500 ברוטור זווית קבועה) ב 15 ° C עד שאמצעי האחסון retentate µL פחות מ 250 (זה לוקח כ- 45-60 דקות). לאסוף את הזרימה דרך וזורקים את retentate.
הערה: הניסוי ניתן להשהות כאן. להקפיא את הדגימות ב-80 מעלות צלזיוס ולהמשיך במועד מאוחר יותר. - כדי acidify את הדגימה, להוסיף כ 20 µL של 5% trifluoroacetic חומצה (TFA) לכל מ של lysate. מתבלים ולמדוד את ה-pH מדגם באמצעות רצועות pH. להתאים את ה-pH ל 2.5 באמצעות 5% TFA.
- חבר את הקצה קצר יותר של עמודה C-18 יריעה ואקום. הגדר את הריק בין kPa 17 ו- 34 (או על פי הוראות היצרן). באמצעות פיפטות זכוכית , להרטיב את העמודה עם 3 מ ל 100% acetonitrile (לחצן מצוקה). אל תתנו את העמודה יבש.
- באמצעות פיפטות זכוכית , equilibrate את העמודה עם 6 מ של 0.1% TFA מורחים 2 x 3 מ"ל. לטעון את הדגימה acidified לתוך העמודה. אל תוסיף יותר מ 3 מ ל בכל פעם. התאם את הואקום למטרה כ 1-2 טיפות לשניה.
- באמצעות פיפטות זכוכית , לשטוף את העמודה עם 9 מ של 0.1% TFA מורחים 3 x 3 מ"ל. Elute את העמודה עם 2 מ של 40% לחצן מצוקה, 0.1% TFA. לאסוף שני שברים 2 מ"ל לתוך צינורות תרבות זכוכית . למחוק את העמודה.
- מכסה את צינורות eluate עם מצלמות-מיקרוסקופים, 3-5 חורים על השער באמצעות מחט 20 גרם. להקפיא את eluate על קרח יבש במשך לפחות 30 דקות עד שזה יהיה לגמרי מוצק.
- Lyophilize השברים בן לילה. ביום הבא, ודא כי הדגימות יבשים לחלוטין לפני העצירה של איזה שהוא לופילייזר. לאחסן את הצינורות צינור חרוטי 50 מ עם מגבונים עדינים ב-80 מעלות צלזיוס.
הערה: הניסוי ניתן להשהות כאן.
4. Immunoprecipitation והעשרה של pY פפטידים24
- Resuspend את האבקה lyophilized 0.5 מ ל קרה כקרח immunoprecipitation (IP) מחייב מאגר של כל שבר. בריכה השברים על-ידי העברת אמצעי האחסון resuspension 0.5 mL השבר השני השבר הראשון ולשמור את הטיפ פיפטה. נמרצות מערבולת (במקום pipetting למעלה ולמטה) כדי לוודא הדגימה היא התפרקה לחלוטין לפני העברת אותו cryotube בורג מכסה 3.6 mL.
- כמו שלב 4.1., לשטוף את צינורות lyophilization עם עוד 0.5 mL מאגר איגוד ה-IP (טבלה 1) בכל שפופרת. להעביר את הפתרון הצינור פקקי בורג 3.6 mL באמצעות הטיפ פיפטה אותו כדי למזער את אובדן הדגימה. חזור על רינס 1 x יותר, ביצוע האחסון resuspension הסופי 2 מ"ל (עבור 5 מ"ג של חלבון). למדוד את רמת החומציות מדגם כדי לוודא שזה כ 7.4. אם זה חומצי מדי, iteratively להוסיף 10 µL של 1 מ' טריס (untitrated, pH ~ 11). אם זה גם בסיסית, iteratively להוסיף 10 µL של HCl שתדללו (1:25 או 1: 100).
-
מראש לשטוף את החרוזים pY (עבור 5 מ"ג של החל lysate)
- 25 µg של נוגדן 4G 10 ו- 12.5 µg של נוגדן 27B10.4 דרושים עבור דגימה. לאחר שימוש של p200 פיפטה עם טיפ לחתוך כדי להעביר את הנוגדנים לתוך צינורות microcentrifuge נפרדים, לשטוף את הנוגדנים עם 450 µL קר כקרח מאגר איגוד ה-IP 2 x. Centrifuge אותם ב g 100 x דקות 1-4 ° C ו לשאוב החוצה תגובת שיקוע.
- Resuspend את החרוזים כדי ריכוז מניות של 0.5 מ"ג/מ"ל באמצעות מאגר איגוד ה-IP. (לעשות לא מערבולת החרוזים.) לאחר aliquoting הצורך slurry (50 µL של slurry נוגדן 4G 10 ו slurry נוגדן 27B10.4 µL 25 עבור דגימה) לתוך צינור יחיד, ספין לטמיון צנטריפוגה מניות ב- g 200 x עבור 1 דקות ב- 4 מעלות צלזיוס. רחץ בקירות הצדדיים עם תגובת שיקוע לפני שחזר את החרוזים לאחסון במקרר.
- להוסיף חרוזים pY טרום שטף הפתרון מדגם resuspended ב cryotubes פקקי בורג. דגירה אותם ב 4 ° C-מסובב מעל קצה-בן לילה.
- מקום cryotubes בורג מכסה את שפופרת צנטרפוגה 50 מ עם מגבון עדין. ספין למטה החרוזים-g x 100 עבור דק 1. להציל תגובת שיקוע, אשר ישמש כדי להעשיר עבור pST פפטידים. (העשרת של pST מתחיל שלב 7, יכול להתבצע במקביל לעיבוד פפטיד pY).
- Resuspend את החרוזים עם 300 µL מאגר איגוד ה-IP. להעביר אותם ל צינור microcentrifuge 2 מ"ל, לסובב אותם למטה ב g x 100 דקות 1-4 מעלות צלזיוס.
- שטיפה הדגירה צינור 3 x עם 200 µL מאגר איגוד ה-IP. העבר את התוכן הצינור Microcentrifuge אותו בכל פעם. ואז לסובב אותם למטה.
- תשטוף החרוזים ב microcentrifuge צינור 3 x עם 500 µL מאגר איגוד ה-IP, לסובב אותם למטה ב- g x 100 עבור 1 דקות. לאחר מכן לשטוף את החרוזים 4 x עם 450 µL של 25 מ מ NH4HCO3, pH 7.5 ו ספין לפדר אותם למטה ב g 100 x לפתרון 1 דקות שימוש טריים 25 מ מ NH4HCO3 מ בכל פעם.
- Centrifuge החרוזים-g x 1,500 עבור 1 הגבלת שימוש טיפ העמסה ג'ל כדי להסיר לחלוטין את תגובת שיקוע בטבילת קצהו של קצה ג'ל-טעינה מעט מתחת לפני השטח של החרוזים.
- להוסיף 4 x נפח חרוז של 0.1% TFA כדי החרוזים (כלומר, להוסיף µL 300 של 0.1% TFA עבור 75 µg של slurry חרוז pY). מתבלים, דגירה התערובת ב thermomixer-1000 סל"ד למשך 15 דקות ב 37 º C.
- להעביר את resuspension מסנן ספין 0.2 µm. ספין דרך צינור • תנאי ובמהירות להעביר את אמצעי האחסון שיורית באותו ספין מסנן משתמש של pipet P10. ספין למטה המסנן ספין ב 850 x g עבור מינימלית 1 להעביר את • תנאי צינור microcentrifuge מחייב חלבון נמוכה . ואקום לרכז את eluate ליובש בלילה ב 40 מעלות צלזיוס, עם זמן החום של 300 דקות.
הערה: הניסוי ניתן להשהות כאן. להקפיא את הדגימות ב-80 מעלות צלזיוס ולהמשיך במועד מאוחר יותר.
5. טיטניום דו-חמצני העשרה25 pY פפטידים
- Resuspend את יבשים למטה phosphopeptides ב µL 200 של 50% לחצן מצוקה, 0.1% TFA. מערבולת, centrifuge אותם ב g 10,000 x ' חזור ' ס' 30 זה x 1 כדי resuspend אותם היטב.
- הכנת חרוזים2 TiO הכלול טיפים בעלי קיבולת של דגימות µL 200.
- טפח בעדינות על הצד הטיפ קטן של קצה כדי להעביר את החומר למטרה זו. לשטוף את הטיפ על-ידי הוספת 200 µL של 100% לחצן מצוקה, ואחריו היפוך הקצה, מצליף הסוף קטן כדי להעביר את הנוזל לכיוון הכיפה.
- בעזרת סכין גילוח, חותכים את קצה הקצה קטן ומניחים אותו מעל. צינור מחייב חלבון נמוכה. (הימנעו משימוש צינורות פוליסטירן TiO2 ידבק צידי הצינור). הסירי את הפקק והכנס של micropipette לצלול החוצה לחצן מצוקה הנותרים. חזור על כביסה עם 200 µL של 100% לחצן מצוקה. החרוזים TiO2 נמצאים עכשיו בצינור מחייב חלבון נמוכה עבור השלבים הבאים.
- מקדים TiO2 עם µL 500 של לחצן מצוקה 100% 2 x. Pipet זה לערבב את החרוזים עם הממס. Centrifuge אותם ב- g x 100 עבור 1 דקות.
- תנאי TiO2 עם 500 µL 0.2 מ' סודיום פוספט מאגר (pH ~ 7) 2 x. תשטוף החרוזים עם 300 µL של equilibration מאגר 3 x. כי TiO2 הוא מאוד צפוף, החרוזים יסדר במהירות.
- להוסיף 400 µL של 50% לחצן מצוקה, 0.1% TFA לתוך הצינורית מחייב חלבון נמוכה, ואחריו הוספת 84 µL של חומצה לקטית. להעביר את phosphopeptides resuspended לתוך הצינור מחייב חלבון נמוכה, דגירה אותם לשעה בטמפרטורת החדר באמצעות מסובב מעל קצה-.
- Centrifuge את החרוזים-g x 100 עבור 1 דקות הצניפה אותם. לשטוף אותם עם 300 µL equilibration מאגר (טבלה 1) 2 x ולסובב אותם למטה ב- g x 100 עבור 1 דקות.
- לשטוף את החרוזים עם 300 µL של שטיפה מאגר 2 x. מעבירים למסנן ספין 0.2 µm. לסובב אותם ב- g x 1,500 עבור 1 דקות.
- העברת יחידת מסנן צינור נקי mL 1.5 מחייב חלבון נמוכה. Elute את התוכן 2 x עם 200 µL של 0.9% NH3 H2O. מדד ה-pH עם חומציות, אשר צריכה להיות בין 10 ל- 11. ואקום לרכז את eluate ליובש בלילה מתמוססות התרכובת הכימית.
6. desalting pY פפטידים עבור MS ניתוחים
- לשקם את phosphopeptides עם µL 15 של 0.1% TFA vortexing, צריך שתוציאו אותם ב g x 10,000 ל 30 s כדי resuspend אותם. חזור על x 1 זה כדי resuspend אותם היטב. לא פיפטה למעלה ולמטה.
- לנקות את הדגימה באמצעות טיפ C-18 עם קיבולת קשירה של 5 µg ופעל הפרוטוקול של היצרן.
- יבש לחלוטין • תנאי האחסון על-ידי ריכוז ואקום. זה לוקח 1-2 ה Resuspend את phosphopeptides יבשים ב- 12.5 µL של פתרון ספקטרומטר מסה (ראה טבלה 1) (או כפי המומלץ על-ידי MS של החוקר פרוטאומיקס ליבה של המתקן). מערבולת בקצרה ספין הפתרון למטה ב 10,000 g x עבור חזור ס' 30 זה 2x resuspend אותם היטב. הדגימות מוכנים להגשה למתקן ספקטרומטר מסה (שלב 11).
הערה: השלבים הבאים להלן קשורים pST פפטיד העשרה בלבד.
7. הפוך שלב מיצוי של פפטידים pST
- מודדים את ריכוז פפטיד תגובת שיקוע רכשה משלב 4.6 על-ידי ביצוע וזמינותו של פפטיד. כמות מספקת עבור pST ספקטרומטר מסה הוא 2.5 מ ג.
- להתאים את ה-pH ל 3.5 עם 5% TFA.
- חבר את הקצה קצר יותר של עמודה C-18 יריעה ואקום. הגדר את הריק בין kPa 17 ו- 34 (או על פי הוראות היצרן). להרטיב את העמודה עם 3 מ"ל של 100% לחצן מצוקה. אל תתנו את העמודה יבש.
- Equilibrate את העמודה עם 6 מ של 0.1% TFA מורחים 2 x 3 מ"ל. לטעון את הדגימה acidified לתוך העמודה. אל תוסיף יותר מ 3 מ ל בכל פעם. התאם את הואקום למטרה כ 1-2 טיפות לשניה.
- לשטוף את העמודה עם 9 מ של 0.1% TFA מורחים 3 x 3 מ"ל. Elute את העמודה עם 2 מ של 40% לחצן מצוקה, 0.1% TFA. לאסוף שני שברים 2 מ"ל לתוך צינורות תרבות זכוכית. למחוק את העמודה.
- מכסה את צינורות eluate עם מצלמות-מיקרוסקופים, 3-5 חורים על השער באמצעות מחט 20 גרם. להקפיא את eluate על קרח יבש במשך לפחות 30 דקות עד שזה יהיה לגמרי מוצק.
- Lyophilize שברים הנבחר בין לילה. ביום הבא, ודא כי הדגימות יבשים לחלוטין לפני העצירה של איזה שהוא לופילייזר. לאחסן את הצינורות צינור חרוטי 50 מ עם מגבונים עדינים ב-80 מעלות צלזיוס.
הערה: הניסוי ניתן להשהות כאן.
8. חזקה קטיון (SCX) של פפטידים pST
- Resuspend של פפטידים lyophilized ב 2 מ"ל של מאגר A (טבלה 1). בריכת השברים עבור כל דגימה. (הפתרון יהיה מעונן.)
- הכינו את סעפת ואקום. להתחבר עמודת SCX מזרק 3 מ עם הבוכנה הוסר. הגדר את הריק בין kPa 17 ו- 34 (או על פי הוראות היצרן).
- להתנות את העמודה SCX עם 4 מ של לחצן מצוקה, ואחריו 4 מ של מאגר א
- לטעון mL 2 של הדוגמה מהצעד 8.1 ולאסוף את eluate מיד. לטעון 3 מ"ל של A:B (80.9:19.1) מאגר ולאסוף את eluate. מאגר eluates של כל דוגמה, aliquot אותם לתוך צינורות מחייב חלבון נמוכה מ ל 2.
- ואקום להתרכז כל דוגמאות עד כ-30% של אמצעי האחסון נשאר. (שלב זה לוקח כ 2-4 h). מאגר של aliquots לתוך צינור 1 מחייב חלבון נמוכה עבור כל דגימה.
- חבר את הקצה קצר יותר של עמודה C-18 יריעה ואקום. הגדר את הריק בין kPa 17 ו- 34 (או על פי הוראות היצרן). להרטיב את העמודה עם 3 מ"ל של 100% לחצן מצוקה 2 x. האם לא נתנו העמודה יבש.
- Equilibrate את העמודה עם 3 מ"ל של 0.1% TFA 2 x. לטעון את הדגימה לתוך העמודה. אל תוסיף יותר מ 3 מ ל בכל פעם. התאם את הואקום למטרה כ 1-2 טיפות לשניה.
- לשטוף את העמודה עם 3 מ"ל של 0.1% TFA 2 x. Elute את העמודה עם 4 מ"ל של 50% לחצן מצוקה, 0.1% TFA.
9. טיטניום דו-חמצני העשרה של פפטידים pST
-
הכנת חרוזים2 TiO הכלול טיפים בעלי קיבולת של 200 דוגמאות µL
- טפח בעדינות על הצד טיפ קטן של קצה כדי להעביר את החרוזים למטרה זו. הסירי את הפקק ויוצקים את החרוזים לתוך צינור חרוטי פוליפרופילן 15 מ"ל.
- לשטוף את הטיפ על-ידי הוספת 200 µL של 100% לחצן מצוקה, היפוך הקצה כמה פעמים והוא מצליף הסוף קטן כדי להעביר את הנוזל לכיוון הכיפה. בעזרת סכין גילוח, חותכים את קצה הקצה קטן, מעל הצינור חרוט פוליפרופילן 15 מ"ל. הסירי את הפקק והכנס של micropipette לצלול החוצה לחצן מצוקה הנותרים. חזור על כביסה עם 200 µL של 100% לחצן מצוקה. החרוזים2 TiO נמצאים עכשיו בצינור חרוט 15 mL עבור השלבים הבאים.
- מקדים TiO2 עם µL 500 של לחצן מצוקה 100% 2 x. Pipet זה לערבב את החרוזים עם הממס. Centrifuge אותם ב- g x 100 עבור 1 דקות.
- תנאי TiO2 עם 500 µL 0.2 מ' סודיום פוספט מאגר (pH ~ 7) פעמיים. תשטוף החרוזים עם 300 µL של equilibration מאגר 3 x.
- להעביר את phosphopeptides eluted לתוך הצינור חרוט פוליפרופילן 15 מ"ל. הוסף µL 560 של חומצה לקטית, דגירה זה לשעה בטמפרטורת החדר באמצעות מסובב מעל קצה-.
- Centrifuge את התערובת ב g x 100 עבור 1 דקות הצניפה החרוזים. לשטוף אותם עם 300 µL equilibration מאגר (טבלה 1) 3 x. ספין אותם למטה ב- g x 100 עבור 1 דקות.
- לשטוף את החרוזים עם 300 µL של שטיפה מאגר 2 x. מעבירים למסנן ספין 0.2 µm. ספין אותם למטה ב- g x 1,500 עבור 1 דקות.
- העברת יחידת מסנן צינור נקי mL 1.5 מחייב חלבון נמוכה. Elute את התוכן 2 x עם 200 µL של 0.9% NH3 H2O. תן את הפתרון לשבת על phosphopeptides למשך 2 דקות לפני eluting אותם. למדוד את רמת החומציות, אשר צריכה להיות בין 10 ל- 11.
- ואקום לרכז את eluate ליובש בלילה מתמוססות התרכובת הכימית.
10. desalting את pST פפטידים עבור MS ניתוחים
- טפח בעדינות על הצד הטיפ קטן של קצה כדי להעביר את החומר למטרה זו. לשטוף את הטיפ על-ידי הוספת 200 µL של 100% לחצן מצוקה, ואחריו היפוך הקצה, מצליף הסוף קטן כדי להעביר את הנוזל לכיוון הכיפה.
- בעזרת סכין גילוח, חותכים את קצה הקצה קטן ומניחים אותו מעל צינור חרוטי פוליפרופילן 15 מ"ל. הסירי את הפקק והכנס של micropipette לצלול החוצה לחצן מצוקה הנותרים. חזור על כביסה עם 200 µL של 100% לחצן מצוקה. החרוזים TiO2 נמצאים עכשיו בצינור חרוט פוליפרופילן 15 mL עבור השלבים הבאים.
- לנקות את הדגימה באמצעות טיפ C-18 עם קיבולת איגוד של 100 µg. (בצע הוראות היצרן).
- יבש לחלוטין • תנאי האחסון על-ידי ריכוז ואקום. זה לוקח 1-2 h.
- Resuspend את phosphopeptides יבשים ב- 12.5 µL של פתרון ספקטרומטר מסה (או כפי המומלץ על-ידי MS של החוקר פרוטאומיקס ליבה של המתקן). מערבולת, centrifuge אותם ב g x 10,000 ל 30 ס חזור על x 2 כדי resuspend אותם היטב. (לא פיפטה למעלה ולמטה.)
11. ניתוח ספקטרומטר מסה
- להגיש את הדגימות למתקן הליבה פרוטאומיקס MS כדי לבצע נוזלי MS כרומטוגרפיה-טנדם (LC-MS/MS) תוך שימוש בהגדרות המומלצות שלהם. הגדרות לדוגמה להלן (ראה טבלה 2 התקציר):
- לטעון µL 5 של הדגימות לתוך עמודה השמנה (2 ס מ זמן x 75 קוטר מיקרומטר) ולשטוף אותם עם 0.1% TFA במשך חמש דקות עם קצב זרימה של µL 5/min.
- תביא את המלכודת בקנה אחד עם ננו אנליטי עמודה (20 ס מ x 75 מיקרומטר) עם קצב זרימה של nL 300/min.
- מעברי צבע ליניאריים מקוטע (אחוז חומצה פורמית 0.16%, 80% לחצן מצוקה ב- 0.2% חומצה פורמית) שונים בין דגימות pY ו pST:
- עבור הדגימות pY, elute אותם באמצעות מעבר הדרגתי של 4-15% ב- 5 דקות, 15-50% בדקות 40 ו 50-90% ב- 5 דקות.
- לקבלת דוגמאות pST, elute אותם באמצעות מעבר הדרגתי של 4-15% 30 דקות, 15-25% ב- 40 דקות, 25-50% בדקות 44 ו- 50-90% ב- 11 דקות.
- MS נתוני רכישת נתונים תלויי במצב עם סדרה מחזורית של סריקה מלאה עם רזולוציה של 120,000 ואחריו MS/MS (HCD, אנרגיית התנגשות היחסי של 27%) של היונים האינטנסיבי ביותר 20 ומשך דינמי אי-הכללה של 20 s.
- לאחר MS להפעיל השלמה, לייבא את קבצי raw של MS תוכנית תוכנת MS ניתוח כדי לזהות ולכמת phosphopeptides. (MaxQuant תוכנה8,26,27 נעשה שימוש בניסוי זה. אלא אם צוין בטבלה3, הגדרות ברירת המחדל שימשו.)
תוצאות
פרוטוקול זה מתאר בפירוט שיטה של חלבון החילוץ ועיכול ואחריו phosphopeptide העשרה, חשפה MS (איור 1). הקומפוזיציות של כל מאגרי ופתרונות אשר נמצאים בשימוש פרוטוקול זה מפורטים בטבלה 1. שימוש רציף Lys-C וטריפסין מספק של עיכול יעיל. שהוכתמו Coomassie ג'ל של טרום מתעכל lysate מאשר נוכחותם של חלבונים, בעוד מכתים של פוסט מתעכל lysate מאשרת עיכול מלאה (איור 2 א). לעיכול מלאה, להקות אמור להופיע מעל kDa 15, למעט את kDa 30 ולהקות kDa 23.3 Lys-C, טריפסין, בהתאמה. התוספת של ליס-C גם מפחית את מספר שלא נענתה אדמירל (איור 2B). מאחר pY פפטידים מייצגים רק 2% phosphoproteome28, immunoprecipitation של פפטידים pY באמצעות נוגדן ספציפי pY היא הצעד הראשון pY פפטיד העשרה. תגובת שיקוע וכתוצאה מכך הופך הקלט pST פפטיד העשרה. Immunoprecipitation pY ביעילות מהנוזל pY פפטידים פפטידים pST בהם בממוצע 85% phosphopeptides זיהה משלב הכנת pY pY (איור 3 א), מעל 99% של phosphopeptides זיהה משלב הכנת pST הם pST (איור 3B). טיטניום דו-חמצני משמש כדי להעשיר עבור phosphopeptides בהכנות בשני. האחוז הצפוי של פפטידים בהכנת MS-מוכנות הן phosphorylated הוא בין 30-50% (איור 4A). ההשתנות באחוזים העשרה phosphopeptide עשוי להיות גדול בהכנת pY כתוצאה שיהיו הרבה פפטידים pY פחות מאשר pST פפטידים. מבחינת phosphopeptide מינים, לרוב phosphopeptides שאותרו יש קבוצה phosphoryl יחיד או כפול (איור 4B).
לאחר ביצוע ספקטרומטר מסה, קבצי raw MS נטענים לתוך תוכנת ניתוח MS. קביעות הפרמטר המשמשים את הניסוי מפורטים בטבלה 3 אבל ישתנו תוכנה תוכנה והם עשויים להשתנות מגירסה לגירסה. הפרמטרים המפורטים לא נשארו כברירת מחדל, כולל פד הקיצוץ של 1% על ספקטרום פפטיד תואמות (PSM) עם תוצאה אנדרומדה מינימלי של 40 לצורך זיהוי פפטידים ששונה27. הגדרת ניתוק ההסתברות לוקליזציה של יותר מ מסננים 0.75 כ 5% של פפטידים pY ו- 15%, 34% של pS, פפטידים pT, בהתאמה (איור 5A). לאחר החלת המסננים האלה, המספר הצפוי של phosphopeptide ההזדהויות בסוף הניתוח MS הוא כ 300 pY פפטידים (עבור 5 מ"ג של החלבון ההתחלתי) כ 7,500 pS פפטידים וכן 640 pT פפטידים (עבור 2.5 מ"ג פפטיד ההתחלה כמות) מהכנות העשרה בהתאמה (איור 5B). המספר של משכפל, ההשתנות של עוצמת האות phosphopeptide קובע את מניעים נאותה להשוואות סטטיסטי. בניסויים נפרד ארבע קבוצות כפילויות ביולוגי או triplicates הכוללת, חושבו המקדמים אחוז של וריאציה (% CV) עבור phosphopeptides שזוהו. הפצות ההשתנות נמוכה יותר (למשל, pST קבוצות 1-5 איור 5C) מציינים כי המדגם, הכנה, ואוסף ספקטרומטר מסה פועל היו עקביים. מצד שני, הפצות של השתנות גבוהה יותר (למשל, pST קבוצה 6 איור 5C) מציין נתונים רועש יותר יידרשו קיפול-שינויים גדולים יותר כדי לזהות הבדלים משמעותיים ניתוחים דיפרנציאלית במורד הזרם.
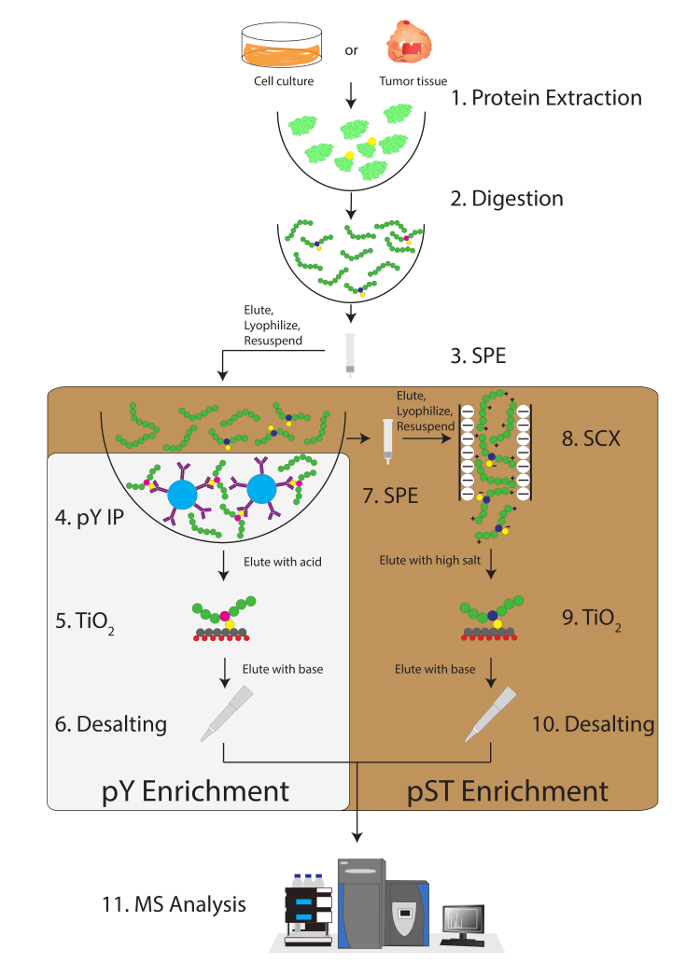
איור 1: דיאגרמת זרימת עבודה. חלבונים מדגימות חילוץ, מתעכל. פפטידים מופקים על ידי מיצוי מעבדתי (SPE), phosphotyrosine (pY) פפטידים immunoprecipitated. במקביל, מועשרים של פפטידים phosphoserine/תראונין (pST) מ תגובת שיקוע בשלב immunoprecipitation pY. קטיון חזקה (SCX) מבוצעת על תגובת שיקוע להסיר פפטידים טעון מאוד לצמצם דיכוי יון12. ההכנות שני עוברים phosphopeptide העשרה באמצעות טיטניום דו-חמצני (TiO2). לאחר דגימה ניקוי נוזלי כרומטוגרפיה-טנדם ספקטרומטר מסה (LC-MS/MS) מתבצע כדי למדוד את השפע phosphopeptide. הנתונים הגולמיים ואז נטען של MS ניתוח תוכנה לזיהוי phosphopeptides. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
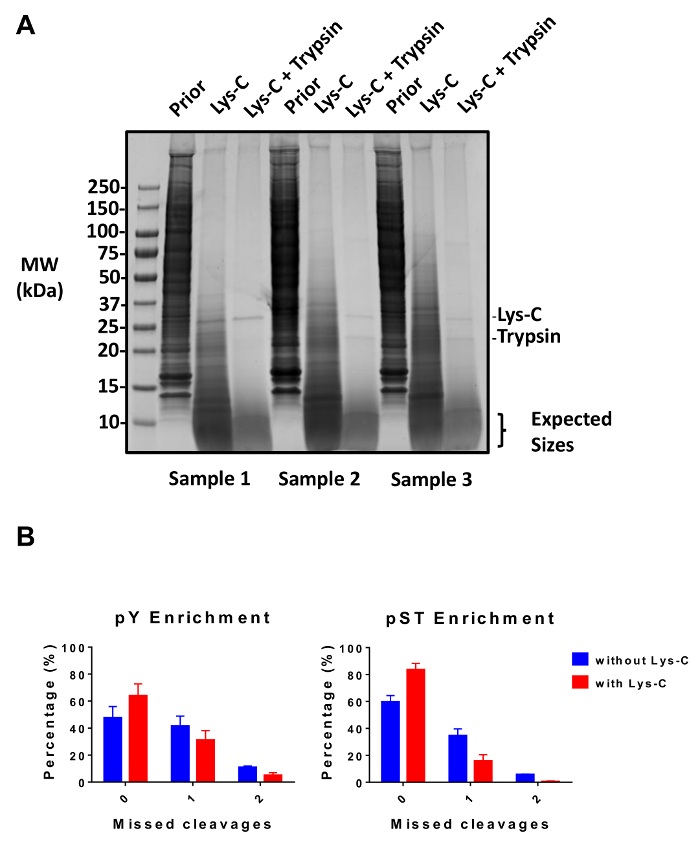
איור 2: הערכה של מערכת העיכול. (א) שלוש דוגמאות עם 12.5 µg העיכול בעיכול, פוסט-לשטיחים-C lysate, ומוצגים טריפסין שלאחר לעיכול. מבחן ג'ל-כתם Coomassie מראה על העיכול נקי לאחר שימוש רציף של ליס-C וטריפסין. סמני גודל משקל מולקולרי (MW) הינם kilodaltons (kDa). (B) א ירידה אדמירל החמיץ נצפית לאחר Lys-C נוספה לפרוטוקול. האחוז של phosphopeptides בלי לפספס אדמירל גדל מ-48% ל-64% ומ 60% ל- 84% בממוצע על ההכנות העשרה pY ו pST, בהתאמה. הגרפים לסכם את הנתונים המתקבלים שני ניסויים המבוצעים ללא Lys-C וניסויים חמש הופיעה עם Lys-סי קווי השגיאה הן סטיות תקן המייצג 38 pY ו pST 38, דגימות 2 ניסויים נפרדים (ללא Lys-C) ו- 62 pY pST 60, דגימות 5 ניסויים נפרדים (עם Lys-C). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
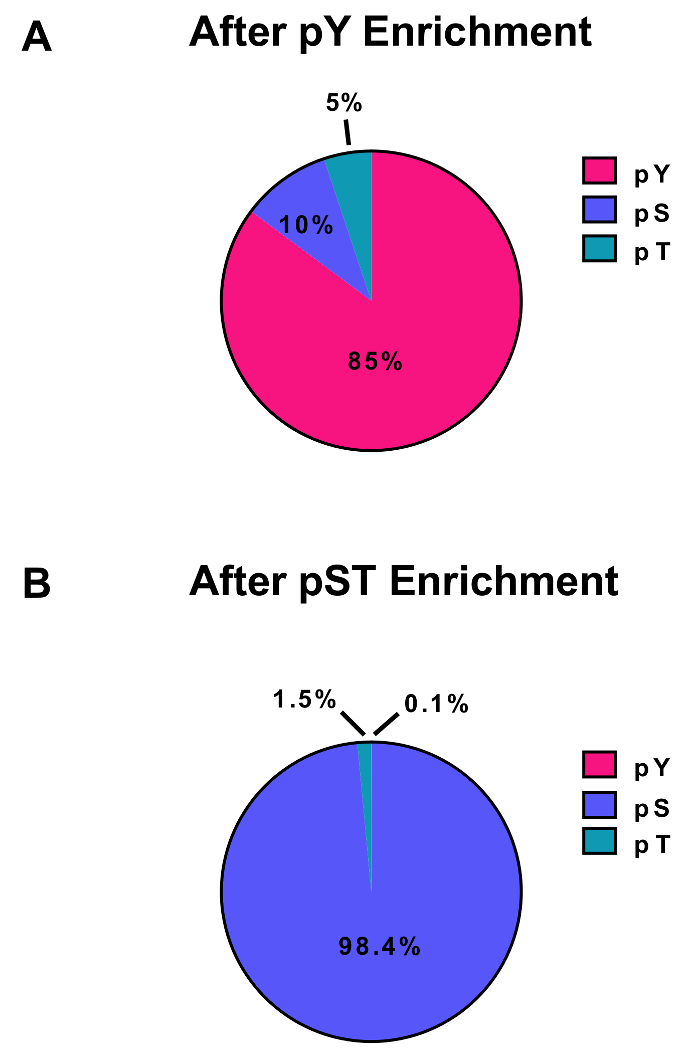
איור 3: העשרת pY ו pST phosphopeptides. לוחות אלה מראים האחוזים של pSTY phosphopeptides או (א) pY או (B) ההכנות העשרה pST. העשרת pY pY immunoprecipitation, טיטניום דיאוקסיד הביאו 85% phosphopeptides להיות pY פפטידים, אמנם רק 0.1% phosphopeptides ב העשרת pST pY. ערכים אלה נמשכו מן בוחן את פוספו (קובץ STY)Sites.txt של ניסוי נציג אחד לאחר סינון מזהמים רצפים הפוכה, phosphopeptides עם לוקליזציה הסתברויות פחות מ- 0.75. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
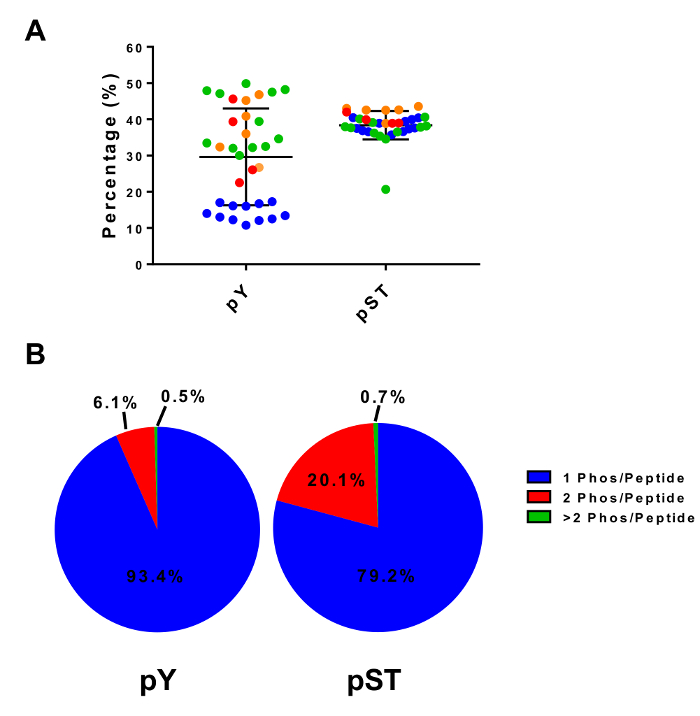
איור 4: Phosphopeptide העשרה עם טיטניום דו-חמצני. (א) מוצג אחוז שזוהו phosphopeptides (ביחס פפטידים סה כ) מדגימות ארבעה ניסויים נפרדים. (B) בלוח זה מציגה את ההרכב הממוצע של מונו - כפול-, phosphorylated-ריבוי פפטידים ארבעה ניסויים נפרדים. קווי השגיאה בחלונית A הן סטיות תקן. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
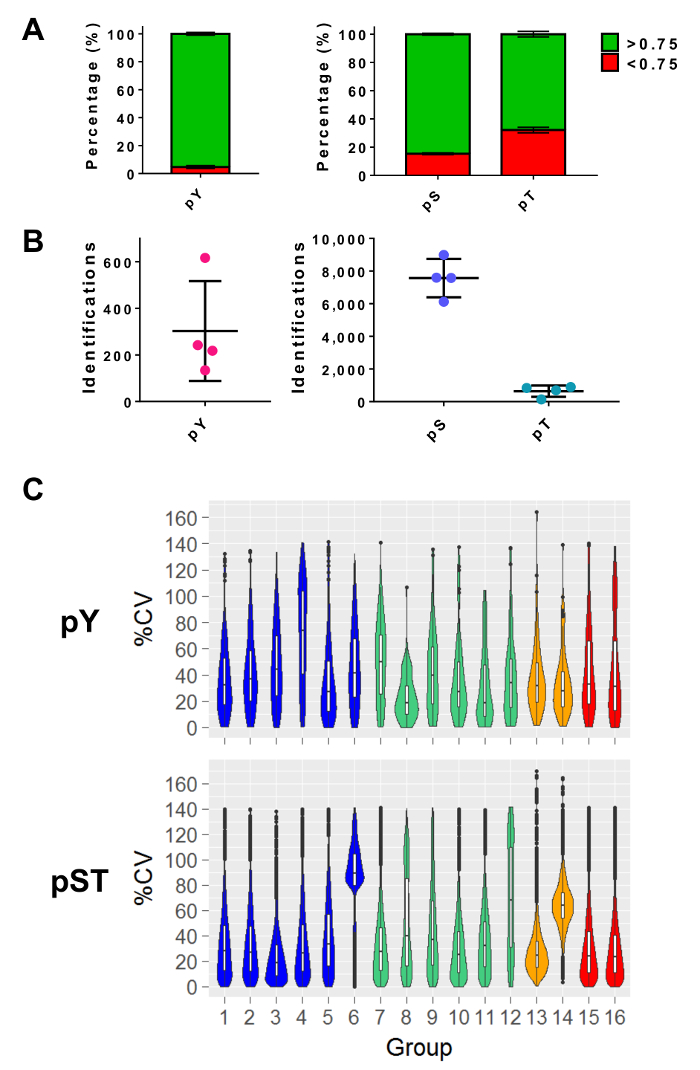
איור 5: צפוי ההזדהויות phosphoresidue. (א) לוח זה מראה היתרון לוקליזציה זירחון של מזהי pY העשרה (משמאל) ו pST העשרה (מימין). האחוז הממוצע של מזהי העונים על החיתוך ההסתברות > 0.75 הוא 93%, 75% ו- 52% pY, pS של pT, בהתאמה. (B) הממוצע מספר מזהים > 0.75 לוקליזציה ההסתברות היא 300 pY, 7,500 עבור pS ו- 640 עבור pT. (ג) לוח זה מציג כינור חלקות של המקדם אחוז של וריאציה (% CV) של phosphopeptides. הערכה של % CV בוצעה רק אם ערך עוצמת אות זוהה כל שכפול ביולוגי או קבוצה triplicate. נתונים נלקח ארבעה ניסויים נפרדים. קווי השגיאה פאנלים A ו- B הן סטיות תקן מן 34 pY ו pST 34, דגימות 4 ניסויים נפרדים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| מאגר | נפח | קומפוזיציה | |
| 6 מ' guanidinium כלוריד פירוק מאגר | 50 מ | 6 מ' guanidinium כלוריד, 100 מ מ טריס pH 8.5, פוספין טריס (2-carboxyethyl) 10 מ מ, 40 מ מ chloroacetamide, orthovanadate נתרן 2 מ מ, 2.5 מ מ נתרן רב-תכליתי, 1 מ מ β-glycerophosphate, 500 מ ג n-תמצית-גליקוזיד, אולטרה טהור מים לאמצעי אחסון | |
| רב-תכליתי נתרן 100 מ מ | 50 מ | 2.23 גרם נתרן ומים רב-תכליתי, מים אולטרא טהורים לאמצעי אחסון | |
| 1 מ' β-glycerophosphate | 50 מ | 15.31 גר' β-glycerophosphate, מים אולטרא טהורים לאמצעי אחסון | |
| 5% חומצה trifluoroacetic | 20 מ | להוסיף 1 מ"ל של 100% trifluoroacetic חומצה לתוך מים אולטרא טהורים 19 mL | |
| 0.1 חומצה trifluoroacetic % | 250 מ | הוסף 5 מ ל 5% חומצה trifluoroacetic מים אולטרא טהורים 245 מ | |
| מאגר • תנאי pY | 250 מ | 0.1% trifluoroacetic acetonitrile 40% חומצה, מים אולטרא טהורים לאמצעי אחסון | |
| מאגר • תנאי pST | 250 מ | 0.1% trifluoroacetic חומצה, 50% acetonitrile, מים אולטרא טהורים לאמצעי אחסון | |
| מאגר איגוד ה-IP | 200 מ | 50 מ מ טריס pH 7.4, 50 מ מ נתרן כלורי, מים אולטרא טהורים לאמצעי אחסון | |
| 25 מ מ אמוניום ביקרבונט, pH 7.5 | 10 מ | יתמוסס 19.7 מ"ג 10 מ"ל מים טהורים אולטרה סטרילי, pH 7.5 עם חומצת מלח N 1 (~ 10-15 µL/10 ml פתרון), להכין טרי | |
| מאגר פוספט 1 מ', ה-pH 7 | 1,000 מ | 423 mL 1 מ' נתרן dihydrogen פוספט, 577 mL 1 מ' סודיום פוספט | |
| מאגר equilibration | 14 מ | 6.3 מ ל acetonitrile, 280 חומצה trifluoroacetic 5% µL, חומצה לקטית 1740 µL, מים אולטרא טהורים 5.68 mL | |
| שטיפה מאגר | 20 מ | acetonitrile מ ל 9, 400 µL trifluoroacetic 5% חומצה, מים אולטרא טהורים 10.6 mL | |
| פתרון ספקטרומטר מסה | 10 מ | 500 µL acetonitrile, 200 µL 5% trifluoroacetic חומצה, מים אולטרא טהורים 9.3 מ | |
| מאגר A | 250 מ | 5 מ מ monopotassium פוספט (pH 2.65), 30% acetonitrile, 5 מ מ אשלגן כלורי, מים אולטרה-טהורים לאמצעי אחסון | |
| מאגר B | 250 מ | 5 מ מ monopotassium פוספט (pH 2.65), 30% acetonitrile, 350 מ"מ אשלגן כלורי, מים אולטרא טהורים לאמצעי אחסון | |
| 0.9% אמוניום מימה | 10 מ | 300 μL 29.42% אמוניה מימית, מים אולטרא טהורים 9.7 מ | |
טבלה 1: מאגרי ופתרונות. טבלה זו מציגה היצירות של מאגרים, פתרונות שימוש בפרוטוקול זה.
| הגדרות LC-MS/MS | ||
| פרמטר | pY הגדרה | pST הגדרה |
| לטעום טעינה (µL) | 5 | |
| טעינת קצב הזרימה (µL/דקה) | 5 | |
| קצב הזרימה הדרגתי (nL/דקה) | 300 | |
| צבע ליניארי (אחוז חומצה פורמית 0.16%, 80% לחצן מצוקה ב- 0.2% חומצה פורמית) | 4 - 15% למשך 5 דקות | 4 - 15% למשך 30 דקות |
| 15 - 50% במשך 40 דקות | 15 - 25% למשך 40 דקות | |
| 50 - 90% למשך 5 דקות | 25 - 50% 44 דקות | |
| 50 - 90% למשך 11 דקות | ||
| רזולוציית סריקה מלאה | 120,000 | |
| מספר יונים האינטנסיבי ביותר שנבחרו | 20 | |
| אנרגיית התנגשות היחסי (%) (HCD) | 27 | |
| הדרה דינמי (s) | 20 | |
בטבלה 2: הגדרות LC-MS- זוהי דוגמה של הגדרות LC-MS בניסוי phosphoproteomic רובה טיפוסי. הדגימות היו טעון על עמודה מלכודת. המלכודת הובא בשורה עם עמודת אנליטית. הגדרות אלה היו ממוטב באמצעות מערכת LC-MS המפורטים בטבלה של חומרים, ריאגנטים. הגדרות אלה צריכים להיות מותאמים למערכות אחרות LC-MS.
| הגדרות הפרמטר MaxQuant | ||
| הגדרה | פעולה | |
| פרמטרים המיועדות לקבוצות | ||
| סוג | סוג | בחר רגיל |
| ריבוי | מוגדר כ- 1 | |
| מצב מערכת העיכול | אנזים | בחר טריפסין/P |
| . מקס. אדמירל שלא נענתה | נקבע ל- 2 | |
| שינויים | שינויים משתנה | להוסיף פוספו (דיר חזירים) |
| כימות ללא תווית | כימות ללא תווית | בחר LFQ |
| LFQ מינימלית יחס ספירה | מוגדר כ- 1 | |
| LFQ מהיר | בדוק | |
| שונות | מחדש לכמת | בדוק |
| הפרמטרים הכלליים | ||
| רצפים | FASTA קבצים | Fasta בחר קבצים שהורדו מ- UniProt |
| שינויים קבועים | הוספת Carbamidomethyl (C) | |
| זיהוי עו ד | התאמה בין פועל | בדוק |
| חלון זמן התאמה | מוגדר כ- 5 דקות | |
| חלון הזמן יישור | מוגדר כ- 20 דקות | |
| להתאים תכונות לא מזוהה | בדוק | |
| חלבון כמת | ספירת יחס מינימלית | מוגדר כ- 1 |
| מיקומי התיקיות | לשנות בהתאם | |
טבלה 3: הגדרות תוכנה ניתוח MS- ב- MaxQuant, הפרמטרים המיועדות לקבוצות והעולמית בטבלה זו היו שנבחרו או מותאם. הפרמטרים האחרים נשארו על ברירת מחדל. הניסויים נערכו באמצעות הגירסה 1.5.3.30. הפרמטרים עשויים להשתנות מגירסה לגירסה, תוכנה תוכנה.
Discussion
לפני שימוש בפרוטוקול זה להעשיר עבור phosphopeptides, התייחסות מקיפה של עיצוב ניסיוני הוא קריטי. שימוש משכפל הביולוגי הוא השימוש במשאבים ספקטרומטר מסה. חסכונית יותר מאשר משכפל טכני. המספר של משכפל הדרושים תלויות באופן חלקי ההשתנות של הנתונים. מחקר שנערך לאחרונה הראה כי, תוך הגדלת מספר משכפל מעבר שלוש רק במעט מגדילה את מספר ההזדהויות, מספר ההזדהויות משמעותיים בין הקבוצות גדל עם עוד משכפל10.
בשל שפע phosphoproteins בתא התחתון, כמויות מספיקות של חלבון המוצא נחוצים לקבל phosphoproteome הכללית של דגימות סרטן הערמונית במצב גילוי. בניסויים אלה, שימשה 5 מ"ג של חלבון. כ חמש מנות 15-ס"מ כמעט confluent של תאים לספק מספיק חלבונים כקלט לתוך פרוטוקול זה, למרות שזה התאים תלויי-קו. באשר רקמת הגידול, התשואה הצפויה של חלבון הוא כ- 6-8% ממשקל רקמת. בהגדרה במבחנה , דגימת בקרה חיובית שיש לקחת בחשבון הוא התוספת של 1 מ מ vanadate למשך 30 דקות לפני הקציר התאים. Vanadate, מעכב תחרותי חלבון phosphotyrosyl פוספטאז, תשמר את זרחון טירוזין, ובכך מגדילים את מספר pY פפטיד ההזדהויות29.
עיכול נקייה היא צעד המפתח כדי למקסם את זיהוי phosphopeptide. בנוסף הבדיקה הכתם Coomassie, האחוזים של אדמירל החמיץ הנתונים ניתן להשתמש כדי להעריך את יעילות עיכול (איור 2). בקרת איכות תוכנה זמינה מנותחים אדמירל החמיץ ומדדים אחרים כדי להעריך את איכות הנתונים MS30. אמנם טריפסין שפרוטאזות הנפוץ ביותר, חלופיים זמינים5 כדי כתובות כיסוי פערי פרוטאום איפה אופטימלית פפטידים tryptic לא יכול להיות שנוצר31. ההגדרות של תוכנת ניתוח MS היה אז צריך להיות שונה בהתאם כדי להתאים לשינויים פרוטאזות.
הפרוטוקול מעסיקה immunoprecipitation (עבור pY העשרה) וכן טיטניום דו-חמצני (TiO2) להעשיר עבור phosphopeptides. גישות אלטרנטיביות כדי להעשיר עבור פפטידים כוללים קיבוע המתכת כרומטוגרפיית זיקה (IMAC), תחמוצות מתכת אחרות של תחמוצת מתכת כרומטוגרפיית (MOAC) כגון אלומיניום הידרוקסיד, לכידת זיקה מבוסס פולימר יון מתכת (PolyMAC) 5,12. מחקרים קודמים הראו כי העשרה שונים בשיטות להעשיר לאוכלוסיות שונות של phosphopeptides32. למשל, IMAC מעשיר פפטידים phosphorylated-רב יותר בזמן MOAC רצוי מעשיר של פפטידים מונו-phosphorylated33. התוצאות נציג של פרוטוקול זה משקפות התבוננות זו (איור 4B). פרסום האחרונות הוכיח כי שילוב IMAC ו MOAC באמצעות חומר היברידי יכולה פוטנציאל לספק כיסוי גדול של מינים phosphopeptide34. לפיכך, פרוטוקול זה יכול להיות שונה כדי לנצל שיטות העשרה אחרות במקביל כדי לאפשר ניתוח phosphoproteomic אפילו יותר מקיף.
חבילת התוכנות26 MaxQuant משמש כדי לנתח את הנתונים MS פרוטוקול זה, אך יישומים מסחריים35 זמינים גם עבור phosphopeptide וכימות. זיהוי phosphopeptide, הסתברות לוקליזציה הקיצוץ מוחל. מסנן זה מבוצע כדי לבחור את phosphopeptides עם ביטחון גבוהה (קרי, גדול מ- 0.75) phosphoresidue זיהוי10,28. במילים אחרות, ההסתברות מסוכם של כל שאריות אחרים, העלולים להכיל פוטנציאל פוספו-הקבוצה היא פחות מ- 0.25. הפסקת הזה יכול יגודל להגדיל את לכתחילה של הבחירה phosphopeptide. לגבי מספר ההזדהויות, המספר הצפוי של פפטידים pY הוא מאות, בעוד המספר הצפוי של פפטידים pST היא באלפים גבוהה. ערכים אלו משקפות את חלוקת phosphoproteome שנצפו בעבר כ- 2%, 12%, ו 86% phosphosites איפה pY, pT ו- pS, בהתאמה28.
אם השלבים העשרה pY ו pST מבוצעים במקביל, ניתן להשלים את השלבים הכנה מדגם בפרוטוקול בשישה ימים. על-ידי זיווג עם כלי רב עוצמה של MS, phosphopeptide פרוטוקולים העשרה כגון זה מספק גישה גלובלית עבור מדענים לאיסוף נתונים כדי לנתח את phosphoproteome בשדה מחקר המתאימים שלהם.
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים חברי המעבדה דרייק למתן ייעוץ והזנת על כתב היד. אנו מודים גם חברי ביולוגי מסה ספקטרומטר מתקן של רוברט ווד ג'ונסון רפואה ראטגרס, את מדינת אוניברסיטת ניו ג'רזי, על ייעוץ וביצוע ספקטרומטר מסה על הדגימות שלנו. לארי סי צ'אנג נתמך על ידי הלאומית המכון כללי רפואי למדעים של מכוני הבריאות הלאומיים תחת מספר פרס T32 GM008339. תומאס ג'י Graeber נתמך על ידי NCI/NIH (ספורה של הערמונית סרטן P50 CA092131; P01 CA168585) ואת פרס מלומד (RSG-12-257-01-TBE) מחקר החברה האמריקנית לסרטן. ג'סטין מ דרייק נתמך על-ידי את המחלקה של ההגנה הערמונית סרטן מחקר תוכנית W81XWH-15-1-0236, הערמונית סרטן יאנג פרס החוקר, קרן בריאות ניו ג'רזי ו פרס טייס יוזמה של רפואה דיוק עובדת פה מכון הסרטן של ניו ג'רזי.
Materials
| Name | Company | Catalog Number | Comments |
| Ultra-Low Temperature Freezer | Panasonic | MDF-U76V | |
| Freezer -20 °C | VWR | scpmf-2020 | |
| Swing rotor bucket | ThermoFisher Scientific | 75004377 | |
| Vacuum manifold | Restek | 26080 | |
| Lyophilizer | Labconco | 7420020 | |
| CentriVap Benchtop Vacuum Concentrator | Labconco | 7810010 | |
| End-over-end rotator | ThermoFisher Scientific | 415110Q | |
| Razor blade | Fisher Scientific | 620177 | |
| Amicon Ultra-15 Centrifugal Filter Units | Millipore Sigma | UFC901024 | |
| Glass culture tubes | Fisher Scientific | 14-961-26 | |
| Parafilm | Fisher Scientific | 13-374-12 | |
| 20G needle | BD | B305175 | |
| Kimwipes | Fisher Scientific | 06-666A | |
| Screw cap cryotube | ThermoFisher Scientific | 379189 | |
| Nunc 15 mL conical tubes | ThermoFisher Scientific | 12-565-268 | |
| Gel loading tips | Fisher Scientific | 02-707-181 | |
| Millipore 0.2 µm spin filter | Millipore Sigma | UFC30GVNB | |
| Low protein-binding Eppendorf tubes | Eppendorf | 22431081 | |
| anti-Phosphotyrosine, Agarose, Clone: 4G10 | Millipore Sigma | 16101 | |
| 27B10.4 antibody | Cytoskeleton | APY03-beads | |
| Peptide assay kit | Thermo Scientific | 23275 | Step 7 |
| TopTip | PolyLC Inc | TT200TIO.96 | Steps 5 and 9 |
| SCX columns (PolySULFOETHYL A) | PolyLC Inc | SPESE1203 | |
| 3 mL syringe | BD | 309657 | |
| Trifluoracetic Acid (TFA) | Fisher Scientific | PI-28904 | |
| Acetonitrile (ACN) | Fisher Scientific | A21-1 | |
| Lactic acid | Sigma-Aldrich | 69785-250ML | |
| Ammonium Hydroxide | Fisher Scientific | A669S-500 | |
| Potassium Phosphate Monobasic | Fisher Scientific | BP362-500 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Calcium Chloride Dihydrate | Fisher Scientific | BP510-500 | |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypsin, TPCK Treated | Worthington Biochemicals | LS003740 | |
| Lysyl Endopeptidase | Wako Pure Chemical Industries, Ltd. | 125-05061 | |
| MonoTip | PolyLC Inc | TT200TIO.96 | Step 10 |
| ZipTip | MilliporeSigma | ZTC18S096 | Step 6 |
| nanoEase, MZ peptide BEH C18, 130A, 1.7 μm, 75 μm x 20 cm | Waters | 186008794 | Step 11: analytical column |
| Acclaim PepMap 100 C18 LC Columns | ThermoFisher Scientific | 164535 | Step 11: trap column |
| Ultimate 3000 RLSCnano System | Dionex | ULTIM3000RSLCNANO | Step 11 |
| Q Exactive HF | ThermoFisher Scientific | IQLAAEGAAPFALGMBFZ | Step 11 |
| MilliQ water | deionized water used to prepare all solutions and bufferes | ||
| Sonic Dismembrator | Fisher Scientific | FB-120 | sonicator |
| Polytron System PT | Kinematica AG | PT 10-35 GT | homogenizer |
References
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Paller, C. J., Antonarakis, E. S. Management of biochemically recurrent prostate cancer after local therapy: evolving standards of care and new directions. Clinical Advances in Hematology & Oncology. 11 (1), 14-23 (2013).
- Lowrance, W. T., Roth, B. J., Kirkby, E., Murad, M. H., Cookson, M. S. Castration-resistant prostate cancer: AUA guideline amendment 2015. The Journal of Urology. 195 (5), 1444-1452 (2016).
- Domon, B., Aebersold, R. Options and considerations when selecting a quantitative proteomics strategy. Nature Biotechnology. 28 (7), 710-721 (2010).
- Zhang, Y. Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. Protein analysis by shotgun/bottom-up proteomics. Chemical Reviews. 113 (4), 2343-2394 (2013).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- Bantscheff, M., Lemeer, S., Savitski, M. M., Kuster, B. Quantitative mass spectrometry in proteomics: critical review update from 2007 to the present. Analytical and Bioanalytical Chemistry. 404 (4), 939-965 (2012).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Rubbi, L., et al. Global phosphoproteomics reveals crosstalk between Bcr-Abl and negative feedback mechanisms controlling Src signaling. Science Signaling. 4 (166), ra18 (2011).
- Hogrebe, A., et al. Benchmarking common quantification strategies for large-scale phosphoproteomics. Nature Communications. 9 (1), 1045 (2018).
- Rush, J., et al. Immunoaffinity profiling of tyrosine phosphorylation in cancer cells. Nature Biotechnology. 23 (1), 94-101 (2005).
- Fila, J., Honys, D. Enrichment techniques employed in phosphoproteomics. Amino Acids. 43 (3), 1025-1047 (2012).
- Mertins, P., et al. Proteogenomics connects somatic mutations to signalling in breast cancer. Nature. 534 (7605), 55-62 (2016).
- Drake, J. M., et al. Phosphoproteome integration reveals patient-specific networks in prostate cancer. Cell. 166 (4), 1041-1054 (2016).
- Lue, H. W., et al. Metabolic reprogramming ensures cancer cell survival despite oncogenic signaling blockade. Genes & Development. 31 (20), 2067-2084 (2017).
- Francavilla, C., et al. Phosphoproteomics of primary cells reveals druggable kinase signatures in ovarian cancer. Cell Reports. 18 (13), 3242-3256 (2017).
- Zhang, H., et al. Integrated proteogenomic characterization of human high-grade serous ovarian cancer. Cell. 166 (3), 755-765 (2016).
- Skaggs, B. J., et al. Phosphorylation of the ATP-binding loop directs oncogenicity of drug-resistant BCR-ABL mutants. Proceedings of the National Academy of Sciences of the United States of America. 103 (51), 19466-19471 (2006).
- Zimman, A., et al. Activation of aortic endothelial cells by oxidized phospholipids: a phosphoproteomic analysis. Journal of Proteome Research. 9 (6), 2812-2824 (2010).
- Zimman, A., Berliner, J. A., Graeber, T. G. Phosphoproteomic analysis of aortic endothelial cells activated by oxidized phospholipids. Methods in Molecular Biology. , 53-69 (2013).
- Humphrey, S. J., Azimifar, S. B., Mann, M. High-throughput phosphoproteomics reveals in vivo insulin signaling dynamics. Nature Biotechnology. 33 (9), 990-995 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Meyer, T. S., Lamberts, B. L. Use of coomassie brilliant blue R250 for the electrophoresis of microgram quantities of parotid saliva proteins on acrylamide-gel strips. Biochimica el Biophysica Acta. 107 (1), 144-145 (1965).
- Bergstrom Lind, S., et al. Immunoaffinity enrichments followed by mass spectrometric detection for studying global protein tyrosine phosphorylation. Journal of Proteome Research. 7 (7), 2897-2910 (2008).
- Pinkse, M. W., Uitto, P. M., Hilhorst, M. J., Ooms, B., Heck, A. J. Selective isolation at the femtomole level of phosphopeptides from proteolytic digests using 2D-NanoLC-ESI-MS/MS and titanium oxide precolumns. Analytical Chemistry. 76 (14), 3935-3943 (2004).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nature Biotechnology. 26 (12), 1367-1372 (2008).
- Cox, J., et al. Andromeda: a peptide search engine integrated into the MaxQuant environment. Journal of Proteome Research. 10 (4), 1794-1805 (2011).
- Olsen, J. V., et al. Global, in vivo, and site-specific phosphorylation dynamics in signaling networks. Cell. 127 (3), 635-648 (2006).
- Huyer, G., et al. Mechanism of inhibition of protein-tyrosine phosphatases by vanadate and pervanadate. The Journal of Biological Chemistry. 272 (2), 843-851 (1997).
- Bielow, C., Mastrobuoni, G., Kempa, S. Proteomics quality control: quality control software for MaxQuant results. Journal of Proteome Research. 15 (3), 777-787 (2016).
- Swaney, D. L., Wenger, C. D., Coon, J. J. Value of using multiple proteases for large-scale mass spectrometry-based proteomics. Journal of Proteome Research. 9 (3), 1323-1329 (2010).
- Bodenmiller, B., Mueller, L. N., Mueller, M., Domon, B., Aebersold, R. Reproducible isolation of distinct, overlapping segments of the phosphoproteome. Nature Methods. 4 (3), 231-237 (2007).
- Leitner, A., Sturm, M., Lindner, W. Tools for analyzing the phosphoproteome and other phosphorylated biomolecules: a review. Analytica Chimica Acta. 703 (1), 19-30 (2011).
- Yang, D. S., et al. Design and synthesis of an immobilized metal affinity chromatography and metal oxide affinity chromatography hybrid material for improved phosphopeptide enrichment. Journal of Chromatography A. 1505, 56-62 (2017).
- Al Shweiki, M. R., et al. Assessment of label-free quantification in discovery proteomics and impact of technological factors and natural variability of protein abundance. Journal of Proteome Research. 16 (4), 1410-1424 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved