Method Article
전립선 암에 있는 Phosphoproteome를 조사 하기 위해 양적 라벨 무료 질량 분석으로 결합 된 Phosphopeptide 농축
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜에는 전립선 암 세포 선 또는 단백질 질량 분석 기반 을 통해 phosphoproteome의 분석에 대 한 조직에서 phosphopeptides을 풍부 하 게 추출 하는 절차를 설명 합니다.
초록
Phosphoproteomics phosphorylated 단백질의 대규모 연구를 포함 한다. 단백질 인 산화 많은 신호 전달 경로에서 중요 한 단계 이며, 단단히 kinases와 가수분해에 의해 규제 됩니다. 따라서, 특성화는 phosphoproteome 소설 목표 및 종양 치료를 위한 생체 식별에 대 한 통찰력을 제공할 수 있습니다. 질량 분석 세계적으로 감지 하 고 독특한 인 산화 이벤트의 수천을 계량 하는 방법을 제공 합니다. 그러나, phosphopeptides는 비-phosphopeptides, 더 도전 하 생 화 확 적인 분석 보다 훨씬 풍부. 이 한계를 극복 하기 위해 방법 질량 분석 분석 전에 phosphopeptides를 풍부 하 게 하는 필요 합니다. 우리는 추출 및 펩 티 드, phosphotyrosine (평)와 phosphoserine/트레오닌 (pST) 펩 티 드 항 체 기반을 사용 하 여 또는 이산화 티타늄 (티 오2)에 대 한 농축 뒤를 조직에서 단백질을 소화 하는 절차를 설명-기반 농축 방법입니다. 샘플 준비 질량 분석 후, 우리는 연속적으로 식별 하 고 phosphopeptides 액체 크로마토그래피-질량 분석 및 분석 소프트웨어를 사용 하 여 계량.
서문
약된 165000 새로운 케이스 및 약 29000 사망자 2018 대표 하는 가장 일반적인 암과 미국1에 남성 암 관련 된 죽음의 두번째 주요한 원인이 전립선 암 때문에 발생 합니다. 전립선 암의 초기 단계는 기관 수감 질병, 10 년 재발 률 20%와 40% 전립선을 받아야 하는 환자와 30%와 50% 방사선을 받을 환자 사이 사이의 절제술 또는 방사선 치료로 치료할 수 있다 치료2. 때문에 안 드로 겐 성장을 위한 신호에 의존 하는 전립선 암, 수술, 화학적 거세 치료 또한 위험이 높은 환자에 대 한 고용 됩니다. 그러나, 재발 발생 암 안 드로 겐 박탈 요법을 생화학 적 재발에 의해 입증 이상 응답 어디에서 혈 청 전립선 특정 항 원 다시 상승 합니다. 이 시점에서 진행, 전이 종종 감지 됩니다. 이 고급 단계, 전이성 거세 내성 전립선 암 이라고 예 지가 2 년3보다는 더 적은의 평균 생존 시간이 질병의 치명적인 형식을 나타냅니다. 몇 가지 치료 옵션이 docetaxel 같은 화학 요법 taxane 기반 뿐만 아니라 enzalutamide와 abiraterone, 2 세대 antiandrogens를 포함 하 여 단계의 질병에 사용할 수 있습니다. 사용 가능한 트리 트 먼 트에 불구 하 고 질병 종종 진행. 따라서, 발견과 새로운 치료 modalities의 개발 고급 질환 전립선 암 환자 치료를 개선 하는 데 필요한 있습니다.
질량 분석 (MS)-펩 티 드 analytes4의 수천 수백의 검색을 통해 proteome의 글로벌 분석을 제공 하는 기반된 접근. 특히, 식별 및 펩 티 드4,5의 수천의 정량 발견 proteomics로 알려진 또한 데이터 종속 수집 (DDA), 얻을 수 있습니다. MS 기반의 검색 proteomics 더 내려 proteomics, 그대로 단백질 특징 및 상향식 (로 알려진 또한 샷건) 단백질, 펩 티 드 단백질5의 특성을 분석 하 구분 된 될 수 있습니다. 따라서, 샷건 proteomics에 베이스 단계에서에서 일어난다 단백질 펩 티 드로 다니엘을 선행 하는 MS 분석 샘플 준비. 결국에는 펩 티 드 단백질 확인을 위해 다시 매핑할 수 데이터베이스 검색 수행 됩니다. 레이블 없는 뿐만 아니라 몇몇 동위 원소-라벨 [예를 들어, 안정 동위 원소 세포 배양 (SILAC)에 있는 아미노산에 의해 라벨] 방법은 사용할 수 있습니다 샘플6,7사이 펩 티 드를 양적 비교 하. 동위 원소 라벨 기술 금 동안, 레이블 자유로운 방법 유사한 정량화 정확도8,9 증명 그리고 감도 및 특이성10비교 장단점. 레이블 없는 정량 큰 범위를 제공 하 고 반면 레이블 기반 방법 비용 및 멀티플렉싱 용량6,,78에 의해 제한 됩니다 많은 더 많은 샘플, 사이 비교를 허용.
또한, 샷건 MS가 포스트 번역 상 수정 (PTMs) 인 산화11등도 사용할 수 있습니다. 총 펩 티 드에 비해 phosphopeptides의 더 낮은 화학 량 론 특성, 여러 가지 방법은 항 체 기반 immunoprecipitation phosphotyrosine (pY) 펩 티 드의 이산화 티타늄 (티 오2 포함 하 여 phosphopeptides에 대 한 풍부 하 게 채용 ), 및 금속 친화성 크로마토그래피 (IMAC)5,12움직일. 단백질 인 산화 신호 경로, 샷건 phosphoproteomics 유 방13, 전립선14, 신장15를 포함 하 여 다른 암에 변화를 신호 하는 세포를 조사 하는 연구원 수 많은 세포에서 중요 한 단계 이므로 그리고 난소,16,17 암 생물학을 이해 하 고 치료에 대 한 잠재적인 새로운 목표를 식별 하는.
이 레이블 없는 샷건 phosphoproteomic 방법은 Graeber 그룹18,,1920에 의해 건축 하 고 세련 된에 따라 이전 작품 이었다. 이 프로토콜 추출 및 펩 티 드로 단백질 및 조직에서 phosphoproteins의 소화를 설명 함으로써 시작 됩니다. 우리는 다음 세부 평 펩 티 드 항 체 특정 phosphotyrosine 사용 하 여 티 오2의 농축. 우리는 또한 강력한 양이온 교환 (SCX) 뒤에 티 오2를 사용 하 여 phosphoserine/트레오닌 (pST) 펩 티 드의 농축을 설명 합니다. 이 프로토콜은 MS 시설 샘플의 제출 및 확인 하 고 phosphopeptides 및 그들의 해당 phosphoproteins 계량 MS 분석 소프트웨어를 사용 하 여 마칩니다. 이 프로토콜의 응용 프로그램은 다른 암과 종양 이외의 필드에 전립선 암 넘어 확장할 수 있습니다.
프로토콜
이 종이 식 종양을 사용 하 여 실험 승인 되었다 Rutgers 대학 기관 동물 관리 및 사용 위원회에 의해 설정으로 앞뒤로 국립 보건원의 지침에 따라.
1. 단백질 추출
- 세포의 용 해 버퍼 (표 1)를 준비 합니다. (볼륨 샘플 수확의 수에 따라 달라 집니다.) 체 외에서 세포 샘플에 대 한 1.2 단계를 진행 합니다. 종양 조직에 대 한 1.3 단계를 진행 합니다.
-
세포를 수확
- 50 mL 원뿔 튜브에 세포를 수집 하 고 700 x g 4 ° c.에서 5 분 동안에 그들을 회전합니다 삭제는 상쾌한 고 얼음에 펠 릿을 유지. 한 펠 릿으로 세포를 수집 하는 모든 요리에 대해이 단계를 반복 합니다. (일반적으로 5 mg의 단백질, 세포의 약 5 거의 confluent 15 cm 요리 필요 하지만이 셀 라인에 종속 될 수 있습니다 각 탐정에 의해 실험적으로 결정 되어야.)
- PBS를 발음 하기 전에 700 x g 4 ° C에서 5 분에 냉장된 인산 염 버퍼 식 염 수 (PBS)와 스핀 30 mL와 펠 릿을 세척. 셀 펠 릿을 사용 하는 단백질의 5 밀리 그램 당 세포의 용 해 버퍼의 1.5 mL를 추가 합니다. 몇 번 위아래로 피펫으로입니다. 1.4 단계로 건너뜁니다.
-
수확 하는 조직
- 종양 무게 고 문화 테스트 튜브에 조직의 모든 100 밀리 그램에 대 한 차가운 세포의 용 해 버퍼의 2 개 mL를 추가 합니다. (일반적으로, 조직 젖은 무게의 50 ~ 150 mg 필요 합니다.)
- 균질 lysate 사용 하는 휴대용 또는 벤치탑 균질 화기 (15 2 x 펄스 s.) 첫 번째 샘플을 하기 전에 및 연속에서 10% 표 백제, 70% 에탄올, 그리고 이온된 수를 사용 하 여 샘플 간의 균질 화기를 청소.
- 줄이고 알, 5 분 동안 95 ° C에서 무 균된 샘플을 열. 다음 15 분 동안 얼음에 그들을 냉각 하십시오. 얼음, lysate 3 x sonicate (즉, 30에 대 한 펄스 펄스 사이 60 s 일시 중지 s). 샘플 수 없습니다 점성 또는 clumpy이 시점에서. 5 분2195 ° C에서 lysate 열.
- 15 분에 대 한 15 ° C에서 3500 x g에서 진동 물통 회전자를 사용 하 여 동일한 쥡니다에 lysate 튜브 원심 분리기는 상쾌한을 수집 하 고 펠 릿을 삭제.
- Bradford 분석 결과22를 수행 하 여 단백질 농도 결정 합니다. 필요한 경우, 세포의 용 해 버퍼 5 mg/ml lysate 희석. -20 ° c.에 그것을 저장합니다
참고: 실험 수 수 일시 중지 여기. -80 ° C에서 샘플을 동결 하 고 나중에 계속 합니다.
2. lysate 소화
- 12-fold 샘플을 희석 100mm 트리 스를 사용 하 여 (pH = 8.5) guanidinium의 양을 줄이기 위해. 부동 한 소화의 효과 최소화 하기 위해 동일한 볼륨에 모든 샘플을 희석. 12.5 µ g는 소화의 Coomassie 스테인드 젤23에 확인 lysate를 저장 합니다.
- 5 mg의 단백질, Lysyl Endopeptidase (리스-C)의 10 µ g을 추가 하 고 5-6 h. 조정 산도 여 8.0에 대 한 실 온에서 품 어 트리 (pH ~ 11) untitrated 1 M를 추가.
- L-1-tosylamido-2-phenylethyl chloromethyl 케 톤 (TPCK)의 1 mg/mL를 준비-1 m m HCl (20 m m CaCl2)에 트립 신을 취급. 트립 신: 단백질 비율을 1: 100에는 트립 신을 추가 하 고 37 ° C 3 h에서 품 어.
- 2.3 단계에서 신선한 trypsin의 동일한 금액을 추가 합니다. 품 어 그것은 37 ° C에서 하룻밤.
- 12.5 µ g는 소화의 Coomassie 스테인드 젤23에 완전 한 소화를 확인 lysate를 저장 합니다.
3. 반전 단계 추출
- Lysate 볼륨을 기록 합니다. 15 mL 10 kDa 컷오프 필터를 사용 하 여 샘플을 필터링 합니다. Retentate 볼륨 미만 250 µ L (이 약 45-60 분 소요) 될 때까지 스윙 양동이 터를 사용 하 여 g (또는 고정된 각도 터에 3500 x g) 3500에서 샘플 15 ° C에서 원심. 흐름을 통해 수집 하 고는 retentate를 삭제.
참고: 실험 수 수 일시 중지 여기. -80 ° C에서 샘플을 동결 하 고 나중에 계속 합니다. - 샘플을 시 어 지 다, lysate의 mL 당 5 %trifluoroacetic 산 (TFA)의 약 20 µ L를 추가 합니다. 그들을 잘 혼합 하 고 산도 스트립을 사용 하 여 샘플 pH를 측정 한다. 2.5 5%를 사용 하 여 pH를 조정 TFA.
- 진공 매니폴드를 C-18 열의 더 짧은 끝을 연결 합니다. 17 34 kPa (또는 제조업체의 지침에 따라) 진공을 설정 합니다. 유리 펫을 사용 하 여 100% 이기 (ACN)의 3 mL와 함께 열 젖은. 건조 열을 게 하지 마십시오.
- 유리 를 사용 하 여 펫, equilibrate 6 mL의 0.1% TFA 2 x 3 mL로 열. 열에 acidified 샘플을 로드 합니다. 한 번에 이상의 3 mL를 추가 하지 마십시오. 초당 약 1 ~ 2 방울을 대상으로 진공을 조정 합니다.
- 유리 를 사용 하 여 펫, 0.1% TFA 3 x 3 mL로 적용의 9 mL와 함께 열을 씻어. 40%의 2 mL와 함께 열을 elute ACN, 0.1 %TFA. 유리 문화 관에 두 2 mL 분수를 수집 합니다. 열을 삭제 합니다.
- Parafilm eluate 튜브 커버 및 20 G 바늘을 사용 하 여 덮개에 3-5 구멍을 펀치. 그것은 완전히 고체 때까지 적어도 30 분을 위한 드라이 아이스에 eluate를 고정 합니다.
- Lyophilize 분수 하룻밤. 다음 날, 샘플은는 lyophilizer를 중지 하기 전에 완전히 건조 되었는지 확인 합니다. 튜브-80 ° c.에 섬세 한 물티슈 50 mL 원뿔 튜브에 저장
참고: 실험 수 수 일시 중지 여기.
4. Immunoprecipitation과 펩 티 드24 평의 농축
- 각 부분에 얼음 처럼 차가운 immunoprecipitation (IP) 바인딩 버퍼의 0.5 mL로 동결 건조 된 분말을 resuspend. 두 번째 부분에서 첫 번째 분수 0.5 mL 물의 resuspension 볼륨을 전송 하 여 분수를 풀 고 피 펫 팁을 저장 합니다. (아래로 pipetting) 대신 적극적으로 소용돌이 샘플 3.6 mL 나사 모자 cryotube에 그것을 전송 하기 전에 완전히 용 해 되도록.
- 4.1 단계에서., 린스 IP 바인딩 버퍼 (표 1)의 또 다른 0.5 mL 동결은 튜브 각 튜브에. 3.6 mL 스크류 캡 튜브 샘플 손실 최소화 하기 위해 동일한 피 펫 팁을 사용 하 여 전송 솔루션. 린스 1, x 2 mL (단백질의 5 mg)에 대 한 최종 물의 resuspension 볼륨 만들기를 반복 합니다. 측정 샘플 pH 약 7.4 있는지 확인 합니다. 그것은 너무 산 성, 반복적으로 1 M 트리 스 (untitrated, pH 11 ~)의 10 µ L를 추가 합니다. 그것은 너무 기본, 반복적으로 희석 HCl (1시 25분 또는 1: 100)의 10 µ L를 추가 합니다.
-
미리 세척 (lysate 시작 5 mg)에 대 한 평 구슬
- 4G 10 항 체의 25 µ g와 27B10.4 항 체의 12.5 µ g 샘플 당 필요 합니다. p200 사용 후 별도 microcentrifuge 튜브로 항 체를 전송, 얼음 처럼 차가운 IP 바인딩 버퍼의 450 µ L와 항 체를 씻어 잘라 팁 플라스틱 2 배. 4 ° C와는 상쾌한 밖으로 aspirate에서 1 분 동안 100 x g에서 원심 그들.
- IP 바인딩 버퍼를 사용 하 여 0.5 mg/mL의 농도 재고를 구슬 resuspend (하지 소용돌이 구슬 할.) 단일 튜브에 aliquoting 필요한 슬러리 (4G 10 항 체 슬러리 및 샘플 당 25 µ L 27B10.4 항 체 슬러리의 50 µ L), 후에 4 ° c.에 1 분 동안 200 x g 재고 원심 분리기 튜브 아래로 회전 상쾌한와 측 벽 반환 구슬 냉장고에 저장 하기 전에 씻으십시오.
- 미리 씻어 pY 구슬 나사 모자 cryotubes에서 resuspended 샘플 솔루션에 추가 합니다. 품 어 그들 이상 끝 회전에 4 ° C에서 하룻밤.
- 섬세 한 지우기 늘어서 50 mL 원심 분리기 튜브에 나사 모자 cryotubes를 배치 합니다. PST 펩 티 드에 대 한 풍부 하 게 하는 데 사용 됩니다 상쾌한 저장 1 분에 100 x g에서 구슬 아래로 회전 합니다. (태평양 표준시에 대 한 농축 단계 7에서 시작 하 고 평 펩 티 드 처리를 병렬로 수행할 수 있습니다).
- IP 바인딩 버퍼의 300 µ L와 구슬 resuspend 2 mL microcentrifuge 튜브에 그들을 전송 하 고 4 ° c.에 1 분 x 100g에 스핀 다운
- 린스는 인큐베이션 IP 바인딩 버퍼의 200 µ L x 3 튜브. 내용을 전송 같은 Microcentrifuge 튜브 각 시간. 다음 아래 그들을 회전 합니다.
- microcentrifuge에 구슬 IP 바인딩 버퍼의 500 µ L x 3 튜브와 1 분 x 100g에 스핀 다운 세척. 다음 씻어 구슬 4 x 25 mM NH4HCO3, pH 7.5, 및 그들에서 1 분 사용 신선한 25mm NH4HCO3 솔루션에 대 한 100 x g에서 분말 때마다 스핀의 450 µ L.
- 원심 1500 x g 1 분 사용에 구슬 구슬의 표면 보다 약간 젤 로드 팁의 끝을 담거 서는 상쾌한을 완전히 제거 하는 젤 로드 팁.
- 0.1%의 비드 볼륨 x 4 추가 TFA는 구슬에 (즉, 0.1%의 300 µ L을 추가 pY 비드 슬러리의 75 µ g에 대 한 TFA). 그들을 잘 혼합 하 고 37 ° c.에 15 분 동안 1000 rpm에서 thermomixer에 혼합물을 품 어
- 0.2 µ m 회전 필터는 물의 resuspension 전송. 신속 하 게 차입 튜브 아래로 회전 하 고 P10 피펫으로 사용 하 여 동일한 회전 필터에 잔류 볼륨을 전송. 1 분에 대 한 850 x g에서 회전 필터 다운 스핀 낮은 단백질 바인딩 microcentrifuge 관에는 차입을 전송 합니다. 진공 집중 건조 하 eluate 하룻밤 40 ° C에서 열 시간 300 분의.
참고: 실험 수 수 일시 중지 여기. -80 ° C에서 샘플을 동결 하 고 나중에 계속 합니다.
5. 이산화 티타늄 농축25 평 펩 티 드의
- 50%의 200 µ L에서 phosphopeptides 아래로 말린 resuspend ACN, 0.1 %TFA. 소용돌이 원심 그들 10000 x g에서 30 s. 반복에 대 한 그들을 잘 resuspend에 1 x이.
- 용량이 200 µ L 샘플에 대 한 팁에 포함 된 티 오2 비즈를 준비.
- 끝으로 자료를 이동 팁의 작은 팁 사이드에 부드럽게 누릅니다. 100%의 200 µ L을 추가 하 여 팁을 린스 ACN, 팁을 반전 하 고 뚜껑 쪽으로 액체를 이동 하려면 작은 끝을 터치 하 여 다음.
- 끝의 작은 끝을 잘라 면도날을 사용 하 고 낮은 단백질 바인딩 튜브위에 그것을 배치. (폴리스 티 렌 튜브는 TiO2 튜브의 측면에 붙어 것입니다 사용 하지 마십시오.) 뚜껑을 제거 하 고 나머지 ACN 밖으로 급락 micropipette 삽입. 100%의 200 µ L 가진 세척을 반복 = 뉴스. TiO2 구슬 지금 다음 단계에 대 한 낮은 단백질 바인딩 튜브에 있습니다.
- 전제 티 오2 100% ACN 2의 500 µ L x. 피펫으로 구슬 용 매 혼합 그것. 1 분에 100 x g에서 원심 그들.
- 티 오2 0.2 M 나트륨 인산 염 버퍼 (pH ~ 7)의 500 µ L 조건 2 배. 평형의 300 µ L와 구슬 버퍼 3 배 세척. 티 오2 매우 밀도 때문에, 구슬 신속 하 게 정착 됩니다.
- 50%의 400 µ L 추가 ACN, 0.1 %TFA 낮은 단백질 바인딩 튜브에 이어서 추가 84 µ L 젖 산의. 낮은 단백질 바인딩 튜브에 resuspended phosphopeptides를 전송 하 고는 이상 끝 회전자를 사용 하 여 실 온에서 1 h에 대 한 그들을 품 어.
- 그들을 작은 1 분 x 100g에 구슬 원심 재래식 버퍼 (표 1) 2의 300 µ L로 그들을 씻어 x 100 x g 1 분 동안에 그들을 아래로 회전 하는 고.
- 300 구슬 린스 rinsing의 µ L 버퍼 2 배. 0.2 µ m 회전 필터에 그들을 전송. 1500 x g 1 분 동안에 그들을 회전 합니다.
- 낮은 단백질 바인딩 깨끗 한 1.5 mL 튜브에 필터 단위를 전송. 내용 2 elute 0.9% NH3 H2오 측정 산도 스트립, 10와 11 사이 있어야 한다 pH에서에서의 200 µ L x. 진공 건조 하룻밤 암모니아를 증발 하 게 eluate 집중.
6. 담 MS 분석 평 펩 티 드
- 0.1%의 15 µ L 함께 phosphopeptides reconstitute vortexing와 30에 대 한 10000 x g에서 centrifuging TFA 그들을 resuspend에 s. 1이 x 잘 그들을 resuspend를 반복 합니다. 위쪽 및 아래쪽 플라스틱 하지 않습니다.
- 5 µ g의 바인딩 용량 C-18 팁을 사용 하 여 샘플을 청소 하 고 제조 업체의 프로토콜에 따라.
- 완전히 진공 농도 의해 차입 볼륨을 건조. 이것은 1-2 헤 질량 분석 솔루션의 12.5 µ L에 말린된 phosphopeptides Resuspend ( 표 1참조) (또는 연구원의 MS에 의해 권장으로 proteomics 시설 코어). 소용돌이 짧게 잘 그들을 resuspend에 30 s. 반복이 2 x에 대 한 10000 x g 다운 솔루션을 회전. 샘플 (11 단계) 질량 분석 시설에 제출에 대 한 준비가 되었습니다.
참고: 다음 단계는 pST 펩 티 드 농축만 관련이 있습니다.
7. 리버스 pST 펩 티 드의 위상 추출
- 펩 티 드 분석 결과 수행 하 여 단계 4.6에서에서 획득 하는 상쾌한의 펩 티 드 농도 측정 합니다. PST 질량 분석에 대 한 충분 한 금액은 2.5 mg 이다.
- 5%와 3.5 pH 조정 TFA.
- 진공 매니폴드를 C-18 열의 더 짧은 끝을 연결 합니다. 17 34 kPa (또는 제조업체의 지침에 따라) 진공을 설정 합니다. 100%의 3 mL와 함께 열 젖은 = 뉴스. 건조 열을 게 하지 마십시오.
- 6 mL의 0.1% TFA 2 x 3 mL로 열 equilibrate 열에 acidified 샘플을 로드 합니다. 한 번에 이상의 3 mL를 추가 하지 마십시오. 초당 약 1-2 방울을 대상으로 진공을 조정 합니다.
- 9 mL의 0.1% TFA 3 x 3 mL로 열 워시. 40%의 2 mL와 함께 열을 elute ACN, 0.1 %TFA. 유리 문화 관에 두 2 mL 분수를 수집 합니다. 열을 삭제 합니다.
- Parafilm eluate 튜브 커버 및 20 G 바늘을 사용 하 여 덮개에 3-5 구멍을 펀치. 그것은 완전히 고체 때까지 적어도 30 분을 위한 드라이 아이스에 eluate를 고정 합니다.
- 밤새 선택한 분수를 lyophilize. 다음 날, 샘플은는 lyophilizer를 중지 하기 전에 완전히 건조 되었는지 확인 합니다. 튜브-80 ° c.에 섬세 한 물티슈 50 mL 원뿔 튜브에 저장
참고: 실험 수 수 일시 중지 여기.
8. 강한 양이온 교환 (SCX) pST 펩 티 드
- (표 1) 버퍼 A의 2 mL에 동결 건조 된 펩 티 드를 resuspend. 각 샘플에 대 한 분수를 풀. (솔루션 흐린 됩니다.)
- 진공 매니폴드를 준비 합니다. SCX 열을 제거 하는 플런저와 함께 3 mL 주사기에 연결할. 17 34 kPa (또는 제조업체의 지침에 따라) 진공을 설정 합니다.
- ACN, 뒤에 버퍼 A.의 4 mL의 4 mL와 함께 SCX 열 조건
- 8.1 단계에서 샘플의 2 개 mL를 로드 하 고 즉시는 eluate를 수집 합니다. A:B (80.9:19.1) 버퍼의 3 mL 로드와 eluate 수집 합니다. 풀의 각 샘플 aliquot 있다 그들 2 mL 낮은 단백질 바인딩 튜브로.
- 진공 집중 모든 샘플 볼륨의 약 30% 남아 때까지. (이 단계는 약 2-4 h 걸립니다.) 각 샘플에 대 한 1 낮은 단백질 바인딩 관으로는 aliquots 풀.
- 진공 매니폴드를 C-18 열의 더 짧은 끝을 연결 합니다. 17 34 kPa (또는 제조업체의 지침에 따라) 진공을 설정 합니다. 100%의 3 mL와 함께 열 젖은 ACN 2 x. 할 게 열 건조 하지 .
- 0.1%의 3 mL와 함께 열 equilibrate TFA 2 x. 열에 샘플을 로드 합니다. 한 번에 이상의 3 mL를 추가 하지 마십시오. 초당 약 1-2 방울을 대상으로 진공을 조정 합니다.
- 3 mL 0.1%의 열을 씻어 TFA 2 x. 50%의 4 mL와 함께 열을 elute ACN, 0.1 %TFA.
9. 이산화 티타늄 농축 pST 펩 티 드의
-
용량이 200 µ L 샘플에 대 한 팁에 포함 된 티 오2 구슬 준비
- 그 끝에 구슬을 이동 팁의 작은 팁 사이드에 부드럽게 누릅니다. 뚜껑을 제거 하 고 폴 리 프로필 렌 15 mL 원뿔 튜브에 비즈를 부 어.
- 100%의 200 µ L을 추가 하 여 팁을 린스 ACN, 반전 팁 몇 번 하 고 뚜껑 쪽으로 액체를 이동 하려면 작은 끝을 터치. 끝의 작은 끝을 잘라 면도날을 사용 하 여, 그리고 폴 리 프로필 렌 15 mL 원뿔 튜브 위에 그것을 배치. 뚜껑을 제거 하 고 나머지 ACN 밖으로 급락 micropipette 삽입. 100%의 200 µ L 가진 세척을 반복 = 뉴스. 티 오2 구슬 지금 다음 단계에 대 한 15 mL 원뿔 튜브에 있습니다.
- 전제 티 오2 100% ACN 2의 500 µ L x. 피펫으로 구슬 용 매 혼합 그것. 1 분에 100 x g에서 원심 그들.
- 티 오2 0.2 M 나트륨 인산 염 버퍼 (pH ~ 7)의 500 µ L을 두 번 조건. 평형의 300 µ L와 구슬 버퍼 3 배 세척.
- 폴 리 프로필 렌 15 mL 원뿔 튜브에 eluted phosphopeptides를 전송 합니다. 젖 산의 560 µ L을 추가 하 고는 이상 끝 회전자를 사용 하 여 실 온에서 1 h 품 어.
- 작은 구슬 1 분 x 100g에 혼합 원심 재래식 버퍼 (표 1) 3의 300 µ L로 그들을 씻어 x. 1 분 x 100g에 그들을 아래로 회전 합니다.
- 300 구슬 린스 rinsing의 µ L 버퍼 2 배. 0.2 µ m 회전 필터에 그들을 전송. 1500 x g 1 분 동안에 그들을 아래로 회전 합니다.
- 낮은 단백질 바인딩 깨끗 한 1.5 mL 튜브에 필터 단위를 전송. 내용 2 elute 0.9% NH3 H2o.의 200 µ L x 솔루션 들을 방출 하기 전에 2 분 동안 phosphopeptides에 앉아 보자. 10와 11 사이 있어야 한다 pH를 측정 합니다.
- 진공 건조 하룻밤 암모니아를 증발 하 게 eluate 집중.
10. MS 분석에 대 한 pST 펩 티 드를 담
- 끝으로 자료를 이동 팁의 작은 팁 사이드에 부드럽게 누릅니다. 100%의 200 µ L을 추가 하 여 팁을 린스 ACN, 팁을 반전 하 고 뚜껑 쪽으로 액체를 이동 하려면 작은 끝을 터치 하 여 다음.
- 끝의 작은 끝을 잘라 면도날을 사용 하 여, 및 폴 리 프로필 렌 15 mL 원뿔 튜브. 위에 그것을 배치합니다 뚜껑을 제거 하 고 나머지 ACN 밖으로 급락 micropipette 삽입. 100%의 200 µ L 가진 세척을 반복 = 뉴스. TiO2 구슬 지금 다음 단계에 대 한 폴 리 프로필 렌 15 mL 원뿔 튜브에 있습니다.
- 100 µ g. 바인딩 용량 C-18 팁을 사용 하 여 샘플을 청소 (제조 업체의 지침을 따릅니다.)
- 완전히 진공 농도 의해 차입 볼륨을 건조. 이 1-2 시간 걸립니다.
- 질량 분석 솔루션의 12.5 µ L에 말린된 phosphopeptides resuspend (또는 연구원의 MS에 의해 권장으로 proteomics 시설 코어). 소용돌이 30에 대 한 10000 x g에서 원심 s. 2 x 잘 그들을 resuspend를 반복. (할 하지 플라스틱 아래로.)
11. 질량 분석 분석
- 그들의 권장된 설정을 사용 하 여 액체 크로마토그래피 탠덤 MS (LC-MS/MS)을 수행 하기 위해 MS proteomics 핵심 시설에 샘플을 제출 합니다. 설정 예는 다음과 같습니다 (요약 표 2 참조).
- 트랩 열에 샘플의 5 µ L 로드 (2 cm 긴 x 75 µ m 직경) 0.1%로 그들을 씻어 TFA 5 µ L/분의 유량으로 5 분.
- 300 nL/min의 유량과 나노 분석 열 (20 cm x 75 µ m)에 따라 트랩을 가져와.
- 세그먼트 선형 그라디언트 (0.16% 개미 산, 80%의 비율 0.2% 개미 산에 ACN) 평 및 pST 샘플 사이:
- PY 샘플에 대 일 분에 4-15%, 15-50%에서 40 분, 5 분에 50-90%의 그라디언트를 사용 하 여 그들을 elute.
- PST 샘플에 대 일 분에 4-15%, 15-25%에서 40 분, 44 분에서 25-50% 및 11 분에 50-90%의 그라디언트를 사용 하 여 그들을 elute.
- 120000 20 가장 강렬한 이온 및 동적 제외 기간 20 MS/MS (HCD, 27%의 상대 충돌 에너지)에 의해 다음의 해상도 가진 전체 검사의 주기적인 시리즈 데이터 종속 획득 모드에서 MS 데이터 s.
- 완료를 실행 하는 MS 후 MS 분석 소프트웨어 프로그램을 식별 하 고 계량 phosphopeptides로 MS raw 파일을 가져옵니다. (MaxQuant 소프트웨어8,,2627 이 실험에 사용 되었다. 표 3을 지정 하지 않으면 기본 설정이 사용 되었다.)
결과
이 프로토콜은 자세하게에서 단백질 추출 및 phosphopeptide 농축 및 후속 MS 분석 (그림 1) 소화 하는 방법을 설명 합니다. 모든 버퍼가이 프로토콜에 사용 되는 솔루션의 구성 표 1에 나열 됩니다. 리스-C trypsin의 순차적 활용 효율적인 소화를 제공합니다. Coomassie 스테인드 젤의 사전 소화 lysate lysate 후 소화의 얼룩 완전 한 소화 (그림 2A)을 확인 하는 동안 단백질의 존재를 확인 합니다. 완전 한 소화를 위한 아무 밴드 나타납니다 30 kDa와 리스 C 및 트립 신, 23.3 kDa 밴드를 제외 하 고 15 kDa 위에 각각. 리스-C의 추가 또한 놓친된 분열 (그림 2B)의 수를 줄입니다. PY 펩 티 드 phosphoproteome28의 2%만 나타내므로 pY 특정 항 체를 사용 하 여 평 펩 티 드의 immunoprecipitation pY 펩 티 드 농축의 첫 번째 단계입니다. 결과 상쾌한 pST 펩 티 드 농축에 대 한 입력 됩니다. PY immunoprecipitation 효과적으로 pST 펩 티 드 어디 평균 평 준비에서 식별 하는 phosphopeptides의 85%는 평 (그림 3A)와 pST 준비에서 식별 하는 phosphopeptides의 99%는 이상에서 평 펩 티 드를 분리 pST (그림 3B)입니다. 이산화 티타늄 phosphopeptides 두 준비에 대 한 풍부 하 게 하는 데 사용 됩니다. Phosphorylated 되는 MS 준비 준비에 펩 티 드의 예상된 비율 30 ~ 50% (그림 4A) 사이입니다. Phosphopeptide 농축 비율에서 가변성 거기 pST 펩 티 드 보다 많은 적은 평 펩 티 드의 결과로 평 준비에 더 있을 수 있습니다. Phosphopeptide 종에서 발견 하는 phosphopeptides의 대다수는 단일 또는 이중 phosphoryl 그룹 (그림 4B) 있다.
질량 분석을 수행한 후 MS raw 파일은 MS 분석 소프트웨어에 로드 됩니다. 실험에 사용 되는 매개 변수 설정을 표 3 에 나열 된 하지만 소프트웨어 소프트웨어 달라 집니다 그리고 버전에서 버전 다를 수 있습니다. 나열 되지 않은 매개 변수 남았다는 루즈벨트를 포함 하 여 기본적으로 1%의 컷오프 펩 티 드-스펙트럼 일치 (PSM) 수정 된 펩 티 드27의 식별을 위한 40의 최소 안드로메다 점수에 대 한. 각각 약 pY 펩 티 드의 5%와 15%와 34%의 pS 및 pT 펩 티 드, 0.75 필터 보다 큰의 지역화 가능성 컷오프 설정 (그림 5A). 이러한 필터를 적용 한 후 MS 분석의 끝에 phosphopeptide 신원의 예상된 수는 약 300 평 (시작 단백질의 5 mg)에 대 한 펩 티 드 약 7, 500 pS 펩 티 드와 640 pT 펩 티 드 (2.5 mg 시작 펩 티 드의에 대 한 금액)에서 각각 농축 준비 (그림 5B). 복제의 수와 phosphopeptide 신호 강도의 변화 통계 비교에 대 한 충분 한 전원을 결정 합니다. 4 개의 별도 실험 생물학 중복 또는 triplicates를 포함 하는 그룹으로,에서 검색 된 phosphopeptides에 대 한 변형 (%CV)의 % 계수 계산 했다. 배포판 (예를 들어, 그림 5C에 pST 그룹 1-5) 낮은 다양성의 샘플 수집, 준비, 및 질량 분석 실행 일관 했다 나타냅니다. 다른 한편으로, 배포판 (예를 들어, 태평양 표준시 그룹 6 그림 5C) 높은 가변성의 아수라장 데이터 다운스트림 차동 분석에 중요 한 차이 검출 하기 위하여 더 큰 배-변경 필요를 나타냅니다.
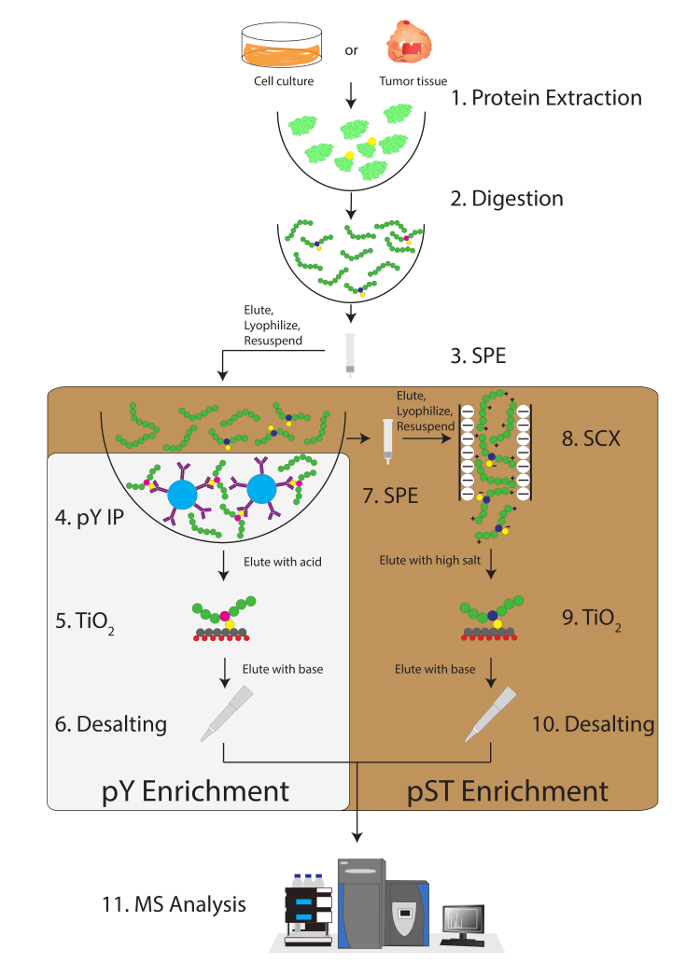
그림 1: 워크플로 다이어그램. 샘플에서 단백질 추출 되며 소화. 펩 티 드 고체 상 추출 (SPE)에 의해 추출 되 고 phosphotyrosine (pY) 펩 티 드 immunoprecipitated는. 동시에 phosphoserine/트레오닌 (pST) 펩 티 드 평 immunoprecipitation 단계에서 상쾌한에서 농축 됩니다. 강력한 양이온 교환 (SCX)을 줄이기 위해 이온 억제12고도로 청구 펩 티 드를 제거 하는 상쾌한에 수행 됩니다. 모두 준비 phosphopeptide 농축을 통해 이산화 티타늄 (티 오2) 받 다. 샘플 정리 후 액체 크로마토그래피 탠덤 질량 분석 (LC-MS/MS) phosphopeptide 풍부를 측정 하기 위해 수행 됩니다. 원시 데이터는 다음 phosphopeptides를 식별 하는 MS 분석 소프트웨어에 로드 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
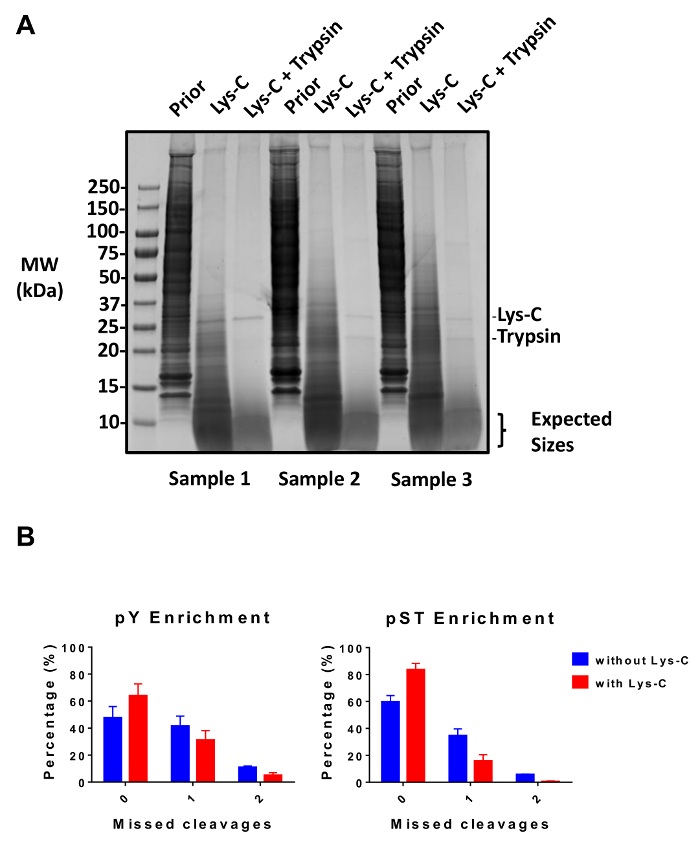
그림 2: 소화의 평가. (A) 3 lysate 사전 소화, Lys c 조 소화의 12.5 µ g을 샘플링 하 고 후 트립 신 소화 표시 됩니다. Coomassie 젤 얼룩 테스트 리스-C와 trypsin의 순차 사용 후 깨끗 한 소화를 보여줍니다. 분자량 (MW) 크기 마커 kilodaltons (kDa)에 있습니다. (B) A 놓친된 분열에 감소 관찰 후 리스 C 프로토콜에 추가 되었습니다. 놓친된 분열 없이 phosphopeptides의 비율 증가 64 %48 %에서 60% ~ 84%에서에서 평균 평 pST 농축 준비에 대 한 각각. 리스-C 없이 수행 하는 두 개의 실험에서 얻은 데이터와 리스 c 수행 5 실험 그래프 요약 오차 막대는 38 평 그리고 (없이 리스-C) 2 별도 실험에서 38 pST 샘플 62 평 (리스-C)와 5 별도 실험에서 60 pST 샘플을 나타내는 표준 편차. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
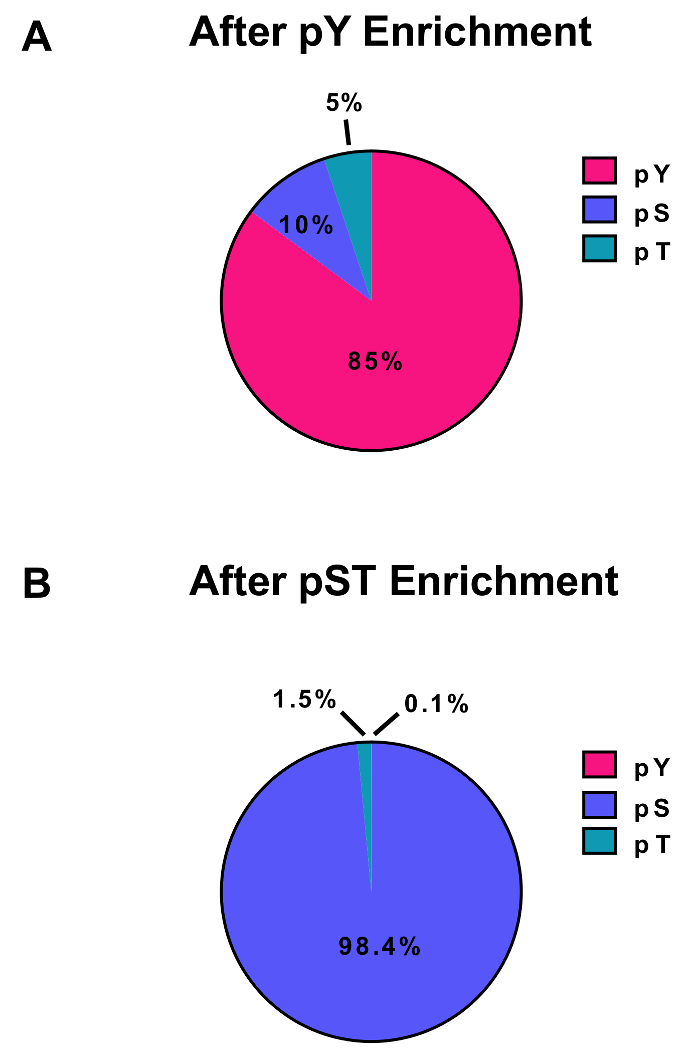
그림 3: 평 및 pST phosphopeptides의 농축. 이러한 패널 pST 농축 준비 중 (A) 평 또는 (B) pSTY phosphopeptides의 비율을 표시합니다. PY immunoprecipitation와 이산화 티타늄 pY 농축 pST 농축에 phosphopeptides의 단지 0.1%는 평 85% phosphopeptides pY 펩 티 드에 대 한 되 고 결과. 이 값 (오염 물질, 역방향 시퀀스 및 지역화 및 확률 0.75 미만 phosphopeptides 필터링 후 한 대표적인 실험의 STY)Sites.txt 파일 인 검사에서 당겨 졌다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
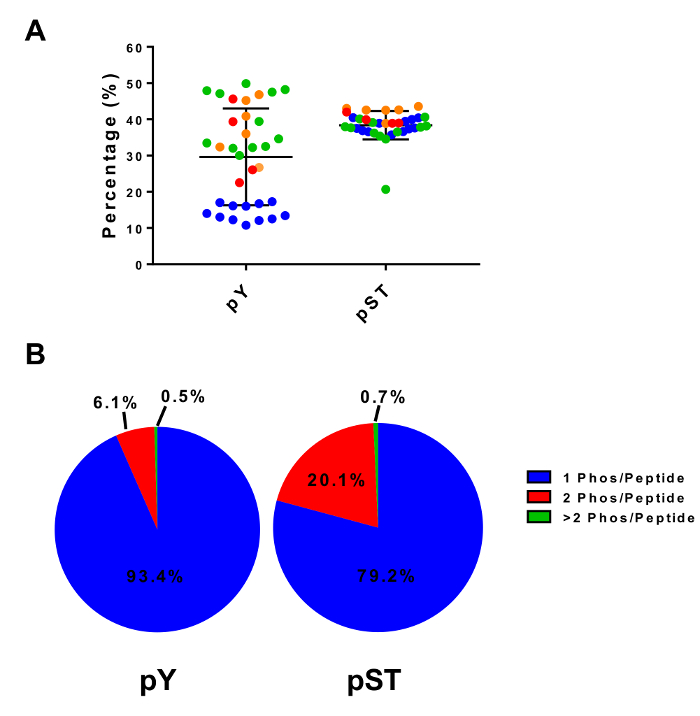
그림 4: 티타늄 이산화 Phosphopeptide 농축. (A)에서 4 개의 별도 실험에서 샘플 (총 펩 티 드)를 기준으로 검색 된 phosphopeptides의 비율이 표시 됩니다. (B)이이 패널 4 별도 실험에서 모노, 이중 및 다중 phosphorylated 펩 티 드의 평균 구성을 보여줍니다. 패널 A 에서 오차 막대는 표준 편차. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
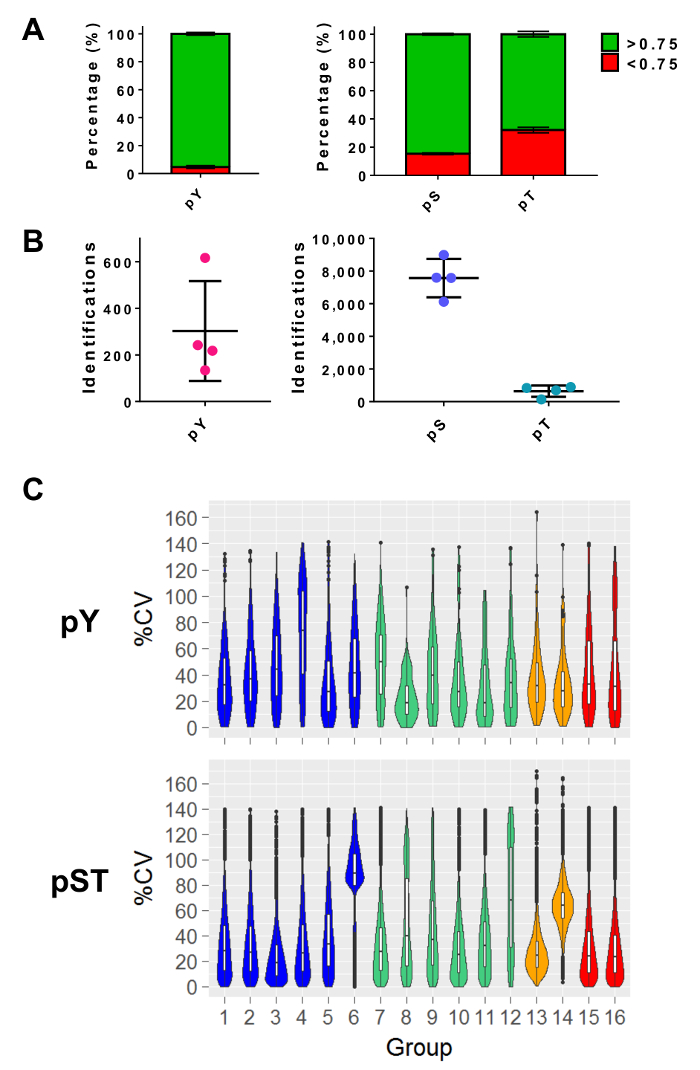
그림 5: phosphoresidue 식별 예상. (A)이이 패널 pY 농축 (왼쪽) 및 pST 농축 (오른쪽)에서 Id의 인 산화 지역화 가능성을 보여 줍니다. > 0.75 확률 컷오프를 만족 하는 Id의 평균 비율 각각 93%, 75%와 평, pS, 및 태평양 표준시에 대 한 52% 이다. (B)는 의미와 함께 id 번호는 > 0.75 지역화 확률은 300 평에 대 한,를 위한 7500 pt 640. (C)이이 패널은 phosphopeptides의 변형 (%CV)의 % 계수의 바이올린 플롯을 표시합니다. CV %의 평가 신호 강도 값은 각 생물 복제 또는 triplicate 그룹에서 검색 된 경우에 수행 됩니다. 데이터는 4 개의 별도 실험에서 촬영 됐다. 패널 A 와 B 에서 오차 막대는 34 평에서 표준 편차와 34 pST 샘플 4 별도 실험에서 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 버퍼 | 볼륨 | 구성 | |
| 6 M guanidinium 염화 물 세포의 용 해 버퍼 | 50 mL | 6 M guanidinium 염화, 100 mM tris pH 8.5, 10 mM tris (2-carboxyethyl) phosphine, 40 m m chloroacetamide, 2 mM 나트륨 orthovanadate, 2.5 m m 나트륨 파이 인산, 1 m m β-glycerophosphate, 볼륨에 500 mg n-octyl-glycoside, 초 순수한 물 | |
| 100 mM 나트륨 파이 인산 | 50 mL | 2.23 g 나트륨 파이 인산 decahydrate, 볼륨에 매우 순수한 물 | |
| 1 M β-glycerophosphate | 50 mL | 15.31 g β-glycerophosphate, 볼륨에 매우 순수한 물 | |
| 5 %trifluoroacetic 산 | 20 mL | 19 초 순수한 물으로 100 %trifluoroacetic 산의 1 mL을 추가 | |
| 0.1 %trifluoroacetic 산 | 250 mL | 245 울트라 순수 물 5 mL 5 %trifluoroacetic 산 추가 | |
| pY 차입 버퍼 | 250 mL | 0.1 %trifluoroacetic 산, 40% 이기, 볼륨에 매우 순수한 물 | |
| pST 차입 버퍼 | 250 mL | 0.1 %trifluoroacetic 산, 50% 이기, 볼륨에 매우 순수한 물 | |
| IP 바인딩 버퍼 | 200 mL | 50 mM tris pH 7.4, 50 m m 염화 나트륨, 볼륨에 매우 순수한 물 | |
| 25 m m 염화 중 탄산염, pH 7.5 | 10 mL | 19.7 mg 10 mL 메 마른 초 순수한 물, pH 7.5 1 N 염 산으로 분해 (~ 10-15 µ L/10 ml 해결책), 신선한 확인 | |
| 1 M 인산 염 버퍼, pH 7 | 1000 mL | 423 mL 1 M 하이드로 인산 나트륨, 577 mL 1 M 나트륨 수소 인산 염 | |
| 재래식 버퍼 | 14 mL | 6.3 mL 이기, 280 µ L 5 %trifluoroacetic 산, 1740 µ L 젖 산, 초 순수한 물 5.68 | |
| Rinsing 버퍼 | 20 mL | 9 mL 이기, 400 µ L 5 %trifluoroacetic 산, 10.6 초 순수한 물 | |
| 질량 분석 솔루션 | 10 mL | 500 µ L 이기, 200 µ L 5 %trifluoroacetic 산, 9.3 초 순수한 물 | |
| 버퍼 A | 250 mL | 5mm monopotassium 인산 염 (pH 2.65), 30% 이기, 염화 칼륨 5 m m, 볼륨 울트라 순수 물 | |
| 버퍼 B | 250 mL | 5mm monopotassium 인산 염 (pH 2.65), 30% 이기, 염화 칼륨 350 m m, 볼륨에 매우 순수한 물 | |
| 0.9% 수산화 암모늄 | 10 mL | 300 μ 29.42% 수산화 암모늄, 9.7 초 순수한 물 | |
표 1: 버퍼 및 솔루션. 이 표에서 버퍼가이 프로토콜에 사용 되는 솔루션의 작곡을 보여 줍니다.
| LC-MS/MS 설정 | ||
| 매개 변수 | pY 설정 | 태평양 표준시 설정 |
| 로드 (µ L) 샘플 | 5 | |
| 로드 유량 (µ L/분) | 5 | |
| 그라데이션 유량 (nL/분) | 300 | |
| 선형 그라데이션 (백분율 0.16% 개미 산, 80% 0.2% 개미 산 = 뉴스) | 4-5 분 동안 15% | 4-30 분 동안 15% |
| 15-40 분 50% | 15-40 분 25% | |
| 50-5 분 동안 90% | 25-44 분 50% | |
| 50-11 분 90% | ||
| 완전 한 스캔 해상도 | 120000 | |
| 선택 하는 가장 강렬한 이온의 수 | 20 | |
| 상대 충돌 에너지 (%) (HCD) | 27 | |
| 동적 제외 (s) | 20 | |
표 2: LC-MS 설정. 이 일반 샷건 phosphoproteomic 실험에서 LC MS 설정의 예입니다. 샘플은 트랩의 열에 로드 되었습니다. 트랩 분석 열이 있는 라인에 오게 됐다. 이러한 설정은 LC-MS 시스템에 테이블의 재료 및 시 약을사용 하 여 최적화 했다. 이러한 설정은 다른 LC-MS 시스템 조정 해야 합니다.
| MaxQuant 매개 변수 설정 | ||
| 설정 | 액션 | |
| 그룹-특정 매개 변수 | ||
| 유형 | 유형 | 표준 선택 |
| 다중성 | 1로 설정 | |
| 소화 모드 | 효소 | 트립 신/P 선택 |
| 최대입니다. 놓친된 분열 | 2로 설정 | |
| 수정 | 변수 수정 | 인 (촌) 추가 |
| 레이블 없는 정량화 | 레이블 없는 정량화 | LFQ 선택 |
| LFQ 분 비율 수 | 1로 설정 | |
| 빠른 LFQ | 확인 | |
| 기타 | 다시 계량 | 확인 |
| 글로벌 매개 변수 | ||
| 시퀀스 | FASTA 파일 | UniProt에서 다운로드 선택 fasta 파일 |
| 고정된 수정 | Carbamidomethyl (C) 추가 | |
| 부. 식별 | 실행 사이의 일치 | 확인 |
| 경기 시간 창 | 5 분으로 설정 | |
| 맞춤 시간을 창 | 20 분으로 설정 | |
| 알 수 없는 일치 | 확인 | |
| 단백질 정량화 | 분 비율 수 | 1로 설정 |
| 폴더 위치 | 적절 하 게 수정 | |
표 3: MS 분석 소프트웨어 설정. MaxQuant에이 테이블에 그룹 및 글로벌 매개 변수 선정 또는 조정. 다른 모든 매개 변수는 기본에 남아 있었다. 이 실험은 버전 1.5.3.30을 사용 하 여 실시 했다. 매개 변수는 버전에서 버전 및 소프트웨어 소프트웨어에서 달라질 수 있습니다.
토론
Phosphopeptides에 대 한 풍부 하 게이 프로토콜을 활용 하 여, 전에 실험 디자인의 신중이 중요 합니다. 생물 복제를 사용 하 여 기술 복제 보다 질량 분석 자원의 경제적인 사용이 이다. 필요한 복제 수 부분에 데이터의 변화에 따라 달라 집니다. 최근 연구, 식별 수 증가 간신히 3 넘어 복제의 수를 증가 하는 동안 더 많은 그룹 증가 사이 중요 한 식별 번호10복제 증명.
셀에 phosphoproteins의 더 낮은 풍부 때문 충분 한 시작 단백질 양을 검색 모드에서 전립선 암 샘플에서 글로벌 phosphoproteome를 얻을 필요가 있습니다. 이 실험에서 단백질의 5 mg이 사용 되었다. 셀의 약 5 거의 confluent 15 cm 요리는 비록이 셀 라인-종속 될 것입니다 충분 한 단백질이이 프로토콜에 대 한 입력으로 제공 합니다. 종양 조직에 관해서는 단백질의 예상된 수익률 조직 무게의 약 6-8%입니다. 체 외에서 환경에서 고려해 야 할 긍정적인 컨트롤 샘플 셀을 수확 하기 전에 30 분 동안 1 m m 바의 추가 이다. 바, 경쟁력 있는 단백질 phosphotyrosyl 인산 가수분해 효소 억제 물, pY 펩 티 드 식별29의 수를 증가 하는 따라서 티로신 인 산화를 유지 됩니다.
깨끗 한 소화 phosphopeptide 식별을 극대화 하기 위해 중요 한 단계 이다. Coomassie 얼룩 테스트 외에도 데이터에서 누락된 분열의 % 소화 효율 (그림 2)를 평가 하 사용할 수 있습니다. 품질 관리 소프트웨어는 사용할 수 있는 놓친된 분열 및 MS 데이터 품질30를 평가 하기 위해 다른 통계 분석. Trypsin은 가장 일반적인, 다른 프로 테아 제를 사용할 수 있습니다 하는 동안 주소 범위 격차는 프로테옴 최적의 tryptic 펩 티 드 수 없습니다5 31생성. MS 분석 소프트웨어의 설정 다음 프로 테아 제에 변화 조정에 따라 수정 해야 합니다.
프로토콜 (pY 농축)에 대 한 immunoprecipitation를 사용 하 여 phosphopeptides에 대 한 풍부 하 게 이산화 티타늄 (티 오2) 뿐만 아니라. 펩 티 드에 대 한 풍부 하 게 대체 방법이 포함 고정된 금속 친화성 크로마토그래피 (IMAC), 금속 산화물 친화성 크로마토그래피 (MOAC) 수산화 알루미늄 등 금속 이온 폴리머 기반 선호도 캡처 (PolyMAC) 에 대 한 다른 금속 산화물 5,12. 이전 연구 결과 다른 농축 방법 phosphopeptides32의 다른 인구에 대 한 풍부 하 게 나타났습니다. 예를 들어, IMAC MOAC 선호 모노 phosphorylated 펩 티 드33풍요롭게 하는 동안 더 많은 멀티 phosphorylated 펩 티 드를 풍요롭게. 이 프로토콜의 대표 결과 반영이 관찰 (그림 4B). 최근 게시는 아이맥과 MOAC 하이브리드 소재를 사용 하 여 잠재적으로 제공할 수 phosphopeptide 종34의 더 큰 범위를 시연 했다. 따라서,이 프로토콜 훨씬 더 포괄적인 phosphoproteomic 분석에 대 한 허용 하는 동시에 다른 농축 방법을 활용 하 수정 될 수 있습니다.
MaxQuant26 소프트웨어 제품군은이 프로토콜에서 MS 데이터를 분석 하는 데 사용 됩니다 하지만 상용 응용35 phosphopeptide 식별 및 정량화에 대 한 사용할 수 있습니다. Phosphopeptide 식별에 대 한 지역화 가능성 차단 적용 됩니다. 이 필터는 phosphoresidue 식별10,28에서 높은 신뢰를 (즉, 0.75 보다 큰)와 phosphopeptides에 대 한 선택 하려면 수행 됩니다. 즉, 인 그룹에 포함 될 수 있는 다른 모든 잔류물의 총계 확률 0.25 보다 작습니다. 이 구분 phosphopeptide 선택의 엄중을 증가 하기 위하여 올려질 수 있습니다. 식별 번호에 관한 평 펩 티 드의 예상된 번호는 수백에 높은 수천에 pST 펩 티 드의 예상된 번호는입니다. 이 값에 약 2%, 12%와 86%는 phosphosites의 있는 평, pT, 및 pS, 각각28이전 관찰된 phosphoproteome 배포 반영.
병렬로 평 및 pST 농축 단계를 수행 하는 경우 6 일에서 프로토콜에 샘플 준비 단계를 완료할 수 있습니다. MS의 강력한 도구와 함께 함으로써,이 같은 phosphopeptide 농축 프로토콜 그들의 각 연구 분야에 phosphoproteome를 분석 하는 데이터를 수집 하는 과학자를 위한 글로벌 접근 방식을 제공 합니다.
공개
저자는 공개 없다.
감사의 말
우리가 원고에 조언과 입력을 제공 하기 위한 드레이 크 연구소의 회원을 감사 합니다. 우리는 또한 조언을 제공 하 고 우리의 샘플에 질량 분석을 수행할 생물 질량 분석 시설의 로버트 우드 존슨 의과대학과는 주립 대학 뉴저지의 럿 거 스의 회원을 감사 합니다. 래리 C. 쳉에 의해 국립 연구소의 일반 의료 과학 보너스 번호 T32 GM008339에서 국립 보건원의 지원 됩니다. 토마스 G. Graeber NCI/NIH (포자 전립선 암 P50 CA092131;에 의해 지원 됩니다. P01 CA168585)와 미국 암 사회 연구 학술 상 (RSG-12-257-01-TBE). 저스틴 M. 드레이크는 부의 방어 전립선 암 연구 프로그램 W81XWH-15-1-0236, 전립선 암 재단 영 조사 상, 뉴저지 건강 재단, 그리고는 Rutgers에서 정밀 의학 이니셔티브 파일럿 수상에 의해 지원 됩니다. 뉴저지 암 연구소입니다.
자료
| Name | Company | Catalog Number | Comments |
| Ultra-Low Temperature Freezer | Panasonic | MDF-U76V | |
| Freezer -20 °C | VWR | scpmf-2020 | |
| Swing rotor bucket | ThermoFisher Scientific | 75004377 | |
| Vacuum manifold | Restek | 26080 | |
| Lyophilizer | Labconco | 7420020 | |
| CentriVap Benchtop Vacuum Concentrator | Labconco | 7810010 | |
| End-over-end rotator | ThermoFisher Scientific | 415110Q | |
| Razor blade | Fisher Scientific | 620177 | |
| Amicon Ultra-15 Centrifugal Filter Units | Millipore Sigma | UFC901024 | |
| Glass culture tubes | Fisher Scientific | 14-961-26 | |
| Parafilm | Fisher Scientific | 13-374-12 | |
| 20G needle | BD | B305175 | |
| Kimwipes | Fisher Scientific | 06-666A | |
| Screw cap cryotube | ThermoFisher Scientific | 379189 | |
| Nunc 15 mL conical tubes | ThermoFisher Scientific | 12-565-268 | |
| Gel loading tips | Fisher Scientific | 02-707-181 | |
| Millipore 0.2 µm spin filter | Millipore Sigma | UFC30GVNB | |
| Low protein-binding Eppendorf tubes | Eppendorf | 22431081 | |
| anti-Phosphotyrosine, Agarose, Clone: 4G10 | Millipore Sigma | 16101 | |
| 27B10.4 antibody | Cytoskeleton | APY03-beads | |
| Peptide assay kit | Thermo Scientific | 23275 | Step 7 |
| TopTip | PolyLC Inc | TT200TIO.96 | Steps 5 and 9 |
| SCX columns (PolySULFOETHYL A) | PolyLC Inc | SPESE1203 | |
| 3 mL syringe | BD | 309657 | |
| Trifluoracetic Acid (TFA) | Fisher Scientific | PI-28904 | |
| Acetonitrile (ACN) | Fisher Scientific | A21-1 | |
| Lactic acid | Sigma-Aldrich | 69785-250ML | |
| Ammonium Hydroxide | Fisher Scientific | A669S-500 | |
| Potassium Phosphate Monobasic | Fisher Scientific | BP362-500 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Calcium Chloride Dihydrate | Fisher Scientific | BP510-500 | |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypsin, TPCK Treated | Worthington Biochemicals | LS003740 | |
| Lysyl Endopeptidase | Wako Pure Chemical Industries, Ltd. | 125-05061 | |
| MonoTip | PolyLC Inc | TT200TIO.96 | Step 10 |
| ZipTip | MilliporeSigma | ZTC18S096 | Step 6 |
| nanoEase, MZ peptide BEH C18, 130A, 1.7 μm, 75 μm x 20 cm | Waters | 186008794 | Step 11: analytical column |
| Acclaim PepMap 100 C18 LC Columns | ThermoFisher Scientific | 164535 | Step 11: trap column |
| Ultimate 3000 RLSCnano System | Dionex | ULTIM3000RSLCNANO | Step 11 |
| Q Exactive HF | ThermoFisher Scientific | IQLAAEGAAPFALGMBFZ | Step 11 |
| MilliQ water | deionized water used to prepare all solutions and bufferes | ||
| Sonic Dismembrator | Fisher Scientific | FB-120 | sonicator |
| Polytron System PT | Kinematica AG | PT 10-35 GT | homogenizer |
참고문헌
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Paller, C. J., Antonarakis, E. S. Management of biochemically recurrent prostate cancer after local therapy: evolving standards of care and new directions. Clinical Advances in Hematology & Oncology. 11 (1), 14-23 (2013).
- Lowrance, W. T., Roth, B. J., Kirkby, E., Murad, M. H., Cookson, M. S. Castration-resistant prostate cancer: AUA guideline amendment 2015. The Journal of Urology. 195 (5), 1444-1452 (2016).
- Domon, B., Aebersold, R. Options and considerations when selecting a quantitative proteomics strategy. Nature Biotechnology. 28 (7), 710-721 (2010).
- Zhang, Y. Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. Protein analysis by shotgun/bottom-up proteomics. Chemical Reviews. 113 (4), 2343-2394 (2013).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- Bantscheff, M., Lemeer, S., Savitski, M. M., Kuster, B. Quantitative mass spectrometry in proteomics: critical review update from 2007 to the present. Analytical and Bioanalytical Chemistry. 404 (4), 939-965 (2012).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Rubbi, L., et al. Global phosphoproteomics reveals crosstalk between Bcr-Abl and negative feedback mechanisms controlling Src signaling. Science Signaling. 4 (166), ra18 (2011).
- Hogrebe, A., et al. Benchmarking common quantification strategies for large-scale phosphoproteomics. Nature Communications. 9 (1), 1045 (2018).
- Rush, J., et al. Immunoaffinity profiling of tyrosine phosphorylation in cancer cells. Nature Biotechnology. 23 (1), 94-101 (2005).
- Fila, J., Honys, D. Enrichment techniques employed in phosphoproteomics. Amino Acids. 43 (3), 1025-1047 (2012).
- Mertins, P., et al. Proteogenomics connects somatic mutations to signalling in breast cancer. Nature. 534 (7605), 55-62 (2016).
- Drake, J. M., et al. Phosphoproteome integration reveals patient-specific networks in prostate cancer. Cell. 166 (4), 1041-1054 (2016).
- Lue, H. W., et al. Metabolic reprogramming ensures cancer cell survival despite oncogenic signaling blockade. Genes & Development. 31 (20), 2067-2084 (2017).
- Francavilla, C., et al. Phosphoproteomics of primary cells reveals druggable kinase signatures in ovarian cancer. Cell Reports. 18 (13), 3242-3256 (2017).
- Zhang, H., et al. Integrated proteogenomic characterization of human high-grade serous ovarian cancer. Cell. 166 (3), 755-765 (2016).
- Skaggs, B. J., et al. Phosphorylation of the ATP-binding loop directs oncogenicity of drug-resistant BCR-ABL mutants. Proceedings of the National Academy of Sciences of the United States of America. 103 (51), 19466-19471 (2006).
- Zimman, A., et al. Activation of aortic endothelial cells by oxidized phospholipids: a phosphoproteomic analysis. Journal of Proteome Research. 9 (6), 2812-2824 (2010).
- Zimman, A., Berliner, J. A., Graeber, T. G. Phosphoproteomic analysis of aortic endothelial cells activated by oxidized phospholipids. Methods in Molecular Biology. , 53-69 (2013).
- Humphrey, S. J., Azimifar, S. B., Mann, M. High-throughput phosphoproteomics reveals in vivo insulin signaling dynamics. Nature Biotechnology. 33 (9), 990-995 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Meyer, T. S., Lamberts, B. L. Use of coomassie brilliant blue R250 for the electrophoresis of microgram quantities of parotid saliva proteins on acrylamide-gel strips. Biochimica el Biophysica Acta. 107 (1), 144-145 (1965).
- Bergstrom Lind, S., et al. Immunoaffinity enrichments followed by mass spectrometric detection for studying global protein tyrosine phosphorylation. Journal of Proteome Research. 7 (7), 2897-2910 (2008).
- Pinkse, M. W., Uitto, P. M., Hilhorst, M. J., Ooms, B., Heck, A. J. Selective isolation at the femtomole level of phosphopeptides from proteolytic digests using 2D-NanoLC-ESI-MS/MS and titanium oxide precolumns. Analytical Chemistry. 76 (14), 3935-3943 (2004).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nature Biotechnology. 26 (12), 1367-1372 (2008).
- Cox, J., et al. Andromeda: a peptide search engine integrated into the MaxQuant environment. Journal of Proteome Research. 10 (4), 1794-1805 (2011).
- Olsen, J. V., et al. Global, in vivo, and site-specific phosphorylation dynamics in signaling networks. Cell. 127 (3), 635-648 (2006).
- Huyer, G., et al. Mechanism of inhibition of protein-tyrosine phosphatases by vanadate and pervanadate. The Journal of Biological Chemistry. 272 (2), 843-851 (1997).
- Bielow, C., Mastrobuoni, G., Kempa, S. Proteomics quality control: quality control software for MaxQuant results. Journal of Proteome Research. 15 (3), 777-787 (2016).
- Swaney, D. L., Wenger, C. D., Coon, J. J. Value of using multiple proteases for large-scale mass spectrometry-based proteomics. Journal of Proteome Research. 9 (3), 1323-1329 (2010).
- Bodenmiller, B., Mueller, L. N., Mueller, M., Domon, B., Aebersold, R. Reproducible isolation of distinct, overlapping segments of the phosphoproteome. Nature Methods. 4 (3), 231-237 (2007).
- Leitner, A., Sturm, M., Lindner, W. Tools for analyzing the phosphoproteome and other phosphorylated biomolecules: a review. Analytica Chimica Acta. 703 (1), 19-30 (2011).
- Yang, D. S., et al. Design and synthesis of an immobilized metal affinity chromatography and metal oxide affinity chromatography hybrid material for improved phosphopeptide enrichment. Journal of Chromatography A. 1505, 56-62 (2017).
- Al Shweiki, M. R., et al. Assessment of label-free quantification in discovery proteomics and impact of technological factors and natural variability of protein abundance. Journal of Proteome Research. 16 (4), 1410-1424 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유