Method Article
前立腺癌におけるリン酸化プロテオームを調べる定量的ラベル無料質量と相まってリン酸化ペプチド濃縮
* これらの著者は同等に貢献しました
要約
このプロトコルでは、抽出し、前立腺癌細胞株あるいは質量分析を用いたプロテオミクスによるリン酸化プロテオーム解析のためのティッシュから調製したカゼインホスホペプチドを豊かにする手順について説明します。
要約
プロテオミクスには、リン酸化タンパク質の大規模な調査が含まれます。蛋白質のリン酸化は多くのシグナル伝達経路の重要なステップとがキナーゼとホスファターゼによって堅く調整されます。したがって、リン酸化プロテオームを特徴付けるは新たな標的、腫瘍治療のためのバイオ マーカーを特定するために洞察力を提供可能性があります。質量分析法は、世界的に検出し、数千のユニークなリン酸化イベントを定量化する方法を提供します。ただし、リン酸が非リン酸、もっと挑戦的な生化学的分析を行うよりもはるかに少ない豊富です。この制限を克服するためには、質量分析の前に調製したカゼインホスホペプチドを豊かにするためのメソッドが必要です。ホスホチロシン (pY) と役割/スレオニン (pST) ペプチド抗体ベースを使用しておよび/または酸化チタン (TiO2) 濃縮ペプチドを生成するためのティッシュからの蛋白質を消化し抽出手順について述べる-ベース濃縮方法です。試料調製及び質量分析法後、我々 はその後識別、液体クロマトグラフィー ‐ 質量分析と解析ソフトウェアを使用して調製したカゼインホスホペプチドを定量化します。
概要
2018 年には前立腺がんは、最も一般的ながんとアメリカ合衆国1男性の癌関連死の 2 番目の主要な原因を表すため、推定 165,000 新たな症例、約 29,000 死亡が発生します。前立腺癌の初期段階、10 年再発率が 20% と前立腺摘除術を受ける患者のと 30% と放射線照射を受ける患者の 50% と 40% の間、臓器限局性疾患の切除や放射線療法で治療可能療法2。前立腺がんは、成長のためのシグナリング アンドロゲンに依存するため、去勢手術と化学療法はハイリスク患者におけるも採用します。ただし、がんがアンドロゲン除去療法に応答しなく、生化学的再発によって証明されるようは血清前立腺特異抗原が再び上昇、再発が発生します。この時点で進行、しばしば転移が同様。この高度な段階で、転移性の去勢抵抗性前立腺癌と呼ばれる致命的な予後が 2 年間3未満の生存時間を病気の形態を表します。後期の疾患、enzalutamide、abiraterone、ドセタキセルなどのタキサン ベース化学療法など第二世代抗アンドロゲンを含むには、ほとんどの治療オプションがありません。利用可能な治療にもかかわらず病気は多くの場合進行します。したがって、探索と新規治療法の開発は、疾患が進行した前立腺癌患者のケアを改善するために必要です。
質量分析法 (MS)-ベースのアプローチは、ペプチド分析4の何千もの何百もの検出によるプロテオームのグローバル分析を提供します。特に、ディスカバリー プロテオミクス、として知られているデータ依存取得 (DDA) 同定と定量ペプチド4、5の何千もを得ることができます。MS ベースのディスカバリー プロテオミクスは、タンパク質の特徴、トップダウン プロテオミクスとボトムアップ (散弾銃として知られている) プロテオミクス、タンパク質5を特徴付けるためのペプチドの分析、さらに線引きできます。したがって、散弾銃プロテオミクスにおけるタンパク質分解ステップで起こるタンパク質をペプチドに切断する試料質量分析の前します。最後に、ペプチドを同定のための蛋白質にマップするデータベースの検索が実行されます。無料のラベルだけでなく、いくつか同位体標識 [例えば, 細胞培養 (SILAC) のアミノ酸によって分類する安定同位体] メソッド使用できますサンプル6、7の間のペプチドを定量的に比較します。同位体ラベリング手法は金本位制、ラベル自由な方法と同様定量精度8,9を実証しているし、感度と特異性10の対等なトレードオフがあります。ラベル無料定量は大きい範囲を提供し、ラベル ベースの方法はコストと多重能力6,7,8によって限られるに対し、多数のサンプル間の比較が可能します。
さらに、MS の散弾銃は11リン酸化などの翻訳後修飾 (Ptm) を尋問するも使用できます。リン酸化ペプチド、抗体を用いた免疫沈降ホスホチロシン (pY) ペプチド、二酸化チタン (TiO 2を含むを豊かにする合計ペプチドと比較してリン酸化ペプチドの下の化学量論的性質のためいくつかの方法を採用します。)、金属アフィニ ティー ・ クロマトグラフィー (IMAC)5,12を固定化。蛋白質のリン酸化は多くの細胞がシグナル伝達経路、セルシグナ リング胸13、前立腺14腎15など、さまざまな癌の変化を調査する研究者可能に散弾銃プロテオミクスの重要なステップ卵巣、16,17がんの生物学を理解するため、治療のための潜在的な新しいターゲットを識別するために。
このラベル無料散弾銃ホスホプロテオミクス メソッドは Graeber グループ18,19,20によって造られ、洗練されたに基づいて前作だったこのプロトコルは、抽出とペプチドにタンパク質と組織からのリン蛋白質の消化を記述することから始まります。我々 は、特定ホスホチロシン抗体と TiO2pY ペプチドの濃縮を詳しく説明します。強陽イオン交換 (SCX) にて TiO2を使用して役割/スレオニン (pST) ペプチドの濃縮についても述べる。このプロトコルは MS 施設にサンプルの提出とリン酸化ペプチドとその対応するリンタンパクの定量化 MS 解析ソフトウェアの使用を終了します。このプロトコルのアプリケーションを他の癌と腫瘍外フィールドに前立腺がんを超えて拡張できます。
プロトコル
異種移植腫瘍を用いた実験によって承認されましたラトガース大学機関動物ケアおよび使用委員会セットとして定める健康の国民の協会のガイドラインの下で。
1. 蛋白質の抽出
- (表 1) の換散バッファーを準備します。(ボリュームは、収穫されるサンプルの数によって異なります)。細胞サンプルの in vitro 1.2 をステップに進みます。腫瘍、1.3 のステップに進みます。
-
セルを収穫
- 50 mL コニカル チューブに細胞を収集し、4 ° C で 5 分間 700 x g でそれらをスピン上澄みを廃棄し、氷の上のペレットを維持します。1 つのペレットに細胞を収集するためにすべての料理に対してこの手順を繰り返します。(通常、タンパク質の 5 mg に必要な細胞の約 5 のほぼ合流 15 cm 皿がこの細胞ラインに依存する可能性がありますおよび調査員によって、経験的に決定する必要があります)。
- 4 ° C で 5 分間 700 x g で PBS を吸引する前に 30 ml チルド リン酸緩衝生理食塩水 (PBS) とスピンのペレットを洗浄します。1.5 mL の細胞ペレットに使用されるタンパク質の 5 mg 当たり換散バッファーを追加します。数回上下ピペットで移しなさい。1.4 の手順に進みます。
-
組織を収穫
- 腫瘍の重さし、文化の試験管に 2 mL の組織のすべての 100 mg の氷の溶解バッファーを追加します。(通常、組織の湿重量の 50 に 150 mg 必要です。)
- ハンドヘルドまたは卓上ホモジナイザーを用いたライセートを均質化 (パルス 15 2 x s)。最初のサンプルの前に、連続で 10% の漂白剤、70% エタノール、および脱イオン水を使用してサンプル間ホモジナイザーをクリーンアップします。
- 削減し、アルキル基を導入、95 ° C、5 分で均質化試料を加熱します。その後、15 分間氷の上それらを冷却します。氷の上超音波ライセート 3 x (すなわち30 のためのパルス パルス間 60 秒一時停止 s)。サンプルないはず粘性または固まりこの時点です。5 分2195 ° C の溶解液を加熱します。
- 同じ超音波で溶解液管 15 ° C で 3,500 × g で 15 分スイング バケツの回転子を使用して遠心上清を収集し、ペレットを破棄します。
- ブラッドフォードの試金22を実行することで、タンパク質濃度を決定します。必要に応じて、希釈換散バッファーと 5 mg/mL に溶解します。-20 ° C で保存します。
注: 実験はここで一時停止することができます。-80 ° C でサンプルを凍結し、後日続行します。
2. ライセート消化
- 12-fold サンプルを希釈 100 mM Tris を使用して (pH = 8.5) ための量を削減します。不平等な消化の影響を最小限に抑えるために同じボリュームにすべてのサンプルを希釈します。12.5 μ g、未消化の Coomassie 染色ゲル23日確認のために lysate を保存します。
- 蛋白質の 5 mg リジルオキシダーゼ エンドペプチダーゼ (Lys-C) の 10 μ g を追加、および 5-6 h. 調整 pH 8.0 で室温でインキュベート トリス (pH ~ 11) を untitrated 1 M を追加します。
- 1 mg/ml の L-1-tosylamido-2-フェニルエチル クロロメチル ケトン (TPCK)-(20 mM CaCl2) で 1 mM 塩酸でトリプシンを扱われます。1: 100 のトリプシン: タンパク質比率でトリプシンを追加し、37 ° C 3 時間で孵化します。
- ステップ 2.3 のように新鮮なトリプシンの同じ量を追加します。37 ° C でそれを一晩インキュベートします。
- 12.5 μ g、消化のライセート Coomassie 染色ゲル23完全な消化力を確認するために保存します。
3. 逆相抽出
- ライセートの量を記録します。15 mL 10 kDa カットオフ フィルターを使用してサンプルを抽出します。未透過ボリュームが (これは約 45-60 分かかる) 未満 250 μ L まで、15 ° C で g スイング バケツの回転子を使用して (または固定角ロータで 3,500 x g) x 3,500 でサンプルを遠心します。フローを通じて収集し、非透過を破棄します。
注: 実験はここで一時停止することができます。-80 ° C でサンプルを凍結し、後日続行します。 - サンプルを酸性、ライセートの mL あたり 5% トリフルオロ酢酸 (TFA) の約 20 μ L を追加します。それらを混ぜるし、pH のストリップを使用してサンプルの pH を測定します。2.5 5% を使用するために pH を調整する TFA。
- 真空マニホールドに C-18 列の短い方の端を接続します。真空 17 と 34 kPa の間 (または製造元の指示に従って) を設定します。ガラスピペットを使用して、ウェットを 3 mL 100% アセトニ トリル (ACN) の列です。列の乾燥をさせてください。
- ガラスピペットを使用して、6 ml の 0.1 %2 x 3 mL として適用される TFA のコラムを平衡させ。列に酸性のサンプルをロードします。一度に 3 mL 以上を追加しないでください。1 秒あたり約 1 〜 2 滴をターゲットに真空を調整します。
- ガラスピペットを使用して、0.1 %tfa 適用 3 x 3 mL 程度の 9 mL を洗い流します。40% の ml の 2 列を溶出 ACN、0.1 %tfa。ガラス培養管に 2 つの 2 mL 分数を収集します。列を破棄します。
- パラフィルムで溶出液管をカバーし、20 G 針を使用してカバーの 3-5 穴をパンチします。それが完全に固体になるまで少なくとも 30 分のドライアイスの溶出液を凍結します。
- 分数を一夜凍乾します。次の日にサンプル、エアカーテンを停止する前に完全に乾燥していることを確認します。-80 ° C で繊細なワイプと 50 mL の円錐管にチューブを格納します。
注: 実験はここで一時停止することができます。
4. 免疫沈降法と pY ペプチド24の濃縮
- 各画分の 0.5 ml の冷たい免疫沈降 (IP) 結合バッファーの凍結乾燥粉末を再懸濁します。最初の分数に 2 番目の分数から 0.5 mL 再懸濁量を移すことで、分数をプールし、ピペット チップを保存します。(上下にピペッティング) ではなく積極的に渦 3.6 mL スクリュー キャップ cryotube に転送する前に、サンプルを完全に溶解していることを確認します。
- 手順 4.1。、各チューブの IP バインド バッファー (表 1) の別の 0.5 ml 凍結チューブを洗浄。3.6 mL スクリュー キャップ チューブ サンプル損失を最小限に抑えるために同じのピペット チップを使用して、ソリューションに転送します。最終的な再懸濁量 (5 mg) 2 mL を作る 1 倍以上、すすぎを繰り返します。それは約 7.4 を確認するサンプルの pH を測定します。それがあまりにも酸性の場合繰り返し 1 M トリス (untitrated、pH 〜 11) の 10 μ L を追加します。あまりにも基本的な場合は、繰り返し希塩酸 (1:25 1: 100) の 10 μ L を追加します。
-
(ライセートから 5 mg) の pY ビーズを前洗い
- 4 10 抗体の 25 μ g と 27B10.4 抗体の 12.5 μ g は、1 サンプルあたり必要です。ピペット p200 を使用した後のカット別マイクロ遠心チューブ用に抗体を転送、450 μ L の冷たい IP 結合バッファーで抗体を洗浄すると 2 倍。4 ° C で培養上清を吸引 1 分 100 × g で遠心分離機に。
- ストック濃度 0.5 mg/mL IP バインドのバッファーを使用してビーズを再懸濁します。(はない渦ビーズ。)4 ° C で 1 分 200 x g でストック遠沈管単管に早かった必要なスラリー (4 10 抗体スラリーと 1 サンプルあたり 25 μ L 27B10.4 抗体スラリーの 50 μ L) 後、スピンダウンします。冷蔵庫に収納するビーズを返す前に清と側壁を洗います。
- 中古洗浄 pY ビーズをスクリュー キャップ cryotubes の再懸濁のサンプル ソリューションに追加します。エンド オーバー エンドの回転子の 4 ° C でそれらを一晩インキュベートします。
- 繊細なワイプと並んで 50 mL の遠心管にスクリュー キャップ cryotubes を配置します。PST ペプチドを豊かに使用する培養上清保存 1 分 100 x g でビーズをスピンします。(PST の濃縮はステップ 7 から始まり、pY ペプチド処理を並列で実行できます)。
- IP 結合バッファーの 300 μ L でビーズを再懸濁します。2 mL 遠心チューブに移して、4 ° C で 1 分 100 x g でそれらをスピンダウン
- リンス孵化チューブ IP 結合バッファーの 200 μ L で 3 倍です。たびに、同じ微量遠心チューブへ内容を転送します。その後、それらを回しなさい。
- 洗浄、遠心のビーズ IP 結合バッファーの 500 μ L で 3 x をチューブし、1 分 100 x g でそれらをスピンダウンします。4 ビーズを洗う 1 分使用新鮮な 25 mM NH4HCO3ソリューションから 100 x g でそれらは毎回粉体スピン、pH 7.5、25 mM NH4HCO3450 μ L と x。
- 遠心分離機で 1 分使用 1,500 × g ビーズ ビーズの表面の下に少しゲルの読み込みヒントの先端を浸すことによって、上清を完全に削除するゲルの読み込みヒント。
- ビーズ量 0.1% × 4 を追加ビーズに TFA (すなわち0.1% を 300 μ l 添加 pY ビーズ スラリーの 75 μ g を TFA)。それらをよく混合し、37 ° C で 15 分間 1,000 rpm で thermomixer の混合物を孵化させなさい
- 再懸濁を 0.2 μ m スピン フィルターに転送します。すぐに溶出チューブ スピンダウンし、残留量を P10 ピペットを使用して同じスピン フィルターに転送します。スピン ・ ダウン 1 分 850 x g でスピン フィルターは、低蛋白結合遠心チューブに溶出を転送します。真空熱時間 300 分と 40 ° C で一晩乾燥する溶出液を集中します。
注: 実験はここで一時停止することができます。-80 ° C でサンプルを凍結し、後日続行します。
5. 二酸化チタン濃縮25 pY ペプチドの
- 50% の 200 μ L でリン酸化ペプチドを乾燥した再懸濁します ACN、0.1 %tfa。渦との遠心分離機に 10,000 x g で 30 s. 繰り返しこの 1 x へのそれらをよく再懸濁します。
- 200 μ L のサンプルの容量を持っているヒントに含まれる TiO2ビーズを準備しています。
- そのために材料を移動の先端の小さい先端側に軽きます。100% の 200 μ L を追加することで先端を洗浄 ACN、続いて先端を反転、キャップの方の液体を移動する小さい方の端にフリックします。
- かみそりの刃を使用すると、先端の小さな先端を切り取って低蛋白結合管の上に置きます。(チューブの側面に固執する、TiO2、ポリスチレンのチューブを使用しないでください。)キャップを外し、残りの ACN を突入するマイクロ ピペットを挿入します。100% の 200 μ L で洗浄を繰り返す ACN。TiO2 ビーズは、次の手順のため低蛋白結合管に今あります。
- TiO2 500 μ L 100% ACN 2 の前提、裏付け x。ピペットで移しなさい溶媒とビーズをミックス。1 分 100 × g で遠心分離機に。
- 条件 TiO2の 0.2 M リン酸ナトリウム緩衝液 (〜 7) 500 μ L で 2 倍。平衡の 300 μ L でビーズ バッファー 3 倍洗浄。TiO2は非常に密、ビーズはすぐに解決されます。
- 50% を 400 μ l 添加 ACN、0.1% 低蛋白結合管に TFA に続いて乳酸の 84 μ L 追加。低蛋白結合管に再懸濁のリン酸化ペプチドを転送し、エンド オーバー エンドの回転子を使用して室温で 1 時間インキュベートするそれら。
- それらをペレットに 1 分間、100 x g でビーズを遠心します。平衡バッファー 2 (表 1) の 300 μ L で洗って x と 1 分 100 x g でそれらを回転停止。
- 300 でビーズを洗浄洗浄の μ L バッファー 2 倍。0.2 μ m スピン フィルターに転送します。1 分の 1,500 × g でそれらを回しなさい。
- きれいな 1.5 mL 低蛋白結合管にフィルター ユニットを転送します。2 内容を溶出 200 μ L H2o. メジャー 10 と 11 の間にする必要がありますの pH ストリップと pH に 0.9% NH3で x。真空集中一晩アンモニアを蒸発させるための乾燥に溶出します。
6. MS 解析の pY ペプチドの脱塩
- 0.1% の 15 μ L でリン酸化ペプチドを再構成ボルテックスとそれらを 30 10,000 × g で遠心分離によって TFA s にそれらを再懸濁します。この 1 x へのそれらをよく再懸濁しますを繰り返します。上下のピペットはないです。
- 5 μ g の結合容量を持つ C-18 ヒントを使用してサンプルをきれいにし製造元のプロトコルに従います。
- 完全に真空濃縮による溶出量を乾燥します。これは 1-2 h. 質量分析ソリューションの 12.5 μ L で、乾燥調製したカゼインホスホペプチドを再懸濁します (表 1参照) (または研究者の MS が推奨としてプロテオミクス コア施設)。渦糸と簡単にそれらをよく再懸濁しますに 30 s. 繰り返しこの 2 倍の 10,000 x g でソリューションをスピンダウンします。サンプル質量ファシリティー (手順 11) に提出する準備ができています。
注: 以下の手順は pST ペプチド濃縮のみに関連しています。
7. 逆相 pST ペプチドの抽出
- ペプチド アッセイを行いステップ 4.6 から取得した上澄みのペプチド濃度を測定します。PST の質量分析のための十分な量は、2.5 mg です。
- 5% で 3.5 に pH を合わせなさい TFA。
- 真空マニホールドに C-18 列の短い方の端を接続します。真空 17 と 34 kPa の間 (または製造元の指示に従って) を設定します。3 ml の 100% の列を濡れている ACN。列の乾燥をさせてください。
- 6 ml の 0.1 %2 x 3 mL として適用される TFA のコラムを平衡させ。列に酸性のサンプルをロードします。一度に 3 mL 以上を追加しないでください。1 秒あたり約 1 〜 2 滴をターゲットに真空を調整します。
- 0.1 %tfa 適用 3 x 3 mL 程度の 9 mL を洗い流します。40% の ml の 2 列を溶出 ACN、0.1 %tfa。ガラス培養管に 2 つの 2 mL 分数を収集します。列を破棄します。
- パラフィルムで溶出液管をカバーし、20 G 針を使用してカバーの 3-5 穴をパンチします。それが完全に固体になるまで少なくとも 30 分のドライアイスの溶出液を凍結します。
- 一晩選択した画分を凍結乾燥します。次の日にサンプル、エアカーテンを停止する前に完全に乾燥していることを確認します。-80 ° C で繊細なワイプと 50 mL の円錐管にチューブを格納します。
注: 実験はここで一時停止することができます。
8. 強い陽イオン交換 (SCX) pST ペプチドの
- 2 mL のバッファー A (表 1) で凍結乾燥させたペプチドを再懸濁します。各サンプルの分数をプールします。(ソリューションが曇りとなります)
- 真空マニホールドを準備します。削除プランジャーで SCX カラムを 3 mL の注射器に接続します。真空 17 と 34 kPa の間 (または製造元の指示に従って) を設定します。
- A. バッファーの 4 mL に続いて、ACN の ml の 4 社の SCX 列を条件します。
- 8.1 のステップから 2 mL サンプルを読み込むし、すぐに溶出液を収集します。3 mL の A:B (80.9:19.1) バッファーをロードし、溶出液を収集します。2 mL 低蛋白結合管にそれらで各サンプルと割り切れるの溶出物をプールします。
- 真空は、ボリュームの約 30% が残っているまで、すべてのサンプルを集中します。(この手順は約 2-4 時間)。各サンプルの 1 低蛋白結合管に試料をプールします。
- 真空マニホールドに C-18 列の短い方の端を接続します。真空 17 と 34 kPa の間 (または製造元の指示に従って) を設定します。3 ml の 100% の列を濡れている ACN 2 x。かないように乾燥の列。
- 3 ml の 0.1% のコラムを平衡させ TFA 2 x。列にサンプルをロードします。一度に 3 mL 以上を追加しないでください。1 秒あたり約 1 〜 2 滴をターゲットに真空を調整します。
- 3 ml の 0.1% の列を洗う TFA 2 x。50% の ml の 4 列を溶出 ACN、0.1 %tfa。
9. 二酸化チタン pST ペプチドの濃縮
-
200 μ L のサンプルの容量を持っているヒントに含まれる TiO2ビーズの準備
- その端にビーズを移動の先端の小さな探針側に軽きます。キャップをはずし、ポリプロピレン 15 mL の円錐管にビーズを注ぐ。
- 100% の 200 μ L を追加することで先端を洗浄 ACN、先端を数回反転とキャップの方の液体を移動する小さい方の端にフリックします。かみそりの刃を使用すると、先端の小さな先端を切り取ってポリプロピレン 15 mL の円錐管の上に置きます。キャップを外し、残りの ACN を突入するマイクロ ピペットを挿入します。100% の 200 μ L で洗浄を繰り返す ACN。TiO2ビーズは次の手順で 15 mL の円錐管に今あります。
- TiO2 500 μ L 100% ACN 2 の前提、裏付け x。ピペットで移しなさい溶媒とビーズをミックス。1 分 100 × g で遠心分離機に。
- 条件 TiO2の 0.2 M リン酸ナトリウム緩衝液 (〜 7) 500 μ L で 2 回。平衡の 300 μ L でビーズ バッファー 3 倍洗浄。
- ポリプロピレン 15 mL の円錐管に溶出したリン酸化ペプチドを転送します。乳酸の 560 μ L を追加し、エンド オーバー エンドの回転子を使用して室温で 1 時間インキュベートします。
- ビーズをペレットに 1 分間、100 x g で混合物を遠心分離機します。平衡バッファー (表 1) 3 の 300 μ L で洗って x。1 分の 100 x g でそれらを回しなさい。
- 300 でビーズを洗浄洗浄の μ L バッファー 2 倍。0.2 μ m スピン フィルターに転送します。1 分の 1,500 × g でそれらを回しなさい。
- きれいな 1.5 mL 低蛋白結合管にフィルター ユニットを転送します。2 内容を溶出 200 μ L H2o. に 0.9% NH3で x解決策はそれらを溶出する前に 2 分のリン酸化ペプチドの上に座るをみましょう。10 と 11 の間であるべき pH を測定します。
- 真空集中一晩アンモニアを蒸発させるための乾燥に溶出します。
10 MS 分析 pST ペプチドの脱塩
- そのために材料を移動の先端の小さい先端側に軽きます。100% の 200 μ L を追加することで先端を洗浄 ACN、続いて先端を反転、キャップの方の液体を移動する小さい方の端にフリックします。
- かみそりの刃を使用すると、先端の小さな先端をカットし、ポリプロピレン 15 mL コニカル チューブ.の上に置きますキャップを外し、残りの ACN を突入するマイクロ ピペットを挿入します。100% の 200 μ L で洗浄を繰り返す ACN。TiO2 ビーズは次の手順でポリプロピレン 15 mL の円錐管に今あります。
- C-18 チップを用いた結合容量 100 μ g のサンプルをクリーンアップ (製造元の指示に従ってください)。
- 完全に真空濃縮による溶出量を乾燥します。これが 1-2 時間かかります。
- 12.5 μ L 質量分析ソリューション (または研究者の MS プロテオミクス コア施設で推奨どおり) で乾燥したリン酸化ペプチドを再懸濁します。渦 30 10,000 × g で遠心分離機のそれらおよび s. を繰り返します 2 倍もそれらを再懸濁します。(はないピペット上下。)
11. 質量分析
- 液体クロマトグラフィー ・ タンデム MS (クロマトグラフィー-タンデム質量) が推奨される設定を使用してを実行する MS プロテオミクス コア施設にサンプルを提出します。設定の例とおり (概要の表 2を参照)。
- トラップの列にサンプルの 5 μ L を読み込む (2 cm 長さ x は 75 μ m の直径) 0.1% で洗って、5 μ L/分の流量で 5 分間 TFA。
- 300 nL/min の流量でナノ分析カラム (20 cm x 75 μ m) に沿ってトラップをもたらします。
- セグメント化された線形グラデーション (0.16% ギ酸、80% の割合で 0.2% ギ酸 ACN) pY と pST のサンプル間で異なっています。
- PY サンプルの 5 分 4-15%、40 分で 15-50%、5 分で 50-90% の勾配を使用してそれらを溶出します。
- Pst ファイルのサンプル、30 分で 4 〜 15%、40 分で 15-25%、44 分の 25-50%、11 分の 50-90% の勾配を使用してそれらを溶出します。
- 続いて MS/MS (HCD、27% の相対的な衝突エネルギー) の 20 の最も強烈なイオンおよび動的除外期間 20 120,000 の解像度でフル スキャンの繰返しシリーズとデータ依存・ アクイジション ・ モードの MS データを集録 s。
- 補完を実行する MS 後に、、リン酸化ペプチドの定量化の MS 分析ソフトウェア プログラムに MS の raw ファイルをインポートします。(MaxQuant ソフトウェア8,26,27は、この実験で使用されました。テーブル 3で指定されている場合を除き、既定の設定が使用されます。)
結果
このプロトコルでは、蛋白質の抽出とリン酸化ペプチド濃縮とその後の MS 分析 (図 1) に続いて消化の方法について詳しく説明します。すべてのバッファーとこのプロトコルで使用されるソリューションの組成物は、表 1に表示されます。Lys C およびトリプシンの連続使用は、効率的な消化を提供します。ライセート消化後の染色完全な消化力 (図 2 a) を確認しながら、Coomassie 染色ゲル事前消化の lysate は蛋白質の存在を確認します。完全な消化力のバンドが表示されますない 15 kDa、30 kDa と Lys C およびトリプシン、23.3 kDa バンドを除く上記それぞれ。Lys-C の添加は、逃された開裂 (図 2 b) の回数も減ります。PY ペプチドは、リン酸化プロテオーム28の 2% だけを表す、ために、pY 特異抗体を用いた pY ペプチドの免疫沈降は pY ペプチド濃縮の最初のステップです。結果上澄み pST ペプチド濃縮のための入力になります。PY 免疫沈降は効果的に pST ペプチド、平均 pY 準備から識別されるリン酸化ペプチドの 85% は pY (図 3 a) と pST 準備から識別されるリン酸化ペプチドの 99% 以上がから pY ペプチドを分離します。pST (図 3 b)。二酸化チタンは、両方の準備でチタニアカラムを豊かに使用されます。リン酸化は MS 準備準備におけるペプチドの予想される割合は 30 ~ 50% (図 4 a) です。リン酸化ペプチド濃縮率の変動は、pST ペプチドよりも多くの少ない pY ペプチドである結果として pY 準備のために大きい場合があります。リン酸化ペプチド種の面で検出されたリン酸化ペプチドの大半がシングルまたはダブルのリン酸化グループ (図 4 b) あります。
質量分析を実行した後は、MS の raw ファイルは MS 分析ソフトウェアに読み込まれます。実験で使用されるパラメーター設定の表 3に掲げるソフトウェアからは、異なります、バージョンごとに異なる場合があります。記載されていないパラメーターは、ペプチド スペクトルに一致する (PSM) 変更されたペプチド27の識別のための 40 のアンドロメダ スコアが最小の 1% のカットオフ、FDR を含め、既定値として残っていた。それぞれ約 pY ペプチドの 5% と 15%、pS と pT ペプチドの 34% を 0.75 フィルター以上のローカリゼーション確率カットオフを設定 (図 5 a)。これらのフィルターを適用すると、MS 解析終了時のリン酸化ペプチドの同定数の期待値は約 300 (5 mg 開始蛋白質) の pY ペプチドと約 7,500 の pS ペプチド (の開始のペプチドの 2.5 mg 640 pT ペプチド量) からそれぞれ濃縮製剤 (図 5 b)。複製の数とリン酸化ペプチドの信号強度の変動は、統計比較のため十分な電力を供給を決定します。生物学的重複またはトリプリケートのいずれかを含むグループに対して 4 つの個別の実験の変動 (CV %) 検出されたリン酸のパーセントの係数を求めた。(例えば図 5で pst ファイル グループ 1-5) 低い変動の分布を示す、サンプルの収集、準備、および質量分析実行一貫性がなかった。その一方で、高い変動 (例えば図 5で pST グループ 6) の分布は大きいフォールド - 下流の差分解析で有意差を検出するための変更が必要となるノイズの多いデータを示します。
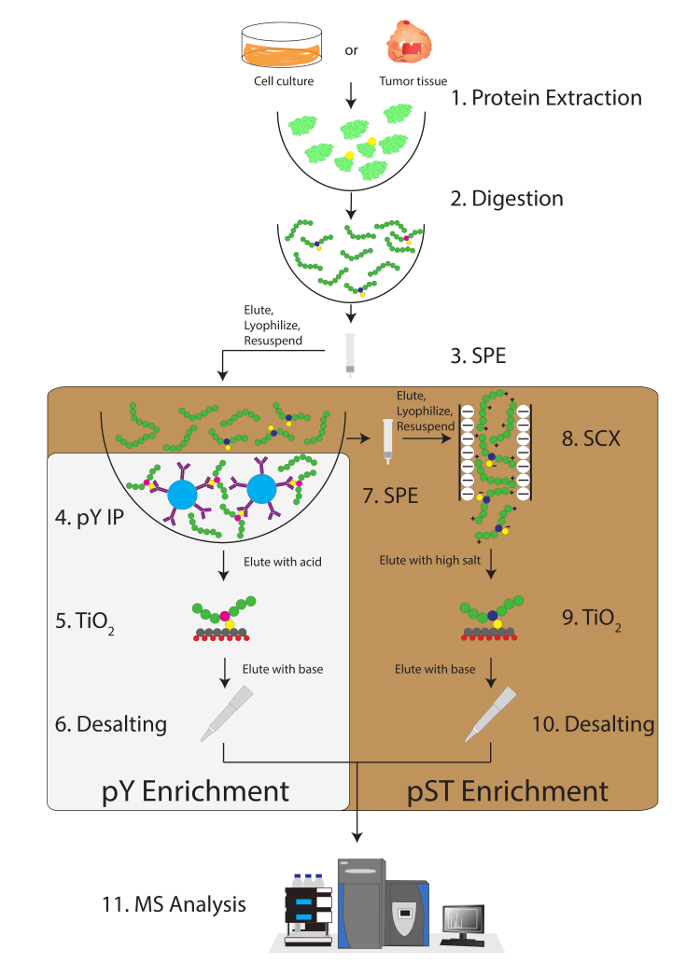
図 1: ワークフロー ダイアグラム。サンプルからの蛋白質の抽出され消化します。固相抽出 (SPE) は、ペプチドを抽出し、ホスホチロシン (pY) ペプチドが沈澱.並行して、役割/スレオニン (pST) ペプチドは、pY 免疫沈降手順の上澄みから濃縮されています。強い陽イオン交換 (SCX) は、イオン抑制12を減らすために高度に荷電ペプチドを削除する上清実行されます。両方の準備は、リン酸化ペプチド濃縮を介して酸化チタン (TiO2) を受けます。サンプルのクリーンアップの後、液体クロマトグラフィー ・ タンデム質量分析法 (MS/LCMS) リン酸化ペプチド量測定されます。リン酸化ペプチドを識別するために MS 解析ソフトウェアには、生データが読み込まれます。この図の拡大版を表示するのにはここをクリックしてください。
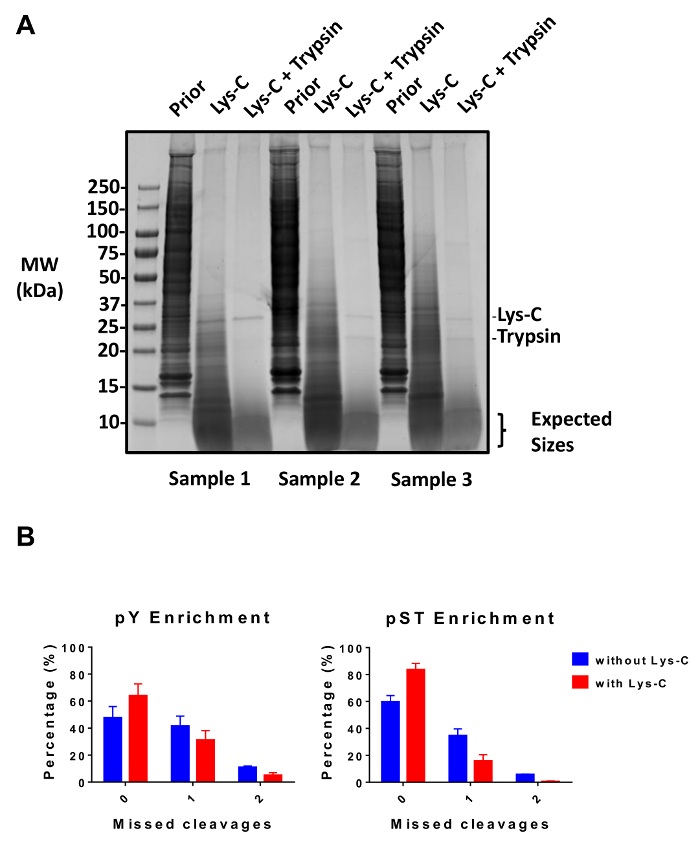
図 2: 消化性。(A) 3 つのライセート事前消化、後 Lys C 消化の 12.5 μ g のサンプル、後のトリプシンの消化力が表示されます。Coomassie ゲル染色テストは、Lys C やトリプシンの連続使用後きれいな消化を示しています。分子量 (MW) サイズ マーカーは、キロダルトン (kDa)。(B)A Lys-C は、プロトコルに追加された後に逃された亀裂の減少が観察されます。逃した劈開せずリン酸化ペプチドの割合 64% に 48% と 60% から 84% から平均で pY と pST の濃縮製剤のそれぞれ増加します。グラフ要約しなくても、Lys C 2 つの実験から得られたデータと Lys c. の 5 つの実験誤差は、標準偏差 38 pY と (Lys-C) なし 2 の独立した実験から 38 の pST サンプルと 62 坪 (Lys-C) と 5 の独立した実験から 60 の pST サンプルを表します。この図の拡大版を表示するのにはここをクリックしてください。
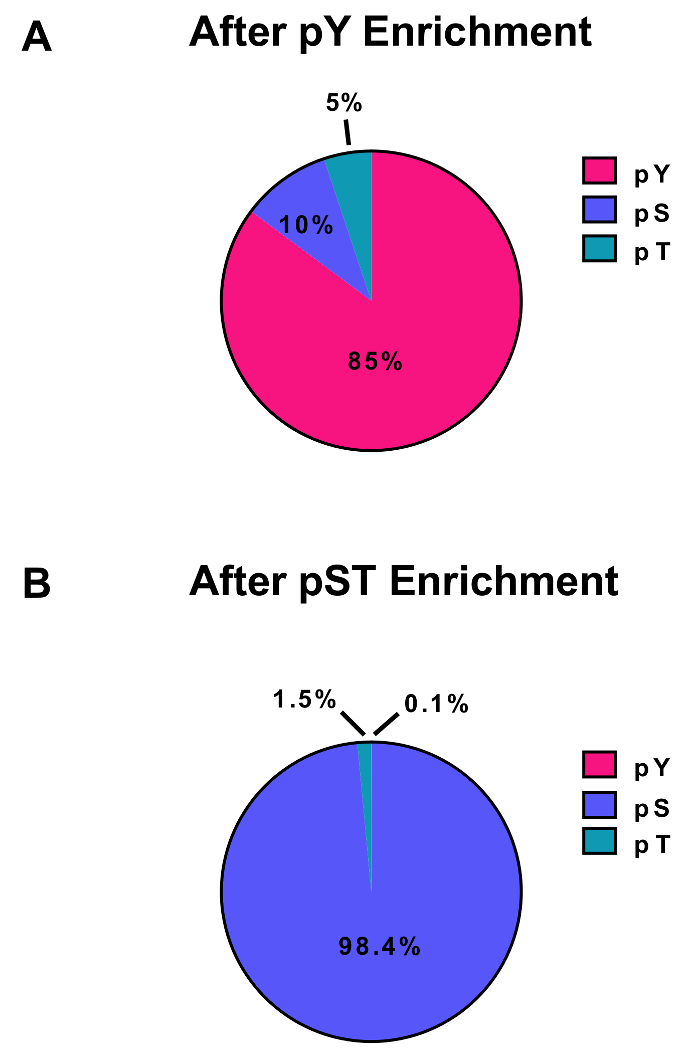
図 3: pY と pST のリン酸化ペプチドの濃縮します。これらのパネルは、pST 濃縮製剤 (A) pY または (B) から pSTY をリン酸化ペプチドの割合を示します。PY 免疫沈降法及び二酸化チタンで pY 濃縮の結果 pST 濃縮リン酸化ペプチドの 0.1% だけは pY pY ペプチド、85% のリン酸がされています。これらの値は、リン (汚染物質、逆シーケンス、およびローカリゼーション確率 0.75 未満でリン酸化ペプチドをフィルタ リングした後 1 つの代表的な実験の STY)Sites.txt ファイルを調べることから描かれていましたです。この図の拡大版を表示するのにはここをクリックしてください。
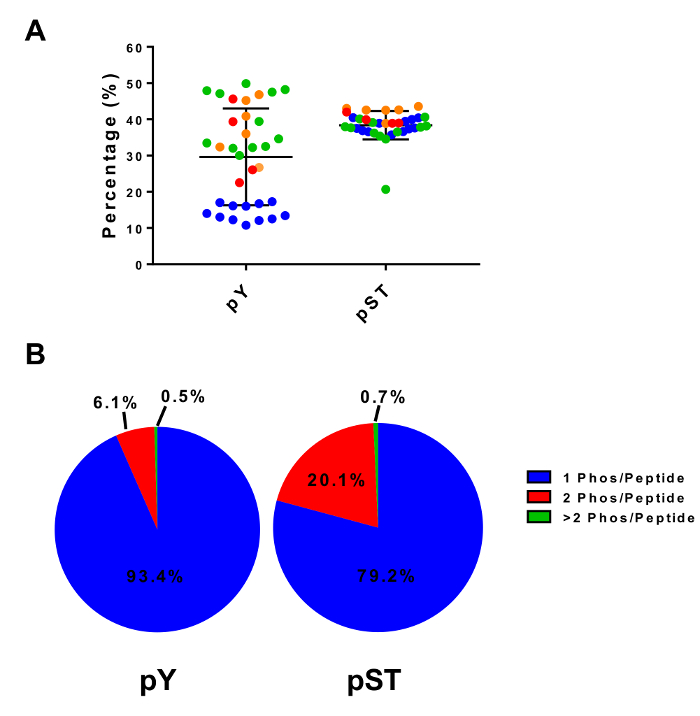
図 4: リン酸化ペプチド濃縮二酸化チタンと。(A) 4 つの別々 の実験のサンプルから (合計ペプチド) を基準にして検出されたリン酸化ペプチドのパーセンテージが表示されます。(B) このパネルは、4 つの独立した実験でモノラル ・ ダブル ・ マルチ リン酸化ペプチドの平均組成を示しています。パネルAの誤差は、標準偏差です。この図の拡大版を表示するのにはここをクリックしてください。
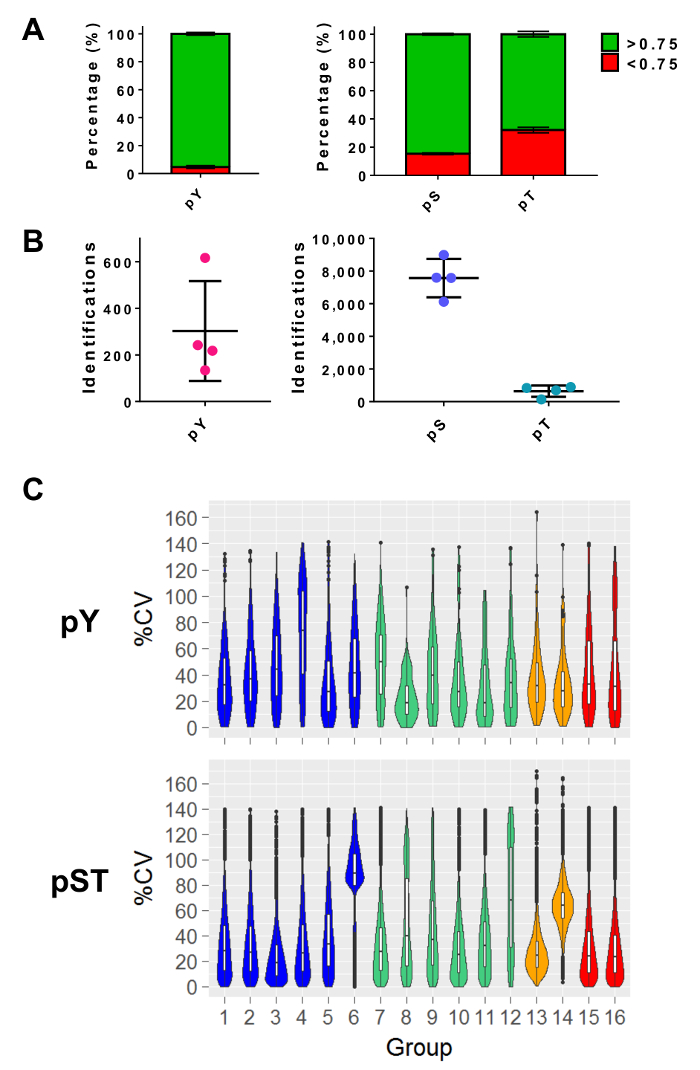
図 5: phosphoresidue の識別を期待します。(A) このパネル pY 濃縮 (左) と pST 濃縮 (右) から Id のリン酸化のローカリゼーションの確率を示しています。> 0.75 確率カットオフを満たす Id の平均割合は 93%、75%、52 %py, pS, pT、それぞれ。(B) 平均値と Id の数、> 0.75 ローカリゼーション確率は py 300、pS の 7,500 pt 640。(C) このパネルは、リン酸化ペプチドの変動 (%cv) 率係数のバイオリン プロットを示しています。%Cv の評価は、各生物の複製または帳票グループの信号強度の値が検出された場合のみ行った。データは、4 つの独立した実験から取られました。パネルAとBの誤差は、34 坪からの標準偏差および 34 pST サンプル 4 の独立した実験からです。この図の拡大版を表示するのにはここをクリックしてください。
| バッファー | ボリューム | 組成 | |
| 6 M ため塩化換散バッファー | 50 mL | 6 M のための塩化物、100 mM tris pH 8.5、10 mM トリス (2-カルボキシメチルリジン) ホスフィン、40 mM chloroacetamide、2 mM ナトリウム バナジン ピロりん酸ナトリウム 2.5 mM、1 mM の β-グリセロリン酸 500 mg n オクチル-配糖体、超純粋な水のボリュームに | |
| 100 mM ピロりん酸ナトリウム | 50 mL | 超純水のボリュームにピロリン酸二ナトリウム 2.23 g | |
| 1 M β-グリセロリン酸 | 50 mL | 15.31 g β-グリセロリン酸、ボリュームに超純水 | |
| 5% トリフルオロ酢酸 | 20 mL | 19 mL 超純粋な水に 100% トリフルオロ酢酸 1 mL を追加します。 | |
| 0.1% トリフルオロ酢酸 | 250 mL | 245 mL 超ピュアな水を 5 mL 5% トリフルオロ酢酸を追加します。 | |
| pY 溶出バッファー | 250 mL | 0.1% トリフルオロ酢酸 40% アセトニ トリル、ボリュームに超純水 | |
| pST の溶出バッファー | 250 mL | 0.1% トリフルオロ酢酸 50% アセトニ トリル、ボリュームに超純水 | |
| IP 結合バッファー | 200 mL | 50 mM トリス pH 7.4 では、50 mM の塩化ナトリウム、ボリュームに超純水 | |
| 25 mM 重炭酸アンモニウム、pH 7.5 | 10 mL | 10 mL 滅菌超純水水、pH を 7.5 1 N 塩酸に溶けて 19.7 mg (10 ~ 15 μ L/10 ml の溶液)、新鮮なを確認 | |
| 1 M のリン酸バッファー、pH 7 | 1,000 mL | 423 mL 1 M ナトリウム二水素リン酸塩、577 mL 1 M ナトリウム リン酸水素 | |
| 平衡バッファー | 14 mL | 6.3 mL アセトニ トリル、280 μ L 5% トリフルオロ酢酸、1740 μ L 乳酸、5.68 mL 超純水 | |
| 洗浄バッファー | 20 mL | 9 mL のアセトニ トリル、400 μ L 5% トリフルオロ酢酸、10.6 mL 超純水 | |
| 質量分析ソリューション | 10 mL | 500 μ L のアセトニ トリルがあり、200 μ L 5% トリフルオロ酢酸、9.3 mL 超純水 | |
| バッファー A | 250 mL | 5 mM リン酸二水素カリウム (pH 2.65)、30% アセトニ トリル、塩化カリウム 5 mM、超純水のボリュームを | |
| バッファー B | 250 mL | 5 mM リン酸二水素カリウム (pH 2.65)、30% アセトニ トリル、塩化カリウム 350 mM、ボリュームに超純水 | |
| 0.9% 水酸化アンモニウム | 10 mL | 300 μ L 29.42% 水酸化アンモニウム、9.7 mL 超純水 | |
表 1: バッファーおよび解決します。このテーブルは、ソリューションをこのプロトコルで使用されるバッファーの組成を示しています。
| クロマトグラフィー-タンデム質量設定 | ||
| パラメーター | pY 設定 | pst ファイルの設定 |
| (Μ L) の読み込みをサンプルします。 | 5 | |
| 負荷流量 (μ L/分) | 5 | |
| グラデーション流量 (nL/min) | 300 | |
| 線形グラデーション (率 0.16% ギ酸、80% 0.2% ギ酸で ACN) | 4-5 分 15% | 4-30 分 15% |
| 15-40 分の 50% | 15-40 分の 25% | |
| 50-5 分の 90% | 25-44 分の 50% | |
| 50-11 分の 90% | ||
| フル スキャン解像度 | 120,000 | |
| 選択されている最も強烈なイオンの数 | 20 | |
| 相対的な衝突エネルギー (%)(HCD) | 27 | |
| 動的除外 (s) | 20 | |
表 2: LC MS 設定します。これは、典型的な散弾銃プロテオーム実験で LC MS 設定の例です。サンプルは、トラップの列に読み込まれました。トラップは、分析カラムと行で持って来られました。これらの設定が [テーブルの材料および試薬LC MS システムを使用するために最適化されました。これらの設定は、他の LC MS システムを調整する必要があります。
| MaxQuant パラメーターの設定 | ||
| 設定 | アクション | |
| グループ固有のパラメーター | ||
| タイプ | タイプ | 規格を選択します。 |
| 多様性 | 1 に設定します。 | |
| 消化モード | 酵素 | トリプシン/P を選択します。 |
| Max。逃した亀裂 | 2 に設定します。 | |
| 変更 | 変数の変更 | リン (ものもらい) を追加します。 |
| 無料のラベルの定量化 | 無料のラベルの定量化 | LFQ を選択します。 |
| LFQ 分率のカウント | 1 に設定します。 | |
| 高速 LFQ | オフにチェックします。 | |
| その他 | 再を定量化します。 | オフにチェックします。 |
| グローバル パラメーター | ||
| シーケンス | FASTA ファイル | UniProt からダウンロード選択 fasta ファイル |
| 固定の変更 | Carbamidomethyl (C) を追加します。 | |
| (副) 識別 | 実行の間に一致します。 | オフにチェックします。 |
| 試合時間ウィンドウ | 5 分に設定します。 | |
| 配置期間 | 20 分に設定します。 | |
| 正体不明の機能に一致します。 | オフにチェックします。 | |
| プロテインの定量 | 分率のカウント | 1 に設定します。 |
| フォルダーの場所 | 適宜変更します。 | |
テーブル 3: MS 分析ソフトウェア設定します。MaxQuant、この表で特定のグループとグローバル パラメーターが選択または調整。他のすべてのパラメーターは、既定で推移しました。バージョン 1.5.3.30 を使用してこれらの実験を行った。バージョンからバージョンとソフトウェアから、パラメーターが異なる場合があります。
ディスカッション
リン酸化ペプチドの豊かにこのプロトコルを活用する前に、実験的なデザインを慎重に考慮が重要です。技術的複製よりも質量分析法資源の効率的な利用は、生物の複製を使用しています。必要とされる複製の数は、データの変動に関する部分で異なります。最近の研究では、わずか 3 つを超えて複製数の増加と、id の数が大きくなりますより多くのグループ間の重要な識別数が10をレプリケートすることを示した。
細胞内のリン蛋白質の低い豊富なのため十分な開始蛋白質量は検出モードに前立腺癌のサンプルからグローバル化プロテオームを取得する必要があります。これらの実験でタンパク質の 5 mg が使用されました。この細胞ライン依存になりますが、細胞の約 5 つのほぼ合流 15 cm 料理はこのプロトコルへの入力として十分なタンパク質を提供します。タンパク質の予想収量は, 腫瘍組織は組織重量の約 6-8% です。体外の設定で考慮する肯定的な制御サンプル、セルを収穫する前に 30 分間 1 mM バナジン酸の追加です。バナジン酸塩、競争力のある蛋白質 phosphotyrosyl ホスファターゼ阻害剤は、pY ペプチド同定29の数が増えて、チロシンリン酸化が保持されます。
きれいな消化はリン酸化ペプチドの同定を最大化する重要なステップです。Coomassie 染色試験に加え消化効率 (図 2) を評価するデータの不在の開裂の % を使用できます。品質管理ソフトウェアは、不在と MS データ品質30を評価する他の統計情報を分析します。トリプシンは最も一般的な代替のプロテアーゼがあります5トリプシンの最適なペプチドがすることはできません、プロテオームのカバレッジ隔たりに対処するには31が生成されます。MS 分析ソフトウェアの設定は、プロテアーゼの変化に合わせて適宜変更する必要があります。
プロトコルは、二酸化チタン (TiO2) チタニアカラムを豊かにするだけでなく、免疫沈降 (pY) (濃縮) 用を採用しています。ペプチドを豊かに代替的なアプローチが含まれて固定化金属アフィニ ティー ・ クロマトグラフィー (IMAC)、金属酸化物アフィニ ティー ・ クロマトグラフィー (MOAC) 水酸化アルミニウムと高分子金属イオン親和性をキャプチャ (PolyMAC)などの他の金属酸化物には5,12。前の研究は、異なる濃縮方法が調製したカゼインホスホペプチド32の異なった人口の豊かな示しています。例えば、IMAC は、MOAC 好ましくモノラル リン酸化ペプチド33豊かながらより複数リン酸化ペプチドを富ませます。このプロトコルの代表の結果は、この観測 (図 4 b) を反映します。最近の出版物は、IMAC と MOAC ハイブリッド素材を使用して提供できること潜在的リン酸化ペプチド種34の大きな範囲を示した。したがって、このプロトコルは、さらに包括的プロテオーム解析を可能にする並列に他の濃縮方法を利用する変更でした。
MaxQuant26ソフトウェア スイートがこのプロトコルで MS データの分析に使われ、商業アプリケーション35もリン酸化ペプチドの同定及び定量化の使用できます。リン酸化ペプチドの同定、カットオフ ローカリゼーション確率が適用されます。このフィルターを実行して、phosphoresidue 識別10,28で (すなわち、0.75 以上) 高安心してチタニアカラムを選択します。つまり、リン グループを含む可能性があるその他のすべての残基の合計の確率は 0.25 未満です。このカットオフは、リン酸化ペプチド選択の金詰りを高めるため発生可能性があります。Id の数、pY ペプチド数の期待値は、pST ペプチド数の期待値は高いの何千もの何百ものです。これらの値は、約 2%、12% と、phosphosites の 86% が pY、pT、pS、それぞれ28以前リン酸化プロテオーム分散を反映します。
PY と pST 濃縮のステップは、並列で実行されます、プロトコルではサンプルの準備の手順が 6 日間で完了できます。MS の強力なツールと組み合わせることでは、このようなリン酸化ペプチド濃縮プロトコルは科学者が彼らのそれぞれ分野でリン酸化プロテオームの分析データを収集するためのグローバルなアプローチを提供します。
開示事項
著者が明らかに何もありません。
謝辞
原稿にアドバイスと入力提供するドレイク研究室のメンバーに感謝いたします。我々 もアドバイスを提供し、我々 のサンプルの質量分析を実行するため生物質量分析施設のロバート ・木材ジョンソン医学と、州立大学ニュージャージー州のラトガース大学のメンバーに感謝します。ラリー c. チェンは、によって、国立医学研究所の一般的な受賞番号 T32 GM008339 の下で健康の国民の協会のサポートします。トーマス G. グレーバーは NCI/NIH (前立腺がん P50 CA092131; 胞子によってサポートされてP01 CA168585) とアメリカ癌学会の研究学者奨励賞 (RSG-12-257-01-TBE)。ジャスティン ・ m ・ ドレイクに支えられて、部門の防衛前立腺がん研究プログラム W81XWH-15-1-0236、前立腺がん財団若手研究者賞、ニュージャージー健康財団、ラトガース大学から精密医療イニシアティブ パイロット賞ニュージャージー州のがん研究所。
資料
| Name | Company | Catalog Number | Comments |
| Ultra-Low Temperature Freezer | Panasonic | MDF-U76V | |
| Freezer -20 °C | VWR | scpmf-2020 | |
| Swing rotor bucket | ThermoFisher Scientific | 75004377 | |
| Vacuum manifold | Restek | 26080 | |
| Lyophilizer | Labconco | 7420020 | |
| CentriVap Benchtop Vacuum Concentrator | Labconco | 7810010 | |
| End-over-end rotator | ThermoFisher Scientific | 415110Q | |
| Razor blade | Fisher Scientific | 620177 | |
| Amicon Ultra-15 Centrifugal Filter Units | Millipore Sigma | UFC901024 | |
| Glass culture tubes | Fisher Scientific | 14-961-26 | |
| Parafilm | Fisher Scientific | 13-374-12 | |
| 20G needle | BD | B305175 | |
| Kimwipes | Fisher Scientific | 06-666A | |
| Screw cap cryotube | ThermoFisher Scientific | 379189 | |
| Nunc 15 mL conical tubes | ThermoFisher Scientific | 12-565-268 | |
| Gel loading tips | Fisher Scientific | 02-707-181 | |
| Millipore 0.2 µm spin filter | Millipore Sigma | UFC30GVNB | |
| Low protein-binding Eppendorf tubes | Eppendorf | 22431081 | |
| anti-Phosphotyrosine, Agarose, Clone: 4G10 | Millipore Sigma | 16101 | |
| 27B10.4 antibody | Cytoskeleton | APY03-beads | |
| Peptide assay kit | Thermo Scientific | 23275 | Step 7 |
| TopTip | PolyLC Inc | TT200TIO.96 | Steps 5 and 9 |
| SCX columns (PolySULFOETHYL A) | PolyLC Inc | SPESE1203 | |
| 3 mL syringe | BD | 309657 | |
| Trifluoracetic Acid (TFA) | Fisher Scientific | PI-28904 | |
| Acetonitrile (ACN) | Fisher Scientific | A21-1 | |
| Lactic acid | Sigma-Aldrich | 69785-250ML | |
| Ammonium Hydroxide | Fisher Scientific | A669S-500 | |
| Potassium Phosphate Monobasic | Fisher Scientific | BP362-500 | |
| Potassium Chloride | Fisher Scientific | BP366-500 | |
| Calcium Chloride Dihydrate | Fisher Scientific | BP510-500 | |
| Tris Base | Fisher Scientific | BP152-5 | |
| Trypsin, TPCK Treated | Worthington Biochemicals | LS003740 | |
| Lysyl Endopeptidase | Wako Pure Chemical Industries, Ltd. | 125-05061 | |
| MonoTip | PolyLC Inc | TT200TIO.96 | Step 10 |
| ZipTip | MilliporeSigma | ZTC18S096 | Step 6 |
| nanoEase, MZ peptide BEH C18, 130A, 1.7 μm, 75 μm x 20 cm | Waters | 186008794 | Step 11: analytical column |
| Acclaim PepMap 100 C18 LC Columns | ThermoFisher Scientific | 164535 | Step 11: trap column |
| Ultimate 3000 RLSCnano System | Dionex | ULTIM3000RSLCNANO | Step 11 |
| Q Exactive HF | ThermoFisher Scientific | IQLAAEGAAPFALGMBFZ | Step 11 |
| MilliQ water | deionized water used to prepare all solutions and bufferes | ||
| Sonic Dismembrator | Fisher Scientific | FB-120 | sonicator |
| Polytron System PT | Kinematica AG | PT 10-35 GT | homogenizer |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2018. CA: A Cancer Journal for Clinicians. 68 (1), 7-30 (2018).
- Paller, C. J., Antonarakis, E. S. Management of biochemically recurrent prostate cancer after local therapy: evolving standards of care and new directions. Clinical Advances in Hematology & Oncology. 11 (1), 14-23 (2013).
- Lowrance, W. T., Roth, B. J., Kirkby, E., Murad, M. H., Cookson, M. S. Castration-resistant prostate cancer: AUA guideline amendment 2015. The Journal of Urology. 195 (5), 1444-1452 (2016).
- Domon, B., Aebersold, R. Options and considerations when selecting a quantitative proteomics strategy. Nature Biotechnology. 28 (7), 710-721 (2010).
- Zhang, Y. Y., Fonslow, B. R., Shan, B., Baek, M. C., Yates, J. R. Protein analysis by shotgun/bottom-up proteomics. Chemical Reviews. 113 (4), 2343-2394 (2013).
- Bantscheff, M., Schirle, M., Sweetman, G., Rick, J., Kuster, B. Quantitative mass spectrometry in proteomics: a critical review. Analytical and Bioanalytical Chemistry. 389 (4), 1017-1031 (2007).
- Bantscheff, M., Lemeer, S., Savitski, M. M., Kuster, B. Quantitative mass spectrometry in proteomics: critical review update from 2007 to the present. Analytical and Bioanalytical Chemistry. 404 (4), 939-965 (2012).
- Cox, J., et al. Accurate proteome-wide label-free quantification by delayed normalization and maximal peptide ratio extraction, termed MaxLFQ. Molecular & Cellular Proteomics. 13 (9), 2513-2526 (2014).
- Rubbi, L., et al. Global phosphoproteomics reveals crosstalk between Bcr-Abl and negative feedback mechanisms controlling Src signaling. Science Signaling. 4 (166), ra18 (2011).
- Hogrebe, A., et al. Benchmarking common quantification strategies for large-scale phosphoproteomics. Nature Communications. 9 (1), 1045 (2018).
- Rush, J., et al. Immunoaffinity profiling of tyrosine phosphorylation in cancer cells. Nature Biotechnology. 23 (1), 94-101 (2005).
- Fila, J., Honys, D. Enrichment techniques employed in phosphoproteomics. Amino Acids. 43 (3), 1025-1047 (2012).
- Mertins, P., et al. Proteogenomics connects somatic mutations to signalling in breast cancer. Nature. 534 (7605), 55-62 (2016).
- Drake, J. M., et al. Phosphoproteome integration reveals patient-specific networks in prostate cancer. Cell. 166 (4), 1041-1054 (2016).
- Lue, H. W., et al. Metabolic reprogramming ensures cancer cell survival despite oncogenic signaling blockade. Genes & Development. 31 (20), 2067-2084 (2017).
- Francavilla, C., et al. Phosphoproteomics of primary cells reveals druggable kinase signatures in ovarian cancer. Cell Reports. 18 (13), 3242-3256 (2017).
- Zhang, H., et al. Integrated proteogenomic characterization of human high-grade serous ovarian cancer. Cell. 166 (3), 755-765 (2016).
- Skaggs, B. J., et al. Phosphorylation of the ATP-binding loop directs oncogenicity of drug-resistant BCR-ABL mutants. Proceedings of the National Academy of Sciences of the United States of America. 103 (51), 19466-19471 (2006).
- Zimman, A., et al. Activation of aortic endothelial cells by oxidized phospholipids: a phosphoproteomic analysis. Journal of Proteome Research. 9 (6), 2812-2824 (2010).
- Zimman, A., Berliner, J. A., Graeber, T. G. Phosphoproteomic analysis of aortic endothelial cells activated by oxidized phospholipids. Methods in Molecular Biology. , 53-69 (2013).
- Humphrey, S. J., Azimifar, S. B., Mann, M. High-throughput phosphoproteomics reveals in vivo insulin signaling dynamics. Nature Biotechnology. 33 (9), 990-995 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72, 248-254 (1976).
- Meyer, T. S., Lamberts, B. L. Use of coomassie brilliant blue R250 for the electrophoresis of microgram quantities of parotid saliva proteins on acrylamide-gel strips. Biochimica el Biophysica Acta. 107 (1), 144-145 (1965).
- Bergstrom Lind, S., et al. Immunoaffinity enrichments followed by mass spectrometric detection for studying global protein tyrosine phosphorylation. Journal of Proteome Research. 7 (7), 2897-2910 (2008).
- Pinkse, M. W., Uitto, P. M., Hilhorst, M. J., Ooms, B., Heck, A. J. Selective isolation at the femtomole level of phosphopeptides from proteolytic digests using 2D-NanoLC-ESI-MS/MS and titanium oxide precolumns. Analytical Chemistry. 76 (14), 3935-3943 (2004).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nature Biotechnology. 26 (12), 1367-1372 (2008).
- Cox, J., et al. Andromeda: a peptide search engine integrated into the MaxQuant environment. Journal of Proteome Research. 10 (4), 1794-1805 (2011).
- Olsen, J. V., et al. Global, in vivo, and site-specific phosphorylation dynamics in signaling networks. Cell. 127 (3), 635-648 (2006).
- Huyer, G., et al. Mechanism of inhibition of protein-tyrosine phosphatases by vanadate and pervanadate. The Journal of Biological Chemistry. 272 (2), 843-851 (1997).
- Bielow, C., Mastrobuoni, G., Kempa, S. Proteomics quality control: quality control software for MaxQuant results. Journal of Proteome Research. 15 (3), 777-787 (2016).
- Swaney, D. L., Wenger, C. D., Coon, J. J. Value of using multiple proteases for large-scale mass spectrometry-based proteomics. Journal of Proteome Research. 9 (3), 1323-1329 (2010).
- Bodenmiller, B., Mueller, L. N., Mueller, M., Domon, B., Aebersold, R. Reproducible isolation of distinct, overlapping segments of the phosphoproteome. Nature Methods. 4 (3), 231-237 (2007).
- Leitner, A., Sturm, M., Lindner, W. Tools for analyzing the phosphoproteome and other phosphorylated biomolecules: a review. Analytica Chimica Acta. 703 (1), 19-30 (2011).
- Yang, D. S., et al. Design and synthesis of an immobilized metal affinity chromatography and metal oxide affinity chromatography hybrid material for improved phosphopeptide enrichment. Journal of Chromatography A. 1505, 56-62 (2017).
- Al Shweiki, M. R., et al. Assessment of label-free quantification in discovery proteomics and impact of technological factors and natural variability of protein abundance. Journal of Proteome Research. 16 (4), 1410-1424 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved