A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
השימוש Autometallography כדי להתאים לשפה וכסף למחצה לכמת ברקמות נושפים
In This Article
Summary
פרוטוקול מוצג כדי להתאים לשפה Ag ברקמות כבד וכליות נושפים על-ידי autometallography. יתר על כן, וזמינותו חדש, בשם וזמינותו Ag היסטולוגית (צ'ה) נושפים מפותחת כדי להעריך את ריכוזי Ag ברקמות הללו.
Abstract
סילבר חלקיקים (AgNPs) היו בשימוש נרחב במוצרים מסחריים, כולל מוצרי טקסטיל, מוצרי קוסמטיקה פריטים הבריאות, בגלל השפעתם מיקרוביאלית חזקה. הם גם עשויים ישוחררו לסביבה ולצבור באוקיינוס. לכן, AgNPs הן המקור העיקרי של זיהום Ag, גוברת המודעות הציבורית של רעילות סביבתי של Ag. מחקרים קודמים הדגימו את bioaccumulation (בהמפיקים) ואת ההגדלה (ב הצרכנים/טורפים) של Ag. יונקים ימיים, כמו הטורפים פיסגה של האוקיינוס, עלול להשפיע לרעה הושפעו תרכובות Ag/Ag. למרות הריכוזים של תרכובות Ag/Ag ברקמות נושפים נמדד על ידי פלזמה inductively בשילוב לספקטרומטרית מסות (ICP-MS), השימוש של ICP-MS הוא מוגבל על ידי ההון עלותו הגבוהה לבין הדרישה להכנה/רקמת אחסון. לכן, autometallography (AMG) שיטה עם ניתוח כמותי התמונה באמצעות פורמלין-קבוע, פרפין-מוטבע רקמות (FFPE) עשוי להיות שיטה אדג'וונט ולהתאימם לעגה Ag הפצה ברמת suborgan. מעריכים את הריכוז Ag ב- cetacean רקמות. האותות חיובי AMG הם בעיקר חום עד שחור גרגירים בגדלים שונים בציטופלסמה של proximal אפיתל אבובית הכליה, hepatocytes ותאים Kupffer. לעתים, קצת אמורפי מצהוב-זהוב לאותות חיובי AMG חום המונפשים לומן, קרום המרתף של כמה בקוריאנית כליות הפרוקסימלית. הבדיקה עבור הערכת הריכוז Ag שם את Cetacean היסטולוגית Ag Assay (צ'ה), אשר הוא מודל רגרסיה שנקבעו על-ידי נתוני התמונה ניתוח כמותי של שיטת AMG, ICP-MS. השימוש של AMG עם צ'ה כדי להתאים לשפה ומתכות כבדות למחצה לכמת מספק מתודולוגיה נוחים ללימודי-עתיים, קרוס-מינים.
Introduction
סילבר חלקיקים (AgNPs) היו בשימוש נרחב במוצרים מסחריים, כולל מוצרי טקסטיל, מוצרי קוסמטיקה פריטים הבריאות, עקב שלהם נהדר אפקטים מיקרוביאלית1,2. לכן, הייצור של AgNPs ואת מספר המוצרים המכילים AgNP הוגדלה לאורך זמן3,4. עם זאת, AgNPs וייתכן שישוחרר לסביבה ולצבור ב אוקיינוס5,6. הם הפכו להיות המקור העיקרי של זיהום Ag, המודעות הציבורית של רעילות סביבתי של Ag גוברת.
המצב של AgNPs ו- Ag בסביבה ימית הוא מורכב ומשתנה כל הזמן. מחקרים קודמים הראו כי AgNPs יכול להישאר כמו חלקיקים, צבירה, להמיס, להגיב עם צורון כימי שונה או ליצור מחדש Ag+ -יונים-7,-8. מספר סוגים של תרכובות Ag, כמו AgCl, התגלו משקעים ימיים, איפה הם יכול לקחת על ידי אורגניזמים בנתיק והזן את שרשרת המזון9,10. על פי מחקר קודם שנערך באזור הצ'י-ku הלגונה לאורך החוף הדרום-מערבי של טייוואן, ריכוזי Ag משקעים ימיים נמוך מאוד ודומה שפע מסדיקת הינם רקמת כבד דגים אלו בדרך כלל מתחת זיהוי להגביל (< 0.025 μg/g רטוב/לח)11. עם זאת, מחקרים קודמים שנערכו במדינות שונות הראו ריכוזים גבוהים יחסית Ag ב הכבדים של יונקים ימיים12,13. הריכוז Ag ב הכבדים של יונקים ימיים הוא תלוי גיל, רומז המקור של Ag בגופם הוא ככל הנראה את הטרף שלהם12. ממצאים אלה נוספים מראים את biomagnification של Ag בבעלי חיים ברמות גבוהות יותר של הזנה. יונקים ימיים, כמו הטורפים איפקס באוקיינוס, אולי סבלו השפעות בריאותיות שליליות הנגרמת על ידי Ag/Ag תרכובות12,13,14. והכי חשוב, כמו יונקים ימיים, בני אדם הם יונקים, הבריאות שלילי ההשפעות שנגרמו על ידי תרכובות Ag/Ag יונקים ימיים עלול להתרחש גם אצל בני אדם. במילים אחרות, יונקים ימיים יכול להיות בלוטת הזקיף חיות בשביל הבריאות של בני אדם וסביבה ימית. לכן, ההשפעות הבריאותיות, רקמות הפצה ו ריכוז של Ag ב יונקים הם דאגה גדולה.
למרות הריכוזים של תרכובות Ag/Ag ברקמות נושפים נמדד על ידי פלזמה inductively בשילוב לספקטרומטרית מסות (ICP-MS), השימוש של ICP-MS הוא מוגבל על ידי עלותו הבירה הגבוהה (ותחזוקה של כלי נגינה) והדרישות רקמת אחסון 12,/preparation15. בנוסף, קשה בדרך כלל לאסוף דגימות רקמה מקיף בחקירות כל המקרים נושפים נטוש בגלל קשיים לוגיסטיים, מחסור של כוח אדם, חוסר משאבים קשורים12. דגימות רקמה קפוא לניתוח ICP-MS לא מאוחסנים בקלות עקב שטח מוגבל קירור, דגימות רקמה קפוא ייתכן ימחקו עקב שבור קירור ציוד12. המכשולים הנ ל ה"בלתי חקירות של רמות זיהום ברקמות נושפים על ידי ניתוח של ICP-MS באמצעות דגימות רקמה קפוא. לעומת זאת, פורמלין קבוע דגימות רקמה קלים יחסית לאסוף במהלך necropsy המלח גדילי יונקים. לכן, יש צורך לפתח שיטה קלה לשימוש וזול כדי לזהות/מדד מתכות כבדות ברקמות נושפים באמצעות פורמלין קבוע דגימות רקמה.
למרות suborgan הפצות של ריכוזים של מתכות אלקליות, עפרורית עשויה להשתנות במהלך פורמלין-קבוע, פרפין-מוטבע (FFPE) תהליך, רק פחות השפעות על מתכות המעבר, כגון Ag, כבר ציין16. לפיכך, רקמת FFPE נחשב כאל משאב מדגם אידיאלי לוקליזציה מתכת ו מידות16,17. Autometallography (AMG), תהליך פתולוגיה, להגביר את מתכות כבדות כמו בגודל variably זהב צהוב שחור AMG אותות חיוביים על מקטעי רקמת FFPE, ואת אלה מתכות כבדות מוגבר, ניתן לאבחן תחת מיקרוסקופ אור18, 19 , 20 , 21. לפיכך, שיטת AMG מספק מידע על חלוקות suborgan של מתכות כבדות. זה יכול לספק פרטים נוספים חשוב ללמוד על מסלולים מטבוליים של מתכות כבדות במערכות ביולוגיות כי ICP-MS רק ניתן למדוד את ריכוז מתכות כבדות-איבר ברמה18. יתר על כן, תוכנת ניתוח תמונה דיגיטלי, כגון ImageJ, הוחל לניתוח כמותי של רקמות היסטולוגית סעיפים22,23. בגודל variably הצהוב הזהב לאותות שחור AMG חיובי סעיפים רקמת FFPE יכול להיות לכמת ומשמשת כדי להעריך את ריכוזי מתכות כבדות. למרות הריכוז Ag מוחלט אין אפשרות לקבוע ישירות על ידי שיטת AMG עם ניתוח כמותי של התמונה, זה יכול להיות לפי אומדן מודל רגרסיה בהתבסס על הנתונים המתקבלים ניתוח כמותי תמונה של ICP-MS, אשר נקרא cetacean Ag היסטולוגית assay (צ'ה). בהתחשב הקשיים במדידת ריכוזי Ag על ידי ניתוח של ICP-MS יונקים נטושים ביותר, צ'ה היא שיטה אדג'וונט יקר כדי להעריך Ag ריכוזים ברקמות נושפים, אשר לא יכול להיקבע על ידי ניתוח של ICP-MS בשל היעדר קפוא דגימות רקמה. מאמר זה מתאר את הפרוטוקול של טכניקה פתולוגיה (שיטת AMG) עבור לוקליזציה Ag ברמה suborgan, וזמינותו של שם צ'ה כדי להעריך את ריכוזי Ag ברקמות הכבד של יונקים ימיים.

איור 1: תרשים זרימה המתאר את הקמת ויישום של נושפים assay Ag היסטולוגית (צ'ה) עבור הערכת ריכוזים Ag- צ'ה = נושפים assay Ag היסטולוגית, FFPE = פורמלין-קבוע, פרפין-מוטבע, ICP-MS = פלזמה inductively בשילוב לספקטרומטרית מסות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Protocol
המחקר בוצע בהתאם להנחיות בינלאומיות, השימוש של דגימות רקמה נושפים הותרה על ידי המועצה של החקלאות של טייוואן (מחקר היתר 104-07.1-SB-62).
1. רקמות הכנת הדוגמא לניתוח ICP-MS
הערה: רקמות כבד וכליות שנאספו מ במתינות ובשקט טרי מת ל- autolyzed תקועים יונקים ימיים24, כולל יונקים נטושים 6 4 מינים שונים, 1 תזונתם העיקרי הקטבים (ג"ג), 2 אדפטציה spp. (Ko), 2 נראה hosei (Lh), 1 Stenella attenuata (Sa). כל cetacean תקועים היו מספר שדה עבור זיהוי אישי. ההכנה דגימת רקמה ICP-MS ניתוח עקב השיטה נוסדה במעבדה של מ. ה. חן, המעבדה מ. ה צ'ן שנערכו13,2511,ניתוח ICP-MS.
- לאסוף רקמות כבד וכליות לניתוח ICP-MS יונקים נטושים ואחסן אותם ב−20 ° C עד השימוש.
- לאסוף את הכבד מתאימים לזוג, רקמות כליה מאותו תקועים יונקים ימיים לניתוח AMG (ראה שלב 2).
- חתוך את השכבה החיצונית של דגימות רקמה שנאספו לניתוח ICP-MS עם איזמל מפלדת. לחתוך את החלק הפנימי של דגימות רקמה לקוביות קטנות (כ 1 ס מ3) ולמקם אותם בשקיות פלסטיק למנעול zip. בדרך כלל, כל התיק מכיל 10 גרם של הרקמות.
- לאחסן את שקיות פלסטיק המכיל דגימות רקמה על −20 ° C להליכי עוקבות.
- לשים את קוביות 1 ס מ3 דוגמאות להקפיא יבש מערכת (-50 ° C, משאבת ואקום עם תזוזה של פחות 98 L/דקה, 0.002 mBar) לפחות 72 h עד יבש לחלוטין על ידי שקילה לקבוע.
- Homogenize את קוביות יבשים לאבקה עם מהמגן לעיכול רקמות עוקבות.
- שוקל 0.3 g הומוגני דוגמאות הליחה בבקבוקי טפלון (PTFE) 30 מ של ומערבבים אותם עם 10 מ"ל של 65% חומצה חנקתית w/w.
- סגרים לשים הבקבוקים PTFE, אך להשאיר את הסגרים untightened.
הערה: זה מאפשר את fume חום לטופס בקבוקים PTFE, ריפלוקס שבתוך הבקבוק לעיכול עד fume חום נעלם והופך ברורה. - מחממים את הדגימות מתעכל עם פלטה, מ- 30 ° C עד 110/120 ° C (על פי fume חום ויוצרים מצב) לבקבוקים PTFE במשך 2-3 שבועות עד הגז חום לבקבוקים PTFE הופך חסר צבע ואת הנוזל בבקבוק PTFE הופך שקוף gree ניש פס צהוב או לגמרי נקי.
הערה: בצע את תהליך חימום בשכונה fume כימי. - מחממים הדגימות מעוכל-120 ° C עד להתאדות של חומצה חנקתית לבקבוקים PTFE עד 0.5-1 רק שרידים מ ל.
הערה: בצע את תהליך חימום בשכונה fume כימי, תמיד לעקוב אחר העלייה בטמפרטורה כדי להבטיח כי אין חום דליפות גז של סגירות של הבקבוקים PTFE. - להדק את הסגרים. ומגניב אותם בטמפרטורת החדר במשך כ 1 h
- המקום funnels עם מסנן את העבודות על המבחנות נפח מ"ל 25 ושטוף הנוזל הנותר עם עב ס 1 מ'3 לאמצעי אחסון סופי של 25 מ.
הערה: לשטוף את הבקבוק. לפחות שלוש פעמים, הסגר פעמיים. - לאמת האיכות אנליטית של ICP-MS ניתוח באמצעות החומרים הפניה רגיל, כולל טיפש-2 (dogfish הכבד) במעונות-2 (שריר dogfish).
- השתמש כפילויות של כל מדגם אנליטית triplicates של חומר עזר סטנדרטיים לניתוח ICP-MS.
- ממוצע Ag הריכוזים של כל הדגימות אנליטית ולהציג את הנתונים כמו משקל יבש בסיס ריכוז (משקל יבש μg/g).
2. רקמת הכנת הדוגמא לניתוח AMG
- לאסוף זוג תואם רקמות כבד וכליות לניתוח AMG cetacean תקועים ותקן אותן בפורמלין במאגר נייטרלי 10% עד השימוש.
הערה: אחסן את דגימות רקמה בקבוקי פלסטיק בפורמלין 10% נייטרלי במאגר (NBF, pH 7.0) 24 עד 48 שעות. עוצמת הקול של NBF צריך להיות לפחות 10 פעמים יותר מאשר אמצעי האחסון רקמות. - לקצץ את פורמלין קבוע רקמות כליה וכבד עם להבי פלדת אל-חלד חד פעמיות מיקרוטום ולשים הסעיפים רקמות החתוך קלטות עם תוויות.
הערה: גודל כל מקטעי רקמת צריך להיות כ 2 ס"מ על 1 ס"מ, עובי כל מקטע רקמות לא יעלה על 3 מ מ. לשים את רקמות כבד וכליות מן הפרט אותו במגרה באותו. - מייבשים את החתוך רקמות סעיפים עם מעבד רקמות באמצעות סדרה של אתנול מדורגת (70% עבור 1 h, 80% לשעה, 95% לשעה, 95% עבור 2 h, 100% 1 h x 2 צביעת מנות, 100% עבור 2 h), שאינם-קסילן (עבור 1 h ו- 2 h במנות מכתימים שונים) , ומשקיעים את דגימות רקמה מיובש ב- paraffin (עבור 1 h ו- 2 h במנות מכתימים שונים).
- מקם את דגימות רקמה מיובש מאחורה בתבניות פלדה היסטולוגיה ולהטביע את דגימות רקמה מיובש עם פרפין.
- מקררים את פורמלין קבוע גושי רקמה (FFPE) פרפין-מוטבע על הצלחת קר עד עפור הפרפין. חתוך את אבני FFPE עם האזמל הקטן עד השטח רקמות חשוף.
- מקררים את אבני FFPE על −20 ° C עבור 10 דקות סעיף אבני FFPE ב 5 מיקרומטר מאת מיקרוטום.
- למלא אמבט מים במים מזוקק פעמיים ב 45 º C. הרם את רצועות הכלים של סעיפים רקמות ולגרום להם לצוף על פני המים החמים באמצעות פינצטה ומברשות.
- הפרד את רצועות הכלים של סעיפים רקמות באמצעות פינצטה. במקום סעיף לשקופית מיקרוסקופ.
- למקם את שקופיות מיקרוסקופ בשקופית חמים יותר, מאפשר מקטעים כדי לילה יבש ב 37 º C.
- לשים את שקופיות מיקרוסקופ בארונות תקשורת שקופית, deparaffinize אותם בהשריה ב 3 מנות מכתימים שונים של טהור שאינו-קסילן (כ 200 עד 250 מ"ל) עבור 8, 5, ו- 3 דקות.
- מימה הסעיפים רקמות בארונות תקשורת שקופית בהשריה במנות מכתימים שונות של פתרונות אתנול מדורגת (100% אתנול פעמיים, 90% אתנול פעם אחת ו- 80% אתנול פעם [1 דקות כל]), יש לשטוף אותן במים מזוקק פעמיים.
הערה: פתרונות אלו הם כ 200 עד 250 מ ל מנות מכתימים שונות. עבור כל כביסה, 30 שניות זה מספיק. - יש לשטוף הרקמה מקטעים בתוך באגירה פוספט תמיסת מלח (PBS) עם 0.5% טריטון X-100, לשטוף אותם עם PBS עבור מספר פעמים ולאחר מכן לשטוף אותם במים מזוקק פעמיים.
הערה: פתרונות אלו הם כ 200 עד 250 מ ל מנות מכתימים שונות. עבור כל אחד היה, 30 שניות הוא מספיק. - להכין כמויות שוות של שלושת המרכיבים (היוזם, מנחה ו activator) שסופקו על-ידי ערכת שיפור כסף בחושך ומערבבים אותם ביסודיות.
הערה: הפתרונות של מנחה, activator הם דביקים, אז בבקשה להשתמש פיפטה עם פתחים עצה רחב (או לחתוך את הטיפים כדי ליצור פתחים רחבים יותר). עבור כל שקופית, μL 300 של הפתרון מעורבת (בהתאם לגודל של סעיף הרקמה) היא בדרך כלל מספיק. לכן, אם השקופיות 10 משמשים, הכמות של כל רכיב (היוזם, מנחה ו activator) הוא 1000 μL (הפתרון מעורב הוא 3000 μL עבור שקופיות 10). - דגירה בסעיפים רקמות הפתרון מעורב למשך 15 דקות בחושך בטמפרטורת החדר. כיסוי מלא הסעיפים רקמות בשקופיות עם הפתרון מעורבת. זמן הדגירה ארוך עלול להוביל אותות AMG חיובי-false.
- רוחצים את השקופיות במים מזוקק פעמיים את תכתים אותם ב hematoxylin 10 s כמו counterstain.
- לשטוף את השקופיות עם ברז מים זורמים, לייבש אותם, והר אותם הרכבה בינונית.
- לבחון את השקופיות תחת מיקרוסקופ אור.
- באופן אקראי ללכוד תמונות היסטולוגית עשר עם עדשה המטרה X 40 של כל מקטע רקמות באמצעות מצלמה דיגיטלית המחובר עם תוכנות הדמיה.
3. חצי כמותית ןועברל AMG ערכים חיוביים של תמונות היסטולוגית
הערה: ערך חיובי AMG פירושו האחוז של האזור עם אותות חיוביים AMG.
- השתמש בתוכנת ניתוח התמונה (ImageJ) כדי לנתח את התמונות היסטולוגית.
- פתחו את התמונה היסטולוגית על ידי לחיצה על קובץ | פתוח.
- לפצל את התמונה שבחרת בשלושה ערוצי צבע (אדום, כחול וירוק) על ידי לחיצה על תמונה | סוג | מחסנית RGB.
- לכמת את האותות חיובי AMG באמצעות ערוץ הצבע הכחול. גרעיני אותות חיובי כוזב בדרך כלל ירד מתחת ערוץ הצבע הכחול hematoxylin הכתם מוחל על הגרעין counterstain (איור 2).
- למדוד את אחוז האזור עם אותות חיוביים AMG ב כל תמונה היסטולוגית בעזרת הכלי הסף (תמונה | התאם | סף).
- כוונן באופן ידני את הערך ניתוק של הסף עבור כל תמונה היסטולוגית (בין 90 ל- 110) בהתבסס על הנוכחות של אזורים חיובי כוזב גרעינים ו/או תאי דם אדומים.
הערה: הגדרת ברירת המחדל, אותות חיוביים AMG אמורים להיות מודגשים באדום. - העיתונות נתח | לקבוע מידות, וסמן את התיבה של אזור השבר כדי לציין אזור השבר נרשם.
- העיתונות נתח | מדד. האזור אחוז חיובי של כל תמונה היסטולוגית מוצג בעמודה של % שטח של חלון התוצאה .
- ממוצע האזורים אחוז חיובי של 10 היסטולוגית תמונות מהסעיף לכל רקמות ולהגדיר את התוצאה כערך חיובי AMG עבור כל מקטע רקמות.

איור 2: הנוכחות של גרעיני אותות חיוביים שווא תחת ערוצי צבע שונה (counterstain: hematoxylin כתם). נציג גרעיני אותות חיובי כוזב מסומנים באמצעות חיצים צהובים. PPA = אחוז חיובי של אזורים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
4. הקמת נושפים היסטולוגית Ag וזמינותו (צ'ה) על ידי מודל הרגרסיה
הערה: הניתוח הבא מתבצע בפריזמה 6.01 עבור Windows.
- הערכת הקשר בין התוצאות של ICP-MS לבין ערכים חיוביים AMG.
- פתחו את התוכנה, ליצור קובץ פרוייקט חדש, ובחרו XY , המתאם.
- נתוני הקלט כולל את התוצאות של ערכים חיוביים של ICP-MS ו- AMG.
- הקש על ניתוח ובחרו המתאם תחת הקטגוריה XY ניתוח כדי לנתח את עוצמת הקשר בין התוצאות של ICP-MS AMG ערכים חיוביים על ידי ניתוח מתאם פירסון.
הערה: התוצאות של ICP-MS, ערכים חיוביים AMG חייב להיות בקורלציה עם השני; אחרת, שמודל הרגרסיה הבאות צריכה לא להיות מפותחת. - מבחינה סטטיסטית להשוות בין הדגמים רגרסיה, כולל רגרסיה ליניארית, רגרסיה ריבועית, רגרסיה מעוקב של רגרסיה ליניארית דרך, דרך2726,12,תוכנת סטטיסטיקה.
הערה: אם שמודל הרגרסיה יוצרת ריכוז לא מציאותי של Ag, שמודל הרגרסיה צריך להיות נטוש12. - לחזור טבלת הנתונים (החלונית הימנית) ולחץ על ניתוח | רגרסיה לא ליניארית (עיקול מתאים) תחת הקטגוריה XY ניתוח | בסדר.
- בחלון פרמטרים: רגרסיה לא ליניארית, לבחור במודל רגרסיה שונות התאמת העמוד, ולאחר מכן השווה מודלים שונים רגרסיה בעמוד להשוות.
- בעמוד להשוות, לבחור את השיטות השוואה, לרבות במבחן F נוסף סכום של-ריבועים מידע קריטריון של הוסיפי (AIC). על פי התוצאות של שיטות ההשוואה, להשתמש מודל רגרסיה יחסית המתאים צ'ה.
- מעריכים Ag ריכוזים של רקמות כבד וכליות נושפים עם ריכוזים Ag לא ידוע על-ידי שימוש של צ'ה.
- להעריך את דיוק ואמינות של צ'ה על רקמות כליה וכבד. ההבדל בין דיוק ודיוק מודגם באיור3.
- דיוק: חישוב הממוצע סטיית התקן (SD) מן ההבדלים בין ריכוזי Ag מוערך וידוע.
- דיוק: לבצע מדידה חוזרות ונשנות (לפחות triplicate) של ערכים חיוביים AMG סעיפים טורי מן הרקמות FFPE אותו. לחשב את ממוצעם SD של מדידות של רקמות כבד או כליה מן ההבדלים בין ריכוזי Ag מוערך וידוע
הערה: שיטות הערכת את דיוק ואמינות מתוארת באיור4.
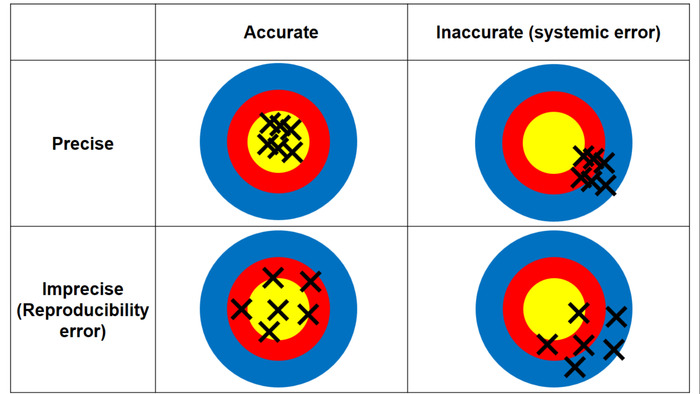
איור 3: ההבדל בין דיוק ואמינות. דיוק אומר כמה קרוב המדידה היא הערך האמיתי (קרי, ריכוז Ag נקבע על ידי ICP-MS); דיוק אומר את הדיר המדידה (קרי, עקביות בין המדידות חוזרות הערכים החיוביים AMG מן הסעיפים triplicate רקמות). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
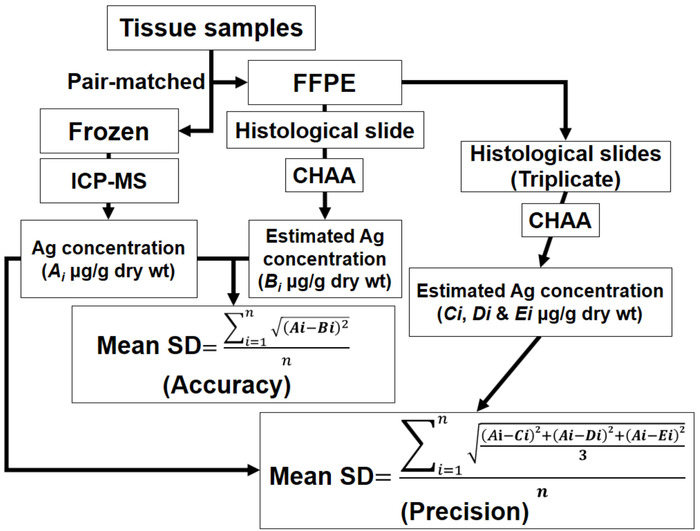
איור 4: ערכת המתארים שיטות הערכת את דיוק ואמינות. צ'ה = נושפים assay Ag היסטולוגית; FFPE = פורמלין-קבוע, פרפין-מוטבע; ICP-MS = פלזמה inductively בשילוב לספקטרומטרית מסות; Ai = כל אחד הריכוזים Ag נקבע על ידי ICP-MS של כל זוג תואם לדגימות; Bi = כל אחד הריכוזים Ag מוערך על ידי צ'ה של כל זוג תואם לדגימות; Ci, Di ו- Ei = כל אחד ריכוזי ה Ag מוערך על ידי צ'ה דוגמאות triplicate של כל זוג תואם לדגימות; אני = 1 ל- n. ראה נתונים גולמיים של הבדיקות ודיוק במקטע של התוצאות נציג. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
5. אומדן של Ag ריכוזים של צ'ה.
- לאסוף את רקמות כבד וכליות יונקים נטושים ותקן אותן בפורמלין במאגר נייטרלי 10%.
- תהליך הרקמות פורמלין-קבוע באופן שגרתי (ראה שלב 2).
- מעריכים את ריכוזי Ag של רקמות כבד וכליות נושפים עם לא ידוע Ag ריכוזים של צ'ה (ראה שלבים 3 ו- 4).
תוצאות
להחליפן בתמונות של האותות חיובי AMG ברקמות כבד וכליות נושפים מוצגים באיור5. האותות חיובי AMG כוללים חום בגודל variably בגרגרים שחורים בגדלים שונים בציטופלסמה של proximal אפיתל אבובית הכליה, hepatocytes ותאים Kupffer. לעיתים, אמורפי מצהוב-זהוב לאותות חיובי AMG חום המונפשים לומ...
Discussion
מטרתו של המחקר במאמר היא להקים שיטה אדג'וונט כדי להעריך את ההתפלגות Ag ברמות suborgan וכדי להעריך Ag ריכוזים ברקמות נושפים. הפרוטוקולים הנוכחי כוללים 1) קביעת ריכוזי Ag ברקמות נושפים מאת ICP-MS, 2) AMG ניתוח של דגימות רקמה מתאימים לזוג עם ריכוזים ידועים Ag, 3) הקמת מודל רגרסיה (צ'ה) עבור הערכת הריכוזים Ag מא?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
אנו מודים טייוואן Cetacean מייג'ור קרטר הרשת עבור מדגם האיסוף והאחסון, כולל החברה Cetacean טייוואן, טייפה; המעבדה בלוויתנאים (פרופסור השעבוד-סיאנג צ'ו), המכון לאקולוגיה, ביולוגיה אבולוציונית, האוניברסיטה הלאומית של טייוואן, טייפה; המוזיאון הלאומי למדעי הטבע (ד ר Chiou-יו יאו), טאיצ'ונג; ו ביולוגיה ימית & מרכז המחקר Cetacean, האוניברסיטה הלאומית צ'נג קונג. אנו מודים גם את הלשכה יערנות, המועצה החקלאות, יואן מנהלים לקבלת היתר שלהם.
Materials
| Name | Company | Catalog Number | Comments |
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | --- | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
References
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved