É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Uso de Autometallography para localizar e quantificar semi prata em tecidos de cetáceos
Neste Artigo
Resumo
Um protocolo é apresentado para localizar Ag em cetáceos tecidos de fígado e rim por autometallography. Além disso, um novo ensaio, chamado o ensaio de Ag histológico cetáceos (CHAA) é desenvolvido para estimar as concentrações de Ag desses tecidos.
Resumo
Nanopartículas de prata (AgNPs) têm sido usadas extensivamente em produtos comerciais, incluindo têxteis, cosméticos e itens de cuidados de saúde, devido aos seus fortes efeitos antimicrobianos. Eles também podem ser liberados no ambiente e se acumulam no oceano. Portanto, AgNPs são a principal fonte de contaminação de Ag, e está aumentando a consciência pública da toxicidade ambiental da Ag. Estudos anteriores têm demonstrado a bioacumulação (em produtores) e ampliação (em consumidores/predadores) da Ag. Cetáceos, como os predadores do apex do oceano, podem ter sido negativamente afetados pelos compostos Ag/Ag. Embora as concentrações dos compostos de Ag/Ag em cetáceos tecidos podem ser medidas por espectroscopia de massa de plasma indutivamente acoplado (ICP-MS), o uso de ICP-MS é limitado pelo seu elevado custo de capital e o requisito de armazenamento/preparação do tecido. Portanto, um autometallography (AMG) método com uma análise quantitativa de imagem usando formalin-fixas, parafina-encaixados do tecido (FFPE) pode ser um método adjuvante para localizar a distribuição de Ag a nível suborgan e estimar a concentração de Ag em cetáceos tecidos. Os sinais positivos de AMG são principalmente marrons a preto granulado de vários tamanhos no citoplasma das células de Kupffer, hepatócitos e epitélio tubular renal proximal. Ocasionalmente, alguns amorfo amarelo dourado a marrons sinais positivos de AMG são anotados no lúmen e membrana basal de alguns túbulos renais proximais. O ensaio para estimar a concentração de Ag é chamado o cetáceo histológica Ag ensaio (CHAA), que é um modelo de regressão estabelecido pelos dados da análise quantitativa de imagem do método AMG e ICP-MS. O uso de AMG com CHAA para localizar e quantificar semi metais fornece uma metodologia conveniente para estudos espácio-temporais e entre espécies.
Introdução
Nanopartículas de prata (AgNPs) têm sido usadas extensivamente em produtos comerciais, incluindo têxteis, cosméticos e itens de cuidados de saúde, devido a seus efeitos antimicrobianos grande1,2. Portanto, a produção de AgNPs e o número de produtos que contenham AgNP são aumentadas por tempo3,4. No entanto, AgNPs pode ser liberado para o ambiente e se acumulam no oceano5,6. Eles se tornaram a principal fonte de contaminação de Ag, e está aumentando a consciência pública da toxicidade ambiental da Ag.
O status de AgNPs e Ag no meio marinho é complicada e constante mudança. Estudos anteriores indicaram que os AgNPs podem permanecer como partículas, agregadas, dissolvem, reagem com diferentes espécies químicas ou ser regeneradas de íons de Ag+ 7,8. Vários tipos de compostos de Ag, como o AgCl, foram encontrados em sedimentos marinhos, onde eles podem ser ingeridos por organismos bênticos e digite a cadeia alimentar9,10. De acordo com um estudo anterior realizado na área de lagoa de Chi-ku ao longo da costa sudoeste de Taiwan, as concentrações de Ag de sedimentos marinhos são extremamente baixos e similares para a abundância da crosta terrestre, e do tecido do fígado de peixes são geralmente abaixo da deteção limite (< 0.025 μg/g úmido/úmido)11. No entanto, estudos anteriores realizados em diferentes países demonstraram relativamente altas concentrações de Ag em fígados de cetáceos12,13. A concentração de Ag em fígados de cetáceos é dependente da idade, sugerindo que a fonte da Ag em seus corpos provavelmente é sua presa12. Estes achados ainda mais sugerem a bioamplificação de Ag em animais em níveis tróficos superiores. Cetáceos, como os predadores do apex no oceano, podem ter sofrido impactos de saúde negativos causados por Ag/Ag compostos12,13,14. Mais importante ainda, como os cetáceos, os humanos são mamíferos e a saúde negativa impactos causados por compostos de Ag/Ag em cetáceos também podem ocorrer em humanos. Em outras palavras, os cetáceos poderiam ser animais de sentinela para a saúde do ambiente marinho e os seres humanos. Portanto, os efeitos na saúde, a distribuição tecidual e concentração de Ag em cetáceos são motivo de grande preocupação.
Embora as concentrações dos compostos de Ag/Ag em cetáceos tecidos podem ser medidas por espectroscopia de massa de plasma indutivamente acoplado (ICP-MS), a utilização de ICP-MS é limitada pelo seu elevado custo de capital (instrumento e manutenção) e os requisitos para armazenamento de tecidos /Preparation12,15. Além disso, é normalmente difícil de coletar amostras de tecido abrangente em todas as investigações de casos de Cetáceos encalhados devido a dificuldades logísticas, a escassez de mão de obra e uma falta de recursos relacionados12. As amostras de tecido congelado para análise de ICP-MS não são facilmente armazenadas por causa do espaço limitado de refrigeração, e amostras de tecido congelado podem ser descartadas devido à refrigeração quebrado equipamentos12. Esses obstáculos acima mencionados dificultam investigações dos níveis de contaminação em cetáceos tecidos por ICP-MS análise usando amostras de tecido congelado. Em contraste, formalina fixo amostras de tecido são relativamente fáceis de coletar durante a necropsia de cetáceos mortos-encalhado. Portanto, é necessário desenvolver um método fácil de usar e de baixo custo para detectar/medida os metais pesados em tecidos de cetáceos usando formalina fixada amostras de tecido.
Embora as distribuições de suborgan e concentrações de metais alcalinos e alcalinos terrosos podem ser alteradas durante o formalin-fixas, parafina processo (FFPE), apenas menores efeitos sobre metais de transição, tais como Ag, ter sido notável16. Daí, tecido FFPE tem sido considerado como um recurso de amostra ideal para localização de metal e medições16,17. Autometallography (AMG), um processo histoquímico, pode amplificar a metais pesados como variably tamanho amarelo dourado para sinais positivos de preto AMG em secções de tecido FFPE, e estes metais pesados amplificados pode ser visualizados sob microscopia de luz18, 19 , 20 , 21. portanto, o método AMG fornece informações sobre as distribuições de suborgan de metais pesados. Pode fornecer informações adicionais importantes para estudar as vias metabólicas de metais pesados em sistemas biológicos porque ICP-MS só pode medir a concentração de metais pesados no órgão nível18. Além disso, software de análise de imagem digital, tais como ImageJ, aplicou-se a análise quantitativa de tecido histológicas seções22,23. O amarelo dourado tamanho variável para sinais positivos de preto AMG FFPE de seções do tecido pode ser quantificado e utilizado para estimar as concentrações de metais pesados. Embora a concentração de Ag a absoluta não pode ser determinada diretamente pelo método AMG com análise quantitativa de imagem, pode ser calculada por um modelo de regressão com base nos dados obtidos a partir da análise quantitativa de imagem e ICP-MS, que é chamado de cetáceos ensaio de Ag histológico (CHAA). Considerando as dificuldades em medir as concentrações de Ag por análise de ICP-MS em cetáceos mais encalhados, CHAA é um método adjuvante valioso para estimar concentrações de Ag em tecidos de cetáceos, que não podem ser determinados pela análise de ICP-MS, devido à falta de congelados amostras de tecido. Este documento descreve o protocolo de uma técnica histochemical (método AMG) para localização de Ag a nível de suborgan e um ensaio chamado CHAA para estimar as concentrações de Ag nos tecidos fígado e rim de cetáceos.

Figura 1: fluxograma representando o estabelecimento e aplicação de ensaio de Ag histológica cetáceos (CHAA) para estimar as concentrações de Ag. CHAA = cetáceos histológica Ag do ensaio, FFPE = Formalin-fixas, parafina, ICP-MS = espectroscopia de massa de plasma indutivo. Clique aqui para ver uma versão maior desta figura.
Protocolo
O estudo foi realizado em conformidade com as diretrizes internacionais, e o uso de amostras de tecido de cetáceos foi autorizado pelo Conselho de agricultura de Formosa (pesquisa permitir 104-07.1-SB-62).
1. tecido preparação de amostras para análise de ICP-MS
Nota: Os tecidos do fígado e rins foram coletados do recém morto e moderadamente autolisada encalhado cetáceos24, incluindo 6 Cetáceos encalhados de 4 espécies diferentes, 1 Grampus griseus (Gg), 2 Kogia spp. (Ko), 2 Lagenodelphis hosei (Lh), 1 Stenella attenuata (Sa). Cada Cetáceos encalhados tinham um número de campo para identificação individual. A preparação da amostra de tecido para análise de ICP-MS seguido o método estabelecido no laboratório de M.H. Chen, e laboratório de M.H. Chen realizado o ICP-MS análise11,13,25.
- Coletar o fígado e rim de tecidos para análise de ICP-MS de Cetáceos encalhados e armazená-los em −20 ° C até o uso.
- Coletar o fígado par-combinadas e tecidos renais da mesma encalhado cetáceos para análise AMG (por favor, consulte a etapa 2).
- Apare a camada externa das amostras de tecido coletadas para análise de ICP-MS com um bisturi de aço inoxidável. Corte a parte interna das amostras de tecido em cubos pequenos (cerca de 1 cm3) e coloque-os em sacos de plástico zip lock. Normalmente, cada saco contém 10g de tecidos.
- Armazene os sacos de plástico contendo amostras de tecido −20 ° C para os procedimentos subsequentes.
- Colocar os cubos de 1 cm3 amostras em um congelamento a seco sistema (-50 ° C, bomba de vácuo com um deslocamento de pelo menos 98 L/min, 0,002 mBar) pelo menos 72 h até completamente secas por pesagem a constante.
- Homogeneizar os cubos secos em pó com um homogenizador para digestão subsequente do tecido.
- Pesar 0,3 g de amostras liofilizadas homogeneizadas em frascos de politetrafluoretileno (PTFE) de 30 mL e misture-os com 10 mL de ácido nítrico a 65% w/w.
- Colocar tampas das garrafas PTFE, mas deixe os fechos de untightened.
Nota: Isto permite que o fumo marrom para formar garrafas PTFE e refluxo dentro da garrafa para a digestão até a fumaça marrom desaparece e fica clara. - Aquecer as amostras digeridas com uma chapa quente, de 30 ° C a 110/120 ° C (de acordo com a marrom das emanações formando condição) nas garrafas PTFE para 2 a 3 semanas até que o gás marrom nas garrafas PTFE torna-se incolor e o líquido em garrafas o PTFE se torna translúcido gree Nish pálido amarelo ou completamente claro.
Nota: Execute o processo de aquecimento em química da coifa. - Aquecer as amostras digeridas a 120 ° C, para evaporar o ácido nítrico nas garrafas PTFE apenas 0,5-1 mL de restos.
Nota: Executar o processo de aquecimento em uma coifa de química e sempre acompanhar o aumento de temperatura para garantir que nenhum gás marrom vazamentos de tampas dos frascos do PTFE. - Aperte os fechos e resfriá-las em temperatura ambiente por cerca de 1h.
- Lugar do funil com filtro papéis em balões volumétricos de 25 mL e lavar o líquido restante com 1 M HNO3 até um volume final de 25 mL.
Nota: Lave a garrafa pelo menos três vezes e o encerramento, duas vezes. - Valide a qualidade analítica de ICP-MS análise usando os materiais de referência padrão, incluindo DOLT-2 (dogfish fígado) e dormitório-2 (músculo dogfish).
- Use duplicatas de cada amostra para análise e triplica de materiais de referência padrão para análise de ICP-MS.
- Média, as concentrações de Ag de cada amostras analíticas e apresentar os dados como concentração de base de peso seco (μg/g de peso seco).
2. tecido preparação de amostras para análise AMG
- Coletar o par correspondente fígado e rim de tecidos para análise AMG de um cetáceo encalhado e corrigi-los em formol tamponado a 10% neutro até o uso.
Nota: Guarde as amostras de tecido em garrafas de plástico em 10% tamponada formol neutro (NBF, pH 7,0) por 24 a 48 horas. O volume de NBF deve ser pelo menos 10 vezes maior do que o volume de tecido. - Apare a formalina fixada de fígado e rim tecidos com lâminas de aço inoxidável descartável micrótomo e colocar as secções de tecido cortado em fitas com rótulos.
Nota: O tamanho de cada secções de tecido deve ter aproximadamente 2 cm x 1 cm e a espessura de cada seção de tecido não deve exceder 3 mm. colocar os tecidos do fígado e do rim do mesmo indivíduo no mesmo. - Desidratar o aparado secções de tecido com um processador de tecido através de uma série de classificados etanol (70% por 1h, 80% por 1h, 95% para 1 h, 95% para 2 h, 100% para 1 h x 2 pratos de coloração e 100% para 2 h), não-xileno (para 1 h e 2 h em pratos de coloração diferentes) e mergulhe as amostras desidratadas em paraffin (para 1 h e 2 h em pratos diferentes de coloração).
- Colocar as amostras de tecido desidratado em fundos de moldes de aço histologia e incorporar as amostras desidratadas com parafina.
- Relaxe a formalina fixada de parafina (FFPE) tecido na placa fria até que a parafina se solidifica. Apare os blocos FFPE com micrótomo, até que a superfície do tecido é exposta.
- Acalme os blocos FFPE −20 ° C durante 10 min. seção os blocos FFPE em 5 µm por micrótomo.
- Encha um banho de água com água bidestilada a 45 ° C. Levante as fitas de cortes de tecido e fazê-los flutuar na superfície da água morna com o uso de pinças e pincéis.
- Separe as fitas de seções do tecido com uma pinça. Coloque uma seção numa lâmina de microscópio.
- Coloque as lâminas de microscópio em um slide mais quentes e permitem que as seções para secar durante a noite a 37 ° C.
- Coloque as lâminas de microscópio em lâminas e deparaffinize-los mergulhando-os em 3 pratos de coloração diferentes do puro não-xileno (cerca de 200 a 250 mL) por 8, 5 e 3 min.
- Hidratar as seções de tecido em lâminas embebendo-los em pratos de coloração diferentes das soluções gradual do etanol (álcool etílico 100% duas vezes, etanol 90% uma vez e 80% etanol uma vez [1 min cada]) e lavá-los em água bidestilada.
Nota: Estas soluções são cerca de 200 a 250 mL em pratos de coloração diferentes. Para cada lavagem, 30 seg é suficiente. - Enxágue o tecido das seções em tampão fosfato salino (PBS) com 0,5% Triton X-100, lavagem com PBS para várias vezes e em seguida, enxágue-os em água bidestilada.
Nota: Estas soluções são cerca de 200 a 250 mL em pratos de coloração diferentes. Para cada um foi, 30 seg é suficiente. - Preparar quantidades iguais dos três componentes (iniciador, moderador e ativador) fornecidas pelo kit de acessório prata escuras e misture-os bem.
Nota: As soluções de moderador e ativador são pegajosas, então por favor use pipetar com aberturas de ponta larga (ou cortar as pontas para criar aberturas mais amplas). Para cada slide, 300 μL da solução mista (dependendo do tamanho da seção de tecido) é geralmente suficiente. Portanto, se 10 laminas são usadas, a quantidade de cada componente (iniciador, moderador e ativador) é 1000 μL (a solução mista é 3000 μL 10 slides). - Incube as seções de tecido na solução mista por 15 min no escuro à temperatura ambiente. Cobrir totalmente as seções de tecido sobre os slides com a solução mista. Um tempo de incubação pode levar a sinais AMG de falso-positivos.
- Lave os slides com água bidestilada e manchá-las em hematoxilina por 10 s como um corante de contraste.
- Lave os slides com água corrente, secá-las e montá-los com meio de montagem.
- Examine as lâminas sob um microscópio de luz.
- Aleatoriamente, capture dez imagens histológicas com uma lente de objetiva 40 X de cada seção de tecido usando uma câmera digital conectada com software de imagens de computador.
3. análise semi-quantitativa para valores positivos de AMG de imagens histológicas
Nota: AMG valor positivo significa que a porcentagem de área com sinais positivos de AMG.
- Use o software de análise de imagem (ImageJ) para analisar as imagens histológicas.
- Abra a imagem histológica pressionando arquivo | Aberto.
- Dividir a imagem escolhida em três canais de cores (vermelho, azul e verde) pressionando imagem | Tipo | Pilha RGB.
- Quantificar os sinais positivos de AMG usando o canal azul. Sinais positivos falsos nucleares estão geralmente diminuídos sob o canal azul quando mancha de hematoxilina é aplicada para nuclear corante de contraste (Figura 2).
- Medir a porcentagem da área com sinais positivos de AMG em cada imagem histológica com a ferramenta de limiar (imagem | Ajustar | Limiar de).
- Ajuste manualmente o valor limite do limiar para cada imagem histológica (de 90 a 110) baseado-se as presenças de falsas positivas áreas nos núcleos e/ou glóbulos vermelhos.
Nota: no padrão de configuração, os sinais positivos de AMG devem ser destacados em vermelho. - Imprensa analisar | Definir medidase marque a caixa de Fração de área para especificar que a fração de área é gravada.
- Imprensa analisar | Medida. A área por cento positiva de cada imagem histológica é exibida na coluna de % área da janela de resultado .
- Média, as áreas por cento positivas de 10 imagens histológicas de cada seção de tecido e definir o resultado como o valor positivo da AMG para cada seção de tecido.

Figura 2: A presença de nucleares sinais positivos falsos sob canais de cores diferentes (corante de contraste: mancha de hematoxilina). Representante nucleares sinais positivos falsos são indicados por setas amarelas. PPA = porcentagem positiva das áreas. Clique aqui para ver uma versão maior desta figura.
4. estabelecimento dos cetáceos histológica Ag ensaio (CHAA) pelo modelo de regressão
Nota: A seguinte análise é executada no prisma 6.01 para Windows.
- Avalie a correlação entre os resultados de ICP-MS e valores positivos de AMG.
- Abra o software, criar um novo arquivo de projeto e escolha XY e correlação.
- Dados de entrada incluindo os resultados de ICP-MS e AMG valores positivos.
- Pressione a análise e escolha de correlação sob a categoria de Análise XY para analisar a força da associação entre os resultados do ICP-MS e valores positivos AMG pela análise de correlação de Pearson.
Nota: Os resultados do ICP-MS e valores positivos AMG têm de ser positivamente correlacionada com o outro; caso contrário, o modelo de regressão subsequente não deve ser desenvolvido. - Estatisticamente, compare os modelos de regressão, incluindo regressão linear, regressão quadrática, cúbica regressão e regressão linear através de origem, através de software de estatísticas a12,26,27.
Nota: Se o modelo de regressão gera uma concentração de Ag irrealista, o modelo de regressão deve ser abandonada12. - Voltar para a tabela de dados (painel esquerdo) e clique em análise | Regressão não-linear (curva) , sob a categoria de Análise XY | Okey.
- Na janela de parâmetros: regressão não-linear, escolher o modelo de regressão diferente na página de ajuste e comparar modelos de regressão diferente na página de comparar.
- Na página de comparar, escolha os métodos de comparação, incluindo o teste de F extra soma de quadrados e critério de informação de Akaike (AIC). De acordo com os resultados dos métodos de comparação, use um modelo de regressão relativamente adequado no CHAA.
- Estime as concentrações de Ag dos cetáceos tecidos fígado e rim com concentrações de Ag desconhecidas usando o CHAA.
- Avalie a exatidão e precisão do CHAA para fígado e rim tecidos. A diferença entre precisão e exatidão é ilustrada na Figura 3.
- Precisão: Calcule o desvio padrão da médio (SD) de diferenças entre as concentrações de Ag conhecidas e estimadas.
- Precisão: Realizar medição repetida (pelo menos três vias) de valores positivos AMG de seções seriais dos tecidos FFPE mesmos. Calcular a média de SD de medições de tecidos de fígado e rim de diferenças entre as concentrações de Ag conhecidas e estimadas
Nota: Os métodos de avaliar a exatidão e precisão são representados na Figura 4.
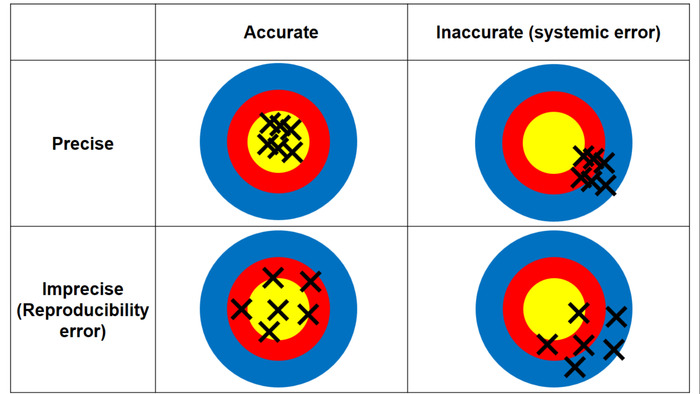
Figura 3: A diferença entre exatidão e precisão. Precisão significa a medição quão próximo está o verdadeiro valor (ou seja, concentração de Ag determinada por ICP-MS); precisão significa a repetibilidade da medida (isto é, a coerência entre as medidas repetidas dos valores positivos AMG dos cortes histologicos triplicado). Clique aqui para ver uma versão maior desta figura.
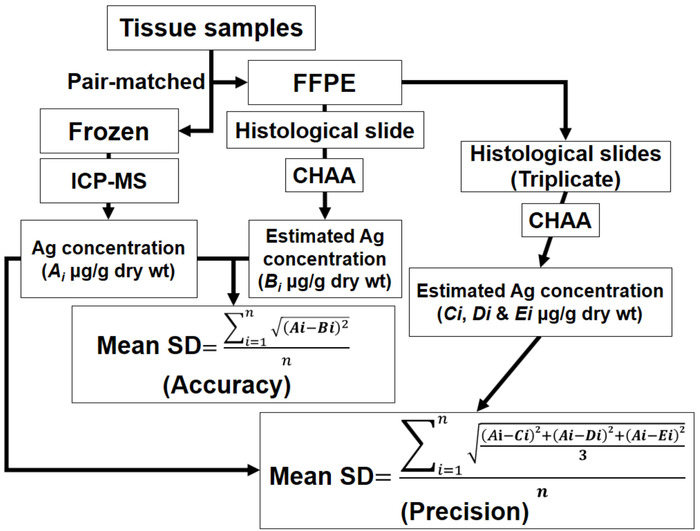
Figura 4: O esquema que descreve os métodos de avaliar a exatidão e precisão. CHAA = cetáceos histológica do ensaio Ag; FFPE = Formalin-fixas, parafina; ICP-MS = espectroscopia de massa de plasma indutivo; Ai = cada uma das concentrações Ag determinadas por ICP-MS de cada amostra de tecido par-combinadas; Bi = cada uma das concentrações Ag estimadas pela CHAA de cada amostra de tecido par-combinadas; CI, Di e Ei = cada uma das concentrações de Ag a estimada pela CHAA de amostras de três vias de cada amostra de tecido par-combinadas; Eu = 1 a n. Por favor, veja os dados brutos dos testes exatidão e precisão na seção de resultados representativos. Clique aqui para ver uma versão maior desta figura.
5. estimativa das concentrações de Ag por CHAA.
- Coletar os tecidos do fígado e rim de Cetáceos encalhados e corrigi-los em formol tamponado a 10% neutro.
- Processar os tecidos fixada em formol rotineiramente (por favor, consulte a etapa 2).
- Estimar as concentrações de Ag dos cetáceos tecidos fígado e rim com concentrações de Ag desconhecidas por Carvalho (consulte as etapas 3 e 4).
Resultados
Imagens representativas dos sinais positivos de AMG nos tecidos fígado e rim cetáceos são mostradas na Figura 5. Os sinais positivos de AMG incluem variàvel tamanho marrom ao preto granulado de vários tamanhos no citoplasma das células de Kupffer, hepatócitos e epitélio tubular renal proximal. Ocasionalmente, amorfo amarelo dourado a marrons sinais positivos de AMG são anotados no lúmen e membrana basal de alguns túbulos renais proximais. Há uma c...
Discussão
O propósito do estudo do artigo é estabelecer um método adjuvante para avaliar a distribuição do Ag em níveis de suborgan e para estimar as concentrações de Ag em tecidos de cetáceos. Os protocolos atuais incluem 1) determinação das concentrações de Ag em cetáceos tecidos por ICP-MS, análise 2) AMG de amostras de tecido par-combinadas com concentrações conhecidas de Ag, 3) o estabelecimento do modelo de regressão (CHAA) para estimar as concentrações de Ag por valores positivos de AMG, 4) avaliação d...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a rede de encalhe de cetáceos Taiwan para coleta e armazenamento, incluindo a sociedade de cetáceos de Taiwan, Taipé; o laboratório de pesquisa de cetáceos (Prof Lien-Siang Chou), o Instituto de ecologia e biologia evolutiva, Universidade Nacional de Taiwan, Taipé; Museu Nacional de ciências naturais (Dr. Yao Chiou-Ju), Taichung; e a biologia marinha & centro de pesquisa de cetáceos, Universidade Nacional de Cheng-Kung. Agradecemos também o departamento de silvicultura, Conselho de agricultura, Yuan executivo pela sua licença.
Materiais
| Name | Company | Catalog Number | Comments |
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | --- | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
Referências
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados