このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ローカライズする Autometallography と鯨類体内半定量化の銀の使用
要約
プロトコルは、autometallography による鯨の肝臓と腎臓の組織で Ag をローカライズするのに提示されます。さらに、それらのティッシュの Ag 濃度を推定する鯨類の組織学的 Ag 試金 (チャー) という、新しいアッセイを開発します。
要約
銀ナノ粒子 (AgNPs) は、商業製品、繊維製品、化粧品、彼らの強力な抗菌効果のためのヘルスケア アイテムなどで広く使用されています。また、環境中に放出されることがあります、海に蓄積されます。したがって、AgNPs は銀汚染の主な原因で、Ag の環境毒性に対する国民の意識が増加しています。以前の研究は、(生産者) の蓄積と Ag の (消費者/捕食者) の倍率を示しています。クジラ、海の頂点捕食者として否定的に遭った Ag/銀化合物による。誘導結合プラズマ質量分析法 (ICP-MS) による鯨類体内 Ag/銀化合物の濃度を測定できますが、ICP-MS の使用は資本コストが高いと組織にストレージを/準備の要件によって制限されます。したがって、autometallography (AMG) 法を用いた画像定量分析にホルマリン固定、suborgan レベルで Ag イオン分布をローカライズし、鯨で Ag 濃度を推定する補助メソッドがあります (FFPE) 組織のパラフィン包埋組織。AMG の肯定的な信号は主に近位尿細管上皮、肝細胞、クッパー細胞の細胞質で様々 なサイズの黒い顆粒に茶色です。時折、内腔といくつかの近位腎尿細管基底膜の茶色の AMG の肯定的な信号をいくつかの非晶質の黄金色が記載されています。Ag 濃度を推定するための試金、鯨組織 Ag の試金 (チャー)、AMG 法と誘導結合プラズマ質量の画像定量的解析からのデータによって設立された回帰モデルであるといいます。AMG をローカライズするチャーと半定量化重金属の使用は、時空とクロス種の研究の便利な方法を提供します。
概要
銀ナノ粒子 (AgNPs) は、商業製品、繊維製品、化粧品、その偉大な抗菌効果1,2のためのヘルスケア アイテムなどで広く使用されています。したがって、AgNPs、AgNP 含有製品の数の生産は時間3,4に増加しました。しかし、AgNPs は環境に放出される可能性があります、海5,6に蓄積されます。銀汚染の主要なソースとなっているし、Ag の環境毒性の国民の意識が増加しています。
海洋環境における AgNPs と銀の状態は複雑で絶えず変化します。以前の研究は、粒子、集計、溶解、化学種と反応や Ag+イオン7,8からを再生成すると AgNPs が残ることができることを示されています。銀化合物、塩化銀などのいくつかの種類は、海底堆積物、彼らが底生生物が摂取することができ、食物連鎖の9,10」と入力で発見されています。台湾の南西部の海岸に沿ってチー区ラグーン エリアで行われた以前の研究によると海底堆積物中の Ag 濃度が非常に低く、地殻の存在と同様、魚の肝臓組織の通常検出下(< 0.025 μ g/g ウェット ・ ウェット)11を制限します。ただし、さまざまな国で行われた以前の研究は、鯨類12,13の肝臓で比較的高い Ag 濃度を示しています。鯨類の肝における Ag 濃度は年齢に依存する自分の体で Ag のソースが最も可能性の高い彼らの獲物の12であることを示唆しています。さらにこれらの調査結果より高い栄養レベルで動物の Ag の biomagnification をお勧めします。クジラ、海、頂点捕食者として受けた可能性があります銀/銀化合物12,13,14によって引き起こされる負の健康への影響。クジラ目の動物のような最も重要なことは、人間では哺乳類、鯨類の銀/銀化合物によって引き起こされる影響がヒトでも発生する負の健康。つまり、鯨類は、sentinel 動物海洋環境および人間の健康のため可能性があります。したがって、健康への影響、組織分布、鯨類の銀の濃度は大きな関心事です。
誘導結合プラズマ質量分析法 (ICP-MS) による鯨類体内 Ag/銀化合物の濃度が測れる、ICP-MS の使用 (楽器と保守)、高資本コストおよび組織のストレージの要件によって制限されます。/preparation12,15。さらに、通常物流の困難は、労働力の不足と関連リソース12の不足のため座礁鯨ケースのすべての調査で包括的な組織サンプルを収集することは困難です。誘導結合プラズマ質量分析のための凍結するティッシュ サンプルは、限られた冷凍スペースのため簡単に格納されず、壊れた冷凍機器12 のため凍結するティッシュ サンプルに破棄される可能性があります。これらの前述の障害は、凍結組織試料を用いた誘導結合プラズマ質量分析による鯨類の体内汚染レベルの調査を妨げます。対照的に、ホルマリン固定組織サンプルが比較的死者座礁鯨類の死体解剖の間に集めやすいです。そのため、ホルマリン固定組織サンプルを用いて鯨類体内重金属の検出/測定に使いやすい、安価な方法を開発する必要があります。
Suborgan 分布とアルカリ及びアルカリ土類金属の濃度は、ホルマリン固定中に変更される可能性があります、パラフィン (FFPE) プロセス、Ag などの遷移金属の低い効果だけは指摘した16をされています。したがって、FFPE 組織は金属および測定16,17理想的なサンプル リソースとして考えられています。Autometallography (AMG)、組織化学的プロセスは FFPE 切片の黒い AMG の肯定的な信号に可変サイズのゴールデン イエローとして重金属を増幅することし、光顕18,の下でこれらの増幅された重金属を視覚化できます。19,20,21します。 したがって、AMG メソッドは、重金属の suborgan 分布に関する情報を提供します。ICP-MS のみ臓器レベル18の重金属の濃度を測定できるので生物における重金属の代謝経路を研究するための重要な追加情報を提供できます。さらに、ImageJ など、デジタル画像分析ソフトウェアは、組織学的組織のセクション22,23の定量分析に適用されています。FFPE 切片の黒い AMG の肯定的な信号を可変サイズの黄金色を定量化し、重金属類の濃度を推定するために使用することができます。それを画像の定量的解析と ICP-MS、鯨の名前はから得られるデータに基づく回帰モデルによって推定できる画像定量解析を用いた AMG 法による絶対 Ag 濃度を直接判断できないが組織学的 Ag 試金 (チャー)。最も孤立した鯨類の誘導結合プラズマ質量分析法による Ag 濃度を測定の難しさを考慮したチャーは鯨類体内の不足のための誘導結合プラズマ質量分析によって確定できない Ag 濃度を推定する貴重な補助方法冷凍組織サンプル。Suborgan レベルと Ag の鯨類の肝臓と腎臓の組織内濃度を推定するチャーというアッセイで Ag のローカライズに関する組織化学的手法 (AMG 法) のプロトコルについて述べる。

図 1: Ag 濃度を推定するための確立と鯨類の組織学的 Ag 試金 (チャー) のアプリケーションを描いたフローチャート。チャー鯨類の組織学的な Ag の試金、FFPE を = = ホルマリン固定、パラフィン包埋、ICP-MS = 誘導結合プラズマ質量分析法。この図の拡大版を表示するのにはここをクリックしてください。
プロトコル
国際ガイドラインに従って研究を行い理事会の農業の台湾 (研究許可 104-07.1-SB-62) によって鯨組織サンプルの使用が認められて。
1. 組織誘導結合プラズマ質量分析の前処理
注: 肝臓と腎臓組織を採取から新鮮な死んで、適度いる自己融解座礁鯨類24をはじめ 4 種の 1ハナゴンドウ(Gg) の孤立した鯨類 6 2 Kogia属 (Ko) 2 Lagenodelphis 法政(Lh) 1スジイルカ属 attenuata (Sa)。各座礁鯨は、個体識別のためのフィールド番号を持っていた。誘導結合プラズマ質量分析のための組織サンプル準備か陳のラボで定められた方法に従い、か陳研究室実施誘導結合プラズマ質量分析11,13,25。
- 座礁鯨類から誘導結合プラズマ質量分析のための肝臓と腎臓の組織を収集し、使用するまで − 20 ° C で保存します。
- 肝臓のペアに一致を収集し、同じから腎組織座礁 AMG 解析の鯨類 (手順 2 を参照してください)。
- ステンレス製メスによる誘導結合プラズマ質量分析の収集された組織サンプルの外側の層をトリムします。小さなキューブ (約 1 cm3) に組織サンプルの内側の部分を切り取って、zip ロックの袋にそれらを置きます。通常、各袋には、組織の 10 g が含まれています。
- 以降の手順については − 20 ° C に組織サンプルを含むビニール袋を格納します。
- 定数に秤量することにより完全に乾燥凍結試料乾燥システム (-50 ° C 少なくとも 98 L/分、0.002 mBar の変位を真空ポンプ) 少なくとも 72 時間までの 1 cm3のキューブを置きます。
- その後ティッシュの消化力のためのホモジナイザーと粉に乾燥したキューブを均質化します。
- ポリテトラフルオロ エチレン (PTFE) 瓶 30 mL の均質化試料の 0.3 グラムの重量を量るし、65%/w 硝酸 10 mL でそれらをミックスします。
- PTFE ボトルにクロージャを置くが、untightened クロージャのまま。
注: これにより、PTFE のボトルと逆流でフォームに茶色のヒューム消化ボトル中茶色の煙が消えるし、が明確になるまで。 - 2 ~ 3 週間まで PTFE 瓶褐色のガスが無色になる、PTFE ボトルの液体になる半透明 gree PTFE ボトルで (成形条件茶色ヒューム) によると 110/120 ° C ~ 30 ° C からのホット プレートなどの実試料を熱します。ニッシュ淡い黄色または完全にオフにします。
注: は、化学の発煙のフード暖房プロセスを実行します。 - 唯一 0.5-1 まで PTFE ボトルに硝酸を蒸発させるための 120 の ° c の実試料を熱 mL のまま。
注: 化学の発煙のフードでは、加熱プロセスを実行し、常に PTFE ボトルのクロージャから褐色のガスが漏れないように温度上昇を監視します。 - クロージャを締めるし、約 1 時間室温で冷ます。
- フィルターとファンネル論文 25 mL メスフラスコと 25 mL の最終巻に 1 M 硝酸溶液3残りの液体の洗浄の場所。
注: は、二度と閉鎖の少なくとも 3 回の瓶を洗います。 - 冴えない男 2 (ツノザメ肝) と寮 2 (ツノザメ筋肉) を含む標準試料を用いた誘導結合プラズマ質量分析の分析の品質を検証します。
- 各分析サンプルの重複および誘導結合プラズマ質量分析用標準物質のトリプリケートを使用します。
- 各分析サンプルの Ag 濃度を平均し、乾燥重量基礎濃度 (μ g/g 乾燥重量) としてデータを表示します。
2. AMG 解析ティッシュ サンプルの準備
- 座礁クジラ目の動物から AMG の分析のためのペアをマッチさせた肝臓と腎臓組織を収集し、使用するまで 10% 中性緩衝ホルマリンでそれらを修正します。
注: は、24 ~ 48 時間 10% 中性緩衝ホルマリン (NBF、pH 7.0) のプラスチックびんの組織サンプルを格納します。NBF のボリュームを少なくとも 10 倍以上の組織ボリュームにする必要があります。 - ステンレス鋼の使い捨てのミクロトーム刃と肝臓と腎臓組織を固定ホルマリンをトリミングし、トリミング切片を入れてラベル カセット。
注: 各切片の大きさは約 2 cm × 1 cm にする必要があります、各切片の厚さが超えない 3 mm. 同じカセットに同じ個体から肝臓と腎臓の組織を置きます。 - 脱水、トリミングされたティッシュ セクション傾斜エタノール (1 h 70%、1 h の 80%、95 %1 h、2 h の 95%、1 h × 2、料理を染色の 100%、2 h で 100%) のシリーズを介して組織プロセッサと非-キシレン (1 h と異なる染色料理 2 h)、paraffin (1 h と異なる染色料理 2 h) のための脱水の組織サンプルを浸す。
- 鋼の組織型の底の水分を取り除かれた組織サンプルを配置し、パラフィンと脱水組織サンプルを埋め込みます。
- パラフィン凝固までコールド プレートにパラフィン (FFPE) ティッシュのブロックを固定ホルマリンを冷やします。組織面が露出するまで FFPE ブロックをミクロトームでトリミングします。
- − 20 ° C で 10 分間セクション 5 μ m で FFPE ブロック FFPE ブロックをミクロトームでチルします。
- 45 ° C で二重蒸留水で水浴を埋めるティッシュ セクションのリボンを持ち上げ、ピンセットやブラシを使用して、暖かい水の表面に浮くようにします。
- ピンセットでティッシュ セクションのリボンを区切ります。顕微鏡スライド上にセクションを配置します。
- 暖かいスライドの顕微鏡スライドを配置でき、37 ° C で一晩乾燥してセクション
- 顕微鏡スライドをスライド ラックに入れ、純粋な非-キシレン (およそ 200 に 250 mL)、8、5、3 分の 3 つの異なる染色料理でそれらを浸すことによってそれらを deparaffinize します。
- 傾斜エタノール溶液 (100% エタノール二度、一度 90% エタノールと 80% エタノール一度 【 1 分 】) の異なる染色料理でそれらを浸すことによってスライド ラックに切片をメタンハイド レートし、ダブル蒸留水でそれらをすすいでください。
注: これらのソリューションは、異なる染色料理約 200 ~ 250 ミリリットルです。各洗浄のため 30 秒は十分です。 - 組織の節リン酸緩衝生理食塩水 (PBS) 0.5% トリトン X-100, いくつかのための PBS の回と二重蒸留水で洗い、洗浄リンス。
注: これらのソリューションは、異なる染色料理約 200 ~ 250 ミリリットルです。それぞれは、30 秒で十分です。 - 暗闇の中で銀の強化キットによって提供される 3 つのコンポーネント (イニシエーター、モデレーター、および活性化) の同量を準備し、それらを徹底的にミックスします。
注意: モデレーターとアクティベーターのソリューションは粘着性がある、使用してください広い先端開口を有するピペット (またはより広い開口部を作成するためのヒントをカット)。スライドごとに 300 μ L の混合液 (ティッシュ セクションのサイズ) によって異なりますが通常は十分です。したがって、10 のスライドを使用する場合、各コンポーネント (イニシエーター、モデレーターや活性剤) の量は 1000 μ L (混合液はスライドは 10 枚のため 3000 μ L) です。 - 室温で暗闇の中で 15 分間混合溶液中ティッシュ セクションを孵化させなさい。混合溶液をスライドにティッシュ セクションを完全にカバーします。偽陽性 AMG 信号インキュベーション時間がかかる可能性があります。
- 二重蒸留水とスライドを洗って、それらを 10 のヘマトキシリンで染色、対比染色として s。
- 水道水を実行しているスライドを洗って水気をメディアをマウントでそれらをマウントします。
- 光学顕微鏡でスライドを確認します。
- ランダムにコンピューターのイメージング ソフトウェアで接続されたデジタル カメラを使用して各組織切片から 40 倍対物レンズ 10 組織学的イメージをキャプチャします。
3. 半定量的な解析 AMG 組織標本画像の正の値を
注: AMG の正の値は、AMG の肯定的な信号を持つ領域の割合を意味します。
- 画像解析ソフト (ImageJ) を使用して、組織のイメージを分析します。
- ファイルを押すことによって組織の画像を開く |オープン。
- 画像を押すことで選択した画像を 3 つのカラー チャンネル (赤、青、および緑) 分割 |種類 |RGB スタックします。
- 青のチャネルを使用して AMG の肯定的な信号を定量化します。核の偽肯定的な信号は通常青のチャネルの下で低下したヘマトキシリン染色が核対比染色 (図 2) に適用されます。
- AMG 肯定的な信号をしきい値ツールと各組織の画像領域の割合を測定 (画像 |調整 |しきい値)。
- 核および/または赤血球の偽肯定的な区域のプレゼンスに基づく (110 90) から各組織画像の閾値のカットオフ値を手動で調整します。
注: 既定の設定、AMG の肯定的な信号は赤色でハイライトする必要があります。 - プレス分析 |測定の設定、し面積率を記録することを指定する面積率のボックスをご確認ください。
- プレス分析 |メジャー。各組織学的イメージの肯定的なパーセント領域が% 地域の結果ウィンドウの列に表示されます。
- 各組織切片から 10 組織標本画像の肯定的なパーセント エリアを平均し、各切片に AMG の正の値として結果を定義します。

図 2: 異なる色チャネルの下で核の偽肯定的な信号の存在 (対比染色: ヘマトキシリン染色).代表的な核の偽肯定的な信号は黄色の矢印で示されます。PPA 領域の正のパーセント値を =。この図の拡大版を表示するのにはここをクリックしてください。
4. 回帰モデルによる鯨類の組織学的 Ag アッセイ (チャー) の確立
注: 次の分析は、Windows 用プリズム 6.01 で実行です。
- ICP-MS の結果と AMG 正の値との相関を評価します。
- ソフトウェアを開き、新しいプロジェクト ファイルを作成、 XYを選択し、相関します。
- ICP-MS と AMG の正の値の結果を含むデータを入力。
- 分析を押し、ピアソン相関解析による ICP-MS の結果と AMG の正の値の間の関連の強さを分析するXY 分析カテゴリの下に相関を選択します。
メモ: 誘導結合プラズマ質量と AMG の正の値の結果がお互いと正の相関があります。そうでなければ、その後回帰モデルは開発されない必要があります。 - 線形回帰、二次回帰式、回帰、および統計ソフトウェア12,26,27を通じての原点を線形回帰を含む回帰モデルを統計的に比較します。
注: 回帰モデルでは、非現実的な Ag 濃度を生成する場合は、放棄された12が回帰モデルでする必要があります。 - データ テーブル (左側のパネル) に戻るし、分析を押す |非線形回帰 (近似曲線) XY 分析カテゴリの下 |[Ok]をします。
- ウィンドウでパラメーター: 非線形回帰フィットページに異なる回帰モデルを選択し、比較ページで異なる回帰モデルを比較します。
- 比較ページで比較メソッド、余分な合計の二乗 F 検定と赤池の情報量規準 (AIC) を含むを選択します。比較メソッドの結果によると、サーチャーで比較的適切な回帰モデルを使用します。
- チャーを使用して不明な銀濃度と鯨の肝臓と腎臓の組織の Ag 濃度を見積もる。
- 精度と肝臓と腎臓組織のチャーの精度を評価します。精度と確度の違いを図 3に示します。
- 精度: は、知られていると推定される Ag 濃度の違いから平均標準偏差 (SD) を計算します。
- 精度: は、同じ FFPE 組織から連続切片の AMG の正の値の (少なくとも帳票) 繰り返しの測定を実行します。知られていると推定される銀濃度との間の違いから肝臓や腎臓の組織からの測定値の平均 SD を計算します。
注: 精度と精度の評価の方法は、図 4に描かれています。
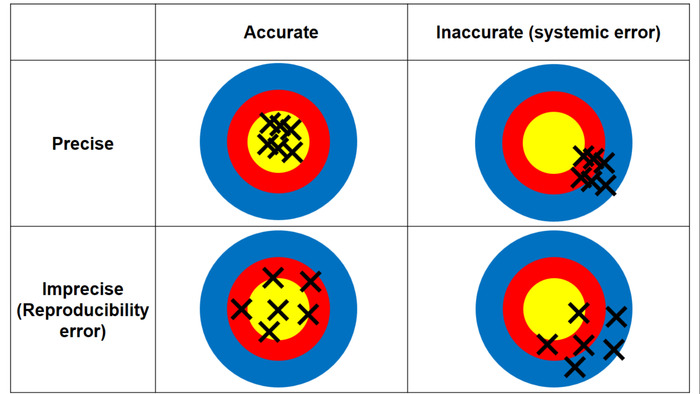
図 3: 精度と精度の違い。精度を意味する測定が (すなわち、 ICP-MS による Ag 濃度); の真の値に近いか精密測定 (すなわち、 AMG 帳票ティッシュ セクションからの正の値の繰り返し測定間の整合性) の再現性を意味します。この図の拡大版を表示するのにはここをクリックしてください。
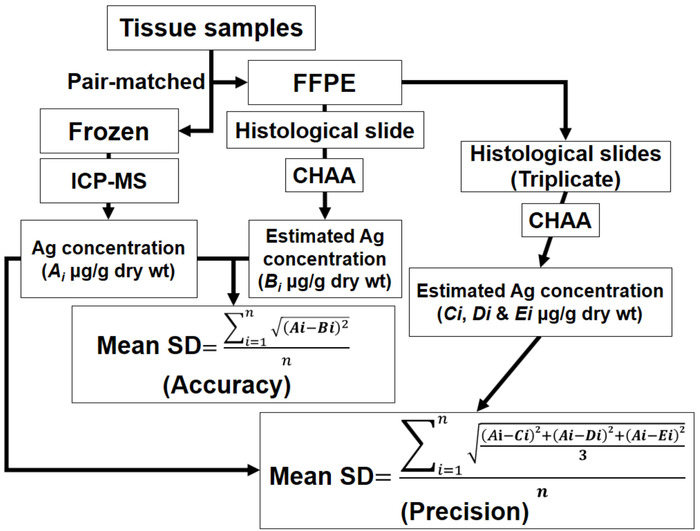
図 4: 正確さと精度の評価の方法を描いたスキーム。チャー = 鯨組織 Ag の試金;FFPE = ホルマリン固定のパラフィン埋め込まれた;ICP-MS = 誘導結合プラズマ質量分析法;Ai = 各ペアをマッチさせた組織サンプルの ICP-MS による Ag 濃度のそれぞれBi = 各ペアをマッチさせた組織サンプルのチャーの Ag 濃度のそれぞれEi、Di と Ci = 各ペアをマッチさせた組織サンプルから帳票サンプルのチャーの Ag 濃度のそれぞれ私 n に 1 を =。代表的な結果のセクションの正確さと精度のテストの raw データを参照してください。この図の拡大版を表示するのにはここをクリックしてください。
5. チャーによる Ag 濃度の推定。
- 座礁鯨類から肝臓と腎臓組織を収集し、10% 中性緩衝ホルマリンでそれらを修正します。
- 日常的にホルマリン固定組織を処理 (手順 2 を参照してください)。
- チャーで Ag 濃度が不明な鯨の肝臓と腎臓の組織の Ag 濃度を推定 (手順 3 と 4 を参照してください)。
結果
鯨の肝臓と腎臓の組織で AMG の肯定的な信号の代表的なイメージは、図 5のとおりです。AMG の肯定的な信号には、近位尿細管上皮、肝細胞、クッパー細胞の細胞質の様々 なサイズの黒い顆粒に可変サイズのブラウンがあります。時折、内腔といくつかの近位腎尿細管基底膜の茶色の AMG の肯定的な信号を非晶質の黄金色が記載されています。ICP-M...
ディスカッション
論文研究の目的は、suborgan レベルで Ag 分布を評価して Ag の鯨類の組織内濃度を推定する補助方法を確立することです。現在のプロトコルは、ICP-MS、知られている Ag 濃度とペアをマッチさせた組織試料の 2) AMG 分析 3) Ag 濃度を推定する回帰モデル (チャー) の確立による鯨類の組織 1) Ag 濃度の測定AMG の正の値、4) が精度とチャー、及び 5 の精度の評価) チャーによる Ag の推定濃度。
開示事項
著者が明らかに何もありません。
謝辞
私たちはサンプル コレクションとストレージ、台湾鯨社会、台北などの台湾日本鯨類のストランディング ネットワークに感謝します。鯨類研究所 (教授先取特権 Siang 周)、生態学研究所、進化生物学、国立台湾大学、台北。自然科学 (博士 Chiou じゅ八尾)、台中; 国立博物館海洋生物学・日本鯨類研究所国立チェン Kung 大学。我々 はまた彼らの許可の林業局、農業委員会、行政院を感謝します。
資料
| Name | Company | Catalog Number | Comments |
| HQ Silver enhancement kit | Nanoprobes | #2012 | |
| Surgipath Paraplast | Leica Biosystems | 39601006 | Paraffin |
| 100% Ethanol | Muto Pure Chemical Co., Ltd | 4026 | |
| Non-Xylene | Muto Pure Chemical Co., Ltd | 4328 | |
| Silane coated slide | Muto Pure Chemical Co., Ltd | 511614 | |
| Cover glass (25 x 50 mm) | Muto Pure Chemical Co., Ltd | 24501 | |
| Malinol | Muto Pure Chemical Co., Ltd | 20092 | |
| GM Haematoxylin Staining | Muto Pure Chemical Co., Ltd | 3008-1 | |
| 10% neutral buffered formalin solution | Chin I Pao Co., Ltd | --- | |
| Tip (1000 μL) | MDBio, Inc. | 1000 | |
| PIPETMAN Classic P1000 | Gilson, Inc. | F123602 | |
| 15 ml Centrifuge Tube | GeneDireX, Inc. | PC115-0500 | |
| Dogfish liver | National Research Council of Canada | DOLT-2 | |
| Dogfish muscle | National Research Council of Canada | DORM-2 | |
| Inductively coupled plasma mass spectrometry (ICP-MS) | PerkinElmer Inc. | PE-SCIEX ELAN 6100 DRC | |
| FreeZone 6 liter freeze dry system | Labconco | 7752030 | For freeze drying |
| BRAND® SILBERBRAND volumetric flask | Merck | Z326283 | |
| 30 mL standard vial, flat interior with 33 mm closure | Savillex Corporation | 200-030-12 | For diagestion |
| Nitric acid, superpur®, 65.0% | Merck | 1.00441 | For diagestion |
| Hot Plate/Stirrers | Corning® | PC-220 | For diagestion |
| High Shear lab mixer | Silverson | SL2T | For homogenization |
| Sterile polypropylene sample jar (250mL) | Thermo Scientific™ | 6186L05 | For homogenization |
| Digital camera | Nikon Corporation | DS-Fi2 | |
| Light microscope | Nikon Corporation | ECLIPSE Ni-U | |
| Shandon™ Finesse™ 325 manual microtome | Thermo Scientific™ | A78100001H | |
| Accu-Cut® SRM™ 200 rotary microtome | Sakura | 1429 | |
| Microtome blade S35 | FEATHER® | 207500000 | |
| Slide staining dish and cover | Brain Research Laboratories | #3215 | |
| Steel staining rack | Brain Research Laboratories | #3003 | |
| Shandon embedding center | Thermo Scientific™ | S-EC | |
| Shandon Citadel® tissue processor | Thermo Scientific™ | 69800003 | |
| Slide warmer | Lab-Line Instruments | 26005 | |
| Water bath | Shandon Capshaw | 3964 | |
| Filter paper | Merck | 1541-070 | |
| Prism 6.01 for windows | GraphPad Software | Statistic software | |
| ImageJ | National Institutes of Health | ||
| Stainless steel tissue embedding mould | Shenyang Roundfin Trade Co., Ltd | RD-TBM003 | For paraffin emedding |
参考文献
- McGillicuddy, E., et al. Silver nanoparticles in the environment: Sources, detection and ecotoxicology. Science Total Environment. 575, 231-246 (2017).
- Yu, S. J., Yin, Y. G., Liu, J. F. Silver nanoparticles in the environment. Environmental Science: Processes and Impacts. 15 (1), 78-92 (2013).
- Hansen, S. F., et al. Nanoproducts- what is actually available to European consumers?. Environmental Science: Nano. 3 (1), 169-180 (2016).
- Vance, M. E., et al. Nanotechnology in the real world: Redeveloping the nanomaterial consumer products inventory. Beilstein Journal of Nanotechnology. 6, 1769-1780 (2015).
- Farre, M., Gajda-Schrantz, K., Kantiani, L., Barcelo, D. Ecotoxicity and analysis of nanomaterials in the aquatic environment. Analytical and Bioanalytical Chemistry. 393 (1), 81-95 (2009).
- Walters, C. R., Pool, E. J., Somerset, V. S. Ecotoxicity of silver nanomaterials in the aquatic environment: a review of literature and gaps in nano-toxicological research. Journal of Environmental Science and Health. Part A, Toxic/hazardous Substances & Environmental Engineering. 49 (13), 1588-1601 (2014).
- Levard, C., Hotze, E. M., Lowry, G. V., Brown, G. E. Environmental transformations of silver nanoparticles: impact on stability and toxicity. Environmental Science & Technology. 46 (13), 6900-6914 (2012).
- Massarsky, A., Trudeau, V. L., Moon, T. W. Predicting the environmental impact of nanosilver. Environmental Toxicology and Pharmacology. 38 (3), 861-873 (2014).
- Wang, H., et al. Toxicity, bioaccumulation, and biotransformation of silver nanoparticles in marine organisms. Environmental Science and Technology. 48 (23), 13711-13717 (2014).
- Buffet, P. E., et al. A marine mesocosm study on the environmental fate of silver nanoparticles and toxicity effects on two endobenthic species: the ragworm Hediste diversicolor and the bivalve mollusc Scrobicularia plana. Science of the Total Environment. 470, 1151-1159 (2014).
- Chen, M. H. Baseline metal concentrations in sediments and fish, and the determination of bioindicators in the subtropical Chi-ku Lagoon, S W Taiwan. Marine Pollution Bulletin. 44 (7), 703-714 (2002).
- Li, W. T., et al. Investigation of silver (Ag) deposition in tissues from stranded cetaceans by autometallography (AMG). Environmental Pollution. , 534-545 (2018).
- Chen, M. H., et al. Tissue concentrations of four Taiwanese toothed cetaceans indicating the silver and cadmium pollution in the western Pacific Ocean. Marine Pollution Bulletin. 124 (2), 993-1000 (2017).
- Li, W. T., et al. Immunotoxicity of silver nanoparticles (AgNPs) on the leukocytes of common bottlenose dolphins (Tursiops truncatus). Scientific Reports. , (2018).
- Bornhorst, J. A., Hunt, J. W., Urry, F. M., McMillin, G. A. Comparison of sample preservation methods for clinical trace element analysis by inductively coupled plasma mass spectrometry. American Journal of Clinical Pathology. 123 (4), 578-583 (2005).
- Bonta, M., Torok, S., Hegedus, B., Dome, B., Limbeck, A. A comparison of sample preparation strategies for biological tissues and subsequent trace element analysis using LA-ICP-MS. Analytical and Bioanalytical Chemistry. 409 (7), 1805-1814 (2017).
- Bischoff, K., Lamm, C., Erb, H. N., Hillebrandt, J. R. The effects of formalin fixation and tissue embedding of bovine liver on copper, iron, and zinc analysis. Journal of Veterinary Diagnostic Investigation. 20 (2), 220-224 (2008).
- Miller, D. L., Yu, I. J., Genter, M. B. Use of Autometallography in Studies of Nanosilver Distribution and Toxicity. International Journal of Toxicology. 35 (1), 47-51 (2016).
- Anderson, D. S., et al. Influence of particle size on persistence and clearance of aerosolized silver nanoparticles in the rat lung. Toxicological Sciences. 144 (2), 366-381 (2015).
- Kim, W. Y., Kim, J., Park, J. D., Ryu, H. Y., Yu, I. J. Histological study of gender differences in accumulation of silver nanoparticles in kidneys of Fischer 344 rats. Journal of Toxicology and Environmental Health, Part A. 72 (21-22), 1279-1284 (2009).
- Danscher, G. Applications of autometallography to heavy metal toxicology. Pharmacology Toxicology. 68 (6), 414-423 (1991).
- Deroulers, C., et al. Analyzing huge pathology images with open source software. Diagnostic Pathology. 8, 92 (2013).
- Shu, J., Dolman, G. E., Duan, J., Qiu, G., Ilyas, M. Statistical colour models: an automated digital image analysis method for quantification of histological biomarkers. BioMedical Engineering Online. 15, 46 (2016).
- Geraci, J. R., Lounsbury, V. J. Specimen and data collection. Marine mammals ashore: a field guide for strandings. , 167-230 (2005).
- Shih, C. -. C., Liu, L. -. L., Chen, M. -. H., Wang, W. -. H. . Investigation of heavy metal bioaccumulation in dolphins from the coastal waters off Taiwan. , (2001).
- Liang, C. S., et al. The relationship between the striatal dopamine transporter and novelty seeking and cognitive flexibility in opioid dependence. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 74, 36-42 (2017).
- Spiess, A. N., Neumeyer, N. An evaluation of R2 as an inadequate measure for nonlinear models in pharmacological and biochemical research: a Monte Carlo approach. BMC Pharmacology. 10, 6 (2010).
- Stoltenberg, M., Danscher, G. Histochemical differentiation of autometallographically traceable metals (Au, Ag, Hg, Bi, Zn): protocols for chemical removal of separate autometallographic metal clusters in Epon sections. Histochemical Journal. 32 (11), 645-652 (2000).
- Dimitriadis, V. K., Domouhtsidou, G. P., Raftopoulou, E. Localization of Hg and Pb in the palps, the digestive gland and the gills in Mytilus galloprovincialis (L.) using autometallography and X-ray microanalysis. Environmental Pollution. 125 (3), 345-353 (2003).
- Loumbourdis, N. S., Danscher, G. Autometallographic tracing of mercury in frog liver. Environmental Pollution. 129 (2), 299-304 (2004).
- Stoltenberg, M., Larsen, A., Kemp, K., Bloch, D., Weihe, P. Autometallographic tracing of mercury in pilot whale tissues in the Faroe Islands. International Journal of Circumpolar Health. 62 (2), 182-189 (2003).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved