A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טיפוח של ירוק Microalgae בועה עמודה Photobioreactors ואת וזמינותו עבור ליפידים נייטרלי
In This Article
Summary
כאן, אנו מציגים פרוטוקול כדי לבנות מעבדה-סולם בועה עמודה photobioreactors ולהשתמש בהן כדי microalgae תרבות. הוא מספק גם שיטה לקביעת שיעור הצמיחה תרבות ותוכן השומנים נייטרלי.
Abstract
יש עניין משמעותי במחקר של microalgae ליישומים הנדסיים כגון הייצור של דלק ביולוגי, מוצרים בעלי ערך גבוה, ועל לטיפול של פסולת. כמו רוב מאמצי מחקר חדש להתחיל בקנה מידה מעבדה, יש צורך שיטות חסכונית culturing microalgae באופן לשחזור. כאן, אנו מתקשרים גישה יעילה microalgae התרבות במעבדה-מידה photobioreactors, וכדי למדוד את הצמיחה ואת תוכן שומני נייטרלי של אצות הזה. הוראות כלולות גם על כיצד להגדיר את המערכת photobioreactor. למרות האורגניזמים דוגמה מינים של כלורלה , Auxenochlorella, ניתן להתאים מערכת זו לטפח מגוון רחב של microalgae, כולל תרבויות המשנה של אצות עם מינים שאינם אצות. תרבויות מניות קודם גדלים בקבוקים כדי לייצר inoculum של המערכת photobioreactor. אצות inoculum מרוכז, הועבר photobioreactors לטיפוח במצב אצווה. דוגמאות נאספים מדי יום עבור המקראות צפיפות אופטית. בקצה של התרבות אצווה, התאים נקצרים על ידי צנטריפוגה, שטף, להקפיא מיובש בריכוז סופי משקל יבש. הריכוז הסופי משקל יבש משמשת ליצירת מתאם בין הצפיפות האופטית ריכוז משקל יבש. שיטה Folch ששונה משתמשים לאחר מכן לחלץ סה כ שומנים ביומסה הליחה, התמצית הוא לבדיקה לתוכן נייטרלי השומנים שלה באמצעות וזמינותו של microplate. זה וזמינותו שפורסם בעבר אבל פרוטוקול צעדים נכללו כאן כדי להדגיש שלבים קריטיים בהליך שבו מתרחשות לעתים קרובות שגיאות. מערכת ביוריאקטור המתוארים כאן ממלא את הנישה שלו בין טיפוח פשוטה את הבקבוק שבשליטת מלא מסחרית ריאקטורים. מעתיק. אפילו עם רק 3-4 ביולוגית לכל טיפול, גישת culturing אצות מוביל חזק סטיות תקן ב מבחני וצמיחה של השומנים.
Introduction
היישום של microalgae הנדסה וביוטכנולוגיה משכה עניין רב בשנים האחרונות. Microalgae נלמדים לשימוש בשפכים טיפול1,2,3,4, biofuel הייצור5,6,7,8, ו ייצור בריאותיים, אחרים9,מוצרים בעלי ערך גבוה10. אצות הן גם להיות מהונדסים גנטית במחירים גדול במאמץ לשפר את כושר ספציפי הנדסי יישומי11,12. כתוצאה מכך, יש עניין רב בניסויים עם תעשייתי הרלוונטיות האורגניזמים בהגדרות מבוקרת. מטרת שיטה זו היא לתקשר גישה יעילה microalgae תרבות בסביבה מעבדתית מבוקרת, וכדי למדוד את הצמיחה ואת תוכן שומני נייטרלי של אצות הזה. שיפור צמיחת המחירים ותוכן השומנים נייטרלי microalgae זוהו שני צווארי בקבוק המפתח לכיוון מסחור של דלק ביולוגי אצה13.
מגוון רחב של גישות שימשו התרבות אצות למטרות ניסוי. באופן כללי, גישות אלה ניתן לחלק בין טיפוח חיצונית בקנה מידה גדול טיפוח מקורה בקנה מידה קטן. חיצונית בטיפוח photobioreactors ובריכות פתוחות מתאימה עבור ניסויים מכוונים קנה מידה את התהליכים כבר הוכחו בקנה מידה מעבדה (למשל, כדי לבדוק את הסולם של מתח גבוה-השומנים החדש של אצות)14. אולם, טיפוח בקנה מידה קטן מקורה מתאים בעת פיתוח זנים חדשים או משופרים אצות או ביצוע ניסויים שמטרתם להבין מנגנונים ביולוגיים. במקרים אלה האחרונים, רמה גבוהה של שליטה ניסויית נדרש לבדוק שינויים עדינים התנהגות ביולוגית. לשם כך, תרבויות axenic נדרשים לעיתים קרובות על מנת לצמצם את הגורמים ביוטיים מורכבים הקשורים אורגניזמים אחרים (למשל חיידקים, אצות אחרות) אשר גדלים באופן בלתי נמנע במערכות חיצוניות בקנה מידה גדול. גם כאשר הלומדים אינטראקציות בין אצות ואורגניזמים אחרים, מצאנו כי תנאי ניסוי מבוקר מאוד שימושי כאשר בוחנים exchange מולקולרי בין אורגניזמים15,16,17.
בקטגוריה של טיפוח אצות מקורה בקנה מידה קטן, שימשו מגוון של גישות. אולי הגישה הנפוצה ביותר היא לגדל אצות Erlenmeyer המבחנות על שולחן שאכר מתחת הבנק אור18,19. החליפין של חמצן ו- CO2 מתקיים על ידי דיפוזיה פסיבית דרך פקק קצף בחלק העליון של הבקבוק. יש חוקרים שיפרו את הגדרת דרך לערבב פעיל מתוך מבחנות20. גישה אחרת היא לטפח אצות בקבוקים, מיקס על ידי ובר מערבבים לערבב פעיל. למרות הפשטות שלהם, מצאנו כי השימוש מימיות ובקבוקי מובילה לעיתים קרובות תוצאות לא עקביות בין משכפל ביולוגי. ככל הנראה זאת בשל המיקום אפקטים - עמדות שונות לקבל כמויות שונות של אור, אשר גם להשפיע על הכור הפנימי טמפרטורות. הסיבוב היומי של כורים למיקומים חדשים יכול לעזור אבל לא להקל על הבעיה כי בשלבים מסוימים של גידול אצות (למשל, מוקדם מעריכית) רגישים יותר להשפעות מיקומיים יותר מהאחרים (למשל, שלב יומן).
בצד השני של הספקטרום של תחכום טכנולוגי נמצאים בשליטה מלאה photobioreactors מסחרי. מערכות אלו ללא הרף לעקוב ולהתאים את התנאים לכור כדי למטב את גידול אצות. יש להם תאורה הניתן לתכנות, בקרת טמפרטורה בזמן אמת ושליטה pH. למרבה הצער, הם יקרים, בדרך כלל עלות כמה אלפי דולרים לכל כור. כתבי עת מדעיים והנדסיים ביותר דורשים שכפול הביולוגי של תוצאות, המחייב רכישת ריאקטורים מרובים. אנו מציגים כאן מערכת הכור בועה עמודה הגשרים את הפער בין פשוטה (הבקבוק) מתוחכם (בשליטה מלאה ביוריאקטור) מתקרב לטיפוח אצות בקנה מידה מעבדה. אכסדרת בועות להשתמש בעליה בועות גז כדי להקל על חילוף הגזים ומערבבים את הכור. גישה זו מספקת מידה מסוימת של שליטה תאורה וטמפרטורה אך עושה זאת באופן חסכוני. יתר על כן, מצאנו את מערכת זו להניב תוצאות עקביות גבוהה בקרב משכפל ביולוגי, הפחתת את המספר הנדרש של משכפל ביולוגי הדרושים על מנת להשיג תוצאות משמעותיות מבחינה סטטיסטית לעומת הגישה את הבקבוק או בקבוק. השתמשנו גם מערכת זו לטפח בהצלחה תערובות של אצות, חיידקים21. בנוסף טיפוח אצות, אנחנו חלוקה לרמות הליך למדידת את תכולת השומנים נייטרלי האצות בתרבית. השיטה השנייה כבר שפורסם במקומות אחרים22, אך אנו כוללים את ההליך פה לספק הוראות שלב אחר שלב כיצד להעסיק אותו בהצלחה.
Protocol
1. כיוונון של בועה עמודה Photobioreactors
- לבנות סט של העפעפיים פרקו מן עפעפיו פלסטיק שהגיע עם בקבוקי זכוכית 1 ליטר וצינורות הכלאה (לקבלת מפרטים טכניים ותמונות, ראה איור 1 ). לבנות מכסים עבור מעשיר, ערבוב מלכודת כל photobioreactor מעלית אויר, כל בכור בקבוק.
- קודחים חורים ¼" המכסה: 2 חורים יש צורך העפעפיים ביוריאקטור ומכשיר האדים; 3 חורים יש צורך המלכודת ערבוב.
- להחליק ¼" o-ring על הנושאים של 1/8" לוח זכוכית הר התאמה והחלק הזה לתוך החור ¼" בתלמידים את המכסה (איור 1 א').
- להחליק השני ¼" o-ring מעל החוטים כך המכסה דחוקה בין שני O-הטבעות. להחליק שם באום אל החוטים והדק לתקן זכוכית הר את החלונית במקום.
- הצמד טבעות מנעול על גבי חשופה זכר סכינים סטריליים מקרין המכסה. חזור על צעדים 1.1.2-1.1.4 עבור כל חור במכסה.
- על העפעפיים אשר ישמש על כורים העמודה ואת הבקבוק בועה, לצרף 1/8" הנשי סכינים סטריליים כדי בארב אביזרי כדי 1.5" חתיכות של מזהה PVC לצנרת 1/8. צרף אלה לכל אחד המדידות סכינים סטריליים הגברי החשוף על המכסה.
- להתחבר שסתום הסימון (הצבעה מן המכסה) סוף חינם אחד 1/8" חתיכות.
הערה: זה ישמש היציאה פליטה ביוריאקטור. - להתחבר עם סכינים סטריליים זכר בארב הולם את החלק השני של "1/8 צינורות מקרין המכסה. במקומו בנקישה את טבעת מנעול סיבוב והדקו מסנן אוויר 0.2 מ מ הזה.
הערה: זה ישמש היציאה כניסת עבור הכור.

איור 1. מפרטים טכניים ותמונות לבניית ריאקטורים. (A) מפרטים טכניים עבור בנייה של ביוריאקטור העפעפיים (B) צילום של המכסה ביוריאקטור התאספו, ו (ג) צילום של המכסה שהורכב המשמש מעשיר. שימו לב כי המדידות מכשיר אדים צריך להיות מצופה סיליקון מים הוכחה כדי להבטיח של החותם אטום עם המכסה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- להרכיב מערכת משלוח אוויר (ראה איור 2A ו- 2B מפרטים טכניים, צילום).
- 1/8 NPT חוט לצרף אביזרי בארב אינלטס, שקעים בגב כל רוטמטר.
הערה: 200-2,500 ס מ3/min rotameters הן עבור אוויר בלחץ אפנון במעלה הזרם מעשיר, rotameters /min3ס מ 100-1, 000 הן עבור בקבוק כורים, 50-500 ס מ3/min rotameters נועדו ריאקטורים מעלית אויר ו- 5-50 ס מ3/ rotemeters מין הן עבור CO2 זרימה רגולציה. מומלץ הר rotameters על משטח קבוע (למשל יריעת פלסטיק) הם לא אפול במהלך המבצע. - . כבה את המקור אוויר דחוס ולאחר מכן להתחבר ¼" מזהה גמיש PVC צינורות המקור אוויר דחוס עם מהדק צינור. לרדת את קוטר צינור כדי 1/8 פלייר מזהה PVC גמיש אבובים באמצעות של ¼" הנקבה. בארב התאמה ו 1/8" זכר ל התאמה בארב-
- חבר את הקצה ללא תשלום של 1/8 פלייר מזהה הצנרת לים של רוטמטר /min3ס מ 200-2,500.
הערה: בשקע של רוטמטר זה יזין את הבקבוק מעשיר באמצעות מזהה לצנרת 1/8. - לחבר את 1/8" אבובים על מעין שקע בחופו כדי מכסה פרקו (שימוש סכינים סטריליים הנשי כדי בארב הולם החיבור). לאחר מכן להתחבר לגוש 1/8" אבובים הפנימי של ההר לוח מתאים.
הערה: קטע זה לתלות למטה לתוך מכשיר אדים ו בועת אוויר דרך המים. - לצרף 1/8 סכינים סטריליים הנשי בארב אביזרי בכל צד של פיסת מזהה לצנרת 1/8" ולהשתמש יצירה זו כדי להתחבר לשקע מעשיר הים של המלכודת ערבוב.
- באותו אופן כמו 1.2.5, להתחבר לשקע של הרגולטורים2 CO נמל השני על המלכודת ערבוב.
- לבנות של יריעה באמצעות 1/8" בארב מרובה צנור ו- 1/8" (ראה איור 2 C) להאכיל אוויר לתוך הבנקים רוטמטר.
הערה: rotameters אלה ישמש כדי לספק את ריאקטורים. הימנע בניית 6 יותר rotameters בסדרה. במקום זאת, השתמש במקביל בנקים של rotameters כדי להרחיב את המערכת. להבטיח כי הדרישה תזרים סה כ כל הכורים הוא פחות מ3ס מ 2,500 /min (או אחר יהיה צורך רוטמטר גדול יותר הזרם של מעשיר). - להתחבר לשקע (פורטרואד 3) של המלכודת ערבוב הבנקים רוטמטר שנבנה מחדש באמצעות 1/8" tubing ו 1/8" הנקבה. בארב סכינים סטריליים.
- להתחבר ארוכה דיה 1/8" אבובים לשקעים של כל רוטמטר בגדה רוטמטר לאספקת אוויר ריאקטורים. תווית את הקצוות של הצנרת, כמו גם את rotameters של הבנק.
- החל מים הוכחה סיליקון מסביב לכל היציאות על העפעפיים מלכודת כדי להבטיח שהן מוצק מעשיר ולערבב.
- 1/8 NPT חוט לצרף אביזרי בארב אינלטס, שקעים בגב כל רוטמטר.
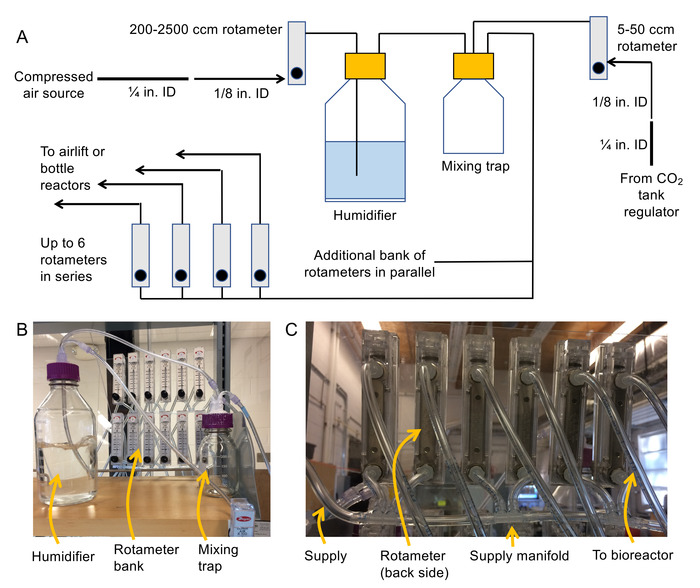
באיור 2. מפרטים טכניים ותמונות להרכבת מערכת עמודה בועה. (א) תיאור סכמטי של התמונה מערכת (B) לערבב מעשיר, ערבוב מלכודת, רוטמטר הבנק, ואת התמונה (C) יריעות המשמש להתחברות הבנקים רוטמטר ביחד. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
- להגדיר את מיכלי דגים, מערבבים צלחות, ואורות (איור 3).
התראה: מערכת זו דורשת מספר רב של חנויות וקיבולת מעגל מספיק כדי לתמוך כל הרכיבים. הימנע stringing יחד מרובים מפצלי חשמל, כבלי אופנה daisy שרשרת כי זה סיכון חשמל. השימוש GFI סוג שקעי חשמל ומפצלי הוא מעודדים בשל נוכחותם של המים במערכת.- לארגן את פרופיל נמוך מטלטלות על משטח ברמה חזקה מספיק כדי להחזיק המשקל של מיכלי דגים מלא מים.
- המקום קטן מעץ או פלסטיק בלוקי (מעט גבוה יותר הצלחות מערבבים) מסביב להיקף של הלוחות מערבבים כדי לתמוך את המשקל של דגים.
התראה: להימנע הצבת מיכלי דגים ישירות על לוחות מערבבים כפי המשקל נמחוץ אותם. - מקם את מיכלי דגים על הצלחות מערבבים תמיכה בלוקים, למלא את מיכלי המים.
- לחתוך חתיכה של גיליון פלסטיק נוקשה כדי להתאים מעל האקווריום כמו מכסה. חתכו את הכיסוי הזה להחליק פנימה והחוצה הצינורות הכלאה. גם לחתוך חור בשביל החימום טנק דגים.
- לארגן את הבנקים אור פלורסנט ליד האקווריום כדי לספק תאורה אופקי של ריאקטורים. חבר הבנק אור שעון עצר אור כדי להגדיר מחזור יום/לילה.

איור 3. מערכת סכמטי של ריאקטורים בקבוק (משמאל) ו photobioreactors עמודה על בועה (מימין). איור זה שונה מהיגינס. et al. 17. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
2. הכנת Microalgae Inoculum
- להשיג microalgae inoculum של תרבות לשימור-הקפאה, מצופים או נוזלי.
הערה: מומלץ כי אורגניזמים cryopreserved להיות מצופה לפני השימוש inoculum כדי להבטיח כי תאים הם קיימא וכי התרבות הנוצרת היא axenic. אגר בינונית (למשל., בקרת האוויר #5 sporulating אגר)21 הוא מדיום עשיר זה עובד היטב עבור להחיות מינים של כלורלה ו Auxenochlorella מהמחסן-הקפאה. - להכין L 2.4 בינוני מינרלים המתאים עבור המין microalgae מסוים.
הערה: הדוגמאות כוללות N8 בינוני23 מינים של כלורלה, N8-NH4 בינוני21 עבור מינים של Auxenochlorella. השימוש במדיום המתאימה לזן של אצות הוא אחד הצעדים החשובים ביותר כלפי להבטיח צמיחה חזקה אצות. - Aliquot 2.4 L של מינרלים בינוני באופן שווה לתוך שלושה בקבוקי זכוכית 1 ליטר, להוסיף מעוררת ברים כל בקבוק ולהרכיב את המכסים פרקו (איור 1) עבור כל בקבוק. שח כפול זה הצינור לערבב על הצד כניסת ועל כל בקבוק יש בר מערבבים.
- אוטוקלב הבקבוקים מניות באמצעות עיקור נוזלי של מחזור (121 מעלות צלזיוס) 30 דקות אוטוקלב 100 מ של מים יונים (dH2O) וצינורות 1.5 mL כמה בו זמנית, אשר מאוחר יותר ישמש עבור ציפוי. לאפשר המדיום כדי לילה מגניב. לחלופין, מגניב הכור לטמפרטורת החדר ולאחר מכן לאוורר כבר שעתיים לפני חיסון.
- ב אבטחה cabinet (BSC), לחסן microalgae צלחת או axenic תרבית נוזלית לתוך הבקבוקים מניות. השתמש סטרילי טכניקה כדי לשמור על תרבויות axenic בשלבים הבאים.
- הוסף 20 מ של בלוק dH2O שפופרת צנטרפוגה סטרילי 50 מ. השתמש לולאה חד פעמי סטרילי 10 µL לאסוף מספר מושבות יחיד מהצלחת מהשלב 2.1. טובלים את הלולאה לתוך הצינור 50 מ ל, לרחוץ תאי האצות לתוך mL 20 של בלוק dH2O. לנער הצינור 50 מ ל לעשות פתרון microalgae הומוגנית.
- פיפטה 6 מ של פתרון microalgae לתוך כל בקבוק מניות עם פיפטה 10 מ"ל סרולוגית סטרילי. מערבולת מהבקבוק לערבב microalgae באופן שווה לתוך האמצעי.
- השתמשו פיפטה סרולוגית סטרילי מ ל 2 לציור 1 מ"ל דגימות מן הבקבוק מניות והעברת כל לתוך צינורות סטרילי mL 1.5.
הערה: Micropipettes לא מומלץ בשלב זה בשל הסיכון של זיהום. להדק את המכסים פרקו על בקבוקי מניות. - למקם את הבקבוקים מניות על צלחות מערבבים (~ 150 סל ד) ולהתאים את קצב הזרימה של האוויר, CO2, ורמות תאורה בהתאם המין. לסובב את המיקום בקבוק מניות כל יום.
- לדלל את הדגימות 1 מ"ל שהתקבל במהלך שלב 2.6 (100-fold לדילול במים סטריליים בדרך כלל עובד היטב) ולהפיץ את הצלחת על גבי מדיום אגר עשיר.
הערה: הצלחות האלה יכול לשמש כדי לבדוק אם המופעים של זיהום גם כפי לשמש כמקור של אצות בעתיד inoculum עבור עוד ניסויים. - לקחת דגימות מן הבקבוקים (ב BSC) בכל יומיים לבדוק את הצמיחה microalgae.
למקם את דגימות microplate 96-ובכן שהפקידים (200 µL) ולמדוד את צפיפות אופטית (OD) ב 550 ננומטר, 680 ננומטר בכל יומיים עד OD מגיע ל- 0.2-0.3 (הדורשת בדרך כלל 5-7 ימים). - תפסיק הדגירה ולמקם את הבקבוקים מניות על הספסל במשך 24-48 שעות לאפשר את התאים אצות להתיישב על ידי הכבידה.
הערה: התאים שיוחסו ישמש הבא לחסן photobioreactors עמודה על בועה. אם אוסף תאים מהירה יותר היא הרצויה, ייתכן centrifuged תאים ב g לא יותר מ- 1,000 x כדי לאסוף תאים.
3. טיפוח Microalgae בתוך בועה עמודה Photobioreactors
- יום לפני חיסון ביוריאקטור, הכנת המדיה המתאימה, העברת 200 מ ל (או לנפח הרצוי) כדי photobioreactor עמודה על בועה צינורות (הכלאה צינורות). אוטוקלב צינורות עם מדיית ומכסים פרקו במקום.
הערה: אם באמצעות בשפכים כמו מדיום הגידול, החיטוי רוקן ריאקטורים ולהוסיף בשפכים סטרילי-מסוננים (אם התרבות axenic רצוי). - לרכז את המניה microalgae שיוחסו על-ידי הסרת את תגובת שיקוע באמצעות משאבה ואקום. להשאיר פחות מ 100 מ של מדיום כל בקבוק אלא למנוע הסרת שיוחסו אצות.
הערה: לנהל הליך זה בתוך BSC ופעל סטרילי טכניקה. ניתן לבנות מנגנון ואקום פשוטה באמצעות flask ואקום או בקבוק. מתאים על פיפטה סרולוגית סטרילי על הקצה של הצנרת. - להשעות ולהעביר את slurry אצות צינורות צנטריפוגה סטרילי 50 מ. צנטריפוגה ב 1,000 x g למשך 5 דקות נוספות להתרכז אצות.
- ב BSC, הסר את תגובת שיקוע מספיק כדי להשיג את הנפח הכולל של ~ 80 מ של אצות תרכיזים לבעלי 12 photobioreacters. הימנע לשאוב החוצה בגדר. להעביר את תרכיז אצות במיכל סטרילי (או הבקבוק מניות אצות בשימוש).
- להוסיף 6 מ של אצות slurry לתוך כל photobioreactor עם פיפטה סרולוגית סטרילי 10 מ"ל.
- מסנן סטרילי (0.2 מ מ מזרק או אבק מסנן) ולהוסיף כמויות מתאימות של כל תרכובות אחרות (למשל ויטמין מניות) אשר לא יכול להיות בלוק.
- מערבולת ריאקטורים לערבב אצות לתוך האמצעי.
- שואבים מדגם 2 מ"ל כל ביוריאקטור באמצעות פיפטה סרולוגית העברת צינור 2 מ"ל. לאסוף דגימה 2 מ"ל (ב BSC) כל 24 שעות כדי לעקוב אחר ההתקדמות תרבות. בדוק המדגם לשימוש pH לבדוק רצועות וכוונן את הכור כנדרש עם 3 או M NaOH או 3 M HCl.
- להדק את המכסים ביוריאקטור ומניחים כל ריאקטורים לאמבטיה דגים טנק מים. התאם את לערבב, CO2ו תאורה לרמת המתאימה עבור המין האנושי. לסובב את המיקום ביוריאקטור בכל יום לאחר דגימה (שלב 3.8).
- µL 200 של כל תרבות מדגם שהפקידים חלות על בארות microplate טוב 96. למדוד צפיפות אופטית (OD) ב 550 ננומטר, 680 ננומטר.
- ביום האחרון של תקופת תרבות, למדוד OD תחת דילול שונים גורמים (למשל, סימן x 1, 2 x, 4 x, 8 x, 16 x ו- 32 x) להקים מתאם בין OD, ומשקל יבש בפועל לאחר הקטיף (שלב 4).
- Centrifuge הצינור מדגם 2 mL ב g x 12,000 במשך 5 דקות.
- לסנן את תגובת שיקוע דרך 0.2 µm מזרק שאינו סטרילי מסנן ולאחסן את תגובת שיקוע (וגלולה במידת הצורך) ללא גבוה מ-20 ° C עבור אחסון לטווח ארוך וניתוחים מאוחר יותר של שינויים בהרכב מדיה.
4. הקציר, להקפיא ייבוש של ביומסה Microalgal
- למדוד את נפח קבוע של אצות התרבות של כל ביוריאקטור עם משורה (למשל, 160 מ ל מ מגיב ביולוגי זה 200 מ ל במקור הכיל בינוני), להעביר לתוך צנטריפוגה בקבוקים. יש לשטוף את משורה עם dH2O בין כל אחת מהמידות.
- צנטריפוגה ב 4,696 x g עבור 5 דק. למחוק את תגובת שיקוע על ידי בקפידה לשאוב אותה החוצה.
- להעביר את החבילות צינורות שכותרתו 50 מ. יש לשטוף את צנטריפוגה בקבוקים עם dH2O, ואת העברת התוכן כדי הצינורות 50 מ. ודא שעוצמת הצינור הכולל אינו עולה על 45 מ.
- לשטוף את כדורי אצות עם dH2O להסיר את מלחי.
- Centrifuge צינורות 50 מ ל- g x 4,696 עבור 5 דקות וזורקים את תגובת שיקוע.
- להוסיף 40 מ ל dH2O כל שפופרת 50 מ; מערבולת לערבב. תגובת שיקוע צנטריפוגה שוב ב- g x 4,696 עבור 5 דקות וזורקים.
- חזור על שלב 4.4.2 שוב.
- תווית ולשקול ריק 15 מ"ל צנטריפוגה צינורות על איזון 4 מקומות אחרי הנקודה העשרונית (תווית של המכסה וגם צינור, לשקול אותם יחד). שוקלים שפופרת אחת לכל התרבות אצות. שוקלים כל שפופרת 15 מ"ל פעמיים כדי למזער את השגיאה.
- לאחר השטיפה האחרונה למחוק את תגובת שיקוע, ולהוסיף 7.5 mL של dH2O כל שפופרת 50 מ. מערבולת והעברה אצות slurries לתוך mL 15 מראש שנשקל צינורות. לשטוף את הצינורות 50 מ ב- dH נוספים2O ולהעביר נוזל צינורות 15 מ"ל. הימנע העולה על 12 מ של הנפח הכולל את החצוצרות שלה 15 מ"ל.
- Centrifuge צינורות 15 מ"ל ב g x 4,696 במשך 5 דקות, decant את תגובת שיקוע. להקפיא את הצינורות עם כדורי ב-80 מעלות צלזיוס במשך לפחות 30 דקות כהכנה ליופיליזציה.
- להקפיא יבש למשך הלילה או עד מיובשים.
- שוקל ולהקליט את צינורות 15 מ"ל להקפיא מיובש עם אצות.
5. השומנים חילוץ באמצעות שיטה שונה Folch בגודל24
- שוקלים לצאת 20 מ ג של ביומסה אצה הליחה לתוך 2 mL פקקי בורג צינור פוליפרופילן (הסימון תווית היצרן כדי להבטיח מוצר מתאים עקירות חרוז).
- להוסיף 1.5 מ של הממס Folch (2:1. כלורופורם/מתנול) כל שפופרת 2 מ"ל (המכיל 20 מ ג של הליחה אצות). שופכים ~0.5 mL חרוזי קריסטל/סיליקה (0.5 מ"מ) לתוך כל שפופרת עד רמת הנוזל בצינור מגיע 2 מ"ל.
התראה: להתמודד עם הכלורופורם מתנול בשכונה fume להימנע נושם את האדים או עור קשר. - Homogenize הדגימות אצות טחנת חרוז 20 s במהירות של 6.5 צינורות העברה m/s לקרח ל 30 s כדי להירגע דגימות. חזור עוד חמש פעמים לחלץ באופן מלא שומנים.
- לסנן את homogenate באמצעות מזרק 5 מ ל המכיל דיסק רשת שינוי של תיל מפלדת (#60 mesh) לאמץ את החרוזים, אוסף פילטרט של צינור 15 מ"ל.
- לשטוף את החרוזים עם 1.5 מ של הממס Folch, רבואסורקל נוזל עם המזרק לפי הצורך. חזור על זה לשטוף פעמיים נוספות ולאסוף את כל פילטרט של צינור 15 מ"ל, מניב נפח סופי של 6 מ.
- הוסף 1.2 מ של 0.9% (w/v) פתרון NaCl תמצית Folch בצינור 15 מ"ל ו מערבולת לערבב היטב.
הערה: אם יש צורך, יותר Folch ממס ניתן לרחוץ חרוזים (שימוש 0.2 x נפח שטיפת הכולל של 0.9% NaCl פתרון לזירוז שלב ההפרדה). - Centrifuge צינורות 15 מ"ל ב g 6,000 x עבור 5 דק רשומה האחסון (ירוק) שלב כלורופורם התחתון הקרוב ביותר מ 0.1 ל באמצעות קווים בצד הצינור 15 מ"ל. להעביר את שלב תחתון בקבוקון זכוכית (עם המכסה) באמצעות כוס פסטר פיפטה.
- אחסן את השומנים ב-20 ° C או (-80 ° C אם קיימות תוכניות לשימוש זו תמצית ניתוח חומצת שומן).
6. נייטרלי השומנים Assay באמצעות שיטת Microplate (משנת היגינס. et al. 201422)
- להכין מלאי פתרונות. הכינו 10 מ ל 1 מ"ג/מ"ל שמן צמחי רגיל ב כלורופורם ולאחסן ב-20 ° C.
הערה: שמן צמחי כלשהו עשוי לשמש assay הזה כי זה לא רגיש סוגים של חומצות שומן. הכינו 10 מ"ל של 200 µg/mL פתרון הנילוס אדום דימתיל סולפוקסיד (דימתיל סולפוקסיד) ולאחסן בחושך בטמפרטורת החדר. - מחממים מראש בלוק microplate יבש עד 55 מעלות צלזיוס בשכונה fume. בזמן זה הוא חימום, לדלל את השומנים תמציות ואת שמן צמחי רגיל מקופלים ל- 3 עם מתנול.
הערה: דילול זה יכולים להשתנות בהתאם לתוכן השומנים של האצות, אבל רמה זו פועלת היטב עבור רוב כלורלה. - עבור כל דגימה מדולל, להוסיף 80 µL microplate טוב פוליפרופילן 96 ב ארבע פעמים.
אזהרה: השימוש plasticware פוליסטירן לא מומלץ לשימוש עם ממיסים אורגניים. - לחומר ריק, החל µL 80 של 2:1. מתנול/כלורופורם ב ארבע פעמים. תקנים, להוסיף 10, 30, 60, 90, 120 µL של שמן ירקות מדולל כסטנדרט ארבע פעמים.
- מקום microplate של תנור בלוק יבש ב 55 מעלות צלזיוס למשך 20-30 דקות עד הממס כל התאדו. בעוד הממס מתאדה, להכין את העבודה הנילוס אדום פתרון (הצורך 200 µL של 1 µg/ml פתרון לכל צלחת טוב). לדוגמה, סט מלא של סטנדרטים ודוגמאות 12 דורש מ 16 ל 1.0 µg/mL פתרון; להכין על ידי המסת µL 80 של המניה µg 200/mL (ב דימתיל סולפוקסיד) לתוך 16 מ ל dH2O.
- להסיר את microplate מהגוש חימום ומצננים לטמפרטורת החדר. להוסיף 30 µL של אלכוהול איזופרופיל מכל קידוח ומערבבים על ידי pipetting למעלה ולמטה. ודא כל הערוצים פיפטה ערבוב הפתרון resuspending של שומנים, מניב נוזל ירוק הומוגנית.
- להוסיף 200 µL של הנילוס אדום פתרון (1 µg/mL) כל טוב, פיפטה למעלה/למטה 10 פעמים כדי לערבב. דגירה את הצלחת. בשביל 5 דקות בטמפרטורת החדר. תוך כדי המתנה, להכין פתרון 50% אקונומיקה על ידי ערבוב אקונומיקה (6% תת-כלורי) עם dH220 או µL בכל טוב יש צורך. הכנת 3 מ"ל של אקונומיקה 50% מספיקה עבור סט מלא של סטנדרטים ודוגמאות 12.
- להוסיף 20 µL של פתרון אקונומיקה microplate בכל טוב, פיפטה לאורך 5 פעמים כדי לערבב היטב. דגירה 30 דקות בטמפרטורת החדר.
- לאחר 30 דקות, לקרוא פלורסצנטיות הדגימות בכל 5-10 דקות-530 ננומטר עירור/575 nm פליטה עם הפסקת אוטומטי מוגדר כ- 570 ננומטר עד האות מדגימות אצות מייצבת. בדרך כלל, 60 דקות של דגירה הכולל מספיקה.
- ליצור עקומת כיול בסטנדרטים שמן צמחי (בטווח של 0-40 ng באר/נפט).
הערה: פונקציה קווית להתאים זו פועלת היטב עבור נמוך (< 30 ננוגרם/טוב) שמן ריכוזים של פולינום מתאים עשוי לשמש אם הסטנדרט עולה 30 ננוגרם/טוב. השתמש המתאם הזה כדי לכמת את השומנים נייטרלי ב הבארות הדגימה.
תוצאות
הליך זה מניב קורס זמן של נתוני צפיפות אופטית אצה-OD 550 ננומטר (איור 4A). צפיפות אופטית ואת משקל יבש ריכוז נתונים יכול להיות בקורלציה (איור 4B). זו מושגת על-ידי הראשונה חישוב ריכוז האצות משקל יבש הסופי לאחר השלב להקפיא ייבוש. בשלב הבא, הצפיפות האו?...
Discussion
השיקול החשוב ביותר כאשר culturing אצות היא הבנה של צרכים הספציפיים של אורגניזם או קבוצה של אורגניזמים. האצות שיטת הטיפוח המתוארים כאן יכול לשמש כדי תרבות מגוון רחב של אצות אבל הגורמים והאביוטיים ספציפי (טמפרטורה, מדיה, pH, עוצמת האור, רמה2 CO, לערבב קצב) צריכים להיות מותאמים לצרכים של האורגנ?...
Disclosures
המחברים אין לחשוף.
Acknowledgements
תמיכה עבור מחקר זה סופק על ידי משרד החקלאות הלאומית המכון של המזון, החקלאות פתח פרוייקט ALA0HIGGINS משרדי אוניברסיטת אובורן של פרווסט סגן הנשיא למחקר, את סמואל גין להנדסה. גם העניקה תמיכה NSF להעניק CBET-1438211.
Materials
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
References
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved