Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Выращивание зеленых микроводорослей в фотобиореакторах колонки пузыря и Assay для нейтральные липиды
В этой статье
Резюме
Здесь мы представляем протокол для создания лаборатории шкала пузырь столбец фотобиореакторах и использовать их для микроводорослей культуры. Он также предоставляет метод для определения темпов роста культуры и содержание нейтральных липидов.
Аннотация
Существует значительный интерес к изучению микроводорослей для инженерных приложений, таких как производство биотоплива, высокой стоимости продуктов и для обработки отходов. Как большинство новых разработок начинаются в лабораторном масштабе, существует необходимость для экономически эффективных методов для культивирования микроводорослей в духе воспроизводимость. Здесь мы общаемся эффективный подход к культуре микроводорослей в лабораторных фотобиореакторах и для измерения роста и липидный нейтральными содержание этой водоросли. Инструкции по настройке системы photobioreactor также включены. Хотя пример организмы являются видов хлореллы и Auxenochlorella, эта система может быть адаптирована к развивать широкий спектр микроводорослей, включая совместное культуры водорослей с не водоросли видов. Сначала фонда культуры выращиваются в бутылки производить посевным материалом для photobioreactor системы. Водоросли посевным материалом сконцентрированы и переданы фотобиореакторах для выращивания в пакетном режиме. Образцы собираются ежедневно для оптической плотности чтений. В конце пакетной культуры клетки собирают на центрифуге, промывают и лиофилизированный для получения окончательного сухого веса концентрации. Концентрация окончательный сухого веса используется для создания корреляции между оптической плотности и концентрации сухого веса. Модифицированный метод Folch впоследствии используется для извлечения общих липидов из лиофилизированной биомассы и экстракт assayed его нейтральной липидов содержимого с помощью Гонав пробирного. Этот assay были опубликованы ранее, но протокол шаги были включены здесь, чтобы выделить важнейшие шаги в процедуре, где часто возникают ошибки. Биореактор системы, описанные здесь заполняет нишу между простой настой выращивания и полностью контролируемые коммерческих биореакторов. Даже с только 3-4 биологического реплицирует за лечение, наш подход к культивирования водорослей приводит к жесткой стандартных отклонений в рост и липидного анализы.
Введение
Приложение микроводорослей в инженерии и биотехнологии привлекла большой интерес в последние годы. В настоящее время изучаются микроводорослей для использования в сточных вод лечения1,2,3,4, биотоплива производство5,6,7,8и производство пищевых добавок и других дорогостоящих продуктов9,10. Водоросли также генетически изменяются большей скоростью в целях повышения их пригодности для конкретных инженерных приложений11,12. Следовательно существует большой интерес к экспериментам с промышленно соответствующих организмов в контролируемых параметров. Цель этого метода является общаться эффективный подход к культуре микроводорослей в контролируемой лабораторной среде, а также для измерения роста и липидный нейтральными содержание этой водоросли. Улучшение роста ставок и содержание липидов нейтральных микроводорослей были определены как два основных узких мест к коммерциализации водорослей биотоплива13.
Широкий спектр подходов были использованы для культуры водорослей для экспериментальных целей. В общем эти подходы можно разделить между крупномасштабных выращивания и мелких Крытый культивирования. Выращивания в фотобиореакторах и открытых прудах подходит для экспериментов, направленных на расширение масштабов процессов, которые уже доказали в лабораторном масштабе (например, для проверки масштабов нового штамма высокой липидов водорослей)14. Однако крытый культивирования небольших уместно, при разработке новых или усовершенствованных водорослей штаммов или проведения экспериментов, направленных на понимание биологических механизмов. В этих последних случаях высокая степень экспериментальных управления требуется дразнить из тонкие изменения в биологических поведение. С этой целью стерильных культурах часто требуется для того, чтобы свести к минимуму комплекс биотические факторы, связанные с другими организмами (например бактерии, другие водоросли), которые неизбежно расти в крупномасштабных наружных систем. Даже при изучении взаимодействия среди водорослей и других организмов, мы обнаружили, что использование высоко контролируемых экспериментальных условиях полезно при изучении молекулярной обмен среди организмов15,16,17.
В рамках категории мелких водорослей Крытый культивирования был использован целый ряд подходов. Вероятно наиболее распространенным подходом является для выращивания водорослей в колбах Эрленмейер шейкер таблицы под легкие банка18,19. Путем пассивной диффузии через пены вилка в верхней части колбы происходит обмен кислорода и CO2 . Некоторые исследователи улучшили эту структуру путем активного вентилирования флаконы20. Другой подход заключается в том, чтобы культивировать водоросли в бутылки, смешанные перемешать бар и активного вентилирования. Несмотря на их простоту мы обнаружили, что использование настоев и бутылки часто приводит к непоследовательным результатам среди биологических реплицирует. Предположительно это из-за позиции эффекты - разные позиции получать различное количество света, которые также влияют на температуру внутренних реактора. Ежедневные вращения реакторов для новых позиций может помочь, но не облегчить проблемы, потому что некоторые этапы роста водорослей (например, рано экспоненциальное) более чувствительны к позиционной эффектов, чем другие (например, журнал фаза).
На противоположной стороне спектра технологической сложности являются полностью контролируемой коммерческих фотобиореакторах. Эти системы постоянно контролировать и корректировать условия в реакторе для оптимизации роста водорослей. Они имеют программируемые освещение, контроль в реальном времени температуры и контроля рН. К сожалению они являются дорогостоящими и обычно стоит несколько тысяч долларов в реактор. Большинство научных и технических журналов требуют биологических репликации результатов, требуя покупки нескольких биореакторов. Мы представляем здесь системы Реактор колонки пузыря, мосты разрыв между простой (колба) и сложные (полностью контролируемой биореакторе) подходит для выращивания водорослей лаборатории масштаба. Колонны пузырьковые использовать рост пузырьки газа для облегчения газообмена и смешивать реактора. Этот подход предоставляет некоторую степень контроля над освещением и температуры, но делает это в экономически эффективным способом. Кроме того мы нашли эту систему весьма последовательной результаты среди биологических реплицирует, сократить необходимое количество биологических реплицирует, необходимые для того, чтобы получить статистически значимые результаты, когда по сравнению с подходом колбу или бутылку. Мы также использовали эту систему успешно культивировать смеси водорослей и бактерий21. Помимо выращивания водорослей мы наметим процедура измерения содержания нейтральных липидов в культивированный водорослей. Последний метод был опубликован других22, но мы включают процедуры здесь предоставлять пошаговые инструкции о том, как успешно использовать его.
протокол
1. Установка столбца фотобиореакторах пузырь
- Постройте набор вентилируемые крышки от пластиковые крышки, которые пришли с стеклянные бутылки 1 Л и гибридизации трубки (см. Рисунок 1 для схемы и фотографии). Конструкция крышки для увлажнителя, смешивая ловушки, каждый photobioreactor подъем воздуха и каждая бутылка реактора.
- ¼" отверстия в крышке: 2 отверстия необходимы для биореактора и увлажнитель крышки; 3 отверстия необходимо для смешивания ловушку.
- Скольжения ¼" кольцо через потоки 1/8" группа горе Луер примерки и вставьте это в ¼" отверстие в крышке (рис. 1A).
- Скольжения второй ¼" кольцо через потоки так, чтобы крышка зажата между двумя O-кольца. Скольжения контргайку на резьбу и затяните исправить Luer горе группа на месте.
- Защелкните стопорных колец на подвергаются мужчины Luer выходящий из крышки. Повторите шаги 1.1.2-1.1.4 для каждого отверстия в крышке.
- Для крышки, которые будут использоваться на пузырь столбец и бутылка реакторов, подключением 1/8" женский Luer Барб арматуры до 1,5" кусочки 1/8" ID ПВХ труб. Подключите их к каждому из подвергаются мужчины Luer фитинги на крышке.
- Подключение к свободный конец одной из 1/8" обратный клапан (указывая от крышки) штук.
Примечание: Это будет служить в качестве выхлопной порт для биореактора. - Подключите мужской Luer Барб, уместно второй кусок 1/8" НКТ, выходящий из крышки. Щелкните вращающейся стопорное кольцо на место и закрепите 0,2 мм воздушный фильтр к этому.
Примечание: Это будет служить в качестве впускное отверстие для реактора.

Рисунок 1. Схема и фото для построения биореакторов. Схема (A) для строительства биореактор крышки (B) Фото крышки собрал биореактора и (C) Фото собраны крышки для увлажнителя. Обратите внимание, что увлажнитель фитинги следует покрытием в воды доказательство силиконовая обеспечить герметичное уплотнение с крышкой. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Соберите систему доставки воздуха (см. рисунок 2A и 2B схема и фото).
- Резьба NPT 1/8" приложите Барб фитинги для впуски и выпуски на задней части каждого ротаметрами.
Примечание: 200-2500 см3/мин Расходомеры электронные для модуляции давления воздуха вверх по течению увлажнитель, Расходомеры электронные 100-1000 см3мин., бутылка реакторов, 50-500 см3/мин Расходомеры электронные предназначены для воздушных подъема биореакторов и 5-50 см3/ мин rotemeters предназначены для регулирования потока CO2 . Рекомендуется к горе Расходомеры электронные к фиксированной поверхности (например пластиковый лист) так они не упасть во время операции. - Выключите источник сжатого воздуха, а затем подключите ¼" ID гибкие ПВХ трубы к источнику сжатого воздуха с зажим шланга. Шаг вниз диаметр шланга 1/8" гибкие шланги ПВХ ID с помощью ¼" женский Барб фитинга и 1/8" мужской Барб фитинга.
- Подсоедините свободный конец трубки ID 1/8" входу ротаметр мин.3200-2500 см.
Примечание: На выходе из этого ротаметр будет кормить увлажнитель бутылки через 1/8" ID трубы. - Соедините трубы на входе вентилируемые крышку (использование женского Luer для Барб, уместно, чтобы сделать связь) 1/8». Затем подключите второй кусок 1/8" трубы внутри панель установки.
Примечание: Эта часть будет висеть вниз в увлажнитель и пузырь воздуха через воду. - Присоединение 1/8" женский Luer Барб арматуры на каждом конце кусок 1/8" ID трубы и использовать этот кусок для подключения на выходе из увлажнителя на входе смешивания ловушку.
- Таким же образом как 1.2.5 Подключите выход регулятора CO2 на второй порт смешивания ловушку.
- Строительство коллектора, используя 1/8" труб и 1/8" многопортовые Барб (см. рис. 2 C) для подачи воздуха в банки ротаметрами.
Примечание: Эти Расходомеры электронные будет использоваться для питания биореакторов. Избегайте создания более чем 6 Расходомеры электронные серии. Вместо этого используйте параллельные банки Расходомеры электронные для расширения системы. Убедитесь, что общий поток спроса на всех реакторов менее 2500 см3/мин (или иначе потребуются большие ротаметр вверх по течению от увлажнителя). - Подключение розетки (3rd порт) смешивания ловушки к недавно построенный ротаметр банки, используя 1/8" трубки и 1/8" женский Барб Luer.
- Подключение труб к розеткам каждого ротаметр в банке ротаметр для подачи воздуха в биореакторах достаточно длинный 1/8". Ярлык концы труб, а также Расходомеры электронные в банке.
- Применение воды доказательство силиконовая вокруг все порты на увлажнитель и смешивания ловушку крышками, чтобы убедиться, что они являются герметичность.
- Резьба NPT 1/8" приложите Барб фитинги для впуски и выпуски на задней части каждого ротаметрами.
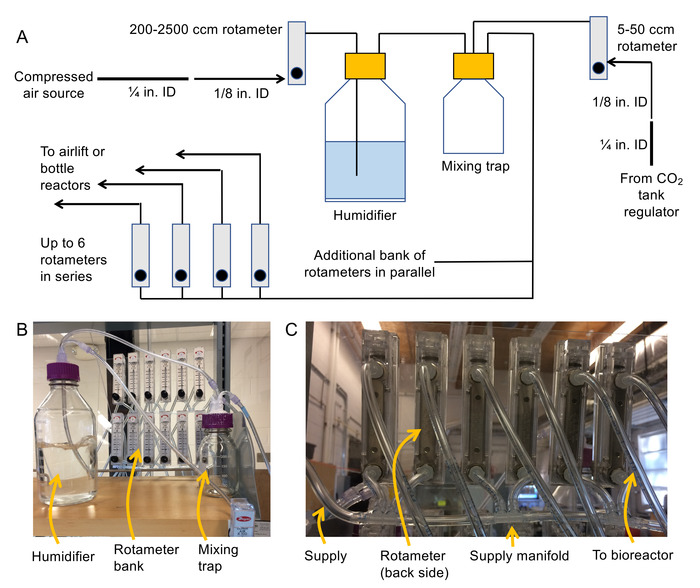
Рисунок 2. Схема и фото для монтажа системы колонки пузыря. (A) схема аэрации системы (B) Фото увлажнитель, смешивая ловушку и ротаметр банка и (C) Фото многообразий, используется для подключения ротаметр банки вместе. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
- Настройка баки рыб, движение плиты и огни (рис. 3).
Предупреждение: Эта система требует большое количество торговых точек и цепи, достаточный для поддержки всех компонентов. Избегайте, нанизывая вместе несколько разветвителей питания и удлинителей в цепочке моды, потому что это электрическим током. GFI тип розетки и удлинители поощряется использование высоко из-за наличия воды в системе.- Организовать низкопрофильные магнитные мешалки на ровной поверхности, достаточно прочной, чтобы выдержать вес водой рыбы цистерны.
- Место небольшие деревянные или пластиковые блоками (немного выше, чем движение плиты) по периметру перемешать пластин для поддержки веса рыбы цистерны.
Предостережение: Избегайте рыбы цистерны непосредственно на движение плиты как вес будет раздавить их. - Место рыбы цистерны над перемешать пластины и поддержка блоков и заполнить цистерны с водой.
- Отрежьте кусок жесткой пластиковый лист надеть поверх бак рыб как крышкой. Вырежьте отверстия в этой оболочке скользить гибридизации трубы внутри и вне. Также вырежьте отверстие нагревательного бака рыб.
- Организовать флуоресцентный свет банки рядом с бак рыб для горизонтального освещения биореакторов. Подключите света банк света таймера, чтобы установить дневной/ночной цикл.

Рисунок 3. Система схема для бутылки биореакторов (слева) и пузырь столбца фотобиореакторах (справа). Эта цифра была изменена от Хиггинс и др. 17. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
2. Подготовка микроводорослей посевным материалом
- Получите микроводорослей посевным материалом от крио сохранились, хромированный или жидкие культуры.
Примечание: Рекомендуется, что до использования в качестве посевным материалом, чтобы обеспечить жизнеспособные клетки и что в результате культура является стерильных покрываемые криоконсервированных организмов. Агар среднего (например., ATCC #5 спорообразующих агар)21 является богатой средой, которая работает хорошо для оживления видов хлореллы и Auxenochlorella от крио хранения. - Подготовьте 2.4 L минеральные среды, которая подходит для видов конкретной микроводорослей.
Примечание: Примеры включают N8 средних23 видов хлорелла, N8-NH4 средних21 видов Auxenochlorella. Использование средства, подходящие для водорослей штамм является одним из наиболее важных шагов в обеспечении надежной водорослей. - Аликвота 2.4 L минеральные среды одинаково в три стеклянные бутылки 1 Л, добавить движение баров на каждой бутылке и собрать вентилируемые крышки (рис. 1) для каждой бутылки. Дважды проверьте, что трубка аэрации на входе и каждая бутылка имеет бар переполох в нем.
- Автоклав фондовых бутылки, с использованием жидкого стерилизации цикла (121 ° C) для 30 мин автоклава 100 мл деонизированной воды (dH2O) и некоторые 1,5 мл пробирок в то же время, который позднее будет использоваться для покрытия. Разрешить средне прохладной ночи. Кроме того охладить реактор до комнатной температуры и затем проветрить за 2 ч до прививки.
- В области биобезопасности кабинета (BSC) прививать микроводорослей из плиты или стерильных жидких культуры в складе бутылки. Используйте метод стерильных стерильных культурах в следующих шагах.
- Добавьте 20 мл газобетона dH2O в стерильных 50 мл пластиковых пробирок. Используйте Стерильные одноразовые цикл 10 мкл подобрать несколько одного колоний от пластины из шага 2.1. Окунуть цикла в 50 мл трубки и вымыть клетки водорослей в 20 мл газобетона dH2O. Встряхните Тюбик 50 мл для получения однородной микроводорослей решения.
- Пипетка 6 мл раствора микроводорослей в каждой акции бутылку с 10 мл стерильной Серологические Пипетки. Вихрем бутылка равномерно смешать микроводорослей в среду.
- Используйте 2 мл стерильного Серологические Пипетки рисовать 1 мл пробы из каждой акции бутылку и передачи в стерильных 1.5 мл пробирок.
Примечание: Micropipettes не рекомендуются для этот шаг из-за риска заражения. Затяните вентилируемые крышки на складе бутылки. - Место фондовых бутылки на движение плиты (~ 150 об/мин) и отрегулировать скорость потока воздуха, CO2и уровня освещения в зависимости от вида. Вращение штока бутылка позиции каждый день.
- Разбавьте 1 мл образцов, полученных во время шага 2.6 (100-кратного разбавления в стерильной воде обычно хорошо работает) и распространение пластину на богатые агар среднего.
Примечание: Эти таблички может использоваться для проверки случаев загрязнения также служить в качестве источника будущего водорослей посевным материалом для дальнейших экспериментов. - Брать пробы из бутылок (в BSC) каждые два дня для проверки роста водорослей.
Поместите образцы в 96-луночных микропланшетов в трех экземплярах (200 мкл) и измерения оптической плотности (OD) 550 Нм и 680 нм каждые два дня до од достигает 0,2-0,3 (который обычно требует 5-7 дней). - Остановить инкубации и место фондовых бутылки на скамейке за 24-48 ч до позволить клеток водорослей селиться под действием силы тяжести.
Примечание: Поселились клетки будут далее использоваться для инокуляции фотобиореакторах колонки пузыря. Если более быстрый сбор клетки, клетки могут центрифугируется на не более чем 1000 x g для сбора клеток.
3. Выращивание микроводорослей в фотобиореакторах колонки пузыря
- За день до прививки биореактора, подготовить соответствующие средства массовой информации и передачи 200 мл (или желаемый объем) для столбца photobioreactor пузырь трубки (гибридизации трубки). Автоклавные трубки с средствами массовой информации и вентилируемые крышки на месте.
Примечание: Если использование сточных вод в качестве среднего роста, автоклав пустой биореакторов и добавить стерильной фильтрации сточных вод (по желанию стерильных культуры). - Концентрат фондовой поселились микроводорослей, удалив супернатанта, с помощью вакуумного насоса. Оставляют меньше чем 100 мл среды в каждой бутылке, но избежать удаления поселились водоросли.
Примечание: Проведение этой процедуры внутри BSC и следовать стерилизации. Простой Вакуумный аппарат может быть построено с помощью термос или бутылку. Вставьте стерильную серологические пипетки на конце трубы. - Приостановить и передаче суспензии водорослей стерильные 50 мл пробирок. Центрифуга на 1000 x g 5 минут, чтобы еще больше сконцентрировать водорослей.
- В BSC удалите достаточно супернатант для достижения общего объема ~ 80 мл водорослей концентратов для 12 photobioreacters. Избегайте пылесосить, гранулы. Передать водорослей концентрат стерильный контейнер (или складе бутылка используется водорослей).
- Добавьте 6 мл суспензии водорослей в каждой photobioreactor с 10 мл стерильной Серологические Пипетки.
- Стерильные фильтр (0,2 мм шприц или вакуум фильтр) и добавить соответствующие суммы любых других соединений (например , запасы витамина) которые не могут быть газобетона.
- Вихрем биореакторов смешивать водорослей в среду.
- Нарисуйте образец 2 мл от каждого биореакторе с использованием Серологические Пипетки и передачи в 2-мл пробирку. Соберите образец 2 мл (в BSC) каждые 24 ч для мониторинга прогресса культуры. Проверьте образец для с помощью рН тест-полоски и отрегулировать реактора, при необходимости с 3 M NaOH или 3 М HCl.
- Завинтите крышки биореактора и поместите все биореакторов в ванну водой бак рыб. Отрегулируйте аэрации, CO2и освещение на соответствующий уровень для видов. Вращайте биореактор позицию каждый день после взятия проб (шаг 3,8).
- Применить 200 мкл пример каждой культуры в трех экземплярах для скважин 96 хорошо микроплиты. Измерение оптической плотности (OD) 550 Нм и 680 нм.
- В последний день периода культуры Измерьте ОД под разрежения различных факторов (например, 1 x, 2 x, 4 x, 8 x, 16 x и 32 x) установить взаимосвязь между ОП и фактической сухого веса после сбора урожая (шаг 4).
- Центрифуга 2-мл пробирку образца на 12000 g x 5 мин.
- Фильтра супернатант через 0,2 мкм фильтром нестерильных шприцев и хранить супернатант (и Пелле, если это необходимо) не выше-20 ° C для длительного хранения и позднее анализ изменений в составе средств массовой информации.
4. урожай и сублимационной сушки биомассы микроводорослей
- Измерить фиксированный объем культуры водорослей от каждого биореактор с мензурку (например, 160 мл от биореактор что первоначально содержится 200 мл среды) и передачи в центрифуге бутылки. Промойте мерного цилиндра с dH2O между каждым измерением.
- Центрифуги на 4,696 x g 5 мин отбросить супернатант пылесосом тщательно его вне.
- Передать брикеты метками 50 мл трубки. Промойте центрифуги бутылки с dH2O и передачи содержимого 50 мл трубки. Убедитесь, что объем всего трубки не превышает 45 мл.
- Вымойте водорослей окатышей с dH2O для удаления солей.
- Центрифуга 50 мл трубки на 4,696 g x 5 минут и удалить супернатант.
- Добавьте 40 мл dH2O каждый Тюбик 50 мл; Вихрь смешивать. Центрифуга снова на 4,696 g x 5 минут и удалить супернатант.
- Повторите шаг 4.4.2.
- Этикетки и весить пустой 15 мл пробирок на баланс 4-десятичное (этикетке трубки и крышкой и взвесить их вместе). Весят одна трубка культуры водорослей. Вес каждого 15 мл дважды, чтобы свести к минимуму ошибки.
- После последнего вымыть удалить супернатант и добавить 7,5 мл dH2O каждый Тюбик 50 мл. Вихрь и передачи суспензии водорослей в предварительно весил 15 мл пробирок. Промойте трубы 50 мл с дополнительным dH2O и переноса жидкости для 15 мл пробирок. Избегайте, превышающих 12 мл общего объема в 15 мл пробирок.
- Центрифуга для 15 мл пробирок на 4,696 g x 5 мин и сцеживаться супернатант. Замораживание труб с окатышей на-80 ° C для по крайней мере 30 минут в рамках подготовки для.
- Замораживание сухой на ночь, или пока не сушат.
- Весят и записывать лиофилизированный 15 мл пробирок с водорослями.
5. липидов извлечение с помощью метода изменения Folch24
- Весят из 20 мг лиофилизированных водорослей биомассы в 2 мл колпачок полипропиленовые трубы (проверка производителя метка чтобы убедиться, что продукт подходит для экстракции шарик).
- Добавьте 1,5 мл растворителя Folch (2:1 хлороформ/метанола) в каждой 2-мл пробирку (который содержит 20 мг лиофилизированных водорослей). Наливайте ~0.5 мл цирконий/кремнезема бусины (0.5 мм) в каждую пробирку, до тех пор, пока уровень жидкости в трубе достигает 2 мл.
Предупреждение: Обрабатывают хлороформом и метанола в зонта и избегать вдыхания паров или контакт с кожей. - Однородный образцы водорослей в бисерная мельница для 20 s со скоростью 6,5 м/с. Передача трубок для льда для 30 s для охлаждения образцов. Повторите пять раз для полного извлечения липидов.
- Через шприц 5 мл, содержащего диск сетки проволока из нержавеющей стали (#60 меш) штамма из бисера, сбора фильтрата в 15 мл фильтр огневки.
- Вымойте бусины с 1,5 мл растворителя Folch, проталкивая жидкость с шприц при необходимости. Повторите это мыть два раза и собирать все фильтрата в 15 мл трубки, уступая окончательный объем примерно 6 мл.
- Добавьте 1,2 мл 0,9% раствора NaCl Folch экстракт в 15 мл (w/v) и вихревой хорошо перемешайте.
Примечание: При необходимости, более Folch растворителя может использоваться для мытья бусины (использование 0,2 x объем всего мыть 0,9% раствор NaCl побудить разделение фаз). - Центрифуга для 15 мл пробирок на 6000 x g для 5 минут записи нижней хлороформ (зеленый) фаза тома ближайших 0,1 мл, с использованием линий на стороне 15 мл. Передача этапа снизу к стеклянный флакон (с крышкой) с помощью стеклянной пипетки Пастера.
- Храните липидов при-20 ° C или (-80 ° C, если планируется использовать этот экстракт для анализа жирных кислот).
6. нейтральная Assay липидов с помощью метода Гонав (адаптировано из Хиггинс et al. 201422)
- Подготовка запасов решений. Подготовка 10 мл 1 мг/мл растительного масла стандарта в хлороформе и хранить при температуре от-20 ° C.
Примечание: Любое растительное масло может использоваться в этот assay, потому что он не чувствителен к типам жирных кислот. Подготовка 10 мл 200 мкг/мл раствора красный Нила в диметилсульфоксида (ДМСО) и хранить в темноте при комнатной температуре. - Блок предварительного подогрева сухого Гонав до 55 ° C в зонта. Хотя это Отопление, разбавить экстракты липидов и растительное масло стандартные 3 раза с метанолом.
Примечание: Этот разрежения могут быть изменены на основании содержания липидов морских водорослей, но этот уровень хорошо работает для большинства хлореллы. - Для каждого образца, разбавленным добавьте 80 мкл 96 хорошо полипропиленовые Гонав в составленном.
Предупреждение: Использование вспененный пластик не рекомендуется для использования с органическими растворителями. - Для пустых растворителя применяются 80 мкл 2:1 метанол/метилхлороформа в составленном. Для стандартов добавьте 10, 30, 60, 90 и 120 мкл разбавленного растительного масла в составленном.
- Место микроплиты в сухой блок отопителя при 55 ° C для 20-30 мин, пока испарится весь растворитель. В то время как растворитель испаряется, подготовить рабочие Нила Красного раствора (необходимо 200 мкл 1 мкг/мл раствора на пластины хорошо). В качестве примера двенадцать образцов и полный набор стандартов требует 16 мл раствора 1,0 мкг/мл; Подготовка путем растворения 80 мкл акций 200 мкг/мл (в ДМСО) в 16 мл dH2O.
- Удалите микроплиты из блока Отопление и Остудите до комнатной температуры. 30 мкл изопропиловый спирт для каждой скважины и смешивать, закупорить вверх и вниз. Обеспечить все каналы пипеткой перемешивания раствора и resuspending липиды, уступая однородная зеленая жидкость.
- Добавьте 200 мкл Нила красный раствора (1 мкг/мл) в каждый хорошо, Пипетка, вверх/вниз 10 раз перемешать. Инкубируйте пластину для 5 мин при комнатной температуре. Во время ожидания, подготовьте раствор отбеливателя 50%, смешивая отбеливатель (6% гипохлорита) с dH2O. 20 мкл за также необходимы. Подготовка 3 мл 50% отбеливателя является достаточным для 12 образцов и полный набор стандартов.
- Добавить 20 мкл раствор отбеливателя для каждого Гонав хорошо и Пипетка вверх и вниз 5 раз, чтобы перемешать. Инкубируйте 30 мин при комнатной температуре.
- После 30 мин, читать флуоресценции в образцах каждые 5-10 мин на 530 Нм возбуждения/575 Нм выбросов с автоматической отсечки равным 570 Нм до тех пор, пока сигнал от водорослей образцов стабилизируется. Как правило 60 мин всего инкубаторов является достаточным.
- Создайте Калибровочная кривая для стандартов растительного масла (в диапазоне от 0-40 нг/скважины).
Примечание: Линейный подходят хорошо работает для низкого (< 30 нг/хорошо) концентрации нефти и полином подходят может использоваться, если стандартом превышает 30 нг/хорошо. Используйте этот корреляции для количественного определения нейтральных липидов в скважинах образца.
Результаты
Эта процедура дает время курса водорослевого оптической плотности данных од 550 Нм (рис. 4A). Оптической плотности и сухой вес концентрации, данные могут быть связаны (рис. 4В). Это достигается путем первого расчета концентрации водорослей ?...
Обсуждение
Самым важным соображением при культивировании водорослей является понимание конкретных потребностей организма или группы организмов. Водоросли выращивания системы, описанные здесь могут быть использованы для культуры широкий спектр водорослей, но конкретные абиотические факторы (?...
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
USDA национального института продовольствия и сельского хозяйства Hatch проекте ALA0HIGGINS и отделениями университета Оберн Провост, вице-президент по исследованиям и Самуэль Ginn инженерного колледжа была оказана поддержка для этого исследования. Поддержка была также оказана NSF Грант CBET-1438211.
Материалы
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
Ссылки
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены