このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
中性脂質のバブル列フォトバイオリアクターとアッセイで緑の微細藻類の栽培
要約
ここでは、ラボスケール バブル列フォトバイオリアクターを構築および微細藻類培養に使用するプロトコルを提案する.文化成長率と中性脂質含量の定量のためのメソッドも提供します。
要約
廃棄物処理、バイオ燃料、高付加価値製品の製造などエンジニア リング アプリケーションのための微細藻類の研究に大きな関心があります。ほとんどの新しい研究努力は、実験室規模で開始、再現可能な方法で微細藻類を培養するためのコスト効果の高い方法の必要性があります。ここでは、我々 は微細藻類培養実験室規模フォトバイオリアクターと成長、その藻の中性脂質含量を測定するための効果的な方法を伝えます。指示は、フォトバイオリアクター システムを設定する方法についても含まれます。例の生物がクロレラとAuxenochlorellaの種、幅広い非藻類種の藻類の共培養を含む微細藻類を育成するこのシステムを合わせることができます。株式文化最初フォトバイオリアクターにおける菌の生成するボトルで栽培しています。藻類は集中し、フォトバイオリアクター バッチ モードでの栽培のために転送。サンプルは光学濃度測定のため毎日収集されます。バッチ文化の終わり、セル洗浄、遠心分離機による収穫、凍結乾燥、最終的な乾燥重量濃度。最終的な乾燥重量濃度を使用して、光学濃度と乾燥重量濃度の間の相関関係を作成します。Folch 法の改良はその後凍結乾燥バイオマスから総脂質を抽出するため、抽出物はマイクロ プレート法を用いた中性脂質内容の検定します。このアッセイは、以前公開されているが、プロトコルの手順は、エラーが頻繁に発生する重要な手順を強調するここに含まれていた。ここで説明したバイオリアクター システムは、単純なフラスコ栽培と商業のバイオリアクターを完全に制御のニッチを埋めます。治療あたり 3-4 生物だけでも複製、藻類を培養へのアプローチは、成長と脂質の試金でタイトな標準偏差に 。
概要
工学とバイオ テクノロジーで微細藻類のアプリケーションは、近年大きな関心を集めています。微細藻類が排水処理1,2,3,4、バイオ燃料生産5,6,7,8で使用するため研究されていると栄養補助食品・その他価値の高い製品9,10の生産。藻類も遺伝的変更される大きい率で特定のエンジニア リング アプリケーションの11,12の健康を改善するために。その結果、制御された設定で工業的に関連する生物の実験には大きな関心があります。このメソッドの目的は、管理された実験室では、文化の微細藻類に効果的なアプローチし成長とその藻の中性脂質含量を測定します。成長の改善率と微細藻類の中性脂質含量は13藻類バイオ燃料の実用化に向けた 2 つのキーのボトルネックとして識別されています。
幅広いアプローチは実験目的のため藻類培養に使用されています。一般に、これらのアプローチは大規模屋外栽培と小規模の屋内栽培の分けることができます。フォトバイオリアクターと開いている池で屋外栽培は実験室規模 (例えば藻類の新種高脂質のスケール アップをテストするため) に既に実績のあるプロセスをスケール アップを目的とした実験に適した14。ただし、屋内の小規模栽培は適切な新規または改善された藻類系統の開発時または生物学的メカニズムを理解することを目的とした実験を行います。これらの後者の場合生物学的態度の微妙な変化を引き出す心理学実験制御の高度が必要です。そのため、無菌共生栽培多くの場合必然的に大規模な屋外における拡張他の生物 (例えば細菌、他の藻類) に関連付けられている複雑な生物的要因を最小限に抑えるために必要があります。藻類や他の生物間の相互作用を学ぶ時でさえ、分子生物15,16,17交流を調べる実験条件の高度制御の使用が役立つことがわかりました。
小規模な屋内藻類栽培のカテゴリ内でのアプローチの範囲が使用されています。おそらく最も一般的なアプローチは、光銀行18,19下シェーカー テーブルの上のエルレンマイヤー フラスコで藻を成長することです。フラスコの上部に泡のプラグインを介して受動拡散によって酸素と CO2の交換が行われる。一部の研究者は、フラスコ20のアクティブな通気によってこの設定を改善しています。攪拌棒とアクティブな通気によって混合ボトルで藻類を育成する方法です。そのシンプルさにもかかわらず、我々 はフラスコやボトルの使用がしばしば生物複製間の一貫性のない結果につながることを発見しました。おそらくこれは位置の影響によるものです - 別の位置を受け取るまた炉内温度に影響を与える光の量が異なる。新しい位置に原子炉の毎日のローテーションは助けることが問題を軽減しないので藻類の成長の特定の段階 (例えば、早期指数) 他 (例えば、ログ フェーズ) よりポジショニング エフェクトにより敏感します。
技術的に洗練されたスペクトルの反対側にある商業のフォトバイオリアクターを完全に制御これらのシステムは継続的に監視し、藻類の成長を最適化するために原子炉で条件を調整します。プログラム可能な照明、リアルタイム温度コントロール、および pH コントロールがあります。残念なことに、彼らは高価であり、通常原子炉あたり数千ドルの費用。最も科学的なおよび工学のジャーナルは複数バイオリアクターの購入を施行した結果の生物学的レプリケーションを必要とします。ここでは提示バブル列原子炉システム シンプル (フラスコ) と高度 (バイオリアクターの完全に制御) 間の格差ラボ スケール藻類栽培へのアプローチその橋。ガス交換を促進し、原子炉をミックスする気泡上昇気泡列を使用します。このアプローチは、照明と温度制御のある程度を提供しますがコスト効率の高い方法で 。さらに、我々 はフラスコやボトルのアプローチと比較して統計的に有意な結果を得るために必要な生物学的複製の必要数を減らすこと生物的複製の間で非常に一貫した結果が得られるこのシステムを発見しました。また正常に藻類と細菌21の混合物を育成するこのシステムを使いました。藻類栽培に加えて培養藻の中性脂質含量を測定するための手順の概要を説明します。後者の方法はされている22、他の場所で公開されたが、我々 は正常にそれを使用する方法の詳細な手順を提供するためにここでプロシージャを含めます。
プロトコル
1. 気泡列フォトバイオリアクターのセットアップ
- 1 リットルのガラス瓶やハイブリダイゼーション チューブ (回路図と写真の図 1を参照) に付属しているプラスチックの蓋から通気孔のある蓋のセットを構築します。加湿器、混合トラップ、各空気リフト フォトバイオリアクターと各ボトル原子炉の蓋を構築します。
- ¼"蓋に穴をあける: バイオリアクターと加湿器の蓋に 2 つ穴が必要混合のトラップの 3 つの穴が必要です。
- スリップ、¼"o リング スレッドに 1/8 インチ パネル マウント ルアー フィットとこれを差し込みます (図 1 a) 蓋にドリル穴 ¼"。
- スリップ、2 ¼"o リング スレッドに、ふたは、2 つの O リングに挟まれた。スレッドにロックナットをスリップし、場所にパネル マウント ルアーを修正するを締めます。
- 蓋から突出する露出男性ルアーにロック リングをスナップします。蓋の各穴の 1.1.2-1.1.4 の手順を繰り返します。
- バブルの列とボトルの原子炉で使用されるふたを添付 1/8"1.5"バーブ継手に女性ルアー 1/8「ID PVC チューブの部分。蓋の上露出男性ルアー継手のそれぞれにこれらを添付します。
- 1/8"の 1 つの自由端に (蓋から指す) チェック バルブを接続部分。
注: これはの排気ポートとなります。 - バーブの 1/8 インチ管の蓋から突出する 2 番目の作品にふさわしい男性のルアーに接続します。所定の位置に回転ロック リングをクリックし、これを 0.2 mm エアー フィルターを固定します。
注: これは、炉の入口となります。

図 1。回路図とバイオリアクターの構築のための写真。(A) 図、バイオリアクターの構築のため蓋の組み立て型バイオリアクターの蓋の (B) 写真と加湿器に使用される組み立てられた蓋の (C) の写真。加湿器付属品を防水シリコーンのふたで密閉を確保するためのコーティング必要があることに注意してください。この図の拡大版を表示するのにはここをクリックしてください。
- 空気配信システムの構築 (回路図と写真、図 2 a および 2 bを参照)。
- 1/8"NPT ねじを入り江やそれぞれの浮子式流量計の背面にコンセントにバーブ継手に接続します。
注: 200 2,500 cm3最低 rotameters は、加湿器の上流に空気圧力変調、ボトル原子炉、50-500 cm3100-1,000 cm3最低 rotameters/分 rotameters 空気リフト バイオリアクターの 5 50 cm3/分 rotemeters は、CO2の流れの調節です。一定の表面 (例えばプラスチック シート) にマウント rotameters をお勧め彼らは操作中に転倒しないように。 - 圧縮空気の供給源を遮断してにホースをクランプ ¼"ID フレキシブル PVC チューブを圧縮空気源に接続します。1/8"、¼" バーブ継手と 1/8"バーブ継ぎ手に男性に女性を使用して ID PVC フレキシブル チューブ ホース径辞任します。
- 200 2,500 cm3最低のロタメーターの入口へ 1/8「ID チューブ無料端を接続します。
注: この浮子式流量計のコンセントは、1/8「ID チューブを介して加湿器ボトルが給紙されます。 - 1/8「通気蓋 (接続継手バーブに女性ルアーロックを使用) を注入口にチューブを接続します。パネル マウントの内側にチューブ 1/8"の 2 番目の部分を接続継手。
注: この作品は、加湿器や水を介して空気を気泡にダウン ハングします。 - 添付 1/8"1/8「ID チューブ部分両端継手バーブし、混合トラップ入口に加湿器のコンセントを接続するこの作品を使用する女性のルアー。
- 1.2.5 と同様、CO2レギュレータの出口を混合のトラップの 2 番目のポートに接続します。
- 1/8"を使用してマニホールドを構築チューブ、1/8" マルチポート バーブ (参照してください図 2 C) 浮子式流量計銀行に空気を供給します。
注: これらの rotameters、バイオリアクターを供給する使用されます。以上 6 rotameters シリーズは避けてください。代わりに、rotameters の並列バンクを使用してシステムを展開します。すべての原子炉の総流量需要が 2,500 cm3ショット/分未満であることを確認 (または大きい浮子式流量計が必要になる他、加湿器の上流)。 - 1/8"チューブ ・ 1/8" バーブ ルアーに女性を使用して新たに構築された浮子式流量計銀行混合のトラップの出口 (3rdのポート) に接続します。
- 十分に長い 1/8 チューブ"、バイオリアクターに空気を供給する浮子式流量計銀行それぞれの浮子式流量計のコンセントに接続します。チューブとして銀行に rotameters の両端のラベルを付けます。
- 加湿器と混合して気密を確認するトラップ蓋上のすべてのポートのまわりで防水シリコーンを適用します。
- 1/8"NPT ねじを入り江やそれぞれの浮子式流量計の背面にコンセントにバーブ継手に接続します。
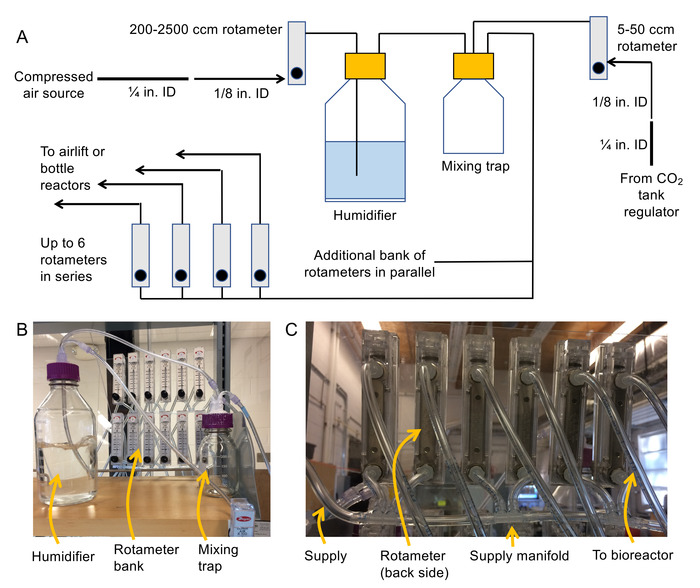
図 2。回路図と写真はバブル列システムを組み立てるため。トラップ、浮子式流量計銀行と浮子式流量計銀行を一緒に接続に使用されるマニホールドの (C) の写真を混合、加湿器の曝気システム (B) 写真の (A) 模式図。この図の拡大版を表示するのにはここをクリックしてください。
- 水槽セットアップ、プレート、およびライト (図 3) かき混ぜなさい。
注意: このシステムには、多数のアウトレットとすべてのコンポーネントをサポートするための十分な回線容量が必要です。糸一緒に複数の電源タップや延長コード デイジー チェーン方式で電気危険ですので避けてください。GFI 型コンセントと電源タップの使用システムで水の存在のために推奨されています。- 水で満たされた水槽の重量を保持するために十分な強いレベルの表面上の低プロファイル磁気スターラーを配置します。
- 木製またはプラスチックを小さなブロック (攪拌板より少し背が高いが) 周囲に水槽の重量を支えるため攪拌板を配置します。
注意: は、重量は、それらを粉砕すると攪拌プレート上に直接水槽を置くことを避けます。 - 炒め皿に水槽を置くし、ブロックをサポートに水タンクを埋めます。
- 蓋と水槽の上に合うように硬いプラスチック シートの部分をカットします。このハイブリダイゼーション チューブを出し入れするための穴をカットします。また、水槽ヒーター用の穴をカットします。
- バイオリアクターの水平面照度を提供するために魚の水槽の横に蛍光灯の光銀行を配置します。光の銀行を昼/夜サイクルを設定する光タイマーに差し込みます。

図 3。システム図 (左) ボトル バイオリアクターと気泡列フォトバイオリアクター (右)。この図は、ヒギンズらから変更されています。17.この図の拡大版を表示するのにはここをクリックしてください。
2. 微細藻類の接種材料の準備
- 低温保存、メッキ、または液体文化から微細藻類菌を取得します。
注: 凍結生物が細胞が実行可能な生成されたカルチャが無菌であるため接種として使用する前にメッキすることをお勧めします。寒天培地 (e.g。、寒天を異なる ATCC #5)21はクロレラとAuxenochlorella属の低温貯蔵からの復活のためによく働く豊富な媒体。 - 特定の藻類種に適している鉱物中の 2.4 L を準備します。
注: 例としては、クロレラ、N8 NH4中21 Auxenochlorellaの種のための種の N8 中23 。藻類株の適切な媒体の使用は、堅牢な藻類の成長を確保に向けた最も重要な手順の 1 つです。 - 3 つの 1 リットルのガラス瓶に均等に鉱物中の因数の 2.4 L は、各ボトルにそれぞれのボトルにバーをかき混ぜるし、通気蓋 (図 1) を組み立てるを追加します。通気管は、入口側と各ボトル ダブル チェックは、攪拌棒をいます。
- 液体滅菌を使用してストック ボトル サイクル (121 ° C) 30 分オートクレーブ 100 ml の脱イオン水 (dH2O) およびいくつかの 1.5 mL チューブ メッキの後で使用される同じ時間のオートクレーブ。一晩冷却的に許可します。または、部屋の温度に原子炉を冷却し、接種前の 2 h の通気。
- バイオセイフティ キャビネット (BSC) のストック ボトルにプレートや液体培養から微細藻類を接種します。次の手順で無菌培養を維持するために、生殖不能の技術を使用します。
- オートクレーブ dH2O の 20 mL を滅菌 50 mL の遠心管に追加します。滅菌 10 μ L 使い捨て可能なループを使用して、手順 2.1 からプレートからいくつかのシングル コロニーをピックアップします。50 mL のチューブにループを浸し、オートクレーブ dH2O. 振る 50 mL チューブ均質微細藻類ソリューションにするための 20 の mL に藻類細胞を洗ってください。
- 各ストック ボトルに微細藻類溶液 6 mL をピペット 10 mL 滅菌血清ピペットと。培地に均等に微細藻類をミックスするボトルを旋回します。
- 2 mL の滅菌血清ピペットを使用して、各ストック ボトルと転送から滅菌 1.5 mL チューブに 1 mL のサンプルを描きます。
注: マイクロ ピペットは汚染の危険があるためこの手順は推奨されません。ストック ボトルの通気孔のある蓋を締めます。 - 攪拌板 (~ 150 rpm) のストック ボトルを置き、空気流量、CO2、および種の適切な照明レベルを調整します。毎日のストック ボトルの位置を回転させます。
- 段階 2.6 試料 1 mL を希釈 (100 希釈滅菌水では通常うまく) と豊富な寒天培地の上にプレートを普及します。
注: これらのプレートは、汚染のインスタンスも将来藻菌のためのソースとして、さらに実験のチェックに使用できます。 - 微細藻類の成長を点検する 2 日毎 (BSC) の中にボトルからサンプルを取る。
3 通 (200 μ L) 96 ウェル マイクロ プレート内のサンプルを置き、550 の光学濃度 (OD) を測定 nm および 680 nm まで OD 2 日毎に達する 0.2 0.3 (これは通常 5-7 日間が必要です)。 - 孵化を停止し、ストック ボトルを藻類の細胞は重力によって解決するために 24-48 h のベンチに置きます。
注: 解決された細胞は、バブル列フォトバイオリアクターを接種する次に使用されます。迅速な細胞採取が必要な場合、細胞は細胞を収集するために以上 1,000 x g で遠心可能性があります。
3. バブル列フォトバイオリアクターで微細藻類の栽培
- バイオリアクター接種前日準備適切なメディアと転送 200 mL (または音量) バブル列フォトバイオリアクターをチューブ (ハイブリダイゼーション チューブ)。オートクレーブは、メディアと場所で通気蓋管します。
注: オートクレーブ空成長媒体として排水を使用して場合バイオリアクター (培養が必要な) 場合、無菌ろ過排水を追加。 - 真空ポンプを使用して上清を除去することによって解決された微細藻類株式を集中します。各ボトルの中の 100 mL 未満を残すが、定住の藻を除去するを避けます。
注: このプロシージャは BSC の内側を行い滅菌手法に従います。簡単な真空装置は、真空フラスコやボトルのいずれかを使用して構築できます。管の端に血清学的滅菌ピペットに適合します。 - 中断し、藻類スラリーを滅菌 50 mL 遠沈管に転送します。1,000 x g でさらに 5 分間遠心藻類に集中します。
- BSC、12 photobioreacters 用藻類濃縮物の ~ 80 mL の容量を達成するために十分な上澄みを削除します。ペレット吸引を避けます。滅菌コンテナー (または使用される藻類のストック ボトル) 藻類濃縮物を転送します。
- 10 mL の滅菌血清ピペットでそれぞれフォトバイオリアクターに藻類スラリーの 6 mL を追加します。
- 滅菌フィルター (0.2 mm 注射器や真空フィルター) と、他の化合物 (例えばビタミン株式) オートクレーブすることはできませんの適切な量を追加します。
- 媒体に藻類をミックスするバイオリアクターを旋回します。
- 血清ピペット 2 mL チューブに転送して各バイオリアクターから 2 mL サンプルを描画します。文化の進行状況を監視するすべての 24 h (BSC) の 2 mL サンプルを収集します。チェックの pH を使用してサンプルをテスト ストリップと原子炉を M NaOH または 3 M HCl いずれか 3 と必要に応じて調整。
- バイオリアクター蓋を締め、タンク水の魚のバスにすべてバイオリアクターを配置します。曝気、CO2、および種のための適切なレベルに照明を調整します。(ステップ 3.8) をサンプリングした後毎日バイオリアクターの位置を回転させます。
- 96 よくマイクロ プレートのウェルに 3 通各文化サンプル 200 μ L を適用します。測定光学濃度 (OD) 550 nm および 680 nm。
- 培養期間の最後の日、別の希釈要因 (例えば、 1 x、2 x、4 x、8 x、16 x と 32 x) 収穫 (手順 4) した後、OD と実際の乾燥重量の間の相関関係を確立するの下で外径を測定します。
- 5 分間 12,000 × g で 2 mL のサンプル チューブを遠心します。
- 0.2 μ m の非滅菌注射器フィルターを介して上清をフィルター処理し、なしで上澄み (と必要な場合ペレット) を格納長期ストレージとメディア組成の変化の後の分析のための-20 ° C よりも高い。
4. 収穫および凍結微細藻類バイオマスの乾燥
- メスシリンダー (例えばバイオリアクター、もともと含まれている 200 mL 中から 160 mL) 各バイオリアクターから藻類培養の固定量を測定し、遠心ボトルに転送します。DH2O 各測定間でメスシリンダーをすすいでください。
- 4,696 x g で 5 分間遠心は、慎重にそれを掃除機で上澄みを廃棄します。
- ラベル付きの 50 mL チューブにペレットを転送します。DH2O、遠心ボトル、50 mL チューブに転送内容をすすいでください。総管容積が 45 mL を超えないことを確認します。
- DH2O 塩を削除する藻類ペレットを洗浄します。
- 5 分 4,696 x g で 50 mL のチューブを遠心し、上澄みを廃棄します。
- 40 mL dH2O; 各 50 mL のチューブを追加します。ミックスする渦。再び 5 分 4,696 × g で遠心、上清を廃棄します。
- 4.4.2 のステップを繰り返します。
- ラベルし、空 15 mL 遠沈管 4-10 進数のバランスで重量を量る (蓋とチューブのラベルおよび一緒にそれらの重量を量る)。藻類培養あたり 1 つの管の重量を量る。エラーを最小限に抑えるために 2 回各 15 mL チューブの重量を量る。
- 最後の洗浄後、上澄みを廃棄し、dH2O の 7.5 mL を各 50 mL チューブに追加します。あらかじめ重量を量られた 15 mL に藻類スラリー管の渦と転送。追加 dH2O 50 mL チューブを洗浄し、液を 15 mL チューブに転送します。15 mL チューブに総量の 12 mL を超えない。
- 5 分間 4,696 x g で 15 mL チューブを遠心し、上清をデカントします。凍結に備えて、少なくとも 30 分間-80 ° C でペレットとチューブを固定します。
- 凍結乾燥乾燥するまでまたは一晩。
- 重さし、藻類の凍結乾燥 15 mL チューブを記録します。
5. 脂質抽出変更 Folch 法24
- 20 mg 2 mL スクリュー キャップ ポリプロピレン管 (製品がビーズ抽出に適したことを確認するチェック メーカー ラベル) に凍結乾燥藻体バイオマスの重量を量り。
- (凍結乾燥藻の 20 mg を含む) の各 2 mL チューブに Folch 溶媒 (2:1 クロロホルム ・ メタノール) 1.5 mL を追加します。各管に、チューブ内の液体レベル 2 mL に達するまで mL ジルコニア ・ シリカ ビーズ (0.5 mm) を ~0.5 に注ぐ。
注意: クロロホルムおよび発煙のフード メタノール処理ガスの吸入を避けるや皮膚の接触。 - 20 のビーズミルで藻類のサンプルを均質化 30 の氷に 6.5 m/s. 管の速度で s サンプルを寒さに s。完全に脂質を抽出する 5 回を繰り返します。
- 15 mL チューブに濾液を収集、ビーズを負担するステンレス鋼ワイヤー メッシュ ディスク (#60 メッシュ) を含む 5 mL シリンジを磨砕液をフィルターします。
- Folch 溶剤、必要に応じて注射器を介して液体をプッシュの 1.5 mL でビーズを洗浄します。この洗浄をさらに 2 回繰り返すし、約 6 mL の最終巻を降伏 15 mL チューブのすべての濾液を収集します。
- 0.9% (w/v) 15 mL チューブに Folch 抽出物に食塩とよく混ぜて渦の 1.2 mL を追加します。
注: 必要な場合は Folch 溶媒は (使用 0.2 0.9 %nacl 水溶液相分離を誘発する合計洗浄ボリューム x) のビーズを洗浄する使用できます。 - 6,000 x g で 5 分間記録下クロロホルム (緑) 相ボリューム 15 mL チューブの側面に線を使用して最も近い 0.1 mL を 15 mL チューブを遠心します。ガラス パスツール ピペットを使用して (蓋) 付きのガラスの瓶に下相を転送します。
- -20 ° C または (-80 ° C の脂肪酸分析にこの抽出物を使用する計画がある場合) で脂質を保存します。
6. 中性脂質分析マイクロ プレート法を用いた (ヒギンズら201422)から適応
- 貯蔵液を準備します。クロロホルム 10 mL 1 mg/mL 植物油標準を準備し、-20 ° C で保存
注: あらゆる植物油は脂肪酸の種類に敏感ではないために、この試金で使用可能性があります。200 μ g/mL ジメチルスルホキシド (DMSO) で Nile Red ソリューションの 10 mL を準備し、室温で暗闇の中で保存します。 - ヒューム フードの 55 ° C に予熱乾燥マイクロ プレート ブロック。これは加熱しながら希釈脂質エキスと植物油の標準 3 倍メタノール。
注: この希釈は、藻類の脂質含量に基づいて変更できますが、このレベルは適してほとんどクロレラ。 - 各希釈サンプルは、4 連でもポリプロピレン マイクロ プレートを 96 80 μ L を追加します。
注意: ポリスチレン容器の使用は有機溶剤の使用は推奨されません。 - 空白の溶媒の 4 連で 2:1 メタノール/クロロホルムの 80 μ L を適用します。標準、10、30、60、90、120 μ L の 4 連で標準的な希薄の植物油を追加します。
- すべての溶剤が蒸発するまでは、55 ° C で 20-30 分のためのドライ ブロック ヒーターでマイクロ プレートを配置します。溶媒が蒸発する準備作業ナイルレッド ソリューション (よくプレートあたり 1 μ g/ml ソリューションの必要性 200 μ L)。例として、12 のサンプルおよび標準の完全なセットが 1.0 μ g/mL ソリューションの 16 mL を必要と16 mL dH2o. に (DMSO) で 200 μ G/ml 株式の 80 μ L を溶解することにより準備します。
- 暖房のブロックからマイクロ プレートを外し、室温に涼しい許可しなさい。各ウェルにイソプロピル アルコールの 30 μ L を加え、ピペッティングを上下で混ぜます。ピペットのすべてのチャンネルが溶液の混合、均一な緑色の液体を降伏、脂質を再ことを確認します。
- アップ/ダウン ミックスに 10 回、各ピペットに Nile Red 液 (1 μ g/mL) の 200 μ L を追加します。室温で 5 分間プレートを孵化させなさい。待っている間、dH2O. 20 μ L/ウェルが必要で漂白剤 (次亜塩素酸 6%) を混合することによって 50% の漂白剤溶液を調製します。50% の漂白剤の 3 mL の調製は、12 のサンプルと標準の完全なセットのための十分なです。
- 各マイクロ プレートにも漂白剤溶液 20 μ L を追加し、ピペットの上下に 5 回にはよく混ぜます。室温で 30 分間インキュベートします。
- 30 分後サンプルの蛍光 530 nm 励起/575 nm の発光で 5-10 分で読む 570 に設定自動カットオフ nm 藻サンプルからの信号が安定するまで。通常、合計インキュベーションの 60 分で十分です。
- 植物油規格 (0-40 ng/油井の範囲) のための校正曲線を作成します。
注: 線形フィット低のためによく働く (< 30 ng/ウェル) 標準 30 ng/ウェルを超えている場合、油濃度と合わせて多項式を使用する可能性があります。この相関関係を使用して、サンプル井戸の中性脂質を定量化します。
結果
この手順には、外径 550 nm (図 4 a) 藻類の光学密度データの時間コースが得られます。光学濃度と乾燥重量集中できるデータに関連する (図 4 b)。これは、最初に凍結乾燥のステップの後の最終的な乾燥重量藻類濃度計算で。次に、実際の乾燥重量濃度と文化シリアル希釈 (サンプリングの最後の日に実行されます) の光学密?...
ディスカッション
藻類を培養する際に最も重要な生物または生物のグループの特定のニーズを理解しています。藻類が特定の非生物的要因 (温度、メディア、pH、光量、CO2レベルの通気率) の広い範囲の文化をここで説明した栽培システムを使用ことができます藻類は生物のニーズを調整する必要があります。クロレラとAuxenochlorellaの耕作のために使用されたここで説明したパラメーター?...
開示事項
著者が明らかに何もありません。
謝辞
この研究のためのサポートは、米国農務省国立食品研究所と農業ハッチ プロジェクト ALA0HIGGINS、学長、研究では、副社長とサミュエル モビルジン工学大学のオーバーン大学のオフィスによって提供されました。サポートは、NSF によって提供されたもあわせて 1438211 を付与します。
資料
| Name | Company | Catalog Number | Comments |
| Supplies for airlift photobioreactor setup | |||
| 1 L Pyrex bottles | Corning | 16157-191 | For bottle reactors, humidifiers |
| 1/2" hose clamp | Home Depot | UC953A | or equivalent |
| 1/4" female luer to barb | Nordson biomedical | Nordson FTLL360-6005 | 1/4" ID, PP |
| 1/4" ID, 3/8" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-244 | 50' |
| 1/4" in O-rings | Grainger | 1REC5 | #010 Medium Hard Silicone O-Ring, 0.239" I.D., 0.379"O.D. |
| 1/8" Female luer to barb | Nordson biomedical | FTLL230-6005 | |
| 1/8" ID, 1/4" OD autoclaveable PVC tubing | Thermo-Nalgene | 63013-608 | 250' |
| 1/8" male spinning luer to barb | Nordson biomedical | MLRL013-6005 | |
| 1/8" multiport barb | Nordson biomedical | 4PLL230-6005 | 1/8" multiport barb |
| 1/8" NPT to barb | Nordson biomedical | 18230-6005 | 1/8" 200 series barb |
| 1/8" panel mount luer | Nordson biomedical | Nordson MLRLB230-6005 | 1/8", PP |
| 10 gallon fish tank | Walmart | 802262 | Can hold up to 8 bioreactors depending on layout |
| 100-1000 ccm flow meter | Dwyer | RMA-13-SSV | For bottle reactors |
| 2 ft fluorescent light bank | Agrobrite | FLT24 T5 | |
| 200-2500 ccm flow meter | Dwyer | RMA-14-SSV | For air regulation upstream of humidifier |
| 250 mL Pyrex bottles | Corning | 16157-136 | For gas mixing after humidifier |
| 50-500 ccm flow meter | Dwyer | RMA-12-SSV | For hybridization tube reactors |
| 5-50 ccm flow meter | Dwyer | RMA-151-SSV | For CO2 flow rate control |
| Air filters 0.2 µm | Whatman/ Fisher | 09-745-1A | Polyvent, 28 mm, 0.2 µm, PTFE, 50 pack |
| Check valves | VWR | 89094-714 | |
| Corning lids for pyrex bottles | VWR | 89000-233 | 10 GL45 lids |
| Female luer endcap | Nordson biomedical | Nordson FTLLP-6005 | Female stable PP |
| Hybridization tubes | Corning | 32645-030 | 35x300 mm, pack of 2 |
| Light timer | Walmart | 556393626 | |
| Locknuts | Nordson biomedical | Nordson LNS-3 | 1/4", red nylon |
| Low profile magnetic stirrer | VWR | 10153-690 | Low profile magnetic stirrer |
| Male luer endcap | Nordson biomedical | Nordson LP4-6005 | Male plug PP |
| Spinning luer lock ring | Nordson biomedical | Nordson FSLLR-6005 | |
| Stir bars - long | VWR | 58949-040 | 38.1 mm, for bottle reactors |
| Stir bars - medium | VWR | 58949-034 | 25 mm, for hyridization tubes |
| Supplies and reagents for culturing algae | |||
| 0.2 µm filters | VWR | 28145-491 | 13 mm, PTFE, for filtering spent media from daily culture sampling |
| 1 mL syringes | Air-tite | 89215-216 | For filtering spent media from daily culture sampling |
| 1.5 mL tubes | VWR | 87003-294 | Sterile (or equivalent) |
| 10 mL Serological pipettes | Greiner Bio-One | 82050-482 | Sterile (or equivalent) |
| 100 mm plates | VWR | 25384-342 | 100x15 mm stackable petri dishes, sterile |
| 15 mL tubes | Greiner Bio-One | 82050-276 | Sterile (or equivalent), polypropylene |
| 2 mL Serological pipette tips | Greiner Bio-One | 82051-584 | Sterile (or equivalent) |
| 2 mL tubes | VWR | 87003-298 | Sterile (or equivalent) |
| 50 mL tubes | Greiner Bio-One | 82050-348 | Sterile (or equivalent), polypropylene |
| 96 well microplate | Greiner Bio-One | 89089-578 | Polystyrene with lid, flat bottom |
| Inocculating loops | VWR | 80094-478 | Sterile (or equivalent) |
| Liquid carbon dioxide tank and regulator | Airgas | CD-50 | |
| Supplies and reagents for lipid extraction and neutral lipid assay | |||
| 2 mL bead tubes | VWR | 10158-556 | Polypropylene tube w/ lid |
| 96 well microplates | Greiner Bio-One | 82050-774 | Polypropylene, flat bottom |
| Bleach | Walmart | 550646751 | Only use regular bleach, not cleaning bleach |
| Chloroform | BDH | BDH1109-4LG | |
| Dimethyl sulfoxide | BDH | BDH1115-1LP | |
| Isopropyl alcohol | BDH | BDH1133-1LP | |
| Methanol | BDH | BDH20864.400 | |
| Nile red | VWR | TCN0659-5G | |
| Pasteur pipette tips | VWR | 14673-010 | |
| Sodium chloride | BDH | BDH9286-500G | |
| Vegetable oil | Walmart | 9276383 | Any vegetable oil should work as long as it is fresh |
| Zirconia/ silica beads (0.5 mm diameter) | Biospec products | 11079105z | |
| Equipment | |||
| Analytical balance | Mettler-Toledo | XS205DU | Capable of at least 4 decimal accuracy |
| Bead homogenizer | Omni | 19-040E | |
| Benchtop micro centrifuge | Thermo | Heraeus Fresco 21 with 24x2 | Including rotor capable of handling 1.5 and 2 mL tubes |
| Dry block heater | VWR | 75838-282 | Including dry block for a microplate |
| Freeze dryer | Labconco | 7670520 | 2.5L freeze drying system |
| Large benchtop centrifuge | Thermo | Heraeus Megafuge 16R Tissue | Including rotors capable of handling 400 mL bottles, 50 mL tubes, and 15 mL tubes |
| Microplate reader | Molecular Devices | SpectraMax M2 | Capable of reading absorbance and fluorescence |
| Vortex mixer | VWR | 10153-838 |
参考文献
- Prandini, J. M., et al. Enhancement of nutrient removal from swine wastewater digestate coupled to biogas purification by microalgae Scenedesmus spp. Bioresource Technology. , 67-75 (2016).
- Liu, C., et al. Phycoremediation of dairy and winery wastewater using Diplosphaera sp. MM1. Journal of Applied Phycology. 28 (6), 3331-3341 (2016).
- Passero, M., Cragin, B., Coats, E. R., McDonald, A. G., Feris, K. Dairy Wastewaters for Algae Cultivation, Polyhydroxyalkanote Reactor Effluent Versus Anaerobic Digester Effluent. BioEnergy Research. 8 (4), 1647-1660 (2015).
- Hodgskiss, L. H., Nagy, J., Barnhart, E. P., Cunningham, A. B., Fields, M. W. Cultivation of a native alga for biomass and biofuel accumulation in coal bed methane production water. Algal Research. 19, 63-68 (2016).
- Gao, C., et al. Oil accumulation mechanisms of the oleaginous microalga Chlorella protothecoides revealed through its genome, transcriptomes, and proteomes. BMC Genomics. 15, (2014).
- Burch, A. R., Franz, A. K. Combined nitrogen limitation and hydrogen peroxide treatment enhances neutral lipid accumulation in the marine diatom Phaeodactylum tricornutum. Bioresource Technology. 219, 559-565 (2016).
- Brennan, L., Owende, P. Biofuels from microalgae--A review of technologies for production, processing, and extractions of biofuels and co-products. Renewable Sustainable Energy Reviews. 14 (2), 557-577 (2009).
- Branyikova, I., et al. Microalgae - Novel highly efficient starch producers. Biotechnology and Bioengineering. 108 (4), 766-776 (2010).
- Chalima, A., et al. Utilization of Volatile Fatty Acids from Microalgae for the Production of High Added Value Compounds. Fermentation. 3 (4), (2017).
- Harun, R., Singh, M., Forde, G. M., Danquah, M. K. Bioprocess engineering of microalgae to produce a variety of consumer products. Renewable and Sustainable Energy Reviews. 14 (3), 1037-1047 (2010).
- Liu, L., et al. Development of a new method for genetic transformation of the green alga Chlorella ellipsoidea. Molecular biotechnology. 54 (2), 211-219 (2013).
- Cheng, J., et al. Mutate Chlorella sp. by nuclear irradiation to fix high concentrations of CO2. Bioresource Technology. 136, 496-501 (2013).
- Davis, R., Aden, A., Pienkos, P. T. Techno-economic analysis of autotrophic microalgae for fuel production. Applied Energy. 88 (10), 3524-3531 (2011).
- Sales, C. M., Au, Comparison of Scale in a Photosynthetic Reactor System for Algal Remediation of Wastewater. Journal of Visualized Experiments. (121), e55256 (2017).
- Higgins, B. T., et al. Cofactor symbiosis for enhanced algal growth, biofuel production, and wastewater treatment. Algal Research. 17, 308-315 (2016).
- Higgins, B., et al. Algal-bacterial synergy in treatment of winery wastewater. Nature Clean Water. 1 (6), (2017).
- Higgins, B. T., et al. Impact of thiamine metabolites and spent medium from Chlorella sorokiniana on metabolism in the green algae Auxenochlorella prototheciodes. Algal Research. 33, 197-208 (2018).
- Lépinay, A., et al. First insight on interactions between bacteria and the marine diatom Haslea ostrearia: Algal growth and metabolomic fingerprinting. Algal Research. 31, 395-405 (2018).
- Franchino, M., Comino, E., Bona, F., Riggio, V. A. Growth of three microalgae strains and nutrient removal from an agro-zootechnical digestate. Chemosphere. 92 (6), 738-744 (2013).
- Choix, F. J., Lopez-Cisneros, C. G., Mendez-Acosta, H. O. Azospirillum brasilense Increases CO2 Fixation on Microalgae Scenedesmus obliquus, Chlorella vulgaris, and Chlamydomonas reinhardtii Cultured on High CO2 Concentrations. Microbial Ecology. 76 (2), 430-442 (2018).
- Higgins, B., VanderGheynst, J. Effects of Escherichia coli on mixotrophic growth of Chlorella minutissima and production of biofuel precursors. PLoS One. 9 (5), e96807 (2014).
- Higgins, B., Thornton-Dunwoody, A., Labavitch, J. M., VanderGheynst, J. S. Microplate assay for quantitation of neutral lipids in extracts from microalgae. Analytical Biochemistry. 465, 81-89 (2014).
- Tanadul, O. U., Vandergheynst, J. S., Beckles, D. M., Powell, A. L., Labavitch, J. M. The impact of elevated CO2 concentration on the quality of algal starch as a potential biofuel feedstock. Biotechnology and Bioengineering. 111 (7), 1323-1331 (2014).
- Folch, J., Lees, M., Sloane Stanley, G. H. A simple method for the isolation and purification of total lipides from animal tissues. Journal of Biological Chemistry. 226 (1), 497-509 (1957).
- Higgins, B. T., et al. Informatics for improved algal taxonomic classification and research: A case study of UTEX 2341. Algal Research. 12, 545-549 (2015).
- Garrett, R. H., Grisham, C. M. . Biochemistry. , 578-730 (2012).
- de-Bashan, L. E., Trejo, A., Huss, V. A. R., Hernandez, J. -. P., Bashan, Y. Chlorella sorokiniana UTEX 2805, a heat and intense, sunlight-tolerant microalga with potential for removing ammonium from wastewater. Bioresource Technology. 99 (11), 4980-4989 (2008).
- Wang, Q., Higgins, B., Ji, H., Zhao, D. . Annual International Meeting of the ASABE. , (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved