Method Article
אלקטרופורזה היברידית ברורה/כחולה עבור הפרדה וניתוח של שרשרת נשימה מיטוכונדריאלי מערכות-העל
In This Article
Summary
כאן אנו מציגים פרוטוקול לחלץ, לפתור ולזהות supercomplexes מיטוכונדריאלי אשר ממזער את החשיפה לדטרגנטים וכחול Coomassie. פרוטוקול זה מציע איזון מיטבי בין רזולוציה, ושימור פעילויות אנזימים, תוך צמצום הסיכון לאובדן אינטראקציות חלבון לבנה-חלבון.
Abstract
מכלולי מכונות זרחון חמצוני טופס הסדרים חלבון סופרא מולקולרית בשם supercomplexes (ה scs), אשר האמינו להעניק יתרונות מבניים ופונקציונליים כדי המיטויום. ה scs זוהו במינים רבים, החל משמרים ליונקים, ומספר גדל והולך של מחקרים מדווחים על הפרעה לארגון שלהם במחלות אנושיות גנטיות ושנרכשו. כתוצאה מכך, מספר גדל והולך של מעבדות מעוניינים לנתח ה scs, אשר יכול להיות methodologically מאתגרת. מאמר זה מציג פרוטוקול ממוטב המשלב את היתרונות של שיטות כחול-וברור-יליד כדי לפתור ולנתח ה scs באופן חסכוני בזמן. עם זה היברידית CN/BN-עמוד שיטה, ה scs מיטוכונדריאלי שחולצו עם כמויות אופטימליות של חומרי ניקוי מתון חשופים לזמן קצר כדי לצבוע את הצבע האניוני כחול (CB) בתחילת האלקטרופורזה, ללא חשיפה לחומרי ניקוי אחרים. זו חשיפה קצרה CB מאפשר להפריד ולפתור ה scs כמו ביעילות כמו עם שיטות מסורתיות BN-PAGE, תוך הימנעות ההשפעה השלילית של רמות CB גבוהות על הפעילות ב-ג'ל assays, ו-יציב משך חלבון חלבון אינטראקציות בתוך ה scs. עם פרוטוקול זה ניתן לשלב מדויק ומהיר של פעילות ג'ל מדידות עם טכניקות אנליטיות מעורבים האלקטרופורזה 2D, הטיפול החיסונית, ו/או פרוטאומניקס לניתוח מתקדם של ה scs.
Introduction
המיטורציה לייצר אנרגיה באמצעות זרחון חמצוני, שבו מתחמי הנשימה I-II-III-IV מתחמצן מצעים ולהעביר אלקטרונים חמצן, יצירת מעבר הדרגתי המאפשר זרחון של ADP על ידי ה-ATP סטנדרטים (CV). בשנים האחרונות, מחקרים נרחבים הראו כי מתחמי שרשרת הנשימה אינם משולבים אך ורק באופן ליניארי בקרום מיטוכונדריאלי הפנימי, אלא גם מאורגנים לתוך מכלולי סופרפוזיציה (ה scs) הסדרים1,2. ב המיטותיים, ה scs קיימים שונים stoichiometries: CI/CIII2/CIV1-4 (אשר נקרא את הנשימות, ואשר מסוגל nadh: O2 oxidoreduction ב מבחנה)2, CI/ciii2, ו ciii2 /CIV1-23,4. יתר על כן, מכלולי הנשימה מופצים ביחס שונה בין הצורה החופשית שלהם והסדרים ה scs. לכן, ההערכה היא כי 85%-100% של CI, 55%-65% של CIII, ו 15% – 25% של CIV נמצאים ה scs4. מבנים מולקולריים אלה נחשבים להפחתת הייצור של רוס, לייצב או לסייע בהרכבת מתחמי בודדים, להסדיר פעילות שרשרת הנשימה, ולמנוע צבירת חלבונים בקרום מיטוכונדריאלי הפנימי עשיר של חלבון5 ,6,7,8. היכולת שלהם לעשות שיפוץ על הווריאציה ביקוש האנרגיה וחשיבותם בפתוגנזה של מחלות הוא נחקר במספר מעבדות3,7,9,10, מיכל בן 11 , מיכל בן 12 , מיכל בן 13 , 14. מחקרים הוכיחו כי שינויים פתולוגיים ב ה scs ההרכבה נמצאים במגוון של הפרעות, כולל, אך לא מוגבל, פגם גנטי בסינתזה הקרדיואוליפין15, ספיקת לב16, איסכמיה-reperfusion17, סוכרת12, והזדקנות18.
אלקטרופורזה מקורית וזיהוי חיסוני משמשים רבות במחקרים ה scs כדי לפתור את הסדרים של אוקפוס מכלולי רביעון2,19,20,21. אלקטרופורזה מקורית יכולה להיות נוספת בשילוב עם מספר הפעילות הספציפי ג'ל מאמר או 2d-sds כדי לאפשר קביעה מולקולרית מדויקת של הרכבות ה scs השונים1,19. היכולת ללמוד ה scs הוא תלוי באופן ביקורתי בתנאי החילוץ, כולל סוג וריכוז של חומרי ניקוי בשימוש, כוח יוניים ו-pH, כמו גם על תנאי הגירה אלקטרופטיות, אשר מהווים הרכב מאגר, נוכחות של CB, ג'ל גודל ואקריל באחוז2.
הפרוטוקולים והה scs של הלהקה משתנים במידה רבה בין העיתונים, תוך השוואה בין מחקרים קשים והסתגלות של שיטות מאתגרות22. לכן, המאמר הזה מציע פרוטוקול חזק ואופטימלי כדי לחלץ ה scs מתוך המיטוטרים מבודדים של מקורות שונים עם הדיגיטלי של חומרי ניקוי לא יוניים, כדי לפתור משקל מולקולרי גבוה ה scs להקות. הריכוז אופטימיזציה של חומרי ניקוי, הרכב של מאגר החילוץ, ואת העדר של Coomassie כחול בהכנה לדוגמה למזער שיבוש של מכלולי חלבון. פרוטוקול זה (ראה איור 1 למבט כולל) משלב CN-page ו-BN-page לקבלת רזולוציה אופטימלית של הרכבות ה scs על ג'ל גדול, והוא תואם לפעילות ב-gel המאפשר הדמיה טובה יותר של להקות תגובתית, יחד עם השימוש ב זיהוי חיסוני לה scs ניתוח מפורט והרכב.
Protocol
1. החילוץ SC
- הכינו 100 mL של מאגר החילוץ (ראו טבלה 2) על ידי המסת edta במים. הגדל pH עם KOH עד התפרקה לחלוטין, ולאחר מכן להתאים את ה-pH ל 7.5 עם HCl. להוסיף את הרכיבים הנותרים לפתרון, להשלים את הנפח הסופי עם מים, ולשמור על קרח. בצינור, לפזר הדיגיטלי במאגר החילוץ כדי להפוך פתרון מניות 10%, מערבולת ביסודיות עד התפרקה לחלוטין, ולשמור על קרח.
הערה: ניתן להכין את מאגר השאיבה מראש ולשמור ב-4 ° c עבור 2 חודשים לכל היותר. אם להקות גלי מתחילות להופיע בתחתית הג, משמעות הדבר היא שמאגר החילוץ ישן מדי. בעת הכנת הפתרון 10% דיגיטלי, להכין נפח מלאי ספירת 500 μL לכל מדגם אם באמצעות הכבד העכבר המיטומטר. מסיסות הדיגיטלי משתנה בהתאם למוצא ולמוצר (ראה לוח חומרים). - מיטוכונמיטויום מבודדים מרקמת בעלי חיים (לב העכבר, שריר, כבד; עכברוש לב) או תאים (האדם פיברובלסט) באמצעות פרוטוקולים סטנדרטיים23,24,25 ניתן להשתמש להפקת ה scs. לאחר המיטו, מתקבלים, לכמת את התוכן חלבון באמצעות ערכת שיטת החומצה bicinchoninic על פי המלצות היצרן. מוסף מבודד המיטוסים עם מעכבי זרחן ו פוספספטסים בשלב זה לפי הצורך.
הערה: ה scs ניתן להפיק על המיטו, טרי או המופשפה. מומלץ לחלץ ה scs מכל הדגימות באותו זמן, כדי להבטיח שהם מטופלים עם אותם אצוות של פתרונות באותו התנאים. - מבוסס על ריכוז חלבון מיטוכונדריאלי שהושג, ואת יחס הדיגיטלי/חלבון הסופי הרצוי, לחשב את הנפח של הפתרון הדיגיטלי של מניות מאגר החילוץ נדרש לפי שולחן 1. עבור חילוץ SC, להוסיף 1 μL של מאגר החילוץ (שולחן 2) המכיל הדיגיטלי עבור כל 10 μg של חלבון מיטוכונדריאלי. יחס הדיגיטלי/חלבון יכול להשתנות בין 2 ל-8 g/g. תמיד יש לבצע את הספרות הדיגיטלי עבור כל סוג חדש של מדגם המשמש (ראה איור 2 לדוגמה).
- גלולה המיטומטר, בצינור 1.5 mL על ידי צנטריפוגה ב 16,000 x g עבור 10 דקות ב 4 ° c.
- השמט את הסופרנאנט והשהה מחדש את הגלולה הדריקסטית בנפח המחושב של מאגר החילוץ הקר והקר המכיל את הדיגיטלי. מניחים צינורות על מסובבי הצינור מיני ו הדגירה של 30 דקות ב 4 ° c במהירות סיבוב בינוני. ודאו שהדגימות. מעורבות כראוי
- בדגימות צנטריפוגה ב 20,400 x g עבור 45 דקות ב 4 ° צ' כדי להסיר קטעים מסוגים שאינם מסיסות.
- העבר סופרנטאנט בצינור חדש על קרח לכמת חלבונים. שבר זה מייצג את התמצית העל-מתחמי הנשימה. אם האלקטרופורזה אינה מבוצעת באותו יום, יש לאחסן דגימות ב-80 ° c.
הערה: 1) הימנע הקפאת/הפשרה מחזורים של התמצית, כמו זה משבש את הסדרים המולקולריים גבוה יותר של ה scs. Aliquot לפני מחזור ההקפאה/הפשרה הראשון אם יש צורך. 2) כדי לבצע ניסוי מסוג BN-PAGE סטנדרטי, יש להוסיף את CB לתמצית ה scs בשלב זה. יש להוסיף CB ביחס של 1g/8g ביחס לכמות חומרי הניקוי המשמשים.
2. ג'ל ליציקה ואלקטרופורזה
- הכינו מאגר מעבר הדרגתי של 3x ומניות אקרילמיד להכנת ג'ל מעבר הצבע, מאגר המידע והחנות ב-20 ° צ' (ראו טבלה 3).
- הכינו מאגרי אנדה וקתודה והמשיכו ב -4 ° צ' (ראו טבלה 5).
- פתחו את תא הליהוק ומניחים צלחת זכוכית חיצונית (20 ס"מ x 22 ס מ) בחדר. מקמו קבוצה אחת של מרווחים (1.5 מ"מ) באמצעות כרטיס היישור כדי לוודא שהם יושבים בחוזקה מול הצד והפינות של החדר. מניחים צלחת זכוכית פנימית (20 ס"מ x 20 ס מ) על גבי הרווחים (זה יוצר את כריך ג'ל), ולשים גיליון הפרדה פלסטיק על גבי צלחת הזכוכית.
- חזור על שלב 2.3 עד למספר הרצוי של ג'לים ליציקה. עבור פרוטוקול זה, 4 ג'לים מחוקים. מערכת קאמרית הליהוק אנו משתמשים (ראה שולחן החומרים) מאפשר הליהוק של מקסימום 10 ג ' לים בכל פעם. קח-up את השטח הנותר בחדר על ידי הוספת הראשון בלוקים אקריליק רבים ככל הנדרש, ולאחר מכן צלחות זכוכית במידת הצורך.
הערה: המונטאז ' חייב להיות אטום היטב; לא צריך להיות מרווח בין כריכי ג'ל בחדר. - מניחים רצועה של parafilm בחריץ לפני המושבים האטם בחוזקה חריץ gasket. הניחו את לוחית האיטום על החדר והדקו את כל 6 הברגים. . עמוד בחדר הליהוק
- הצב מעבר צבע לשעבר על צלחת מהומה עם מערבב מגנטי בחדר ערבוב "האור". לחבר את הצינורות של חדר הליהוק לעבר הדרגתי, לאבטח את אבובים בקלטת של המשאבה הפריסטלטית, ולוודא את הפפין של מעבר הצבע לשעבר סגור.
- כדי להטיל 4 ג'לים, להכין 60 mL של 4% ו 60 mL של 12% ג'ל הפתרונות (ראה שולחן 4) בבקבוקון Erlenmeyer ו מערבולת ביסודיות לערבב. יוצקים 60 mL של 4% ג'ל הפתרון בחדר ערבוב "האור", ו 60 mL של 12% בחדר "כבד" המאגר של מעבר הצבע לשעבר. הגדר מהירות מהומה של צלחת מהומה ב 350 סל ד. פתח את הסטופין והפעל את המשאבה ב 35 סל ד.
- לאחר שבר האור הוא נמוך יותר מאשר שבר כבד, להשהות את המשאבה ולפתוח את גבעול שסתום בין "אור" ו "כבד" מאגרים, לתת נפח שברים משקל, ולהפעיל מחדש את המשאבה.
הערה: חשוב כי אין בועות להיכנס למערכת ולכוד בין צלחות זכוכית. אם הדבר קורה, בטל את השלב, שטוף ובצע שוב. - לאחר הג מעבר שנשפך לגמרי, לעצור את המשאבה, ואת מי השכבה (כ 1 מ ל) על כריך ג'ל כדי למנוע ייבוש של ג'ל. . תנו לפולימו לעבור 2 שעות
- הכינו 25 מ ג ג'ל לערימה ב Erlenmeyer ו מערבולת לערבב ביסודיות. להסיר מים ולהוסיף 15 גם מסרקים בכל סנדוויץ ' ג'ל. יוצקים ג'ל הערמה ולאפשר פולימו עבור 2 h.
הערה: ג'ל ניתן לזיכוי ולשמור ב -4 ° c במשך שבוע אחד. - הוסף ג'ל מלחציים כריך ולהסיר מסרק. עם צלחת הזכוכית הקצרה הפונה כלפי מטה, הכנס את כריך ג'ל בליבת קירור. חזרו על הצד השני והניחו את הליבה במיכל האלקטרופורזה.
- יוצקים 300 מ ל של מאגר קתודה כחול בחדר הפנימי של מיכל האלקטרופורזה. יוצקים 2 L של מאגר אנאודה בחדר החיצוני של מיכל האלקטרופורזה.
הערה: האלקטרודות יש לשים מתחת למאגר הקתודה, אשר דורש כ 300 mL. - העומס בין 75 μg ו 175 μg של חלבון לכל טוב. הפעל ג'ל ב 150 V עבור 1.5 h (או עד כל הדגימות נכנסו ג'ל מעבר הצבע) בחדר קר (4 ° c).
הערה 1:1) מינימום של 75 μg לכל טוב נדרש עבור רזולוציה טובה של להקות פעילות ב-gel. טעינת מעל 175 μg של חלבון יוביל לאובדן להקות ברורות עקב פעילות אנזימים מוגזמת. 2) יש לטעון את הדגימה בבארות נפרדות כדי לאפשר קביעה מקבילה של פעילויות ב-ג'ל וניתוח כתמי החיסוני של מתחמי ה-OXPHOS. קביעה מקבילה של IGA עבור CI, CII, CIV ו-CV דורש מינימום של 300 μg. ניתוח חיסוני מקבילי של CI, CII, CII, CIV ו-CV דורש מינימום של 375 μg. - הסרת מאגר קתודה כחול עם pipet או ואקום, להחליף על ידי 300 mL Coomassie כחול חינם מאגר קתודה, ולהפעיל ג'ל ב 200 V לילה (16-20 h) בחדר קר (4 ° c). המשך לשלב 3 או 4 עבור מדידת פעילות ב-gel או החיסוני.
3. ב-ג'ל פעילות עבור מתחמי I, II, IV ו-CV
- לפני סיום האלקטרופורזה, הכינו מאגרי פעילות מתוך-ג'ל בהתאם לטבלה 6, ושמרו בחושך ב-RT. 20 מ ל של מאגר הפעילות ב-gel מספיק ל -3 מסלולים לדוגמה.
הערה: שיטת הפעילות של קורות חיים בתוך ג'ל מבוססת על הפעילות ההפוכה של Atpסטנדרטים (כלומר, ATP הידרוליזה), ומשתמשת בסידן כגורם משותף, אשר מזרז את הג. הסידן מזיק פחות מההפניה המשמשת בפרוטוקולים אחרים. יתרה מזו, השימוש בפרוטוקול זה אינו דורש הפעלה/התניה של ג'ל23. - . תפסיק את האלקטרופורזה ותחזיר ג'ל מסלולים חותכים, אם יש צורך, ולהעביר מסלולים ג'ל בשקיות פלסטיק (3 הצדדים לחתוך, ושקית פלסטיק נפתח כמו ספר). חותם 2 מתוך 3 הצדדים עם איטום חום.
הערה: כדי להשוות את ההרכב של להקות SC בין קבוצות נסיוניות, מומלץ להפעיל את אותם דגימות בתוך שכפול על אותו ג'ל. מסלולים לחתוך כדי דגירה כל שכפול במאגרי פעילות שונים של ג'ל (CI, II, IV, V). כדי לאשר את הספציפיות של ההסכמה, משכפל נוסף יכול להיות מוכן לרוץ בפעילויות ג'ל בנוכחות של מעכבי ספציפי שרשרת הנשימה. - עבור 3 דגימות ניסוי (כלומר 3 בארות), להוסיף 20 מ ל של מאגר פעילות ב-gel, להסיר בועות, ו לאטום צד 4 של שקית ניילון.
הערה: הוספת מעכבי בניסויים בשליטה שלילית אם בוצעה: CI: Rotenone 1 μM; CII: נתרן Malonate 10 מ"מ; CIII: Antimycin-A 8 μM; CIV: KCN 0.6 mM; CV: Oligomycin 0.5 μM. - מסלולי הג מודצ ב 37 ° c בחושך ולבדוק כל 15 דקות. זמן דגירה משתנה בהתאם לכמות החלבונים והתסביכים. CI יגיב מהר יותר מאשר CIV או קורות חיים. מכתים אופטימלי מתרחשת בדרך כלל אחרי 2 h עבור CI, 4 h עבור CIV ו-6 h עבור CII ו-CV.
- לשטוף נתיבי ג'ל במים כדי לעצור את התגובה, ואת התמונה על רקע לבן עבור CI, CII, CIV, או רקע שחור עבור CV.
הערה: ג ' לים ניתן לשמור בשקיות פלסטיק ב RT או 4 ° צ' במשך מספר חודשים.
4. מבלוק חיסוני
- הכן את מאגר ההעברות בהתאם לטבלה 7, והמשך בשעה Rt. הכן את tbst והמשך ב-rt.
- מקם את הג כולו, או נתיבים נבחרים, במיכל והוסף מאגר העברה בתוספת SDS (0.25% הסופי במאגר ההעברה). מיכל המקום על נדנדה ו מודל 1 h.
- חותכים קרום PVDF (גודל המתאים לגודל של ג'ל) ולהפעיל 20 מ ל של מתנול תחת עצבנות עבור 2 דקות. החלף על ידי מאגר העברת 20 מ ל ומקום תחת עצבנות עבור 2 דקות.
- להכין כריך העברה, מלמטה למעלה, וודא שאין בועה בין ג'ל וממברנה PVDF מופעל: הצד הנקי של הקלטת/ספוג שחור/בלוק נייר/ממברנה/ג'ל/בלוק נייר/ספוג שחור/צד שחור של הקלטת. סגור ונעל את הקלטת.
- מקום כריך העברה במיכל העברה, עם צד ברור של הכריך מול הצד האדום של האלקטרודה, ויוצקים מאגר העברה כדי למזג את הג. חבר את מערכת הקירור למיכל ההעברות והגדר ב -4 ° c. התחבר לספק הכוח, הגדר ב 40 mA, ולרוץ 24 שעות.
- לאחזר ממברנות, לחסום עבור 1 h ב 5% BSA ב TBST, ו הדגירה בפתרון הנוגדן העיקרי הכין 5% BSA ב TBST לילה ב 4 ° c.
הערה: ראה שולחן 8 לשימוש בנוגדנים. - לשטוף את הקרומים ב-TBST 3x עבור 10 דקות כל אחד.
- ממברנות דגירה פתרונות נוגדן משני הכין ב 5% BSA ב TBST עבור 2 h בטמפרטורת החדר.
- לשטוף את הקרומים ב-TBST 3x עבור 10 דקות כל אחד.
- הוסיפו את הפתרון הכימי לקרומים ולדימוי.
5. אנליזה
- ניתן להשתמש בשימוש בתמונות או בגושים החיסוני של הפעילות ב-gel כדי לנתח את ה scs. כדי לנתח הרכב של להקות, ליישר משכפל ולאמת איזה מורכב הגיב באופן חיובי עבור כל להקה נתונה.
- כדי לנתח את חלוקת התסביכים, בהרכבות מולקולריות שונות, יש לפתוח תמונות ב-ImageJ ולהשתמש בכלי הניתוח ג'ל (ראה איור 5 לדוגמה).
- בחרו נתיבים בעזרת הכלי מלבן ונתיבי התוויה.
- צייר קווים כדי לסגור את האזור תחת עקומת כל להקות של עניין ולחץ על כל אזור עם הכלי שרביט כדי ליצור טבלה המכילה את האזור תחת ערכי העקומה.
- כדי לחשב את התפלגות הקומפלקס, דווח על הערכים עבור כל רצועה ביחס לזה של המונומר.
תוצאות
איור 2 מראה תוצאות מניסוי דיגיטלי שמטרתו לזהות את הכמות המתאימה של הדיגיטלי הנדרש להפקת ה scs. סכום זה ישתנה בהתאם לסוג הרקמה/תא והאם המדגם קפא או לא. עבור ניסוי זה, פעילות CIV ב-ג'ל בוצעה כדי להמחיש ה scs בודד מתוך כבד העכבר החדש המיטוa. יחס של 2/1 עד 10/1 גרם הדיגיטלי/גרם של חלבון נבדקו. הכמות האופטימלית של הדיגיטלי עבור דוגמה זו היא 4 g/g, כפי שהיא מספקת ברזולוציה טובה של מונומאריק CIV, ומשקל מולקולרי גבוה ה scs. ביחס נמוך יותר, הלהקות לא ברורות ומאפשרות לפתור את הכתם במהלך האלקטרופורזה, בעוד שהשימוש ביחס גבוה יותר של הדיגיטלי מוביל לשיבוש של משקל מולקולרי גבוה.
איור 3 ואיור 4 להראות את התוצאות של הניסוי המלא ביצע על הכנת הכבד של העכבר המיטומטר שחולצו עם 4 g הדיגיטלי/g חלבון. חלבונים הופרדו באמצעות היברידית בסון/CN-PAGE, סטנדרטי BN-PAGE, או CN-PAGE. כל שלושת הג היו מצוידים באותו הזמן והנתיבים היו טעונים משכפל של אותה דוגמית. בעקבות אלקטרופורזה, מסלולים בודדים נחתכו ועובדו עבור במדידה פעילות ג'ל (CI, CII, CIV ו-CV על איור 3) ו החיסונית (CI, CII, CIII, CIV, קורות חיים על איור 4).
תוספת של CB בכל רגע במאגר הקתודה (כלומר היברידית CN/BN-PAGE) או במאגר מדגם וקתודה ברחבי האלקטרופורזה (כלומר BN-PAGE), משפר במידה ניכרת את הניידות והרזולוציה של להקות SC, ומכלולי הנשימה הפרט לעומת CN-PAGE (איור 3). להקות הן בקלות להבדיל עם השיטה היברידית או BN-PAGE לאחר הפעילות ב-gel עבור CIV, ואילו במדגם אותו נפתר על ידי CN-PAGE, ה scs ו monomeric CIV להקות תגובתי לא ניתן לזהות.
איור 3 ואיור 4 מראים כי הרזולוציה והסימון דפוס של oxphos ונומרים והרכבות סופרא מולקולרית ולקולרית הוא דומה בצורה איכותית בין היברידית CN/BN-page ו-BN-page. עם זאת, קיימים הבדלים בולטים. ראשית, הניידות אלקטרופלוטית של מכלולי OXPHOS מופחתת מעט כאשר חלבונים מופרדים באמצעות CN היברידית/בסון-עמוד תנאים לעומת תקן BN-page, בשל כמות מופחתת של CB. שינוי ניידות זה גדול יותר עבור מונמרים CIV, ואחריו קורות חיים monomers, ו-CI (איור 3 ואיור 4). שנית, הרקע הכחול נמוך יותר בתוך היברידית CN/BN-עמוד לעומת BN-PAGE (איור 3, מסלולים שמאלה). כתוצאה מכך, רמות הרקע הגבוהות הבאות באמצעות BN-PAGE מסיכות לחלוטין את הצביעת של הפעילות ב-gel עבור CII, ומגבירה את רעשי הרקע המשויכים לפעילות הדימרס של CIV (איור 3). שלישית, הפעילות של CV גבוהה יותר כאשר הדגימות מופעל תחת היברידית CN/BN-עמוד תנאים לעומת BN-עמוד (איור 3), בשל כמות מופחתת של CB, אשר ידוע להתערב עם קורות חיים קטליטי פעילות. 26 CN/BN-PAGE גם מאפשר שימור טוב יותר של קורות חיים supraמולקולריים, כפי שמוצג על ידי שיעור גדול יותר של הפעילות קורות חיים כולל הקשורים קורות חיים דימרים (איור 3). יתר על כן, קורות חיים oligomers גלויים תחת CN/בסון-עמוד, בעוד הם המונתק לחלוטין תחת בתנאים BN עמוד. מעניין, להקות נפרדות המציגים פעילות קורות חיים נצפו גם בין קורות חיים ונומרים ודימרס, כאשר דגימות פועלות תחת CN/BN-עמוד (איור 2).
איור 5 מראה ניתוח מייצג של התפלגות OXPHOS מורכבים בהרכבות supraמולקולריות. התמונה מציגה CI בפעילות ג'ל של דגימות שהתקבלו 4 הכבד בריא בריאות העכבר מיטוכונדההכנות. ניתוח densi, try מאפשר למדוד את האזור תחת עיקול של להקות CI, ולהציג את ההתפלגות היחסית של פעילות C1 ב monomeric (אני1) ו סופרא מולקולרית צורות (אני 1iii2, אני1iii2IV 1, אני1III2IVn). ניתן לבצע ניתוח דומה בעקבות כתמי החיסוני.
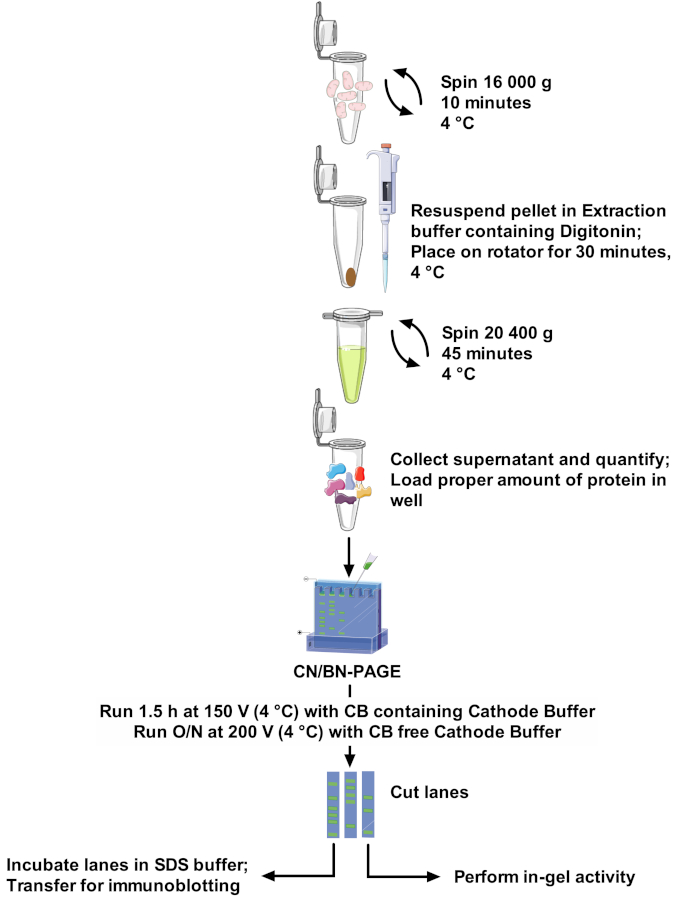
איור 1: תהליך העבודה של שיטת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
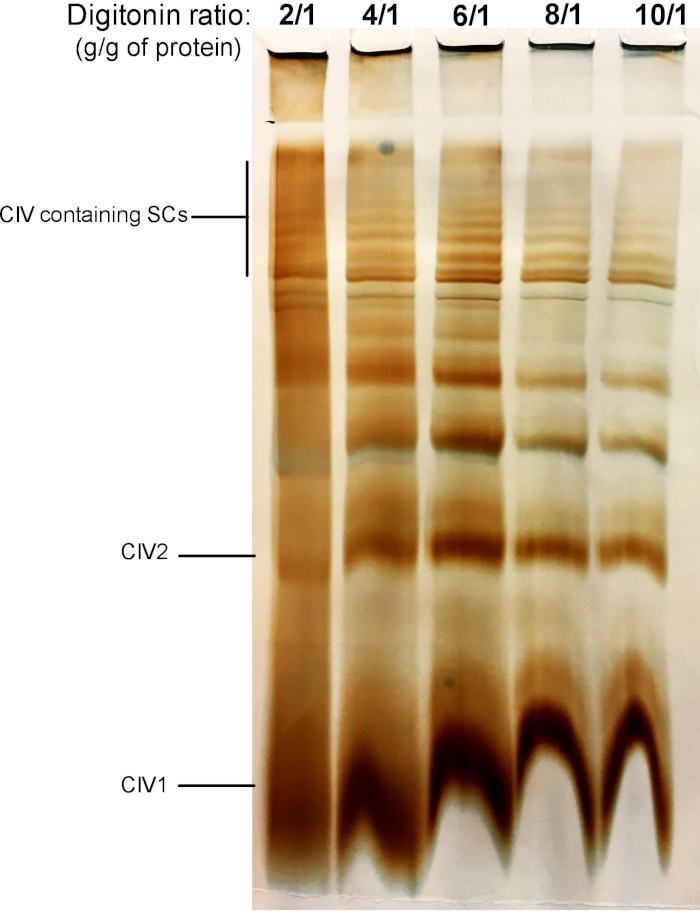
איור 2: טיקוציה הדיגיטלי כדי לחלץ supercomplexes מן הכבד העכבר החדש המיטוa. דוגמה זו מציגה אליקוטים של כבד העכבר המיטוa, מבודד מחיה אחת שטופלה עם כמויות הולכות וגדלות של הדיטונין כדי לחלץ supercomplexes הנשימה. דגימות נפתרו לאחר מכן על ידי היברידית CN/BN דף, ו-ג'ל הפעילות של CIV נקבע. CIV1: מונמרים IV מורכבים; CIV2: מורכבות הרביעי במרס; SC: סופר מתחמי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
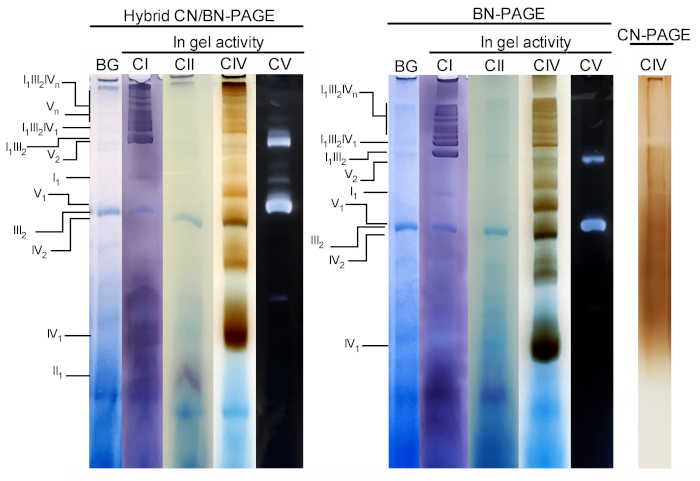
איור 3: הפעילות ב-gel של מכלולי OXPHOS בעקבות היברידית CN/BN-page, BN-עמוד או CN-page. המיטוהכבד מבודד מעכבר אחד טופלו דיגיטלי (4 g/g יחס digotonin/חלבון) כדי לחלץ supercomplexes הנשימה. מתוך דוגמה זו נטענו לאחר מכן על בארות מרובות בשלושה ג ' לים ברורים שהוגשו CN/BN-PAGE, בסון-עמוד או CN-PAGE. כל מסלול שכפול בתוך כל ג'ל היה אז נחתך מיד משמש עבור הפעילות ב-gel (מתויג CI, CII, CIV ו-CV). נתיב אחד שימש כשליטה כדי להציג רקע (בתווית BG) כתמים עם Coomassie כחול. מתחמי OXPHOS ומכלולים מולקולריים מזוהים באמצעות המינוח הרגיל, עם מספרים במדדים המציינים את הסטואיצ'ימטריה המולקולרית של כל מתחם OXPHOS. יש לציין כי מיקומו של הרכבות supraמולקולריות המכילות את CIII מבוסס על גילוי חיסוני מאז הפעילות ב-gel עבור CIII לא בוצעה בניסוי מסוים זה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: ניתוח חיסוני של מתחמי OXPHOS בעקבות היברידית CN/BN-page או bn-page. משכפל מתוך הניסויים המתוארים באיור 3 האגדה היו אלקטרו הועברו על קרום אחד. לאחר ההעברה, נתיבים בודדים נחתכו ו מודבטים עם נוגדנים ספציפיים לזהות CI, CII, CIII, CIV, ו-CV. מתחמי OXPHOS ומכלולים מולקולריים מזוהים באמצעות המינוח הרגיל, עם מספרים במדדים המציינים את סטויכמטריה מולקולרית של כל אחד ממכלול ה-OXS. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
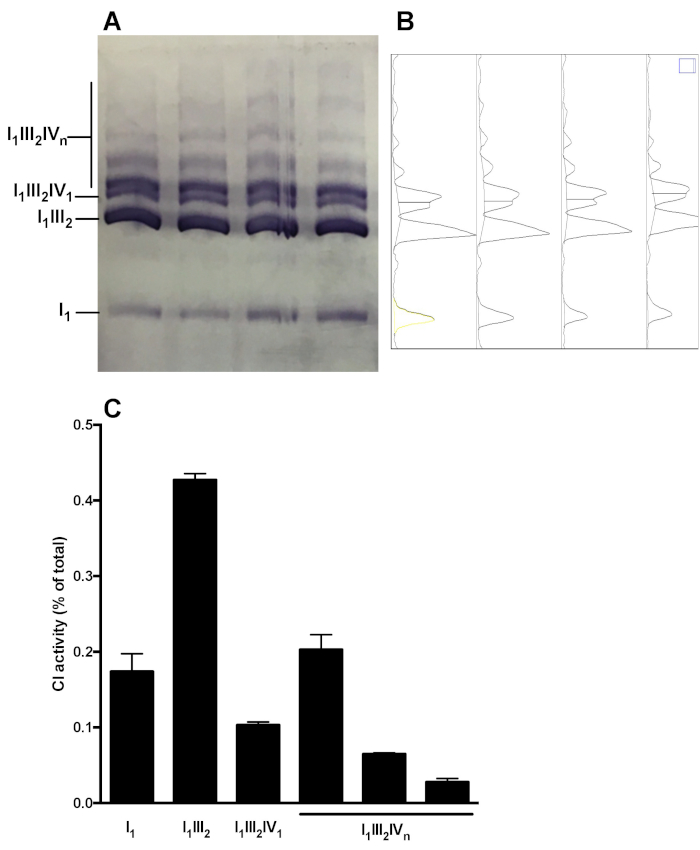
איור 5: קוונפיקציה של התפלגות CI בהרכבות monomeric ו סופרא מולקולרית. (א) הפעילות של CI ב-ג'ל נקבע לאחר היברידית CN/BN-עמוד של תמציות בכבד המיטוa SC שהתקבלו מ 4 עכברים. (ב) densitograms השיג באמצעות הכלי ניתוח ג'ל של imagej מראה פסגות ברורים המתאימים CI ונומרים (אני1) ושונים CI-המכיל מתחמי supraמולקולריים (i1iii2, אני1iii2IV1 , ואני1III2ו-n). (ג) קוונפיקציה של ההתפלגות היחסית של פעילות C1. הנתונים מייצגים ממוצע ו-SEM של 4 עכברים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| יחס דיגיטלי/חלבון (גר'/גר') | 2 g/g | 4 g/g | 6 g/g | 8 גר'/גר' |
| נפח של מאגר החילוץ (μL) | 400 | 300 | 200 | 100 |
| נפח של 10% הדיגיטלי מניות (μL) | 100 | 200 | 300 | 400 |
| סה כ נפח מאגר החילוץ (μL) | 500 | 500 | 500 | 500 |
טבלה 1: אמצעי אחסון הדרושים כדי לחלץ ה scs מ 5 מ ג של חלבונים מיטוכונדריאלי באמצעות יחסי הדיגיטלי/חלבון שונים.
| מתחם | ריכוז סופי |
| EDTA, pH 7.5 | 1 ממ ' |
| מיכל ביטון | 30 ממ ' |
| אשלגן אצטט | 150 ממ ' |
| גליצרול | 12 |
| 6-חומצה עמינח | 2 ממ ' |
שולחן 2: מאגר החילוץ SC (הריכוזים הסופיים). המשיכו ב -4 ° c במשך 3 חודשים לכל היותר.
| מתחם | ריכוז סופי |
| מאגר 3X ג'ל: המשך-20 ° c, pH 7.5 | |
| שנדורדול/הHCl pH-7.0 | 75 ממ ' |
| 6-חומצה עמינח | 1.5 מ ' |
| מאגר אקרילאמיד: המשך-20 ° c | |
| אקרילאמיד | 99.5% |
| Bis אקרילאמיד | 3 |
שולחן 3: מאגרי מניות ג'ל.
| עבור 2 ג ' לים: | 4% (60 mL) | 12% (60 mL) | הערמה (4%) (25 מ ל) |
| מאגר 3X ג'ל | 19.8 מ ל | 19.8 מ ל | 8.25 מ ל |
| מאגר אקרילאמיד | 4.8 מ ל | 14.4 מ ל | 2 מ ל |
| H2O | 35 מ ל | 13.1 מ ל | 14.6 מ ל |
| גליצרול | - | 12 מ ל | - |
| נקודות גישה 10% | 360 מיקרומטר | 60 מיקרומטר | 150 מיקרומטר |
| מיכל מטאד | 24 μL | 12 מיקרומטר | 10 מיקרומטר |
שולחן 4:4% – 12% ג'ל מעבר צבע.
| מתחם | ריכוז סופי |
| מאגר anode: לשמור על 4 ° c, pH 7.5 | |
| סרדאמיד | 25 ממ ' |
| מאגר קתודה: לשמור ב 4 ° c, pH 7.5 | |
| טריצין | 50 ממ ' |
| סרדאמיד | 7.5 ממ ' |
| עם או בלי Coomassie כחול כחול (G250) | 0.022% |
שולחן 5: מאגרי אלקטרופורזה.
| מתחם | ריכוז סופי |
| מורכב I פעילות מאגר: להכין טרי ב 5 מ mM טריס-HCl pH 7.4 | |
| ניטרוגליצרין כחול | 3 ממ ' |
| NADH | 14 ממ ' |
| מאגר הפעילות השנייה מורכבת: להכין טרי ב 5 מילימטר טריס-HCl pH 7.4 | |
| סוסואט | 20 ממ ' |
| PMSF | 0.2 ממ ' |
| ניטרוגליצרין כחול | 3 ממ ' |
| היחידה מורכבת הרביעי מאגר: להכין טרי ב 50 mM Na-פוספט pH 7.2 | |
| ציטוכרום C | 0.05 ממ ' |
| דיאמנואובאנדין | 2.3 ממ ' |
| מאגר פעילות Atpסטנדרטים: להכין טרי במים, להתאים את ה-pH כדי 8 עם קו | |
| גליצין | 50 ממ ' |
| מיכלהשני | 5 ממ ' |
| מיכל ביטון | 50 ממ ' |
| מיכל2 | 30 ממ ' |
| ATP | 5 ממ ' |
טבלה 6: מאגרי שיטת הפעילות בתוך-ג'ל.
| מתחם | ריכוז סופי |
| מאגר העברות | |
| בסיס טריס | 25 ממ ' |
| גליצין | 192 ממ ' |
| שירותי המשך | 4 |
| מתנול | 20 |
| מיכל הירקון | |
| בסיס טריס | 20 ממ ' |
| מיכל שלמה | 137 ממ ' |
| היחידה 20 | 0.1% |
שולחן 7: מאגרים הניתנים לדיכוי.
| מורכבים | יחידת | שיבוט |
| אני | NDUFA9 | מיכל בן-ציון |
| השני | מיכל ברכה | עדי שחורי |
| השלישי | UQCRC2 | עדי לוי |
| רביעי | COX4 | עדי כהן |
| V | היכל ה, ATPB | שלמה כהן |
שולחן 8: נוגדנים המשמשים לאיתור חיסוני לזהות שרשרת הנשימה SC. ראה טבלת חומרים לחברות ומספרים רבים.
Discussion
מתחמי מיטוכונדריאלי מתבקשים ללמוד באופן פעיל כדי להבהיר את תפקידם הפיזיולוגי, ואת חשיבותם בפתוגנזה של מחלות אנושיות רבות, בין אם הם נרכשים או מחלות מיטוכונדריאלי גנטיות3,7 , מיכל בן 10 , מיכל עשור , מיכל בן 11 , מיכל בן 12 , מיכל בן 13 , 14. על מנת לקבל תוצאות אמינות, יש לשקול מספר היבטים. פרוטוקול זה נבדק עם כבד העכבר המיטוa, שריר השלד השרירים של העכבר (תוצאות לא הראו), לב עכברוש המיטוa, והמיטופיברוסט האדם (תוצאות לא הראו), אבל בהחלט יכול להיות מותאם למקורות אחרים של מבודדים מיטוכונדריה. השיטה האופטימלית משלבת היבטים שונים של בסון ו-CN-PAGE פרוטוקולים, אשר מאפשרים להפחית את החשיפה לדטרגנטים ותרכובות anionic למינימום לעומת פרוטוקולים שפורסמו20,27,28.
הכנה לדוגמא
הכנה לדוגמה מייצגת צעד מכריע להפרדה מוצלחת של ה scs. מאגר הרכב צריך להיות נבחר בקפידה על מנת להשיג מסיסות הנכון של חלבונים וחלבונים הרכבות, תוך שמירה ככל האפשר שלהם פונקציונלי ושלמות מבנית. חוזק יונית ו-pH של מאגר החילוץ הם שני גורמים חשובים כדי לשקול. ריכוזי מלח כי הם נמוכים מדי (< 50 mM K-אצטט או הנאל) יגרום לפתרון עני של חלבונים בנוכחות של חומרי ניקוי לא יוניים, בעוד ריכוזי מלח מעל 500 מ"מ יקדם את הערימה/צבירה של חלבון, ומשקעים של CB ו חלבונים29. לפיכך, ה scs צריך להיות מחולץ באמצעות מאגרים בסמוך לחוזק הפיסיולוגי. ביחס ל-pH, השימוש ב-pH פיזיולוגי הקרוב מומלץ.
סוג חומרי ניקוי ויחס כביסה/חלבון הם גם קריטיים לחילוץ מיטבי של SC. לשימור מקסימלי של מה scs הילידים, הדיגיטלי הוא26מועדף. כפי שמוצג בפרוטוקול הנוכחי ושיטות אחרות שפורסמו23,30,31,32, זה ניקוי עדין משמר את הרכב סופרא מולקולרית של מספר הרכבות SC, ו dimeric ו מבנה oligomeric של ATPsynthase (איור 3 ואיור 4). טיטור של דגימות העניין עם כמויות שונות של הדיגיטלי הוא קריטי על מנת לזהות את התנאים המאפשרים מסיסות אופטימלית, תוך שמירה על פעילות אנזימים ואינטראקציות חלבונים פיזיולוגיים. הטיטור צריך להתבצע ביחס הנע בין 2 ל-8 g/g26. התוצאות האופטימליות עבור כבד, שריר השלד והמיטו, לב מתקבלים בהתאמה עם 4, 5, ו 6 g הדיגיטלי/g חלבון. יש לציין כי ניתן להחליף את הדיגיטלי על ידי טריטון X-100, אשר בתנאים מיטביים התוצאה היא הגירה דומה וקומפוזיציה SC כמו אלה שנצפו עם הדיגיטלי2. עם זאת, חומרי ניקוי זה צריך לשמש עם זהירות, מאז עלייה קטנה יחסית ביחס כביסה/חלבון (g., מ 1 עד 1.5 g/g) יכול לגרום לדיסוציאציה מלאה של ה scs מכלולים2, אשר יכול לגרום לחוסר עקביות ניסיוני. לאחר החילוץ, דגימות מצורפים באופן מסורתי עם coomassie כחול כדי לתת חלבונים חיוב כאשר מוחל על ג'ל, למעט CN-עמוד מסורתי20,26. כדי למזער את חשיפת החלבון כדי coomassie כחול ופוטנציאל דיסוציאציה של חלבונים יציב משך, דגימות לא יושלם עם coomassie כחול בפרוטוקול זה.
אלקטרופורזה
שני CN-PAGE ו-BN-עמוד שימשו לחקר מכלולי מיטוכונדריאלי OXPHOS, כל אחד מהם בעל יתרונות ומגבלות ברורים. התנאים הקלים ביותר המשמשים תחת CN-PAGE (בעיקר העדר של CB, אשר יש לו אפקט של חומרי ניקוי), מאפשר שימור טוב יותר של ATP סטנדרטים ב-ג'ל, ומגביל את הדיסוציאציה של חלבונים יציב משך במשקל מולקולרי גבוה ה scs ו-ATP סטנדרטים מכלולים26. עם זאת, העדר של הצבע האנייוני CB בתמצית החלבון ומאגרי האלקטרופורזה גורמים לחלבונים להגר בהתבסס על המטען הפנימי שלהם ונקודת איזואלקטריים, אשר מפחית את הניידות אלקטרופיניטית של חלבונים בתוך ג'ל26. יתר על כן, בהעדר CB, חלבונים עם חיוב שלילי מספיק נוטים לצבור, ובכך לצמצם את הרזולוציה של מכלולי חלבונים ב ג'ל20,26. כדי לעקוף מגבלות אלה, ה-CN-PAGE של הרזולוציה הגבוהה פותחה על ידי ויטטיג ו-שירי20. בפרוטוקול זה, הנתרן הדאואואואלי (DOC) וחומרי ניקוי שונים קלים בלתי-יוניים (DDM, טריטון X100) נוספים למאגר הקתודה לשמור על חלבונים הממברנה מסיסות ולהטיל משמרת שלילית על חלבונים, אשר התוצאות שיפור ניכר החלטה20.
תכונה ייחודית של פרוטוקול CN/BN היברידית הנוכחית היא שניתן להגיע לרזולוציה דומה ללא חומרי ניקוי אלה. תוספת רגעית של CB למאגר הקתודה בתחילת האלקטרופורזה מספיקה כדי להגביל את צבירת החלבון ולשפר את הניידות בג (איור 3 ואיור 4). כתוצאה מכך, טכניקה זו היברידית מאפשרת רזולוציה מעולה של הרכבות SC ברורים מאוד נמוך או לא חשיפה לדטרגנטים. הנוכחות של כמויות נמוכות של CB גם מאפשר שימור טוב יותר של קורות חיים, שימור משופר של dimeric ו oligomeric הרכבות קורות חיים (איור 3 ו ויטטיג ו schägger 200526), והפחתה של רעש הרקע הכחול שיכול ל לעכב את הקוונפיקציה של פעילויות ג'ל, במיוחד עבור CII ו-CIV (איור 2). יתר על כן, היעדר CB בתמצית חלבון מגביל את השיבוש של אינטראקציות חלבון יציב משך בתוך ה scs. לדוגמה, האגודה הפיזית של ה-ATP סטנדרטים עם נמלה כדי ליצור את הסטנדרטים 33 או עם ציקלופילב-D כדי להסדיר את הפתיחה ptp 34 הם נראים טוב יותר בהעדר CB. חשיפה רגעית ל-CB במהלך האלקטרופורזה בלבד יכול להיות שימושי כדי לחשוף את האינטראקציה הרומן חלבון בתוך ה scs. הכולל, זה היברידית CN/BN-PAGE פרוטוקול ובכך מאפשר לשלב באופן מדויק ומהיר מדידות פעילות ג'ל עם אנליטי טכניקות הקשורות לאלקטרופורזה דו-ממדית, לזיהוי הטיפול ב-ה scs ולניתוח מתקדם. יצוין כי עם הריבית הגוברת עבור ה scs, מספר גדל והולך של מחקרים להשתמש קטן 10 x 10 ג ' לים ס"מ עבור דף יליד. בעוד גישה זו עשויה להיות מספיקה כדי לזהות שינויים ברוטו בהרכבות השפע SC, קיבולת ההפרדה התחתונה של ג ' לים קטנים כנראה מוגבל כדי לפתור הסדרים מחדש עדין או לגזור להקות נפרדות עבור ניתוח פרוטמית. יתר על כן, מספר מחקרים באמצעות ג ' לים קטנים דיווחו כי הנשימות כמה נודד באותו גודל כמו Atpסטנדרטים dimer, מה שמקשה על הנתק אותם22. לכן, השימוש ג ' לים גדולים צריך להיות המועדף.
Disclosures
לא
Acknowledgements
המחברים רוצים להודות לג רוסי על סיוע טכני, וד ר מיכאיל ח'צ'ו, ד ר דוד פאטן וד ר יוואל אניל קומאר לדיון מועיל תוך כדי פיתוח שיטה זו. עבודה זו ממומנת על ידי המכונים הקנדיים של מחקר הבריאות (CIHR) ו הלאומית למדעים ומועצת ההנדסה של קנדה (NSERC). AC הוא חתן פרס הדוקטורט-פרדריק בנטינג ו צ'ארלס בסט מלגות בוגר קנדה (CIHR).
Materials
| Name | Company | Catalog Number | Comments |
| 3,3'-Diaminobenzidine tetra-hydrochloride hydrate | Sigma | D5637 | |
| 6-amino caproic acid | sigma | A2504 | |
| Acrylamide | Sigma | A3553 | |
| Adenosine 5'-triphosphate disodium salt hydrate | sigma | A3377 | |
| Anti-ATPB antibody [3D5] - Mitochondrial Marker | Abcam | ab14730 | Lot number GR3174539-12, RRID AB_301438 |
| Anti-SDHA antibody [2E3GC12FB2AE2] | Abcam | ab14715 | Lot number GR3235943-1, RRID AB_301433 |
| Anti-UQCRC2 antibody [13G12AF12BB11] | Abcam | ab14745 | Lot number GR304308-3, RRID AB_2213640 |
| Bis N,N'-Methylene-Bis-Acrylamide | Biorad | 1610201 | |
| Brilliant Blue G | Sigma | 27815 | |
| COX4 Monoclonal Antibody (1D6E1A8) | Invitrogen | 459600 | Lot number TI2637158, RRID AB_2532240 |
| Cytochrome c from equine heart | sigma | C7752 | |
| Digitonin | Sigma | D141 | |
| Fisherbrand FH100M Multichannel Peristaltic Pumps | Thermo Fisher | 13-310-660 | |
| Imidazole | Sigma | I0250 | |
| Inner Glass Plates. Pkg of 2, 20 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with outer plate | Biorad | 1651823 | |
| Model 485 Gradient Former. 40-175 ml acrylamide gradient former, includes valve stem and tubing kit, for use with Mini-PROTEAN multi-casting chamber systems | Biorad | 1654120 | |
| NDUFA9 Monoclonal Antibody (20C11B11B11) | Invitrogen | 459100 | Lot number TD2536591, RRID AB_2532223 |
| Nitrotetrazolium Blue chloride | Sigma | N6639 | |
| Outer Glass Plates. Pkg of 2, 22.3 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with inner plate | Biorad | 1651824 | |
| Phenylmethanesulfonyl floride | Sigma | P7626 | |
| Powerpack 1000 | Biorad | Serial Number 286BR 07171 | |
| PROTEAN II Sandwich Clamps. Pkg of 2, clamps for running gels, for 20 cm PROTEAN II xi electrophoresis cell, 1 left and 1 right | Biorad | 1651902 | |
| PROTEAN II xi Cell. Large format vertical electrophoresis cell, 16 x 20 cm gel size, 4 gel capacity, spacers and combs | Biorad | 1651811 | |
| PROTEAN II xi Comb. Pkg of 1, 15-well, 1.5 mm, comb for PROTEAN II xi electrophoresis cell | Biorad | 1651873 | |
| PROTEAN II xi Multi-Gel Casting Chamber. Multi-gel casting chamber, 20 x 20 cm gel size, for up to ten 1.5 mm thick gels, includes sealing plate, gasket, separation sheets, acrylic blocks, PROTEAN II XL alignment cards | Biorad | 1652025 | |
| PROTEAN II xi Spacers. Pkg of 4, 1.5 mm, spacers for 20 cm PROTEAN II xi electrophoresis cell | Biorad | 1651849 | |
| SCIENCEWARE Utility Bags (10 x 12") 4 mil, Bel-Art, Box of 100 | VWR | 11215-388 | |
| Thick Blot Paper. Pkg of 25 sheets, 15 x 20 cm, absorbent filter paper, for use with Trans-Blot cassette | Biorad | 1703956 | |
| Trans-Blot Cell With Plate Electrodes and Super Cooling Coil. Transfer cell and cooling coil (#170-3912), includes 2 gel holder cassettes, buffer tank, lid with cables, fiber pads, 1 pack blot paper | Biorad | 1703939 |
References
- Shagger, H. Respiratory Chain Supercomplexes. IUBMB Life. 52 (3-5), 119-128 (2001).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular Cell. 32 (4), 529-539 (2008).
- Greggio, C., et al. Enhanced Respiratory Chain Supercomplex Formation in Response to Exercise in Human Skeletal Muscle. Cell Metabolism. 25 (2), 301-311 (2017).
- Schagger, H., Pfeiffer, K. The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes. Journal of Biological Chemistry. 276 (41), 37861-37867 (2001).
- Milenkovic, D., Blaza, J. N., Larsson, N. G., Hirst, J. The Enigma of the Respiratory Chain Supercomplex. Cell Metabolism. 25 (4), 765-776 (2017).
- Acin-Perez, R., Enriquez, J. A. The function of the respiratory supercomplexes: the plasticity model. Biochimica et Biophysica Acta. 1837 (4), 444-450 (2014).
- Vartak, R., Porras, C. A., Bai, Y. Respiratory supercomplexes: structure, function and assembly. Protein Cell. 4 (8), 582-590 (2013).
- Lapuente-Brun, E., et al. Supercomplex Assembly Determines Electron Flux in the Mitochondrial Electron Transport Chain. Science. 340 (6140), 1567-1570 (2013).
- Lazarou, M., Smith, S. M., Thorburn, D. R., Ryan, M. T., McKenzie, M. Assembly of nuclear DNA-encoded subunits into mitochondrial complex IV, and their preferential integration into supercomplex forms in patient mitochondria. The FEBS Journal. 276 (22), 6701-6713 (2009).
- Sun, D., Li, B., Qiu, R., Fang, H., Lyu, J. Cell Type-Specific Modulation of Respiratory Chain Supercomplex Organization. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Aurelio, M., Gajewski, C. D., Lenaz, G., Manfredi, G. Respiratory chain supercomplexes set the threshold for respiration defects in human mtDNA mutant cybrids. Human Molecular Genetics. 15 (13), 2157-2169 (2006).
- Antoun, G., et al. Impaired mitochondrial oxidative phosphorylation and supercomplex assembly in rectus abdominis muscle of diabetic obese individuals. Diabetologia. 58 (12), 2861-2866 (2015).
- Kanaan, G. N., Patten, D. A., Redpath, C. J., Harper, M. -. E. Atrial Fibrillation Is Associated With Impaired Atrial Mitochondrial Energetics and Supercomplex Formation in Adults With Type 2 Diabetes. Canadian Journal of Diabetes. , (2018).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochimica et Biophysica Acta. 1862 (4), 741-753 (2016).
- McKenzie, M., Lazarou, M., Thorburn, D. R., Ryan, M. T. Mitochondrial Respiratory Chain Supercomplexes Are Destabilized in Barth Syndrome Patients. Journal of Molecular Biology. 361 (3), 462-469 (2006).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovascular Research. 80 (1), 30-39 (2008).
- Jang, S., et al. Elucidating Mitochondrial Electron Transport Chain Supercomplexes in the Heart During Ischemia-Reperfusion. Antioxidants & Redox Signaling. 27 (1), 57-69 (2017).
- Frenzel, M., Rommelspacher, H., Sugawa, M. D., Dencher, N. A. Ageing alters the supramolecular architecture of OxPhos complexes in rat brain cortex. Experimental Gerontology. 45 (7), 563-572 (2010).
- Krause, F. Detection and analysis of protein-protein interactions in organellar and prokaryotic proteomes by native gel electrophoresis: (Membrane) protein complexes and supercomplexes. Electrophoresis. 27 (13), 2759-2781 (2006).
- Wittig, I., Karas, M., Schagger, H. High Resolution Clear Native Electrophoresis for In-gel Functional Assays and Fluorescence Studies of Membrane Protein Complexes. Molecular Cell Proteomics. 6, 1215-1225 (2007).
- Wittig, I., Braun, H. P., Schagger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Jang, S., Javadov, S. Current Challenges in Elucidating Respiratory Supercomplexes in Mitochondria: Methodological Obstacles. Frontiers in Physiology. 9, 238-238 (2018).
- Cuillerier, A., et al. Loss of hepatic LRPPRC alters mitochondrial bioenergetics, regulation of permeability transition and trans-membrane ROS diffusion. Human Molecular Genetics. 26 (16), 3186-3201 (2017).
- Pallotti, F., Lenaz, G. . Methods in Cell Biology. 80, 3-44 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nature Protocols. 4, 1582 (2009).
- Wittig, I., Schägger, H. Advantages and limitations of clear-native PAGE. PROTEOMICS. 5 (17), 4338-4346 (2005).
- Jha, P., Wang, X., Auwerx, J. Analysis of Mitochondrial Respiratory Chain Supercomplexes Using Blue Native Polyacrylamide Gel Electrophoresis (BN-PAGE). Current Protocols in Mouse Biology. 6 (1), 1-14 (2016).
- Beutner, G., Porter, G. A. Analyzing Supercomplexes of the Mitochondrial Electron Transport Chain with Native Electrophoresis, In-gel Assays, and Electroelution. Journal of Visualized Experiments. (124), e55738 (2017).
- Von Hagen, J. . Proteomics Sample Preperation. , 485 (2008).
- Couoh-Cardel, S. J., Uribe-Carvajal, S., Wilkens, S., García-Trejo, J. J. Structure of dimeric F1F0-ATP synthase. The Journal of Biological Chemistry. 285 (47), 36447-36455 (2010).
- Strauss, M., Hofhaus, G., Schröder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO Journal. 27 (7), 1154-1160 (2008).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Wittig, I., Schägger, H. Structural organization of mitochondrial ATP synthase. Biochimica et Biophysica Acta - Bioenergetics. 1777 (7), 592-598 (2008).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proceedings of the National Academy of Sciences of the United Stated of America. 110 (15), 5887 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved