Method Article
Hybrid Clear/Blaue Elektrophorese für die Trennung und Analyse von Mitochondrialen Respiratory Chain Supercomplexen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, um mitochondriale Superkomplexe zu extrahieren, zu lösen und zu identifizieren, die die Exposition gegenüber Waschmitteln und Coomassie Blue minimieren. Dieses Protokoll bietet ein optimales Gleichgewicht zwischen der Auflösung und der Erhaltung von Enzymaktivitäten und minimiert gleichzeitig das Risiko, labile Wechselwirkungen mit Eiweißprotein zu verlieren.
Zusammenfassung
Komplexe der oxidativen Phosphorylies-Maschinerie bilden supramolekulare Proteinarrangements namens Superkomplexe (SCs), von denen angenommen wird, dass sie den Mitochondrien strukturelle und funktionelle Vorteile verleihen. SCs wurden in vielen Arten identifiziert, von Hefe bis Säugetieren, und eine wachsende Zahl von Studien berichten von einer Störung ihrer Organisation bei genetischen und erworbenen menschlichen Krankheiten. Infolgedessen sind immer mehr Labore daran interessiert, SCs zu analysieren, was methodisch eine Herausforderung darstellen kann. Dieser Artikel stellt ein optimiertes Protokoll vor, das die Vorteile von Blue-und Clear-Native PAGE-Methoden kombiniert, um SCs zeiteffektiv zu lösen und zu analysieren. Mit dieser Hybrid-CN/BN-PAGE-Methode werden mitochondriale SCs, die mit optimalen Mengen des milden Reinigungsmittels digitonin extrahiert werden, zu Beginn der Elektrophorese kurz dem anionischen Farbstoff Coomassie Blue (CB) ausgesetzt, ohne dass andere Waschmittel ausgesetzt sind. Diese kurze Exposition gegenüber CB ermöglicht es, SCs so effektiv wie bei herkömmlichen BN-PAGE-Methoden zu trennen und aufzulösen, während die negativen Auswirkungen hoher CB-Werte auf In-Gel-Aktivitätsuntersuchungen und labile Wechselwirkungen mit Eiweiß-Protein innerhalb von SCs vermieden werden. Mit diesem Protokoll ist es somit möglich, präzise und schnelle Gel-Aktivitätsmessungen mit Analysetechniken zu kombinieren, die 2D-Elektrophorese, Immundetektion, and/oder Proteomik für die fortgeschrittene Analyse von SCs beinhalten.
Einleitung
Mitochondrien erzeugen Energie durch oxidative Phosphorylierung, bei der die Atemkomplexe I-II-III-IV Substrate oxidieren und Elektronen auf Sauerstoff übertragen, wodurch ein Gefälle entsteht, das die Phosphorylierung von ADP durch die ATP-Synthase (CV) ermöglicht. In den vergangenen Jahren haben umfangreiche Studien gezeigt, dass Atemkettenkomplexe nicht nur linear in die innere mitochondriale Membran integriert werden, sondern auch in Superkomplexen (SCs)-Arrangements 1,2organisiert sind. In Säugetier-Mitochondrien gibt es SCs in verschiedenen stoichiometären Formen: CI/CIII 2/CIV 1-4 (das das Atemschutzasom genannt wird, und das zu NADHfähig ist: O2 Oxidorpädagogik in vitro) 2, CI/CIII 2 und CIII 2 /CIV1-23,4. Darüber hinaus werden die Atemwege unter verschiedenen Verhältnissen zwischen ihrer freien Form und den SCS-Arrangements verteilt. Daher wird geschätzt, dass 85% – 100% der CI, 55% – 65% des CIII und 15% – 25% der CIV in SCs4gefunden werden. Diese supramolekularen Strukturen sollen die ROS-Produktion verringern, die Produktion von Komplexen stabilisieren oder unterstützen, die Aktivität der Atemkette regulieren und die Proteinaggregation in der proteinreichen inneren Mitochondrien-Membran verhindern. ,6, 7,8. Ihre Umbaufähigkeit bei Schwankungen des Energiebedarfs und ihre Bedeutung bei der Krankheitserreger wird in mehreren Laboren3,7,9,10 untersucht. 11 , 12 , 13 , 14. Studien haben gezeigt, dass pathologische Veränderungen in der Zusammensetzung der SCs bei einer Vielzahl von Erkrankungen vorhanden sind, einschließlich, aber nicht beschränkt auf, genetischen Defekt in der Kardiolip-Synthese15, Herzinsuffizienz16, ischemia-reperfusion17, Diabetes12, und älter18.
Die Ureinwohner von Elektrophorese und Immundetektion werden in SCs Studien häufig verwendet, um die quaternärenAnordnungen derOXPHOS-Komplexe zu lösen 2,19, 20,21. Die Ureinwohner der Elektrophorese können auch mit spezifischen In-Gel-Aktivitätsuntersuchungen oder 2D-SDS PAGE kombiniert werden, um eine präzise molekulare Bestimmung der verschiedenen SCsBaugruppen1,19 zuermöglichen. Die Fähigkeit, SCs zu untersuchen, ist entscheidend abhängig von den Extraktionsbedingungen, einschließlich Art und Konzentration des verwendeten Reinigungsmittels, ionischer Stärke und pH-Wert, sowie von elektrophoretischen Migrationsbedingungen, die Pufferzusammensetzung, Anwesenheit von CB, Gel umfassen Größe, und Acrylamid Prozentsatz2.
Protokolle und SCs Bandauflösung variieren stark in den Papieren, was den Vergleich zwischen Studien und Anpassung von Methoden schwierig macht22. Daher schlägt dieses Papier ein robustes und optimales Protokoll vor, um SCs aus isolierten Mitochondrien verschiedener Quellen mit dem nicht-ionischen Waschmittel Digitonin zu extrahieren und hochmolekulare SC-Bänder zu lösen. Die optimierte Waschmittelkonzentration, die Zusammensetzung des Absaugpuffers und das Fehlen von Coomassie Blue bei der Probenvorbereitung minimieren die Störung von Proteinkomplexen. Dieses Protokoll (siehe Abbildung 1 für eine Übersicht) kombiniert CN-PAGE und BN-PAGE für eine optimale Auflösung von SCs Baugruppen auf großem Gel und ist kompatibel mit In-Gle-Aktivitäts-Assays, die eine bessere Visualisierung von Reaktionsbändern ermöglichen, zusammen mit dem Einsatz von Immundetektion für eine detaillierte Analyse SCs Arrangements und Zusammensetzung.
Protokoll
1. SC Extraktion
- Bereiten Sie 100 ml Extraktionspuffer (siehe Tabelle 2) vor, indem Sie EDTA im Wasser auflösen. Steigern Sie pH-Wert mit KOH bis zur vollständigen Auflösung, dann passen Sie pH auf 7,5 mit HCl. Fügen Sie die restlichen Komponenten der Lösung hinzu, die vollständig auf das endgültige Volumen mit Wasser, und halten Sie auf Eis. In einem Rohr, lösen Sie Digitonin im Extraktionspuffer auf, um eine 10% Lagerlösung zu machen, wirbeln Sie gründlich, bis sie vollständig aufgelöst sind, und halten Sie auf Eis.
Hinweis: Der Absaufferpuffer kann im Voraus aufbereitet und bei 4 ° C maximal 2 Monate aufbewahrt werden. Wenn Wellenbänder am Boden des Gels erscheinen, bedeutet das, dass der Extraktionspuffer zu alt ist. Bei der Vorbereitung der 10% Digitonin-Lösung, bereiten Sie ein Lagervolumen von 500 μL pro Probe, wenn Sie Mausleber Mitochondrien verwenden. Die Lösung des Digitonin variiert je nach Herkunft und Produktlot (siehe Materialtabelle). - Mitochondrien, die von tierischem Gewebe (Maus-Herz, Muskel, Leber; Rattenherz) oder Zellen (menschliches Fibroblast) mit Standardprotokollen 23,24,25 isoliert sind, können für die Extraktion von SCs verwendet werden. Sobald Mitochondrien erhalten sind, quantifizieren Sie den Proteingehalt mit dem Bicinchoninsäure-Assay-Kit nach den Empfehlungen des Herstellers. VerErgänzung isolierter Mitochondrien mit Proteasen und Phosphatasen-Inhibitoren bei Bedarf.
Hinweis: SCs können entweder auf frischen oder aufgetauten Mitochondrien extrahiert werden. Es wird empfohlen, SCs aus allen Proben gleichzeitig zu extrahieren, um sicherzustellen, dass sie mit den gleichen Lösungsmengen und unter den gleichen Bedingungen behandelt werden. - Basierend auf der gewonnenen mitochondrialen Proteinkonzentration und dem gewünschten endgültigen digitonin/Protein-Verhältnis wird das Volumen der nach Tabelle 1erforderlichen Bestands-Digitonin-Lösung und Extraktionspuffer berechnet. Für die SC-Extraktion, fügen Sie 1 μL Extraktionspuffer (Tabelle 2) mit Digitonin für je 10 μg mitochondriales Protein hinzu. Das Verhältnis digitonin/protein kann zwischen 2 und 8 g/g variieren. Für jede neue Art von Probe sollte immer eine Digitonin-Titation durchgeführt werden (siehe Abbildung 2 zum Beispiel).
- Pellechmitochondrien, in einem 1,5 mL-Rohr durch Zentrifugation bei 16.000 x g für 10 min bei 4 ° C.
- Discard-Supernatant und wieder aussetzen Sie das mitochondriale Pellet in dem berechneten Volumen der eiskalten Extraktionspuffer, die Digitonin enthält. Rohren auf einen Mini-Röhrendreher legen und bei mittlerer Drehzahl 30 min bei 4 ° C inkubieren. Achten Sie darauf, dass die Proben richtig gemischt werden.
- Zentrifugenproben mit 20.400 x g für 45 min bei 4 ° C, um unlösliche Fragmente zu entfernen.
- Übertragen Sie supernatant in ein neues Rohr auf Eis und quantifizieren Sie Proteine. Dieser Bruchteil stellt den Auszug der Atemschutz-Superkomplexe dar. Wenn die Elektrophorese nicht am selben Tag durchgeführt wird, lagern Sie Proben bei-80 ° C.
Hinweis: 1) Vermeiden Sie die Gefriere/Tauwaw-Zyklen des Extrakts, da dies die höheren molekularen Anordnungen von SCs stört. 2) Um ein Standard-SBN-PAGE-Experiment durchzuführen, sollte CB in diesem Schritt in den SCs-Extrakt aufgenommen werden. CB sollte in einem Verhältnis von 1 g/8g im Verhältnis zur Menge des verwendeten Reinigungsmittels hinzugefügt werden.
2. Gradientengel Casting und Elektrophorese
- Bereiten Sie 3x Gradientenpuffer und Acrylamid-Vorräte für die Herstellung des Gradientengels, Aliquot und speichern bei-20 ° C (siehe Tabelle 3).
- Anoden-und Kathodenpuffer zubereiten und bei 4 ° C halten (siehe Tabelle 5).
- Öffnen Sie die Gießkammer und legen Sie eine äußere Glasplatte (20 cm x 22 cm) in die Kammer. Positionieren Sie einen Satz von Abstandshaltern (1,5 mm) mit der Ausrichtungskarte, um sicherzustellen, dass sie fest an der Seite und den Ecken der Kammer sitzen. Legen Sie eine innere Glasplatte (20 cm x 20 cm) auf die Abstandshalter (dies bildet das Gel-Sandwich) und legen Sie eine Kunststoff-Trennplatte auf die Glasplatte.
- Wiederholen Sie den Schritt 2.3, bis die gewünschte Anzahl von Gelen erreicht ist. Für dieses Protokoll werden 4 Gele gegossen. Das von uns verwendete Gießkammersystem (siehe Materialtabelle) ermöglicht das Gießen von maximal 10 Gelen gleichzeitig. Nehmen Sie den restlichen Raum in der Kammer auf, indem Sie zunächst so viele Acrylblöcke wie nötig hinzufügen und bei Bedarf Glasplatten hinzufügen.
Achtung: Die Montage muss dicht besiegelt werden; Zwischen den Gel-Sandwiches in der Kammer sollte kein Platz sein. - Legen Sie einen Streifen Parafilm in den Rille, bevor Sie die Dichtung fest in die Dichtungskerne einlegen. Die Dichtplatte auf die Kammer legen und alle 6 Schrauben anziehen. Stehen Sie die Gießkammer.
- Den Steigbügel auf eine Rührplatte mit einem magnetischen Rührer in die "leichte" Mischkammer legen. Verbinden Sie die Schläuche der Gießkammer mit dem Gradientenformer, sichern Sie die Schläuche in der Kassette der Peristaltikpumpe und stellen Sie sicher, dass der Stopcock des Gradientenformer geschlossen ist.
- Um 4 Gele zu werfen, bereiten Sie 60 mL von 4% und 60 mL von 12% Gel-Lösungen (siehe Tabelle 4) in einer Erlenmeyer Flasche und wirbeln gründlich zu mischen. 60 ml von 4% Gel-Lösung in die "leichte" Mischkammer gießen, in der "schweren" Behälterkammer des Gradientenformer 60 mL von 12%. Bei 350 U/min wird die Umrührgeschwindigkeit der Rührplatte eingestellt. Öffnen Sie den Stophahn und schalten Sie die Pumpe um 35 U/min ein.
- Sobald die Lichtfraktion niedriger ist als die schwere Fraktion, die Pumpe zu unterbrechen und den Ventilstamm zwischen "leichten" und "schweren" Behältern zu öffnen, lassen Sie die Fraktionen volumenmäßig ausgleichen und starten Sie die Pumpe neu.
Achtung: Es ist wichtig, dass keine Blasen in das System gelangen und zwischen Glasplatten gefangen werden. Wenn dies geschieht, montage, waschen und redo. - Sobald das Gradientengel vollständig gegossen ist, stoppen Sie die Pumpe und überlagern Sie Wasser (ca. 1 ml) auf jedem Gel Sandwich, um das Austrocknen des Gels zu verhindern. Lassen Sie die Polymerisation für 2 h.
- 25 ml Stapelgel in Erlenmeyer zubereiten und durcheinander mischen. Wasser entfernen und 15 Brunnenkämme in jedes Gel-Sandwich einlegen. Stapelgel gießen und 2 Stunden polymeren lassen.
Achtung: Die Gels können gegossen und 1 Woche bei 4 ° C aufbewahrt werden. - Gel in Sandwich-Klemmen einlegen und Kamm entfernen. Mit der kurzen Glasplatte nach unten, das Gel-Sandwich in den Kühlkern einlegen. Wiederholen Sie auf der anderen Seite und legen Sie den Kern in den Elektrophorese-Tank.
- 300 ml Blauer Kathoden-Buffer in die innere Kammer des Elektrophorese-Tanks gießen. 2 L von Anode Buffer in der äußeren Kammer des Elektrophorese-Tanks.
Hinweis: Die Elektrode muss in Kathodenpuffer getaucht werden, was etwa 300 ml benötigt. - Belastung zwischen 75 μg und 175 μg Eiweiß pro Brunnen. Das Gel bei 150 V für 1,5 h (oder bis die Proben alle in das Gradientengel eingetragen sind) im kalten Raum (4 ° C) ausführen.
NOTE 1:1) Für eine gute Auflösung von In-Gel-Aktivitätsbändern ist ein Minimum von 75 μg pro Brunnen erforderlich. Die Verladung von über 175 μg Eiweiß führt zu einem Verlust von klaren Bändern durch übermäßige Enzymaktivität. 2) Die Replikate der Probe sollten in separaten Brunnen geladen werden, um eine parallele Bestimmung der In-Gel-Aktivitäten und eine Immunoblot-Analyse von OXPHOS-Komplexen zu ermöglichen. Die parallele Bestimmung von IGA für CI, CII, CIV und CV erfordert mindestens 300 μg. Die parallele Immunsobbarkeitsanalyse von CI, CII, CII, CIV und CV erfordert mindestens 375 μg. - Entfernen Sie den Blauen Kathoden-Buffer mit Pipette oder Vakuum, ersetzen Sie durch 300 mL Coomassie Blue-free Cathode Buffer, und führen Sie Gel bei 200 V Übernachtung (16 – 20 Uhr) im kalten Raum (4 ° C). Gehen Sie zu Schritt 3 oder 4 für In-Gel-Aktivitätsmessung oder Immunoblotting.
3. In-Gel-Aktivität für Complexes I, II, IV und CV
- Vor dem Ende der Elektrophorese, bereiten In-Gel-Aktivitätspuffer nach Tabelle 6, und halten Sie im Dunkeln bei RT. 20 mL der In-Gel-Aktivitätspuffer ist ausreichend für 3 Probenspuren.
NOTE: Dieser Lebenslauf-In-G-Aktivitäten-Test basiert auf der umgekehrten Aktivität von ATPsynthase (d.h. ATP-Hydrolyse) und verwendet Kalzium als Ko-Faktor, der im Gel ausfällt. Kalzium ist weniger schädlich als das Blei, das in anderen Protokollen verwendet wird. Darüber hinaus erfordert die Verwendung dieses Protokolls keine Voraktivierung des Gel23. - Stoppen Sie die Elektrophorese und holen Sie sich Gel. Schneiden Sie die Gassen, wenn nötig, und übertragen Sie Gel-Bahnen in Plastiktüten (3 Seiten geschnitten, und Plastiktüte wie ein Buch geöffnet). Siegel 2 der 3 Seiten mit einem Wärmeschutz.
Hinweis: Um die Zusammensetzung der SC-Bands zwischen experimentellen Gruppen zu vergleichen, empfiehlt es sich, die gleichen Samples in Replikaten auf dem gleichen Gel auszuführen. Schneiden Sie die Bahnen, um jedes Replikat in verschiedenen In-Gel-Aktivitätspuffern (CI, II, IV, V) zu inkubieren. Um die Spezifität der Assays zu bestätigen, können zusätzliche Replikate vorbereitet werden, um in Gel-Aktivitäten in Anwesenheit von spezifischen Atemketten-Inhibitoren laufen. - Für 3 experimentelle Proben (d.h. 3 Brunnen) 20 ml In-Gel-Aktivitätspuffer hinzufügen, Blasen entfernen und 4. Seite Plastikbeutel versiegeln.
Hinweis: Hemmer in negativen Kontrollexperimenten hinzufügen, wenn sie durchgeführt werden: CI: Rotenone 1 μM; CII: Natriummalonat 10 mM; CIII: Antimycin-A 8 μM; CIV: KCN 0,6 mM; Lebenslauf: Oligomycin 0,5 μM. - Die Inkubationszeiten bei 37 ° C in der Dunkelheit einblenden und alle 15 Minuten überprüfen. CI reagiert schneller als CIV oder CV. Optimale Färbung tritt in der Regel nach 2 Stunden bei CI, 4 Stunden für CIV und 6 Stunden für CII und CV auf.
- Spülen Sie Gelspuren im Wasser, um die Reaktion zu stoppen, und Bild auf einem weißen Hintergrund für CI, CII, CIV, oder schwarzen Hintergrund für CV.
Achtung: Gels können mehrere Monate in Plastiktüten bei RT oder 4 ° C aufbewahrt werden.
4. Immunoblotting
- Bereiten Sie den Transferpuffer nach Tabelle 7vor und halten Sie sich bei RT.
- Legen Sie das gesamte Gel oder ausgewählte Bahnen in einen Behälter und fügen Sie den Transfer-Puffer mit SDS (0,25% Finale im Transferpuffer) ergänzt. Behälter auf Rocker legen und 1 Stunde inkubieren.
- Schneiden Sie die PVDF-Membran (Größe entspricht der Größe des Gels) und aktivieren Sie in 20 ml Methanol unter Ragitation für 2 min. Ersetzen Sie durch 20 ml Transferpuffer und unter Rührung für 2 min.
- Bereiten Sie das Sandwich von unten nach oben vor, um sicherzustellen, dass es keine Blase zwischen Gel und aktivierter PVDF-Membran gibt: Klare Seite von Kassette/schwarzer Schwamm/Blotting Papier/Membran/Gel/Blotting Papier/schwarzer Schwamm/schwarze Seite der Kassette. Schließen Sie die Kassette und verschließen Sie sie.
- Legen Sie das Sandwich in den Transferbehälter, mit der klaren Seite des Sandwiches auf die rote Seite der Elektrode, und gießen Sie Transferpuffer, um das Gel zu tauchen. Verbinden Sie das Kühlsystem mit dem Transferbehälter und setzen Sie es bei 4 ° C. Verbinden Sie sich an die Stromversorgung, setzen Sie auf 40 mA und laufen Sie für 24 Stunden.
- Membranen abrufen, für 1 h in 5% BSA in TBST blockieren, und inkubieren in der primären Antikörper-Lösung in 5% BSA in TBST über Nacht bei 4 ° C.
Hinweis: Siehe Tabelle 8 für Antikörper, die verwendet werden. - Spülen Sie Membranen in TBST 3x für jeweils 10 min.
- Inkubate Membranen in sekundären Antikörper-Lösungen in 5% BSA in TBST für 2 h bei Raumtemperatur vorbereitet.
- Spülen Sie Membranen in TBST 3x für jeweils 10 min.
- Fügen Sie Membranen und Bild eine chemische Lösung hinzu.
5. Analyse
- Für die Analyse von SCs können In-Gel-Aktivitäts-Assay-Bilder oder Immunoblots verwendet werden. Um die Zusammensetzung der Bands zu analysieren, richten Sie Replikate aus und validieren Sie, welcher Komplex für jeden einzelnen Band positiv reagierte.
- Um die Verteilung der Komplexe in verschiedenen supramolekularen Baugruppen zu analysieren, öffnen Sie Bilder in ImageJ und verwenden Sie das Line-Analysewerkzeug (siehe Abbildung 5 zum Beispiel).
- Wählen Sie die Fahrspuren mit dem Rechteck-Werkzeug aus und zeichnen Sie die Fahrspuren.
- Zeichnen Sie Linien, um den Bereich unter der Kurve der einzelnen Bänder von Interesse zu schließen und klicken Sie auf jeden Bereich mit dem Zauber-Tool, um eine Tabelle mit dem Bereich unter den Kurvenwerten zu erzeugen.
- Um die Verteilung des Komplexes zu berechnen, melden Sie die Werte für jedes Band im Verhältnis zu denen des Monomers.
Ergebnisse
Abbildung 2 zeigt Ergebnisse eines Digitonin-Titation-Experiments, das darauf abzielt, die richtige Menge an Digitonin zu ermitteln, die für die Extraktion von SCs benötigt wird. Dieser Betrag variiert je nach Gewebe/Zelltyp und ob die Probe eingefroren wurde oder nicht. Für dieses Experiment wurde eine CIV In-G-Aktivität durchgeführt, um SCs zu visualisieren, die von frischen Maus-Lebermitochondrien isoliert wurden. Die Verhältnisse von 2/1 bis 10/1 g digitonin/g des Proteins wurden getestet. Die optimale Menge an Digitonin für diese Probe beträgt 4 g/g, da es eine gute Auflösung von monomeren CIV und hochmolekularen GSCs bietet. Bei geringerem Verhältnis sind Bänder nicht klar und lösen sich während der Elektrophorese zu einem Abstrich auf, während die Verwendung eines höheren Digitonin-Verhältnisses zu einer Störung des hochmolekularen Gewichts SC führt.
Abbildung 3 und Abbildung 4 zeigen die Ergebnisse eines kompletten Experiments, das an einem Präparat von Maus-Lebermitochondrien durchgeführt wurde, das mit 4 g digitonin/g Protein extrahiert wird. Die Proteine wurden mit Hybriden BN/CN-PAGE, Standard BN-PAGE oder CN-PAGE getrennt. Alle drei Gele wurden gleichzeitig gegossen und die Gassen waren mit Replikaten derselben Probe beladen. Nach der Elektrophorese wurden einzelne Fahrspuren geschnitten und für die Gel-Aktivitätsmessung (CI, CII, CIV und CV auf Abbildung 3) und Immunoblottting (CI, CII, CIII, CIV, CV auf Abbildung4) verarbeitet.
Die Zugabe von CB entweder momentan im Kathodenpuffer (z.B. Hybrid CN/BN-PAGE) oder im Proben-und Kathodenpuffer während der gesamten Elektrophorese (z.B. BN-PAGE) verbessert die Beweglichkeit und Auflösung von SC-Bändern und einzelnen Atemkomplexen erheblich. Im Vergleich zu CN-PAGE (Abbildung 3). Bänder sind nach der In-Gel-Aktivität für CIV leicht mit der Hybrid-Technik oder BN-PAGE zu unterscheiden, während in der gleichen Probe, die von CN-PAGE, SCs und monomeren CIV-Reaktionsbändern gelöst wird, nicht identifiziert werden kann.
Abbildung 3 und Abbildung 4 zeigen, dass das Auflösungs-und Bändermuster von OXPHOS-Monomeren und supramolekularen Baugruppen qualitativ vergleichbar ist zwischen Hybrid-CN/BN-PAGE und BN-PAGE. Es gibt jedoch bemerkenswerte Unterschiede. Erstens wird die elektrophoretische Beweglichkeit von OXPHOS-Komplexen leicht reduziert, wenn Proteine durch Hybrid-CN/BN-PAGE-Bedingungen gegenüber der Standard-BN-PAGE getrennt werden, was auf eine geringere Menge an CB zurückzuführen ist. Diese Mobilitätsverschiebung ist bei CIV-Monomeren, gefolgt von CV-Monomeren, und CI (Abbildung 3 und Abbildung4), größer. Zweitens ist der blaue Hintergrund im Hybrid CN/BN-PAGE niedriger als bei BN-PAGE (Abbildung3, linke Fahrspuren). Die Folge ist, dass hohe Hintergrundwerte nach BN-PAGE die In-Gel-Aktivitätsfärbung für CII vollständig verdecken und das Hintergrundgeräusch, das mit der Aktivität der CIV-Dimere verbunden ist, verstärken (Abbildung3). Drittens ist die Aktivität des Lebenslaufs höher, wenn Proben unter Hybrid-CN/BN-PAGE-Bedingungen laufen, verglichen mit BN-PAGE (Abbildung3), was auf die reduzierte Menge an CB zurückzuführen ist, die bekanntermaßen die CV-Katalytik stört. 26 CN/BN-PAGE ermöglicht auch eine bessere Konservierung von CV-Überbaugruppen, wie ein größerer Anteil der gesamten Lebenslauf-Aktivität zeigt, die mit CV-Dimern in Verbindung gebracht wird (Abbildung3). Darüber hinaus sind CV-Oligomere unter CN/BN-PAGE sichtbar, während sie unter BN-PAGE-Bedingungen komplett getrennt sind. Interessanterweise werden auch verschiedene Bänder beobachtet, die die CV-Aktivität anzeigen, und zwar zwischen CV-Monomeren und Dimern, wenn Proben unter CN/BN-PAGE laufen (Abbildung2).
Abbildung 5 zeigt eine repräsentative Analyse der komplexen OXPHOS-Komponentverteilung in supramolekularen Baugruppen. Das Bild zeigt CI in Gel-Aktivität von Proben, die aus 4 verschiedenen gesunden Maus-Leber-Mitochondrien-Präparaten gewonnen werden. Die Densitometrie-Analyse erlaubt es, das Gebiet unter der Kurve der CI-Reaktionsbänder zu messen und die relative Verteilung der C1-Aktivität in den monomeren (I1) und supramolekularen Formen(I1III 2, I1III 2 IV) darzustellen. 1, I1III2 IVn). Ähnliche Analysen können nach dem Immunoblot durchgeführt werden.
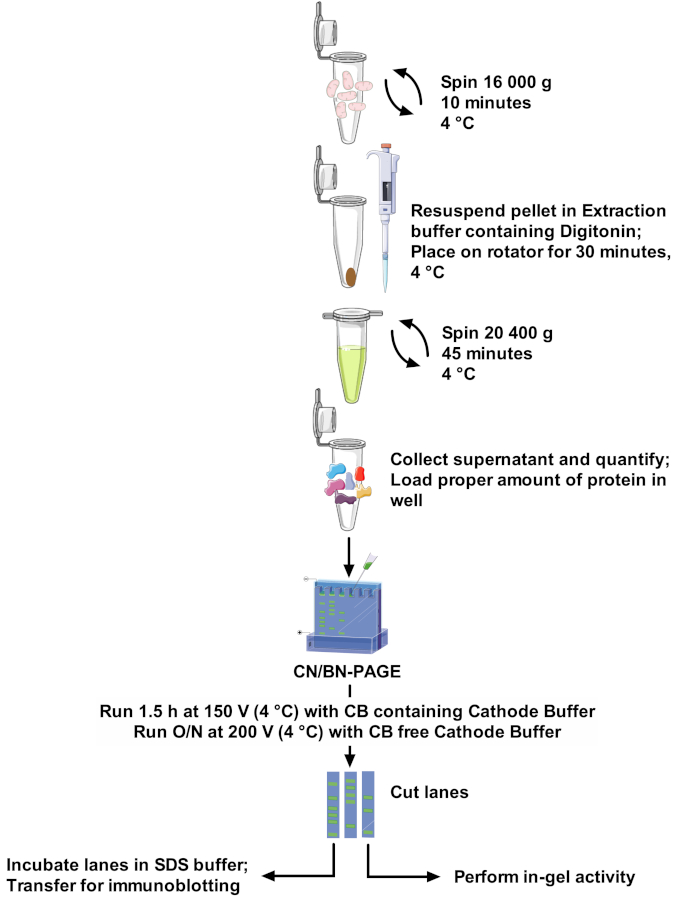
Abbildung 1: Den Arbeitsablauf bewerten. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
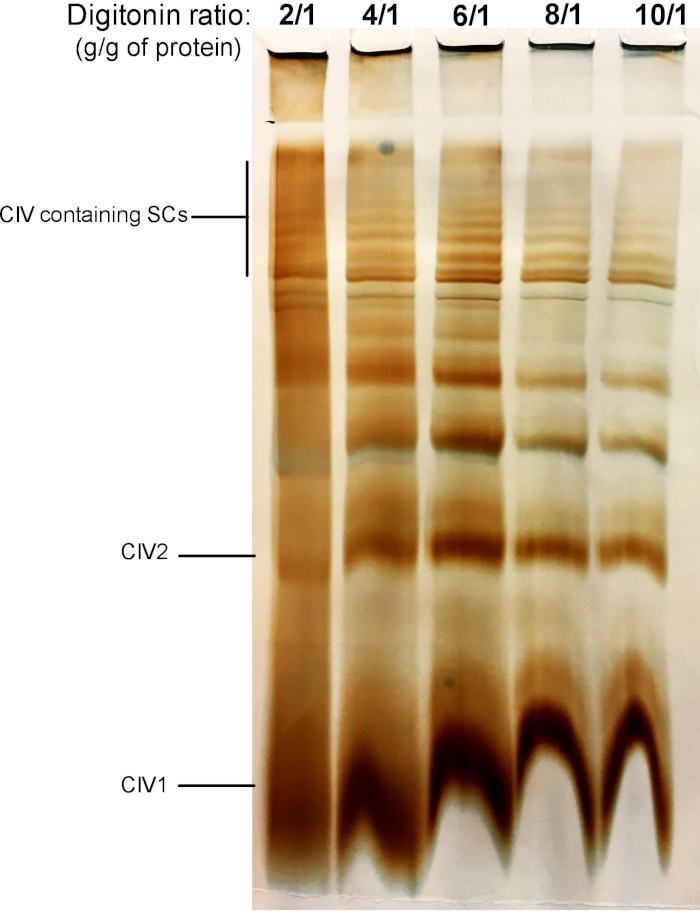
Abbildung 2: Digitonin-Titration, um Superkomplexe aus frischer Mauslebermitochondrien zu extrahieren. Dieses Beispiel zeigt Aliquots von Maus-Lebermitochondrien, isoliert von einem Tier, das mit zunehmender Menge an Digitonin behandelt wurde, um Atemschutz-Superkomplexe zu extrahieren. Die Proben wurden dann durch Hybrid CN/BN PAGE gelöst, und die In-Gel-Aktivität von CIV wurde bestimmt. CIV1:Komplex IV Monomere; CIV2: Komplex IV Dimmer; SC: Supercomplexes. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
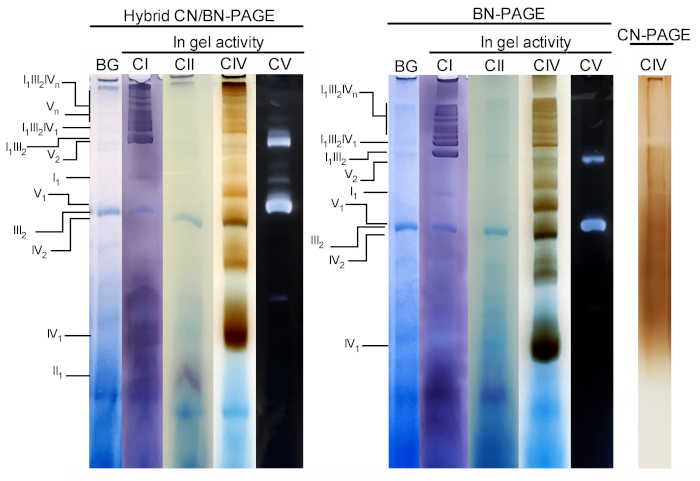
Abbildung 3: In-Gel-Aktivität von OXPHOS-Komplexen nach Hybrid-CN/BN-PAGE, BN-PAGE oder CN-PAGE. Lebermitochondrien, die von einer Maus isoliert wurden, wurden mit Digitonin (4 g ratio digotonin/protein) behandelt, um Atemschutz-Superkomplexe zu extrahieren. Aliquots dieser Probe wurden dann auf mehrere Brunnen in drei verschiedenen Gels geladen und bei CN/BN-PAGE, BN-PAGE oder CN-PAGE eingereicht. Jede Replikationsspur innerhalb jedes Gels wurde dann geschnitten und sofort für In-Gel-Aktivitätenuntersuchungen (mit KI, CII, CIV und CV) verwendet. Eine Fahrspur wurde als Steuerung verwendet, um die Färbung mit Coomassie Blue (mit der Bezeichnung BG) zu zeigen. OXPHOS-Komplexe und supramolekulare Baugruppen werden mit der Standard-Nomenklatur identifiziert, wobei die Zahlen in Indizes auf die molekulare Stoichiometrie jedes OXPHOS-Komplexes hinweisen. Es ist zu beachten, dass die Position der CIII-haltigen supramolekularen Baugruppen auf der Immundetektion basiert, da die In-Gel-Aktivität für CIII in diesem speziellen Experiment nicht durchgeführt wurde. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 4: Immunoblot-Analyse von OXPHOS-Komplexen nach Hybrid-CN/BN-PAGE oder BN-PAGE. Die in der Figure 3-Legende beschriebenen Experimente wurden auf eine einzige Membran übertragen. Nach der Übertragung wurden einzelne Fahrspuren geschnitten und mit spezifischen Antikörpern, die CI, CII, CIII, CIV und CV erkennen, bebrütet. OXPHOS-Komplexe und supramolekulare Baugruppen werden mit der Standard-Nomenklatur identifiziert, wobei die Zahlen in Indizes die Die molekulare Stoichiometrie jedes OXPHOS-Komplexes. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
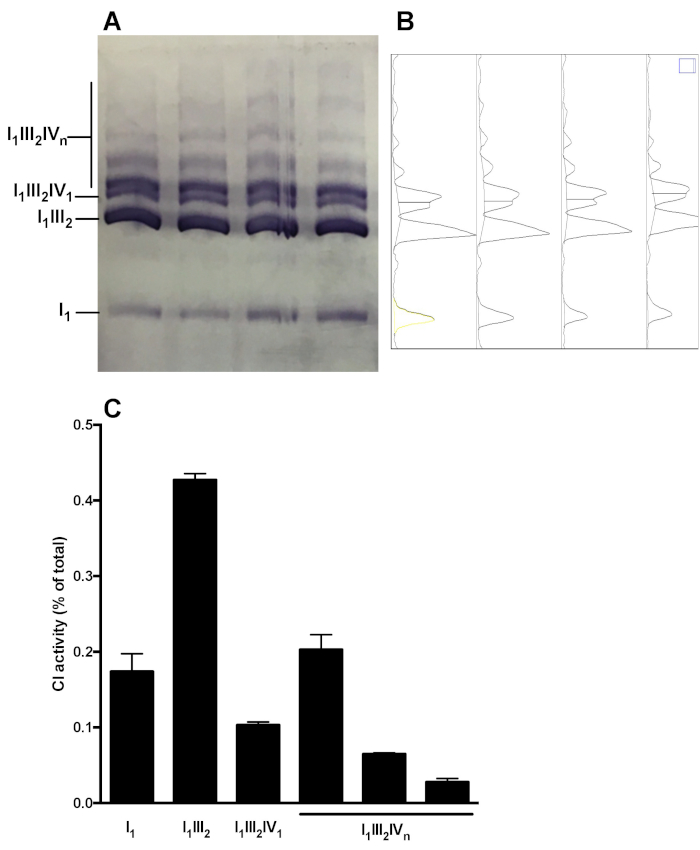
Abbildung 5: Quantifizierung der CI-Verteilung in monomeren und supramolekularen Baugruppen. A) CI-In-Gel-Aktivität nach Hybrid CN/BN-PAGE in Leber-Mitochondrien SC-Extrakten, die von 4 Mäusen gewonnen wurden. (B) Densitogramme, die mit ImageJ es Gel Analysis Tool gewonnen wurden, die deutliche Spitzen aufweisen, die KI-Monomeren (I1) und verschiedenen CI-haltigen supramolekularen Komplexenentsprechen (I 1 III 2, I1III 2 IV 1 , und I1III2 IVn). C) Quantifizierung der relativen Verteilung der C1-Aktivität. Die Daten stellen Mittel-und SEM-GESSEM der 4 Mäuse dar. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
| Digitonin/Protein-Verhältnis (g/g) | 2 g/g | 4 g/g | 6 g/g | 8 g/g |
| Volumen des Absaugpuffers (μL) | 400 | 300 | 200 | 100 |
| Volumen von 10% Lagerdigitonin (μL) | 100 | 200 | 300 | 400 |
| Gesamtabsaugpuffervolumen (μL) | 500 | 500 | 500 | 500 |
Tabelle 1: Volumes, die benötigt werden, um SCs aus 5 mg mitochondrialer Proteine zu extrahieren, wobei verschiedene digitonin/Protein-Verhältnisse verwendet werden.
| umzäuntes grundstück | Letzte Konzentration |
| EDTA, pH 7,5 | 1 mM |
| HEPES | 30 mM |
| Kaliumaktivität | 150 mM |
| Glycerin | 12 Prozent |
| 6-aminocaproic Säure | 2 mM |
Tabelle 2: SC-Absaugpuffer (Endkonzentrationen). Bei 4 ° C maximal 3 Monate halten.
| umzäuntes grundstück | Letzte Konzentration |
| 3X Gel Buffer: Aliquot und bei-20 ° C, pH 7,5 | |
| Imidazole/HCl pH-7.0 | 75 mM |
| 6-aminocaproic Säure | 1,5 M |
| Acrylamid-Puffer: Aliquot und bei-20 ° C halten | |
| Acrylamid | 99,5 Prozent |
| Bis-Acrylamid | 3 Prozent |
Tabelle 3: Gel-Stockpuffer.
| Für 2 Gele: | 4% (60 mL) | 12% (60 mL) | Stapeln (4%) (25 mL) |
| 3X Gel Buffer | 19,8 mL | 19,8 mL | 8.25 mL |
| Acrylamid-Buffer | 4,8 mL | 14,4 mL | 2 mL |
| H2O | 35 mL | 13,1 mL | 14,6 mL |
| Glycerin | - | 12 mL | - |
| APS 10% | 360 μL | 60 μL | 150 μL |
| TEMED | 24 μL | 12 μL | 10 μL |
Tabelle 4:4% – 12% Gradientengel.
| umzäuntes grundstück | Letzte Konzentration |
| Anode Buffer: Halten Sie bei 4 ° C, pH 7,5 | |
| Imidazole | 25 mM |
| Kathode Buffer: Halten Sie bei 4 ° C, pH 7,5 | |
| Tricine | 50 mM |
| Imidazole | 7,5 mM |
| Mit oder ohne Coomassie Blue (G250) | 0,22 Prozent |
Tabelle 5: Elektrophorese-Puffer.
| umzäuntes grundstück | Letzte Konzentration |
| Komplexe I Aktivität Buffer: Bereiten Sie frisch in 5 mM TRIS-HCl pH 7.4 | |
| Nitrotetrazoliumblau | 3 mM |
| Nadh | 14 mM |
| Komplexe II-Aktivität Buffer: Bereiten Sie frisch in 5 mM TRIS-HCl pH 7.4 | |
| Succinat | 20 mM |
| PMSF | 0,2 mM |
| Nitrotetrazoliumblau | 3 mM |
| Komplexe IV-Aktivität Buffer: Bereiten Sie frisch in 50 mM Na-Phosphat pH 7,2 | |
| Cytochrom C | 0.05 mM |
| Diaminobenzidin | 2,3 mM |
| ATPsynthase Aktivität Buffer: Frisch im Wasser zubereiten, pH-Wert auf 8 mit KOH einstellen | |
| Glycin | 50 mM |
| MgCl2 | 5 mM |
| HEPES | 50 mM |
| CaCl2 | 30 mM |
| Atp | 5 mM |
Tabelle 6: Assay-Puffer in Gel-Aktivität.
| umzäuntes grundstück | Letzte Konzentration |
| Transfer-Buffer | |
| Tris Base | 25 mM |
| Glycin | 192 mM |
| Sds | 4 Prozent |
| Methanol | 20 Prozent |
| Tbst | |
| Tris Base | 20 mM |
| Nacl | 137 mM |
| Zwischen 20 | 0,1 Prozent |
Tabelle 7: Immunoblotting-Puffer.
| Komplex | Untereinheit | klonieren |
| Ich | NUFA9 | 20C11B11B11 |
| Ii | SDHA | 2E3GC12FB2AE2 |
| Iii | UQCRC2 | 13G12AF12BB11 |
| Iv | COX4 | 1D6E1A8 |
| gegen | ATPB | 3D5 |
Tabelle 8: Antikörper, die für die Immunoblotting verwendet werden, um die Atemkette SC zu erkennen. Siehe Materialliste für Unternehmen und Losnummern.
Diskussion
Mitochondriale Superkomplexe werden aktiv untersucht, um ihre physiologische Rolle und ihre Bedeutung für die Pathogenese zahlreicher menschlicher Krankheiten zu klären, ob sie nun erworben werden oder genetische Mitochondrien-Erkrankungen 3, 7 , 9 , 10 , 11 , 12 , 13 , 14. Um verlässliche Ergebnisse zu erzielen, sind mehrere Aspekte zu berücksichtigen. Dieses Protokoll wurde mit Maus Leber Mitochondrien, Maus Skelett-Muskel Mitochondrien (Ergebnisse nicht gezeigt), Ratte Herz Mitochondrien, und menschliche Fibroblast Mitochondrien (Ergebnisse nicht gezeigt) getestet, könnte aber sicherlich an andere Quellen der isolierten angepasst werden Mitochondrien. Die Methode kombiniert optimal verschiedene Aspekte von BN und CN-PAGE-Protokollen, die es ermöglichen, die Exposition gegenüber Waschmitteln und anionischen Verbindungen im Vergleich zu den veröffentlichten Protokollen 20,27, 28aufein Minimum zu reduzieren.
Probenvorbereitung
Die Probenvorbereitung ist ein entscheidender Schritt für die erfolgreiche Trennung von SCs. Die Pufferzusammensetzung sollte sorgfältig ausgewählt werden, um eine angemessene Lösung von Proteinen und Protein-Baugruppen zu erreichen und dabei so viel wie möglich ihre funktionelle Und strukturelle Integrität. Ionische Stärke und pH-Wert des Absaugpuffers sind zwei wichtige Faktoren, die es zu berücksichtigen gilt. Salzkonzentrationen, die zu niedrig sind (< 50 mM K-Acetat oder NaCl), führen zu einer schlechten Lösungsansammlung von Proteinen in Anwesenheit von nicht-ionischen Reinigungsmitteln, während Salzkonzentrationen über 500 mM die Proteinstapfung und Niederschlag von CB fördern und Proteine 29. Die SCs sollten daher mit Puffern in nahezu physiologischer Ionenstärke extrahiert werden. Im Hinblick auf den pH-Wert wird die Verwendung eines nahezu physiologischen pH-Wertes empfohlen.
Auch das Verhältnis von Waschmitteltyp und Waschmittel-/Proteinverhältnis sind für eine optimale SC-Extraktion entscheidend. Für die maximale Konservierung von nativen SCs wird Digitonin bevorzugt 26. Wie im vorliegenden Protokoll und anderen veröffentlichten Methoden23,30,31, 32gezeigt, bewahrt dieses milde Reinigungsmittel die supramolekulare Zusammensetzung mehrerer SC-Versammlungen und die dimerische und Oligomomerische Struktur der ATPsynthase(Abbildung 3 und Abbildung4). Die Bezifferung der Proben von Interesse mit verschiedenen Mengen von digitonin ist entscheidend, um die Bedingungen zu identifizieren, die eine optimale Lösungsfähigkeit ermöglichen, während die Enzymaktivität und physiologische Proteininteraktionen erhalten bleiben. Die Titration sollte mit Verhältnissen zwischen 2 und 8 g/g 26 durchgeführtwerden. Optimale Ergebnisse für Leber-, Skelettmuskulatur und Herz-Mitochondrien werden jeweils mit 4, 5 und 6 g digitonin/Protein erzielt. Es ist zu beachten, dass Digitonin durch Triton X-100 ersetzt werden kann, was unter optimalen Bedingungen zu einer ähnlichen Migration und SC-Komposition führt wie bei digitonin 2. Dieses Waschmittel sollte jedoch mit Vorsicht eingesetzt werden, da ein relativ geringer Anstieg des Reinigungsmittel-Protein-Verhältnisses (z.B. von 1 auf 1,5 g/g) zu einer vollständigen Distanzierung von SCs Baugruppen2führen kann, was zu experimentellen Ungereimtheiten führen kann. Nach der Extraktion werden die Proben traditionell mit Coomassie Blue ergänzt, um Proteinen eine Ladung zu geben, wenn sie auf das Gel aufgetragen wird, mit Ausnahme der traditionellen CN-PAGE20,26. Um die Proteinbelastung bei Coomassie blue und die mögliche Dissoziation von labilen Proteinen zu minimieren, werden die Proben in diesem Protokoll nicht mit Coomassie blue ergänzt.
Elektrophorese
Sowohl CN-PAGE als auch BN-PAGE wurden für die Untersuchung von mitochondrialen OXPHOS-Komplexen verwendet, die jeweils unterschiedliche Vorteile und Einschränkungen aufweisen. Die milderen Bedingungen, die unter CN-PAGE verwendet werden (vor allem das Fehlen von CB, das eine waschgleidige Wirkung hat), ermöglichen eine bessere Konservierung der ATP-Synthase In-Gel-Aktivität und begrenzen die Dissoziation von labilen Proteinen in hochmolekularen SCs und ATP-Synthase. Versammlungen26. Das Fehlen des anionischen Farbstoffs CB im Proteinextrakt und Elektrophorese-Puffer führt jedoch dazu, dass die Proteine aufgrund ihrer intrinsischen Ladung und ihres isoelektrischen Punktes wandern, was die elektrophoretische Beweglichkeit der Proteine innerhalb des Gel26reduziert. Darüber hinaus neigen Proteine mit unzureichender negativer Belastung in Ermangelung von CB dazu, sich zu sammeln, wodurch die Auflösung von Proteinkomplexen im Gel20,26reduziert wird. Um diese Einschränkungen zu umgehen, wurde die sogenannte hochauflösende CN-PAGE von Wittig und Schragger20entwickelt. In diesem Protokoll werden Natriumdeoxycholat (DOC) und verschiedene milde nicht-ionische Reinigungsmittel (DDM, Triton X100) in den Kathodenpuffer aufgenommen, um Membranproteine löslich zu halten und eine negative Ladungsverschiebung auf Proteine zu erzwingen, was zu einer erheblichen Verbesserung führt. Resolution20.
Das Besondere an dem vorliegenden Hybrid-CN/BN-Protokoll ist, dass ohne diese Waschmittel eine vergleichbare Auflösung erreicht werden kann. Die Momentinhalte des CB zum Kathodenpuffer zu Beginn der Elektrophorese reichen aus, um die Proteinaggregation zu begrenzen und die Beweglichkeit im Gel zuerhöhen (Abbildung 3 und Abbildung 4). Dadurch ermöglicht diese Hybridtechnik eine hervorragende Auflösung von unterschiedlichen SC-Assemblies und eine sehr geringe oder keine Belastung durch Waschmittel. Das Vorhandensein von geringen Mengen von CB ermöglicht auch eine bessere Erhaltung der Lebenslauf-Aktivität, eine bessere Erhaltung der dimerischen und oligomeren Lebenslauf-Versammlungen (Abbildung 3 und Wittig und Schägger 200526), und eine Verringerung der blauen Hintergrundgeräusche, die kann Die Quantifizierung von Gel-Aktivitäten, insbesondere für CII und CIV, wird behindert (Abbildung 2). Darüber hinaus schränkt das Fehlen von CB im Proteinextrakt die Störung von labilen Proteininteraktionen innerhalb von SCs ein. So ist beispielsweise die physikalische Assoziation der ATP-Synthase mit ANT zum Synthasom 33 oder mit Cyclophilin-D zur Regulierung der PTP-Öffnung 34 in Abwesenheit von CB besser zu sehen. Eine geringe Exposition gegenüber CB während der Elektrophorese kann daher nur nützlich sein, um neue Proteininteraktionen innerhalb von SCs aufzudecken. Insgesamt ermöglicht dieses hybride CN/BN-PAGE-Protokoll somit, präzise und schnelle In-Gel-Aktivitätsmessungen mit analytischen zu kombinieren. Techniken mit 2D-Elektrophorese, Immundetektion und/oder Proteomik für die fortgeschrittene Analyse von SCs. Es ist zu beachten, dass mit dem wachsenden Interesse an SCs immer mehr Studien kleine 10 x 10 cm-Gele für einheimische PAGE verwenden. Während dieser Ansatz ausreichen kann, um grobe Veränderungen in den Überflutungs-SC-Versammlungen zu identifizieren, ist die geringere Trennungskapazität von kleinen Gelen wahrscheinlich begrenzt, um subtile Umgestaltungen zu lösen oder verschiedene Bänder für proteomische Analyse zu schneiden. Darüber hinaus haben mehrere Studien mit kleineren Gelen berichtet, dass das Atemschutzgerät in der gleichen Größe wie der ATPsynthase-Dimmer wandert, was es schwierig macht,sie zu trennen 22. Daher sollte der Einsatz von großen Gelen begünstigt werden.
Offenlegungen
nichts
Danksagungen
Die Autoren danken Jenna Rossi für die technische Unterstützung und Dr. Mireille Khacho, Dr. David Patten und Dr. Ujval Anil Kumar für die hilfreiche Diskussion bei der Entwicklung dieser Methode. Diese Arbeit wurde von den Canadian Institutes of Health Research (CIHR) und dem National Sciences and Engineering Council of Canada (NSERC) finanziert. AC ist Preisträger des Doktorandenpreises-Frederick Banting und Charles Best Canada Graduate Scholarships (CIHR).
Materialien
| Name | Company | Catalog Number | Comments |
| 3,3'-Diaminobenzidine tetra-hydrochloride hydrate | Sigma | D5637 | |
| 6-amino caproic acid | sigma | A2504 | |
| Acrylamide | Sigma | A3553 | |
| Adenosine 5'-triphosphate disodium salt hydrate | sigma | A3377 | |
| Anti-ATPB antibody [3D5] - Mitochondrial Marker | Abcam | ab14730 | Lot number GR3174539-12, RRID AB_301438 |
| Anti-SDHA antibody [2E3GC12FB2AE2] | Abcam | ab14715 | Lot number GR3235943-1, RRID AB_301433 |
| Anti-UQCRC2 antibody [13G12AF12BB11] | Abcam | ab14745 | Lot number GR304308-3, RRID AB_2213640 |
| Bis N,N'-Methylene-Bis-Acrylamide | Biorad | 1610201 | |
| Brilliant Blue G | Sigma | 27815 | |
| COX4 Monoclonal Antibody (1D6E1A8) | Invitrogen | 459600 | Lot number TI2637158, RRID AB_2532240 |
| Cytochrome c from equine heart | sigma | C7752 | |
| Digitonin | Sigma | D141 | |
| Fisherbrand FH100M Multichannel Peristaltic Pumps | Thermo Fisher | 13-310-660 | |
| Imidazole | Sigma | I0250 | |
| Inner Glass Plates. Pkg of 2, 20 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with outer plate | Biorad | 1651823 | |
| Model 485 Gradient Former. 40-175 ml acrylamide gradient former, includes valve stem and tubing kit, for use with Mini-PROTEAN multi-casting chamber systems | Biorad | 1654120 | |
| NDUFA9 Monoclonal Antibody (20C11B11B11) | Invitrogen | 459100 | Lot number TD2536591, RRID AB_2532223 |
| Nitrotetrazolium Blue chloride | Sigma | N6639 | |
| Outer Glass Plates. Pkg of 2, 22.3 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with inner plate | Biorad | 1651824 | |
| Phenylmethanesulfonyl floride | Sigma | P7626 | |
| Powerpack 1000 | Biorad | Serial Number 286BR 07171 | |
| PROTEAN II Sandwich Clamps. Pkg of 2, clamps for running gels, for 20 cm PROTEAN II xi electrophoresis cell, 1 left and 1 right | Biorad | 1651902 | |
| PROTEAN II xi Cell. Large format vertical electrophoresis cell, 16 x 20 cm gel size, 4 gel capacity, spacers and combs | Biorad | 1651811 | |
| PROTEAN II xi Comb. Pkg of 1, 15-well, 1.5 mm, comb for PROTEAN II xi electrophoresis cell | Biorad | 1651873 | |
| PROTEAN II xi Multi-Gel Casting Chamber. Multi-gel casting chamber, 20 x 20 cm gel size, for up to ten 1.5 mm thick gels, includes sealing plate, gasket, separation sheets, acrylic blocks, PROTEAN II XL alignment cards | Biorad | 1652025 | |
| PROTEAN II xi Spacers. Pkg of 4, 1.5 mm, spacers for 20 cm PROTEAN II xi electrophoresis cell | Biorad | 1651849 | |
| SCIENCEWARE Utility Bags (10 x 12") 4 mil, Bel-Art, Box of 100 | VWR | 11215-388 | |
| Thick Blot Paper. Pkg of 25 sheets, 15 x 20 cm, absorbent filter paper, for use with Trans-Blot cassette | Biorad | 1703956 | |
| Trans-Blot Cell With Plate Electrodes and Super Cooling Coil. Transfer cell and cooling coil (#170-3912), includes 2 gel holder cassettes, buffer tank, lid with cables, fiber pads, 1 pack blot paper | Biorad | 1703939 |
Referenzen
- Shagger, H. Respiratory Chain Supercomplexes. IUBMB Life. 52 (3-5), 119-128 (2001).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular Cell. 32 (4), 529-539 (2008).
- Greggio, C., et al. Enhanced Respiratory Chain Supercomplex Formation in Response to Exercise in Human Skeletal Muscle. Cell Metabolism. 25 (2), 301-311 (2017).
- Schagger, H., Pfeiffer, K. The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes. Journal of Biological Chemistry. 276 (41), 37861-37867 (2001).
- Milenkovic, D., Blaza, J. N., Larsson, N. G., Hirst, J. The Enigma of the Respiratory Chain Supercomplex. Cell Metabolism. 25 (4), 765-776 (2017).
- Acin-Perez, R., Enriquez, J. A. The function of the respiratory supercomplexes: the plasticity model. Biochimica et Biophysica Acta. 1837 (4), 444-450 (2014).
- Vartak, R., Porras, C. A., Bai, Y. Respiratory supercomplexes: structure, function and assembly. Protein Cell. 4 (8), 582-590 (2013).
- Lapuente-Brun, E., et al. Supercomplex Assembly Determines Electron Flux in the Mitochondrial Electron Transport Chain. Science. 340 (6140), 1567-1570 (2013).
- Lazarou, M., Smith, S. M., Thorburn, D. R., Ryan, M. T., McKenzie, M. Assembly of nuclear DNA-encoded subunits into mitochondrial complex IV, and their preferential integration into supercomplex forms in patient mitochondria. The FEBS Journal. 276 (22), 6701-6713 (2009).
- Sun, D., Li, B., Qiu, R., Fang, H., Lyu, J. Cell Type-Specific Modulation of Respiratory Chain Supercomplex Organization. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Aurelio, M., Gajewski, C. D., Lenaz, G., Manfredi, G. Respiratory chain supercomplexes set the threshold for respiration defects in human mtDNA mutant cybrids. Human Molecular Genetics. 15 (13), 2157-2169 (2006).
- Antoun, G., et al. Impaired mitochondrial oxidative phosphorylation and supercomplex assembly in rectus abdominis muscle of diabetic obese individuals. Diabetologia. 58 (12), 2861-2866 (2015).
- Kanaan, G. N., Patten, D. A., Redpath, C. J., Harper, M. -. E. Atrial Fibrillation Is Associated With Impaired Atrial Mitochondrial Energetics and Supercomplex Formation in Adults With Type 2 Diabetes. Canadian Journal of Diabetes. , (2018).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochimica et Biophysica Acta. 1862 (4), 741-753 (2016).
- McKenzie, M., Lazarou, M., Thorburn, D. R., Ryan, M. T. Mitochondrial Respiratory Chain Supercomplexes Are Destabilized in Barth Syndrome Patients. Journal of Molecular Biology. 361 (3), 462-469 (2006).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovascular Research. 80 (1), 30-39 (2008).
- Jang, S., et al. Elucidating Mitochondrial Electron Transport Chain Supercomplexes in the Heart During Ischemia-Reperfusion. Antioxidants & Redox Signaling. 27 (1), 57-69 (2017).
- Frenzel, M., Rommelspacher, H., Sugawa, M. D., Dencher, N. A. Ageing alters the supramolecular architecture of OxPhos complexes in rat brain cortex. Experimental Gerontology. 45 (7), 563-572 (2010).
- Krause, F. Detection and analysis of protein-protein interactions in organellar and prokaryotic proteomes by native gel electrophoresis: (Membrane) protein complexes and supercomplexes. Electrophoresis. 27 (13), 2759-2781 (2006).
- Wittig, I., Karas, M., Schagger, H. High Resolution Clear Native Electrophoresis for In-gel Functional Assays and Fluorescence Studies of Membrane Protein Complexes. Molecular Cell Proteomics. 6, 1215-1225 (2007).
- Wittig, I., Braun, H. P., Schagger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Jang, S., Javadov, S. Current Challenges in Elucidating Respiratory Supercomplexes in Mitochondria: Methodological Obstacles. Frontiers in Physiology. 9, 238-238 (2018).
- Cuillerier, A., et al. Loss of hepatic LRPPRC alters mitochondrial bioenergetics, regulation of permeability transition and trans-membrane ROS diffusion. Human Molecular Genetics. 26 (16), 3186-3201 (2017).
- Pallotti, F., Lenaz, G. . Methods in Cell Biology. 80, 3-44 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nature Protocols. 4, 1582 (2009).
- Wittig, I., Schägger, H. Advantages and limitations of clear-native PAGE. PROTEOMICS. 5 (17), 4338-4346 (2005).
- Jha, P., Wang, X., Auwerx, J. Analysis of Mitochondrial Respiratory Chain Supercomplexes Using Blue Native Polyacrylamide Gel Electrophoresis (BN-PAGE). Current Protocols in Mouse Biology. 6 (1), 1-14 (2016).
- Beutner, G., Porter, G. A. Analyzing Supercomplexes of the Mitochondrial Electron Transport Chain with Native Electrophoresis, In-gel Assays, and Electroelution. Journal of Visualized Experiments. (124), e55738 (2017).
- Von Hagen, J. . Proteomics Sample Preperation. , 485 (2008).
- Couoh-Cardel, S. J., Uribe-Carvajal, S., Wilkens, S., García-Trejo, J. J. Structure of dimeric F1F0-ATP synthase. The Journal of Biological Chemistry. 285 (47), 36447-36455 (2010).
- Strauss, M., Hofhaus, G., Schröder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO Journal. 27 (7), 1154-1160 (2008).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Wittig, I., Schägger, H. Structural organization of mitochondrial ATP synthase. Biochimica et Biophysica Acta - Bioenergetics. 1777 (7), 592-598 (2008).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proceedings of the National Academy of Sciences of the United Stated of America. 110 (15), 5887 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten