Method Article
Eletroforese nativa clara/azul híbrida para a separação e análise de supercomplexos de cadeia respiratória mitocondrial
Neste Artigo
Resumo
Aqui apresentamos um protocolo para extrair, resolver e identificar supercomplexos mitocondrial que minimiza a exposição a detergentes e Coomassie Blue. Este protocolo oferece um equilíbrio ideal entre a resolução e a preservação das atividades enzimáticas, minimizando o risco de perda de interações proteína-proteína lábil.
Resumo
Os complexos da maquinaria oxidativa do fosforilação formam os arranjos supramoleculares da proteína nomeados supercomplexos (SCs), que são acreditados para conferir vantagens estruturais e funcionais às mitocôndria. As SCs foram identificadas em muitas espécies, de levedura a mamífero, e um número crescente de estudos relata a ruptura de sua organização em doenças humanas genéticas e adquiridas. Como resultado, um número crescente de laboratórios está interessado em analisar SCs, o que pode ser metodologicamente desafiador. Este artigo apresenta um protocolo otimizado que combina as vantagens de métodos de página de azul e Clear nativo para resolver e analisar SCs de uma forma eficaz no tempo. Com este método híbrido de CN/BN-Page, o SCs mitochondrial extraído com quantidades óptimas do digitonin detergente suave é exposto momentaneamente à tintura aniônicos Coomassie azul (CB) no começo da electroforese, sem exposição a outros detergentes. Esta exposição curta a CB permite separar e resolver SCs tão eficazmente quanto com métodos tradicionais da BN-página, ao evitar o impacto negativo de níveis elevados do CB em ensaios da atividade do em-gel, e interações lábil da proteína-proteína dentro de SCS. Com este protocolo é assim possível combinar preciso e rápido em medições da atividade do gel com as técnicas analíticas que envolvem a electroforese 2D, immuno-Detection, e/ou proteômica para a análise avançada de SCs.
Introdução
As mitocôndrias produzem energia através da fosforilação oxidativa, onde os complexos respiratórios I-II-III-IV oxidam substratos e transferem elétrons para oxigênio, gerando um gradiente que permite a fosforilação da ADP pela ATP sintase (CV). Nos últimos anos, estudos extensos mostraram que os complexos de cadeia respiratória não são incorporados unicamente de forma linear na membrana mitocondrial interna, mas também são organizados em arranjos de supercomplexos (SCs)1,2. Nas mitocôndrias de mamíferos, as SCs existem em diferentes estequiometrias: CI/CIII2/CIV1-4 (que é nomeado o respirasome, e que é capaz de NADH: o2 de in vitro)2, CI/CIII2, e CIII2 /CIV1-23,4. Além disso, os complexos respiratórios são distribuídos diferentes proporções entre sua forma livre e arranjos de SCs. Portanto, estima-se que 85% – 100% de IC, 55% – 65% de CIII, e 15% – 25% de CIV são encontrados no SCs4. Essas estruturas supramoleculares são pensadas para diminuir a produção de Eros, estabilizar ou auxiliar na montagem de complexos individuais, regular a atividade da cadeia respiratória e prevenir a agregação proteica na membrana mitocondrial interna rica em proteínas5 ,6,7,8. Sua capacidade de remodelação em relação à variação na demanda de energia e sua importância na patogênese das doenças está sendo investigada em vários laboratórios3,7,9,10, 11 anos de , 12 anos de , 13 anos de , 14. estudos demonstraram que alterações patológicas na Assembléia de SCs estão presentes em uma variedade de distúrbios, incluindo, mas não limitado a, defeito genético na síntese de cardiolipina15, insuficiência cardíaca16, isquemia-reperfusão17, diabetes12e envelhecimento18.
Eletroforese nativa e imunodetecção são amplamente utilizados em estudos SCs para resolver complexos oxphos arranjos quaternários2,19,20,21. A electroforese nativa pode mais ser combinada com específico em ensaios da atividade do gel ou na página 2D-SDS para permitir a determinação molecular precisa dos vários conjuntos SCs1,19. A capacidade de estudar SCs é criticamente dependente das condições de extração, incluindo tipo e concentração de detergente utilizado, força iónica e pH, bem como em condições de migração eletroforética, que compreendem a composição tampão, presença de CB, gel tamanho e a percentagem de acrilamida2.
Protocolos e resolução de banda SCs variam muito entre os trabalhos, fazendo a comparação entre estudos difíceis e adaptação de métodos desafiadores22. Portanto, este trabalho propõe um protocolo robusto e ótimo para extrair SCs de mitocôndrias isoladas de diferentes fontes com a digitonina em detergente não-iônico, e para resolver bandas de alto peso molecular da SCs. A concentração de detergente otimizada, a composição do tampão de extração e a ausência de Coomassie Blue na preparação da amostra minimizam o rompimento de complexos proteicos. Este protocolo (veja Figura 1 para uma visão geral) combina CN-Page e BN-Page para a definição óptima dos conjuntos de SCs no grande gel, e é compatível com os ensaios da atividade do em-gel permitindo a melhor visualização de faixas reactivas, junto com o uso de imunodetecção para uma análise detalhada SCs arranjos e composição.
Protocolo
1. extração SC
- Prepare 100 mL de tampão de extração (ver tabela 2) DISSOLVENDO o EDTA em água. Aumente o pH com KOH até dissolver completamente, em seguida, ajustar o pH para 7,5 com HCl. Adicione os componentes restantes à solução, complete ao volume final com água, e mantenha no gelo. Em um tubo, dissolver digitonin em tampão de extração para fazer uma solução de estoque de 10%, vórtice completamente até dissolver completamente, e manter no gelo.
Nota: o tampão de extração pode ser preparado com antecedência e mantido a 4 ° c durante 2 meses no máximo. Se as bandas onduladas começarem a aparecer na parte inferior do gel, significa que a reserva de extração é muito antiga. Ao preparar a solução digitonina a 10%, prepare um volume de estoque contando 500 μL por amostra se estiver usando mitocôndria do fígado do rato. A solubilidade da digitonina varia consoante a proveniência e o lote de produtos (ver tabela de materiais). - Mitocôndrias isoladas de tecido animal (coração de rato, músculo, fígado; coração de rato) ou células (fibroblastos humanos) usando protocolos padrão23,24,25 pode ser usado para a extração de SCs. Uma vez que as mitocôndrias são obtidas, quantificar o teor de proteínas usando o kit de ensaio de ácido ácido de acordo com as recomendações do fabricante. Suplemento de mitocôndrias isoladas com proteases e inibidores de fosfatases nesta etapa, conforme necessário.
Nota: SCs pode ser extraído em qualquer mitocôndria fresca ou descongelada. Recomenda-se extrair SCs de todas as amostras ao mesmo tempo, para garantir que eles são tratados com os mesmos lotes de soluções e nas mesmas condições. - Com base na concentração protéica mitocondrial obtida, e a relação de digitonina/proteína final desejada, calcular o volume de solução de digitonina de estoque e tampão de extração exigido conforme tabela 1. Para a extração de SC, adicione 1 μL de tampão de extração (tabela 2) contendo digitonina para cada 10 μg de proteína mitocondrial. A relação da digitonina/proteína pode variar de 2 a 8 g/g. Uma titulação digitonina deve ser sempre executada para cada novo tipo de amostra usado (consulte a Figura 2 para obter um exemplo).
- Mitocôndria da pelota, em um tubo de 1,5 mL pela centrifugação em 16.000 x g por 10 minutos em 4 ° c.
- Descarte o sobrenadante e Resuspenda a pelota mitocondrial no volume calculado de tampão de extração gelada contendo digitonina. Coloc os tubos em um mini rotator do tubo e incubar por 30 minutos em 4 ° c em uma velocidade de rotação média. Certifique-se de que as amostras estão sendo misturadas corretamente.
- Centrifugue amostras em 20.400 x g para 45 min a 4 ° c para remover fragmentos insolubilizados.
- Transfira o sobrenadante em um novo tubo no gelo e quantifique as proteínas. Esta fração representa o extrato de supercomplexos respiratórios. Se a electroforese não for realizada no mesmo dia, armazene amostras a-80 ° c.
Nota: 1) Evite congelar/degelo ciclos do extrato, como isso interrompe maior arranjos moleculares de SCs. aliquot amostra antes do primeiro congelamento/descongelar ciclo, se necessário. 2) para executar um experimento BN-PAGE padrão, CB deve ser adicionado ao extrato SCs nesta etapa. CB deve ser adicionado em uma relação 1G/8G em relação à quantidade de detergente utilizado.
2. carcaça e electroforese do gel do inclinação
- Prepare 3x de gradiente de buffer e acrilamida estoques para fazer o gradiente de gel, alíquota, e armazenar a-20 ° c (ver tabela 3).
- Prepare tampões de ânodo e cátodos e mantenha-se a 4 ° c (ver tabela 5).
- Abra a câmara de fundição e coloque uma placa de vidro exterior (20 cm x 22 cm) na câmara. Posicione um conjunto de espaçadores (1,5 mm) usando o cartão de alinhamento para garantir que eles estejam sentados firmemente contra o lado e os cantos da câmara. Coloc uma placa de vidro interna (20 cm x 20 cm) sobre os espaçadores (este dá forma ao sanduíche do gel), e põr uma folha plástica da separação sobre a placa de vidro.
- Repita a etapa 2,3 até atingir o número desejado de géis a serem fundidos. Para este protocolo, 4 géis são casted. O sistema de câmara de fundição que utilizamos (ver tabela de materiais) permite a fundição de um máximo de 10 géis de cada vez. Tome-acima o espaço restante na câmara adicionando primeiramente tantos como blocos acrílicos como necessário, e então placas de vidro se necessário.
Nota: a montagem tem de ser firmemente selada; Não deve haver espaço entre os sanduíches de gel na câmara. - Coloque uma tira de parafilm no sulco antes de colocar a junta firmemente no entalhe da junta. Coloque a placa de vedação na câmara e aperte todos os 6 parafusos. Levante a câmara de fundição.
- Coloc o Gradient anterior em uma placa do stir com um agitador magnético na câmara de mistura da "luz". Conecte a tubulação da câmara da carcaça ao anterior do inclinação, prenda a tubulação na gaveta da bomba peristáltica, e certifique-se que o torneira do anterior do inclinação está fechado.
- Para moldar 4 géis, prepare 60 mL de 4% e 60 mL de soluções de gel de 12% (ver tabela 4) num balão de Erlenmeyer e misture completamente. Despeje 60 mL de solução de gel a 4% na câmara de mistura "leve", e 60 mL de 12% na câmara de reservatório "pesada" do gradiente anterior. Ajuste a velocidade da agitação da placa do stir em 350 rpm. Abra o torneira e gire sobre a bomba em 35 rpm.
- Uma vez que a fração de luz é menor do que a fração pesada, pausar a bomba e abrir a haste da válvula entre "luz" e "pesados" reservatórios, deixe o volume de frações equilibrados, e reinicie a bomba.
Nota: é importante que nenhuma bolha entrar no sistema e ficar preso entre as placas de vidro. Se isso acontecer, desfazer montagem, lavar e refazer. - Uma vez que o gel gradiente é completamente derramado, parar a bomba, e sobreposição de água (cerca de 1 mL) em cada sanduíche de gel para evitar a secagem do gel. Deixe polimerizar por 2 h.
- Prepare o gel de empilhamento de 25 mL em erlenmeyer e gire para misturar completamente. Retire a água e insira 15 pentes de poço em cada sanduíche de gel. Despeje o gel de empilhamento e deixe polimerizar por 2 h.
Nota: os géis podem ser fundidos e mantidos a 4 ° c durante 1 semana. - Insira o gel em grampos de sanduíche e retire o pente. Com a placa de vidro curta virada para baixo, insira o sanduíche de gel no núcleo de resfriamento. Repita do outro lado, e coloque o núcleo no tanque de eletroforese.
- Despeje 300 mL de tampão cáde azul na câmara interna do tanque de eletroforese. Despeje 2 L de tampão de ânodo na Câmara exterior do tanque de eletroforese.
Nota: o eletrodo deve ser submergido em tampão cátodos, o que requer aproximadamente 300 mL. - Carga entre 75 μg e 175 μg de proteína por poço. Funcione o gel em 150 V para 1,5 h (ou até que as amostras tenham entrado todo o gel do inclinação) na sala fria (4 ° c).
Nota 1:1) é necessário um mínimo de 75 μg por poço para uma boa resolução de bandas de atividade em gel. O carregamento de mais de 175 μg de proteína levará a uma perda de bandas claras devido à atividade enzimática excessiva. 2) as repetições da amostra devem ser carregadas em poços separados para permitir a determinação paralela de atividades do em-gel e a análise do immunoblot de complexos de OXPHOS. A determinação paralela de IGA para IC, CII, CIV e CV requer um mínimo de 300 μg. a análise do immunoblot paralelo de CI, de CII, de CII, de CIV e de CV exige um mínimo de 375 μg. - Remover Blue cátodos buffer com Pipet ou vácuo, substitua por 300 mL Coomassie Blue-Free cátodos buffer, e executar gel em 200 V durante a noite (16 – 20 h) em sala fria (4 ° c). Prossiga para a etapa 3 ou 4 para a medição de atividade em gel ou immunoblotting.
3. atividade em gel para complexos I, II, IV e CV
- Antes do fim da electroforese, prepare tampões da atividade do em-gel de acordo com a tabela 6, e mantenha no escuro em RT. 20 ml do tampão da atividade do em-gel são suficientes para 3 pistas da amostra.
Nota: Este ensaio de atividade em gel de CV baseia-se na actividade inversa de ATPsynthase (i.e., hidrólise ATP), e utiliza o cálcio como um cofactor, que precipita no gel. O cálcio é menos prejudicial do que o chumbo usado em outros protocolos. Além disso, o uso deste protocolo não requer uma pré-ativação/condicionamento do gel23. - Pare a electroforese e recupere o gel. Corte pistas, se necessário, e transferência de pistas de gel em sacos plásticos (3 lados cortados, e saco de plástico aberto como um livro). Sele 2 dos 3 lados com um aferidor do calor.
Nota: para comparar a composição das bandas SC entre os grupos experimentais, recomenda-se a execução das mesmas amostras em repetições no mesmo gel. Corte as vias para incubar cada repetição em diferentes buffers de atividade em gel (CI, II, IV, V). Para confirmar a especificidade dos ensaios, repetições adicionais podem ser preparadas para serem executadas em atividades de gel na presença de inibidores específicos da cadeia respiratória. - Para 3 amostras experimentais (ou seja, 3 poços), adicione 20 mL de tampão de atividade em gel, retire as bolhas e sele o lado 4 do saco plástico.
Nota: Adicionar inibidores em experimentos de controle negativo se realizado: IC: rotenona 1 μM; CII: malonato de sódio 10 mM; CIII: Antimicina-A 8 μM; CIV: KCN 0,6 mM; CV: oligomicina 0,5 μM. - Incubar pistas de gel a 37 ° c no escuro e verifique a cada 15 min. o tempo de incubação varia dependendo da quantidade de proteínas e complexos. O CI reagirá mais rapidamente do que o CIV ou o CV. a coloração óptima ocorre geralmente após 2 h para o CI, 4 h para CIV e 6 h para CII e CV.
- Enxague as pistas do gel na água para parar a reação, e a imagem em um fundo branco para CI, CII, CIV, ou fundo preto para o CV.
Nota: os géis podem ser mantidos em sacos plásticos a RT ou 4 ° c durante vários meses.
4. o immunoblotting
- Prepare o buffer de transferência de acordo com a tabela 7e mantenha-se em RT. Prepare TBST e mantenha-se em RT.
- Coloque o gel inteiro, ou faixas selecionadas, em um recipiente e adicionar buffer de transferência suplementado com SDS (0,25% final no buffer de transferência). Colocar o recipiente no balancim e incubar por 1 h.
- Corte a membrana de PVDF (tamanho correspondente ao tamanho do gel) e ative em 20 mL de metanol agitação por 2 min. substitua por 20 mL de tampão de transferência e coloque agitação por 2 min.
- Prepare o sanduíche de transferência, de baixo para cima, certificando-se que não há nenhuma bolha entre o gel e a membrana de PVDF ativada: lado desobstruído da gaveta/esponja preta/papel blotting/membrana/gel/papel de mancha/esponja preta/lado preto da gaveta. Feche e bloqueie a gaveta.
- Coloque o sanduíche de transferência no tanque de transferência, com o lado desobstruído do sanduíche que enfrenta o lado vermelho do elétrodo, e despeje o amortecedor de transferência para immerge o gel. Ligue o sistema de arrefecimento ao tanque de transferência e defina a 4 ° c. Conecte à fonte de alimentação, ajuste em 40 miliampères, e funcione por 24 h.
- Recupere as membranas, obstrua para 1 h em 5% BSA em TBST, e incubar na solução preliminar do anticorpo preparada em 5% BSA em TBST durante a noite em 4 ° c.
Nota: ver tabela 8 para os anticorpos utilizados. - Lave as membranas em TBST 3x por 10 min cada.
- Incubar membranas em soluções de anticorpos secundários preparadas em 5% BSA em TBST para 2 h à temperatura ambiente.
- Lave as membranas em TBST 3x por 10 min cada.
- Adicione a solução quimioluminescente às membranas e à imagem.
5. análise de
- As imagens do ensaio da atividade do em-gel ou os immunoblots podem ser usados para analisar SCs. Para analisar a composição das bandas, alinhe replicações e valide qual complexo reagiu positivamente para cada faixa dada.
- Para analisar a distribuição de complexos, em vários conjuntos supramoleculares, abra imagens no ImageJ e use a ferramenta de análise de gel (veja a Figura 5 para um exemplo).
- Selecione as faixas com a ferramenta retângulo e as faixas de plotagem.
- Desenhe linhas para fechar a área a curva de cada bandas de interesse e clique em cada área com a ferramenta varinha para gerar uma tabela contendo a área os valores de curva.
- Para calcular a distribuição do complexo, relate os valores para cada banda em relação ao do monómero.
Resultados
A Figura 2 mostra os resultados de um experimento de titulação digitonina com o objetivo de identificar a quantidade adequada de digitonina necessária para a extração de SCs. Esse valor variará dependendo do tipo de tecido/célula e se a amostra foi congelada ou não. Para este experimento, uma atividade de CIV em gel foi realizada para visualizar os SCs isolados de mitocôndrias frescas de fígado de camundongo. Foram testadas proporções de 2/1 a 10/1 g de proteína digitonina/g de proteínas. A quantidade óptima de digitonin para esta amostra é 4 g/g, porque fornece uma boa definição de CIV monoméricas, e de alto peso molecular SCs. Em uma relação mais baixa, as faixas não são desobstruídas e resolvem em uma mancha durante a electroforese, visto que o uso da relação mais elevada de digitonin conduz ao rompimento do SC elevado do peso molecular.
A Figura 3 e a Figura 4 mostram os resultados de um experimento completo realizado em uma preparação de mitocôndrias hepáticas de camundongo extraídas com 4 g de proteína digitonina/g. As proteínas foram separadas por meio de BN/CN-PAGE híbrida, BN-Page padrão ou CN-Page. Todos os três géis foram fundidos ao mesmo tempo e as faixas foram carregadas com repetições da mesma amostra. Após eletroforese, as faixas individuais foram cortadas e processadas para a medida da atividade do gel (IC, CII, CIV e CV na Figura 3) e imunoblotting (CI, CII, CIII, CIV, CV na Figura 4).
A adição de CB momentaneamente no tampão do cátodo (isto é híbrido CN/BN-PAGE) ou na amostra e no amortecedor do cátodo durante toda a electroforese (isto é BN-página), melhora consideravelmente a mobilidade e a definição de faixas do SC, e os complexos respiratórios individuais em comparação com a CN-PAGE (Figura 3). As bandas são facilmente distinguíveis com a técnica híbrida ou BN-PAGE após a atividade em gel para CIV, enquanto que na mesma amostra resolvida por CN-PAGE, SCs e bandas monoméricas de CIV reativa não podem ser identificadas.
A Figura 3 e a Figura 4 mostram que o padrão de resolução e bandagem dos MONÔMEROS oxphos e dos conjuntos supramoleculares é QUALITATIVAMENTE comparável entre CN/BN-PAGE e BN-Page híbridos. No entanto, existem diferenças notáveis. Primeiramente, a mobilidade electrophoretic de complexos de OXPHOS é reduzida ligeiramente quando as proteínas são separadas usando condições híbridas de CN/BN-PAGE contra BN-página padrão, devido à quantidade reduzida de CB. Essa mudança de mobilidade é maior para monômeros de CIV, seguidos de monômeros CV e IC (Figura 3 e Figura 4). Em segundo lugar, o fundo azul é menor no híbrido CN/BN-PAGE em comparação com BN-PAGE (Figura 3, faixas esquerdas). Como resultado, altos níveis de fundo após BN-PAGE completamente máscaras a atividade em gel coloração para CII, e aumenta o ruído de fundo associado com a atividade de dímeros CIV (Figura 3). Em terceiro lugar, a atividade de CV é maior quando as amostras são executadas condições híbridas CN/BN-PAGE em comparação com BN-PAGE (Figura 3), devido à quantidade reduzida de CB, que é conhecido por interferir com a atividade catalítica CV. 26 CN/BN-Page também permite uma melhor preservação dos conjuntos supramoleculares CV, como demonstrado por uma maior proporção de atividade total CV sendo associado com dímeros CV (Figura 3). Além disso, os oligômeros do CV são visíveis CN/BN-Page, quando são dissociada completamente condições da BN-página. Curiosamente, bandas distintas exibindo atividade CV também são observadas entre monômeros CV e dímeros, quando as amostras são executadas em CN/BN-PAGE (Figura 2).
A Figura 5 mostra uma análise representativa da distribuição complexa de OXPHOS em montagens supramoleculares. A imagem mostra CI na atividade do gel das amostras obtidas de 4 preparações saudáveis distintas das mitocôndria do fígado do rato. A análise da densitometria permite mensurar a área a curva das bandas CI-reativas, e apresentar a distribuição relativa da atividade C1 nas formas monomérica (I1) e supramoleculares (i 1 III2, i1III2IV 1, I1III2IVn). A análise similar pode ser executada Depois do immunoblot.
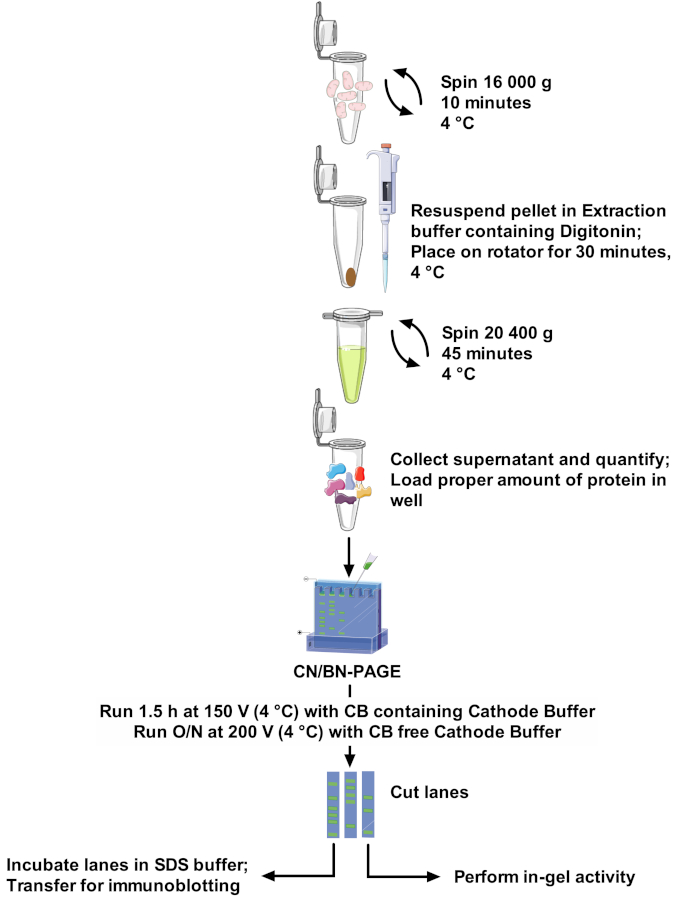
Figura 1: fluxo de trabalho do ensaio. Por favor clique aqui para ver uma versão maior desta figura.
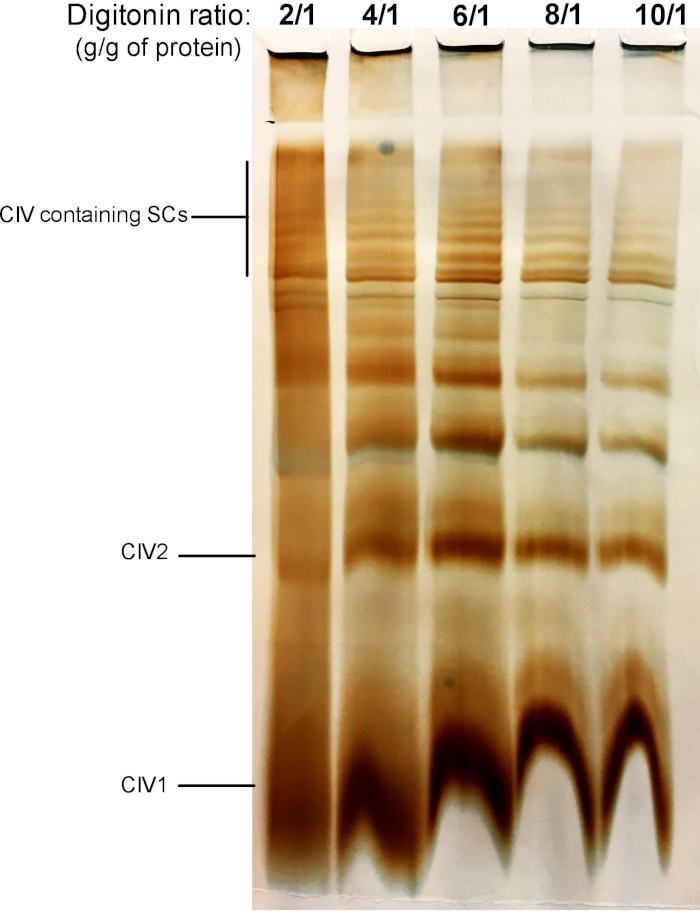
Figura 2: titulação de Digitonina para extrair supercomplexos de mitocôndrias hepáticas frescas do camundongo. Este exemplo mostra alíquotas de mitocôndria do fígado do rato, isoladas de um animal que foi tratado com quantidades crescentes de digitonin para extrair supercomplexos respiratórios. As amostras foram resolvidas então pela página híbrida de CN/BN, e a atividade do em-gel de CIV foi determinada. CIV1: monómeros IV complexos; CIV2: dímeros complexos IV; SC: supercomplexos. Por favor clique aqui para ver uma versão maior desta figura.
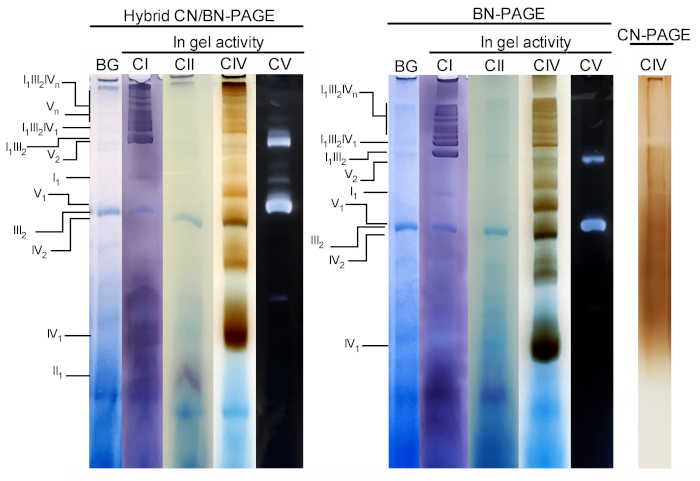
Figura 3: atividade in-gel de complexos OXPHOS após híbrido CN/BN-Page, BN-Page ou CN-Page. As mitocôndrias hepáticas isoladas de um rato foram tratadas com digitonina (4 g/g de relação digotonina/proteína) para extrair supercomplexos respiratórios. As alíquotas desta amostra foram então carregadas em vários poços em três géis distintos e submetidas a CN/BN-PAGE, BN-Page ou CN-Page. Cada pista replicada dentro de cada gel foi então cortada e imediatamente utilizada para ensaios de atividade em gel (rotulados CI, CII, CIV e CV). Uma pista foi usada como controle para mostrar a coloração de fundo (rotulada BG) com o Coomassie Blue. Os complexos de OXPHOS e os conjuntos supramoleculares são identificados usando a nomenclatura padrão, com números nos índices que indicam a estequiometria molecular de cada complexo de OXPHOS. Deve-se notar que a posição dos conjuntos supramoleculares contendo CIII é baseada na imunodetecção, uma vez que a atividade em gel para o CIII não foi realizada neste experimento específico. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: análise de immunoblot de complexos de OXPHOS depois do híbrido CN/BN-Page ou BN-Page. As repetições dos experimentos descritos na Figura 3 legenda foram electro-transferidas em uma única membrana. Após a transferência, as faixas individuais foram cortadas e incubadas com anticorpos específicos que reconhecem os complexos CI, CII, CIII, CIV e CV. OXPHOS e os conjuntos supramoleculares são identificados por meio da nomenclatura padrão, com números em índices que indicam a estequiometria molecular de cada complexo OXPHOS. Por favor clique aqui para ver uma versão maior desta figura.
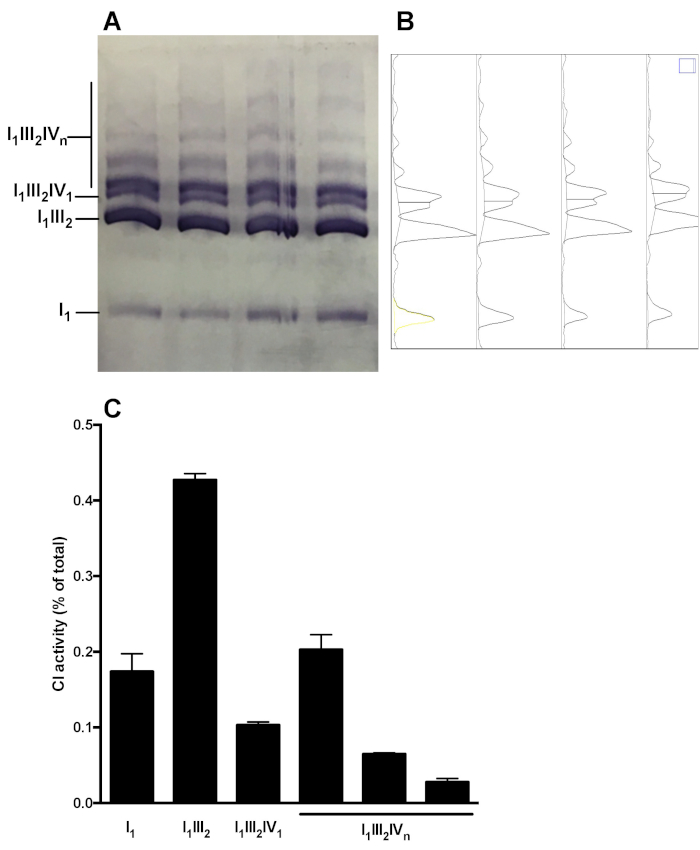
Figura 5: quantificação da distribuição de IC em montagens monoméricas e supramoleculares. (A) atividade de CI in-gel determinada após CN/BN-Page híbrido em extratos de SC mitocôndrias hepáticas obtidos a partir de 4 camundongos. (B) densitogramas obtidos usando a ferramenta de análise de gel de ImageJ mostrando picos distintos correspondentes a monômeros de CI (i1) e vários complexos supramoleculares contendo CI (i1III2, i1III2IV1 , e I1III2IVn). (C) quantificação da distribuição relativa da atividade C1. Os dados representam média e SEM dos 4 camundongos. Por favor clique aqui para ver uma versão maior desta figura.
| Relação da digitonina/proteína (g/g) | 2 g/g | 4 g/g | 6 g/g | 8 g/g |
| Volume de tampão de extração (μL) | 400 | 300 | 200 | 100 |
| Volume do digitonin do estoque de 10% (μL) | 100 | 200 | 300 | 400 |
| Volume total do tampão de extração (μL) | 500 | 500 | 500 | 500 |
Tabela 1: volumes necessários para extrair SCs de 5 mg de proteínas mitocondriais usando várias proporções de digitonina/proteína.
| Composto | Concentração final |
| EDTA, pH 7,5 | de 1 mM |
| HEPES | de 30 mM |
| Acetato de potássio | 150 milímetros |
| Glicerol | 12 |
| Ácido 6-Aminocaproic | de 2 mM |
Tabela 2: tampão de extração SC (concentrações finais). Manter a 4 ° c durante um máximo de 3 meses.
| Composto | Concentração final |
| amortecedor do gel 3x: Alíquota e manter a-20 ° c, pH 7,5 | |
| Imidazol/HCl pH-7,0 | 75 milímetros |
| Ácido 6-Aminocaproic | 1,5 M |
| Tampão de acrylamide: Alíquota e manter a-20 ° c | |
| Acrilamida | 99,5% de |
| Bis-acrilamida | 3 |
Tabela 3: buffers de estoque de gel.
| Para 2 géis: | 4% (60 mL) | 12% (60 mL) | Empilhamento (4%) (25 mL) |
| 3X tampão do gel | 19,8 mL | 19,8 mL | 8,25 mL |
| Tampão de acrilamida | 4,8 mL | 14,4 mL | 2 mL de |
| H2O | 35 mL | 13,1 mL | 14,6 mL |
| Glicerol | - | 12 mL de | - |
| APS 10% | 360 μL | 60 μL | 150 μL |
| TEMED | 24 μL de | 12 μL de | 10 μL de |
Tabela 4:4% – gel de gradiente de 12%.
| Composto | Concentração final |
| Tampão do ânodo: sustento em 4 ° c, pH 7,5 | |
| Imidazol | de 25 mM |
| Tampão de cátodos: sustento em 4 ° c, pH 7,5 | |
| Tricine | 50 milímetros |
| Imidazol | 7,5 milímetros |
| Com ou sem Coomassie Blue (G250) | 0, 22% de |
Tabela 5: amortecedores de eletroforese.
| Composto | Concentração final |
| Complexo I atividade tampão: preparar fresco em 5 mM TRIS-HCl pH 7,4 | |
| Azul de nitrotetrazolium | de 3 mM |
| Nadh | de 14 mM |
| Complexo II atividade tampão: preparar fresco em 5 mM TRIS-HCl pH 7,4 | |
| Succinato | de 20 mM |
| PMSF | 0,2 milímetros |
| Azul de nitrotetrazolium | de 3 mM |
| Complexo IV atividade tampão: preparar fresco em 50 mM nd-fosfato pH 7,2 | |
| Citocromo C | 0, 5 milímetros |
| Diaminobenzidina | 2,3 milímetros |
| Atividade ATPsynthase tampão: Prepare fresco na água, ajuste o pH a 8 com KOH | |
| Glicina | 50 milímetros |
| MgCl2 | de 5 mM |
| HEPES | 50 milímetros |
| CaCl2 | de 30 mM |
| Atp | de 5 mM |
Tabela 6: buffers de ensaio de atividade em gel.
| Composto | Concentração final |
| Buffer de transferência | |
| Base de tris | de 25 mM |
| Glicina | 192 milímetros |
| Sds | 4 |
| Metanol | 20 |
| Tbst | |
| Base de tris | de 20 mM |
| Nacl | 137 milímetros |
| Tween 20 | 0,1% de |
Tabela 7: buffers de immunoblotting.
| Complexo | Subunit | Clone |
| Eu | NDUFA9 | 20C11B11B11 |
| Ii | ELECTRÕES | 2E3GC12FB2AE2 |
| Iii | UQCRC2 | 13G12AF12BB11 |
| Iv | COX4 | 1D6E1A8 |
| V | DE | 3D5 |
Tabela 8: anticorpos usados para a imunoblotting para detectar a corrente respiratória SC. Consulte tabela de materiais para empresas e números de lote.
Discussão
Os supercomplexos mitocondriais estão sendo ativamente estudados para elucidar seu papel fisiológico, e sua importância na patogênese de inúmeras doenças humanas, sejam elas adquiridas ou doenças genéticas mitocondrial3,7 , 9 anos de , 10 de , 11 anos de , 12 anos de , 13 anos de , 14. a fim de obter resultados fiáveis, é necessário considerar vários aspetos. Este protocolo foi testado com mitocôndria do fígado do rato, mitocôndria do músculo esqueletal do rato (resultados não mostrados), mitocôndria do coração do rato, e mitocôndria humanas do fibroblasto (resultados não mostrados), mas poderia certamente ser adaptado a outras fontes de isolados Mitocôndrias. O método combina de forma otimizada vários aspectos dos protocolos BN e CN-Page, que permitem reduzir a exposição a detergentes e compostos aniônicos a um mínimo em comparação com os protocolos publicados20,27,28.
Preparação da amostra
A preparação da amostra representa um passo crucial para a separação bem-sucedida de SCs. a composição do tampão deve ser cuidadosamente selecionada, a fim de alcançar a solubilização adequada de proteínas e conjuntos de proteínas, preservando, tanto quanto possível, o seu funcionamento e integridade estrutural. A força iónica e o pH do tampão da extração são dois fatores importantes a considerar. As concentrações de sal que são demasiado baixas (< 50 milímetros de K-acetato ou NaCl) conduzirão à solubilização pobre das proteínas na presença de detergentes não-iônicos, quando as concentrações de sal acima de 500 milímetros promoverem o empilhamento/agregação da proteína, e a precipitação do CB e proteínas29. Os SCs devem conseqüentemente ser extraídos usando bufferes na força iónica próxima fisiológica. No que diz respeito ao pH, recomenda-se o uso de um pH fisiológico próximo.
O tipo de detergente e a relação detergente/proteína também são críticos para a extração ideal de SC. Para a preservação máxima de SCs nativos, a digitonina é preferida26. Como mostrado no presente protocolo e outros métodos publicados23,30,31,32, este detergente suave preserva a composição supramoleculares de vários conjuntos de SC, e o diméricas e estrutura oligomérica de ATPsynthase (Figura 3 e Figura 4). A titulação das amostras de interesse com várias quantidades de digitonina é fundamental para identificar as condições que permitem a solubilização ótima, preservando a atividade enzimática e interações protéicas fisiológicas. A titulação deve ser realizada com proporções variando entre 2 e 8 g/g26. Resultados ideais para fígado, músculo esquelético e mitocôndrias cardíacas são obtidos respectivamente com 4, 5 e 6 g de proteína digitonina/g. Deve-se notar que a digitonina pode ser substituída por Triton X-100, que em condições ideais resulta em migração semelhante e composição de SC como as observadas com digitonina2. No entanto, este detergente deve ser usado com cautela, uma vez que um aumento relativamente pequeno na relação detergente/proteína (por exemplo, de 1 a 1,5 g/g) pode resultar em uma dissociação completa dos conjuntos de SCs2, o que pode resultar em inconsistências experimentais. Após a extração, as amostras são tradicionalmente suplementadas com o azul Coomassie para dar uma carga às proteínas quando aplicadas ao gel, exceto para a tradicional CN-página20,26. A fim minimizar a exposição da proteína ao azul de Coomassie e à dissociação potencial de proteínas lábil, as amostras não são suplementadas com o azul de Coomassie neste protocolo.
Electroforese
Ambos CN-PAGE e BN-PAGE têm sido usados para estudar complexos de OXPHOS mitocondrial, cada um deles com vantagens e limitações distintas. As condições mais suaves utilizadas em CN-PAGE (principalmente a ausência de CB, que tem um efeito detergente-like), permite uma melhor preservação da atividade de ATP sintase in-gel, e limita a dissociação de proteínas lábeis em alto peso molecular SCs e ATP sintase dos conjuntos26. No entanto, a ausência do corante aniônico CB nos buffers de extrato protéico e eletroforese faz com que as proteínas migrem com base em sua carga intrínseca e ponto isoelétrico, o que reduz a mobilidade eletroforética de proteínas dentro do gel26. Além disso, na ausência de CB, as proteínas com carga negativa insuficiente tendem a agregar, reduzindo assim a resolução de complexos proteicos no gel20,26. Para contornar essas limitações, o chamado CN-PAGE de alta resolução foi desenvolvido por Wittig e Schragger20. Neste protocolo, o desoxicolato do sódio (doc) e os vários detergentes não-iônicos suaves (DDM, Triton X100) são adicionados ao tampão de cátodos para manter as proteínas da membrana solubilizadas e impor uma mudança negativa da carga em proteínas, que conduz a uma melhoria considerável da resolução20.
Uma característica distintiva do presente protocolo híbrido CN/BN é que uma resolução comparável pode ser alcançada sem estes detergentes. A adição momentânea de CB ao tampão cáde no início da eletroforese é suficiente para limitar a agregação proteica e aumentar a mobilidade no gel (Figura 3 e Figura 4). Em conseqüência, esta técnica híbrida permite a definição excelente de montagens distintas do SC e muito baixa ou nenhuma exposição aos detergentes. A presença de baixas quantidades de CB também permite uma melhor preservação da atividade CV, melhoria da preservação dos conjuntos de CV Dimérico e oligomérica (Figura 3 e Wittig e schägger 200526), e uma redução do ruído de fundo azul que pode dificultam a quantificação das atividades em gel, particularmente para CII e CIV (Figura 2). Além disso, a ausência de CB no extrato proteico limita a ruptura das interações protéicas lábeis dentro da SCs. Por exemplo, a associação física da ATP sintase com ANT para formar o synthasome 33 ou com Cyclophilin-D para regular a abertura de ptp 34 é melhor visto na ausência de CB. A exposição momentânea a CB durante a eletroforese só pode, portanto, ser útil para revelar novas interações proteicas dentro da SCs. globalmente, este protocolo híbrido CN/BN-PAGE permite, assim, combinar medições precisas e rápidas em atividades de gel com técnicas envolvendo eletroforese 2D, imuno-detecção e/ou proteômica para análise avançada de SCs. Deve-se notar que, com o crescente interesse pela SCs, um número crescente de estudos usa pequenos géis de 10 x 10 cm para a página nativa. Embora essa abordagem possa ser suficiente para identificar alterações brutas nos conjuntos SC de abundância, a menor capacidade de separação de géis pequenos é provavelmente limitada para resolver rearranjos sutis ou para cortar bandas distintas para análise proteômica. Além disso, vários estudos que utilizam géis menores relataram que o respirador migra ao mesmo tamanho que o dímero de ATPsynthase, dificultando a dissociá-los22. Portanto, o uso de géis grandes deve ser favorecido.
Divulgações
Nenhum
Agradecimentos
Os autores gostariam de agradecer a Jenna Rossi pela assistência técnica, e o Dr. Mireille Khacho, o Dr. David Patten e o Dr. Ujval Anil Kumar para uma discussão útil enquanto desenvolvia este método. Este trabalho foi financiado pelos institutos canadenses de pesquisa em saúde (CIHR) e pelo Conselho Nacional de Ciências e engenharia do Canadá (NSERC). AC é um destinatário do prêmio de doutorado-Frederick Banting e Charles Best Canada bolsas de pós-graduação (CIHR).
Materiais
| Name | Company | Catalog Number | Comments |
| 3,3'-Diaminobenzidine tetra-hydrochloride hydrate | Sigma | D5637 | |
| 6-amino caproic acid | sigma | A2504 | |
| Acrylamide | Sigma | A3553 | |
| Adenosine 5'-triphosphate disodium salt hydrate | sigma | A3377 | |
| Anti-ATPB antibody [3D5] - Mitochondrial Marker | Abcam | ab14730 | Lot number GR3174539-12, RRID AB_301438 |
| Anti-SDHA antibody [2E3GC12FB2AE2] | Abcam | ab14715 | Lot number GR3235943-1, RRID AB_301433 |
| Anti-UQCRC2 antibody [13G12AF12BB11] | Abcam | ab14745 | Lot number GR304308-3, RRID AB_2213640 |
| Bis N,N'-Methylene-Bis-Acrylamide | Biorad | 1610201 | |
| Brilliant Blue G | Sigma | 27815 | |
| COX4 Monoclonal Antibody (1D6E1A8) | Invitrogen | 459600 | Lot number TI2637158, RRID AB_2532240 |
| Cytochrome c from equine heart | sigma | C7752 | |
| Digitonin | Sigma | D141 | |
| Fisherbrand FH100M Multichannel Peristaltic Pumps | Thermo Fisher | 13-310-660 | |
| Imidazole | Sigma | I0250 | |
| Inner Glass Plates. Pkg of 2, 20 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with outer plate | Biorad | 1651823 | |
| Model 485 Gradient Former. 40-175 ml acrylamide gradient former, includes valve stem and tubing kit, for use with Mini-PROTEAN multi-casting chamber systems | Biorad | 1654120 | |
| NDUFA9 Monoclonal Antibody (20C11B11B11) | Invitrogen | 459100 | Lot number TD2536591, RRID AB_2532223 |
| Nitrotetrazolium Blue chloride | Sigma | N6639 | |
| Outer Glass Plates. Pkg of 2, 22.3 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with inner plate | Biorad | 1651824 | |
| Phenylmethanesulfonyl floride | Sigma | P7626 | |
| Powerpack 1000 | Biorad | Serial Number 286BR 07171 | |
| PROTEAN II Sandwich Clamps. Pkg of 2, clamps for running gels, for 20 cm PROTEAN II xi electrophoresis cell, 1 left and 1 right | Biorad | 1651902 | |
| PROTEAN II xi Cell. Large format vertical electrophoresis cell, 16 x 20 cm gel size, 4 gel capacity, spacers and combs | Biorad | 1651811 | |
| PROTEAN II xi Comb. Pkg of 1, 15-well, 1.5 mm, comb for PROTEAN II xi electrophoresis cell | Biorad | 1651873 | |
| PROTEAN II xi Multi-Gel Casting Chamber. Multi-gel casting chamber, 20 x 20 cm gel size, for up to ten 1.5 mm thick gels, includes sealing plate, gasket, separation sheets, acrylic blocks, PROTEAN II XL alignment cards | Biorad | 1652025 | |
| PROTEAN II xi Spacers. Pkg of 4, 1.5 mm, spacers for 20 cm PROTEAN II xi electrophoresis cell | Biorad | 1651849 | |
| SCIENCEWARE Utility Bags (10 x 12") 4 mil, Bel-Art, Box of 100 | VWR | 11215-388 | |
| Thick Blot Paper. Pkg of 25 sheets, 15 x 20 cm, absorbent filter paper, for use with Trans-Blot cassette | Biorad | 1703956 | |
| Trans-Blot Cell With Plate Electrodes and Super Cooling Coil. Transfer cell and cooling coil (#170-3912), includes 2 gel holder cassettes, buffer tank, lid with cables, fiber pads, 1 pack blot paper | Biorad | 1703939 |
Referências
- Shagger, H. Respiratory Chain Supercomplexes. IUBMB Life. 52 (3-5), 119-128 (2001).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular Cell. 32 (4), 529-539 (2008).
- Greggio, C., et al. Enhanced Respiratory Chain Supercomplex Formation in Response to Exercise in Human Skeletal Muscle. Cell Metabolism. 25 (2), 301-311 (2017).
- Schagger, H., Pfeiffer, K. The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes. Journal of Biological Chemistry. 276 (41), 37861-37867 (2001).
- Milenkovic, D., Blaza, J. N., Larsson, N. G., Hirst, J. The Enigma of the Respiratory Chain Supercomplex. Cell Metabolism. 25 (4), 765-776 (2017).
- Acin-Perez, R., Enriquez, J. A. The function of the respiratory supercomplexes: the plasticity model. Biochimica et Biophysica Acta. 1837 (4), 444-450 (2014).
- Vartak, R., Porras, C. A., Bai, Y. Respiratory supercomplexes: structure, function and assembly. Protein Cell. 4 (8), 582-590 (2013).
- Lapuente-Brun, E., et al. Supercomplex Assembly Determines Electron Flux in the Mitochondrial Electron Transport Chain. Science. 340 (6140), 1567-1570 (2013).
- Lazarou, M., Smith, S. M., Thorburn, D. R., Ryan, M. T., McKenzie, M. Assembly of nuclear DNA-encoded subunits into mitochondrial complex IV, and their preferential integration into supercomplex forms in patient mitochondria. The FEBS Journal. 276 (22), 6701-6713 (2009).
- Sun, D., Li, B., Qiu, R., Fang, H., Lyu, J. Cell Type-Specific Modulation of Respiratory Chain Supercomplex Organization. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Aurelio, M., Gajewski, C. D., Lenaz, G., Manfredi, G. Respiratory chain supercomplexes set the threshold for respiration defects in human mtDNA mutant cybrids. Human Molecular Genetics. 15 (13), 2157-2169 (2006).
- Antoun, G., et al. Impaired mitochondrial oxidative phosphorylation and supercomplex assembly in rectus abdominis muscle of diabetic obese individuals. Diabetologia. 58 (12), 2861-2866 (2015).
- Kanaan, G. N., Patten, D. A., Redpath, C. J., Harper, M. -. E. Atrial Fibrillation Is Associated With Impaired Atrial Mitochondrial Energetics and Supercomplex Formation in Adults With Type 2 Diabetes. Canadian Journal of Diabetes. , (2018).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochimica et Biophysica Acta. 1862 (4), 741-753 (2016).
- McKenzie, M., Lazarou, M., Thorburn, D. R., Ryan, M. T. Mitochondrial Respiratory Chain Supercomplexes Are Destabilized in Barth Syndrome Patients. Journal of Molecular Biology. 361 (3), 462-469 (2006).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovascular Research. 80 (1), 30-39 (2008).
- Jang, S., et al. Elucidating Mitochondrial Electron Transport Chain Supercomplexes in the Heart During Ischemia-Reperfusion. Antioxidants & Redox Signaling. 27 (1), 57-69 (2017).
- Frenzel, M., Rommelspacher, H., Sugawa, M. D., Dencher, N. A. Ageing alters the supramolecular architecture of OxPhos complexes in rat brain cortex. Experimental Gerontology. 45 (7), 563-572 (2010).
- Krause, F. Detection and analysis of protein-protein interactions in organellar and prokaryotic proteomes by native gel electrophoresis: (Membrane) protein complexes and supercomplexes. Electrophoresis. 27 (13), 2759-2781 (2006).
- Wittig, I., Karas, M., Schagger, H. High Resolution Clear Native Electrophoresis for In-gel Functional Assays and Fluorescence Studies of Membrane Protein Complexes. Molecular Cell Proteomics. 6, 1215-1225 (2007).
- Wittig, I., Braun, H. P., Schagger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Jang, S., Javadov, S. Current Challenges in Elucidating Respiratory Supercomplexes in Mitochondria: Methodological Obstacles. Frontiers in Physiology. 9, 238-238 (2018).
- Cuillerier, A., et al. Loss of hepatic LRPPRC alters mitochondrial bioenergetics, regulation of permeability transition and trans-membrane ROS diffusion. Human Molecular Genetics. 26 (16), 3186-3201 (2017).
- Pallotti, F., Lenaz, G. . Methods in Cell Biology. 80, 3-44 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nature Protocols. 4, 1582 (2009).
- Wittig, I., Schägger, H. Advantages and limitations of clear-native PAGE. PROTEOMICS. 5 (17), 4338-4346 (2005).
- Jha, P., Wang, X., Auwerx, J. Analysis of Mitochondrial Respiratory Chain Supercomplexes Using Blue Native Polyacrylamide Gel Electrophoresis (BN-PAGE). Current Protocols in Mouse Biology. 6 (1), 1-14 (2016).
- Beutner, G., Porter, G. A. Analyzing Supercomplexes of the Mitochondrial Electron Transport Chain with Native Electrophoresis, In-gel Assays, and Electroelution. Journal of Visualized Experiments. (124), e55738 (2017).
- Von Hagen, J. . Proteomics Sample Preperation. , 485 (2008).
- Couoh-Cardel, S. J., Uribe-Carvajal, S., Wilkens, S., García-Trejo, J. J. Structure of dimeric F1F0-ATP synthase. The Journal of Biological Chemistry. 285 (47), 36447-36455 (2010).
- Strauss, M., Hofhaus, G., Schröder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO Journal. 27 (7), 1154-1160 (2008).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Wittig, I., Schägger, H. Structural organization of mitochondrial ATP synthase. Biochimica et Biophysica Acta - Bioenergetics. 1777 (7), 592-598 (2008).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proceedings of the National Academy of Sciences of the United Stated of America. 110 (15), 5887 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados