Method Article
Гибридный ясный/синий родной электрофорез для разделения и анализа митохондриальных Сверхкомплексов дыхательной цепи
В этой статье
Резюме
Здесь мы представляем протокол для извлечения, разрешения и идентификации митохондриальных суперкомплексов, что сводит к минимуму воздействие моющих средств и Coomassie Blue. Этот протокол предлагает оптимальный баланс между разрешением и сохранением активности фермента, при этом сводя к минимуму риск потери лабильных белков-белковых взаимодействий.
Аннотация
Комплексы окислительного фосфорилирования образуют супрамолекулярно-белковые аранжировки, названные суперкомплексами (СКС), которые, как полагают, наделяют митохондрии структурными и функциональными преимуществами. СКС были определены во многих видов, от дрожжей до млекопитающих, и все большее число исследований докладе нарушения их организации в генетических и приобретенных заболеваний человека. В результате все большее число лабораторий заинтересовано в анализе СКС, что может быть методологически сложным. Эта статья представляет оптимизированный протокол, который сочетает в себе преимущества Blue-и Clear-родные методы PAGE для решения и анализа СКС в сроки эффективным образом. С помощью этого гибридного метода CN/BN-PAGE Митохондриальные СКС, извлеченные из оптимального количества мягкого моющего средства, подвергаются кратковременному воздействию анионного красителя Blue (CB) в начале электрофореза, без воздействия других моющих средств. Это короткое воздействие CB позволяет отделить и решить СКС так же эффективно, как с традиционными BN-PAGE методы, избегая при этом негативное влияние высоких уровней CB на в-гель деятельности исследования, и лабильных белков белка взаимодействий в СКС. С помощью этого протокола, таким образом, можно сочетать точные и быстрые измерения активности геля с аналитическими методами с участием 2D электрофорез, иммуно-обнаружение, и/или протеомика для продвинутого анализа СКС.
Введение
Митохондрии вырабатывают энергию через окислительное фосфорилирование, где дыхательные комплексы I-II-III-IV окисляют субстраты и переносят электроны в кислород, создавая градиент, который позволяет фосфорилирование АДФ по СПС синтаза (CV). В последние годы обширные исследования показали, что дыхательные комплексы не только в линейном виде включены в внутреннюю митохондриальную мембрану, но также организованы в суперкомплексы (СКС)1,2. В митохондриях митохондрии, ЦС существуют в различных стойкометох: CI/CIII2/ципс1-4 (который назван респирасосом, и который способен NADH: O2 оксидацион в ПРОБИРКЕ)2, CI/CIII2, и CIII2 /P21-23,4. Кроме того, дыхательные комплексы распределяются по разным соотношениях между их свободной формой и механизмами СКС. Таким образом, по оценкам, 85%-100% CI, 55%-65% CIII, и 15%-25% ЦИВ находятся в ГКС4. Считается, что эти супрамолекулярные структуры снижают производство ROS, стабилизируют или помогают в сборке индивидуальных комплексов, регулируют деятельность дыхательной цепи и предотвращают агрегацию белка в богатой внутренней митохондриальной мембране, которая5 ,6,7,8. Их Ремоделирование при изменении спроса на энергию и их значимости в патогенезе заболеваний изучается в нескольких лабораториях3,7,9,10, 11 , 12 , 13 , 14. исследования показали, что патологические изменения в сборке СКС присутствуют в различных расстройствах, включая, но не ограничиваясь этим, генетический дефект в Кардиолипин синтез15, сердечная недостаточность16, в-репертуаре17, диабет12, и старение18.
Родной электрофорез и иммунообнаружение широко используются в исследованиях СКС для решения oxфос комплексов четвертичных договоренностей2,19,20,21. Родной электрофорез может быть дополнительно совмещен с конкретными в гелевых действиях или на странице 2D-СДЗ, чтобы обеспечить точное молекулярное определение различных сборок1,19. Способность к изучению СКС в решающей степени зависит от условий извлечения, включая тип и концентрацию моющего средства, ионной прочности и рН, а также на электрофлефотических условиях миграции, которые состоят из буферного состава, наличия ЦБ, геля размер, и акриламида процент2.
Протоколы и резолюции группы МСК значительно различаются между документами, что делает сравнение между исследованиями трудным и адаптации методов, бросающей вызов22. Таким образом, этот документ предлагает надежный и оптимальный протокол для извлечения ГТИ из изолированных митохондрий различных источников с неионного моющего средства, и для решения высокой молекулярной массы ГТС полос. Оптимизированная концентрация моющих средств, состав буфера экстракции и отсутствие Комасси Блю в подготовке образцов минимизируют разрушение белковых комплексов. Этот протокол (см. диаграмму 1 для обзора) сочетает в себе CN-Page и BN-Page для оптимального разрешения СБК сборки на большой гель, и совместим с в гель деятельности исследования, позволяющие лучше визуализации реактивных полос, наряду с использованием иммунообнаружение для детального анализа договоренностей и состава.
протокол
1. Удаление SC
- Подготовьте 100 мл буфера извлечения (см. таблицу 2) путем растворения ЭДТА в воде. Увеличьте рН с Кох до полного растворения, затем отрегулируйте рН до 7,5 с совместимого. Добавьте оставшиеся компоненты в раствор, завершите до конечного тома водой и продолжайте лед. В трубке Растворите дигинин в буфере извлечения, чтобы сделать 10%-ное решение, вортекс тщательно, пока полностью не растворится, и держать на льду.
Примечание: извлечение буфер может быть подготовлен заранее и хранится при температуре 4 ° c в течение 2 месяцев максимум. Если волнистые полосы начинают появляться в нижней части геля, это означает, что извлечение буфера слишком стар. При подготовке 10%-ного решения, подготовьте объем запасов, подсчитывая 500 мкл за образец при использовании митохондрий печени мыши. Растворимость в дигонине варьируется в зависимости от происхождения и количества продукта (см. таблицу материалов). - Митохондрии изолированы от животной ткани (мышь сердце, мышца, печень; крысиное сердце) или клетки (человеческий фибровзрыв) с использованием стандартных протоколов23,24,25 могут быть использованы для извлечения СКС. После получения митохондрий, количественно содержание белка, используя бицин-миновой кислоты анализ комплекта в соответствии с рекомендациями производителя. Дополнение изолированных митохондрий с протеаз и ингибиторы фосфоратазы на этом этапе по мере необходимости.
Примечание: СКС могут быть извлечены либо из свежих или талых митохондрий. Рекомендуется, чтобы извлечь СКС из всех образцов в то же время, чтобы застраховать их лечат с теми же партиями решений и в тех же условиях. - Основываясь на полученной митохондриальной концентрации белка и окончательном соотношении дигинина/белка, следует рассчитать объем запаса дигинина и буфер извлечения, необходимый в соответствии с таблицей 1. Для извлечения из СК, добавьте 1 мкл извлечения буфера (Таблица 2), содержащий дигинин для каждого 10 мкг митохондриального белка. Соотношение дигнин/белок может варьироваться от 2 до 8 г/г. Для каждого нового типа образца (см . Рисунок 2 для примера) следует всегда выполнять "титрование" в виде оцифрования.
- Гранулы митохондрий, в 1,5 mL трубки центрифугирования на 16 000 x g для 10 мин при температуре 4 °c.
- Откажитесь от супернаранта и снова приостанавлийте митохондриальную гранулу в вычисляном объеме буфера ледяной экстракции, содержащего дигинин. Поместите трубы на мини-трубку ротатора и инкубировать в течение 30 минут при температуре 4 ° с при средней скорости вращения. Убедитесь, что образцы получают правильно смешанные.
- Пробы центрифуг на 20 400 x g для 45 мин при температуре 4 °c для удаления нерастворимой фрагменты.
- Перенесите супернатант в новую трубку на льду и квантифицировать белки. Эта фракция представляет экстракт дыхательных суперкомплексов. Если электрофорез не выполняется в тот же день, Храните образцы при температуре-80 ° c.
Примечание: 1) Избегайте замораживания/оттаивания циклов экстракта, так как это нарушает высшие молекулярные механизмы СКС. Aliquot образца до первого цикла замораживания/оттаивания, если это необходимо. 2) для выполнения стандартного эксперимента BN-PAGE к экстракту СКС следует добавить ЦБ на этом шаге. ЦБ должен быть добавлен в соотношении 1g/8g по отношению к количеству используемого моющего средства.
2. градиент гель кастинг и электрофорез
- Подготовка 3x градиент буфера и акриламида запасов для изготовления градиент гель, aliquot, и хранить при температуре-20 ° c (см. таблицу 3).
- Подготовьте буферы анода и катода и держите на 4 °C (см. таблицу 5).
- Откройте кастинную камеру и поместите наружную стеклянную пластинку (20 см х 22 см) в камеру. Установите один набор рассаров (1,5 мм) с помощью карты выравнивания, чтобы убедиться, что они крепко сидят в стороне и углах камеры. Поместите внутреннюю стеклянную пластинку (20 см х 20 см) поверх прокладки (это образует гель сэндвич), и положить пластиковый лист разделения на верхней части стеклянной пластины.
- Повторите шаг 2,3, пока не будет достигнуто желаемое количество гелей. Для этого протокола, 4 гели литье. Система литья камеры, которую мы используем (см. таблицу материалов) позволяет литья максимум 10 гели одновременно. Take-up оставшееся пространство в камере, сначала добавив, как много акриловых блоков по мере необходимости, а затем стеклянные пластины, если это необходимо.
Примечание: Монтаж должен быть плотно запечатан; между гелевыми сэндвичами в камере не должно быть места. - Поместите полосу парапленки в паз, прежде чем усаживать прокладку твердо на зазубрину прокладки. Поместите уплотнительное блюдо на камеру и затяните все 6 винтов. Стенд литья камеры.
- Место градиент бывший на перемешать пластины с магнитной мешалкой в "легких" смешивания камеры. Подключите трубопровод литья камеры к градиенту бывший, закрепите трубки в кассете перисталистики насоса, и убедитесь, что стоп-кран градиент бывший закрыт.
- Для литья 4 гели, подготовить 60 мл 4% и 60 mL из 12% гель решения (см. таблицу 4) в колбе Эрленмайер и вихрем тщательно перемешать. Налейте 60 mL 4% гель раствор в "легких" смесительные камеры, и 60 мл 12% в "тяжелых" водохранилище камеры градиента бывшего. Установите скорость движения перемешать пластины на 350 оборотов в минуту. Откройте стоп-кран и включите насос в 35 оборотов в минуту.
- После того, как легкая фракция ниже, чем тяжелая фракция, пауза насоса и открыть клапан стволовых между "легких" и "тяжелых" водохранилищ, пусть фракции объем выравниваться, и перезапустить насос.
Примечание: важно, что нет пузырьков войти в систему и получить в ловушке между стеклянными пластинами. Если это произойдет, отменить монтаж, мыть и переделывать. - После того как градиент гель полностью налил, остановить насос, и наложение воды (около 1 мл) на каждый гель сэндвич для предотвращения высыхания геля. Пусть полимеризации в течение 2 ч.
- Приготовьте гель для укладки 25 мл в Эрленмейре и тщательно перемешайте. Удалите воду и вставьте 15 хорошо гребни в каждый гель сэндвич. Налейте укладывая гель и дайте полимеризировать для 2 ч.
Примечание: гели могут быть литье и хранится при температуре 4 ° c в течение 1 недели. - Вставить гель в сэндвич зажимы и удалить гребень. С короткой стеклянной пластиной, облицовкой вниз, вставьте гель-сэндвич в охлаждающий сердечник. Повторите с другой стороны, и поместите ядро в танк электрофорез.
- Налейте 300 мл голубого катодного буфера во внутреннюю камеру резервуара электрофорез. Налейте 2 л анода буфера в наружной камере электрофорез танк.
Примечание: электрод должен быть погружен в Катодный буфер, который требует приблизительно 300 mL. - Нагрузка между 75 мкг и 175 мкг белка на хорошо. Запустите гель на 150 V для 1,5 h (или до тех пор, пока образцы не вошли в градиент гель) в холодном помещении (4 ° c).
Примечание 1:1) минимум 75 мкг в скважины требуется для хорошего разрешения полос активности в гелевых. Загрузка более 175 мкг белка приведет к потере четких полос из-за чрезмерной активности фермента. 2) реплицирует образца должны быть загружены в отдельных скважин для обеспечения параллельного определения в гелевых деятельности и иммунообмного анализа комплексов OXФОС. Параллельное определение ига для CI, ИСИ, ЦПС и CV требует минимум 300 мкг. при параллельном иммунооблих анализе CI, ИСИ, ИСИ, ЦПС и CV требуется минимум 375 мкг. - Удалите синий катод буфер с пипетки или вакуум, заменить на 300 мл сине-свободный Катодный буфер, и запустить гель на 200 V ночь (16-20 ч) в холодном помещении (4 ° c). Перейти к шагу 3 или 4 для измерения активности в гелевых или иммунооблетирования.
3. в-гель деятельности для комплексов I, II, IV и CV
- Перед окончанием электрофореза, подготовьте в геле буферные активности в соответствии с таблицей 6, и держать в ТЕМНОТЕ на RT. 20 мл буфера активности в гель достаточно для 3 полос образца.
Примечание: Этот анализ активности CV в гелевой основе основывается на обратной активности Атфнтраза (т.е. АТФ-гидролиза) и использует кальций в качестве софактора, который осаждает гель. Кальций менее вреден, чем свинец, используемый в других протоколах. Кроме того, использование этого протокола не требует предварительной активации/кондиционирования геля23. - Остановите электрофорез и заберите гель. Срезанные дорожки, при необходимости, и передача геля полос в полиэтиленовых пакетах (3 стороны вырезать, и полиэтиленовый пакет открыт как книга). Печать 2 из 3 сторон с термоуплотнитель.
Примечание: чтобы сравнить состав SC полос между экспериментальными группами, рекомендуется запускать те же образцы в реплицирует на тот же гель. Срезанные полосы для инкубирования каждой репликации в различных буферов активности в гелевых (CI, II, IV, V). Чтобы подтвердить специфичность анализов, дополнительные реплициты могут быть подготовлены для работы в гелевых действиях в присутствии определенных ингибиторов дыхательной цепи. - Для 3 экспериментальных образцов (т. е. 3 скважины) добавьте 20 мл буфера активности в геле, удалите пузырьки и запечатайте 4-ю сторону полиэтиленовый пакет.
Примечание: Добавление ингибиторов в отрицательных экспериментах по контролю при исполнении: CI: Rotenone 1 мкм; ИСИ: натрий Malonate 10 мм; CIII: Антимицин-8 мкм; В: КCN 0,6 mM; CV: Ололиомицин 0,5 мкм. - Инкубируйте полосы геля при температуре 37 °C в темноте и проверяйте каждые 15 мин. время инкубации варьируется в зависимости от количества белка и комплексов. CI будет реагировать быстрее, чем в или CV. оптимальное окрашивание обычно происходит после 2 ч для CI, 4 ч для и 6 ч для ИСИ и CV.
- Промыть гелевые дорожки в воде, чтобы остановить реакцию, и изображение на белом фоне для CI, ИСИ, или черный фон для CV.
Примечание: гели могут храниться в пластиковых пакетах на RT или 4 °C в течение нескольких месяцев.
4. иммунооблотинг
- Подготовьте буфер переноса в соответствии с таблицей 7и храните в RT. Подготовьте ТБСТ и храните в рт.
- Поместите весь гель, или выбранных полос, в контейнере и добавить буферный буфер дополнена СДД (0,25% окончательный в передаче буфера). Поместите контейнер на рокер и инкубировать в течение 1 ч.
- Вырезать ПВХ мембраны (размер, соответствующий размеру геля) и активировать в 20 мл метанола под агитацией в течение 2 мин. Замените 20 мл буфером и поместите под агитацию на 2 мин.
- Подготовка передачи сэндвич, снизу вверх, убедившись, что нет пузыря между гелем и активированный ПВХ мембраны: ясная сторона кассеты/черная Губка/промокательной бумаги/мембраны/гель/промокательной бумаги/черная Губка/Черная сторона кассеты. Закройте и заприте кассету.
- Место Трансфер бутерброд в передаче танк, с четкой стороны сэндвич перед красной стороной электрода, и залить Трансфер буфер для погружения геля. Подключите систему охлаждения к цистерне и установите при температуре 4 °C. Подключение к энергоснабжение, установленных на 40 mA, и запустить в течение 24 ч.
- Извлечение мембран, блок для 1 ч в 5% БСА в ТБСТ, и инкубировать в первичных антител решение подготовлено в 5% БСА в ТБСТ ночь на 4 ° c.
Примечание: см. таблицу 8 для используемых антител. - Промыть мембраны в ТГСТ 3x за 10 мин каждый.
- Инкубировать мембраны в вторичных растворах антител, подготовленных в 5% БСА в ТБСТ для 2 ч при комнатной температуре.
- Промыть мембраны в ТГСТ 3x за 10 мин каждый.
- Добавьте хемилюлюминесцентное раствор к мембране и изображению.
5. анализ
- В гель деятельность анализа изображений или иммунооблоты могут быть использованы для анализа СКС. Для анализа композиции полос, выровнять реплицирует и проверить, какой комплекс положительно отреагировал на каждой данной группы.
- Для анализа распределения комплексов, в различных супрамолекулярных сборок, открытые изображения в Iiiej и использовать инструмент анализа геля (см. Рисунок 5 для примера).
- Выберите полосы с помощью инструмента прямоугольника и полос движения.
- Нарисуйте линии, чтобы закрыть область под кривой каждой группы интересов и нажмите на каждой области с палочкой инструмент для создания таблицы, содержащей площадь под кривой значений.
- Чтобы вычислить распределение комплекса, сообщите значения для каждой группы относительно мономера.
Результаты
На рисунке 2 показаны результаты эксперимента по титрации, направленного на выявление надлежащего количества дигинина, необходимого для извлечения СКС. Эта сумма будет варьироваться в зависимости от типа ткани/ячейки и был ли образец заморожен или нет. Для этого эксперимента была проведена активность в гелевых, чтобы визуализировать МСК, изолированные от свежей митохондрии печени мыши. Были протестированы коэффициенты от 2/1 до 10/1 г./г белка. Оптимальное количество гистонина для данного образца составляет 4 г/г, так как обеспечивает хорошее разрешение мономерные и высокомолекулярные ГТС. При более низком соотношении диапазоны не ясны и не разрешаются в мазке во время электрофореза, в то время как использование более высокого соотношения дигинина приводит к нарушению высокого молекулярного веса SC.
На рисунке 3 и рисунке 4 приведены результаты полного эксперимента, который выполняется на основе подготовки митохондрий печени мыши, полученных с помощью 4 г белка/г. Белки были разделены с использованием гибридных BN/CN-PAGE, Стандартный BN-PAGE, или CN-PAGE. Все три гели были литье в то же время и полос были загружены с реплицирует же образца. После электрофореза отдельные полосы были разрезаны и обработаны для измерения активности геля (CI, ИСИ, ЦИВ и CV на рисунке 3) и иммунооблетирования (CI, ИСИ, CIII, ТПС, CV на рисунке 4).
Добавление CB либо на мгновение в катодной буфер (т.е. гибридный CN/BN-PAGE) или в образце и катодной буфер на протяжении электрофорез (т. е.-PAGE), значительно улучшает мобильность и разрешение полос SC, и отдельных дыхательных комплексов по сравнению с CN-PAGE (рис. 3). Диапазоны легко различимы с гибридной техникой или БН-страницей после того, как активность в гелевых реакционной мощности для, в то время как в той же выборке, разрешенных CN-PAGE, СКС и мономерные реактивные полосы не могут быть идентифицированы.
На рисунке 3 и рисунке 4 показано, что схема разрешения и диапазонов окфосс мономеров и супрамолекулярных сборок качественно СОПОСТАВИМА между гибридным CN/BN-PAGE и BN-Page. Однако существуют заметные различия. Во-первых, электрофонная мобильность комплексов ОКФОС несколько снижается, когда белки разделяются с использованием гибридных условий CN/BN-PAGE VS Стандартный BN-Page, в связи с уменьшенным количеством ЦБ. Этот сдвиг мобильности больше для мономеров, а затем CV мономеров, и CI (рис.3 и рис. 4). Во-вторых, синий фон ниже в гибридных CN/BN-PAGE по сравнению с BN-PAGE (рис. 3, левые полосы). В результате, высокие фоновые уровни после BN-PAGE полностью маскирует окрашивание в гель активности для ИСИ, и усиливает фоновый шум, связанный с активностью димеров (рис.3). В-третьих, активность CV выше, когда образцы запускаются под гибридным CN/BN-PAGE условиях по сравнению с BN-PAGE (рис. 3), в связи с уменьшенным количеством ЦБ, который, как известно, вмешиваться в CV каталитической деятельности. 26 CN/BN-Page также позволяет лучше сохранить CV супрамолекулярных сборок, как показано на большей части общей активности CV, связанные с димеров CV (рис.3). Кроме того, на CN/BN-PAGE отображаются олигомеры CV, в то время как они полностью диссоциированные в условиях BN-PAGE. Интересно, что отдельные группы отображения CV деятельности также наблюдаются между CV мономеров и димеров, когда образцы работают под CN/BN-PAGE (рис. 2).
На рисунке 5 показан репрезентативный анализ комплексного распределения окфос в супрамолекулярных агрегах. Изображение показывает CI в гелевой активности образцов, полученных из 4 различных здоровых печени мыши митохондрий препаратов. Анализ денситометрии позволяет измерить область под кривой CI-реактивных полос и представить относительное распределение активности С1 в мономерные (I1) и супрамолекулярных формах (i1III2, i1III2IV 1, I1III2IVn). Подобный анализ может быть выполнен после иммунообмного.
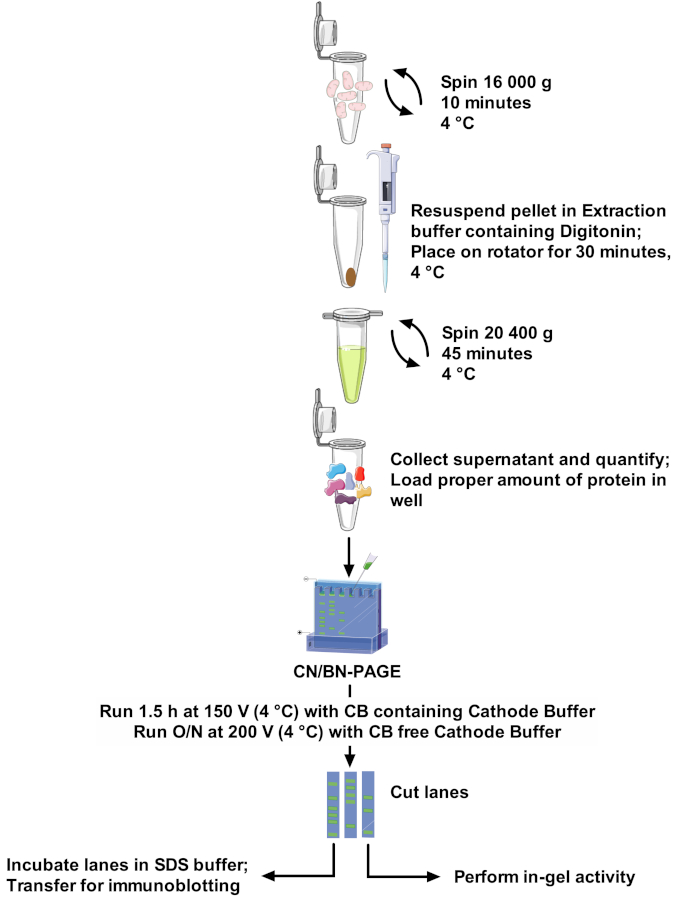
Рисунок 1: процесс анализа. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
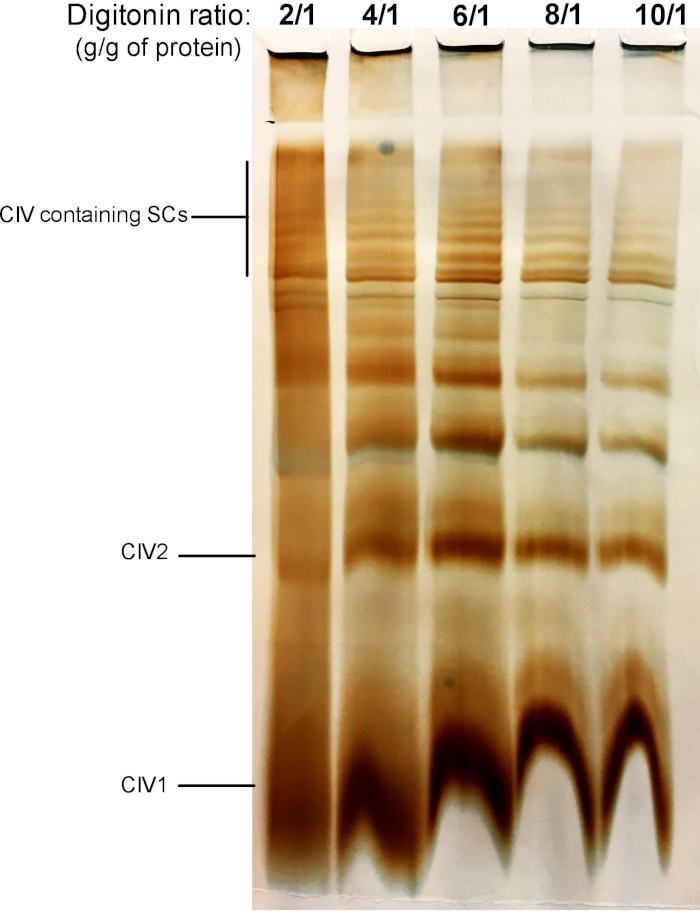
Рисунок 2: титрование гипотонина для извлечения суперкомплексов из свежей митохондрии печени мыши. Этот пример показывает аликвотов митохондрий мыши печени, изолированные от одного животного, которое лечился с увеличением количества дигинина для извлечения дыхательных суперкомплексов. Затем образцы были разрешены гибридным CN/BN PAGE, и была определена активность в геле. В1: комплекс IV мономеров; 2: сложные ДИМЕРЫ IV; SC: суперкомплексы. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
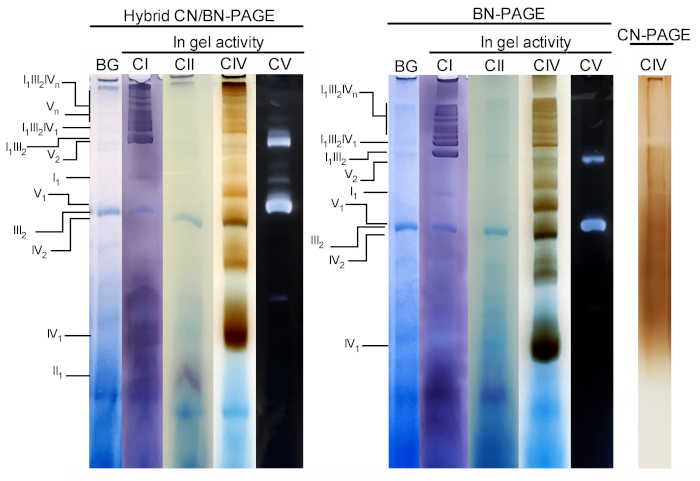
Рисунок 3: активность в гелевых комплексах ОКФОС после ГИБРИДНОГО CN/BN-Page, BN-Page или CN-Page. Печень митохондрии изолированы от одной мыши лечили с помощью Ги, (4 g/g соотношение диготонин/белка) для извлечения дыхательных суперкомплексов. Аликуты этого образца были загружены на несколько скважин в трех различных гелях и представлены в CN/BN-PAGE, BN-PAGE или CN-PAGE. Каждая репликация в каждом геле была затем вырезана и сразу использовалась для анализов активности в гелевых (помечены CI, ИСИ, циг и CV). Один переулок был использован в качестве элемента управления, чтобы показать фона (помечены BG) окрашивание с Coomassie Blue. Комплексы OXФОС и супрамолекулярные агрегаты идентифицируются с использованием стандартной номенклатуры, с цифрами в индексах, указывающими молекулярную стоиметрию каждого комплекса ОКФС. Следует отметить, что позиция супрамолекулярных сборок, содержащих CIII, основывается на иммунообнаружении, так как в данном эксперименте не выполнялась деятельность в области геле для CIII. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.

Рисунок 4: Иммунооблот анализа комплексов окфос после ГИБРИДНОЙ CN/BN-Page или BN-Page. Реплицирует из экспериментов, описанных в рисунке 3 легенда были электро-переданы на одной мембране. После переноса отдельные полосы были разрезаны и инкубированы специфическими антителами, признающими CI, ИСИ, CIII, циг и CV. комплексы ОКФОС и супрамолекулярно-массовых агрегатов идентифицируются с использованием стандартной номенклатуры, с цифрами в индексах, указывающими Молекулярная стоиметрия каждого комплекса ОКФС. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
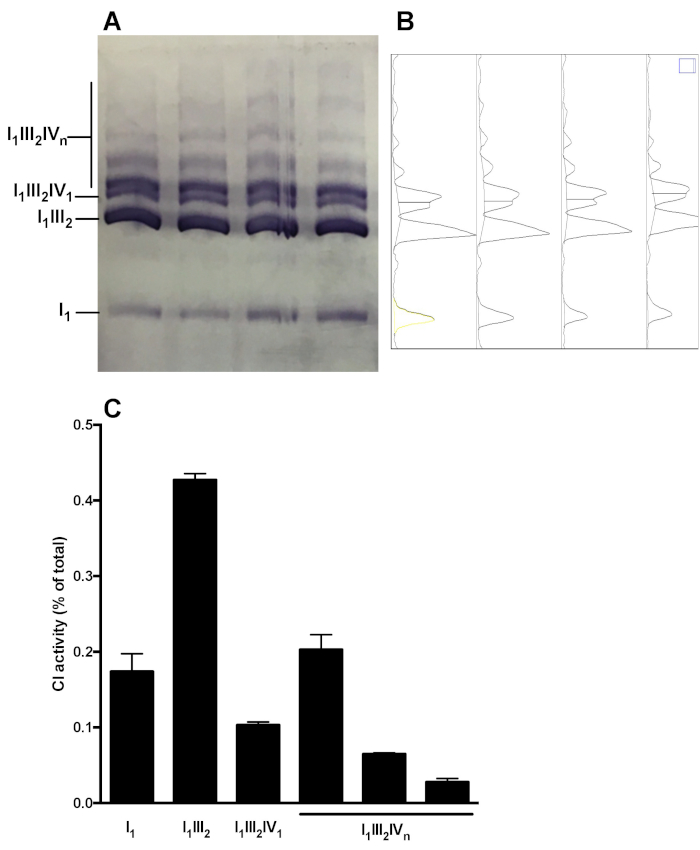
Диаграмма 5: количественная оценка распределения CI в мономерческих и супрамолекулярных собраниях. (A) CI в-гель деятельности определяется следующие гибридные CN/BN-Page в печени МИТОХОНДРИЙ SC экстракты получены из 4 мышей. B) денцтограммы, полученные при помощи геля для анализа изображений, показывающих различные пики, соответствующие CI мономерам (i1) и различным CI-содержащих супрамолекулярных комплексов (i1III2, i1III2IV1 , и I1III2IVn). C) количественное определение относительного распределения активности С1. Данные представляют собой среднее и сем из 4 мышей. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
| Соотношение дикинина/белка (г/г) | 2 г/г | 4 г/г | 6 г/г | 8 г/г |
| Объем буферного извлечения (мкл) | 400 | 300 | 200 | 100 |
| 10%-ный запас дигонина (мкл) | 100 | 200 | 300 | 400 |
| Общий объём буферного извлечения (мкл) | 500 | 500 | 500 | 500 |
Таблица 1: объемы, необходимые для извлечения ГТС из 5 мг митохондриальных белков с использованием различных коэффициентов дигинина/белка.
| Составной | Окончательная концентрация |
| ЭДТА, pH 7,5 | 1 мм в |
| HEPES | 30 мм в |
| Ацетат калия | 150 мм |
| Глицерин | 12 |
| 6-аинопрововая кислота | 2 мм в |
Таблица 2: буфер экстракции SC (окончательные концентрации). Хранить при температуре 4 °C максимум 3 месяца.
| Составной | Окончательная концентрация |
| 3x гель буфер: Aliquot и держать на-20 ° c, pH 7,5 | |
| Имидазол/совместный рН-7,0 | 75 мм |
| 6-аинопрововая кислота | 1,5 м в |
| Буфер акриламида: Aliquot и держать на-20 °c | |
| Акриламида | 99,5% |
| Бис-акриламида | 3 |
Таблица 3: буферы запаса геля.
| Для 2 гелей: | 4% (60 мл) | 12% (60 mL) | Укладка (4%) (25 мл) |
| 3X гель буфер | 19,8 мл | 19,8 мл | 8,25 мл |
| Акриламида буфер | 4,8 мл | 14,4 мл | 2 мл |
| H2O | 35 мл | 13,1 мл | 14,6 мл |
| Глицерин | - | 12 мл | - |
| APS 10% | 360 мкл | 60 мкл | 150 мкл |
| TEMED | 24 мкл | 12 мкл | 10 мкл |
Таблица 4:4%-12% градиент геля.
| Составной | Окончательная концентрация |
| Анод буфер: держать при температуре 4 ° c, pH 7,5 | |
| Имидазола | 25 мм в |
| Катодный буфер: Держите при температуре 4 °C, pH 7,5 | |
| Трицин | 50 мм |
| Имидазола | 7,5 мм |
| С или без Коомсси Блю (G250) | 0,022% |
Таблица 5: буферы электрофорез.
| Составной | Окончательная концентрация |
| Комплекс I деятельности буфер: подготовить свежий в 5 мм рис-совместимого рН 7,4 | |
| Нинайтетазолиум синий | 3 мм в |
| Надн | 14 мм в |
| Комплекс II деятельности буфер: подготовить свежий в 5 мм рис-совместимого рН 7,4 | |
| Сукцинат | 20 мм в |
| ВБГ | 0,2 мм |
| Нинайтетазолиум синий | 3 мм в |
| Комплекс IV деятельности буфера: подготовить свежий в 50 mM Na-фосфат pH 7,2 | |
| Цитохром C | 0,05 мм |
| Диаминобензидин | 2,3 мм |
| Активность ATPsynthase буфер: подготовить свежий в воде, настроить рН до 8 с Кох | |
| Глицин | 50 мм |
| MgCl2 | 5 мм в |
| HEPES | 50 мм |
| Качл2 | 30 мм в |
| Atp | 5 мм в |
Таблица 6: анализ активности в гелевых буферов.
| Составной | Окончательная концентрация |
| Трансфер буфер | |
| База «рис» | 25 мм в |
| Глицин | 192 мм |
| Sds | 4 |
| Метанола | 20 |
| ТБСТ | |
| База «рис» | 20 мм в |
| Nacl | 137 мм |
| Анимация 20 | 0,1% |
Таблица 7: иммуно-иммунные буферы.
| Комплекс | Субъединицы | Клон |
| Я | NDUFA9 | 20C11B11B11 |
| Ii | SDHA | 2E3АТТЕСТАТА 12FB2AE2 |
| Iii | UQCRC2 | 13G12AF12BB11 |
| Iv | COX4 | 1D6E1A8 |
| V | АТПБ | 3D5 |
Таблица 8: антитела, используемые для иммунооболтинга для обнаружения дыхательной цепи SC. Смотрите таблицу материалов для компаний и номера лота.
Обсуждение
В настоящее время активно изучаются Митохондриальные суперкомплексы для выяснения их физиологической роли и их значимости в патогенезе многочисленных заболеваний человека, будь то приобретенные или генетические Митохондриальные заболевания3,7 , 9 , 10 , 11 , 12 , 13 , 14. для получения надежных результатов необходимо рассмотреть несколько аспектов. Этот протокол был протестирован с митохондриями печени митохондрий, мышь скелетных мышц митохондрий (результаты не показано), крысы сердца митохондрии, и человека фибровзрыва митохондрий (результаты не показали), но, безусловно, может быть адаптирована к другим источникам изолированных Митохондрии. Метод оптимально сочетает в себе различные аспекты протоколов BN и CN-страниц, позволяющих свести к минимуму воздействие моющих средств и анионных соединений по сравнению с опубликованными протоколами20,27,28.
Подготовка образцов
Подготовка образцов представляет собой решающий шаг для успешного разделения СКС. буферная композиция должна быть тщательно отобрана для того, чтобы добиться надлежащей растворизации белков и белков, при сохранении как можно большей их функциональной и структурной целостности. Ионная прочность и рН буфера извлечения являются двумя важными факторами для рассмотрения. Концентрация соли, которые являются слишком низкими (< 50 мм к-ацетат или накл) приведет к плохой растворенизации белков в присутствии неионных моющих средств, в то время как концентрация соли выше 500 mM будет способствовать укладки белка/агрегацию, и осадки ЦБ и белки29. Поэтому СКС следует экстрагируется с помощью буферов вблизи физиологических ионных сил. Что касается рН, рекомендуется использовать вблизи физиологических рН.
Тип моющего средства и соотношение моющего средства/белка также имеют решающее значение для оптимальной добычи SC. Для максимального сохранения родного СКС, оцифнин предпочтительнее26. Как показано в настоящем Протоколе и других опубликованных методах23,30,31,32, это мягкое моющее средство сохраняет супрамолекулярный состав нескольких SC собраний, и димерики и олигомерический состав Атфнтраза (рис. 3 и рис. 4). Титрование образцов, представляющих интерес с различным количеством дитонина, имеет решающее значение для определения условий, позволяющих оптимально растворимость, сохраняя активность фермента и физиологические взаимодействия белка. Titration должно быть выполнено с коэффициентами колебаясь между 2 и 8 g/g26. Оптимальные результаты для печени, скелетных мышц и сердечной митохондрий, соответственно, получаются с 4, 5 и 6 г белка. Следует отметить, что на замену дигонина может быть заменен Тритон X-100, который при оптимальных условиях приводит к аналогичной миграции и составу СК, как и к наблюдаемым с помощью дигонина2. Однако, это моющее средство следует использовать с осторожностью, так как относительно небольшое увеличение соотношения моющего средства/белка (например, от 1 до 1,5 г/г) может привести к полной диссоциации СБК сборки2, что может привести к экспериментальной несогласованности. После извлечения образцы традиционно дополняются коомсси Блю, чтобы дать белкам заряд при применении к гелю, за исключением традиционного CN-Page20,26. Чтобы свести к минимуму воздействие белка на Сомасси и потенциальную диссоциацию лабильных белков, образцы не дополняются синим цветом Комасси в этом протоколе.
Электрофорез
Оба CN-PAGE и BN-PAGE были использованы для изучения митохондриальных комплексов ОКФОС, каждый из них имеют явные преимущества и ограничения. Более мягкие условия, используемые при CN-PAGE (главным образом отсутствие ЦБ, который имеет моющее средство, как эффект), позволяет лучше сохранение АТФ синтаза в-гель деятельности, и ограничивает диссоциации лабильных белков в высокой молекулярной массы ГТС и АТФ-синтаза собраний26. Тем не менее, отсутствие анионного красителя CB в экстракт белка и электрофорез буферов вызывает белки мигрировать на основе их внутреннего заряда и Изоэлектрическая точка, которая уменьшает электрофоореотической мобильности белков в гель26. Кроме того, в отсутствие CB, белки с недостаточным отрицательным заряда, как правило, агрегировать, таким образом уменьшая разрешение белковых комплексов в гель20,26. Чтобы обойти эти ограничения, так называемая CN-PAGE с высоким разрешением была разработана Виттиг и Шрэггер20. В этом протоколе деоксичетные натрия (DOC) и различные мягкие неионные моющие средства (DDM, Тритон х 100) добавляются в Катодный буфер, чтобы сохранить мембранные белки и наложить отрицательный сдвиг заряда на белки, что приводит к значительному улучшению резолюции20.
Отличительной особенностью настоящего гибридного протокола CN/BN является то, что сопоставимая резолюция может быть достигнута без этих моющих средств. Мгновенное добавление ЦБ в Катодный буфер в начале электрофореза достаточно для ограничения агрегация белка и повышения подвижности в геле (рис. 3 и Рисунок 4). В результате эта гибридная методика обеспечивает превосходное разрешение различных сборок СС и очень низкую или не подверженность воздействию моющих средств. Наличие низкого количества CB также позволяет лучше сохранение деятельности CV, улучшение сохранения димерических и олигомерные сборки CV (рис. 3 и Виттиг и Шахтер 200526), и снижение синего фонового шума, который может препятствовать количественной оценке активности геля, особенно для ИСИ и ГТУ (рис. 2). Кроме того, отсутствие CB в экстракт белка ограничивает нарушения Лабильно белков взаимодействий в СКС. Например, физическое объединение АТФ-синтаза с ANT для формирования синтазы 33 или с циклофилином-D для регулирования открытия ptp 34 лучше рассматривать в отсутствие CB. Мгновенное воздействие ЦБ во время электрофореза только может поэтому быть полезным, чтобы выявить новые взаимодействия белка в СКС. в целом, этот гибридный протокол CN/BN-PAGE таким образом позволяет сочетать точные и быстрые измерения активности геля с аналитическими методы с участием 2D электрофорез, иммуно-обнаружения и/или протеомики для предварительного анализа СКС. Следует отметить, что с растущим интересом к СКС, все большее число исследований используют небольшие 10 х 10 см гели для родной PAGE. Хотя этот подход может быть достаточным для выявления грубых изменений в сборках SC изобилия, более низкая разделительная способность малых гелей, скорее всего, ограничивается решением тонких перемер или разрезают отдельные полосы для протеомического анализа. Более того, несколько исследований с использованием меньших гелей сообщили, что респирасома мигрирует в том же размере, что и Ацфнтсэ димер, что затрудняет их отмежеваться22. Таким образом, использование больших гелей должно быть благоприятствования.
Раскрытие информации
Ни один
Благодарности
Авторы хотели бы поблагодарить Дженну Росси за техническую помощь, и д-р Мирей Хачо, д-р Дэвид Паттен и д-р Ujval Анил Кумар для полезной дискуссии при разработке этого метода. Эта работа финансировалась канадскими институтами медицинских исследований (CIHR) и национальным научным и инженерным Советом Канады (NSERC). AC является получателем докторской премии-Фредерик Бантинг и Чарльз Лучшие стипендии Канады (CIHR).
Материалы
| Name | Company | Catalog Number | Comments |
| 3,3'-Diaminobenzidine tetra-hydrochloride hydrate | Sigma | D5637 | |
| 6-amino caproic acid | sigma | A2504 | |
| Acrylamide | Sigma | A3553 | |
| Adenosine 5'-triphosphate disodium salt hydrate | sigma | A3377 | |
| Anti-ATPB antibody [3D5] - Mitochondrial Marker | Abcam | ab14730 | Lot number GR3174539-12, RRID AB_301438 |
| Anti-SDHA antibody [2E3GC12FB2AE2] | Abcam | ab14715 | Lot number GR3235943-1, RRID AB_301433 |
| Anti-UQCRC2 antibody [13G12AF12BB11] | Abcam | ab14745 | Lot number GR304308-3, RRID AB_2213640 |
| Bis N,N'-Methylene-Bis-Acrylamide | Biorad | 1610201 | |
| Brilliant Blue G | Sigma | 27815 | |
| COX4 Monoclonal Antibody (1D6E1A8) | Invitrogen | 459600 | Lot number TI2637158, RRID AB_2532240 |
| Cytochrome c from equine heart | sigma | C7752 | |
| Digitonin | Sigma | D141 | |
| Fisherbrand FH100M Multichannel Peristaltic Pumps | Thermo Fisher | 13-310-660 | |
| Imidazole | Sigma | I0250 | |
| Inner Glass Plates. Pkg of 2, 20 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with outer plate | Biorad | 1651823 | |
| Model 485 Gradient Former. 40-175 ml acrylamide gradient former, includes valve stem and tubing kit, for use with Mini-PROTEAN multi-casting chamber systems | Biorad | 1654120 | |
| NDUFA9 Monoclonal Antibody (20C11B11B11) | Invitrogen | 459100 | Lot number TD2536591, RRID AB_2532223 |
| Nitrotetrazolium Blue chloride | Sigma | N6639 | |
| Outer Glass Plates. Pkg of 2, 22.3 x 20 cm, glass plates for 20 cm PROTEAN II xi and PROTEAN II XL electrophoresis cells, use with inner plate | Biorad | 1651824 | |
| Phenylmethanesulfonyl floride | Sigma | P7626 | |
| Powerpack 1000 | Biorad | Serial Number 286BR 07171 | |
| PROTEAN II Sandwich Clamps. Pkg of 2, clamps for running gels, for 20 cm PROTEAN II xi electrophoresis cell, 1 left and 1 right | Biorad | 1651902 | |
| PROTEAN II xi Cell. Large format vertical electrophoresis cell, 16 x 20 cm gel size, 4 gel capacity, spacers and combs | Biorad | 1651811 | |
| PROTEAN II xi Comb. Pkg of 1, 15-well, 1.5 mm, comb for PROTEAN II xi electrophoresis cell | Biorad | 1651873 | |
| PROTEAN II xi Multi-Gel Casting Chamber. Multi-gel casting chamber, 20 x 20 cm gel size, for up to ten 1.5 mm thick gels, includes sealing plate, gasket, separation sheets, acrylic blocks, PROTEAN II XL alignment cards | Biorad | 1652025 | |
| PROTEAN II xi Spacers. Pkg of 4, 1.5 mm, spacers for 20 cm PROTEAN II xi electrophoresis cell | Biorad | 1651849 | |
| SCIENCEWARE Utility Bags (10 x 12") 4 mil, Bel-Art, Box of 100 | VWR | 11215-388 | |
| Thick Blot Paper. Pkg of 25 sheets, 15 x 20 cm, absorbent filter paper, for use with Trans-Blot cassette | Biorad | 1703956 | |
| Trans-Blot Cell With Plate Electrodes and Super Cooling Coil. Transfer cell and cooling coil (#170-3912), includes 2 gel holder cassettes, buffer tank, lid with cables, fiber pads, 1 pack blot paper | Biorad | 1703939 |
Ссылки
- Shagger, H. Respiratory Chain Supercomplexes. IUBMB Life. 52 (3-5), 119-128 (2001).
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Molecular Cell. 32 (4), 529-539 (2008).
- Greggio, C., et al. Enhanced Respiratory Chain Supercomplex Formation in Response to Exercise in Human Skeletal Muscle. Cell Metabolism. 25 (2), 301-311 (2017).
- Schagger, H., Pfeiffer, K. The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes. Journal of Biological Chemistry. 276 (41), 37861-37867 (2001).
- Milenkovic, D., Blaza, J. N., Larsson, N. G., Hirst, J. The Enigma of the Respiratory Chain Supercomplex. Cell Metabolism. 25 (4), 765-776 (2017).
- Acin-Perez, R., Enriquez, J. A. The function of the respiratory supercomplexes: the plasticity model. Biochimica et Biophysica Acta. 1837 (4), 444-450 (2014).
- Vartak, R., Porras, C. A., Bai, Y. Respiratory supercomplexes: structure, function and assembly. Protein Cell. 4 (8), 582-590 (2013).
- Lapuente-Brun, E., et al. Supercomplex Assembly Determines Electron Flux in the Mitochondrial Electron Transport Chain. Science. 340 (6140), 1567-1570 (2013).
- Lazarou, M., Smith, S. M., Thorburn, D. R., Ryan, M. T., McKenzie, M. Assembly of nuclear DNA-encoded subunits into mitochondrial complex IV, and their preferential integration into supercomplex forms in patient mitochondria. The FEBS Journal. 276 (22), 6701-6713 (2009).
- Sun, D., Li, B., Qiu, R., Fang, H., Lyu, J. Cell Type-Specific Modulation of Respiratory Chain Supercomplex Organization. International Journal of Molecular Sciences. 17 (6), (2016).
- D'Aurelio, M., Gajewski, C. D., Lenaz, G., Manfredi, G. Respiratory chain supercomplexes set the threshold for respiration defects in human mtDNA mutant cybrids. Human Molecular Genetics. 15 (13), 2157-2169 (2006).
- Antoun, G., et al. Impaired mitochondrial oxidative phosphorylation and supercomplex assembly in rectus abdominis muscle of diabetic obese individuals. Diabetologia. 58 (12), 2861-2866 (2015).
- Kanaan, G. N., Patten, D. A., Redpath, C. J., Harper, M. -. E. Atrial Fibrillation Is Associated With Impaired Atrial Mitochondrial Energetics and Supercomplex Formation in Adults With Type 2 Diabetes. Canadian Journal of Diabetes. , (2018).
- Kuter, K., et al. Adaptation within mitochondrial oxidative phosphorylation supercomplexes and membrane viscosity during degeneration of dopaminergic neurons in an animal model of early Parkinson's disease. Biochimica et Biophysica Acta. 1862 (4), 741-753 (2016).
- McKenzie, M., Lazarou, M., Thorburn, D. R., Ryan, M. T. Mitochondrial Respiratory Chain Supercomplexes Are Destabilized in Barth Syndrome Patients. Journal of Molecular Biology. 361 (3), 462-469 (2006).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovascular Research. 80 (1), 30-39 (2008).
- Jang, S., et al. Elucidating Mitochondrial Electron Transport Chain Supercomplexes in the Heart During Ischemia-Reperfusion. Antioxidants & Redox Signaling. 27 (1), 57-69 (2017).
- Frenzel, M., Rommelspacher, H., Sugawa, M. D., Dencher, N. A. Ageing alters the supramolecular architecture of OxPhos complexes in rat brain cortex. Experimental Gerontology. 45 (7), 563-572 (2010).
- Krause, F. Detection and analysis of protein-protein interactions in organellar and prokaryotic proteomes by native gel electrophoresis: (Membrane) protein complexes and supercomplexes. Electrophoresis. 27 (13), 2759-2781 (2006).
- Wittig, I., Karas, M., Schagger, H. High Resolution Clear Native Electrophoresis for In-gel Functional Assays and Fluorescence Studies of Membrane Protein Complexes. Molecular Cell Proteomics. 6, 1215-1225 (2007).
- Wittig, I., Braun, H. P., Schagger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Jang, S., Javadov, S. Current Challenges in Elucidating Respiratory Supercomplexes in Mitochondria: Methodological Obstacles. Frontiers in Physiology. 9, 238-238 (2018).
- Cuillerier, A., et al. Loss of hepatic LRPPRC alters mitochondrial bioenergetics, regulation of permeability transition and trans-membrane ROS diffusion. Human Molecular Genetics. 26 (16), 3186-3201 (2017).
- Pallotti, F., Lenaz, G. . Methods in Cell Biology. 80, 3-44 (2007).
- Wieckowski, M. R., Giorgi, C., Lebiedzinska, M., Duszynski, J., Pinton, P. Isolation of mitochondria-associated membranes and mitochondria from animal tissues and cells. Nature Protocols. 4, 1582 (2009).
- Wittig, I., Schägger, H. Advantages and limitations of clear-native PAGE. PROTEOMICS. 5 (17), 4338-4346 (2005).
- Jha, P., Wang, X., Auwerx, J. Analysis of Mitochondrial Respiratory Chain Supercomplexes Using Blue Native Polyacrylamide Gel Electrophoresis (BN-PAGE). Current Protocols in Mouse Biology. 6 (1), 1-14 (2016).
- Beutner, G., Porter, G. A. Analyzing Supercomplexes of the Mitochondrial Electron Transport Chain with Native Electrophoresis, In-gel Assays, and Electroelution. Journal of Visualized Experiments. (124), e55738 (2017).
- Von Hagen, J. . Proteomics Sample Preperation. , 485 (2008).
- Couoh-Cardel, S. J., Uribe-Carvajal, S., Wilkens, S., García-Trejo, J. J. Structure of dimeric F1F0-ATP synthase. The Journal of Biological Chemistry. 285 (47), 36447-36455 (2010).
- Strauss, M., Hofhaus, G., Schröder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO Journal. 27 (7), 1154-1160 (2008).
- Schägger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. The EMBO Journal. 19 (8), 1777-1783 (2000).
- Wittig, I., Schägger, H. Structural organization of mitochondrial ATP synthase. Biochimica et Biophysica Acta - Bioenergetics. 1777 (7), 592-598 (2008).
- Giorgio, V., et al. Dimers of mitochondrial ATP synthase form the permeability transition pore. Proceedings of the National Academy of Sciences of the United Stated of America. 110 (15), 5887 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены