Method Article
מדריך לבניית מאוד נוטה נסחף מיקרוסקופ אריח עבור הדמיה מולקולה בודדת שדה-of-view מורחבת
In This Article
Summary
הוראה מפורטת מתואר כיצד לבנות מאוד נוטה נסחף מיקרוסקופ אריח (HIST) ואת השימוש עבור הדמיה מולקולה בודדת.
Abstract
מולקולה בודדת הדמיה התקדמה באופן משמעותי ההבנה שלנו של המנגנונים המולקולריים במחקרים ביולוגיים. עם זאת, זה היה מאתגר כדי לקבל שדה-of-view גדול תמונות חדות גבוהה ב עבה תאים ורקמות. כאן, אנחנו מציגים מיקרוסקופ מאוד נוטה להיסחף אריח (HIST) מתגבר על הבעיה הזו. זוג עדשות גלילי בוצע כדי ליצור של קרן עירור מוארך שנסרק על אזור ההדמיה גדול באמצעות מראה galvo מהר. תצורה 4נ שימש כדי למקם רכיבים אופטיים. מצלמה מדעי משלימים המוליך למחצה זיהה את האות קרינה פלואורסצנטית וחסם את הרקע out-of-להתמקד עם חתך קונאפוקלית דינמי מסונכרן עם קרן גורף. אנו מציגים את ההוראות צעד אחר צעד לבניית המיקרוסקופ HIST עם כל הרכיבים הבסיסיים.
Introduction
קרינה פלואורסצנטית מולקולה בודדת הדמיה ממלא תפקיד חשוב במחקרים ביולוגיים רבים החושפים ultrastructures, דינמיקה, כמות מולקולות1,2,3. עם זאת, זה מאתגר ללמוד יחיד-מולקולות בתוך תאים או רקמות. בעוד מיקרוסקופיה קונפוקלית מספק יכולת אופטים גבוהה4, הוא לא מתאים עבור הדמיה מולקולה בודדת עקב photobleaching קשות על ידי עירור גבוהה בעוצמה או הדמיה במהירות איטית. מיקרוסקופ Widefield משתמש תאורה חלשה יותר, אך סובל האות עניים על רקע יחס (SBR)5. מיקרוסקופ אור גיליונות, מצד שני, יכול להראות טוב חלוקתה ו- photobleaching נמוך6; עם זאת, זמינות מספרי הצמצם (NA) מאוד מוגבל על ידי הדרישה של מטרות שמוקם orthogonally7. לחלופין, זה דורש מיוחדת illuminators ומדגם צ'יימברס8,9.
מסיבות אלו, נוטה מאוד, למינציה גיליון אופטי (חילו) מיקרוסקופיה כבר בשימוש נרחב עבור תלת-ממד יחיד מולקולה הדמיה10. הקורה נוטה נתקלת ממשק של שני חומרים (זכוכית, מים, למשל), הקרן משתקף על פי חוק סנל. חשוב, קרן משובש נעשה דק יותר, את עוביו מתואר dz = R/tan(θ) כאשר R הוא הקוטר של הקורה נוטה ו θ באמצעות הוא זווית שבירה קרן המשודרת. מימוש פשוט זה תוצאות אופטים יכולת טובה. למרות זאת, יחס זה מציין כי תאורה דק (קרי, גבוהה אופטים יכולת) דורש a R קטן ו/או של θ באמצעות גדולים. לדוגמה, כאשר R = 20 מיקרומטר ו θ באמצעות = 72 מעלות, הוא יכול להשיג dz = 6.5 מיקרומטר. מכיוון שאין מגבלה מעשית להגדלת זווית שבירה כדי התמונה עמוק בתוך תאים ולהימנע גמורה, יש זוג חזקה של הקוטר תאורה, בעובי הקורה. מסיבה זו, הילו הדמיה מראה קטנה יחסית שדה-של-תצוגה (FOV) המגבילה באופן משמעותי וביישומיה בתחום ההדמיה multicellular.
לאחרונה, אנו יש להתגבר על בעיה זו על ידי מיקרוסקופ מאוד נוטה להיסחף אריח (HIST) איפה FOV decoupled מ בעובי הקורה דרך מאוד פשוטה11. ראשית, קרן מוארך בכיוון אחד נוצר באמצעות זוג עדשות גלילי. קרן זו, כינה אריח, מייצרת של תאורה דק עם הצניחה ~ 4 מיקרומטר בעוד FOV שלה הוא 130 x 12 מיקרומטר2. לאחר מכן, המשבצת הוא פשט את הדגימה באמצעות מראה galvo מסתובב. בינתיים, בתמונה זריחה מתועד במצלמה מדעי משלימים תחמוצת מתכת מוליכים למחצה (sCMOS) מסננים ביעילות out-of-להתמקד ברקע על ידי הפעלה במצב תריס מתגלגל המשמש כאמצעי זיהוי tunable שסע קונפוקלי. בדרך זו, מיקרוסקופיה HIST מאפשר הדמיה מולקולה בודדת עם תצוגה של שדה גדולה (~ 130 x מיקרומטר 1302) והארה דק יותר מאשר הדמיה חילו. אנחנו מוחלים זה חדש הדמיה טכניקה לגילוי תעתיקים RNA עם מכשיר בדיקה בודדת בתאים או עם כמה הגששים ברקמות המוח העכבר, אשר יש פוטנציאל משמעותי ללמוד ביטוי גנים ומחלות. בניגוד גישות אחרות, HIST מעסיקה רק מטרה אחת מפתח נומרי גבוהה ללא מאייר נוספים או מטרות זיהוי מרחוק, תואם באופן מלא עם מיקרוסקופים הפוכה. יתרונות אלה FOV גדולים, חדות גבוהה יגרום HIST מיקרוסקופ כלי בולטים ביולוגיה ורפואה. אנו מציגים הוראות מפורטות לגבי אינסטרומנטציה של המיקרוסקופ HIST, ואיך לבדוק, לכייל את הביצועים שלו כמפורט להלן.
Protocol
1. הגדרת הכלים מיקרוסקופ, לייזרים ויישור
- לפני בניית המיקרוסקופ, להכין את כל המרכיבים הדרושים לרבות optomechanics, אופטיקה, אלקטרוניקה כמפורט בטבלה שלחומרים.
- להכין גופה מיקרוסקופ מורכב בעיקר שני חלקים: מחזיק אובייקטיבית עם יציאת הליכי משנה RMS ו piezo-שלב רכוב על בלוק אלומיניום (איור 1א').
הערה: הגוף מיקרוסקופ בהזמנה אישית משמש את הנוחות והגמישות של מכשור12. כל גוף מיקרוסקופ זמינים מסחרית יכול לשמש HIST מיקרוסקופ. - שילוב של מספר קווי לייזר ו צימוד אותם לסיב סינגל מוד
- התקנת 405, 561, 638 ננומטר לייזר על גבי האופטי שולחן ולשלב את הקורות דרך מפצל קרן מהפכנית, מראה ודיקרואיק זוהר פס ארוך כפי שמוצג באיור 1ב'. ודא כי כל קרני לייזר עוברים דרך pinholes על הכלי יישור. להוסיף חצי לוחיות גל עבור כוח התאמה.
הערה: ללבוש משקפי בטיחות להגנה העין ולהשתמש קרן-בלוקים כדי לספוג את קרני לייזר לא רצויים. - התקנת עדשה צימוד סיבים (f = 4.5 מ מ) מתאם סיבים שנערך ציר z תרגום עם מערכת הכלוב.
- לחבר סיבים כינוייהם (MMF, Ø 62.5 מיקרומטר) המתאם סיבים. התאם כל זוג במראה ההיגוי ומתרגם את z-עד היעילות צימוד של כל לייזר הוא גבוה יותר מ 95%. קרן פלט יש פרופיל בצורת גאוסיאן ליד עם דפוסים חודרני.
- לקחת סיבים כינוייהם וחבר בד סינגל מוד (SMF). בדומה MMF, לכוונן, למקסם את היעילות צימוד של לייזרים שלוש.
- התקנת 405, 561, 638 ננומטר לייזר על גבי האופטי שולחן ולשלב את הקורות דרך מפצל קרן מהפכנית, מראה ודיקרואיק זוהר פס ארוך כפי שמוצג באיור 1ב'. ודא כי כל קרני לייזר עוברים דרך pinholes על הכלי יישור. להוסיף חצי לוחיות גל עבור כוח התאמה.
- להרכיב מקור אור מקבילות שישמש עבור קרן יישור בנתיבים עירור וזיהוי. התקן זה מורכב של מקור אור קוהרנטי חנותם (561 ננומטר) מחובר SMF, מתאם סיבים, עדשה אכרומטית (f = 60 מ מ), איריס, Ø1 "צינור מרווח במערכת הכלוב (איור 1C). להתאים את המרחק בין המתאם סיבי העדשה באמצעות interferometer הטיה על מנת להבטיח את collimation.
- להכין כלי יישור קרן (איור 1D). זה זוג של אלומיניום פוסטים עם pinholes בגובה 2" מפני השטח של שולחן אופטי, מה שמאפשר עבור יישור קרן מהיר ומדויק.
- להרכיב מערכת חריר כפול המורכב Ø1 שני "שברי זכוכית יישור דיסקים בכל קצה, Ø1 שני" עדשה צינורות (התחתון מחוררת), כפי שמוצג באיור 1E.
2. הגדרת הנתיב זיהוי
- להוציא את המטרה ולהתקין את מקור האור מקבילות. להתאים את ידיות של המראה (M1) מתחת המחזיק אובייקטיבית כך הקרן פלט מן המיקרוסקופ הוא בערך מקביל השולחן האופטי בגובה מיושר עם חורים מושחל על השולחן. עיין איור 2 למשרות מפורט של כל רכיב אופטי.
- להוסיף מראה ודיקרואיק זוהר multiband (DM), משקפים את הקרן ב- 90 מעלות. להשתמש את הגודל המרבי של הקשתית וודא כי הקרן עובר דרך המרכז של השיקוף ודיקרואיק זוהר ללא מסיכה.
- השתמש קרן דולפים עובר דרך המראה ודיקרואיק זוהר להנחות את היישור של איתור נתיב. למקם את מצלמת sCMOS הקורה וודא כי הקרן פוגע במרכז השבב המצלמה בעזרת שתי מראות (M2 ו- M3).
- הוסף עדשה צינור (TL; f = 300 מ"מ) כ-300 מ מ מן המצלמה.
- להסיר את מקור האור מקבילות ולהתאים את המרחק היחסי בין העדשה שפופרת המצלמה עד דפוס על התקרה בבירור תיפתר על ידי המצלמה.
- הכנס של הלהקה רב מסנן (BF) לפני העדשה צינור עבור צבע רב זריחה הדמיה.
3. הגדרת הנתיב עירור
- התקן מחדש את מקור אור מקבילות על המחזיק אובייקטיבית. להציב קיפול-מראה (M4) כדי לנתב מחדש את פלט קרן תגלי את-90 מעלות. התאם בידית של המראה ודיקרואיק זוהר ומראה את הקיפול-iteratively עד הקורה עובר pinholes הכלי יישור קרן.
- ניתוק מקור האור מקבילות ולהתקין אותה על השולחן, שבו הקרן מצביעה לכיוון הגוף מיקרוסקופ. יישר את הקרן באמצעות כלי יישור קרן ומערכת חריר כפול.
- הוסף עדשה L4 (f = 400 מ"מ; Ø = 2") לנתיב האופטי כ 400 מ"מ בלבד המחזיק אובייקטיבית. התקן את העדשה אובייקטיבי, לכוונן את המיקום של L4 לאורך הציר האופטי עד תבנית איירי מושלמת נוצר על התקרה.
הערה: בעת הוספת העדשה, תנוחת הקורה עובר דרך העדשה יש לשמור ללא שינוי. העדשה L4 יש חוט SM2 המאפשר לו להיות מחובר/מנותק מ 60 מ מ כלוב הליכי משנה SM2 צלחת בקלות. - לפרק את המטרה ולהתקין מחדש את מקור האור מקבילות עם קשתית פתוחה. זכר הפלט קרן של המיקרוסקופ עם כרטיס ביקור. הר ראי M5 במקום בו הגודל של קרן הקטן ביותר, כ- 400 מ"מ הרחק L4, אשר הוא מטוס התמונה מצומדת (cIP).
- יש להתקין מראה M6 ומשקפים את הקרן ב- 90 מעלות. להתאים M5 M6 iteratively בעזרת הכלי יישור קרן.
- הוסף עדשה L3 (f = 150 מ מ) בערך 150 מ מ בלבד M5. השתמש interferometer גזירה כדי להבטיח את collimation של קרן פלט.
- באופן זמני לקחת L4 ו מעקב את הקורה כדי למצוא את המיקום מוקד של L3. שמים מראה galvo ציר יחיד בשלב זה, אשר הוא מטוס בחזרה מוקד מצומדת (cBFP). לספק 0 וולט למראה galvo וסובב בעל המראה galvo כך שישקף את הקרן ב- 90 מעלות.
- המקום M7 קיפול-מראה. כראוי מקום L2 (f = 100 מ מ) באותו אופן כמו שלב 3.6.
- הסר מקור האור מקבילות המחזיק אובייקט. התקנת עדשה collimation L1 (f = 100 מ מ), סיבים מתאם ואיריס. להתחבר סיבים סינגל מוד המתאם ולשלוח את קרן דרך מערכת הדמיה.
- הכנס מחדש L4 וללטש את המערכת להופעת תבנית איירי מושלם על התקרה.
4. הגדרת את העדשות גלילי
- הוסף עדשה גלילית (CL1, f = 400 מ) לאחר L1 ולוודא כי גלילי העדשה מתמקדת הקרן לאורך ציר ה-x.
- להוסיף עוד עדשה גלילית (CL2, f = 50 מ מ) לנתיב קרן. השתמש interferometer גזירה כדי להבטיח שקרן פלט היא ממוקדת.
הערה: המרחק בין שתי העדשות גלילי הוא 450 מ מ. קרן פלט יש יחס הדחיסה של 8, תבנית מוארכת סגלגל בצורת איירי נוצר על התקרה.
5. בדיקות דימות אריח
- להכין את הדגימה הידרוג תלת-ממד. מיקס 20 ננומטר ארגמן חרוזים עם פתרון הידרוג, אשר מורכב של 12% acrylamide:bisacrylamide (29:1), 0.2% (v/v) TEMED ו- 0.2% (w/v) קירור במאגר x TAE 0.75. מזריקים µL 50 של הפתרון מעורב לתוך תא זרימה כמתואר11. לאחר 10 דקות, המדגם הידרוג 3D הוא מוכן עבור הדמיה.
- שים המדגם על המחזיק לדוגמה. הפעל 638 ננומטר לייזר ולהתאים את הכוח < 1 mW עבור עירור מדגם.
- להפעיל את התוכנה בקרת מצלמה. בחלונית רכישה-הגדרה ' מצלמה ', בחר פנימית מפעיל מצב ולאחר מכן לחץ על לקחת וידאו בחינם פועל במצב.
- מעט להתאים את המיקום של המצלמה כך התמונה ממוקמת במרכזו של המצלמה 0 וולט מוחל על המראה galvo.
- סובב את כפתור אופקי של השיקוף M5 להשיג תאורה מאוד נוטה.
הערה: עם העלייה של זווית תאורה, הידרוג התמונה הופכת להיות יותר ברור מזה של התמונה אפי כמו הקרן נעשה דק יותר. עם זאת, התמונה שומר כמעט באותה התנוחה. - להקליט את תמונת אריח. לחשב את רוחב תאורה יעילה11. לדוגמה, איור 3 מראה את הרוחב תאורה יעילה של 12 מיקרומטר.
6. היסטוריה הדמיה
- להכין לוח רכישת נתונים מקושר עם בלוק מסוף. חבר מחבר BNC משתמש 1 עם P0.0 באמצעות כבל חשמלי. שימוש משתמש 1 פלט דיגיטלי עבור הפעלה חיצוניים של המצלמה sCMOS. חיבור אנלוגי פלט AO0 נהג מראה galvo.
- ליצור רכבות הדופק TTL מ- P0.0 באמצעות תוכנית בהזמנה אישית (איור 4א) וקבע את מועד המחזור = 400 ms ו- t_ON = 2 גב' לבדוק הפולסים שנוצר בין משתמש 1 BNC מסוף אוסצילוסקופ דיגיטלית ולאחר מכן חבר את כבל BNC למצלמה יציאת טריגר חיצוני.
הערה: התוכנה שליטה בשימוש הנייר הזה זמין על פי בקשה. כאשר הדמיה במחירים מסגרת למצלמה אחרת, תקופת זמן צריך להיות מותאם בהתאם. - התחל גורף מראה galvo באמצעות התוכנית בהזמנה אישית. התאם Vמינימום ל-500 mV ו- Vמקסימום 500 mV לדימות FOV מלאה. שימו לב כי תחת פעולה זו, 3D הידרוג דגימות עדיין להראות רקע דומה תאורה אפינפרין.
- שינוי הגדרות רכישת המצלמה.
- בחר חיצוני מפעיל מצב ומטה (שקריאה) בתפריט הנפתח LightScan פלוס כפי שמוצג באיור 4B.
הערה: בהגדרה זו, המצלמה לא לוקח תמונות. אלא אם כן אות ההדק מופעלת. - לחץ על סרוק ספיד קונטרול עבור החלון גובה וקו פקד זמן חשיפה ולהגדיר את הערכים להיות שורות 180 ו- 28 ms, בהתאמה.
הערה: כאשר רוחב אריח (Weff) הוא 180 שורות (12 מיקרומטר) והוא מועד אינטגרציה בכל שורה (Tint) 28 ms, זמן השהיה בין השורות (TD) נקבע כמו TD = Tint/Weff = גב 0.156 הדמיה 2,048 x 2,048 פיקסלים, הזמן הכולל רכישת הוא 2,048 x TD + Tint = ms 346, המתאים ~2.9 fps.
- בחר חיצוני מפעיל מצב ומטה (שקריאה) בתפריט הנפתח LightScan פלוס כפי שמוצג באיור 4B.
- מעט להתאים Vmax ו- Vדקות לקבלת תמונות ברורות יותר.
- להשיג תמונות בערימה תלת-ממד באמצעות התוכנית בהזמנה אישית על-ידי החלפת מחסנית 3D על וציון מספר המחסניות ואת גודל צעד.
תוצאות
לדוגמה, דנ א חד גדילי המסומנת Atto647N צולמה עם אורך גל עירור של 638 nm, הידרוג תלת-ממד. ה-DNA שעגנה לרשת הידרוג ויה moiety acrydite במהלך ג'ל הפילמור. התמונות צולמו ב 5 מיקרומטר מעל פני השטח כפי שמוצג באיור 5. התמונה HIST הראה הרבה פחות רקע בהשוואה לתמונה אפינפרין, שממנו מחושב את אות יחס רקע להיות ± 1.9 0.7 עבור התמונה HIST בעוד רוב המקומות מולקולה בודדת יכולה בקושי יזוהו על-ידי אפינפרין.
קרינה פלואורסצנטית RNA מולקולה בודדת בהכלאה באתרו (smFISH) בוצעה עם 4 דגים רגשים. איור 5 b מציג תמונות smFISH של EEF2 (תרגום האיקריוטים התארכות פקטור 2) המסומנת AlexaFluor 647 על תאים A549 מאגר הדמיה (עיין העבודות הקודמות שלנו לגבי הכנת המדגם11). תחזית העוצמה המקסימלית בוצעה על 20 z-ערימות המייצגים 5 מיקרומטר עובי. התמונה HIST הראה לא רק SBR השתפרה אבל גם יותר תאורה אחידה לעומת אפינפרין התמונה. עבור הדמיה אפינפרין, הפעם חשיפה הייתה 400 ms בזמן עבור HIST הדמיה השילוב היה זמן בכל שורה 32 ms, אשר שניהם היה את אותו הכוח תאורה של 7.5 mW נמדד לפני המטרה. המהירויות הדמיה של אפינפרין, HIST היו 2.5 fps.

איור 1 . כלי הגוף, לייזרים ויישור מיקרוסקופ. (א) המטרה, בעל מדגם. (B) תמונה של מערכות לייזר. LP, זמן לעבור המראה ודיקרואיק זוהר; צלחות λ/2, חצי-גל; PBS, beamsplitter מהפכנית. (ג) Collimated מקור האור. (ד) קרן הכלי יישור עם שני pinholes ניתן להוספה. מערכת חריר כפול (E). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
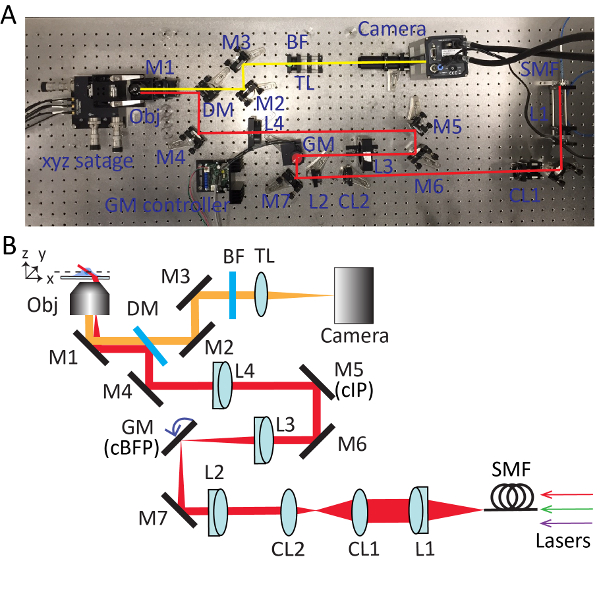
איור 2 . הגדרה מפורטים עבור מיקרוסקופ מאוד נוטה להיסחף אריח (HIST). צילום (A) ו- (B) סכמטית HIST מיקרוסקופ מערכת. BF, מסנן לעבור הלהקה רב; CL1-2, גלילי עדשות; מיט, מראה ודיקרואיק זוהר; GM, מראה galvo; BF, מסנן לעבור הלהקה; M1-7, מראות; L1-4, עדשות; SMF, סינגל מוד סיבים; TL, עדשה צינור; cIP, התמונה מצומדת המטוס; cBFP, מצומדת במישור המוקד בחזרה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
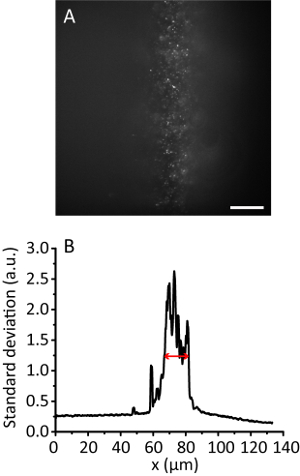
איור 3 . אריח תאורה עם יחס דחיסה של 8. (א) זריחה תמונה של 20 ננומטר חרוזים ב הידרוג תלת-ממד. סולם בר, 20 סטיית תקן הקרנה מיקרומטר. (B) לאורך כיוון y A, החליק על-ידי נתונים 10 נקודות. החץ האדום מציין רוחב של תאורה יעילה של 12 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
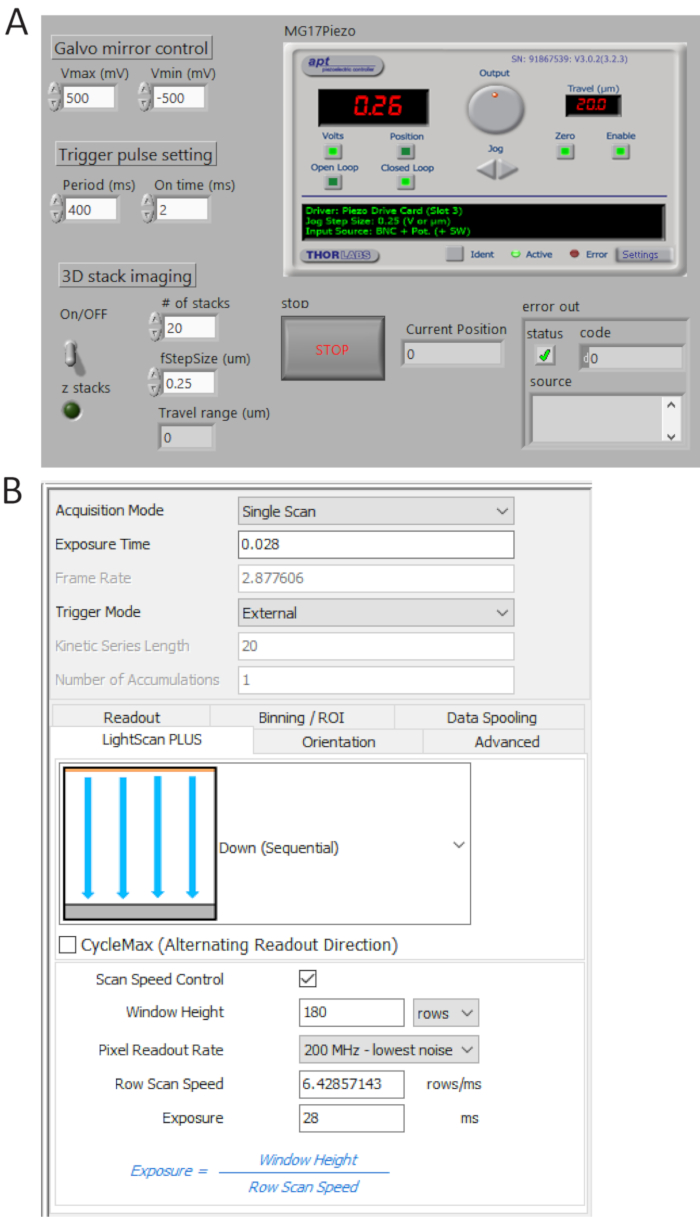
איור 4 . תוכנות ליצירת תמונות ובקרה מול לוחות. תוכנית LabView בהזמנה אישית (א) א שולטת באופן סינכרוני סריקה של המראה galvo, הרכישה ההתחלתי של מצלמה sCMOS, התנועה של השלב piezo. לוח הבקרה של הגדרת רכישת המצלמה (B). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
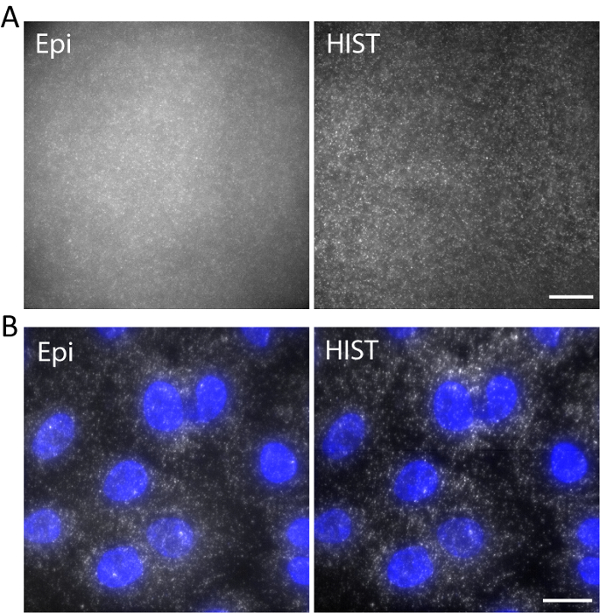
איור 5. (א) התווית על-ידי תמונות של Atto647N-DNA הידרוג 3D עם אפינפרין ו HIST תאורה. (B) תמונות smFISH של EEF2 באמצעות 4 דגים רגשים בתאי A549 על ידי מיקרוסקופ אפינפרין ו HIST. דאפי הכתם מוצג בצבע כחול. גודל ברים, 20 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
ישנם שני שלבים קריטיים פרוטוקול זה. הראשון הוא המיקום הנכון של L4 בשלב 3.3, קרן האירוע עובר דרך המרכז של העדשה של תבנית איירי מושלמת נוצר על התקרה. המיקום של L4 קובע את המיקום של אחרים אופטי הרכיבים, כולל M5, L3, ג'נרל מוטורס ו- L2. השלב הקריטי השני הוא תהליך הסינכרון. לדחיית מחוץ מיקוד הרקע, פיקסלים פעילים אשר איתור יעיל רוחב שווה רוחב אריח יסונכרנו עם גורף קרן. לכן, יש צורך למדוד את רוחב תאורה יעילה של קרן אריח (שלב 5.6), המצלמה הגדרת פרמטרים בהתאם בשלב 6.4.
כאשר הדמיה עם FOV גדולים מאוד, השיטה הציג מראה על רקע מוגבר בצד אחד, לעומת הצד השני. זו מיוחסת זוויות מעט שונה של תאורה לעבר עמדות הדמיה שונות. יישום מראה galvo השני במקום M5 מקלה על בעיה זו כפי שמתואר לפני על ידי התאמת באופן סינכרוני את המיקום ואת זווית סריקה11. במקום doublets off-the-shelf אכרומטי, עדשה סריקה telecentric תהיה גם שימושית. עם זאת, עבור הדמיה על שטח של < 8,080 מיקרומטר2, galvo יחיד גורף המראה היה מספיק. מיקרוסקופ HIST החינמי מגבלה של עומק הדמיה, זאת, יכול לקבל SBR טוב כאשר הדמיה עד ~ 15 מיקרומטר עם קרן אריח 12 מיקרומטר נה 1.45 שמן טבילה המטרה העדשה ו11.
ב פרוטוקול זה, השתמשנו יחס דחיסה קרן של 8 כדי להפוך קרן אריח. תאורה דק יותר יכול לשמש HIST מיקרוסקופ כדי להשיג SBR גבוהה יותר, אשר עשוי להיות חזק בשביל לרקמות מולקולה בודדת הדמיה11. עם זאת, במקרה זה, אפקט photobleaching להתייחס באינטנסיביות עירור מוגברת בזמן יחס הדחיסה קרן הנוכחי הראה photobleaching מופחת ב- 3D הדמיה לעומת אפינפרין11. בהשוואה מיקרוסקופ אור גיליונות עם שתי מטרות שמוקם orthogonally, מיקרוסקופיה HIST הוא פשוט ליישם תואם מדגם קונבנציונאלי ההכנות. SBR משופרת של FOV גדול של מיקרוסקופיית HIST מתאים ללמוד את האינטראקציה ואת הדינמיקה של מולקולות יחיד בתאים מרובים והוא יכול לשמש עוד ב הדמיה ברזולוציה סופר ומעקב מולקולה בודדת.
Disclosures
אוניברסיטת מרכז פלורידה הגישה בקשה לרישום פטנט המכסים את העבודה המתוארת במאמר זה.
Acknowledgements
עבודה זו נתמכה על ידי הגנה מתקדמת מחקר פרוייקטים הסוכנות (DARPA) (HR00111720066), הלאומית למדע קרן (NSF) (1805200). אנו מודים מייקל סרג בטכנולוגיית אנדור שהשאלת בנדיבות את המצלמה sCMOS.
Materials
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
References
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047(2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641(2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123(2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved