Method Article
Una guida per costruire un altamente propenso spazzato Tile microscopio per l'esteso campo di vista singola molecola Imaging
In questo articolo
Riepilogo
Un'istruzione dettagliata è descritta su come costruire un altamente propenso spazzato tile (HIST) microscopio e suo utilizzo per l'imaging di singola molecola.
Abstract
Formazione immagine singola molecola ha notevolmente avanzato la nostra comprensione dei meccanismi molecolari in studi biologici. Tuttavia, è stato impegnativo per ottenere immagini di grandi dimensioni campo di vista, ad alto contrasto in spessore cellule e tessuti. Qui, presentiamo la microscopia tegola Sweep altamente inclinata (HIST) che supera questo problema. Un paio di lenti cilindriche è stato implementato per generare un fascio di eccitazione allungata che è stato digitalizzato su una vasta area di imaging tramite uno specchio galvo veloce. Per posizionare i componenti ottici è stata utilizzata una configurazione di 4f . Una fotocamera scientifiche complementari metal-oxide semiconductor rilevato il segnale di fluorescenza e bloccato sullo sfondo di out-of-focus con una fessura confocale dinamica sincronizzata con la pulizia del fascio. Vi presentiamo un istruzioni dettagliate sulla costruzione del microscopio HIST con tutti i componenti di base.
Introduzione
L'imaging di fluorescenza di singola molecola svolge un ruolo importante in molti studi biologici che rivelano ultrastrutture, la dinamica e la quantità di biomolecole1,2,3. Tuttavia, esso è stato impegnativo per studiare singolo-molecole all'interno di cellule o tessuti. Mentre la microscopia confocale fornisce alta taglio capacità4, non è adatto per l'imaging di singola molecola a causa di grave photobleaching dall'intensità di eccitazione ad alta o bassa velocità di formazione immagine. Widefield microscopia utilizza più debole illuminazione ma soffre di un segnale è scarso a sfondo rapporto (SBR)5. Microscopia a luce-foglio d'altra parte, potrebbe mostrare buona sezionamento e photobleaching basso6; Tuttavia, il disponibile apertura numerica (NA) è notevolmente limitata dal requisito di obiettivi posizionati ortogonalmente7. In alternativa, richiede speciali illuminatori e campione Colombo8,9.
Per questi motivi, la microscopia foglio ottico altamente propensa e laminato (HILO) è stato ampiamente usata per 3D imaging di singola molecola10. Quando un fascio di luce inclinato rileva un'interfaccia di due mezzi (vetro e acqua, per esempio), il fascio viene rifratta secondo la legge di Snell. D'importanza, il raggio rifratto si assottiglia, ed il suo spessore è descritto come dz = R/tan(θ) dove R è il diametro del fascio inclinato e θ è l'angolo di rifrazione del raggio trasmesso. Questa implementazione semplice si traduce in una buona capacità di taglio. Tuttavia, questo rapporto indica che una sottile illuminazione (cioè, elevata capacità di taglio) richiede una piccola R e/o un grande θ. Ad esempio, quando R = 20 µm e θ = 72 gradi, uno può ottenere dz = 6,5 µm. Poiché non esiste un limite pratico per aumentare l'angolo di rifrazione per immagine profonda all'interno delle cellule ed evitare riflessione interna totale, c'è un forte accoppiamento del illuminazione diametro e lo spessore del fascio. Per questo motivo, HILO imaging mostra un relativamente piccolo campo di vista (FOV) che limita notevolmente le sue applicazioni in imaging pluricellulari.
Recentemente, abbiamo superato questo problema da microscopia tegola Sweep altamente inclinata (HIST) dove il FOV è disaccoppiato dallo spessore del fascio in un modo molto semplice11. In primo luogo, un fascio di forma allungato in una direzione è generato tramite una coppia di lenti cilindriche. Questa trave, definita come una tegola, produce un'illuminazione sottile con dz ~ 4 µm mentre suo FOV è 130 x 12 µm2. Quindi, la piastrella è spazzata tutta l'esempio utilizzando uno specchio rotante galvo. Nel frattempo, l'immagine di fluorescenza è registrata su una videocamera scientifiche complementari metal-oxide semiconductor (sCMOS) che filtra in modo efficiente di out-of-focus sfondo operando in una modalità dell'otturatore rolling che serve come rilevamento sintonizzabile fessura confocale. In questo modo, HIST microscopia permette l'imaging a singola molecola con un campo visivo più grande (~ 130 x 130 µm2) e un'illuminazione più sottile rispetto all'imaging di HILO. Abbiamo applicato questa nuova tecnica per rilevare le trascrizioni del RNA con una singola sonda in cellule o con alcune sonde nei tessuti di cervello di topo, che ha un potenziale significativo per lo studio delle malattie e l'espressione genica di imaging. A differenza di altri approcci, HIST impiega solo un obiettivo singolo apertura numerica elevata senza un illuminatore aggiuntivo o obiettivi di rilevamento remoto ed è pienamente compatibile con microscopi rovesciati. Questi vantaggi insieme un grande FOV e ad alto contrasto farà HIST microscopia uno strumento importante nella biologia e nella medicina. Vi presentiamo le istruzioni dettagliate per quanto riguarda la strumentazione del microscopio HIST e come testare e calibrare la sua prestazione come qui sotto.
Protocollo
1. impostare gli strumenti di microscopio, laser e allineamento
- Prima di costruire il microscopio, preparare tutti i componenti necessari tra cui ottica, Optomeccanica ed elettronica come elencato nella Tabella materiali.
- Preparare un corpo del microscopio composto di due parti: un supporto obiettivo con una porta a thread RMS e una fase di piezo montato su un blocco di alluminio (Figura 1A).
Nota: Il corpo del microscopio su misura viene utilizzato per la convenienza e la flessibilità della strumentazione12. Qualsiasi corpo del microscopio commercialmente disponibile può essere utilizzato per la microscopia HIST. - Combinando più linee laser e loro accoppiamento ad una fibra di singolo modo
- Installazione 405, 561, 638 laser nm su ottica tavolo e combinare le travi attraverso un beam splitter polarizzante e uno specchio dicroico passa-lungo, come illustrato nella Figura 1B. Assicurarsi che tutti i raggi laser passano attraverso fori di spillo sullo strumento di allineamento. Inserire mezza onda piastre per la regolazione della potenza.
Nota: Indossare gli occhiali di protezione per gli occhi e utilizzare blocchi di larghezza per assorbire i raggi laser non desiderati. - Installare una lente di accoppiamento fibra (f = 4,5 mm) e un adattatore di fibra svolge in traduttore asse z con un sistema a gabbia.
- Collegare una fibra multimodale (MMF, Ø 62.5 µm) all'adattatore della fibra. Regolare ogni coppia dello specchio dello sterzo e il z-traduttore fino a quando l'efficienza di accoppiamento di ogni laser è supera al 95%. Il fascio di uscita ha un profilo a forma gaussiana vicino con macchie.
- Asportare la fibra multimodale e collegare una fibra monomodale (SMF). Simile al MMF, ottimizzare e massimizzare l'efficienza di accoppiamento di tre laser.
- Installazione 405, 561, 638 laser nm su ottica tavolo e combinare le travi attraverso un beam splitter polarizzante e uno specchio dicroico passa-lungo, come illustrato nella Figura 1B. Assicurarsi che tutti i raggi laser passano attraverso fori di spillo sullo strumento di allineamento. Inserire mezza onda piastre per la regolazione della potenza.
- Assemblare una sorgente di luce collimata che verrà utilizzata per l'allineamento del raggio nei percorsi di rilevamento e di eccitazione. Questo dispositivo è composto da una sorgente di luce temporalmente coerente (561 nm) collegato a SMF, fibra adattatore, lente acromatica (f = 60 mm), iris e Ø1 "tubo distanziale in un sistema a gabbia (Figura 1C). Regolare la distanza tra l'adattatore della fibra e la lente con un interferometro di taglio per garantire la collimazione.
- Preparare uno strumento di allineamento del fascio (Figura 1D). Si tratta di una coppia di colonnine in alluminio con fori di spillo alle 2" altezza dalla superficie del tavolo ottico, che consente un allineamento rapido e preciso fascio.
- Assemblare un sistema di doppio foro stenopeico che consiste di due Ø1 "dischi di allineamento di vetro smerigliato a ciascuna estremità e due Ø1" lente tubi (quello inferiore è a intaglio) come mostrato in Figura 1,E.
2. impostare il percorso di rilevamento
- Estrarre l'obiettivo e installare la sorgente di luce collimata. Regolare le manopole dello specchio (M1) sotto il titolare oggettivo in modo che il fascio di uscita dal microscopio è approssimativamente parallelo al tavolo ottico in altezza e allineato con fori filettati sul tavolo. Fare riferimento alla Figura 2 per le posizioni dettagliate di ciascun componente ottico.
- Inserire uno specchio dicroico multibanda (DM) e riflettere il fascio di 90 gradi. Utilizzare la dimensione massima dell'iride e assicurarsi che il fascio passa attraverso il centro dello specchio dicroico senza clipping.
- Utilizzare il fascio che perde, passando attraverso lo specchio dicroico per guidare l'allineamento del percorso di rilevamento. Posizionare una telecamera sCMOS il fascio di luce e assicurarsi che il fascio colpisce il centro del chip della fotocamera utilizzando due specchi (M2 e M3).
- Inserire un tubo lente (TL; f = 300 mm) circa 300 mm di distanza dalla fotocamera.
- Rimuovere la fonte di luce collimata e regolare la distanza relativa tra il tubo di lente e la fotocamera fino a quando un reticolo sul soffitto è chiaramente risolto dalla fotocamera.
- Inserire un filtro passa multi-banda (BF) prima la lente di tubo per l'imaging di fluorescenza multicolore.
3. impostare il percorso di eccitazione
- Reinstallare la sorgente di luce collimata sul supporto oggettivo. Posizionare un piega-specchio (M4) per reindirizzare l'output del fascio dal microscopio di 90 gradi. Regolare le manopole dello specchio dicroico e piega-specchio in modo iterativo fino a quando il fascio passa attraverso fori di spillo nello strumento di allineamento del fascio.
- Scollegare la fonte di luce collimata e installarlo sul tavolo, in cui il fascio punti verso il corpo del microscopio. Allineare il fascio utilizzando uno strumento di allineamento del fascio e un sistema di doppio foro stenopeico.
- Inserire una lente L4 (f = 400 mm; Ø = 2") per il percorso ottico circa 400 mm dalla titolare del oggettivo. Installare la lente dell'obiettivo e regolare la posizione di L4 lungo l'asse ottico fino a formare un modello di disco di Airy perfetto sul soffitto.
Nota: Quando si inserisce la lente, la posizione di fascio passa attraverso l'obiettivo dovrebbe essere mantenuta invariata. La lente L4 ha un thread SM2 che permette di essere attaccato/staccato da 60 mm piastra filettata SM2 gabbia facilmente. - Svitare l'obiettivo e reinstallare la sorgente di luce collimata con un diaframma aperto. Traccia verso il basso l'uscita del fascio dal microscopio con un biglietto da visita. Montare uno specchio M5 presso il luogo dove la dimensione della trave è il più piccolo e non circa 400 mm L4, che è un aereo di immagine coniugati (cIP).
- Installare uno specchio M6 e riflettere il fascio di 90 gradi. Regolare in modo iterativo M5 e M6 con lo strumento di allineamento del fascio.
- Inserire una lente L3 (f = 150mm) circa 150 mm dalla M5. Utilizzare un interferometro di taglio per garantire la collimazione del fascio uscita.
- Togliere temporaneamente L4 e traccia giù il fascio per trovare la posizione focale di L3. Mettere un asse singolo galvo specchio a questo punto, che è un piano indietro focale coniugato (cBFP). Alimentazione Volt 0 allo specchio galvo e ruotare il supporto dello specchio galvo, in modo che rifletta il raggio di 90 gradi.
- Posto un M7 specchio ripiegabile. Posizionare correttamente la L2 (f = 100 mm) allo stesso modo come passaggio 3.6.
- Rimuovere la fonte di luce collimata dal portaoggetti. Installare una lente di collimazione L1 (f = 100 mm), adattatore fibra e iris. Una fibra di singolo modo di collegare all'adattatore e invia il raggio attraverso il sistema di imaging.
- Reinserire la L4 e mettere a punto il sistema finché non viene visualizzato un modello di disco di Airy perfetto sul soffitto.
4. impostare le lenti cilindriche
- Inserire una lente cilindrica (CL1, f = 400 mm) dopo L1 e assicurarsi che la lente cilindrica si concentra il fascio lungo l'asse x.
- Inserire un'altra lente cilindrica (CL2, f = 50 mm) per il percorso del fascio. Utilizzare un interferometro di taglio per assicurare che il fascio di uscita è collimato.
Nota: La distanza tra le due lenti cilindriche è 450 mm. Il fascio di uscita ha un rapporto di compressione di 8 ed un modello di disco di Airy a forma ovale allungata è formato sul soffitto.
5. test di imaging delle mattonelle
- Preparare il campione di idrogel 3D. Mix 20 nm Crimson perline con una soluzione di idrogel, che consiste di 12% acrylamide:bisacrylamide (29: 1), 0,2% (v/v) TEMED e persolfato dell'ammonio 0,2% (w/v) in 0.75 x TAE tampone. Iniettare 50 µ l della soluzione mista in una camera di flusso come descritto altrove11. Dopo 10 min, il campione di idrogel 3D è pronto / a per l'imaging.
- Mettere il campione sul supporto del campione. Accendere 638 nm laser e regolare la potenza a < 1 mW per l'eccitazione del campione.
- Eseguire il software di controllo della telecamera. Nel pannello Acquisizione-impostazione della fotocamera, selezionare interno in modo trigger e scegliere prendere video gratis modalità di esecuzione.
- Leggermente regolare la posizione della fotocamera in modo che l'immagine si trova al centro della fotocamera quando 0 volt viene applicato allo specchio galvo.
- Ruotare la manopola orizzontale dello specchio M5 per ottenere un'illuminazione ed inclinata.
Nota: Con l'aumento dell'angolo di illuminazione, l'immagine di idrogel diventa più chiara di quella dell'immagine Epi come il fascio si assottiglia. Tuttavia, l'immagine mantiene quasi la stessa posizione. - Registrare l'immagine di piastrelle. Calcolare la larghezza efficace illuminazione11. Ad esempio, la figura 3 Mostra la larghezza efficace illuminazione di 12 µm.
6. HIST imaging
- Preparare una scheda di acquisizione dati collegata con una morsettiera. Collegare il connettore BNC 1 utente con P0.0 attraverso un cavo elettrico. Utilizzare 1 utente come un'uscita digitale per il comando esterno di sCMOS fotocamera. Collegare un analogico AO0 dell'output su un driver di mirror galvo.
- Generare treni di impulsi TTL da P0.0 utilizzando un programma su misura (Figura 4A) e impostare il periodo di tempo = 400 ms e t_ON = 2 ms. controllare gli impulsi generati dall'utente 1 BNC terminale di un oscilloscopio digitale e quindi collegare il cavo BNC per la fotocamera Porto di trigger esterno.
Nota: Il software di controllo utilizzato in questa carta è disponibile su richiesta. Quando imaging a frame rate diversi fotocamera, il periodo di tempo deve essere regolata di conseguenza. - Iniziare a spazzare un mirror di galvo tramite il programma su misura. Regolare Vmin a-500 mV e Vmax a 500 mV per l'imaging di FOV completo. Notare che sotto questa operazione, idrogel 3D campioni ancora mostrano alta priorità bassa simile a Epi illuminazione.
- Cambiando l'impostazione di acquisizione della fotocamera.
- Selezionare esterno in modalità trigger e giù (sequenziale) nel menu a discesa LightScan Plus come mostrato in Figura 4B.
Nota: In questa impostazione, la fotocamera non scattare immagini a meno che un segnale trigger è attivato. - Scegliere Controllo di velocità di scansione per finestra altezza e linea esposizione tempo controllo e impostare i valori per essere 180 righe e ms 28, rispettivamente.
Nota: Quando una piastrella larghezza (WFEP) è 180 righe (12 µm) e un tempo d'integrazione per riga (Tint) è 28 ms, un tempo di ritardo tra le linee (TD) è determinato come TD = Tint/weff = 0.156 ms per l'imaging di 2.048 x 2.048 pixel, il tempo di acquisizione totale è 2.048 x TD + Tint = 346 ms, corrispondente a ~2.9 fps.
- Selezionare esterno in modalità trigger e giù (sequenziale) nel menu a discesa LightScan Plus come mostrato in Figura 4B.
- Regolare leggermente Vmax e Vmin per ottenere immagini più nitide.
- Ottenere immagini 3D stack utilizzando il programma su misura di commutazione in pila 3D ON e specificando il numero di stack e la dimensione del passo.
Risultati
Ad esempio, il DNA single-stranded etichettato con Atto647N era imaged con una lunghezza d'onda di eccitazione di 638 nm in un idrogel 3D. DNA è stato ancorato alla rete tramite una parte coprocoltura idrogel durante la polimerizzazione del gel. Le immagini sono state scattate a 5 µm sopra la superficie, come illustrato nella Figura 5un. L'immagine HIST ha mostrato molto meno priorità bassa rispetto all'immagine di Epi, da cui lo sfondo rapporto segnale è stato calcolato per essere ± 1,9 0,7 per l'immagine HIST mentre la maggior parte delle macchie singola molecola potrebbe a malapena essere rilevata da Epi.
Singola molecola di RNA fluorescenza l'ibridazione in situ (smFISH) è stata realizzata con 4 sonde di pesce. Figura 5 b Visualizza le immagini smFISH di EEF2 (fattore di allungamento di traduzione negli eucarioti 2) etichettate con 647 AlexaFluor sulle cellule A549 in un buffer di imaging (fare riferimento al nostro precedente lavoro per quanto riguarda la preparazione del campione11). Una proiezione di massima intensità è stata effettuata su 20 z-stack corrispondente a 5 µm di spessore. L'immagine HIST ha mostrato non solo SBR molto migliorata, ma anche più omogenea rispetto all'immagine di Epi. Per l'imaging di Epi, il tempo di esposizione era 400 ms mentre per l'integrazione di imaging HIST tempo per riga era 32 ms, entrambi i quali aveva lo stesso potere di illuminazione di 7,5 mW misurata prima l'obiettivo. La velocità di formazione immagine di Epi e HIST erano 2,5 fps.

Figura 1 . Strumenti di corpo, laser e allineamento di microscopio. (A) obiettivo e supporto del campione. (B) foto di sistemi laser. LP, specchio dicroico passa-lungo; Piastre di λ/2, semionda; PBS, polarizzazione beamsplitter. (C) Collimated fonte di luce. (D) strumento di allineamento del fascio con due fori di spillo inseribile. (E) sistema di doppio foro stenopeico. Clicca qui per visualizzare una versione più grande di questa figura.
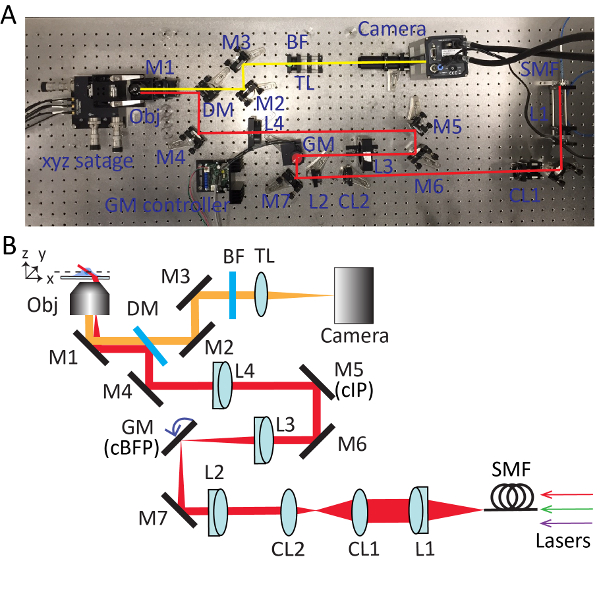
Figura 2 . Installazione dettagliata per microscopia tegola Sweep altamente inclinata (HIST). Foto (A) e schema (B) del sistema di microscopio HIST. BF, filtro passa multi banda; Lenti cilindriche CL1-2; DM, specchio dicroico; GM, galvo specchio; BF, filtro passa-banda; M1-7, specchi; L1-4, lenti; SMF, fibra di singolo modo; TL, tubo lente; cIP, aereo di immagine coniugati; cBFP, coniugato piano focale posteriore. Clicca qui per visualizzare una versione più grande di questa figura.
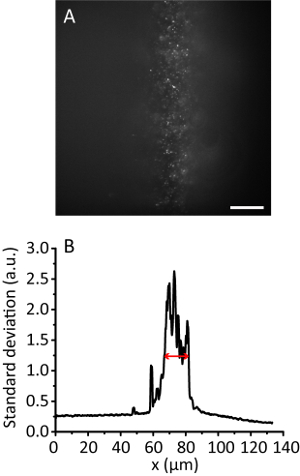
Figura 3 . Mattonelle di illuminazione con un rapporto di compressione di 8. (A) immagine di fluorescenza di 20 perle di nm in un idrogel 3D. Barra della scala, proiezione di deviazione Standard 20 µm. (B) lungo la direzione y di A, levigata da punti 10 dati. La freccia rossa indica una larghezza efficace illuminazione di 12 µm. Clicca qui per visualizzare una versione più grande di questa figura.
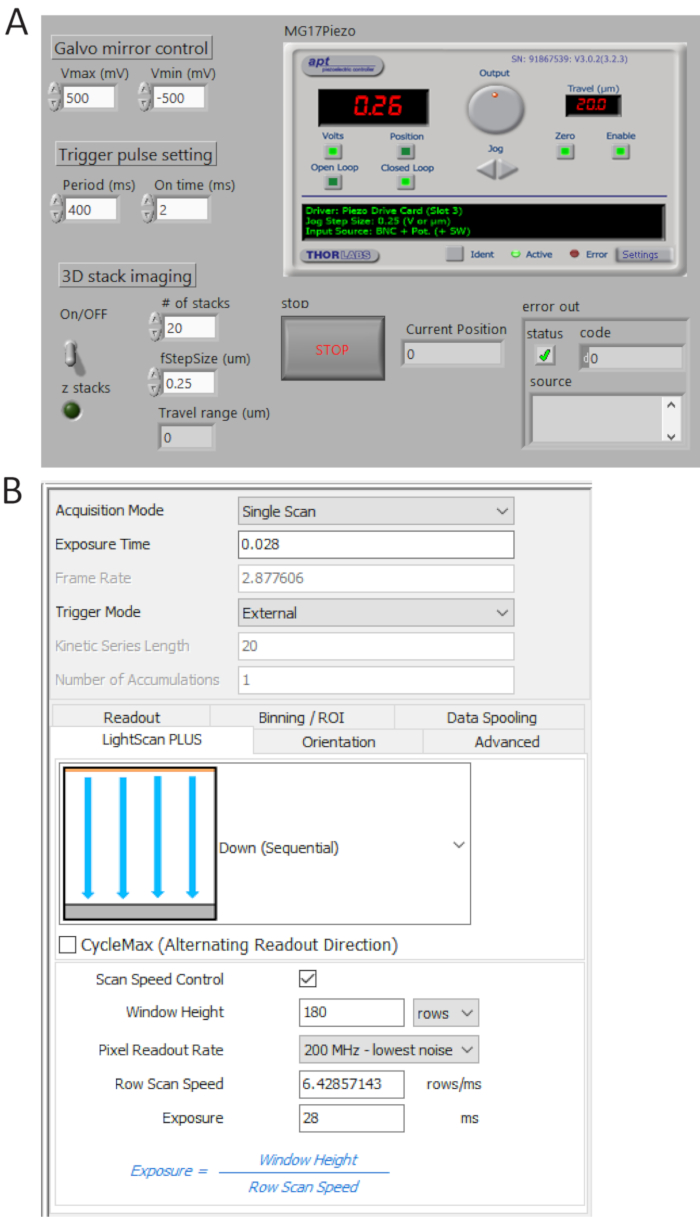
Figura 4 . Controllo e software di imaging frontalini. (A) A su misura LabView programma controlla in modo sincrono la scansione dello specchio galvo, l'acquisizione iniziale di sCMOS fotocamera e il movimento della fase piezo. (B) pannello di controllo di impostazione di acquisizione della fotocamera. Clicca qui per visualizzare una versione più grande di questa figura.
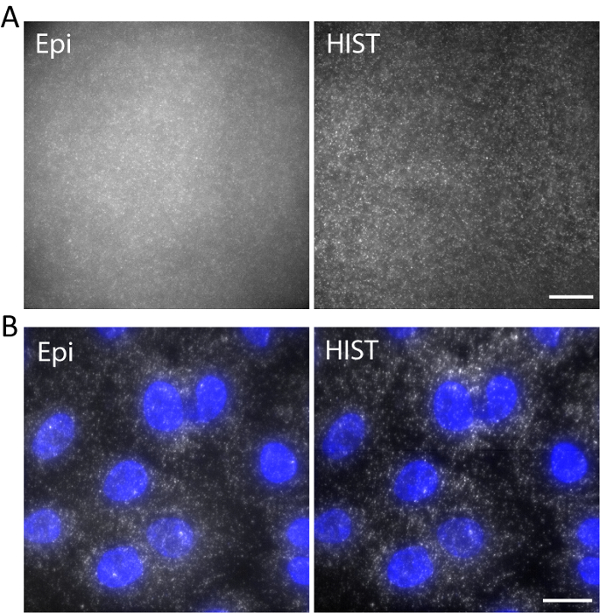
Nella figura 5. (A) immagini di Atto647N-contrassegnata del DNA in un idrogel 3D con illuminazione Epi e HIST. (B) smFISH immagini di EEF2 utilizzando 4 FISH sonde su cellule A549 da microscopia Epi e HIST. Macchia DAPI è indicata in blu. Scala bar, 20 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Ci sono due passaggi critici in questo protocollo. Il primo è il posizionamento corretto di L4 al punto 3.3, assicurando che il fascio incidente passa attraverso il centro della lente e un modello di disco di Airy perfetto è formato sul soffitto. La posizione di L4 determina la posizione di tutti gli altri componenti ottici, tra cui M5, L3, GM e L2. Il secondo passaggio critico è il processo di sincronizzazione. Per rifiutare il out sfondo sfocato, pixel attivi cui larghezza efficace rilevamento è uguale alla larghezza della piastrella deve essere sincronizzato con la pulizia del fascio. Pertanto, è necessario misurare la larghezza efficace illuminazione di un fascio di mattonelle (punto 5.6) e impostare la fotocamera parametri conseguenza al punto 6.4.
Quando la formazione immagine con FOV molto grande, il metodo presentato Mostra un aumento sfondo su un lato rispetto a altro lato. Ciò è attribuita agli angoli leggermente alterati dell'illuminazione alle diverse posizioni di imaging. Implementazione di un secondo specchio galvo invece M5 allevia questo problema come dimostrato prima regolando in modo sincrono la posizione e la scansione angolo11. Invece di doppietti acromatici disponibili in commercio, obiettivo telecentrico scansione sarà anche utile. Tuttavia, per l'imaging di un'area di < 8.080 µm2, galvo singolo specchio spazzamento era sufficiente. HIST microscopia ha un limite di profondità imaging, tuttavia, è in grado di ottenere un buon SBR quando fino a ~ 15 µm con un fascio di mattonelle di 12 µm e un NA 1,45 olio immersione dell'obiettivo11di imaging.
In questo protocollo, abbiamo usato un rapporto di compressione del fascio di 8 per fare un fascio di piastrelle. Un'illuminazione più sottile può essere utilizzatoin HIST microscopia per raggiungere SBR superiore, che potrebbe essere potente per11di formazione immagine del tessuto di singola molecola. Tuttavia, in questo caso, photobleaching effetto dovrebbe essere considerato da un'intensità maggiore eccitazione mentre il rapporto di compressione di fascio attuale ha mostrato ridotta photobleaching in imaging 3D rispetto al Epi11. Rispetto ai microscopi di luce-foglio con due obiettivi posizionati ortogonalmente, HIST microscopia è semplice da implementare e compatibile con preparazione del campione convenzionale. L'avanzata SBR e grande FOV di HIST microscopia è adatto per studiare le interazioni e le dinamiche delle singole biomolecole in più celle e può essere utilizzato ulteriormente in Super-resolution imaging e rilevamento di singola molecola.
Divulgazioni
Università di Florida centrale ha depositato una domanda di brevetto che coprono i lavori descritti in questa carta.
Riconoscimenti
Questo lavoro è stato supportato dalla Defense Advanced Research Projects Agency (DARPA) (HR00111720066) e la National Science Foundation (NSF) (1805200). Ringraziamo Michael Serge nella tecnologia di Andor per generosamente prestato la macchina fotografica di sCMOS.
Materiali
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
Riferimenti
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047(2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641(2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123(2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon