Method Article
높은 경사 구축 가이드 확장 된 시야의 단일 분자 이미징 타일 현미경을 휩 쓸
요약
상세한 지시는 타일 (HIST) 현미경 및 단일 분자 이미징에 대 한 용법을 휩 쓸 높은 경사를 구축 하는 방법에 설명 되어 있습니다.
초록
단일 분자 이미징 크게 생물 학적 연구에 분자 메커니즘에 대 한 우리의 이해를 전진 했다. 그러나, 그것은 두꺼운 세포와 조직에 큰 보기의 필드, 높은 콘트라스트 이미지를 얻기 위해 도전 하고있다. 이 문제를 극복 하는 매우 경사 스윕된 타일 (HIST) 현미경 검사 법을 소개 합니다. 한 쌍의 원통형 렌즈 빠른 galvo 거울을 통해 큰 이미징 영역 검색 길쭉한 여기 빔을 생성 하기 구현 되었습니다. 4f 구성 광학 부품 위치 사용 되었다. 과학적인 보완 금속-산화물 반도체 카메라 형광 신호를 감지 하 고 동적 confocal 슬릿 빔 연소와 함께 동기화와 함께 밖으로의 초점 배경 차단. 우리는 모든 기본 구성 요소와 HIST 현미경 건물에 단계별로 지침 제시.
서문
단일 분자 형광 이미징 ultrastructures, 역학 및 생체1,2,3의 수량을 공개 하는 많은 생물학 연구에서 중요 한 역할을 한다. 그러나, 그것은 세포 또는 조직 내 단일 분자를 공부 하 도전 하고있다. Confocal 현미경 검사 법에는 높은 단면 기능4제공 한다, 때문에 높은 자극 강도 또는 이미징 저속에 의해 심각한 photobleaching 단일-분자 이미징 적당 하다. Widefield 현미경 약한 조명 사용 하지만 배경 비율 (SBR)5가난한 신호에서 겪고 있다. 좋은 단면화 및 낮은 photobleaching6; 빛 시트 현미경 검사 법, 다른 한편으로, 보여줄 수 있는 그러나, 사용할 수 있는 수 가늠 구멍 (NA) 기가 배치 목표7의 요구에 의해 크게 제한 됩니다. 또는, 특별 한 조명 기 및 샘플 챔버8,9필요합니다.
이러한 이유로, 매우 경사 하 고 적 층 광학 시트 (힐로) 현미경은 3D 단일 분자 이미징10널리 사용 되었습니다. 경사 빔 (유리 및 예 물) 두 미디어의 인터페이스를 발견 하면 빔 Snell의 법률에 따라 굴절 이다. 중요 한 것은, 굴절된 빔 얇은, 도착 하 고 두께 dz로 설명 = R/tan(θ) R은 경사 빔 직경 및 θ 전송된 광선의 굴절 각도입니다. 이 간단한 구현 좋은 단면 기능에서 결과. 그럼에도 불구 하 고,이 관계는 얇은 조명 (즉, 높은 단면 기능) 필요한 작은 R 또는 큰 θ 나타냅니다. 예를 들어, R = 20 µ m와 θ = 72도, 하나 dz를 얻을 수 있습니다 6.5 µ m =. 깊은 셀 안에 이미지 하 고 총 내부 반사를 피하기 위해 굴절 각도 증가 하는 실제적인 제한 때문에, 조명 직경 및 빔 두께의 강한 커플링이 있다. 이러한 이유로 힐로 이미징은 상대적으로 작은-의-시야 (FOV) 크게 다세포 이미징에서 응용 프로그램을 제한 하는 표시 됩니다.
최근에, 우리는 FOV는 매우 간단한 방법11빔 두께에서 분리는 매우 경사 스윕된 타일 (HIST) 현미경으로이 문제를 극복 했다. 첫째, 한 방향으로 길쭉한 빔 원통형 렌즈의 쌍을 통해 생성 됩니다. 타일로 불리는이 빔 생성 dz와 얇은 조명 ~ 4 µ m의 FOV는 130 x 12 µ m2. 다음, 타일은 회전 galvo 거울을 사용 하 여 샘플 전역 휩 쓸. 한편, 형광 이미지 롤링 셔터 모드 가변 confocal 슬릿 탐지 역할에서 작동 하 여 효율적으로 밖으로의 초점 배경 필터 과학적 상보성 금속 산화물 반도체 (sCMOS) 카메라에 기록 됩니다. 이 방법에서는, HIST 현미경 단일 분자 이미징을 큰 필드의 보기 (~ 130 x 130 µ m2)와 힐로 영상 보다 얇은 조명 수 있습니다. 우리는이 새로운 이미징 유전자 발현을 연구 하 고 질병에 대 한 상당한 잠재력을가지고 있는 셀에 단일 프로브 또는 마우스 뇌 조직에 몇 가지 프로브 RNA 사본을 감지 기술 적용. 다른 접근 달리 HIST 추가 조명 없이 단일 높은 수 가늠 구멍 목표 또는 원격 탐지 목표를 사용 하 여 그리고 거꾸로 현미경와 완벽 하 게 호환 됩니다. 이러한 장점은 큰 FOV와 고대비 HIST를 만들 것 이다 현미경 검사 법 생물학과 약에서 눈에 띄는 도구. 선물이 HIST 현미경 및 테스트 하 고 아래에로 그 성능을 교정 방법의 계측에 관한 자세한 내용은.
프로토콜
1. 현미경, 레이저 및 정렬 도구 설정
- 구축 하기 전에 현미경, 광학, 전자 재료의 테이블에에서 나열 된, optomechanics 등 모든 필요한 구성 요소를 준비 합니다.
- 두 부분 주로 구성 된 현미경 몸 준비: RMS 스레드 포트와 피 단 객관적인 홀더 알루미늄 블록 (그림 1A)에 장착.
참고: 맞춤 현미경 몸 편의 계측12의 유연성을 위해 사용 됩니다. 어떤 상용 현미경 몸 HIST 현미경 검사 법에 대 한 사용할 수 있습니다. - 여러 레이저 라인을 결합 하 고 단일 모드 섬유에 결합
- 설치 405, 561, 638 nm 레이저 광에 표 및 그림 1B와 같이 편광 빔 스플리터와 긴 패스 dichroic 거울을 통해 광선을 결합. 모든 레이저 빔 정렬 도구에 핀 홀을 통과 것 다는 것을 확인 하십시오. 전원 조정 위한 반 파 격판덮개를 삽입 합니다.
참고: 눈 보호를 위한 안전 고글을 착용 하 고 빔-블록을 사용 하 여 원치 않는 레이저 광선 흡수. - 섬유 커플링 렌즈 설치 (f = 4.5 m m)를 광섬유 어댑터 z 축 번역기에서 케이지 시스템.
- (MMF, Ø 62.5 μ m) 다중 모드 광섬유 광섬유 어댑터에 연결 합니다. 각 레이저의 커플링 효율은 95% 보다 높은 때까지 스티어링 거울과 z-번역기의 각 쌍을 조정. 출력 빔 얼룩 패턴 근처 가우스 모양 프로필이 있다.
- 다중 모드 광섬유 려 고 단일 모드 광섬유 (SMF)를 연결 합니다. MMF, 유사한 세밀 하 고 3 개의 레이저의 커플링 효율을 극대화.
- 설치 405, 561, 638 nm 레이저 광에 표 및 그림 1B와 같이 편광 빔 스플리터와 긴 패스 dichroic 거울을 통해 광선을 결합. 모든 레이저 빔 정렬 도구에 핀 홀을 통과 것 다는 것을 확인 하십시오. 전원 조정 위한 반 파 격판덮개를 삽입 합니다.
- 조립 조명을된 광원 구동 및 검출 경로에서 빔 정렬에 사용 됩니다. 이 장치는 일시적으로 일관 된 광원의 구성 (561 nm) SMF, 광섬유 어댑터, achromatic 렌즈에 연결 (f = 60 m m), 아이리스와 Ø1 "케이지 시스템 (그림 1C)에서 스페이서 튜브. 광섬유 어댑터 사용 하 여 전단 간섭계는 준 렌즈 사이의 거리를 조정 합니다.
- 빔 정렬 도구 (그림 1D)를 준비 합니다. 이것은 알루미늄 게시물 pinholes 2 "는 신속 하 고 정확한 빔 정렬 광학 테이블의 표면에서 높이에 한 쌍 이다.
- 2 Ø1의 구성 된 더블 핀 홀 시스템 조립 "각 끝에 지상 유리 맞춤 디스크 및 2 개의 Ø1" 그림 1E(하단 하나 이룰) 튜브 렌즈.
2. 검색 경로 설정
- 목표를 꺼내와 조명을된 광원을 설치. 현미경에서 출력 빔 이며 대략 높이 광학 테이블에 평행 하 게 정렬 테이블에 뚫린된 구멍으로 되도록 객관적인 홀더 아래 거울 (M1)의 손잡이 조정 합니다. 각 광 부품의 상세한 위치 그림 2 를 참조 하십시오.
- 멀티 밴드 dichroic 거울 (DM)을 삽입 하 고 90도 광선을 반영. 조리개의 최대 크기를 사용 하 고 빔 클리핑 없이 dichroic 거울의 센터를 통과 다는 것을 확인 한다.
- 새 빔 dichroic 거울 통과 사용 하 여 검색 경로 맞춤 안내. 광속으로 sCMOS 카메라를 놓고 빔을 2 개의 거울 (m 2와 M3)를 사용 하 여 카메라 칩의 센터 조회 수 있는지 확인 합니다.
- 삽입 튜브 렌즈 (TL; f = 300 m m) 카메라에서 약 300 m m.
- 조명을된 광원을 제거 하 고 천장에 패턴은 명확 하 게 카메라에 의해 해결 될 때까지 튜브 렌즈와 카메라 사이의 상대 거리를 조정 합니다.
- 다 색 형광 이미징 튜브 렌즈 앞 멀티 밴드 패스 필터 (BF)를 삽입 합니다.
3. 여기 경로 설정
- 객관적인 홀더에 조명을된 광원을 다시 설치 합니다. 90도 현미경에서 배 거울 (M4) 빔 출력을 놓습니다. Dichroic 거울과 배-거울의 손잡이 빔 빔 정렬 도구에 핀 홀을 통해 전달 될 때까지 반복적으로 조정 합니다.
- 조명을된 광원을 분리 하 고 있는 빔 현미경 몸으로 점 테이블에 그것을 설치. 빔 빔 정렬 도구와 더블 핀 홀 시스템을 사용 하 여 맞춥니다.
- 삽입 한 렌즈 L4 (f = 400 m m; Ø = 2") 객관적인 홀더에서 약 400 m m 광학 경로를. 대물 렌즈를 설치 하 고 완벽 한 통풍 디스크 패턴은 천장에 형성 될 때까지 광학 축 따라 L4의 위치를 조정 합니다.
참고: 렌즈를 삽입할 때 렌즈를 통과 하는 광속 위치 유지 되어야 한다 변경 되지 않은. 렌즈 L4 SM2 스레드를 쉽게 연결/60 m m SM2 스레드 케이지 접시에서에서 분리 될 수 있다. - 목적은 나사 고 오픈 창포와 조명을된 광원을 설치 하십시오. 비즈니스 카드와 함께 현미경에서 광선 출력 아래로 추적. 광속의 크기는 작은 장소에서 활용된 이미지 평면 (cIP)은 L4 거리 약 400 m m M5 거울을 탑재 합니다.
- M6 거울을 설치 하 고 90도 광선을 반영. 빔 정렬 도구와 M5와 M6 반복적으로 조정 합니다.
- L3 렌즈 삽입 (f = 150mm) M5에서 약 150 m m. 깎는 간섭계를 사용 하 여 출력 광속의 준을 보장 하기 위해.
- 일시적으로 빼앗 L4와 L3의 초점 위치를 찾을 수 빔 아래로 추적. 이 시점에서 단일 축 galvo 거울을 넣어, 활용된 다시 초점 비행기 (cBFP)입니다. Galvo 거울에 0 볼트를 공급 하 고 90도 광속 반영 galvo 거울의 회전.
- 장소 배 거울 M7입니다. 제대로 L2 장소 (f = 100 m m) 단계 3.6으로 같은 방식으로.
- 개체 소유자에서 조명을된 광원을 제거 합니다. 준 렌즈 L1 설치 (f = 100 m m), 어댑터와 아이리스. 단일 모드 광섬유 어댑터에 연결 하 고 이미징 시스템을 통해 광속을 보낼.
- L4 다시 삽입 하 고 완벽 한 통풍 디스크 패턴 천장에 나타날 때까지 시스템을 미세 조정.
4. 원통형 렌즈를 설정
- 원통형 렌즈 삽입 (CL1, f = 400 m m) L1 후 원통형 렌즈 x 축 따라 빔을 초점을 맞추고 있는지 확인 하십시오.
- 또 다른 원통 모양 렌즈를 삽입 (CL2, f = 50mm) 빔 경로에. 깎는 간섭계를 사용 하 여 출력 빔 조명을 위해.
참고: 두 개의 원통형 렌즈 사이의 거리는 450 m m. 출력 빔 8의 압축률 있으며 천장에는 길쭉한 타원형 모양의 공기 디스크 패턴 형성 된다.
5. 타일 이미지 테스트
- 3D 하이드로 겔 샘플을 준비 합니다. 혼합 20 nm 크림슨 12 %acrylamide:bisacrylamide (29: 1), 0.2% (v/v) TEMED 및 0.75 x TAE 버퍼에 0.2% (w/v) 암모늄 persulfate 이루어져 히드로 솔루션 비즈. 11설명 되어 있는 대로 흐름 챔버로 혼합된 솔루션의 50 µ L를 주사. 10 분 후 3D 하이드로 겔 샘플 영상에 대 한 준비가 되어 있습니다.
- 샘플 홀더에 샘플을 넣어. 638 nm 레이저를 켜고 전원을 조정 < 1 샘플 여기 mW.
- 카메라 제어 소프트웨어를 실행 합니다. 카메라 수집 설정 패널에 트리거 모드에서 내부 를 선택 하 고 비디오 무료 모드 실행을 클릭 합니다.
- 이미지는 카메라의 중심에 0 볼트 galvo 거울에 적용 되 면 되도록 카메라의 위치를 약간 조정 합니다.
- M5 달성 높은 경사 조명 거울의 수평 손잡이 회전 합니다.
참고: 조명 각도의 증가, 히드로 이미지 피 이미지 보다 명확 하 게 빔을 얇은 되 면 된다. 그러나, 이미지는 거의 동일한 위치를 유지합니다. - 타일 이미지를 기록 합니다. 효과적인 조명 폭11계산 합니다. 예를 들어 그림 3 12 µ m의 효과적인 조명 폭을 보여준다.
6. HIST 이미징
- 터미널 블록에 연결 된 데이터 수집 보드를 준비 합니다. 전기 와이어를 통해 P0.0와 사용자 1 BNC 커넥터를 연결 합니다. SCMOS 카메라의 외부 트리거링을 위한 사용자 1 디지털 출력으로 사용 합니다. 아날로그 연결 galvo 미러 드라이버를 AO0를 출력.
- 맞춤 프로그램(그림 4)를사용 하 여 P0.0에서 TTL 펄스 트레인을 생성 하 고 설정 기간 시간 400 ms 및 t_ON = 2 = 양 디지털 오실로스코프에 의해 사용자 1 BNC 터미널에서 생성 된 펄스를 확인 하 고 카메라에 BNC 케이블 연결 외부 트리거 포트입니다.
참고:이 문서에 사용 된 제어 소프트웨어는 요청 시 이용 가능. 다른 카메라 프레임 속도로 이미징, 기간에 따라 조정 한다. - 맞춤 프로그램을 통해 galvo 거울을 청소를 시작 합니다. V분 -500 mV 및 V최대 500 조정 전체 FOV 이미징에 대 한 mV. Note는이 작업에서 3D 하이드로 겔 샘플 여전히 보여 높은 배경 Epi 조명 비슷합니다.
- 카메라 수집 설정을 변경합니다.
- 외부 트리거 모드에서 (순차) 아래 에서 선택 LightScan 플러스 드롭-다운 메뉴 그림 4B와 같이 합니다.
참고:이 설정에서 카메라 받지 않는다 이미지 트리거 신호 설정 하지 않는 한. - 창 높이 선 노출 시간 제어를 위한 스캔 속도 제어 를 클릭 하 고 설정 값을 180 행 과 28 ms, 각각.
참고: 때 타일 너비 (Weff) 180 행 (12 µ m) 이며 줄 (intT) 통합 시간 28 ms, 줄 (TD) 사이의 지연 시간으로 결정 됩니다 TD Tint/Weff = = 2, 048 x 이미징을 위한 0.156 양 2, 048 픽셀, 총 수집 시간은 TD + Tint x 2048 = 346 ms, ~2.9 fps에 해당.
- 외부 트리거 모드에서 (순차) 아래 에서 선택 LightScan 플러스 드롭-다운 메뉴 그림 4B와 같이 합니다.
- 약간 V최대 및 V분 명확 하 게 이미지를 조정 합니다.
- 3D 스택에 전환 하 고 스택 및 스텝 크기의 수를 지정 하 여 주문 품 프로그램을 사용 하 여 3D 스택 이미지를 얻을.
결과
예를 들어, 단일 가닥 DNA Atto647N으로 표시 했다 638의 여기 파장 몇 군데 3D 히드로에 nm. DNA는 젤 합 동안 acrydite moiety 통해 히드로 네트워크에 정박 했다. 이미지 에서처럼 그림 5는표면 위의 5 µ m에서 찍은 사진. HIST 이미지에서 신호 대 배경 비는 계산 단일 분자 관광 명소의 대부분 HIST 이미지 1.9 ± 0.7 겨우 피에 의해 검출 될 수 피 이미지에 비해 훨씬 적은 배경으로 나타났다.
단일 분자 RNA 형광 제자리 교 잡 (smFISH) 4 수행한 물고기 프로브. 그림 5 이미지 버퍼에 A549 세포에 AlexaFluor 647 표시 EEF2 (진 핵 번역 신장 요인 2)의 smFISH 이미지를 표시 하는 b (샘플 준비11에 대 한 우리의 이전 작업 참조). 최대 강도 프로젝션 20 z-스택 해당 5 µ m 두께 하에서 수행 되었다. HIST 이미지 많이 개선된 SBR 뿐만 아니라 또한 더 획 일 한 조명 피 이미지에 비해 했다. 피 이미징에 대 한 노출 시간 동안 HIST 통합 이미징에 대 한 줄 시간 둘 다 했다 7.5의 동일한 조명 전원 32 ms 400 ms을 했다 mW 목표 전에 측정. 피와 HIST 이미징 속도 2.5 프레임 했다.

그림 1 . 현미경 몸, 레이저 및 정렬 도구. (A) 목표 및 샘플 홀더. 레이저 시스템의 (B) 사진. LP, 긴 패스 dichroic 거울; Λ/2, 하프-파 판; PBS, 편광 beamsplitter (C) Collimated 광원. (D)와 2 개의 플러그 pinholes 빔 정렬 도구. (E) 더블 홀 시스템입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
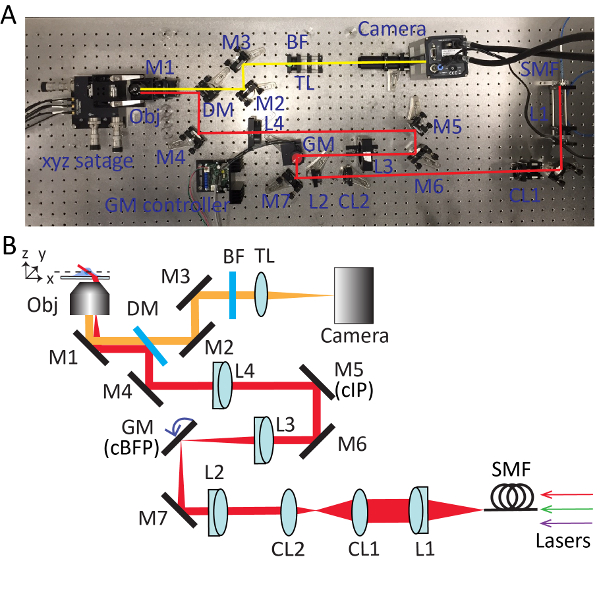
그림 2 . 높은 경사 스윕된 타일 (HIST) 현미경 검사 법에 대 한 자세한 설정. 사진 (A) 그리고 HIST 현미경 시스템의 개략도 (B). BF, 멀티 밴드 패스 필터; CL1-2, 원통형 렌즈; DM, dichroic 거울; GM, galvo 거울; BF, 대역 통과 필터; M1-7, 거울; L1-4, 렌즈; SMF, 단일 모드 섬유; TL, 튜브 렌즈; cIP, 활용된 이미지 평면; cBFP, 다시 초점 평면 활용. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
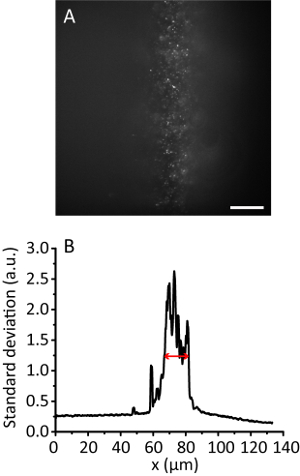
그림 3 . 8의 압축 비율 조명 타일. (A) 3 차원 하이드로 겔에 20 nm 구슬의 형광 이미지. 스케일 바, 20 µ m. (B) 표준 편차 프로젝션 A, 부드럽게 10 데이터 포인트의 y 방향 따라. 빨간색 화살표 표시는 효과적인 조명 폭 12 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
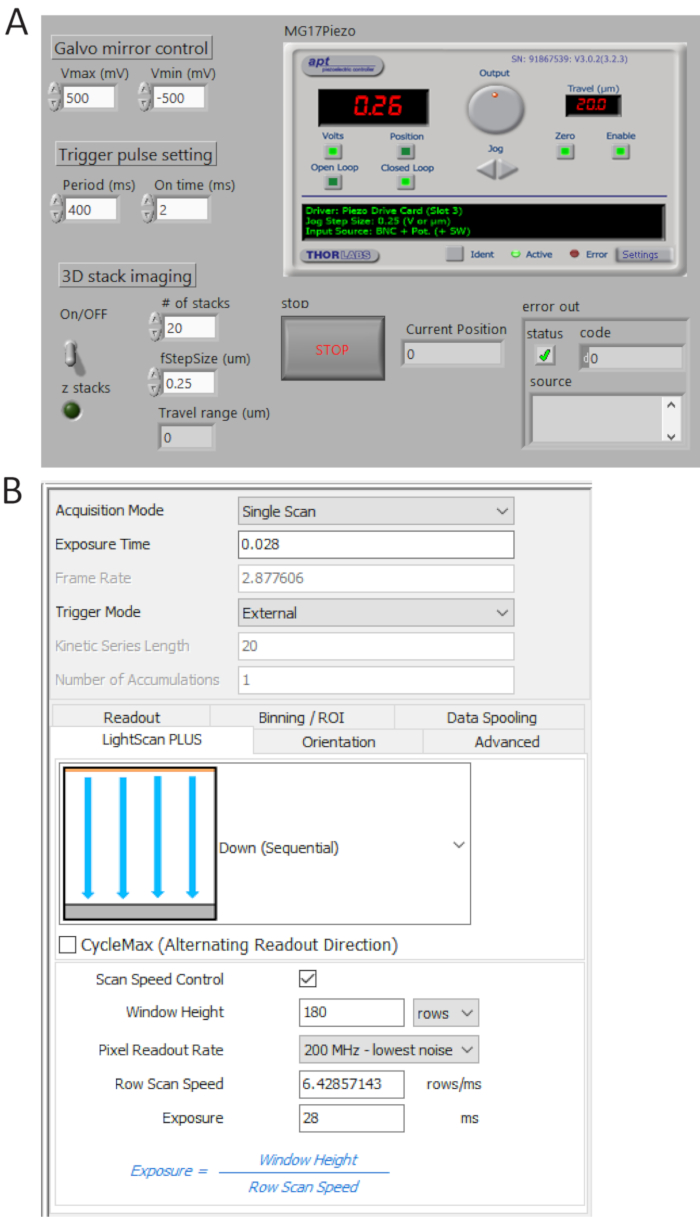
그림 4 . 제어 및 이미징 소프트웨어 전면 패널. (A) A 맞춤 LabView 프로그램 동기적 galvo 거울, sCMOS 카메라의 시작 수집 및 압 전 무대의 움직임의 스캔 제어. (B) 카메라 수집 설정 제어판. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
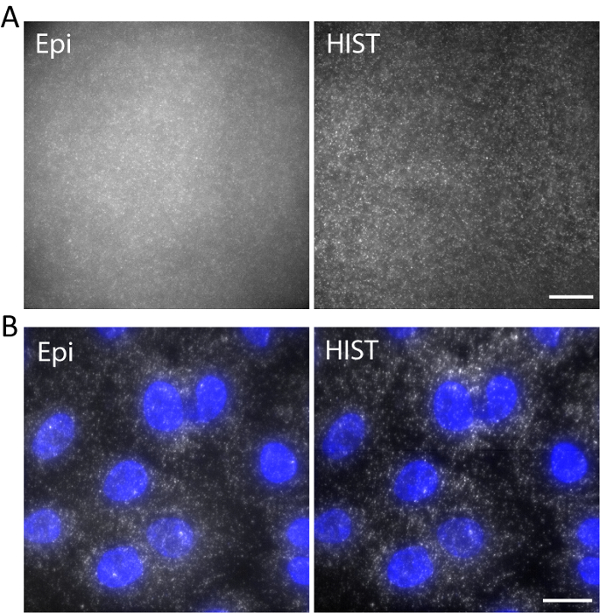
그림 5. (A) 피와 HIST 조명 3D 하이드로 겔에서 DNA를 이미지의 Atto647N 표시 된. (B) smFISH 이미지 EEF2 4를 사용 하 여 물고기 피와 HIST 현미경 검사 법에 의해 A549 세포에 프로브 합니다. DAPI 얼룩은 파란색으로 표시 됩니다. 스케일 바, 20 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 프로토콜에서 두 가지 중요 한 단계가 있습니다. 첫 번째 단계 3.3, 입사 빔 렌즈의 센터를 통해 전달 하 고 완벽 한 통풍 디스크 패턴은 천장에 형성에서 L4의 적절 한 배치 이다. L4의 위치 모든에서 다른 광학 부품, M5, L3, GM과 2를 포함 하 여 배치를 결정 합니다. 두 번째 중요 한 단계는 동기화 프로세스. 거부 하려면 초점 배경 밖으로, 액티브 픽셀의 효과적인 탐지 폭 타일 너비는 빔 연소와 동기화 해야 합니다. 따라서, 그것은 타일 빔 (5.6 단계)의 효과적인 조명 폭을 측정 하는 데 필요한 하 고 설정된 카메라 매개 변수 따라 단계에서 6.4.
매우 큰 FOV와 이미징, 제시 방법 증가 배경 다른 쪽에 비해 한 쪽에 표시 됩니다. 이것은 조명의 다른 영상 위치에서 약간 변경된 각도에 기인 합니다. 같이 하기 전에 스캔 각도11와 동기적으로 조정 하 여이 문제를 완화 한다 M5 대신 두 번째 galvo 미러를 구현. 상용 무색 남자 대신 트릭 스캔 렌즈도 도움이 될. 그러나, 이미징의 영역에 대 한 < 8,080 µ m2, 단일 galvo 거울 청소 충분 했다. 그러나 HIST 현미경 이미징 깊이의 한계는,, 그것은 12 µ m 타일 빔과 없음 1.45 기름 침수 렌즈11~ 15 µ m 이미징 때 좋은 SBR를 얻을 수 있습니다.
이 프로토콜에서 우리 사용 8의 빔 압축 비율 타일 빔. 얇은 조명 HIST 현미경에 단일 분자 조직11이미징에 대 한 강력한 될 수 있는 높은 SBR을 달성 하기 위해 사용할 수 있습니다. 그러나,이 경우에, photobleaching 효과 고려 되어야 한다 증가 자극 강도 의해 현재 빔 압축 비율에 피11에 비해 3D 이미징에서 감소 photobleaching 보였다 동안. 2 기가 배치 목표 빛 시트 현미경에 비해, HIST 현미경 검사 법은 간단 구현 하 고 기존의 샘플 준비와 호환. 향상 된 SBR 및 큰 FOV HIST 현미경 검사 법의 상호 작용의 여러 셀에 단일 생체 역학 공부에 적합 및 더 사용할 수 있습니다 슈퍼 해상도 이미징 및 단일 분자 추적.
공개
센트럴 플로리다 대학이이 문서에 설명 된 작업을 다루는 특허 출원을 제기 했다.
감사의 말
이 작품은 방위 고 등 연구 프로젝트 기구 (DARPA) (HR00111720066) 및 국립 과학 재단 (NSF) (1805200)에 의해 지원 되었다. 우리 감사 마이클 방탄복 Andor 기술에 아낌없이 sCMOS 카메라를 임대.
자료
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
참고문헌
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047(2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641(2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123(2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유