Method Article
Un Guide pour construire un très inclinée a balayé la tuile Microscope pour l’imagerie de molécule unique champ de vision étendu
Dans cet article
Résumé
Une instruction détaillée est décrit comment construire un très inclinée a balayé le microscope de tuile (HIST) et son utilisation pour l’imagerie de la molécule unique.
Résumé
Single-molecule imaging a grandement contribué à améliorer notre compréhension des mécanismes moléculaires dans les études biologiques. Toutefois, il a été difficile d’obtenir des images grands champ de vision, contraste élevé en épaisseur cellules et tissus. Ici, nous introduisons la tuile balayé très inclinée (HIST) microscopie qui surmonte ce problème. Une paire de lentilles cylindriques a été mis en place pour générer un faisceau d’excitation allongée qui a été analysé sur une vaste zone d’imagerie via un miroir galvanométrique rapide. Une configuration 4f était utilisée pour maintenir les composants optiques. Une caméra scientifique complémentaire métal-oxyde-semiconducteur détecté le signal de fluorescence et bloqué l’arrière-plan out-of-focus avec une fente confocale dynamique synchronisée avec le balayage du faisceau. Nous présentons une instruction étape par étape sur la construction du microscope HIST avec tous les composants de base.
Introduction
Imagerie de fluorescence de la seule molécule joue un rôle important dans de nombreuses études biologiques qui révèlent des ultrastructures, la dynamique et la quantité des biomolécules1,2,3. Toutefois, il a été difficile à étudier seul les molécules à l’intérieur des cellules ou tissus. Microscopie confocale fournit haute sectionnement capacité4, il n’est pas adapté pour l’imagerie de la molécule unique en raison de grave Photoblanchiment de l’intensité d’excitation haute ou basse vitesse d’imagerie. Microscope Widefield utilise plus faible éclairage mais souffre d’un mauvais signal à fond ratio (SBR)5. Microscopie à lumière-feuille, en revanche, pourrait montrer bonnes coupes et Photoblanchiment faible6; Toutefois, l’ouverture numérique disponible (NA) est grandement limitée par l’exigence d’objectifs orthogonalement placé7. Sinon, il faut enlumineurs spéciale et échantillon chambres8,9.
Pour ces raisons, microscopie fiche optique fortement incliné et feuilleté (HILO) a été largement utilisée pour 3D simple-molécule d’imagerie10. Lorsqu’une poutre inclinée rencontre une interface de deux milieux (verre ou l’eau, par exemple), le faisceau est réfracté conformément à la loi de Snell-Descartes. Ce qui est important, le faisceau réfracté s’amincit, et son épaisseur est décrite comme dz = R/tan(θ) où R est le diamètre de la poutre inclinée et θ est l’angle de réfraction du faisceau transmis. Cette implémentation simple se traduit par une bonne capacité de coupe. Néanmoins, cette relation indique qu’un éclairage mince (c.-à-d., haute capacité sectionnement) requiert un petit R et/ou une grande θ. Par exemple, lorsque R = 20 µm et θ = 72 degrés, on peut obtenir dz = 6,5 µm. Puisqu’il n’y a une limite à l’augmentation de l’angle de réfraction pour image profondément à l’intérieur des cellules et éviter la réflexion interne totale, il y a un couplage fort de l’illumination de diamètre et l’épaisseur de la poutre. Pour cette raison, l’imagerie HILO montre une relativement faible champ de vision (FOV) qui limite grandement ses applications en imagerie multicellulaire.
Récemment, nous avons surmonté ce problème en microscopie de tuile balayé très inclinée (HIST) où le champ de vision est découplé de l’épaisseur du faisceau d’un moyen très simple de11. Tout d’abord, un faisceau allongé dans un seul sens est généré grâce à une paire de lentilles cylindriques. Ce faisceau, qualifié comme une tuile, produit une illumination mince avec dz ~ 4 µm, tandis que son champ de vision est 130 x 12 µm2. Ensuite, la tuile est balayée de l’échantillon à l’aide d’un miroir galvanométrique tournant. Pendant ce temps, l’image de fluorescence est enregistrée sur un appareil scientifique complémentaire métal-oxyde-semiconducteur (sCMOS) qui filtre efficacement out-of-focus fond en opérant en mode obturateur roulant qui sert de détection fente confocal accordable. De cette manière, HIST microscopie permet l’imagerie seule molécule avec un plus grand champ de vision (~ 130 x 130 µm2) et un éclairage plus mince que l’imagerie HILO. Nous avons appliqué cette nouvelle technique pour détecter l’ARN transcrits avec une seule sonde dans les cellules ou avec quelques sondes dans les tissus cérébraux de souris, qui a un potentiel important pour l’étude des maladies et l’expression des gènes d’imagerie. Contrairement aux autres approches, HIST emploie seulement un objectif unique ouverture numérique élevée sans un illuminateur supplémentaire ou objectifs de détection à distance et est entièrement compatible avec les microscopes inversés. Ces avantages ainsi qu’un grand champ de vision et un contraste élevé fera HIST microscopie un outil important en biologie et en médecine. Nous présentons des instructions détaillées concernant l’instrumentation du microscope HIST et comment faire pour tester et calibrer ses performances comme ci-dessous.
Protocole
1. mise en place des outils de microscope, de lasers et d’alignement
- Avant de construire le microscope, préparer tous les éléments nécessaires y compris optique, optomécanique et électronique figurant dans la Table des matières.
- Préparer un corps de microscope principalement composé de deux parties : titulaire d’un objectif avec un port de threads RMS et piezo-stage monté sur un bloc d’aluminium (Figure 1A).
Remarque : Le corps de microscope sur mesure est utilisé pour la commodité et la souplesse de l’instrumentation12. N’importe quel corps de microscope disponibles dans le commerce peut être utilisé pour la microscopie HIST. - Combinant lignes multiples de laser et les coupler à une fibre monomode
- Install 405, 561, 638 lasers nm sur l’optique de table et combiner les poutres grâce à un séparateur de faisceau polarisant et d’un miroir dichroïque de long-col, comme illustré à la Figure 1B. Assurez-vous que tous les faisceaux laser traversent de trous d’épingle sur l’outil d’alignement. Insérez un demi flasques de vague pour le réglage de la puissance.
NOTE : Porter des lunettes de protection oculaire et faisceau-blocs permet d’absorber les rayons laser non désirés. - Installer un objectif de couplage de fibres (f = 4. 5 mm) et un adaptateur fibre qui s’est tenue dans le traducteur de l’axe z avec un système de cage.
- Connecter une fibre multimode (MMF, Ø 62,5 µm) à l’adaptateur fibre. Réglez chaque paire de miroir de la direction et le z-traducteur jusqu'à ce que l’efficacité du couplage de chaque laser est supérieure à 95 %. Le faisceau de sortie a un profil en forme gaussienne proche avec des motifs de chatoiement.
- Enlever la fibre multimode et raccorder une fibre monomode (SMF). Semblable en MMF, affiner et maximiser l’efficacité de couplage de trois lasers.
- Install 405, 561, 638 lasers nm sur l’optique de table et combiner les poutres grâce à un séparateur de faisceau polarisant et d’un miroir dichroïque de long-col, comme illustré à la Figure 1B. Assurez-vous que tous les faisceaux laser traversent de trous d’épingle sur l’outil d’alignement. Insérez un demi flasques de vague pour le réglage de la puissance.
- Assembler une source de lumière collimatée qui sera utilisée pour l’alignement du faisceau dans les chemins de détection et d’excitation. Ce dispositif se compose d’une source de lumière cohérente dans le temps (561 nm) connecté à SMF, adaptateur fibre, lentille achromatique (f = 60 mm), iris et Ø1 » tube entretoise dans un système de cage (Figure 1C). Ajuster la distance entre l’adaptateur fibre et la lentille à l’aide d’un interféromètre de cisaillement pour s’assurer de la collimation.
- Préparer un outil d’alignement de faisceau (Figure 1D). Il s’agit d’une paire de bornes en aluminium avec trous d’épingle à 2" hauteur de la surface de table optique, qui permet l’alignement rapide et précis de faisceau.
- Monter un système de double trou d’épingle qui se compose de deux Ø1 » disques alignement verre dépoli à chaque extrémité et deux Ø1 » lentille de tubes (le bas est fendu) comme illustré à la Figure 1E.
2. configurer le chemin d’accès détection
- Retirez l’objectif et installer la source de lumière collimatée. Réglez les boutons du miroir (M1) sous le porte-objectif afin que le faisceau de sortie du microscope est à peu près parallèle à la table optique en hauteur et alignés avec les trous filetés sur la table. Reportez-vous à la Figure 2 pour les positions détaillées de chaque composant optique.
- Insérer un miroir Dichroique multiband (DM) et reflètent le faisceau de 90 degrés. Utiliser la taille maximale de l’iris et s’assurer que le faisceau passe à travers le centre du miroir dichroïque sans écrêtage.
- Utiliser le faisceau qui fuit en passant à travers le miroir dichroïque pour guider l’alignement du chemin d’accès détection. Placer une caméra sCMOS dans le faisceau et s’assurer que le faisceau frappe le centre de la puce de la caméra à l’aide de deux miroirs (M2 et M3).
- Insérez un tube de lentille (TL ; f = 300 mm) environ 300 mm de l’appareil photo.
- Supprimer la source de lumière collimatée et ajustez la distance relative entre la lentille du tube et la caméra jusqu'à ce qu’un modèle sur le plafond est clairement résolu par la caméra.
- Insérer un filtre passe-bande multiples (BF) devant l’objectif de tube pour l’imagerie de fluorescence multicolore.
3. configurer le chemin d’accès d’excitation
- Réinstaller la source de lumière collimatée sur le porte-objectif. Placer un pli-miroir (M4) pour rediriger la sortie de la poutre du microscope de 90 degrés. Réglez les boutons de la miroir dichroïque et le pli-miroir par itération jusqu'à ce que le faisceau passe à travers des trous d’épingle dans l’outil d’alignement de faisceau.
- Détacher la source de lumière collimatée et l’installer sur la table, dans lequel la poutre est orientée vers le corps de microscope. Aligner le faisceau à l’aide d’un outil d’alignement de faisceau et un système de double trou d’épingle.
- Insérez une lentille L4 (f = 400 mm ; Ø = 2") pour le trajet optique environ 400 mm loin de l’objectif titulaire. Installer le porte-objectif et ajuster la position du L4 le long de l’axe optique, jusqu'à ce qu’un modèle de disque aéré parfait est formé sur le plafond.
Remarque : Lorsque vous insérez la lentille, la position du faisceau passant à travers la lentille doit rester inchangée. La lentille L4 a un thread SM2 qui lui permet d’être attaché/détaché de la 60 mm plaque filetée SM2 facilement. - Dévisser l’objectif et de réinstaller la source de lumière collimatée avec un iris ouvert. Remonter vers le bas de la sortie du faisceau du microscope avec une carte de visite. Monter un miroir M5 à l’endroit où la taille du faisceau est le plus petit et environ 400 mm de L4, qui est un plan de l’image conjugués (cIP).
- Installer un miroir M6 et reflètent le faisceau de 90 degrés. Ajuster les M5 et M6 itérative avec l’outil d’alignement de faisceau.
- Insérez une lentille L3 (f = 150 mm) environ 150 mm par rapport à M5. Utilisez un interféromètre de cisaillement pour garantir la collimation de la poutre de sortie.
- Temporairement à emporter L4 et trace vers le bas de la poutre pour trouver la position focale de L3. Mettez un seul axe galvo miroir à ce stade, qui est un plan de retour focal conjugué (PFBC). Alimentation 0 Volt au miroir galvanométrique et faire pivoter le support du miroir galvanométrique afin qu’il reflète le faisceau de 90 degrés.
- Placer un pli-miroir M7. Placer correctement la L2 (f = 100 mm) la même manière que l’étape 3.6.
- Supprimer la source de lumière collimatée du détenteur de l’objet. Installer un objectif de collimation L1 (f = 100 mm), adapteur de fibre et d’iris. Connecter une fibre monomode à l’adaptateur et envoyer le faisceau à travers le système d’imagerie.
- Réinsérez le L4 et affiner le système jusqu'à ce qu’une configuration de disque aéré parfait apparaît sur le plafond.
4. mise en place des lentilles cylindriques
- Insérez une lentille cylindrique (CL1, f = 400 mm) après L1 et assurez-vous que la lentille cylindrique concentre le faisceau le long de l’axe des abscisses.
- Insérez une autre lentille cylindrique (CL2, f = 50 mm) à la marche des rayons. Un interféromètre de cisaillement permet de s’assurer que le faisceau de sortie est collimaté.
Remarque : La distance entre les deux lentilles cylindriques est de 450 mm. Le faisceau de sortie a un taux de compression de 8 et un modèle de disque d’aérée en forme ovale allongé est formé sur le plafond.
5. essai de tuile d’imagerie
- Préparation des échantillons de l’hydrogel 3D. Mélanger 20 nm Crimson perles avec une solution d’hydrogel, qui se compose de 12 %, acrylamide:bisacrylamide (29 : 1), 0,2 % (v/v) TEMED et persulfate d’ammonium 0,2 % (p/v) dans un tampon x TAE 0,75. Injecter 50 µL de la solution mélangée dans une chambre à flux comme décrit ailleurs11. Après 10 min, l’échantillon d’hydrogel 3D est prêt à pour l’imagerie.
- Placez l’échantillon sur le porte-échantillon. 638 laser nm et régler la puissance à < 1 mW pour l’excitation de l’échantillon.
- Exécutez le logiciel de contrôle de la caméra. Dans le panneau acquisition-réglage de l’appareil, sélectionnez interne en mode de déclenchement, puis prendre la vidéo gratuite mode de fonctionnement.
- Ajustez légèrement la position de la caméra afin que l’image se trouve au centre de l’appareil photo lorsque 0 Volt est appliqué au miroir galvanométrique.
- Tourner la poignée horizontale du miroir M5 pour obtenir un éclairage très incliné.
Remarque : Avec l’augmentation de l’angle d’éclairage, l’image de l’hydrogel devient plus claire que celle de l’image de la PEV, car le faisceau s’amincit. Cependant, l’image garde presque la même position. - Enregistrer l’image de la tuile. Calculer l’éclairement efficace largeur11. Par exemple, la Figure 3 montre la largeur de l’éclairage efficace de 12 µm.
6. HIST d’imagerie
- Préparer une carte d’acquisition de données liée à un bloc de terminaisons. Connectez le connecteur BNC 1 utilisateur avec P0.0 grâce à un fil électrique. Utiliser 1 utilisateur comme une sortie numérique pour le déclenchement externe de caméra sCMOS. Connecter un analogue AO0 de sortie à un conducteur de miroir galvanométrique.
- Générer des trains d’impulsions TTL de P0.0 à l’aide d’un programme sur mesure (Figure 4A) et régler la durée de la période = 400 ms et t_ON = 2 Mme vérifier les pulsations générées à USER 1 BNC terminal par un oscilloscope numérique et puis connectez le câble BNC à la caméra port de déclenchement externe.
Remarque : Le logiciel de contrôle utilisé dans le présent document est disponible sur demande. Lorsque l’imagerie à taux de trame de caméra différents, le délai doit être ajustée en conséquence. - Commencer à balayer un miroir galvanométrique via le programme sur mesure. Réglage Vmin à-500 mV et Vmax à 500 mV pour l’imagerie de champ de vision complet. Remarquer que dans cette opération, hydrogel 3D échantillons toujours ambiants semblable à l’illumination de l’Epi.
- Changement de la valeur d’acquisition de caméra.
- Sélectionnez externe en mode détente et vers le bas (en série) dans le menu déroulant LightScan Plus comme illustré à la Figure 4B.
Remarque : Dans ce cadre, la caméra ne prend pas des images sauf si un signal de déclenchement est allumé. - Cliquez sur Scan Speed Control pour fenêtre hauteur et ligne temps Exposeur et définissez les valeurs de 180 lignes et ms 28, respectivement.
Remarque : Lorsqu’une tuile largeur (Weff) est de 180 lignes (12 µm) et un temps d’intégration par ligne (Tint) est 28 ms, un temps de retard entre les lignes (TD) est déterminé comme TD = Tint/weff = 0,156 Mme d’imagerie x 2 048 2 048 pixels, le temps d’acquisition total est de 2 048 x TD + Tint = ms 346, correspondant à ~2.9 fps.
- Sélectionnez externe en mode détente et vers le bas (en série) dans le menu déroulant LightScan Plus comme illustré à la Figure 4B.
- Ajustez légèrement Vmax et Vmin afin d’obtenir des images plus claires.
- Obtenir des images 3D pile en utilisant le programme sur mesure de mise en marche ON pile 3D et précisant le nombre de piles et de la taille de palier.
Résultats
À titre d’exemple, ADN monocaténaire marquée avec Atto647N a été photographié avec une longueur d’onde d’excitation de 638 nm dans un hydrogel en 3D. L’ADN était ancré au réseau hydrogel via une portion d’acrydite lors de la polymérisation du gel. Les images ont été prises à 5 µm au-dessus de la surface, comme le montre la Figure 5a. L’image HIST a montré beaucoup moins de fond par rapport à l’image de l’Epi, d'où le rapport signal sur fond a été évalué à 1,9 ± 0,7 pour l’image HIST alors que la plupart des taches seule molécule pouvait à peine être décelée par l’Epi.
Simple-molécule RNA hybridation in situ fluorescence (smFISH) a été réalisée avec 4 sondes de poissons. Figure 5 b affiche des images de la smFISH EEF2 (facteur d’élongation de la traduction eucaryote 2) étiquetés avec AlexaFluor 647 sur cellules A549 dans un tampon d’imagerie (voir nos travaux antérieurs concernant l’échantillon préparation11). Une projection de l’intensité maximale a été réalisée sur 20 z-piles correspondant à 5 µm d’épaisseur. L’image HIST a montré non seulement SBR beaucoup améliorée mais aussi plus un éclairage homogène par rapport à l’image de l’Epi. Pour l’imagerie de l’Epi, le temps d’exposition se 400 ms pour HIST imagerie l’intégration temps par ligne est de 32 ms, qui avaient la même puissance d’éclairage de 7,5 mW mesurée avant l’objectif. Les vitesses d’imagerie de l’Epi et HIST étaient 2,5 images/s.

Figure 1 . Outils de corps, de lasers et d’alignement microscope. Objectif (A) et le porte-échantillon. (B) Photo de systèmes laser. LP, long-pass miroir dichroïque ; Plaques de λ/2, demi onde ; PBS, diviseur de faisceau polarisant. (C) Collimated source lumineuse. (D) outil d’alignement de faisceau avec deux trous d’épingle insérables. Système de Double trou d’épingle (E). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
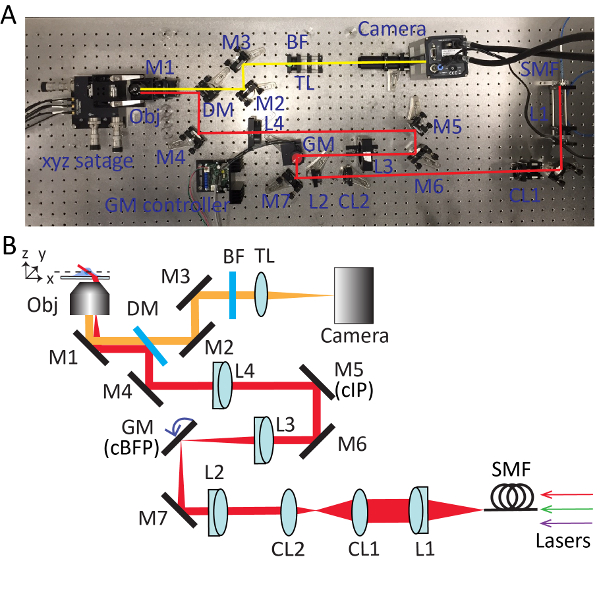
Figure 2 . Configuration détaillée pour la microscopie de tuile balayé très inclinée (HIST). Photo (A) et le schéma (B) du système de microscope HIST. BF, filtre passe-bande multiples ; Lentilles CL1-2, cylindriques ; DM, miroir dichroïque ; GM, galvo miroir ; BF, filtre passe-bande ; M1-7, miroirs ; L1-4, lentilles ; SMF, monomode ; TL, lentille du tube ; cIP, plan de l’image conjugués ; PFBC, conjugué à plan focal arrière. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
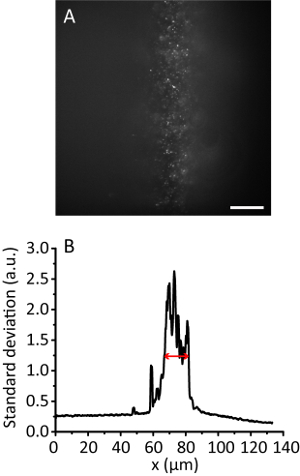
Figure 3 . Tuile d’éclairage avec un taux de compression de 8. (A) image de Fluorescence de 20 perles nm dans un hydrogel en 3D. Echelle, 20 µm. (B) écart-type projection le long de l’axe y de A, lissée par les points de 10 données. La flèche rouge indique une largeur d’éclairage efficace de 12 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
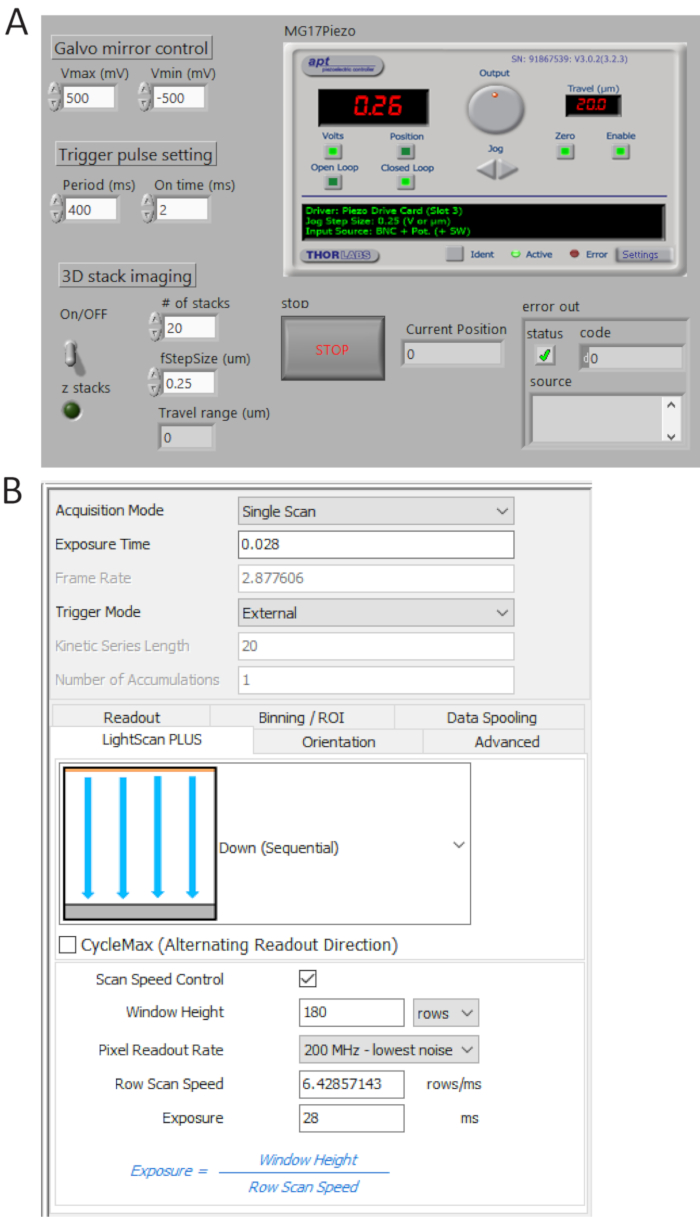
Figure 4 . Contrôle et logiciels d’imagerie avant panneaux. (A) A fait sur mesure LabView programme contrôle synchrone la numérisation du miroir galvanométrique, l’acquisition de départ de sCMOS caméra et le mouvement de la scène piezo. Panneau de commande de réglage de la caméra acquisition (B). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
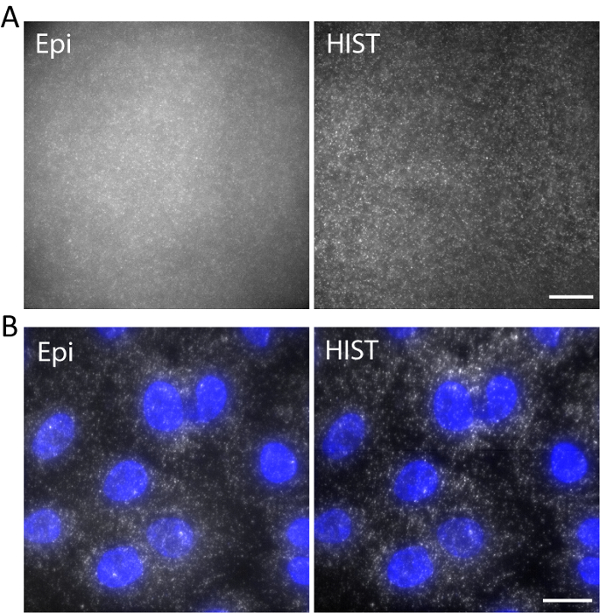
Figure 5. (A) des Images de Atto647N-étiquetée d’ADN dans un hydrogel en 3D avec l’Epi et HIST d’illumination. (B) smFISH images EEF2 à l’aide de 4 poissons sondes sur cellules A549 par microscopie Epi et HIST. Tache DAPI est affiché en bleu. Échelle de barres, de 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Il y a deux étapes cruciales dans le présent protocole. Le premier est le positionnement correct de L4 à l’étape 3.3, veiller à ce que le faisceau incident traverse le centre de la lentille et un modèle de disque aéré parfait est formé sur le plafond. La position de L4 détermine le placement de tous les autres composants optiques, y compris les M5, L2, L3 et GM. La deuxième étape critique est le processus de synchronisation. Pour rejeter le hors contexte de la mise au point, les pixels actifs dont une détection efficace la largeur est égale à la largeur de la tuile doivent être synchronisés avec le balayage du faisceau. Par conséquent, il est nécessaire de mesurer la largeur de l’éclairage efficace d’un faisceau de carreaux (point 5.6) et paramètres de la caméra fixe en conséquence à l’étape 6.4.
Lorsque l’imagerie avec très grand champ de vision, la méthode présentée montre une formation accrue d’un côté par rapport à l’autre côté. Ceci est attribué à des angles légèrement modifiées de l’éclairement à différentes positions d’imagerie. Mise en œuvre d’un second miroir galvanométrique au lieu de M5 atténue ce problème comme l’a démontré avant en ajustant simultanément la position et la numérisation de l’angle11. Au lieu de doublets achromatiques sur étagère, un objectif de balayage télécentrique sera également utile. Toutefois, pour une superficie de l’imagerie < 8 080 µm2, galvo seul miroir de balayage était suffisant. La microscopie HIST a une limite de la profondeur d’imagerie, cependant, il est en mesure d’obtenir un bon SBR lors d’imagerie jusqu'à ~ 15 µm avec un faisceau de tuile 12 µm et 1,45 NA huile d’immersion objectif11.
Dans ce protocole, nous avons utilisé le ratio de compression de faisceau de 8 pour faire une poutre de la tuile. Un éclairage plus mince peut être utilisé dans la microscopie HIST pour atteindre SBR plus élevé, qui pourrait être puissant pour imagerie11des tissus de molécules simples. Toutefois, dans ce cas, effet de Photoblanchiment devrait considérer une intensité d’excitation accrue tandis que le taux de compression actuel faisceau montrait Photoblanchiment réduit en imagerie 3D par rapport aux Epi11. Par rapport aux microscopes de lumière-feuille avec deux objectifs placés perpendiculairement, HIST microscopie est simple à implémenter et compatible avec les préparations classiques. Le SBR renforcée et un grand champ de vision de microscopie HIST convient pour étudier les interactions et dynamique des biomolécules unique en plusieurs cellules et peut être utilisé également en imagerie de super-résolution et suivi des molécules simples.
Déclarations de divulgation
Université de Central Florida a déposé une demande de brevet couvrant les travaux décrit dans cet article.
Remerciements
Ce travail a été soutenu par la Defense Advanced Research Projects Agency (DARPA) (HR00111720066) et la National Science Foundation (NSF) (1805200). Nous remercions Michael Serge dans Andor Technology généreusement prêté la caméra sCMOS.
matériels
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
Références
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047(2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641(2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123(2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon