A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זיהוי וניתוח של מחסני עכבר מגוונים
In This Article
Summary
אדיפוציטים קיימות במחסנים נפרדים ויש להם תפקידים מגוונים בתוך המיקרו-סביבות הייחודיות שלהם. כמו הבדלים אזוריים אופי ותפקוד הפונקציה נחשפים, זיהוי סטנדרטית בידוד של מחסני חיוני לקידום השדה. בזאת, אנו מציגים פרוטוקול מפורט לגבי כריתה של מחסני שומן בעכבר.
Abstract
רקמות אדיפוז הן איברים מורכבים עם מגוון רחב של פונקציות, כולל אחסון והגיוס של אנרגיה בתגובה לצרכים מקומיים וגלובליים, ללא צימוד של חילוף החומרים כדי ליצור חום, הפרשה של adipokines כדי לווסת את כל הגוף הומאוסטזיס ו תגובות החיסון. מחקר המתעוררים מזהה הבדלים אזוריים חשובים בפרופילים התפתחותיים, מולקולריים פונקציונלי של adipocytes ממוקם במחסנים דיסקרטית ברחבי הגוף. תכונות שונות של המחסנים הם רלוונטיים מבחינה רפואית מאז מחלות מטבולית לעתים קרובות להפגין אפקטים ספציפיים דיפו. פרוטוקול זה יספק לחוקרים אטלס אנטומי מפורט ומדריך לחיתוך לזיהוי ולניתוח מדויק ולכריתה של רקמות מגוונות של שומן העכבר. ניתוח מתוקננת של מחסני אדיפוז נפרדים יאפשר השוואות מפורטות של מאפיינים מולקולריים ומטבוליים שלהם ותרומות למצבים מקומיים ומערכתית הפתולוגיים בתנאים תזונתיים וסביבתיים שונים.
Introduction
הרקמות של אדיפוז משחקות תפקידים קריטיים בהומאוסטזיס הגוף המלא, כולל אחסון ושחרור של אנרגיה בתגובה לצרכים מקומיים וגלובליים, הומיאותרמיות והפרשת adipokines כדי להסדיר את איזון האנרגיה, מטבוליזם ותגובות החיסון1 , 2. adipocytes מופץ ברחבי הגוף במחסנים דיסקרטית, ובמקרים מסוימים לשרת תפקידים מיוחדים בתוך מיקרוסביבות שלהם3,4,5. מבחינה היסטורית, מחקר הרקמה האדיפוז התרכז ברקמת השומן הלבנה (WAT), ותפקידה בשמירה על הומאוסטזיס האנרגיה. האדיפוציטים ביותר מופצים בכל הגוף בתוך מחסני תת עורית וואט הקרביים. המאפיינים של מחסני אלה חשובים עבור הרגישות הדיפרנציאלית למחלות מטבולית. Adipocytes תת עורית, ממוקם מתחת לעור, היו קשורים עם הגנה השפעות מטבולית5. Adipocytes הקרביים, אשר מקיפים את האיברים החיוניים וכלולים בתוך הגונאדאל, perirenal, הצפק, מחסני מלנטל ו קרום הלב, מקושרים בדרך כלל להפרעות מטבולית, כולל סוכרת סוג 2 מחלות לב וכלי דם2 . בנוסף, למדו באופן נרחב רקמות שומן בצבע חום (BAT). חלבון בצבע חום וחום (adipocytes express) (UCP1) ולשחק תפקידים חשובים ב תרמוגנזה מסתגלת ו גלוקוז הומאוסטזיס6,7. Adipocytes חום קלאסי הם כלולים ב מחסן בת הגלימה8. אשכולות של adipocytes חום נמצאים גם במקומות אחרים, כולל supraclavicular, אינפרא-אדום השכמה, צוואר הרחם, פאראחוליה ו מחסני האבי העורקים8,9.
בנוסף המיקום שלהם בוואט וואט הגדולות והעטלף, adipocytes להתקיים נישות דיסקרטית ברחבי הגוף4, שם הם עשויים לבצע פונקציות מיוחדות בתוך מיקרוסביבות המתאימות שלהם. לדוגמה, מח עצם (BMAT) משמש כמאגר שומנים בדם, הוא מקור מרכזי של במחזור adiponectin, ואינטראקציה מקרוב עם אוסטאופתית, אוסטאוקיים, ותאים המטודטיים10,11. Adipocytes העורי תורמים תהליכים נרחבים, כולל ריפוי הפצע, תגובה חיסונית, הומיאותרמיות, ו זקיק השיער צמיחה12,13. עוד, adipocytes האפיציטים עשוי לייצר מספר adipokines ו נוגדנים להפעיל אפקטים מקומיים מערכתית על פיתוח והתקדמות של מחלת עורק כלילית14. התרחבות הוואט הבין-פנימי מתואם באופן חיובי לעמידות מוגברת, לתנגודת אינסולין מערכתית ולירידה בחוזק השרירים ובניידות15. בנוסף, עדיפוציטים popliteal לשמש מאגר השומנים להרחבת הלימפה במהלך זיהום16. בעוד התפקידים הספציפיים של מחסני שונות שונים הם בדרך כלל לא ידוע, מחסן הופה (התשתיות) בתוך הברך נחשב כיום לתרום לפתווגיות, כולל כאב בברך קדמי, אוסטיאוארתריטיס17.
בעוד הבדלים אזוריים באופי adipocyte ותפקוד נמצאים תחת מחקר אינטנסיבי, השדה מוגבל כרגע על ידי חוסר פרוטוקול מתוקננת לזיהוי וניתוח של מחסני עכבר מגוונים. שיטות שפורסמו בעבר תיארו בדרך כלל את הבידוד של אחד או שניים מחסני מסוים וחוסר רמת הפירוט הנדרש עבור כריתה אחידה18,19. הפרוטוקול המתואר בכתב יד זה מספק מדריך מקיף עבור המיקומים האנטומיים הספציפיים וצעדי הבידוד של הרבה מחסני עכברים שונים. למרות שהמחסנים בוואט הם המוקד העיקרי של כתב היד הזה, כריתה של עטלף הגלימה מתוארת אף היא בפרוטרוט. ניתן להשתמש ברקמות אדיפוז באמצעות פרוטוקול זה למגוון רחב של נקודות קצה נסיוניות, לרבות לימודי החולוגיה, היסטולוגיה וניתוחי ביטויים גנטיים.
מטרת כתב היד היא לספק לחוקרים פרוטוקול מפורט באופן ברור ומדויק, לזהות ולבודד בצורה בולטת וברורה פחות של מחסני עכברים (איור 1). משאב זה יקל על חקירה מלאה יותר של המאפיינים התפתחותיים, מולקולריים ופונקציונלי של adipocytes בתוך נישות מגוונות.
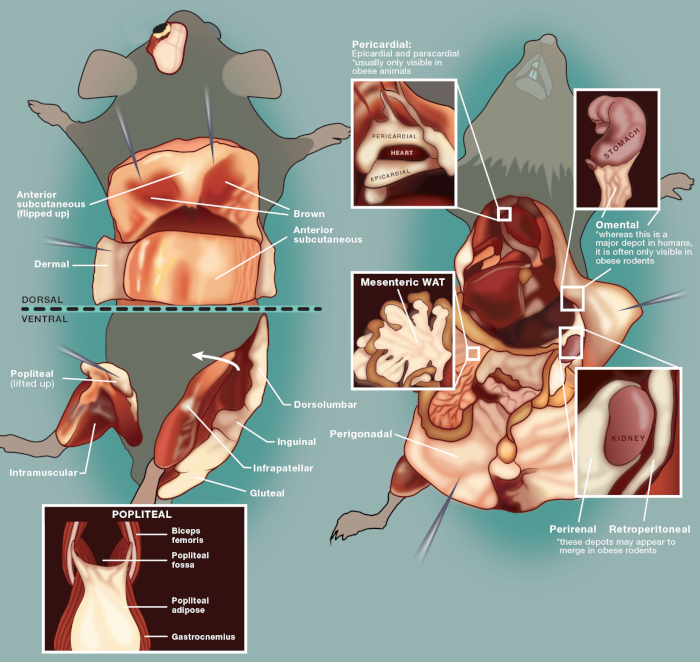
איור 1: תיאור סכמטי של מחסני העכבר בפרוטוקול זה. תמונה זו הותאמה מ Bagchi et al., 20184. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל הליכים בעלי חיים מבוצעים עם אישור של הוועדה לטיפול בבעלי חיים מוסדיים (IACUC) של אוניברסיטת מישיגן.
1. המתת חסד
הערה: לצורך פרוטוקול וידאו זה, משתמשים בעכבר C57BL/6J בן 4 עד 6 חודשים.
- הניחו את העכבר בתא מאדה, והתאימו את קצב הזרימה של isofלאנה ל-5% או יותר. . עד דקה אחרי שהנשמה נעצרת ואז להסיר את העכבר מן החדר מאדה ולאשר המתת חסד באמצעות מדד משני מאושר.
הערה: האמצעים המשניים שאושרו ישתנו באמצעות פרוטוקול מוסד ובעלי חיים ועשויים לכלול פריקת צוואר הרחם או עריפת ראש. - מניחים את העכבר הורדמים על מחבת החיתוך. לחטא את המשטחים החיצוניים החלק החיצוני של העכבר באמצעות 70% אתנול. ודא כי המשטח החיצוני של העכבר הוא רטוב מספיק כדי למזער את הזיהום מפרווה במהלך הניתוח.
2. זיהוי ובידוד תת עורית הגדול (תת-עורית, דוראממבאר, אינרירינאלה, גלוטיל) ורקמות חום
- זיהוי ובידוד תת עורית הקדמי וואט
הערה: וואט תת עורית הקדמי ממוקם בין השכמה, יורד מעורף הצוואר אל האקפיליות של העכבר7. מחסן זה יש לחילופין תיאר בתור שכבת8 או interשכמה20 וואט ו שקרים ישירות על גבי מחסן בת בתוך הגלימה.- כדי לבודד את המחסן התת עורית הקדמי, הנח את העכבר על בטנו במצב נוטה. אבטחו את הגפיים העליונות והתחתונות. לסיר החיתוך עם סיכות החיתוך
- השתמש מלקחיים כדי להרים את העור העורפי בעורף. להשתמש במספריים הקשתית כדי ליצור קטן (1 מ"מ) חתך בעור.
- הכנס להב אחד של מספריים הקשתית לתוך החיתוך הראשוני והפוך חתך אנכי בקו האמצע (2 – 3 ס מ) דרך העור, החל בעורף הצוואר ויורד לאורך עמוד השדרה לאמצע העורף.
- הפוך שני חתכים אופקיים (1 ס מ כל אחד) באמצעות מספריים איריס, הרחבה לרוחב האמצע, בחלק העליון והתחתון של החתך האנכי הראשוני.
- השתמש מלקחיים כדי לקלף בזהירות את העור ולחשוף את המחסן התת עורית הקדמי.
- להשתמש במספריים הקשתית כדי להסיר את דיפו בעקבות גבולות הטבעי של הרקמה.
הערה: שיטה זו מבודדת הן וואט תת עורית הקדמי והגלימה BAT. - מניחים את מחסן לגזור על המחבת לחיתוך בזהירות להסיר את המחבט מזהם באמצעות איריס מספריים.
- זיהוי ובידוד ג בת לפני-פיזיקלי
הערה: העטלף הקלאסי ממוקם מתחת מחסן תת עורית הקדמי.- כדי לבודד BAT, להשתמש במספריים איריס לחתוך אופקית לאורך הקצה התחתון של הרקמה התת עורית הקדמי, בעקבות הגבול הטבעי של דיפו.
- ואז, להשתמש במספריים איריס לעשות שני חתכים אנכיים לאורך הקצוות לרוחב של דיפו, בעקבות גבולות הטבעי של הרקמה.
- השתמש מלקחיים כדי בזהירות להעיף את דיפו למעלה ולחשוף את הפרפר בצורת הגלימה בת מוטבע בתוך הוואט. מנתחים בזהירות את העטלף מוואט שמסביב.
- זיהוי ובידוד תת עורית וואט,
- הנח את העכבר על גבו במצב פרקדן.
- לאחר הבטחת הגפיים העליון והתחתון עם סיכות לחיתוך, השתמש מלקחיים להרים את העור בבסיס של עצם החזה ולעשות לחתוך קטן (1 מ"מ) לגזור בעור.
- הכנס להב אחד של מספריים קשתית לתוך החיתוך הראשוני ולעשות חתך באמצע קו (4 – 5 ס מ) דרך העור, החל בבסיס עצם החזה ויורדים לבסיס הזנב. היזהרו כאשר עושים את החתך הזה כי העור הגחוני הוא דק מאוד והוא קשור היטב את הקיר חלל הצפק בסיסי.
- הפוך שני חתכים אופקיים (1 ס מ כל אחד) באמצעות מספריים איריס, הרחבה לרוחב הפס מאמצע הקו, בראש החתך האנכי הראשוני.
- השתמש מלקחיים כדי לקלף בזהירות את העור מן החלל הצפק ואת הרגל כדי למצוא וואט תת עורית האחורי, אשר צריך להישאר משויך לעור. אבטחו את העור המוחלק בעזרת סיכות החיתוך כדי להקל על כריתה מלאה של הוואט.
הערה: למרות שוואט התת-עורי האחורי נראה רצוף, הוא מורכב למעשה משלוש מחסני בדידים: dorסיסות mbar, אינפרירינאר וגלוטיל1. The dorסיסות mbar דיפו משתרע מעמוד השדרה המותני לבסיס של האיבר החוצה. משולש אינרינזה משתרע מתוך הבסיס של ventrally הגפיים על פני המפשעה ומכיל צומת לימפה בולטת. הגלוטיל משתרע מתוך הבסיס של המפשעה וגולש סביב הרגל לבסיס הזנב.
3. זיהוי ובידוד של אדיפוז מחסני הקרביים (גונדאל, פררגאל, רטרופריפריאל, אומנטל, בלוטת הלב)
- זיהוי ובידוד מחסני וואט בקרביים
הערה: וואט מחסני, אשר נמצאים במידה רבה בתוך חללים בחלל החזה הצפק, לשמור את העכבר במצב פרקדן. אבטחו את הגפיים העליונות והתחתונות. לסיר החיתוך עם סיכות החיתוך- מלקחיים להשתמש כדי להרים את הקיר החלל הצפק דק בבסיס של עצם החזה ולעשות חתך קטן (1 מ"מ) באמצעות מספריים איריס.
- הכנס להב אחד של מספריים איריס לתוך לחתוך ולעשות חתך אנכי יורד (4 – 5 ס מ) מן החלק העליון של חלל הצפק (בסיס של עצם החזה) לרקטום.
- הפוך שני חתכים אופקיים (1 ס מ כל אחד) עם מספריים איריס, הרחבת לרוחב האמצע, בחלק העליון והתחתון של החתך האנכי.
- השתמש מלקחיים לקלף בחזרה את הצפק ולחשוף את תוכן חלל הבטן. הצמד את הצפק הפרושות לתבנית החיתוך.
- זיהוי ובידוד ג'י onadal וואט
הערה: Gonadal וואט סביב הרחם והשחלות הנקבות (השחלות או parametrial) ואת יותרת האשך והאשכים אצל זכרים (אפידיאממל). השחלות וואט מקיפה את השחלות, הרחם, ואת שלפוחית השתן. בבעלי חיים שמנים, gonadal ו perirenal וואט יכול להיראות רציפה — במקרה זה, להפריד את המחסנים על קרן הרחם והשחלות. האפידיפה וואט מצוי כרוך ביותרת האשך, באשכים ובכלי הדם הבולטים באפידימל.- לאתר את הגונדות (האשכים או השחלות) ולהשתמש מלקחיים כדי להרים את הוואט gonadal המשויך.
- השתמש מספריים איריס כדי לבלו בזהירות את הוואט מן הגונדות.
- זיהוי ובידוד p ארירגאל וואט
הערה: Perirenal וואט סביב הכליות בקיעים. בבעלי חיים שמנים, מחסן זה יכול להופיע כדי להאריך את החלק העליון של קרן הרחם והשחלות. למרות וואט perirenal באופן מסורתי מסווג כמחסן הקרביים21, כמה קבוצות זיהו את זה כמו דיפו חום מבוסס על מעקב שושלת היוחסין מחקרים ספיגה של גלוקוז8,9, 20. היסטולוגית הוא מורכב תערובת של adipocytes לבן וחום.- כדי לבלו את מחסן perirenal, לאתר את הכליה ולהשתמש מלקחיים להרים אותו למעלה ולמשוך אותו באמצע כדי לראות חלוקה ברורה בין מחסני הפרקנאל והצפק.
- בלו את הוואט הקשור ישירות לכליות. ודא שבלוטות יותרת הכליה, הממוקמות מעל הכליות, מוסרות מהוואט.
- זיהוי ובידוד ר אטצפק וואט
הערה: וואט הצפק ממוקם בתנוחה של פאראטבורי, לאורך הגבול בין קיר הבטן האחורי לחוט השדרה.- כדי לבלו מחסן זה, להשתמש מלקחיים כדי להרים את הכליה למעלה ולכיוון האמצע כדי לראות בבירור את הגבול בין מחסני הפרקנאל והצפק.
הערה: בבעלי חיים שמנים, זיהוי גבול זה יכול להיות מאתגר. - ואז, להשתמש במספריים הקשתית כדי לנתח בזהירות את הוואט הצפק מקיר הצפק האחורי.
- כדי לבלו מחסן זה, להשתמש מלקחיים כדי להרים את הכליה למעלה ולכיוון האמצע כדי לראות בבירור את הגבול בין מחסני הפרקנאל והצפק.
- זיהוי ובידוד של וואט
הערה: מלון אומנטל וואט ממוקם לאורך העקמומיות הגדולה יותר של הקיבה. למרות שאדיפוז הוא מחסן חשוב בבני אדם, הוא מופיע בדרך כלל רק בעכברים צורה חולנית מנים.- כדי לזהות וואט הקרביים, השתמש מלקחיים כדי להרים את הבטן למעלה. השתמשו במספריים להסרת רקמת השומן המשויכת לאורך הגבול הנחות של הקיבה. אין לבלבל בין וואט לבין הלבלב.
- זיהוי ובידוד מססנטרמית וואט
הערה: Mesenteric WAT הוא מבנה כמו אינטרנט המקיף וקשור עם המעיים קטנים וגדולים.- כדי לבלו מחסן זה, להסיר את המעיים משאר מערכת העיכול על ידי גזירה בבסיס הקיבה ואת הרקטום. השתמש מלקחיים להרים את המעיים מתוך חלל הקרביים ולפענח אותם.
- השתמש במספריים הקשתית כדי לנתח בזהירות את הוואט מצע הרחק מן המעיים, החל בתריסריון והמשך לסוף המעי הגס. בזהירות להסיר בלוטות הלימפה כי הם קשורים הדוק עם מחסן מצע.
- זיהוי ובידוד באמצעות הלב וואט
הערה: הוואט ממוקם מחוץ לקרום הלב הקרביים ומעל המשטח החיצוני של הקרום הדופן, לעתים קרובות לאורך ההיבט הנחות של הלב14.- כדי לקבל גישה אל חלל בית החזה, לשמור את העכבר במצב פרקדן. אבטחו את הגפיים העליונות והתחתונות. לסיר החיתוך עם סיכות החיתוך
- מלקחיים להשתמש כדי להרים את התהליך xyphoid (סחוס בבסיס של עצם החזה) ולעשות קטן (1 מ"מ) לחתוך בקיר חלל החזה.
- הכנס להב אחד של מספריים הקשתית לתוך החתך והפוך שני חתכים אופקיים (1 ס מ כל אחד) הארכת מתחת לבסיס עצם החזה. זה יחשוף את הסרעפת ואת הגבול הנחות של חלל החזה.
- השתמש במספריים לניתוח כדי ליצור שני חתכים אנכיים עולים (3 – 4 ס מ) דרך הצלעות, הארכת הראש מן הגבולות הצדדיים של חלל החזה אל הבריח.
- השתמש מלקחיים להרים את החצי הגחוני של הצלעות. השימוש במספריים מבתר כדי לבצע חתך סופי (2 ס מ) לאורך האורך הנחות של הבריח כדי להסיר את הצלעות ולחשוף את תכולת החלל הבית החזה.
- במקרה הנוכחי, בזהירות לנתח את קרום הלב האדיפוז מהמשטח החיצוני של קרום הלב.
4. זיהוי ובידוד מחסני אדיפוז אחרים
- זיהוי ובידוד וואט
הערה: וואט אפיארדיאל כלול בתוך קרום הלב בקרביים והוא משויך ישירות למשטח של שריר הלב.- אם ההווה, אדיפוציטים האפיתאי ניתן לצפות באופן היסטולוגית לאחר בידוד וקיבוע של הלב בתוך 10% ניטרלי באגירה במשך 24 שעות.
- זיהוי ובידוד p opliteal וואט
הערה: פוליטיל וואט ממוקם בפוסות הפוקליטיל בברך האחורי ומכיל צומת לימפה גדול. המחסן הזה לא נראה. בדרך כלל בחיות צעירות- כדי לבודד את popliteal WAT, להשתמש במספריים הקשתית כדי להסיר בזהירות את העור מהבסיס של האיבר האחוריות אל כף הרגל.
- הניחו את הפטלה כנגד מחבת החיתוך ואבטחו את הרגל הנטויה בעזרת סיכה ברגל. ודאו שהפוסות הפוקליטיל שבגב הברך פונות כלפי מעלה.
- השתמש איריס מספריים כדי לחתוך את הגבול הנחות של ראשי המדידיים והצדדיים של השריר גקטנמיוס. מלקחיים להשתמש כדי להרים את השריר ולחשוף את המשולש popliteal דיפו.
- להשתמש במספריים הקשתית כדי לבלו את המחסן לאורך גבולות הרקמה הטבעית.
- איתור ובידוד העורי וואט
הערה: העור וואט היא שכבה דקה של adipocytes ממוקם בין הדרך הרשתית ואת שכבת השריר carnosus השרירים.- כדי לזהות adipocytes העורי על ידי שיטות היסטולוגית, מניחים את העכבר על בטנו במצב נוטה. לאחר אבטחת הגפיים העליונים והתחתונים עם סיכות לחיתוך, רסס את המשטח החיצוני של העכבר עם 70% אתנול כדי להרטיב את העור.
- השתמשו באזמל כדי להסיר את הפרווה הווממה מחלק מרובע של העור בגב העכבר.
- השתמש מספריים איריס כדי לבלו בזהירות את החלק המגולח של העור, אשר יכלול את הדרך הרשתית, וואט העורי, panniculus carnosus, ועוד כמה וואט תת עורית.
- השתמש באזמל כדי לחתוך את העור המפעל לרצועות אנכיות דקות.
- הצב את הרצועות האנכיות הדקות עם שכבת וואט התת-עורית הדביקה הפונה כלפי מטה.
- החל מקצה אחד, גלגל את הרצועה על עצמו כדי ליצור ספירלה. שכבת וואט תת עורית דביק על החלק החיצוני של הספירלה יאפשר רול כדי לשמור על צורתו במהלך הקיבעון.
- הניחו את הספירלה בבאר של 24 לוחית המכילה 10% פורמאלין ניטרלי באגירה עבור 24 שעות לפני עיבוד היסטולוגית22.
- זיהוי ובידוד וואט בין-שרירי
הערה: וואט intermuscular מוגדר באופן נרחב כמו adipocytes ממוקם מתחת עמוק של השרירים. מונח זה כולל adipocytes בהפרש בין סיבי שריר של שריר השלד, הידוע גם בשם וואט שרירי, ו adipocytes ממוקם בתוך צרורות שריר עצמם. עכברים wildtype בדרך כלל אין מספר גדול של adipocytes שרירי. עם זאת, ייתכן שבתנאים מסוימים ניתן לזהות וואט בין-שרירי באמצעות שיטות היסטולוגית. בתנאים מסוימים, adipocytes שרירי יכול להימצא גם השרירים החלקים, כגון הסרעפת.- כדי לבודד את השריר הקדמי (TA), למשל, מניחים את העכבר על גבו בעמדה פרקדן ולאבטח את הגפיים התחתונות לסיר הקרע באמצעות סיכות לנתיחה. להרטיב את העור עם 70% אתנול כדי למזער את הזיהום עם פרווה.
- השתמש מספריים איריס להסיר בזהירות את העור מהרגל ולחשוף את קבוצת השריר הארבע ראשי, הממוקם מעל הברך על פיר הירך, ואת ה-TA הממוקם מתחת לברך על המשטח הגחוני של השוקה.
הערה: ה-TA עבה ליד הקצה הקרוב ביותר של השוקה ועוד יותר מתוח קרוב לקצה המרוחק. - השתמש מספריים איריס לבלו פיסת שריר ולתקן ב 10% המאגר ניטרלי באגירה עבור 24 שעות לפני עיבוד היסטולוגית22.
- זיהוי ובידוד מחסני וואט פנים-ארטיטים
הערה: מחסני וואט פנים ממוקמים בתוך מפרקי סיננובקבוקון.- כדי לזהות וואט, לדוגמה, על-ידי שיטות היסטולוגית, עצמות הרגל של הקציר כמפורט במקטע BMAT.
- לאחר הסרת מורכבות עצם הירך, להשתמש מספריים איריס רפידות גזה כדי להסיר את השריר ואת רקמת החיבור ככל האפשר. . אל תשבור את המפרק המוסרי
- לתקן את מורכבות עצם הירך בשנת 10% באגירה נייטרלית עבור 24 שעות לפני decalcification ועיבוד היסטולוגית (המתואר להלן, שלב 4.6.8).
- זיהוי ובידוד רקמה של מח עצם
הערה: רקמת העצם שאדיפוז (BMAT) כלולה בתוך העצמות, ביחד עם תאים המטפאות. מבחינה אנטומית, BMAT יכול להיות מסווג כקונסטיטוטיב (החוליות מהסטרם והקדל) או מוסדר (באמצע עד האבומית, עצם הירך, ואת חוליות המותניים)10,11. נקיון בידוד של מח עצם אדיפוציטים עבור RNA וניתוחי חלבון הוא מאתגר בעכברים. עם זאת, עצמות העכבר ניתן בקלות לקצור, קבוע, decalcified פרפין-מוטבע ניתוח היסטולוגית.- כדי לקצור עצמות הרגל, למשל, תחילה להסיר את הרגליים מהעכבר. להשתמש במספריים לחיתוך לחתוך את המפרק מרחכי הירך, שמירה על ראש הירך שלם.
- השתמש מספריים איריס להסיר בזהירות את העור מהרגל, חשיפת שרירי הרגל.
- מנתחים בזהירות את השרירים העיקריים מעצם הירך והשוקה באמצעות מספריים איריס ותחבושות גזה.
- כאשר עצם הירך נחשפת, עקבו אחר קצה העצם לחיתוך האגן ועצם הירך, ושחררו בזהירות את ראש הירך ממפרק מרחמת הירך. להשתמש גזה לנקות את כל הרקמה הנותרת מעצם הירך.
- עקבו אחר גבול השוקה. למפרק הקרסול שחררו בזהירות את הקרסולית המדיאלי, הממוקם בקצה השוקה, ממפרק הקרסול.
- לאחר מורכבות עצם הירך כבר בודד, להסיר כמו שרירים ורקמות החיבור ככל האפשר באמצעות מספריים איריס ו/או גזה.
- הפרד את השוקה מעצם הירך על ידי החדרת להב אחד של מספריים הקשתית לתוך המפרק המוסרי ולחתוך בעדינות את הרצועות המדיאלית ולרוחב ואת הרצועות הקדמיות והאחורי מצלבים. אין להסיר את הקפסולה של מפרק הברך כדי להבטיח כי השוקה נשאר שלם. השתמש גזה לנקות את כל הרקמה הנותרת מן השוקה.
- תקן עצמות ב 10% מאגר נייטרלי באגירה עבור 24 שעות בטמפרטורת החדר ולאחר מכן לשטוף ולאחסן בהתאם לצרכים עתידיים.
- כדי לנתח את פרמטרי העצם באמצעות טומוגרפיה מיקרומחושבת (μCT), עצמות החנות במאגר הפוספט של סורנסן, pH 7.423.
- עבור BMAT כימות היסטולוגית ניתוחים, העצמות decalcify ב 14% EDTA, pH 7.4, עבור 10-14 ימים.
- בעקבות decalcification, השימוש אוסמיום tetroxide כתמי ו μt ניתוח לכמת bmat24. אחרת, תהליך ו פרפין-להטביע עצמות עבור היסטולוגיה23.
Access restricted. Please log in or start a trial to view this content.
תוצאות
ניתן להשיג זיהוי מוצלח ובידוד של מחסני שימוש שונים בעכבר באמצעות הפרוטוקול המתואר לעיל. המיקומים האנטומיים הגולמי של תת עורית (A, E-F), חום (ב), הקרביים (C, D, G-J), ו popliteal (K) מחסני מוצגים באיור 2.
Access restricted. Please log in or start a trial to view this content.
Discussion
כחשיבותו של המאפיינים המולקולריים והפונקציונליים המגוונים של אשכולות אדיפוציטים בדידים מזוהים יותר ויותר, הדבר חיוני שחוקרים בתוך השדה יזהו ומחסני כלים לניתוח נוסף. עד כה, קיימים פרוטוקולים מעטים ללוקליזציה ובידוד סטנדרטיים של מגוון רחב של מחסני עכבר. שיטות שפורסמו בעבר מתמקדות בעיקר ע...
Access restricted. Please log in or start a trial to view this content.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
O.A.M. נתמכת על-ידי מענקי NIH DK062876 וDK092759; D.P.B. נתמך על ידי מדען רפואי אוניברסיטת מישיגן תוכנית הדרכה (T32GM007863), אוניברסיטת מישיגן תוכנית הדרכה באורגאוגנזה (T32HD007605), אוניברסיטת מישיגן מלגת רקהם ההצטיינות, ו טיילנול טיפול בעתיד.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fisher Scientific | 22-110-869 | |
| 24-well plates, untreated | Sigma-Aldrich | CLS3738 | |
| 70% ethanol (dilute from 95%) | Fisher Scientific | 04-355-226 | |
| Dissecting forceps with curved tips | VWR | 89259-946 | |
| Dissecting pan | Carolina Biological Supply Company | 629004 | |
| Dissecting scissors (sharp/blunt tip) | VWR | 82027-588 | |
| Gauze sponges | Vitality Medical | 2634 | Curity 4 inch x 4 inch gauze sponge, 12 ply |
| Handi-Pins for dissection | Carolina Biological Supply Company | 629132 | |
| Iris scissors (straight) | VWR | 470018-890 | |
| Isoflurane | VetOne | 501017 | |
| Scalpel | VWR | 100499-578 | Feather scalpel handle with blade, disposable |
References
- Cinti, S. The adipose organ at a glance. Disease Models & Mechanisms. 5 (5), 588-594 (2012).
- Rosen, E. D., Spiegelman, B. M. What we talk about when we talk about fat. Cell. 156 (1-2), 20-44 (2014).
- Sanchez-Gurmaches, J., Guertin, D. A. Adipocyte lineages: tracing back the origins of fat. Biochimica et Biophysica Acta. 1842 (3), 340-351 (2014).
- Bagchi, D. P., Forss, I., Mandrup, S., MacDougald, O. A. SnapShot: Niche Determines Adipocyte Character I. Cell Metabolism. 27 (1), 264-264 (2018).
- Tchkonia, T., et al. Mechanisms and metabolic implications of regional differences among fat depots. Cell Metabolism. 17 (5), 644-656 (2013).
- Kajimura, S., Spiegelman, B. M., Seale, P. Brown and Beige Fat: Physiological Roles beyond Heat Generation. Cell Metabolism. 22 (4), 546-559 (2015).
- Frontini, A., Cinti, S. Distribution and development of brown adipocytes in the murine and human adipose organ. Cell Metabolism. 11 (4), 253-256 (2010).
- Zhang, F., et al. An Adipose Tissue Atlas: An Image-Guided Identification of Human-like BAT and Beige Depots in Rodents. Cell Metabolism. 27, 252-262 (2018).
- Sanchez-Gurmaches, J., Guertin, D. A. Adipocytes arise from multiple lineages that are heterogeneously and dynamically distributed. Nature Communications. 5, 4099(2014).
- Li, Z., Hardij, J., Bagchi, D. P., Scheller, E. L., MacDougald, O. A. Development, regulation, metabolism and function of bone marrow adipose tissues. Bone. 110, 134-140 (2018).
- Scheller, E. L., Cawthorn, W. P., Burr, A. A., Horowitz, M. C., MacDougald, O. A. Marrow Adipose Tissue: Trimming the Fat. Trends in Endocrinology & Metabolism. 27 (6), 392-403 (2016).
- Alexander, C. M., et al. Dermal white adipose tissue: a new component of the thermogenic response. The Journal of Lipid Research. 56 (11), 2061-2069 (2015).
- Kruglikov, I. L., Scherer, P. E. Dermal Adipocytes: From Irrelevance to Metabolic Targets? Trends in Endocrinology & Metabolism. 27 (1), 1-10 (2016).
- Iacobellis, G. Local and systemic effects of the multifaceted epicardial adipose tissue depot. Nature Reviews Endocrinology. 11 (6), 363-371 (2015).
- Addison, O., Marcus, R. L., LaStayo, P. C., Ryan, A. S. Intermuscular Fat: A Review of the Consequences and Causes. International Journal of Endocrinology. 2014, 1-11 (2014).
- Pond, C. M. Adipose tissue and the immune system. Prostaglandins, Leukotrienes, and Essential Fatty Acids. 73 (1), 17-30 (2005).
- Kloppenburg, A. I. -F. M. An emerging player in knee osteoarthritis: the infrapatellar fat pad. Arthritis Research & Therapy. 15 (225), 1-9 (2013).
- Mann, A., Thompson, A., Robbins, N., Blomkalns, A. L. Localization, Identification, and Excision of Murine Adipose Depots. Journal of Visualized Experiments. (94), e52174(2014).
- Casteilla, L., Cousin, B., Calise, D. Choosing an adipose tissue depot for sampling: factors in selection and depot specificity. Methods in Molecular Biology. 155, 1-22 (2008).
- de Jong, J. M., Larsson, O., Cannon, B., Nedergaard, J. A stringent validation of mouse adipose tissue identity markers. American Journal of Physiology-Endocrinology and Metabolism. 308 (12), E1085-E1105 (2015).
- Cinti, S. The adipose organ. Prostaglandins, Leukotrienes, and Essential Fatty Acids. 73 (1), 9-15 (2005).
- Parlee, S. D., Lentz, S. I., Mori, H., MacDougald, O. A. Quantifying size and number of adipocytes in adipose tissue. Methods in Enzymology. 537, 93-122 (2014).
- Scheller, E. L., et al. Region-specific variation in the properties of skeletal adipocytes reveals regulated and constitutive marrow adipose tissues. Nature Communications. 6, 7808(2015).
- Scheller, E. L., et al. Use of osmium tetroxide staining with microcomputerized tomography to visualize and quantify bone marrow adipose tissue in vivo. Methods in Enzymology. 537, 123-139 (2014).
- Lukjanenko, L., Brachat, S., Pierrel, E., Lach-Trifilieff, E., Feige, J. N. Genomic profiling reveals that transient adipogenic activation is a hallmark of mouse models of skeletal muscle regeneration. PLoS One. 8 (8), e71084(2013).
- Pagano, A. F., et al. Muscle Regeneration with Intermuscular Adipose Tissue (IMAT) Accumulation Is Modulated by Mechanical Constraints. PLoS One. 10 (12), e0144230(2015).
- Khan, I. M., et al. Intermuscular and perimuscular fat expansion in obesity correlates with skeletal muscle T cell and macrophage infiltration and insulin resistance. International Journal of Obesity. 39 (11), 1607-1618 (2015).
- Sulston, R. J., et al. Increased Circulating Adiponectin in Response to Thiazolidinediones: Investigating the Role of Bone Marrow Adipose Tissue. Frontiers in Endocrinology. 7, 128(2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved