Method Article
מדידת הדרכה זרע ותנועתיות בתוך האלגיה של מערכת הרבייה של האנדרוגינוס
In This Article
Summary
זרע חייב לנווט בהצלחה דרך צינור ההטלה כדי להפרות oocyte. כאן אנו מתארים את הבקשה למדידת העברת זרע בתוך הרחם הדו. הדבר יכול לספק נתונים כמותיים על חלוקת זרע בתוך הרחם לאחר ההזדווגות, כמו גם על מהירות, מהירות כיוונית ותדר היפוך.
Abstract
הפריה מוצלחת היא בסיסית לרבייה מינית, אך מעט ידוע על המנגנונים שמנחים זרע לאוציטים בתוך מערכת הרבייה הנשית. למרות שמחקרים מחוץ למערכת העיכול מצביעים על כך שזרע של בעלי חיים המפרה באופן פנימי יכול להגיב לרמזים שונים מסביבתם, חוסר היכולת להמחיש את התנהגותם בתוך מערכת הרבייה הנשית, יוצר אתגר להבנת העברת הזרע וניידות בסביבתו הטבעית. כאן, אנו מתארים שיטה באמצעות C. אלגיה הגוברת על מגבלה זו ומנצל את האפידרמיס שקוף שלהם. ג. אלאים זכרים מוכתמים בצבע מיטוכונדריאלי מוטים עם הרמדיט מבוגרים, הפועלים כנקבות ששונו, ומצוידים בתווית של זרע ברחם האנדרוגינוס. הגירה ותנועתיות של הזרע שכותרתו ניתן לעקוב ישירות באמצעות מיקרוסקופ אפינפרין-פלואורסצנטית ב אנדרוגינוס חי. בחיות מסוג פראי, כ 90% של הזרע לזחול באמצעות הרחם ולהגיע לאתר ההפריה, או spermatheca. התמונות של הרחם ניתן לקחת 1 h לאחר ההזדווגות כדי להעריך את התפלגות הזרע בתוך הרחם ואת אחוז הזרע שהגיעו הספרה1. לחילופין, תמונות בזמן הפקיעה ניתן לנקוט מיד לאחר ההזדווגות כדי להעריך את מהירות הזרע, מהירות כיוונית ותדר היפוך. שיטה זו יכולה להיות משולבת עם כלים גנטיים ומולקולריים אחרים הזמינים עבור C. אלגיה כדי לזהות מנגנונים גנטיים ומולקולריים חדשניים החשובים בוויסות הנחיית זרע ותנועתיות בתוך מערכת הרבייה הנשית.
Introduction
המנגנונים המולקולריים שלפיהם מנווטים הזרע בדרכי הרבייה של הנקבה כלפי האוסייטה אינם מובנים היטב, אך הם בסיסיים לרבייה מינית. תנועתיות הזרע היא דינאמית מאוד והיא תלויה באותות תקשורת חזקים המשנים מהירות זרע ותנועתיות כיווניות1,2,3,4,5,6 , מיכל סבן , בן שמונה , מיכל בן 10 , מיכל עשור , מיכל בן 11 , 12. ג. אלאנים הפך למודל רב עוצמה לחקר תנועת הזרע ב vivo כי האפידרמיס השקוף של האנדרוגינוס מאפשר מעקב אחר זרע חי ברזולוציית תא בודדת2,3, 8,10. מטרת הנייר היא לספק שיטות להערכת תנועת זרע בתוך הרחם הדו.
במינים בעלי חיים שבהם הזרע והאוסייטה נפגשים בסביבה החיצונית (כלומר, סביבות רכישה), זרע מגיב לאותות כימוטקטיק שמופרשים על ידי האוציטים. האותות הללו מנחים את כיוון תנועת הזרע, מביאים אותם קרוב יותר למקור האות4,6,11. עם זאת, הרבה פחות ידוע על תנועת זרע במינים ההפרות מבפנים. אתגר גדול הוא הארכיטקטורה של מערכת הרבייה הנשית, שאינה נגישה למיקרוסקופיה ברוב המינים. לימודי מבחנה בבני אדם, עכברים וחזירים, למשל, מספקים ראיות לכך שאוכלוסיות משנה של זרע יכולות להגיב לחומרים כוללים, זרימת נוזלים ומעברי צבע תרמיים1,5,7,9, . שתיים עשרה במערכות אלה, חוסר היכולת להמחיש ולעקוב אחר תנועת הזרע בvivo מציב מגבלות חמורות על אסטרטגיות לגילוי מנגנוני המפתח המסדירים פונקציות אלה.
כדי להתגבר על מגבלות אלה, פיתחנו שיטות באמצעות האלמטדה C. אלגיה להמחיש במישרין את הזרע לאחר ההפריה, למדוד פרמטרים בודדים של העברת זרע בvivo, ולמדוד את היכולת של אוכלוסיית הזרע למטרה אתר ההפריה. שיטות אלה, יחד עם הכלים המולקולריים והגנטיים של C. אלגיה , מקלים על גילוי מולקולות האיתות הכימיות והמכונות המולקולריות המווסתים התנהגויות לתנועתיות זרע. לדוגמה, ניתן לנהל מסכים גנטיים בדיכוטים או זכרים כדי לזהות גנים החיוניים לתנועת זרע יעילה ב-vivo13. מולקולות ניתן להזריק לתוך לוטה האנדרוגינוס כדי לבדוק את ההשפעות על הפעלת זרע, מהירות הגירה, כיווניות לתנועתיות3. בנוסף, ניתן להשתמש בשיטות המתוארות לניטור העברת זרע מתחזה למיקומי גוף חוץ-רחמי ולהערכת תחרות הזרע10,14.
ג. אלאנים קיימים בטבע כדו וכזכרים (ראו איור 1). זיבה האנדרוגינוס יש שתי זרועות בצורת U כי הם תמונות מראה אחד של השני. בשלב הזחל הL4, תאי הנבט הקרובים ביותר (כלומר, התאים הסמוכים לspermatheca) עוברים מזרע בראשית. כל אחד מהספרציט הראשי נכנס למאיוזיס ומייצר ארבע הדודואיד ספרטידים. הספרדים הללו נדחפו לתוך הספרמקה ביחד עם האוסייטה הבוגר הראשון ועוברים את הספרבגנזה15. הרמניים מבוגרים מחליפים. מזרע לכיוון בראשית האוסטציטים בוגרת אופנה קו הרכבה לאורך gonad, עם oocyte הבוגר ביותר בקצה הקרוב ביותר של gonad, ליד spermatheca. אותות MSP מהזרע נדרשים לעורר התבגרות מיוטית וביוץ16,17. לזכר האלאנים, לעומת זאת, יש זיבה בצורת J שמייצרת רק זרע. הספרדים מאוחסנים. בנוזל הזרע עם ההזדווגות עם האנדרוגינוס או הנשי, הזכר מוסיף את החריפות ליד הזנב אל הפות. Spermatids מופעלים במהלך פליטה, כאשר הם באים במגע עם נוזל הזרע18. ג. אלאנים זרע אינם שוחים כפי שהם לא מלאים בדגלים. במקום זאת, הם זוחלים דרך מערכת הרבייה, תוך שימוש בפסדויוד לתנועה. הוא מבוסס היטב כי זרע זכר, אשר גדול יותר, יש יתרון תחרותי על זרע דו-מיניים14.
בשיטה זו, משמש הזכר כתורם הזרע ומזדווג לבגירים בוגרים. זכרים בוגרים מוכתמים בצבע מיטוכונדריאלי פלורסנט לייצור זרע. ברגע שהופקדו דרך הפות האנדרוגינוס, הזרע חייב לזחול סביב העוברים ברחם לקראת spermatheca, או אתר הפריה. האפידרמיס השקוף של מודל ה -C. אלגיה מאפשר הדמיה ישירה של כל זרע בודד כפי שהוא מנווט דרך מערכת הרבייה הנשית. בשנים האחרונות, המעבדה שלנו השתמשה בהצלחה בשיטה זו כדי להדגים את החשיבות של מעמד של סדרת F-הסדרה המנחה את הזרע מהפות אל הספרמקה,19,20. המכונה המולקולרית שמסדירים את הסינתזה שלה על ידי האנדרוגינוס והתגובה של הזרע עדיין תחת חקירה. עם זאת, שיטה זו להערכת תנועתיות הזרע והגירה מקלה מאוד על זיהוי נגני המפתח השולטים על הזרע והתקשורת האוסייתית בבעלי חיים המפרה באופן פנימי. הפרוטוקול הבא מתאר את שלב אחר שלב כיצד לבצע את הפעולה הזאת.
Protocol
הערה: כל השלבים בפרוטוקול זה מתבצעים בטמפרטורת החדר (~ 20-22 ° c) או בחממות בטמפרטורה קבועה שנקבעו ל -16 ° c או 20 ° c. הגברים והרמפרונים מגודלים באמצעות תנאי תרבות סטנדרטיים ו NA22 או OP50 E. coli כמקור מזון21,22. פראי סוג N2 הרממיניים ו ערפל -2 (q71) גברים משמשים בהליך למטה.
1. יום 1: לקטוף L4 השלב הדיכוטים להזדווגות
- כדי לקבל תוצאות עקביות, כל המדוגטים צריכים להיות מסונכרנים כמבוגרים באופן פעיל להתרבות. לבחור 20-30 L4 השלב הדיכוטים כדי 6 ס מ גידול בינוני הצמיחה נמטודות (ngm) צלחת. . ב -20 מעלות צלזיוס עבור 28-30
הערה: רק 12-15 הרמיוטים. ישמשו להזדווגות . הדיכוטים הנותרים עודפים
2. יום 1: כתמים של זכרים עם צבע מיטוכונדריאלי פלורסנט (Mito-צבען)
- הפוך את צלחת הצביעת הגברי על-ידי הצבת נקודה של E. coli (נקודה מזון) במרכז צלחת ngm בלתי מופרה. כדי להפוך את הנקודה מזון, להשתמש בסוף המוט מערבב זכוכית כדי לגרד את ה-coli מן הדשא חיידקים של צלחת הזריעה ולהפקיד אותו על הצלחת unseeded. הנקודה צריכה להיות ~ 5-7 מ"מ קוטר.
- מערבבים יחד 2 μL של מיאל 1 מ"מ-צבען (ראה טבלת חומרים) ב dmso ו 10 Μl של M9 מאגר (3 גרם KH2PO4, 6 גרם של Na 2hpo4, 5 g של הנאמל, 1 מ ל 1 מ 'מג 4, H 2 O ל 1 L. Add mgso 3, השני ל אוטוקלינג). לנקודת המזון על. צלחת הצביעת הגברי תנו לצלחת להתייבש בחשכה (~ 30 דקות).
הערה: מיאל-צבען הוא רגיש באור. מגן על כל הפתרונות, צלחות, ותולעים המכילות mito-צבען מן האור. אחסן את המניה בעובי 1 מ"מ ב-20 ° c. - לאסוף ~ 100 1-3 היום המבוגר זכרים23 לנקודה המוכתמת צבע מזון מוכתם על הצלחת מכתים את הזכר. עוטפים את הצלחת ברדיד אלומיניום ומודקת לילה ב -16 ° c. עבור ההזדווגות, השתמש ~ 50-60 גברים לכל 12-15 הדיכוטים. אם יותר מ-~ 100 גברים נחוצים, ליצור לוחיות יותר מכתים כדי למנוע צפיפות יתר של זכרים.
הערה: זכרים יכולים גם להיות מוכתם על ידי הדגירה של 10 μM-צבען פתרון במאגר M9 עבור 3 h על זכוכית שעון. לשמור על תולעים מכוסים כדי למנוע אידוי וחשיפה אור. לאחר 3 שעות, השתמש בחיית מחמד פסטר כדי להעביר זכרים על לוחית 10 ס"מ הנזרע NGM. העבר את הפתרון הקטן ביותר שניתן לצבוע. עוטפים את הצלחת ברדיד אלומיניום ו-דגירה הלילה ב -16 ° c.
3. יום 2: הזדווגות
- לבחור את הזכרים מוכתם מן היום 1 על לוחית חדש, הנזרע של NGM. השאירו את הצלחת בחשיכה. עד ההזדווגות שלב זה מבטיח כי בקטריה עודף מוכתם-צבען מסביב לזכרים יוסרו. על-גבי על צלחת ההזדווגות ניתן להכתים רקמות דו-מיניים.
- לעשות צלחת ההזדווגות על ידי שחרור 2 μL של התערובת E. coli עבה על צלחת ngm בלתי מופרה. תן את החיידקים העבים יבש כדי להפוך את נקודה ההזדווגות. זכרים והרממיניים יועברו. לנקודה זו להזדווגות כדי להפוך את ה-e. coliעבה, ספין למטה 3 מ ל של e. coli לילה ולהשעות מחדש את הגלולה חיידקים 1 מ ל של M9. ניתן לאחסן תערובת זו ב -4 ° c ולהשתמש בה לשימוש של עד 6 חודשים.
הערה: ניתן לכוונן את עובי התמיסה E. coli . אם הפתרון דק מדי, הזכרים עלולים לזחול הרחק מנקודת ההזדווגות במקום לעבור עליה להזדווגות. נקודות הזדווגות שבוצעו מ -E. coli מסיסות כי הוא עבה מדי עלולה להקטין את יעילות ההזדווגות. - בעוד לוחית ההזדווגות משלב 3.2 הוא ייבוש, לערבב יחד 300 μL של 1% (w/v) Tricaine (Tri), 300 μL של 0.1% (w/v) טטרמיאולה (ט'), ו-900 μL של M9.
הערה: מאגר 1% (w/v) Tricaine ו-0.1% (w/v) הטטרמיסיטאס בתור הציטוטים ב-20 ° c. הימנע מהפשרה הקפאה חוזרת. - העבר 600 μL של הפתרון המשולש/שלוש לזכוכית שעון.
- העברת 12-15 הדיכוטים שנבחר ביום 1 לפתרון ה-ט'/Tri בחלון השעון. מודקון במשך 30 דקות. כדי לשתק את המהרמבטים שמור על זכוכית השעון מכוסה כדי למנוע את הפתרון של ט/Tri להתאדות.
הערה: חשוב כי המראיינים מורדם לפחות 30 דקות. פחות זמן יכול לגרום לתולעת נעה במהלך רכישת תמונה, אשר יכול interefere עם הדמיה. - בעוד הדיכוטים הם הדגירה, לבחור 50-60 זכרים מוכתם משלב 3.1 על נקודה ההזדווגות (שלב 3.2). אחסן את הצלחת בחשכה עד שלב 3.8.
- לאחר הדגירה 30 דקות בפתרון ט/Tri, להשתמש זכוכית פסטר pipet כדי להעביר את הדיכוטים מקיבוע מן הזכוכית השעון על צלחת NGM בלתי מופרה. להסיר את הנוזל ככל האפשר ולתת עודף נוזלי יבש.
הערה: אל תתנו לרממיניים. להתייבש ביתר מוגזם ברגע שכל נוזל גלוי התאדה, התחל בשלב הבא. - להעביר את הרמאת ההרדמה מתוך צלחת NGM הנזרע על נקודה ההזדווגות עם הזכרים המוכתמת. מודקון בחשכה במשך 30 דקות כדי לאפשר לזכרים להזדווג עם הרמדוטים.
- לאחר ההזדווגות עבור 30 דקות, הר הדיכוטים מיד עבור הדמיה זמן לפקיעה או להעביר את הדיכוטים על הצלחת חדש, הזריעה של NGM לנוח עבור 1 h לפני הדמיה.
הערה: הזמן וידאו לשגות של הרחם האנדרוגינוס משמשים לכמת מהירות זרע ותדר היפוך. תמונות סטילס של הרחם שנלקחו 1 h לאחר ההזדווגות משמשות לכמת התפלגות זרע, או הדרכה spem.
4. יום 2: הרכבה תולעים להדמיה
-
יצירת משטח הרכבה עם 2% מעלה ב-H2O
הערה: 2% agarose ניתן לעשות בצובר, מצוטט לתוך צינורות בדיקת זכוכית, ומאוחסן ב 4 ° c. בעת הצורך, כל סדרת מחלקים יכול להיות מחממת לפני כל שימוש ומאוחסן בלוק חום כדי למנוע את זה מפני מיצוק.- כדי להפוך את הלוח ההרכבה, ליישר שלוש שקופיות זכוכית מיקרוסקופ זה לצד זה עם הקצוות הארוכים נוגעים. הצב שתי פיסות מיסוך אחת על גבי השנייה על שתי השקופיות החיצוניות. אלה הזכוכית החיצונית שקופיות עם הקלטת יפעל כתמיכה כך את העובי של כרית agarose המתקבל יהיה "two קלטת עמוק".
- מקום ~ 75 μL של מותך 2% התעוררה בשקופית המרכז (זוהי השקופית ללא קלטת). מיד המקום מיקרוסקופ זכוכית חדש על גבי העלה. שקופית הזכוכית העליונה צריכה להיות אנכית לשקופיות האחרות, כשכל קצה מונח על הקלטת של שתי שקופיות התמיכה.
- תנו לאגקם להיות הרדן (~ 30 s). הסר בזהירות את שקופית הזכוכית העליונה על-ידי הזזת אותו משטח agarose.
- מקום 10-15 μL של פתרון ה-טט/Tri על המשטח 2% agarose. להעביר את הדיכוטים. לתוך הפנקס שמור על עצמך להעביר כמו חיידקים קטנים ככל האפשר.
- הציבו שובר כיסוי על התולעים שבמשטח הצמח.
5. יום 2: התקנת רכישת תמונה
הערה: כל miscroscope ישרים מצויד אפינפרין-זריחה, 10x ו 60x מטרות, ומצלמה דיגיטלית ניתן להשתמש כדי לרכוש תמונות עבור התפלגות זרע. תוכנה המסוגלת לרכוש תמונות זמן שהזמן נדרשות להערכת מהירות זרע, מהירות כיוונית ותדר היפוך.
-
רכישת תמונה 1 h לאחר ההזדווגות
- הר את השקופית על במת המיקרוסקופ. להסתכל דרך חתיכות העין כדי לסרוק תולעים על כרית agarose באמצעות מטרה 10x עם פליטת הפליטה אדום מסנן (TRITC פילטר). לאחר שנמצאה תולעת, הדליקו בקצרה את אור הזריחה כדי לראות אם התולעת הזדווג. אם הזרע נראה בתוך הרחם, לעבור למטרה 60x.
הערה: הלחץ שנוצר על ידי המטרה 60x על שמיכות עלול להזיק כמה תולעים שברירי, גורם המעי או לוטה כדי הבלטת מהחיה. סריקה להזדווגות מוצלחת באמצעות המטרה 10x יכול למזער את החשיפה של תולעים ללחץ נוסף. אל תחשוף את התולעים הזדווג לפרקי זמן ארוכים של תאורת פלורסנט. - שימוש במיקרוסקופיה של הפרעות דיפרנציאליות (DIC) ממקם את התולעת כך שהפות ו-spermatheca אחת נמצאות בתצוגה. למקד את התמונה על ידי התמקדות במרכז spermatheca. בדוק את החשיפה עבור ערוצי DIC ו-TRITC. ב-DIC, מבנה תולעת פנימי צריך להיות גלוי בבירור. בטריtc, זרע בודד צריך להיות גלוי כמו דקדפי ברורים.
הערה: כל תמונה צריך ללכוד את הרחם מן הפות לאחת spermatheca. אם הרחם ארוך מדי מכדי להתאים לתמונה אחת, ניתן לנקוט בשתי תמונות נפרדות. זה לא הכרחי עבור כל התמונות להילקח באותה רמת חשיפה. עם זאת, חשוב כי זרע בודד יכול להיות מכובד לכמת את התמונות של הזריחה. - לרכוש תמונות DIC ו-פלואורסצנטית עבור כל רחם.
- חזור על שלבים 5.1.1-5.1.3 עד ליצירת תמונה של כל הרממיניים.
- הר את השקופית על במת המיקרוסקופ. להסתכל דרך חתיכות העין כדי לסרוק תולעים על כרית agarose באמצעות מטרה 10x עם פליטת הפליטה אדום מסנן (TRITC פילטר). לאחר שנמצאה תולעת, הדליקו בקצרה את אור הזריחה כדי לראות אם התולעת הזדווג. אם הזרע נראה בתוך הרחם, לעבור למטרה 60x.
-
לכידת קטעי וידאו של פקיעה בזמן
- סרוק את הלוח האגקם ואתר את הדיכוטים המכילים זרע בתוך הרחם, כפי שמתואר בשלב 5.1.1 ו5.1.2
- הגדר את התוכנה כך שתרכוש תמונות בזמן הקפיצה בערוצים DIC ו-TRITC. באופן כללי, תמונות הזמן לפקיעה נלקחים במרווחי 15-30 s עבור 10-20 דקות לכל הרחם.
6. כמת
-
ככמת התפלגות זרע על תמונות הרחם נלקח 1 h אחרי ההזדווגות
- החל עם הפות על קצה אחד ואת spermatheca בצד השני, לחלק את הרחם לתוך שליש. . אלה ייצגו את שלושת האזורים אזור 1 (Z1) מכיל את הפות ואת אזור 3 (Z3) מכיל את spermatheca.
- לספור באופן ידני את מספר הזרע בתוך כל שליש של הרחם, ולדווח את המספר בכל אזור כאחוז של הזרע סה כ ברחם כולו. להלן דוגמה מסופקת.
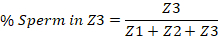
הערה: לעיתים, יש לכוונן את עוצמת האות של תמונת הערוץ TRITC כך שכל זרע שנלכד בתמונה יכול להיות גלוי וכולל כימות.
-
מעקב אחר זרע בתמונות בזמן מעידה
הערה: במאמר זה, השתמשנו בתוכנה של רכיבי NIS לצורך ניתוח. בסעיפים שלהלן, אנו מעניקים הוראות למעקב ידני אחר זרע באמצעות תוכנה זו (step 6.2.1), כמו גם בתוכנת הקוד הפתוח ImageJ/פיג'י (שלב 6.2.2).-
מעקב אחר זרע עם אלמנטים שקלים
- פתח את קובץ ה-. nd2 כאשר מתבצע מעקב אחר סידרת הקפיצה בזמן. כדי להתחיל במעקב, פתח את החלונית ' מעקב ' על-ידי לחיצה ימנית בתוכנה ובחירה באפשרות ' פקדי ניתוח ' | . מעקב אחר
- בחלונית ' מעקב ', בחרו ' הגדר ROI חדש'. הגדר כל אזור של ריבית (ROI) על-ידי לחיצה על כל זרע שיתבצע במעקב. סימן צבעוני יופיע מעל הזרע שנבחר. לחץ על סיום כאשר כל הנבחרת נבחרה.
- לאחר הזיהוי של ROIs, לעבור למסגרת הבאה בסדרה פקיעה זמן. גרור את סמן ה-ROI למיקום החדש של הזרע בתמונה. המשך לעשות זאת עד שאין עוד מעקב אחר הזרע. קווים מנוקדים יופיעו ויתחברו כל אחד מהמיקומים שסמן ה-ROI הוצב באמצעות כל המסגרות של התמונה שמעידה על הזמן.
הערה: יש לעקוב רק אחר זרע באזור 2 כזרע באזורים 1 ו-3 נוטים לנוע בתבנית מעגלית גם בחיות מסוג פראי. - ייצוא כל הנתונים הניתנות לשינוי (לדוגמה, אורך נתיב, זמן, מיקום XY וכו ') מתוך הזרע הנמצא במעקב למסמך Excel על-ידי לחיצה על ייצוא בחלונית ' מעקב '.
-
מעקב אחר זרע עם פיג'י
- המרת תמונות ערוץ TRITC בסידרת הזמן לקבצי tif. שמור את כל הקבצים מסידרה אחת לתיקיה אחת.
- יבא את התמונות לפיג באמצעות פונקציית הייבוא BioFormats. יבא תמונות מסידרה אחת של מעידה בזמן כהיפר-מחסנית אחת.
- לפתוח TrackMate בפיג24 דרך תוספים | מעקב | מעקב ידני עם TrackMate. . תיבת דיאגרמה תיפתח
- בחר בכלי TrackMate בסרגל הכלים של פיג'י. לחץ פעמיים על הזרע שיהיה מעקב. מעגל ירוק עם קווים מקווקווים יופיע. ייתכן שעיגול זה ממקם מיקום על-ידי לחיצה בתוך העיגול וגרירה למיקום הרצוי. הגודל של עיגול זה עשוי להשתנות על-ידי הקשה בו על מקש ALT וגלילה בעכבר.
- לאחר שהגודל והמיקום של מכשיר המעקב הוגדרו, לחץ שוב על העיגול. הקווים הירוקים המקווקו. הופכים לקו ירוק מוצק במקביל הכה את המקש SHIFT ושלי כדי להפעיל את מצב המעקב. פעולה זו תצוין בסרגל הכלים של פיג'י.
- מעבר למסגרת הבאה בסדרת הצניחה הזמנית. כדי להגדיר את המיקום החדש של הזרע המתבצע במסגרת החדשה, רחף על העכבר מעל הנקודה החדשה והקש על מקש A . מאתר המעקב יופיע כעת במיקום החדש, ויופיע קו המחבר את המיקומים שבהם הגשש הוצב במסגרות הקודמות.
- לאחר השלמת העקבות, לחץ על נתח בתיבת הדו trackmate כדי ליצור את הנתונים הדרושים.
- כדי לחשב את המהירות, חלק את אורך הנתיב הכולל של הזרע לפי הזמן שחלף.
- כדי לחשב את המהירות מהירות, למתוח קו דרך הרחם החל הפות הצבעה לעבר spermatheca. למדוד את המרחק שהזרע הועבר לאורך הקו הזה מתחילתו ועד סופו של המעקב. חלק את המרחק הזה. בזמן שחלף ערכים שליליים מצביעים על כך שהזרע הועבר הרחק מהספרמקה.
- כדי להקליט את תדירות ההיפוך, ספור את מספר הפעמים שבהן מעקב הזרע יצר זווית קטנה מ-90 ° במהלך שלוש מסגרות ברציפות לקפיצה בזמן.
-
מעקב אחר זרע עם אלמנטים שקלים
תוצאות
כדי ליצור את התוצאות המתוארים במאמר זה, ערפל -2 (q71) זכרים היו מוכתמים בצבע mito-צבען הזדווג לסוג פראי, N2 הרמטים. איור 2 מספק ערכה כוללת עבור השיטה, לרבות הכנה לתולעת, הזדווגות וניתוח. כמו הסרט 1 מראה, למבוגרים במערכת הרבייה האנדרוגינוס יש שתי זרועות כי הם תמונות מראה אחד של השני. עם ההזדווגות, זרע התווית מופקד ברחם האנדרוגינוס דרך הפות. הזרע לנוע סביב העוברים המתפתח בתוך הרחם לכיוון spermatheca, שם הם מאוחסנים עד הפריה. כמו תאי הנבט של האנדרוגינוס המבוגר להתפתח oocytes, האבופי, הבוגר ביותר oocyte הוא נדחף לתוך spermatheca באמצעות התוויות תא נדן. הדישון מתרחש בזמן שה "הוא ב-spermatheca.
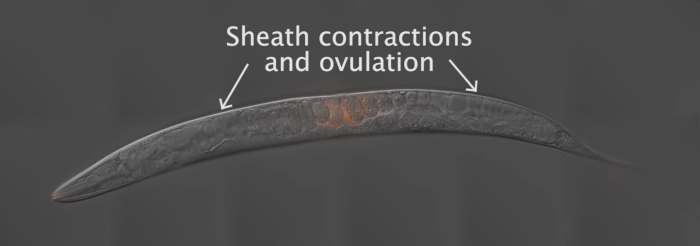
כדי לכמת את התפלגות זרע והגירה דרך מערכת הרבייה הנשית, הרחם האנדרוגינוס מחולק לשלושה אזורים (סרט 1, איור 3A). אזור 1 משתרע על השליש הראשון של הרחם, החל הפות. אזור 2 משתרע על פני השליש האמצעי של הרחם, ואזור 3 משתרע על פני השליש האחרון של הרחם וכולל את spermatheca. הדרכה הזרע הנכון באמצעות פראי, N2 הדיכוטים ו ערפל-2 (q71) זכרים צריך לגרום כ 90% הזרע בתווית להגיע spermatheca, או אזור 3 (איור 3b). מתגים הנובעים מעטים מדי (איור 3C, פחות מ 10-15 זרע) או יותר מדי (איור 3c, רחם מלא בזרע) זרע ברחם אין לספור. ב מתגים כי התוצאה היא פחות מ 10-15 זרע, 3-4 זרע מתחזה עשוי להטות בכבדות את הנתונים. באופן דומה, כאשר הרחם מתמלא לחלוטין בזרע, הזרע לא יכול להעביר כראוי. זרע עשוי להיראות מפוזרים ברחבי הטרנאני של כמה מוטציות המציגות הדרכה הזרע המסכן הנחיות. עם זאת, במקרה זה, זרע לא צריך למלא כל הבקיע של הרחם, כפי שנראה באיור 3D. הכמת של כל זרוע של הגונאד נחשבת לדוגמה אחת, או אחת n.
תמונות בזמן מעידה נלקחים לכמת מהירות זרע ותדר היפוך. יש לעקוב רק אחר זרע באזור 2 (איור 4A) מכיוון שזרע באזורים 1 ו-3 (סרט 1) נוטים לנוע בתבנית מעגלית גם בתוך חיות מסוג פראי. תמונות Time-laspe שצולמו במרווחים של 15-30 s משמשות בדרך כלל למעקב אחר זרע. רק זרע שניתן לעקוב אחריהם במסגרות עוקבות עבור יותר מ-2.5-3 דקות מכמת. באיור 4B-M, הזרע המסומן בנקודות האדומות והכחולות מספק קריטריון זה, ואילו הזרע המסומן בנקודה הירוקה אינו מסומן. לכן, הערכים המוגדרים באיור 4N מתים על הזרע המסומן בנקודות האדומות והכחולות (איור 4n), בעוד שאלה עבור הזרע המסומן בנקודה הירוקה לא כונו.
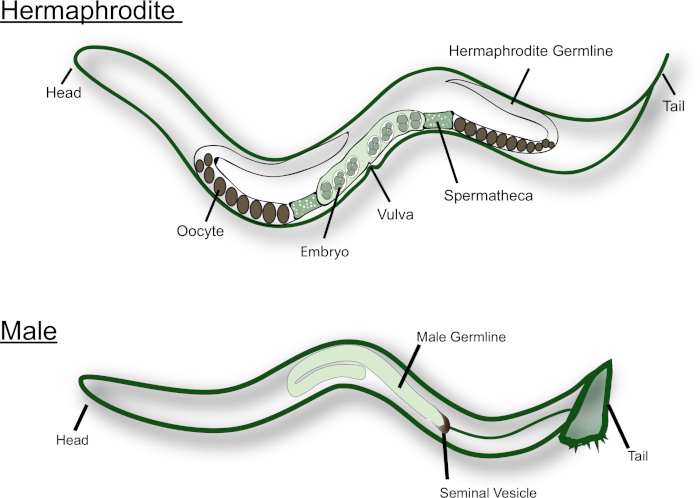
איור 1: הקריקטורה של הג המבוגר האנדרוגינוס והזכרי. מבני הרבייה העיקריים מסומנים בדמות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: דיאגרמה סכמטית של הכנה לדוגמה ורכישת נתונים. הזכרים המוכתמים בצבע המיאל, מוגברים בצורה מסונכרנת. תמונות מעידה בזמן של מזדווג נלקחים מיד לאחר ההזדווגות כדי ללכוד נתונים עבור מהירות זרע ותדר היפוך. תמונות סטילס של הזדווג נלקחו 1 h לאחר ההזדווגות כדי להעריך את התפלגות הזרע בתוך הרחם. עיין בטקסט לקבלת פרטים נוספים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: לכמת את התפלגות הזרע בתוך הרחם האנדרוגינוס. (א). סכמטי הרחם הדו . V = הפות, E = העובר, S = spermatheca, O = oocyte, Z1-Z3 = אזורים 1-3 המשמשים למדידת התפלגות זרע. (B-D). DIC + TRITC ממוזג (לוחות שמאל) ו TRITC בלבד (לוחות זכות) תמונות של הסוג פראי האנדרוגינוס 1 h לאחר ההזדווגות ערפל -2 (q71) זכרים מוכתם עם הצבע mito-. . זרע נראה אדום קווי המתאר הצהובים מצביעים. על מיקומו של הספרהימקה סרגל קנה מידה: 20 μm. Z1, Z2, Z3 קוונפיקציה ב-B מייצגים את אחוז הזרע בכל אזור ± סטיית התקן. תמונות ב- C ו -D מייצגות מתגים שגרמו למעט מדי (C) או לזרע רבים מדי (D) לכמת. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: כימות מהירות הזרע ותדר היפוך במהלך הגירה דרך הרחם. (א). DIC + tritc התמונה הממוזגת של רחם אנדרוגינוס המכיל זרע פלורסנט (אדום). V = הפות, צהוב = spermatheca, Z1-Z3 = שלושה אזורים של הרחם, הקופסה השחורה: אזור 2. (ב-M). זמן מעידה TRITC תמונות ערוץ הגדלת על אזור 2 (קופסה שחורה ב-A). . התמונות נרכשו במרווחים של 20 במהלך כל תמונה נמצאו שלושה זרע בודד (אדום, ירוק ונקודות כחולות). נקודות צבעוניות בלוח M מייצגת את הנתיב של כל זרע מ -B-L. סרגל קנה מידה = 20μm. (N). משוואות והגדרות עבור מהירות זרע, מהירות וקטורית ותדר היפוך. (O). מהירות, מהירות והיפוך תדר של זרע מסומנים בפאנלים B-L על ידי הנקודות אדום וכחול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
סרט 1: סרט של תנועת זרע והגירה. מסוג wildtype הזדווג בערפל -2 (q71) זכרים מוכתמים בצבעי mito-צבען. הסרט הוא המורכב של תמונות זמן שצולמו במרווחי זמן מגוונים. אנא לחץ כאן כדי לצפות בסרטון וידאו זה. (לחץ לחיצה ימנית להורדה).
Discussion
היכולת של זרע לנווט במערכת הרבייה הנשית מפותל ולמצוא oocytes הוא קריטי עבור רבייה מינית. מחקרים שנעשו לאחרונה באמצעות זרע של בעלי חיים בעלי הדשנים הפנימיים מצביעים על כך שהם מגיבים באופן אקטיבי לרמזים סביבתיים שונים, כולל אותות כימיים, זרימת נוזלים ומעברי צבע בטמפרטורה1,5,7, מיכל בן 10 , 12. עם זאת, תצפיות אלה הגיעו במידה רבה מניסויים בתחום החוץ והקטן ידוע על התנהגות זרע ותקשורת בתוך מערכת הרבייה. אחד המחסומים המרכזיים להשגת נתונים vivo על הגירה בזרע ותנועתיות הוא חוסר ניראות בתוך מרבית הרבייה הנשית. השיטה שתיארנו כאן באמצעות הג גוברת על המגבלה הזאת. ככל שתוצאות הנציג מציגות, האפידרמיס השקוף מאפשר הדמיה ישירה ומעקב אחר כל זרע ברזולוציית תא בודדת באורגניזם חי ושלא שלם.
לג יש שני מינים. הזכרים, עם גנוטיפ של קצין המבצעים, מייצרים רק זרע, ובשיטה זו, משמשים כתורמים לזרע. האנדרוגינוס, עם גנוטיפ XX, הם שונה נקבות. הגונדות שלהם עוברות לראשונה בתקופת הזחל הרביעי ועוברים לאוסטגנזה בבגרות25. מעשה זה משתמש בדיכוטים למבוגרים, שרקמות הרבייה שלו מספקות מודל למערכת הרבייה הנשית. ניצול שני המינים מאפשר לנו לזהות מסלולים גנטיים ומולקולריים בזכר ובנקבה, העשויים להסדיר הדרכה ותנועתיות של זרע. בשילוב עם כל המגוון של הטכניקות הגנטיות והמולקולריות הזמינות עבור C. אלגיה, שיטה זו יכולה להוביל לתובנות מסוימות להעברת זרע ולתנועתיות, כמו גם לתקשורת באמצעות זרע וכדומה.
מספר שלבים קריטיים בפרוטוקול זה מספקים שיקול דעת נוסף, בנוסף לפרטים המסופקים בסעיף הפרוטוקול.
תולעים
ערפל -2 (q71), אותו -5 (e1490), או אותו -8 (e1489) זכרים מוטנטים יכולים לשמש במקום N2 זכרים. מוטציות אלו מגדילות את תדירות הזכרים בתרבויות, אך אינן משפיעות על ההזדווגות הגברית או על תפקודי זרע13. נקבות, כגון ערפל-2 (q71) נקבות, ניתן להשתמש במקום של הדיכוטים. עם זאת, הנקבות חייבים להיות מועסקות מראש עם זכרים כדי לאפשר פיתוח מתאים oocyte. נוכחותם של עוברים מופרות מלפני ההזדווגות הזאת מבטיחה גם שהרחם ארוך מספיק כדי להעריך כראוי את התפלגות הזרע. אם מתבצע הערכה של מוטציות או של הרמטים ניסיוניים, כלול קבוצת בקרה (ות). לדוגמה, הדיכוטים של המוטציות צריך להיות מזווג עם N2 מסוג wildtype כפקד עבור משתנים אחרים בתוך השיטת. הרממיניים כי האכילו בחיידקים המכילים פלמידים עבור התערבות RNA בחני צריך גם להיות ניזון עם חיידקים המכילים שליטה וקטורית ריק. המרחק מן הפות, שבו זרע מופרית, כדי spermatheca, אתר הדישון, יכול להשתנות בהתאם למספר הביצים ברחם (כלומר, הרחם מתרחב עם הגדלת מספר ביצה). אם נעשים השוואות בין הגנוטיפים, לבחור הרמדוטים אשר מכילים מספר דומה של ביצים. אל תבחרו הרמטים המכילים עוברי בקיעה או הזחלים נעים. ניתן לבצע מסלול זמן כדי לזהות את הגיל האופטימלי שבו יש לקבל הרמטים.
לקטוף מהדיכוטים וזכרים
חשוב שהדו-מיניים שנאספו לצורך שיטת הפעולה הזאת אינם מלוחות מגודלים או מורעבים. מזון ופרומונים מרמזים לווסת את הביטוי של דאף -7, הומובול של TGFß. דאף-7 מסלול הוכח לווסת את הסינתזה של הסדרה F-ה, פרוסטגלנדינים כי לשחק תפקידים חשובים המנחה זרע כדי spermatheca20. בחירת הרמטים מפני הצלחות צפוף או מורעב עלול לגרום הדרכה זרע עני לא קשור ליעד של ריבית. לא נראה שצפיפות הצלחות. משפיעה על הזרע הגברי עם זאת, זכרים שהם צעירים מדי או זקנים מדי עלולים לגרום לירידה ביעילות ההזדווגות (כלומר, אחוז הדיכוטים על צלחת ההזדווגות שיש להם מספיק זרע באוטרן לכמת). 1-3 בוגרים בני היום זכרים הם אופטימליים עבור הצורך באותה שיטת23.
הרמטים
בידינו, שילוב הטטרמיאולה והטריקיין מבטיח כי תולעים הן מקיבוע, ונשארות בחיים במהלך ההזדווגות ורכישת התמונה. ניתן להשתמש גם בהרדמה אחרת, כגון נתרן עזידה. עם זאת, נתרן אזיד הוא רעיל מאוד התנאים צריכים להיות סטנדרטיים. טכניקות השתק באמצעות מיקרוחרוזי מיקרו, ותאי מיקרופלואידיקה אינם מומלצים כשהם מפריעים להזדווגות.
צביעת גברים
את mito-צבען בשימוש כתב יד זה, MitoTrackerCMXRos, נעשה שימוש נרחב לתיוג זרע, כמו גם המיטוסים אחרים, ב -C. אלגיה. הזרע המסומן עם מיאל זה הוא פונקציונלי לחלוטין, שמירה על יכולתה להיות מופעל, להעביר, להפרות oocytes, ולייצר צאצאים קיימא26,27. צבעים מיטוכונדריאלי אחרים, כגון הרדמון 6g ו DiOC6 השתמשו כדי להכתים את C. אלגיה המיטוסים28,29. עם זאת, התנאים עבור צבעים אלה צריך להיות מתוקננת עבור תיוג זרע בתוך הסדר הזה. בנוסף מנגנוני תיוג מירוכרוקל, כתמי DNA, כגון Syto17, עשוי לשמש גם כדי לתייג זרע עבור הגירה בחני30. בעוד טכניקות תיוג אלה הם קלים יחסית ומהירה לבצע, אסטרטגיות טרנסגניים יכול גם להיות מועסק כדי ליצור זרע לבטא את תגי פלורסנט באמצעות זרע היזמים ספציפיים31,32.
הזדווגות
נקודות ההזדווגות עבה מדי עלולה להקטין את יעילות ההזדווגות. הטיפול צריך להילקח כדי להעביר כמו חיידקים קטנים ככל האפשר כאשר העברת הזכרים מורדם הרמסיים על הנקודה ההזדווגות.
הכנת רפידות מעלה והצבת שובר הכיסוי
בועות אוויר ניתן לייצר ברפידות agarose. הם עשויים להצית אור במהלך רכישת תמונה או, כאשר גדול מספיק, לגרום תולעים ליפול, מה שהופך את זה בלתי אפשרי לרכוש את התמונה (ים). באופן דומה, בועות אוויר ניתן ליצור לאורך הדיכוטים כאשר שובר הכיסוי מוצב עליהם על כרית agarose. בועות אלה שבירה אור לגרום לירידה באיכות התמונה. התרגול יסייע להקטין את התרחשות בועות האוויר.
כימות
כאשר כימות התפלגות זרע, מטוסי z שונים דרך הרחם של תולעת עשויים להיות הבדלים קלים התפלגות זרע. אנו מוצאים כי לקיחת תמונה אחת ממוקדת על spermatheca נותן לנו תוצאות מסוימות, כי הם דומים לתוצאות המתקבלות על ידי בממוצע מספר z-סעיפים. אנו ממליצים למקד את הדימוי במרכז הספרמקה, אך ניתן לשנות מעט את מטוסי המוקד בהתאם לצורכי הניסויים. עם זאת, זה קריטי, עם זאת, כי כל התמונות נלקחים באותו אופן. יתרה מזאת, חשוב שרק זרע הנמצא בפוקוס ייספר. זוהי שיקול דעתה של הדלפק בקביעת הקריטריונים לזרע ממוקד. עם זאת, יש לחשוב שהקריטריונים מוחלים באופן שיטתי על כל תולעת המוכמת. עבור מעקב אחר זרע, תוכנות רבות מציעות יכולות מעקב אוטומטי. עם זאת, אנו מוצאים שמעקב ידני מבצע את אלגוריתם המעקב האוטומטי של התוכנה משתי סיבות עיקריות: 1) השפע של גרעינים בגודל דומה בתוך החלל הסגור מקשה על התוכנה להבחין בין זרע בודד וליצור ROIs מוגדר עבור כל זרע. 2) כאשר זרע נכנס ויוצא ממוקד, עוצמות התזוזה שלהם, מקשה על התוכנה לעקוב אחר הזרע על פני פרקי זמן ארוכים.
Disclosures
למחברים אין ניגודי אינטרסים.
Acknowledgements
אנו מודים בכנות למורה הרוחני המנוח שלנו, ד ר מיכאל מילר, על מנטוריו השראה ובלתי אנוכית ויצירת שיטה זו ככלי כדי להבין טוב יותר את הזרע ואת התקשורת oocyte. המעבר הפתאומי שלו היה אבידה אדירה למשפחתו, למעבדתו ולקהילה המדעית. מחקר זה היה נתמך על ידי NIH (R01GM085105 כדי אמא ו F30HD094446 ל MH). התוכן הינו באחריות המחברים בלבד ואינו מייצג בהכרח את ההשקפות הרשמיות של המכון הלאומי לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents and Material | |||
| 60 mm x 15 mm Petri dish | Fisher | FB0875713A | |
| Agar | Fisher | BP1423-500 | |
| Sodium Chloride | Fisher | S671-3 | |
| Peptone | Fisher | BP1420-500 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB broth, Miller | Fisher | 1426-2 | |
| Escherichia coli strain NA22 | Caenorhabditis Genetics Center (CGC) | NA22 | Either this or OP50 E. coli can be used for C. elegans maintenance and assay. Both may be purchased at the CGC |
| N2 | CGC | N2 | |
| fog-2(q71) | CGC | CB4108 | |
| Platinum wire 0.25 mm dia | Alfa Aesar | 10288 | |
| 5 3/4" Disposable Pasteur pipet | Fisher | 13-678-20A | |
| Watch glass | Fisher | 02-612A | |
| 5 mm Dia. Glass rod | Fisher | 50-121-5269 | |
| MitoTracker CMXRos (Mito-dye) | Fisher | M7512 | Shield from light, store at -20 °C |
| Monopostassium phosphate | Fisher | P285-500 | |
| Disodium phosphate | Fisher | S374-1 | |
| Magnesium sulfate | Fisher | M63-500 | |
| Dimethyl sulfoxide | Fisher | BP231-1 | DMSO |
| Aluminum foil | Fisher | 01-213-102 | |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma | E10521-10G | Tricaine is the common name. Store in aliquotes at -20 °C. |
| Tetramisole hydrochloride | Sigma | L9756-5G | Store in aliquotes at -20 °C |
| Agarose | Fisher | BP1356-100 | |
| Coverslips | Fisher | 12-548-A | 18 x 18-1 |
| Frosted microscope slides | Fisher | 12-552-3 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 16 °C and 20 °C incubators | Fisher | 97-990E | Same model, set at different temperatures. |
| Upright Microscope with epi-fluorescence illuminator, camera, and 10x and 60x objectives | Nikon | ||
| Software with image acquisition and tracking capabilities | Nikon | NIS-elements AR | |
| Stereo-microscope | Nikon | SMZ800N | Any stereo-microscope that can be used to visualize C. elegans may be used with this protocol |
References
- Boryshpolets, S., Perez-Cerezales, S., Eisenbach, M. Behavioral mechanism of human sperm in thermotaxis: a role for hyperactivation. Human Reproduction. 30 (4), 884-892 (2015).
- Edmonds, J. W., McKinney, S. L., Prasain, J. K., Miller, M. A. The gap junctional protein INX-14 functions in oocyte precursors to promote C. elegans sperm guidance. Developmental Biology. 359 (1), 47-58 (2011).
- Edmonds, J. W., et al. Insulin/FOXO signaling regulates ovarian prostaglandins critical for reproduction. Developmental Cell. 19 (6), 858-871 (2010).
- Espinal-Enriquez, J., Priego-Espinosa, D. A., Darszon, A., Beltran, C., Martinez-Mekler, G. Network model predicts that CatSper is the main Ca(2+) channel in the regulation of sea urchin sperm motility. Scientific Reports. 7 (1), 4236 (2017).
- Hunter, R. H., Nichol, R. A preovulatory temperature gradient between the isthmus and ampulla of pig oviducts during the phase of sperm storage. Journal of Reproduction and Fertility. 77 (2), 599-606 (1986).
- Hussain, Y. H., Guasto, J. S., Zimmer, R. K., Stocker, R., Riffell, J. A. Sperm chemotaxis promotes individual fertilization success in sea urchins. Journal of Experimental Biology. 219 (Pt 10), 1458-1466 (2016).
- Kantsler, V., Dunkel, J., Blayney, M., Goldstein, R. E. Rheotaxis facilitates upstream navigation of mammalian sperm cells. Elife. 3, e02403 (2014).
- Kubagawa, H. M., et al. Oocyte signals derived from polyunsaturated fatty acids control sperm recruitment in vivo. Nature Cell Biology. 8 (10), 1143-1148 (2006).
- Miki, K., Clapham, D. E. Rheotaxis guides mammalian sperm. Current Biology. 23 (6), 443-452 (2013).
- Ting, J. J., Tsai, C. N., Schalkowski, R., Cutter, A. D. Genetic Contributions to Ectopic Sperm Cell Migration in Caenorhabditis Nematodes. G3. 8 (12), 3891-3902 (2018).
- Yanagimachi, R., et al. Chemical and physical guidance of fish spermatozoa into the egg through the micropyledagger, double dagger. Biology of Reproduction. 96 (4), 780-799 (2017).
- Zhang, Y., et al. Generation of Gradients on a Microfluidic Device: Toward a High-Throughput Investigation of Spermatozoa Chemotaxis. PloS One. 10 (11), e0142555 (2015).
- Hoang, H. D., Miller, M. A. Chemosensory and hyperoxia circuits in C. elegans males influence sperm navigational capacity. PLoS Biology. 15 (6), e2002047 (2017).
- Hansen, J. M., Chavez, D. R., Stanfield, G. M. COMP-1 promotes competitive advantage of nematode sperm. Elife. 4, (2015).
- L'Hernault, S. W. Spermatogenesis. WormBook: The Online Review of C. Elegans Biology. , 1-14 (2006).
- Miller, M. A., et al. A sperm cytoskeletal protein that signals oocyte meiotic maturation and ovulation. Science. 291 (5511), 2144-2147 (2001).
- Greenstein, D. Control of oocyte meiotic maturation and fertilization. WormBook: The Online Review of C. Elegans Biology. , 1-12 (2005).
- O'Hagan, R., Wang, J., Barr, M. M. Mating behavior, male sensory cilia, and polycystins in Caenorhabditis elegans. Seminars in Cell & Developmental Biology. 33, 25-33 (2014).
- Hoang, H. D., Prasain, J. K., Dorand, D., Miller, M. A. A heterogeneous mixture of F-series prostaglandins promotes sperm guidance in the Caenorhabditis elegans reproductive tract. PLoS Genetics. 9 (1), e1003271 (2013).
- McKnight, K., et al. Neurosensory perception of environmental cues modulates sperm motility critical for fertilization. Science. 344 (6185), 754-757 (2014).
- Chaudhuri, J., Parihar, M., Pires-daSilva, A. An introduction to worm lab: from culturing worms to mutagenesis. Journal of Visualized Experiments. (47), (2011).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Chatterjee, I., et al. Dramatic fertility decline in aging C. elegans males is associated with mating execution deficits rather than diminished sperm quality. Experimental Gerontology. 48 (11), 1156-1166 (2013).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. , 80-90 (2017).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent Window into Biology: A Primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Sato, M., Sato, K. Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science. 334 (6059), 1141-1144 (2011).
- Wang, Y., et al. Kinetics and specificity of paternal mitochondrial elimination in Caenorhabditis elegans. Nature Communications. 7, 12569 (2016).
- Wolke, U., Jezuit, E. A., Priess, J. R. Actin-dependent cytoplasmic streaming in C. elegans oogenesis. Development. 134 (12), 2227-2236 (2007).
- Mottram, L. F., Forbes, S., Ackley, B. D., Peterson, B. R. Hydrophobic analogues of rhodamine B and rhodamine 101: potent fluorescent probes of mitochondria in living C. elegans. Beilstein Journal of Organic Chemistry. 8, 2156-2165 (2012).
- Singson, A., Hill, K. L., L'Hernault, S. W. Sperm competition in the absence of fertilization in Caenorhabditis elegans. Genetics. 152 (1), 201-208 (1999).
- Wu, J. C., et al. Sperm development and motility are regulated by PP1 phosphatases in Caenorhabditis elegans. Genetics. 190 (1), 143-157 (2012).
- Seidel, H. S., et al. A novel sperm-delivered toxin causes late-stage embryo lethality and transmission ratio distortion in C. elegans. PLoS Biology. 9 (7), e1001115 (2011).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved