Method Article
Ölçme sperm rehberlik ve motilite içinde Caenorhabditis elegans hermafrodit üreme yolu
Bu Makalede
Özet
Sperm, bir ooksit döllemek için ovidukt üzerinden başarılı bir şekilde gezinmelidir. Burada, C. elegans hermafrodit uterusun içinde sperm göçünü ölçmek için bir tahlil açıklanmaktadır. Bu tahlil çiftleşme sonra rahim içinde sperm dağılımı nicel veri sağlayabilir, yanı sıra hız, yönlü hız, ve ters frekans.
Özet
Başarılı gübreleme cinsel üreme için temel, henüz küçük kadın üreme sistemi içinde oosit sperm kılavuzluk mekanizmaları hakkında bilinmektedir. In vitro çalışmalar iken iç gübreleme hayvanların sperm kendi çevresinden çeşitli ipuçlarına yanıt verebilir, kadın üreme sistemi içinde davranışlarını görselleştirmek için yetersizlik sperm göç anlamak için bir meydan okuma oluşturur ve hareketliliğinin doğal ortamında. Burada, bu sınırlamanın üstesinden gelen ve şeffaf epidermis avantajlarından yararlanan C. elegans kullanarak bir yöntem açıklanmaktadır. C. elegans erkek bir mitokondriyal boya ile lekelenmiş yetişkin hermaphrodites ile montaj ilişkili, hangi değiştirilmiş kadın olarak hareket, ve kasılma floresan etiketli sperm hermafrodit uterusa. Etiketlenmiş spermlerin göç ve motilitesi daha sonra canlı bir hermafrodit içinde epi-floresans mikroskop kullanılarak doğrudan izlenebilir. Wild-tipi hayvanların, yaklaşık 90% etiketli sperm rahim aracılığıyla tarama ve fertilizasyon siteye ulaşmak, ya da spermatheca. Uterusun görüntüleri, rahim içinde sperm dağılımı ve spermatheca ulaştı sperm yüzdesi değerlendirmek için çiftleşme sonra 1 h alınabilir. Alternatif olarak, sperm hızını, yön hızını ve tersine çevirme sıklığını değerlendirmek için çiftleşme işleminden hemen sonra zaman atlamalı görüntüler alınabilir. Bu yöntem, kadın üreme sistemi içinde sperm rehberlik ve motilitesi düzenleyen önemli olan yeni genetik ve moleküler mekanizmaları tanımlamak için C. elegans için mevcut diğer genetik ve moleküler araçları ile kombine edilebilir.
Giriş
Spermatozoa (sperm olarak adlandırılır), ooksit doğru kadın üreme sistemi üzerinden gezinmek moleküler mekanizmalar iyi anlaşılmadı, henüz cinsel üreme için temel vardır. Sperm motilitesi son derece dinamiktir ve sperm hızını ve yönlü motilitesi1,2,3,4,5,6 ' ı değiştiren sağlam iletişim sinyallerine bağlıdır , 7 , 8 , 9 , 10 ' dan fazla , 11 ' i , 12. C. elegans , hermafrodit 'in şeffaf epidermis tek hücreli çözünürlükte canlı sperm takibine izin verdiğinden, in vivo sperm hareketinin incelenmesi için güçlü bir model haline gelmiştir2,3, 8,10. Bu makalenin amacı, C. elegans hermafrodit rahim içinde sperm hareketinin değerlendirilmesi için yöntemler sağlamaktır.
Sperm ve ooksit dış ortamda (yani, acquatic ortamlar) karşılamak hayvan türlerinde, sperm oositler tarafından salgılanan kemotaktik sinyalleri yanıt. Bu sinyaller, sperm hareketinin yönünü yönlendirmekte ve onları sinyal kaynağına4,6,11' e yaklaştırır. Ancak, çok daha az iç döllemek türlerin sperm hareketi hakkında bilinmektedir. Büyük bir meydan okuma kadın üreme sisteminin mimarisidir, çoğu türün mikroskobu erişilemiyor. İnsan, fare ve domuzların In vitro çalışmalarında, örneğin, spermlerin subnüfus Chemo, sıvı akışı ve termal degradeler1,5,7,9, tepki verebilir kanıt sağlamak 12' ye kadar. Bu sistemler ile, bu fonksiyonları düzenleyen anahtar mekanizmaları keşfetmek için stratejiler üzerinde ciddi sınırlamalar yer vivo ve sperm hareketini görselleştirmek ve izlemek için yetersizlik.
Bu sınırlamaların üstesinden gelmek için, nematod C. elegans 'ı kullanarak, döllenme sonrası spermleri doğrudan görselleştirecek, tek başına sperm göç parametrelerini ölçmek ve bir sperm nüfusunun hedeflenme yeteneğini ölçmek için yöntemler geliştirdik. fertilizasyon sitesi. Bu yöntemler, C. elegans moleküler ve genetik araç seti ile birlikte, kimyasal sinyalizasyon molekülleri ve sperm motilite davranışlarını düzenleyen moleküler makine keşfi kolaylaştırır. Örneğin, hermafrodit veya erkeklerde genetik ekranlar, vivo13' te verimli sperm hareketi için gerekli olan genleri tanımlamak için yapılabilir. Moleküller, sperm aktivasyonu, göç hızı ve yönlü motilite3üzerinde etkileri test etmek için hermafrodit gonad içine enjekte edilebilir. Ayrıca, açıklanan yöntemler, sahte sperm göçünü ektopik vücut konumlarına kadar izlemek ve sperm rekabetini değerlendirmek için kullanılabilir10,14.
C. elegans doğadaki hermafrodit ve erkek olarak var (bkz. Şekil 1). Hermafrodit gonad birbirlerine ayna görüntüleri iki U şeklinde kollar vardır. L4 larva aşamasında, en proksimal germ hücreleri (yani, spermatheca yakınlarındaki hücreler) spermatogenezin geçmesi. Her birincil spermatocyte mayoz girer ve dört haploid spermatids üretir. Bu spermatids ilk olgun oosit ile birlikte spermatheca içine itti ve spermiogenesis geçmesi15. Yetişkin Hünsa spermatogenez oogenesis için geçiş. Oositler gonad boyunca bir montaj hattı moda olgun, gonad proksimal ucunda en olgun oosit ile, spermatheca yanında. MSP sinyalleri spermlerden Mayoz bölünmenin olgunlaşma ve yumurtlama tetiklemek için gerekli16,17. Erkek C. elegans, diğer taraftan, sadece sperm üreten bir J şeklinde gonad var. Spermatids seminal vezikül saklanır. Hermafrodit veya kadın ile çiftleşme üzerine, Erkek vulva içine kuyruk yakın spicules ekler. Spermatids Boşalma sırasında aktive edilir, onlar seminal sıvı ile temas geldiğinde18. C. elegans sperm onlar flagellated değil gibi yüzmeyin. Bunun yerine, üreme sistemi aracılığıyla tarama, lokomotif için fazlası kullanarak. İyi, boyutu daha büyük olan erkek sperm, hermafrodit sperm14üzerinde rekabetçi bir avantaj var kurulmuştur.
Bu yöntemle, Erkek C. elegans sperm donör olarak hareket ve yetişkin hermaprhodites montaj ilişkili vardır. Erişkin erkek bir floresan mitokondriyal boya ile boyalı etiketli sperm ile lekelenmiş. Bir kez hermafrodit vulva üzerinden yatırılan, sperm spermatheca veya fertilizasyon sitesine doğru uterusa embriyolar etrafında tarama gerekir. C. elegans modelinin şeffaf epidermis, kadın üreme sistemi üzerinden geçerken her bir spermin doğrudan görselleştirilmesini sağlar. Son yıllarda laboratuvarımız, vulva 'dan spermatheca19,20' ye gelen spermlere rehberlik ederek F serisi prostaglandinler sınıfının önemini göstermek için bu yöntemi başarıyla kullandı. Hermafrodit tarafından sentezini yöneten moleküler mechansims ve sperm tarafından yanıt hala soruşturma altında. Ancak, sperm motilitesi ve göç değerlendirmek için bu yöntem büyük ölçüde hayvan iç gübreleme sperm ve oosit iletişimi kontrol anahtar oyuncuların tanımlaması kolaylaştırır. Aşağıdaki protokol adım bu tahlil gerçekleştirmek için nasıl adım açıklar.
Protokol
Not: bu protokoldeki tüm adımlar oda sıcaklığında (~ 20-22 °C) veya 16 °C veya 20 °C ' ye kadar olan sabit sıcaklık inkükulörler ile gerçekleştirilir. Erkek ve hermafrodit C. elegans bir gıda kaynağı olarak standart kültür koşulları ve NA22 veya OP50 E. coli kullanılarak yetiştirilen21,22. Aşağıdaki yordamda vahşi tip N2 Hünsa ve Fog-2 (Q71) erkek kullanılmaktadır.
1. gün 1: çiftleşme için L4 aşama Hermaphrodites toplama
- Tutarlı sonuçlar elde etmek için, tüm Hünsa aktif yetişkinler yeniden üreten olarak senkronize edilmelidir. 6 cm 'lik seribaşı nematod büyüme orta (NGM) plakasına L4 aşama Hünsa 20-30 pick. 28-30 h için 20 °C ' de hermaphroditler Inküye.
Not: Çiftleşme için sadece 12-15 Hünsa kullanılacaktır. Kalan Hünsa fazlasıdır.
2. gün 1: floresan mitokondriyal boya ile erkeklerin boyama (Mito-boya)
- Bir unseeded NGM plaka merkezinde E. coli (gıda nokta) bir nokta yerleştirerek bir erkek boyama plakası olun. Gıda nokta yapmak için, bir cam karıştırma çubuk sonunda bir dikişli plaka bakteri çim e. coli kazımak için kullanın ve unseeded plaka üzerinde yatırın. Nokta ~ 5-7 mm çapı olmalıdır.
- 2 μL 1 mM Mito-boya (bkz. malzeme tablosu) DMSO ve 10 μL M9 tampon (3 g KH2Po4, 6 g na2HPO4, 5 g NaCl, 1 ml 1 M MgSO4, H2O 1 L. MgSO4 ' ü sonra Ekle autoclaving). Tüm Mito-boya çözeltisi, Erkek boyama plakasının gıda noktası üzerine pipet. Plaka karanlıkta (~ 30 dk) kuru izin verin.
Not: Mito-boya hafif hassastır. Tüm solüsyonu, plakaları ve solucanları ışıktan gelen Mito-boya içeren kalkanı. 1 mM stokları-20 °C ' de saklayın. - Pick ~ 100 1-3 gün eski yetişkin erkek23 Mito-boya lekeli gıda erkek boyama plakası üzerinde nokta. Plakayı alüminyum folyo içinde sarın ve bir gecede 16 °C ' de inküye yapın. Çiftleşme için, 12-15 hermaphrodites başına ~ 50-60 erkek kullanın. Eğer fazla ~ 100 erkek ihtiyaç vardır, erkeklerin aşırı kalabalığı önlemek için daha fazla boyama plakaları yapmak.
Not: Erkekler de bir saat camında 3 saat için M9 tampon içinde 10 μM Mito-boya çözeltisi içinde inküt tarafından lekelenmiş olabilir. Buharlaşma ve ışık pozlama önlemek için kapalı solucanlar tutun. 3 saat sonra, erkekleri 10 cm 'lik bir NGM plakasına aktarmak için bir Pasteur pipet kullanın. Mito-boya çözeltisi mümkün olduğunca az transfer. Plakayı alüminyum folyo içinde sarın ve 16 °C ' de gecede inküye yapın.
3. gün 2: çiftleşme
- 1. günden itibaren lekelenmiş erkekleri yeni bir NGM plakasına seçin. Plakayı çiftleşene kadar karanlıkta bırakın. Bu adım, erkeklerin etrafında aşırı Mito-boya lekeli bakterilerin kaldırılmasını sağlar. Aşırı Mito-boya lekeli bakterilerin çiftleşme plakasının üzerine olması hermafrodit dokusunu lekeleyebilir.
- Bir unseeded NGM plaka üzerinde 2 μL kalın bir E. coli karışımı bırakarak bir çiftleşme plaka olun. Kalın bakteri çiftleşme nokta yapmak için kuru edelim. Erkek ve hermafroditler çiftleşme için bu noktaya transfer edilecektir. Kalın e. coliyapmak için, gece e. coli 3 ml aşağı spin ve M9 1 ml bakteri Pelet pelletini. Bu karışım 4 °C ' de depolanabilir ve 6 aya kadar yeniden kullanılabilir.
Not: E. coli çözeltisinin kalınlığı ayarlanabilir. Çözüm çok ince ise, erkekler, montaj ilişkisi için toplamak yerine montaj ilişkisi noktasından uzak gezinebilir. Çok kalın bir E. coli çözümü yapılan çiftleşme noktaları çiftleşme verimliliğini azaltabilir. - Adım 3,2 ' den çiftleşme plakası kurutulurken, birlikte 300 μL 1% (w/v) Tricaine (Tri), 300 μL% 0,1 (w/v) Tetramisol (Tet) ve 900 μL M9 ile karıştırın.
Not: Mağaza 1% (w/v) Tricaine ve 0,1% (w/v) Tetramisole-20 °C ' de aliquotes olarak. Tekrarlanan dondurmayı çözme kaçının. - Tet/Tri çözeltisi 600 μL değerini bir saat camına aktarın.
- Transfer 12-15 Hünsa saat cam Tet/Tri çözüm için gün 1 aldı. Hermaphrodites hareketsiz için 30 dakika boyunca inkübe. Tet/Tri çözeltisi buhardan önlemek için saat camı kaplı tutun.
Not: Hermafroditlerin en az 30 dakika anestezize edilmesi önemlidir. daha az zaman görüntü edinme sırasında hareketli bir solucan neden olabilir, hangi görüntüleme ile tarafından olabilir. - Hünsa inküferasyon iken, seçin 50-60 lekeli erkek adım 3,1 çiftleşme nokta üzerine (adım 3,2). Adım 3,8 kadar koyu plaka saklayın.
- Tet/Tri çözeltisi içinde 30 dakika kuluçka sonra, bir unseeded NGM plaka üzerine saat cam immobilize Hünsa aktarmak için bir cam Pasteur pipet kullanın. Mümkün olduğunca fazla sıvı çıkarın ve aşırı sıvı kuru izin verin.
Not: Hünsa aşırı kuru izin vermeyin. Görünür sıvı buharlanmış en kısa sürede, bir sonraki adıma başlayın. - Anestezileştirilmiş hermafroditleri, unseeded NGM plakasını, lekeli erkeklerle çiftleşme noktası üzerine aktarın. Erkeklerin hermaphrodites ile Mate izin vermek için 30 dakika karanlıkta inkübe.
- 30 dakika boyunca çiftleşme sonra, zaman atlamalı görüntüleme için hemen Hünsa monte veya yeni bir, seribaşı NGM plaka üzerine Hünsa aktarmak 1 görüntüleme önce h.
Not: Hermafrodit uterusun zaman atlamalı videoları, sperm hızını ve tersine çevirme sıklığını ölçmek için kullanılır. Hala rahim görüntüleri 1 saat çiftleşme sonra alınan sperm dağılımı veya Spem rehberlik ölçmek için kullanılır.
4. gün 2: görselleştirme için Worms montaj
-
H2O 'da% 2 agaroz ile montaj yastığı oluşturma
Not: 2% agaroz, toplu olarak yapılabilir, cam test borularının içine alaşağı edilebilir ve 4 °c ' de saklanır. Gerektiğinde, her bir kısım her kullanmadan önce mikro dalgada olabilir ve bir ısı bloğu içinde saklanmasını önlemek için depolanabilir.- Montaj yastığı yapmak için, uzun kenarlar dokunmadan üç cam mikroskop slaytlar yan yana hizalayın. Her iki dış slaytta birbirlerinin üstüne maskeleme bandı iki adet yerleştirin. Bant ile bu dış cam slaytlar, böylece elde edilen agaroz yastık kalınlığı "iki bant derin" olacak destek olarak hareket edecektir.
- Yere ~ 75 μL eritilmiş 2% agaroz orta slayt üzerinde (Bu teyp olmadan slayt). Hemen agarose üzerine yeni bir cam mikroskop slayt yerleştirin. Bu üst cam slayt diğer slaytlara dik olmalıdır, her son iki destek slaytlarının teyp üzerinde dinlenme ile.
- Agaroz sertleşmesine izin verin (~ 30 s). Dikkatli bir şekilde üst cam slaytı agaroz yastığı üzerinden kaydırarak çıkarın.
- Tet/Tri çözeltisi 10-15 μL 'ini% 2 agaroz yastık üzerine yerleştirin. Montaj ilişkili Hünsa Pad üzerine aktarın. Mümkün olduğunca az bakteri olarak aktarmak için dikkat alın.
- Agaroz yastık üzerinde solucanlar üzerinde bir kapak kayma yerleştirin.
5. gün 2: görüntü edinme kurulumu
Not: Epi-floresan, 10X ve 60x hedefleri ile donatılmış herhangi bir dik miscroscope ve bir dijital kamera sperm dağılımı için görüntüler elde etmek için kullanılabilir. Sperm hızını, yön hızını ve tersine çevirme sıklığını değerlendirmek için zaman aşımına uğramış görüntüler edinme yeteneğine sahip yazılım gereklidir.
-
Resim edinme 1 saat çiftleşme sonra
- Slaytı mikroskop aşamasına takın. Kırmızı floresan emisyon filtresi (TRISC filtresi) ile 10X objektif kullanarak agaroz yastık üzerinde solucanlar taramak için göz parçaları göz atın. Bir solucan bulunduktan sonra, solucanın montaj olup olmadığını görmek için floresan ışığını kısaca açın. Eğer sperm uterusun içinde görünüyorsa, 60x hedefine geçin.
Not: Lamel magazini üzerinde 60x amaç tarafından oluşturulan basınç bazı kırılgan solucanlara zarar verebilir, bağırsaklara neden veya hayvandan ekstrüze gonad. 10X amacı kullanarak başarılı çiftleşme için tarama solucanların eklenen basınca maruz en aza indirebilirsiniz. Montaj ilişkili solucanları uzun süre floresan ışık olarak açığa çıkarmayın. - Diferansiyel girişim kontrast mikroskopisi (DıC) kullanarak, solucanı hem vulva hem de bir spermatheca görünümündeki şekilde konumlandırın. Spermatheca merkezine odaklanarak görüntü odaklanmak. Hem DıC hem de TRıSC kanalları için pozlama kontrol edin. DıC 'de, iç solucan yapıları açıkça görünür olmalıdır. TRITC 'de, bireysel sperm farklı puncta olarak görünür olmalıdır.
Not: Her görüntü spermatheca birine vulva rahim yakalamak gerekir. Rahim bir görüntüye sığamayacak kadar uzunsa, iki ayrı görüntü alınabilir. Tüm görüntülerin aynı pozlama seviyesinde alınması gerekli değildir. Ancak, bireysel sperm floresans görüntülerde ayırt edilebilir ve nicelik olabilir önemlidir. - Her rahim için DıC ve floresan görüntüleri edinin.
- Tüm montaj ilişkili Hünsa görüntülenmiş kadar 5.1.1-5.1.3 adımları yineleyin.
- Slaytı mikroskop aşamasına takın. Kırmızı floresan emisyon filtresi (TRISC filtresi) ile 10X objektif kullanarak agaroz yastık üzerinde solucanlar taramak için göz parçaları göz atın. Bir solucan bulunduktan sonra, solucanın montaj olup olmadığını görmek için floresan ışığını kısaca açın. Eğer sperm uterusun içinde görünüyorsa, 60x hedefine geçin.
-
Zaman atlamalı videoları yakalama
- Agaroz yastığı tarayın ve adım 5.1.1 ve 5.1.2 'de açıklandığı gibi uterusun içinde etiketli sperm içeren hermaphroditleri bulun
- Yazılımı DıC ve TRıSC kanallarında zaman atlamalı görüntüler elde etmek için yapılandırın. Genellikle, zaman atlamalı görüntüler, rahim başına 10-20 dakika için 15-30 s aralıklarla alınır.
6. miktar ölçümü
-
Alınan rahim görüntüleri üzerinde sperm dağılımı ölçerek 1 saat çiftleşme sonra
- Bir ucunda vulva ve diğer üzerinde spermatheca ile başlayarak, üçte içine rahim bölmek. Bunlar üç bölgeyi temsil edecektir. Bölge 1 (Z1) vulva içerir ve bölge 3 (Z3) spermatheca içerir.
- Elle uterusun her üçte birinde sperm sayısını saymak ve tüm rahim içinde toplam sperm yüzdesi olarak her bölgede numarasını rapor. Bir örnek aşağıda verilmiştir.
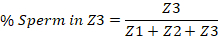
Not: Bazen, TRITC kanal görüntünün sinyal yoğunluğu görüntü yakalanan her sperm görünür ve nicelik olabilir böylece ayarlanması gerekir.
-
Zaman aşımı görüntülerde sperm Takibi
Not: Bu yazıda, analiz için NIS-Elements yazılımını kullandık. Aşağıdaki bölümlerde, bu yazılımı (adım 6.2.1) yanı sıra açık kaynak yazılım ımagej/Fiji (adım 6.2.2) kullanarak elle sperm takibi için talimatlar vermek.-
NIS-Elements ile sperm Takibi
- İzlenecek zaman aşımı serisi ile. ND2 dosyasını açın. İzlemeye başlamak için, yazılımı sağ tıklatarak ve analiz kontrolleri 'ni seçerek Izleme panelini açın | Takipetmek.
- İzleme panelinde yenı YG 'Yi tanımla'yı seçin. Takip edilecek her spermin üzerine tıklayarak her bir ilgi bölgesini (YG) tanımlayın. Seçilen spermin üzerinde renkli bir işaret görünecektir. Tüm Roıs seçildiğinde son 'u tıklatın.
- ROIs tespit edildikten sonra, zaman atlamalı serisindeki bir sonraki kareye taşıyın. YG işaretçisini görüntüdeki spermin yeni konumuna sürükleyin. Sperm artık izlenemez kadar bunu yapmaya devam edin. Noktalı çizgiler, ROı işaretçisinin zaman atlamalı görüntünün tüm çerçevelerine yerleştirilen her bir konumu bağlayan görünür.
Not: Zone 2 ' de sadece sperm, bölgeler 1 ve 3 ' te sperm olarak izlenmelidir, vahşi tip hayvanlarda bile dairesel bir desende hareket etmeye eğilimlidir. - Izleme panelinde Dışa Aktar 'ı tıklatarak, ölçülebilir tüm verileri (örn. yol uzunluğu, zaman, XY konumu, vb.) izlenen spermden bir Excel belgesine dışa aktarın.
-
Fiji ile sperm izleme
- Zaman aşımı serisi TRITC kanal görüntülerini. tif dosyalarına dönüştürün. Bir dizinin tüm dosyaları bir klasöre kaydedin.
- BioFormats alma işlevini kullanarak görüntüleri Fiji 'ye aktarın. Bir zaman aşımı serisinden görüntüleri tek bir hyperstack olarak içe aktarın.
- Açık TrackMate Fiji24 üzerinden eklentileri | İzleme | TrackMate ile manuel izleme. Bir diaglogue kutusu açılacaktır.
- Fiji araç çubuğundaki TrackMate aracını seçin. Takip edilecektir sperm çift tıklayın. Kesikli çizgilerle yeşil bir daire görünecektir. Bu daire, dairenin içine tıklayarak ve istediğiniz konuma sürükleyerek yeniden konumlandırılabilir. Bu dairenin boyutu aynı anda alt tuşuna basarak ve fareyi kaydırma tarafından değiştirilebilir.
- Takipçinin boyutu ve konumu ayarlandığında, daireyi tekrar tıklayın. Kesikli yeşil çizgiler düz yeşil bir çizgi haline dönecek. Aynı anda SHIFT ve L tuşlarını vurmak izleme modunu açmak için. Bu, Fiji araç çubuğunda belirtilecektir.
- Zaman atlamalı serisindeki sonraki kareye taşıyın. Yeni çerçevede izlenen spermin yeni konumunu ayarlamak için fareyi yeni noktanın üzerine getirin ve A tuşuna basın. İzleyici artık yeni konumda görünecektir ve izleyicisinin önceki çerçevelere yerleştirildiği konumları bağlayan bir çizgi görünecektir.
- İzler tamamlandıktan sonra, gerekli verileri oluşturmak için TrackMate iletişim kutusunda analiz et 'i tıklatın.
- Hızı hesaplamak için, geçen süre sperm toplam yol uzunluğunu bölmek.
- Vektörel hızını hesaplamak için, spermatheca doğru işaret vulva başlayarak uterusa bir çizgi çizin. Spermin bu hat boyunca başından itibaren izin sonuna kadar taşındığını ölçün. Bu mesafeyi geçen zamana bölün. Negatif değerler sperm spermatheca uzağa göç olduğunu gösterir.
- Tersine çevirme sıklığını kaydetmek için, sperm izlemin ardışık üç zaman atlamalı kare sırasında 90 ° ' den daha az bir açı oluşturduğu sayısı saymak.
-
NIS-Elements ile sperm Takibi
Sonuçlar
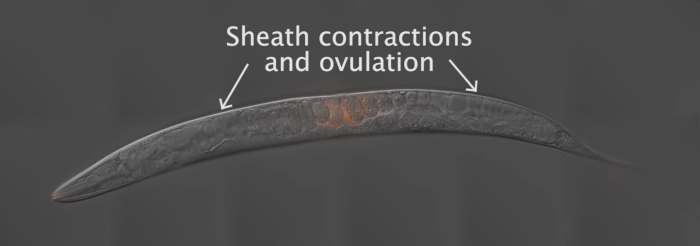
Bu yazıda gösterilen sonuçları oluşturmak için Fog-2 (Q71) erkek Mito-boya ile lekelenmiş ve vahşi tip, N2 hermaphrodites için montaj ilişkili. Şekil 2 , solucan hazırlama, montaj ilişkisi ve analiz gibi yöntem için genel bir düzen sağlar. Film 1 gösterileri olarak, Yetişkin hermafrodit üreme yolu birbirlerine ayna görüntüleri iki kolu vardır. Çiftleşme üzerine, etiketli sperm vulva aracılığıyla hermafrodit uterusa yatırılır. Sperm, rahim içinde gelişmekte olan embriyolar etrafında spermatheca doğru hareket, nerede onlar döllenme kadar saklanır. Yetişkin hermafrodit içindeki germ hücreleri oositlere gelişirken, proksimal, en olgun ooksit, kılıf hücresi contrations yoluyla spermatheca içine itilir. Döllenme, oosit spermatheca ise oluşur.
Kadın üreme sistemi yoluyla sperm dağılımı ve göç ölçmek için, hermafrodit rahim üç bölgeye ayrılır (Film 1, Şekil 3A). Bölge 1 rahim ilk üçte yayılan, vulva başlayarak. Bölge 2 uterusun Orta üçte birini kapsar ve bölge 3 uterusun son üçte birini kapsar ve spermatheca içerir. Vahşi tip, N2 Hünsa ve Fog-2 (Q71) erkek kullanarak uygun sperm rehberlik spermatheca ulaşan etiketli sperm yaklaşık% 90, veya bölge 3 (Şekil 3B) neden olmalıdır. Çok az neden olan matings (Şekil 3c, az 10-15 sperm) veya çok fazla (şekil 3D, uterusa sperm dolu) uterusa sperm sayılmamalıdır. 10-15 sperm daha az sonuç matings, 3-4 haydut sperm ağır veri eğriltme olabilir. Benzer şekilde, rahim tamamen sperm ile doldurulduğunda, sperm uygun şekilde göç edemez. Sperm kötü sperm rehberlik fenotipi görüntüleyen bazı mutantların uteri boyunca dağınık görünebilir. Ancak, bu durumda, sperm, şekil 3D'de görüldüğü gibi, uterusun her bir kırışıklık doldurmamalıdır. Gonad her kolunun ölçümü bir örnek olarak kabul edilir, ya da bir n.
Zaman atlamalı görüntüler sperm hızı ve ters frekans ölçmek için alınır. Zone 2 ' de sadece sperm izlenmelidir (Şekil 4A) çünkü bölgeler 1 ve 3 ' te sperm (Film 1) vahşi tip hayvanların içinde bile dairesel bir desenle hareket etmeye eğilimlidir. Zaman-laspe görüntüleri 15-30 s aralıklarla alınan genellikle sperm izlemek için kullanılır. Sadece 2.5-3 dk daha fazla ardışık çerçeveler takip edilebilir sperm nicelik vardır. Şekil 4b-M ' de, kırmızı ve mavi noktalardan işaretlenmiş sperm bu kriteri tatmin ederken, yeşil nokta ile işaretlenmiş sperm değildir. Bu nedenle, Şekil 4N 'de tanımlanan değerler, kırmızı ve mavi noktalardan (Şekil 4o) işaretlenmiş sperm için nicelik olup, yeşil nokta ile işaretlenmiş spermler için nicelik değildi.
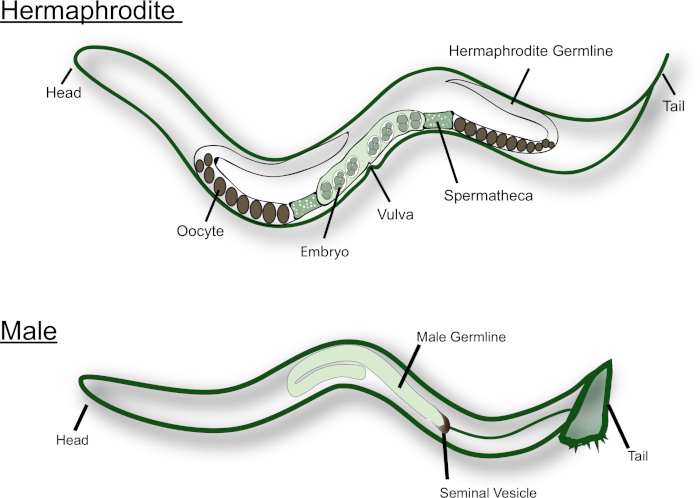
Şekil 1: yetişkin C. elegans hermafrodit ve erkek karikatür. Majör üreme yapıları şekil olarak etiketlenmiştir. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 2: numune hazırlama ve veri alımı Şematik diyagramı. Mito-boya ile lekelenmiş erkekler senkronize yetişkin hermaphrodites için montaj ilişkili vardır. Montaj ilişkili Hünsa zaman atlamalı görüntüleri sperm hızı ve ters frekans için veri yakalamak için çiftleşme sonra hemen alınır. Hala montaj ilişkili Hünsa görüntüleri alınır 1 rahim içinde sperm dağılımı değerlendirmek için çiftleşme sonra h. Daha fazla ayrıntı için metne bakın. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 3: hermafrodit uterusun içinde sperm dağılımının ölçülme. (A). C. elegans hermafrodit rahim Schematic. V = vulva, E = embriyo, S = spermatheca, O = oocyte, Z1-Z3 = bölgeler 1-3 sperm dağılımını ölçmek için kullanılır. (B-D). DıC + TRıSC birleştirilmiş (sol paneller) ve TRITC sadece (sağ paneller) Wild-Type hermafrodit uteri görüntüleri 1 h çiftleşme sonra sis-2 (Q71) erkeklerde Mito-boya ile lekelenmiş. Sperm kırmızı görünüyor. Sarı anahatlar spermatheca yerini gösterir. Ölçek çubuğu: 20 μm. Z1, Z2, Z3 oran B 'de her bölge ± standart sapma içinde yüzde sperm temsil eder. C ve D 'deki görüntüler, miktarlar için çok az (c) veya çok fazla (D) sperm oluşmasına neden olan matürleri temsil eder. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.

Şekil 4: rahim yoluyla göç sırasında sperm hızını ve ters frekansı ölçmek. (A). DIC + tritc, floresan sperm (kırmızı) içeren bir hermafrodit uterusun yansımasını birleştirdi. V = vulva, sarı = spermatheca, Z1-Z3 = uterusun üç bölgesi, kara kutu: bölge 2. (B-M). Zaman aşımı TRITC kanal görüntüleri, bölge 2 ' de (A 'da kara kutu) yakınlaştırılmış. Görüntüler 20 s aralıklarla elde edildi. Her görüntüde 3 bireysel sperm izleniyor (kırmızı, yeşil ve mavi noktalar). Panel M renkli noktalar B-Lher sperm yolunu temsil eder. Ölçek çubuğu = 20μm. (N). sperm hızı, vektör hızı ve tersine çevirme frekansı için denklemler ve tanımları. (O). kırmızı ve mavi noktalardan B-L panellerde izlenen sperm hızı, vektörel hız ve ters frekans. Bu figürün daha büyük bir versiyonunu görmek Için lütfen tıklayınız.
Film 1: film sperm hareketi ve göç. Bir wildtype hermafrodit sis-2 (Q71) erkeklerde Mito-boya ile lekelenmiş oldu. Film, çeşitli zaman aralıklarında çekilen zaman atlamalı görüntülerin bir bileşimdir. Bu videoyu görüntülemek Için lütfen tıklayınız. (İndirmek için sağ tıklayın.)
Tartışmalar
Sperm yeteneği, konik kadın üreme sistemi gezinmek ve oositler bulmak cinsel üreme için önemlidir. İç gübreleme hayvanların sperm kullanılarak yapılan son çalışmalar, kimyasal sinyaller, sıvı akışı ve sıcaklık degradeleri1,5,7, dahil olmak üzere çeşitli çevresel ipuçlarını aktif olarak cevaplamanızı önerir 9 , 12. ancak, bu gözlemler büyük ölçüde in vitro deneyler sonuçlanan ve küçük sperm davranışı ve üreme sistemi içinde iletişim hakkında bilinmektedir. Sperm göçü ve motilite konusunda in vivo verilerinin alınması için ana engellerden biri, çoğu kadın üreme alanında görünürlük eksikliği. Biz burada C. elegans kullanarak tarif ettik yöntemi bu sınırlama üstesinden gelir. Temsili sonuçlar göstermek gibi, şeffaf epidermis canlı, bozulmamış bir organizmada tek hücreli çözünürlükte her sperm doğrudan görselleştirme ve izleme için izin verir.
C. elegans iki cinsiylere sahiptir. XO genotipi olan erkekler sadece sperm üretir ve bu yöntemle sperm bağışçıları olarak kullanılır. Bir XX genotipi ile hermafrodit, kadınlarda değiştirilir. Onların gonadlar ilk dördüncü larva aşamasında spermatogenez geçmesi ve yetişkinlikte oogenesis geçiş25. Bu tahlil yetişkin hermaphrodites kullanır, hangi üreme dokularının kadın üreme sistemi için bir model sağlar. Bu tahlil her iki cinsiyet kullanımı bize sperm rehberlik ve motilite düzenleyen olabilir hem erkek hem de kadın genetik ve moleküler yollar belirlemenizi sağlar. C. elegansiçin mevcut olan tüm genetik ve moleküler tekniklerle birlikte, bu yöntem sperm göç ve motilite ve sperm ve oosit iletişiminin yeni anlayışına yol açabilir.
Bu protokoldeki birkaç kritik adım, protokol bölümünde verilen ayrıntılara ek olarak, daha fazla dikkate alınacaktır.
Solucan
Fog-2 (Q71), onu-5 (e1490)veya onu-8 (e1489) mutant erkek N2 erkek yerine kullanılabilir. Bu mutasyonlar kültürlerde erkeklerin sıklığını arttırır, ancak erkek çiftleşme veya sperm fonksiyonlarını etkilemez13. Sis-2 (Q71) dişi gibi kadın, hermaphrodites yerine kullanılabilir. Ancak, kadınların uygun yulaf gelişimi sağlamak için erkek ile ön-mated olmalıdır. Bu ön çiftleşme döllenmiş embriyolar varlığı da rahim düzgün sperm dağılımı değerlendirmek için yeterince uzun olduğunu sağlar. Mutant veya deneysel Hünsa değerlendirildiğinde, bir kontrol grubu (ler) içerir. Örneğin, mutant Hünsa test diğer değişkenler için bir kontrol olarak wildtype N2 Hünsa ile eşleştirilmiş olmalıdır. RNA parazitleri için plazmids içeren bakterilerle beslenen hermaphroditler de boş vektör kontrolü içeren bakterilerle beslenmelidir. Sperm döllendiği vulva uzaklığı, spermatheca, döllenme sitesi, rahim içinde yumurta sayısına bağlı olarak değişebilir (yani, rahim artan yumurta numarası ile genişletir). Genotürleri arasındaki karşılaştırmalar yapılırsa, uteri benzer sayıda yumurta içeren Hünsa seçin. Embriyoların veya hareketli larvaları içeren hermaphroditler seçmeyin. Hermaphroditlerin belirlenmesi gereken en uygun çağı belirlemek için bir zaman kursu yapılabilir.
Hünsa ve erkek toplama
Bu tahlil için seçilmiş Hünsa büyümüş veya açlık plakaları değil önemlidir. Gıda ve feromon ipuçları DAF-7, bir tgfß homolog ifadesi modüle. DAF-7 yolu spermatheca20için sperm rehberlik önemli rolleri oynamak F-serisi prostaglandinler sentezini düzenleyen gösterildi. Aşırı kalabalık veya acıkmış plakalardan Hünsa almak, ilgi hedefiyle ilgili olmayan zayıf sperm rehberliğine neden olabilir. Plakaların yoğunluğu erkek sperm etkilemez görünmüyor. Ancak, çok genç ya da çok yaşlı erkekler azaltılmış çiftleşme verimliliği neden olabilir (yani, kendi uteri üzerinde yeterli sperm var çiftleşme plaka üzerinde Hünsa yüzdesi). 1-3 gün eski yetişkin erkek bu tahlil için idealdir23.
Hermafrodit anestezi
Bizim elimizde, Tetramisole ve Tricaine kombinasyonu solucanlar immobilized sağlar ve çiftleşme ve görüntü edinme sırasında hayatta kalır. Sodyum azid gibi diğer anestezik de kullanılabilir. Ancak, sodyum azid son derece toksik ve koşullar standardize edilmesi gerekir. Mikroboncuk, agarose ve Mikroakiskan sistemler odaları kullanarak immobilizasyon teknikleri çiftleşme müdahale olarak tavsiye edilmez.
Erkek boyama
Bu yazıda kullanılan Mito-boya, MitoTrackerCMXRos, C. elegansiçinde, diğer mitokondri yanı sıra, sperm etiketleme için yaygın olarak kullanılmıştır. Bu Mito-boya ile etiketlenmiş sperm tamamen işlevsel, aktif olma yeteneğini koruyarak, göç, yulaf döllemek, ve uygulanabilir Döl üretmek26,27. Diğer mitokondriyal boyalar, rodamin 6G ve DiOC6 gibi C. elegans mitokondri leke için kullanılmıştır28,29. Ancak, bu boyalar için koşullar bu tahlil sperm etiketleme için standardize edilmesi gerekir. Mitochrondrial etiketleme mekanizmalarına ek olarak, Syto17 gibi DNA lekeleri,30. Bu etiketleme teknikleri nispeten kolay ve gerçekleştirmek için hızlı iken, transgenik stratejiler de sperm spesifik Rehberleri altında floresan etiketleri ekspres sperm üretmek için istihdam edilebilir31,32.
Çiftleşme
Çok kalın olan montaj ilişkisi noktaları çiftleşme verimliliğini düşürebilir. Erkek ve anestezi Hünsa çiftleşme noktası üzerine aktarırken mümkün olduğunca az bakteri olarak aktarmak için bakım alınmalıdır.
Agaroz pedleri yapma ve kapak fişi yerleştirme
Hava kabarcıkları agaroz pedleri içinde oluşturulabilir. Görüntü edinme sırasında ışığı kırabilir veya yeterince büyük olduğunda, solucanların düşmesine neden olabilir, görüntü (ler) elde etmeyi imkansız hale gelebilir. Benzer şekilde, Hünsa boyunca hava kabarcıkları oluşturulabilir ve kapak slip agaroz yastık üzerine yerleştirildiğinde. Bu kabarcıklar ışık refract ve düşük görüntü kalitesine yol. Uygulama hava kabarcıklarının oluşumunu azaltmaya yardımcı olacaktır.
Miktar
Sperm dağıtımını ölçerek, bir solucanın uterusuna farklı z-düzlemler sperm dağılımında küçük farklılıklar olabilir. Biz spermatheca odaklı tek bir görüntü alarak bize birden fazla z-bölümleri ortalamasını alarak elde edilen sonuçlara benzer tekrarlanabilir sonuçlar verir bulabilirsiniz. Görüntüyü spermatheca 'nın ortasına odaklamak tavsiye edilir, ancak odak düzlemleri deneylerin ihtiyaçlarına göre biraz değişebilir. Ancak, tüm görüntülerin aynı şekilde alındığı önemlidir. Ayrıca, sadece odak olan sperm sayılır önemlidir. Odaklı sperm ölçütlerini belirlemede sayacın takdirine bağlıdır. Ancak, kritere göre ölçülenmiş her solucanın sistematik olarak uygulanması önemlidir. Sperm izleme için, birçok yazılım otomatik izleme yetenekleri sunuyor. Bununla birlikte, manuel takip işlemi, yazılımın otomatik izleme algoritmasını iki ana nedenden dolayı daha fazla gerçekleştirir: 1) sınırlı alan içinde benzer boyutta çekirdeklerin bolluğu, yazılımın bireysel sperm arasında ayrım yapmasını zorlaştırır ve her sperm için tanımlanmış ROIs oluşturun. 2) sperm olarak ve odak dışında gitmek, onların yoğunlukları vardiya, zor yazılım için uzun süre boyunca sperm izlemek için yapım.
Açıklamalar
Yazarlar ilgi çatışması yok.
Teşekkürler
Biz içtenlikle bizim geç akıl hocası, Dr Michael Miller, onun ilham verici ve özverili mentorluk ve daha iyi sperm ve oosit iletişimi anlamak için bir araç olarak bu yöntemin oluşturulması için teşekkür ederiz. Onun ani geçişini ailesi, Laboratuvarı ve bilimsel toplum için büyük bir kayıp oldu. Bu çalışmada NıH (R01GM085105-MAM ve F30HD094446 MH) tarafından desteklenmektedir. İçerik sadece yazarlar sorumluluğundadır ve mutlaka Ulusal Sağlık Enstitüleri resmi görüşlerini temsil etmez.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents and Material | |||
| 60 mm x 15 mm Petri dish | Fisher | FB0875713A | |
| Agar | Fisher | BP1423-500 | |
| Sodium Chloride | Fisher | S671-3 | |
| Peptone | Fisher | BP1420-500 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB broth, Miller | Fisher | 1426-2 | |
| Escherichia coli strain NA22 | Caenorhabditis Genetics Center (CGC) | NA22 | Either this or OP50 E. coli can be used for C. elegans maintenance and assay. Both may be purchased at the CGC |
| N2 | CGC | N2 | |
| fog-2(q71) | CGC | CB4108 | |
| Platinum wire 0.25 mm dia | Alfa Aesar | 10288 | |
| 5 3/4" Disposable Pasteur pipet | Fisher | 13-678-20A | |
| Watch glass | Fisher | 02-612A | |
| 5 mm Dia. Glass rod | Fisher | 50-121-5269 | |
| MitoTracker CMXRos (Mito-dye) | Fisher | M7512 | Shield from light, store at -20 °C |
| Monopostassium phosphate | Fisher | P285-500 | |
| Disodium phosphate | Fisher | S374-1 | |
| Magnesium sulfate | Fisher | M63-500 | |
| Dimethyl sulfoxide | Fisher | BP231-1 | DMSO |
| Aluminum foil | Fisher | 01-213-102 | |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma | E10521-10G | Tricaine is the common name. Store in aliquotes at -20 °C. |
| Tetramisole hydrochloride | Sigma | L9756-5G | Store in aliquotes at -20 °C |
| Agarose | Fisher | BP1356-100 | |
| Coverslips | Fisher | 12-548-A | 18 x 18-1 |
| Frosted microscope slides | Fisher | 12-552-3 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 16 °C and 20 °C incubators | Fisher | 97-990E | Same model, set at different temperatures. |
| Upright Microscope with epi-fluorescence illuminator, camera, and 10x and 60x objectives | Nikon | ||
| Software with image acquisition and tracking capabilities | Nikon | NIS-elements AR | |
| Stereo-microscope | Nikon | SMZ800N | Any stereo-microscope that can be used to visualize C. elegans may be used with this protocol |
Referanslar
- Boryshpolets, S., Perez-Cerezales, S., Eisenbach, M. Behavioral mechanism of human sperm in thermotaxis: a role for hyperactivation. Human Reproduction. 30 (4), 884-892 (2015).
- Edmonds, J. W., McKinney, S. L., Prasain, J. K., Miller, M. A. The gap junctional protein INX-14 functions in oocyte precursors to promote C. elegans sperm guidance. Developmental Biology. 359 (1), 47-58 (2011).
- Edmonds, J. W., et al. Insulin/FOXO signaling regulates ovarian prostaglandins critical for reproduction. Developmental Cell. 19 (6), 858-871 (2010).
- Espinal-Enriquez, J., Priego-Espinosa, D. A., Darszon, A., Beltran, C., Martinez-Mekler, G. Network model predicts that CatSper is the main Ca(2+) channel in the regulation of sea urchin sperm motility. Scientific Reports. 7 (1), 4236 (2017).
- Hunter, R. H., Nichol, R. A preovulatory temperature gradient between the isthmus and ampulla of pig oviducts during the phase of sperm storage. Journal of Reproduction and Fertility. 77 (2), 599-606 (1986).
- Hussain, Y. H., Guasto, J. S., Zimmer, R. K., Stocker, R., Riffell, J. A. Sperm chemotaxis promotes individual fertilization success in sea urchins. Journal of Experimental Biology. 219 (Pt 10), 1458-1466 (2016).
- Kantsler, V., Dunkel, J., Blayney, M., Goldstein, R. E. Rheotaxis facilitates upstream navigation of mammalian sperm cells. Elife. 3, e02403 (2014).
- Kubagawa, H. M., et al. Oocyte signals derived from polyunsaturated fatty acids control sperm recruitment in vivo. Nature Cell Biology. 8 (10), 1143-1148 (2006).
- Miki, K., Clapham, D. E. Rheotaxis guides mammalian sperm. Current Biology. 23 (6), 443-452 (2013).
- Ting, J. J., Tsai, C. N., Schalkowski, R., Cutter, A. D. Genetic Contributions to Ectopic Sperm Cell Migration in Caenorhabditis Nematodes. G3. 8 (12), 3891-3902 (2018).
- Yanagimachi, R., et al. Chemical and physical guidance of fish spermatozoa into the egg through the micropyledagger, double dagger. Biology of Reproduction. 96 (4), 780-799 (2017).
- Zhang, Y., et al. Generation of Gradients on a Microfluidic Device: Toward a High-Throughput Investigation of Spermatozoa Chemotaxis. PloS One. 10 (11), e0142555 (2015).
- Hoang, H. D., Miller, M. A. Chemosensory and hyperoxia circuits in C. elegans males influence sperm navigational capacity. PLoS Biology. 15 (6), e2002047 (2017).
- Hansen, J. M., Chavez, D. R., Stanfield, G. M. COMP-1 promotes competitive advantage of nematode sperm. Elife. 4, (2015).
- L'Hernault, S. W. Spermatogenesis. WormBook: The Online Review of C. Elegans Biology. , 1-14 (2006).
- Miller, M. A., et al. A sperm cytoskeletal protein that signals oocyte meiotic maturation and ovulation. Science. 291 (5511), 2144-2147 (2001).
- Greenstein, D. Control of oocyte meiotic maturation and fertilization. WormBook: The Online Review of C. Elegans Biology. , 1-12 (2005).
- O'Hagan, R., Wang, J., Barr, M. M. Mating behavior, male sensory cilia, and polycystins in Caenorhabditis elegans. Seminars in Cell & Developmental Biology. 33, 25-33 (2014).
- Hoang, H. D., Prasain, J. K., Dorand, D., Miller, M. A. A heterogeneous mixture of F-series prostaglandins promotes sperm guidance in the Caenorhabditis elegans reproductive tract. PLoS Genetics. 9 (1), e1003271 (2013).
- McKnight, K., et al. Neurosensory perception of environmental cues modulates sperm motility critical for fertilization. Science. 344 (6185), 754-757 (2014).
- Chaudhuri, J., Parihar, M., Pires-daSilva, A. An introduction to worm lab: from culturing worms to mutagenesis. Journal of Visualized Experiments. (47), (2011).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Chatterjee, I., et al. Dramatic fertility decline in aging C. elegans males is associated with mating execution deficits rather than diminished sperm quality. Experimental Gerontology. 48 (11), 1156-1166 (2013).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. , 80-90 (2017).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent Window into Biology: A Primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Sato, M., Sato, K. Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science. 334 (6059), 1141-1144 (2011).
- Wang, Y., et al. Kinetics and specificity of paternal mitochondrial elimination in Caenorhabditis elegans. Nature Communications. 7, 12569 (2016).
- Wolke, U., Jezuit, E. A., Priess, J. R. Actin-dependent cytoplasmic streaming in C. elegans oogenesis. Development. 134 (12), 2227-2236 (2007).
- Mottram, L. F., Forbes, S., Ackley, B. D., Peterson, B. R. Hydrophobic analogues of rhodamine B and rhodamine 101: potent fluorescent probes of mitochondria in living C. elegans. Beilstein Journal of Organic Chemistry. 8, 2156-2165 (2012).
- Singson, A., Hill, K. L., L'Hernault, S. W. Sperm competition in the absence of fertilization in Caenorhabditis elegans. Genetics. 152 (1), 201-208 (1999).
- Wu, J. C., et al. Sperm development and motility are regulated by PP1 phosphatases in Caenorhabditis elegans. Genetics. 190 (1), 143-157 (2012).
- Seidel, H. S., et al. A novel sperm-delivered toxin causes late-stage embryo lethality and transmission ratio distortion in C. elegans. PLoS Biology. 9 (7), e1001115 (2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır