Method Article
Caenorhabditis elegansふたなり生殖管内の精子の誘導と運動性の測定
要約
精子は、卵母細胞を受精させるために卵管を正常にナビゲートしなければならない。ここでは、 elegansふたなり子宮内での精子移動を測定するためのアッセイについて説明する。このアッセイは、交配後の子宮内の精子分布、ならびに速度、方向速度、および反転周波数に関する定量的データを提供することができます。
要約
成功した受精は生殖の基本であるが、女性の生殖管の中で精子を卵母細胞に導くメカニズムについてはほとんど知られていない。体外研究では、内部で受精する動物の精子が周囲からの様々な合図に反応できることを示唆しているが、女性生殖器内の行動を視覚化することができないことは、精子の移行を理解するための挑戦を作成するとそのネイティブ環境でのモビリティ。ここでは、この制限を克服し、その透明な表皮を利用するc. elegansを用いた方法について述べる。ミトコンドリア色素で染色されたelegansの雄は、修飾雌として作用する成体 hermaphrodites と交配し、蛍光標識精子をふたなり子宮に堆積する。標識された精子の遊走および運動性は、ライブふたなりにおける epi 蛍光顕微鏡を使用して直接追跡することができます。野生型動物では、標識された精子の約 90% が子宮を通ってクロールし、受精部位に到達するか、または spermatheca する。子宮の画像は、子宮内の精子の分布および spermatheca に達した精子の割合を評価するために交配後1時間摂取することができる。あるいは、時間経過画像は、精子速度、方向速度および逆転頻度を評価するために交配直後に撮影することができる。この方法は、 elegansのために利用可能な他の遺伝的および分子ツールと組み合わせて、女性の生殖管内の精子の誘導および運動性を調節するのに重要な新規の遺伝的および分子的メカニズムを同定することができる。
概要
精液 (精子と呼ばれる) が卵母細胞に向かって女性の生殖管を通って移動する分子機構はよく理解されておらず、性的生殖の基本である。精子の運動性は非常にダイナミックであり、精子の速度と方向の運動性を変更する堅牢な通信信号に依存します1,2,3,4,5,6,7,8,9,10,11,12. c. elegansはふたなりの透明な表皮が単一の細胞の決断2,3で生きている精子の追跡を可能にするので、インビボで精子の動きを研究するための力強いモデルになった 8、10。本論文の目的は、 elegansふたなり子宮内の精子の動きを評価するための方法を提供することである。
精子と卵子が外部環境 (すなわち水草環境) で出会う動物種では、精子は卵母細胞によって分泌される走化性シグナルに反応する。これらの信号は、精子の動きの方向を導き、それらを信号源4、6、11に近づける。しかし、内部で受精する種における精子の動きについては、はるかに少ないことが知られている。主な課題は、ほとんどの種の顕微鏡検査にアクセスできない女性の生殖路のアーキテクチャです。ヒトにおけるインビトロ研究では、マウス、およびブタは、例えば、精子の亜集団が chemoattractants、流体の流れ、および熱勾配1、5、7、9に応答することができるという証拠を提供し、 12です。これらのシステムによって、インビボでの精子の動きを視覚化および追跡することができないことは、これらの機能を調節する主要なメカニズムを発見するための戦略に重大な制限を置く。
これらの制限を克服するために、線虫c. elegansを用いて受精後の精子を直接可視化し、インビボで個々の精子移行パラメータを測定し、そして精子集団の能力を目標に測定する方法を開発しました。受精部位。これらの方法は、 elegans分子および遺伝的ツールセットと共に、精子運動性挙動を調節する化学シグナル分子および分子機械の発見を容易にする。例えば、遺伝スクリーンは、インビボ13における効率的な精子運動に必須である遺伝子を同定するために hermaphrodites または雄で実施することができる。分子をふたなり生殖腺に注入して、精子の活性化、遊走速度、方向運動性3に対する効果をテストすることができます。さらに、記述された方法は、異所性の身体位置への不正な精子の移行を監視し、精子競争10、14を評価するために使用することができる。
C. elegansは、hermaphrodites と雄のように自然界に存在する (図 1参照)。ふたなり生殖腺には、互いの鏡像である2つの U 字形のアームがあります。L4 幼虫期には、最も近位の生殖細胞 (すなわち、spermatheca 近傍の細胞) が精子形成を受ける。各プライマリ spermatocyte は減数分裂に入り、4つの半数 spermatids を生成します。これらの spermatids は、最初の成熟した卵母細胞と共に spermatheca に押し込まれ、spermiogenesis15を受ける。精子形成から oogenesis への成人 hermaphrodites スイッチ。卵母細胞は、生殖腺に沿って組み立てラインの方法で成熟し、最も成熟した卵子は生殖腺の近位端で、spermatheca の隣にあります。精子からの MSP 信号は、meiotic 成熟および排卵16,17を誘発するために必要とされる。一方、オスc. elegansは、精子のみを生産する J 字型の生殖腺を持っています。Spermatids は、精嚢に保存されている。ふたなりやメスと交配すると、オスは尾の近くの spicules を外陰部に挿入します。Spermatids は、射精中に活性化され、彼らは精液流体18と接触するとき。Elegans精子は flagellated ではないので、泳いではいけません。代わりに、彼らは運動のための pseudopod を使用して、生殖管を介してクロールします。それは十分にサイズが大きい男性の精子がふたなり精子14上の競争上の利点を持っていることが確立されています。
この方法では、雄c. elegansは精子ドナーとして作用し、成人 hermaprhodites と交配される。成人男性は蛍光性ミトコンドリア色素で染色され、標識精子が生成される。いったんふたなり外陰部を通して沈着した精子は、子宮内の胚を spermatheca、または受精部位に向けて這う必要がある。Elegansモデルの透明な表皮は、女性の生殖路を通って移動するので、個々の精子を直接可視化することができます。近年では、私たちの研究室では、F シリーズプロスタグランジンのクラスは外陰部から spermatheca19,20に精子を導くことの重要性を実証するために、この方法を首尾よく使用しています。精子によるふたなりと応答によってその合成を支配する分子 mechansims は、まだ調査中である。しかし、精子の運動性および遊走を評価するこの方法は、内部で受精動物に精子や卵母細胞の通信を制御するキープレーヤーの同定を容易にする。以下のプロトコルは、このアッセイを実行する方法を段階的に説明する。
プロトコル
注: この議定書のすべてのステップは室温 (~ 20-22 ° c) でまたは16° c または20° c. に置かれる一定した温度の定温器で行われる。オスおよびふたなりc. elegansは、食物源21、22として標準培養条件および NA22 または OP50 大腸菌を使用して成長させる。野生型 N2 hermaphrodites および曇-2 (q71)雄を以下の手順で使用する。
1日目: 交配のための Hermaphrodites を選ぶ L4 の段階
- 一貫した結果を得るには、成人を積極的に再生するようにすべての hermaphrodites を同期する必要があります。ピック 20-30 L4 ステージ hermaphrodites に6センチメートルの線虫成長培地 (NGM) プレートを播種。Hermaphrodites を20° c で 28-30 h にインキュベートします。
注:交配には 12-15 hermaphrodites のみが使用されます。残りの hermaphrodites は黒字だ。
2. 1 日目: 蛍光ミトコンドリア色素 (水戸・染料) による男性の染色
- シード NGM プレートの中央に大腸菌(フードドット) のドットを配置して、雄染色プレートを作ります。食品の点を作るには、ガラスの攪拌棒の端を使って、播種したプレートのバクテリアの芝生から大腸菌を掻き、シードプレートに堆積させます。ドットは直径の〜5-7 ミリメートルでなければなりません。
- 水戸で2μ l を混ぜる (材料の表を参照) DMSO と10μ l の M9 バッファー (3 g の KH2の PO4, 6 g の Na2HPO4, 5 g の NaCl は、1Ml の MgSO4, H2O を1リットル。後に MgSO4を追加します。オートクレーブ)。水戸染料液を雄染色板のフードドットにピペットで移します。(〜30分) 暗闇の中でプレートを乾燥させてください。
注:水戸-染料は光に敏感です。水戸染料を含むすべての溶液、プレート、虫を光から遮蔽する。1 mM のストックを-20 ° c で保管します。 - ピック ~ 100 1-3 日齢成人男性23 ~ 水戸の男性染色プレートに染色されたフードドット。アルミホイルでプレートを包み、16° c で一晩インキュベートします。交配のために、12-15 hermaphrodites ごとの ~ 50-60 の男性を使用しなさい。100以上の男性が必要な場合は、男性の過密を防ぐために、より多くの染色板を作ります。
注:雄はまた、時計グラス上で 3 h のための M9 バッファー内の10μ m の水戸染料溶液でインキュベートすることによって染色することができる。蒸発と光の暴露を防ぐために覆われた虫を保ちます。3時間後、パスツール pipet を使用して NGM プレートに雄を 10 cm まで移します。可能な限り水戸色素溶液をわずかに転送します。アルミホイルでプレートを包み、16° c で一晩インキュベートします。
3. 2 日目: 交配
- 1日目から染色された雄を新たに播種した NGM プレートにピックします。交配するまで、暗闇の中でプレートを残します。このステップは、男性の周りの余分な水戸染料染色細菌が除去されることを保証します。過剰な水戸による、染色されたバクテリアと嵌合プレートへの持ち越しは、ふたなり組織を染色することができる。
- シード NGM プレート上に厚い大腸菌混合物を2μ l 滴下して嵌合板を作ります。太い細菌を乾燥させて、嵌合ドットを作ります。雄と hermaphrodites は交配のためにこのドットに移されます。厚い大腸菌を作るには、3 ml の一晩大腸菌をスピンダウンし、再懸濁の 1 ml でバクテリアをペレットにします。この混合物は4° c で貯えられ、6か月まで再使用することができる。
注:大腸菌溶液の厚さを調整してもよい。溶液が薄すぎる場合、雄は交配のためにそれを集約するのではなく、交配ドットから離れてクロールすることができます。厚すぎている大腸菌ソリューションから作られた嵌合点は、嵌合効率を低下させることがある。 - ステップ3.2 からの嵌合プレートが乾燥している間、300μ l を 1%(w/v) Tricaine (トライ)、300μ l の 0.1%(w/v) Tetramisole (テト)、および900μ l の M9 を混合する。
注:1% (w/v) Tricaine および 0.1%(w/v) Tetramisole を-20 ° c で aliquotes として保存します。凍結融解を繰り返さないでください。 - テト/トリ溶液の600μ l を腕時計ガラスに移す。
- 転送 12-15 hermaphrodites は、時計のガラスでテト/トライソリューションに1日目にピッキングしました。30分間インキュベートして、hermaphrodites を固定します。テト/トライソリューションが蒸発するのを防ぐために、時計のガラスを覆ったままにしてください。
注:Hermaphrodites が少なくとも30分間麻酔されることが重要である。画像取得中に移動するワームが発生し、イメージングに interefere ことができます。 - Hermaphrodites がインキュベートされている間、ピック50-60 は、ステップ3.1 からの雄染色オスを交配ドット (ステップ 3.2) に当てる。プレートは、ステップ3.8 まで暗所に保管してください。
- テト/トライソリューションで30分間インキュベーションした後、ガラスパスツール pipet を使用して、固定化された hermaphrodites を時計ガラスからシード NGM プレートに移します。できるだけ多くの液体を除去し、余分な液体を乾燥させます。
注:Hermaphrodites を過度に乾燥させないでください。目に見える液体がすべて蒸発したらすぐに、次のステップを開始します。 - シード NGM 板から麻酔をかけた hermaphrodites を染色された雄との嵌合ドット上に移す。男性が hermaphrodites と嵌合できるように、30分間暗所でインキュベートします。
- 30分間交配した後、タイムラプス撮影のために直ちに hermaphrodites をマウントするか、または hermaphrodites を新しいものに移し、播種した NGM プレートを、撮像する前に1時間安静にする。
注:ふたなり子宮のタイムラプス動画は、精子の速度と逆転の頻度を定量化するために使用されます。交配後1時間服用した子宮の静止画像は、精子分布、または spem 指導を定量化するために使用される。
4. 2 日目: 視覚化のためにワームをマウントする
-
H2o に 2% のアガロースで取り付けパッドを作成する
注: 2% のアガロースはバルク製、ガラス試験管に等分、4° c で保存することができます。必要に応じて、各アリコートを使用する前に電子レンジし、それが固化するのを防ぐために、ヒートブロックに格納することができます。- 取り付けパッドを作成するには、3つのガラス顕微鏡のスライドを、長いエッジに接するように並べて配置します。2枚のマスキングテープを、外側のスライドの両方に重ねて配置します。テープによるこれらの外のガラススライドはサポートとして作用し、得られたアガロースパッドの厚さは「2テープ深い」になります。
- 溶融 2% アガロースの〜75μ l をセンタースライドに置きます (これはテープのないスライドです)。すぐにアガロースの上に新しいガラス顕微鏡スライドを配置します。このトップガラスのスライドは、他のスライドに垂直で、各端が2つのサポートスライドのテープ上に置かれている必要があります。
- アガロースを硬化させます (~ 30 秒)。上部のガラススライドをアガロースパッドの上にスライドさせて慎重に取り外します。
- テト/トライ溶液の10-15 μ l を 2% アガロースパッド上に置きます。嵌合した hermaphrodites をパッド上に転写します。できるだけ少ないバクテリアを転送するように注意してください。
- アガロースパッドのワームの上にカバースリップを置きます。
5. 2 日目: 画像取得の設定
注:Epi 蛍光、10x および60x の目的、およびデジタルカメラを備えた直立 miscroscope は、精子分布のための画像を取得するために使用することができます。時間経過した画像を取得することができるソフトウェアは、精子の速度、方向速度、および反転周波数を評価するために必要とされます。
-
交配後の画像取得 1 h
- スライドを顕微鏡ステージ上に取り付けます。赤い蛍光発光フィルタ (TRITC フィルタ) を使用して10倍の目標を使用して、アガロースパッド上のワームをスキャンするには、目の部分を見てください。ワームが発見されたら、瞬間的に蛍光灯をオンにして、ワームが嵌合しているかどうかを確認します。精子が子宮内で可視である場合、60x の目的に切り替えます。
注:カバースリップの60x の目的によって作成された圧力は、いくつかの脆弱なワームを損傷する可能性があり、腸管または生殖腺が動物から押し出される原因となる。10x 目標を使用して成功した交配のスキャンは、追加された圧力へのワームの暴露を最小限に抑えることができます。嵌合した蠕虫を、長期間の蛍光灯にさらさないでください。 - 差動干渉コントラスト顕微鏡 (DIC) を使用して、外陰部と1つの spermatheca の両方が表示されるように、ワームを配置します。Spermatheca の中心に焦点を当てて画像をフォーカスします。DIC と TRITC チャンネルの両方の露出を確認してください。DIC では、内部のワームの構造がはっきりと見えるはずです。TRITC では、個々の精子は別個の尚として表示されるべきである。
注:各画像は、外陰部から spermatheca のいずれかに子宮を捕捉する必要があります。子宮が長すぎて1つの画像に収まらない場合は、2つの別々の画像を撮影することができます。すべての画像を同じ露出レベルで撮影する必要はありません。しかしながら、個々の精子が蛍光画像において区別および定量化されることが重要である。 - 各子宮の DIC と蛍光画像を取得します。
- 手順 5.1.1 ~ 5.1.3 を繰り返し、すべての合致する hermaphrodites がイメージングされます。
- スライドを顕微鏡ステージ上に取り付けます。赤い蛍光発光フィルタ (TRITC フィルタ) を使用して10倍の目標を使用して、アガロースパッド上のワームをスキャンするには、目の部分を見てください。ワームが発見されたら、瞬間的に蛍光灯をオンにして、ワームが嵌合しているかどうかを確認します。精子が子宮内で可視である場合、60x の目的に切り替えます。
-
タイムラプス動画のキャプチャ
- アガロースパッドをスキャンし、ステップ5.1.1 および5.1.2 で説明されているように、子宮内にラベルの付いた精子を含む hermaphrodites を見つけます。
- DIC と TRITC チャンネルでタイムラプス画像を取得するために、ソフトウェアを設定します。一般的に、タイムラプス画像は、子宮あたり10-20 分の15-30 秒間隔で撮影されます。
6. 定量化
-
交配後1時間採取した子宮画像に対する精子分布の定量化
- 一方の端の外陰部と、他方の spermatheca から始めて、子宮を3つに分けます。これらは3つのゾーンを表します。ゾーン 1 (Z1) は外陰部を含み、ゾーン 3 (Z3) には spermatheca が含まれています。
- 手動で子宮の各3分の1以内に精子の数を数え、子宮全体の全精子のパーセントとして各ゾーンの数を報告する。以下に例を示します。
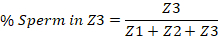
注: 場合によっては、TRITC チャネルイメージの信号強度を調整して、画像にキャプチャされたすべての精子を表示および定量化できるようにする必要があります。
-
タイムラプス画像で精子を追跡
注:本稿では、分析のために NIS 要素ソフトウェアを使用した。以下のセクションでは、このソフトウェアを使用して手動で精子を追跡するための手順を提供します (ステップ 6.2.1) だけでなく、オープンソースソフトウェア ImageJ/フィジー (ステップ 6.2.2).-
NIS 要素による精子の追跡
- 追跡するタイムラプスシリーズで nd2 ファイルを開きます。トラッキングを開始するには、ソフトウェアで右クリックしてトラッキングパネルを開き、[解析コントロール] を選択します。 |追跡。
- [追跡] パネルで、[新しい ROI の定義] を選択します。追跡される各精子をクリックして、関心のある各領域 (ROI) を定義します。選択した精子の上に色付きのマークが表示されます。[すべての ROIs が選択されたときに終了] をクリックします。
- ROIs が特定されると、タイムラプスシリーズの次のフレームに移動します。ROI マーカーを画像内の新しい精子の位置にドラッグします。精子を追跡できなくなるまでこれを続けます。時間経過画像のすべてのフレームを通じて ROI マーカーが配置された各位置を接続する点線が表示されます。
注:ゾーン1と3の精子は、野生型動物であっても円形のパターンで動く傾向があるので、区域2の精子だけが追跡されるべきである。 - トラッキングパネルで [エクスポート] をクリックして、追跡対象の精子から、定量化可能なすべてのデータ (パスの長さ、時間、XY 位置など) を Excel ドキュメントにエクスポートします。
-
フィジーで精子を追跡
- タイムラプスシリーズの TRITC チャンネルイメージを tif ファイルに変換します。1つのシリーズのすべてのファイルを1つのフォルダに保存します。
- BioFormats インポート機能を使用して、フィジーに画像をインポートします。1つのタイムラプスシリーズから1つの hyperstack として画像をインポートします。
- プラグインを介してフィジー24で TrackMate を開く|追跡 |TrackMate で手動追跡。Diaglogue ボックスが開きます。
- フィジーのツールバーで TrackMate を選択します。追跡される精子をダブルクリックします。点線の付いた緑色の円が表示されます。円の内側をクリックし、目的の位置にドラッグすることで、この円を再配置できます。ALTキーを押しながらマウスをスクロールすると、この円のサイズが変更されることがあります。
- トラッカーのサイズと位置が設定されたら、もう一度円をクリックします。緑の破線は緑の実線に変わります。同時に、シフトとLキーを押してトラッキングモードをオンにします。これは、フィジーのツールバーに表示されます。
- タイムラプスシリーズの次のフレームに移動します。新しいフレームで追跡された精子の新しい場所を設定するには、新しいポイントの上にマウスを移動し、 Aキーを押します。これで、トラッカーが新しい位置に表示され、トラッカーが前のフレームに配置された位置を接続する線が表示されます。
- トレースが完了したら、[TrackMate] ダイアログボックスで [ Analyze ] をクリックして、必要なデータを生成します。
- 速度を計算するために、精子の総パス長を経過時間によって除算する。
- ベクトル速度を計算するには、spermatheca の方向を指す外陰部から子宮を通る線を引きます。この線に沿って精子が移行した距離を、トレースの最初から最後まで測定します。この距離を経過時間で割ります。負の値は、精子が spermatheca から移行したことを示します。
- 逆転の頻度を記録するために、精子のトレースが3つの連続したタイムラプスフレームの間に90°より小さい角度を発生させた回数を数えてください。
-
NIS 要素による精子の追跡
結果
この論文で示された結果を生成するために、霧 2 (q71)の雄を水戸染料で染色し、野生型の N2 hermaphrodites と交配させた。図 2は、ワームの準備、交配、分析など、この方法の全体的なスキームを示しています。映画 1が示すように、成人ふたなり生殖路は、互いの鏡像である2つのアームを有する。交配の際、標識された精子は外陰部を通してふたなり子宮内に沈着する。精子は、子宮内の発達した胚の周りを spermatheca に向かって移動し、そこで受精まで貯蔵される。成人ふたなりにおける生殖細胞が卵母細胞へと成長するにつれて、近位、最も成熟した卵子は、シース細胞 contrations を介して spermatheca に押し込まれる。卵母細胞が spermatheca にある間に受精が起こる。
女性の生殖管を通して精子の分布と遊走を定量化するために、ふたなり子宮は3つのゾーンに分けられます (ムービー1、図 3a)。ゾーン1は、外陰部から始まり、子宮の最初の三分の一に及びます。ゾーン2は子宮の中央三分の一にまたがり、ゾーン3は子宮の最後の3分の1にまたがり、spermatheca を含む。野生型、N2 hermaphrodites およびfog-2 (q71)を用いた適切な精子誘導は、spermatheca、またはゾーン3に達する標識された精子の約 90% になるはずである (図 3b)。 Matings が少なすぎる (図 3c、10-15 未満の精子)、または多すぎる (図 3d、精子で満たされた子宮) 子宮内の精子は数えてはならない。10-15 未満の精子をもたらす matings では、3-4 の不正な精子がデータを大きくスキューする可能性があります。同様に、子宮が精子で完全に満たされると、精子は適切に移行することができない。精子は、貧しい精子指導表現型を表示するいくつかの変異体の頚全体に散在しているように見えるかもしれない。しかし、この場合には、精子は、図 3dで見られるように、子宮の各隙間を埋めてはならない。生殖腺の各アームの定量化は、1つのサンプル、または1つの n とみなされる。
タイムラプス画像は、精子の速度と反転周波数を定量化するために撮影されています。ゾーン1および 3 (ムービー 1) の精子は、野生型動物内であっても円形パターンで移動する傾向があるため、ゾーン2の精子のみを追跡する必要があります (図 4a)。15-30 秒間隔で撮影した時間 laspe 画像は、通常、精子を追跡するために使用されます。2.5-3 分以上連続したフレームに従うことができる唯一の精子は定量化されます。図 4bにおいて、赤色および青色のドットによってマークされた精子はこの基準を満たすが、一方、緑色のドットによってマークされる精子はそうではない。したがって、図 4nに定義された値は、赤色および青色のドット (図 4O) によって示される精子について定量化されるが、一方、緑色のドットでマークされた精子については定量化しなかった。
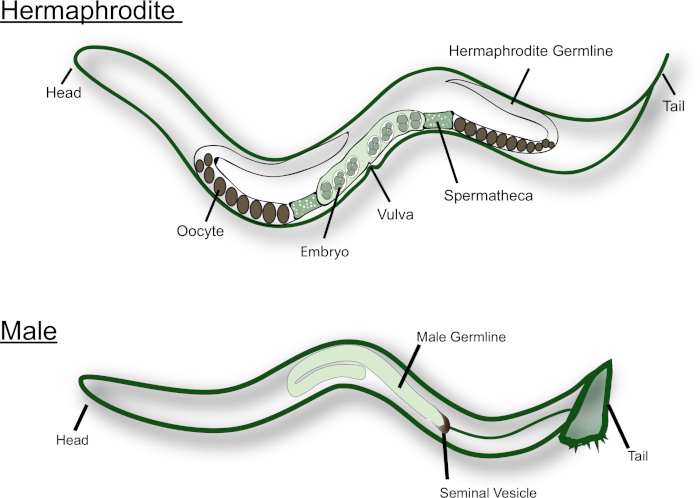
図 1: 大人の漫画c. elegansふたなりとオス。主要な生殖構造は図で標識されています。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 2: サンプル調製とデータ取得の概略図水戸染料で染まった雄は、シンクロナイズド・アダルト hermaphrodites に交配される。嵌合した hermaphrodites のタイムラプス画像は、精子の速度と反転周波数のデータを捕捉するために交配直後に撮影される。嵌合した hermaphrodites の静止画は、子宮内の精子分布を評価するために交配後1時間服用される。詳細については、テキストを参照してください。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 3: ふたなり子宮内の精子分布の定量化(A) c. elegansふたなり子宮の模式図。V = 外陰部、E = 胚、S = spermatheca、O = 卵母細胞、Z1-Z3 = ゾーン1-3 精子分布を測定するために使用されます。(B-D)。DIC + TRITC マージ (左パネル) と TRITC のみ (右パネル) ふたなりに交配した後頚 1 h の野生型の画像(q71) は水戸染料で染色した。精子は赤く見える。黄色のアウトラインは、spermatheca の位置を示します。スケール棒:20 μ m。Z1, Z2, Z3 B における定量化は、各ゾーン±標準偏差における精子のパーセントを表す。CおよびDの画像は、定量化のために少なすぎる (c) または多すぎる (D) 精子をもたらした matings を表す。この図の大規模なバージョンを表示するには、ここをクリックしてください。

図 4: 子宮内移行時の精子の速度と逆転頻度の定量化(A) DIC + TRITC 蛍光精子を含むふたなり子宮の結合画像 (赤色)。V = 外陰部、黄 = spermatheca、Z1-Z3 = 子宮の3つのゾーン、ブラックボックス: ゾーン2。(B-M) です。タイムラプス TRITC チャンネル画像がゾーン 2 (A のブラックボックス) にズームインします。画像は20秒間隔で取得した。3個々の精子は、各画像 (赤、緑、青のドット) で追跡されました。パネルMにおける色付きのドットは、 B − Lからの各精子の経路を表す。スケールバー = 20 μ m。(N). 精子の速度、ベクトル速度と反転周波数の方程式と定義。(O). 速度, ベクトルの速度と赤と青のドットでパネルBで追跡された精子の反転周波数.この図の大規模なバージョンを表示するには、ここをクリックしてください。
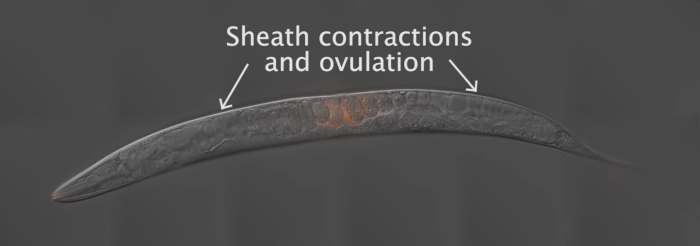
動画 1: 精子の動きと移行の動画。野生型ふたなりを、水戸染料で染色した霧 2 (q71)雄に交配させる。ムービーは、さまざまな時間間隔で撮影されたタイムラプス画像の合成です。この動画を見るにはここをクリックしてください。(右クリックしてダウンロードします。
ディスカッション
複雑な女性の生殖路をナビゲートし、卵母細胞を見つけるために精子の能力は、性的生殖のために重要です。内部で施肥された動物の精子を用いた最近の研究では、化学物質のシグナル、流体の流れ、温度の勾配など、さまざまな環境の手掛かりに積極的に反応することを示唆しています1、5、7、9,しかし、これらの観察は、大部分はインビトロ実験に起因しており、生殖管内の精子の挙動およびコミュニケーションについてはほとんど知られていない。精子の移行と運動におけるインビボデータを取得するための主な障壁の1つは、ほとんどの女性の生殖路内の可視性の欠如である。Elegansを使用してここで説明した方法は、この制限を克服します。代表結果が示すように、透明な表皮は生きた、無傷の生物の単一の細胞の決断で各精子の直接視覚化そして追跡を可能にする。
C. elegansは、2つの男女を持っています。男性は、XO 遺伝子型で、精子のみを産生し、そしてこの方法では、精子ドナーとして使用される。ふたなりは、XX 遺伝子型で、女性を変更します。彼らの生殖腺は、第4幼虫期の間に精子形成を受け、成人期25で oogenesis に切り替えます。このアッセイは、生殖組織が女性の生殖管のモデルを提供する成人 hermaphrodites を使用します。このアッセイにおいて男女の両方を利用することにより、精子の誘導と運動性を調節する可能性のある男性と女性の両方の遺伝的および分子的経路を同定することができます。Elegansのために利用可能な遺伝的および分子的技術の全ホストと組み合わせることで、この方法は、精子の遊走および運動性だけでなく、精子および卵母細胞の通信に新しい洞察をもたらす可能性があります。
このプロトコルのいくつかの重要なステップは、プロトコルセクションで提供される詳細に加えて、さらなる考慮を保証します。
ワーム
fog-2 (q71)、彼-5 (e1490)、または彼-8 (e1489)変異体雄は、N2 男性の代わりに使用することができる。これらの変異は、培養中の男性の頻度を増加させるが、男性の交配または精子機能13には影響を与えない。女性は、例えば霧-2 (q71)メス、hermaphrodites の代わりに使用することができる。しかし、適切な卵母細胞の発達を可能にするために、雌は雄と事前に交配されなければならない。この前交配からの受精胚の存在はまた、子宮が適切に精子分布を評価するのに十分な長さであることを保証する。変異型または実験的 hermaphrodites が評価されている場合は、対照群 (複数可) を含む。例えば、変異 hermaphrodites は、アッセイにおける他の変数に対する対照として野生型 N2 hermaphrodites と対にするべきである。RNA 干渉アッセイのためにプラスミドを含む細菌を摂食された Hermaphrodites は、空のベクターコントロールを含むバクテリアも供給する必要があります。外陰部からの距離は、精子が授精するところで、spermatheca に対して、受精部位に、子宮内の卵の数に応じて変化させることができる (すなわち、子宮は、卵数の増加に伴って膨張する)。遺伝子型間の比較を行う場合は、頚に類似する数の卵が含まれている hermaphrodites を選択します。孵化胚または幼虫の移動を含む hermaphrodites は選択しないでください。Hermaphrodites をアッセイすべき最適な年齢を特定するために、タイムコースを実施することができる。
ピッキング hermaphrodites と男性
このアッセイのために選ばれた hermaphrodites は、生い茂ったまたは飢えたプレートからではないことが重要です。食品とフェロモンのキューは、DAF-7、TGFßホモログの表現を調節します。DAF −7経路は、spermatheca20に精子を導く上で重要な役割を果たしている F シリーズプロスタグランジンの合成を調節することが示されている。過密または飢餓のプレートから hermaphrodites を選ぶと、目的のターゲットに関連しない貧しい精子の指導をもたらす可能性があります。プレートの密度は、男性の精子に影響を与えるようには見えません。しかし、あまりにも若すぎるか、または古すぎる男性は、嵌合効率を低下させることがある (すなわち、それらの頚に十分な精子を有する嵌合プレート上の hermaphrodites の割合を定量化する)。1-3 日齢成人男性は、このアッセイ23に最適である。
麻酔 hermaphrodites
私たちの手の中で、Tetramisole と Tricaine の組み合わせは、ワームが固定化され、交配と画像取得中に生き続けることを保証します。アジ化ナトリウムなどの他の麻酔薬も使用できます。しかし、アジ化ナトリウムは非常に有毒であり、条件を標準化する必要があります。マイクロビーズ、アガロース、およびマイクロ流体チャンバを使用する固定化技術は、交配を妨害するので推奨されません。
男性染色
本稿で使用されている水戸染料は、MitoTrackerCMXRos、 elegansにおいて、精子やその他のミトコンドリアを標識するために広く用いられてきた。この水戸染料で標識された精子は、完全に機能し、活性化される能力を保持し、移行し、卵子を受精し、そして生存可能な子孫26、27を産生する。ローダミン6g および DiOC6 などの他のミトコンドリア染料は、 elegansミトコンドリア28,29に染色するために使用されてきた。しかしながら、これらの染料のための条件は、このアッセイにおいて精子を標識するために標準化される必要がある。Mitochrondrial 標識機構に加えて、Syto17 のような DNA 染色剤も、遊走アッセイ30のために精子にラベルを付けるために使用されてもよい。これらの標識技術は比較的容易かつ迅速に行うことができるが、トランスジェニック戦略は、精子特異的プロモーター31,32の下で蛍光タグを発現する精子を生成するために用いられてもよい。
交配
厚すぎる嵌合ドットは、嵌合効率が低下する可能性があります。男性を移送し、hermaphrodites に麻酔をかけたときは、できるだけ少ないバクテリアを移送するように注意する必要があります。
アガロースパッドの作成とカバースリップの配置
気泡は、アガロースパッド内に生成することができます。それらは、画像取得中に光を屈折させるか、または、十分に大きい場合には、ワームが通過する原因となり、画像を取得することを不可能にする。同様に、アガロースパッド上にカバースリップが配置されると、hermaphrodites に沿って気泡が生成されることがあります。これらの気泡は光を屈折させると画質低下につながります。練習は、気泡の発生を減少させるのに役立ちます。
定量化
精子の分布を定量化するとき、ワームの子宮を通る異なる z 面は、精子分布にわずかな違いがあるかもしれません。Spermatheca に焦点を当てた単一の画像を撮ると、複数の z セクションを平均した結果に似た再現性のある結果が得られることがわかります。Spermatheca の中心に画像を焦点を合わせることをお勧めしますが、焦点面は実験者のニーズに基づいてわずかに変更することができます。ただし、すべてのイメージが同じ方法で取得されることが重要です。さらに、集中している精子だけがカウントされることが重要である。インフォーカス精子の基準を決定する際のカウンターの裁量です。ただし、定量化されるすべてのワームに対して、基準が体系的に適用されることが重要です。精子の追跡のために、多くのソフトウェアは、自動追跡機能を提供します。しかし、次の2つの主な理由から、手動追跡はソフトウェアの自動追跡アルゴリズムよりも優れていることがわかります。 1) 限られた空間内で同様の大きさの核が存在すると、ソフトウェアが個々の精子を区別することが困難になる各精子に対して定義された ROIs を作成します。2) 精子が焦点から入ったり出たりすると、強度が変化し、ソフトウェアが長期間にわたって精子を追跡することが困難になります。
開示事項
著者は利害の対立はありません。
謝辞
精子と卵母コミュニケーションをよりよく理解するためのツールとして、この方法のインスピレーションと無私の指導と創造のために、私たちの亡きメンター、マイケル・ミラー博士に心から感謝します。彼の突然の通過は、彼の家族、彼の研究室、そして科学界にとって大きな損失となっています。この研究は、NIH によってサポートされました (R01GM085105 に MAM と F30HD094446 に MH).コンテンツは、著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Reagents and Material | |||
| 60 mm x 15 mm Petri dish | Fisher | FB0875713A | |
| Agar | Fisher | BP1423-500 | |
| Sodium Chloride | Fisher | S671-3 | |
| Peptone | Fisher | BP1420-500 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB broth, Miller | Fisher | 1426-2 | |
| Escherichia coli strain NA22 | Caenorhabditis Genetics Center (CGC) | NA22 | Either this or OP50 E. coli can be used for C. elegans maintenance and assay. Both may be purchased at the CGC |
| N2 | CGC | N2 | |
| fog-2(q71) | CGC | CB4108 | |
| Platinum wire 0.25 mm dia | Alfa Aesar | 10288 | |
| 5 3/4" Disposable Pasteur pipet | Fisher | 13-678-20A | |
| Watch glass | Fisher | 02-612A | |
| 5 mm Dia. Glass rod | Fisher | 50-121-5269 | |
| MitoTracker CMXRos (Mito-dye) | Fisher | M7512 | Shield from light, store at -20 °C |
| Monopostassium phosphate | Fisher | P285-500 | |
| Disodium phosphate | Fisher | S374-1 | |
| Magnesium sulfate | Fisher | M63-500 | |
| Dimethyl sulfoxide | Fisher | BP231-1 | DMSO |
| Aluminum foil | Fisher | 01-213-102 | |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma | E10521-10G | Tricaine is the common name. Store in aliquotes at -20 °C. |
| Tetramisole hydrochloride | Sigma | L9756-5G | Store in aliquotes at -20 °C |
| Agarose | Fisher | BP1356-100 | |
| Coverslips | Fisher | 12-548-A | 18 x 18-1 |
| Frosted microscope slides | Fisher | 12-552-3 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 16 °C and 20 °C incubators | Fisher | 97-990E | Same model, set at different temperatures. |
| Upright Microscope with epi-fluorescence illuminator, camera, and 10x and 60x objectives | Nikon | ||
| Software with image acquisition and tracking capabilities | Nikon | NIS-elements AR | |
| Stereo-microscope | Nikon | SMZ800N | Any stereo-microscope that can be used to visualize C. elegans may be used with this protocol |
参考文献
- Boryshpolets, S., Perez-Cerezales, S., Eisenbach, M. Behavioral mechanism of human sperm in thermotaxis: a role for hyperactivation. Human Reproduction. 30 (4), 884-892 (2015).
- Edmonds, J. W., McKinney, S. L., Prasain, J. K., Miller, M. A. The gap junctional protein INX-14 functions in oocyte precursors to promote C. elegans sperm guidance. Developmental Biology. 359 (1), 47-58 (2011).
- Edmonds, J. W., et al. Insulin/FOXO signaling regulates ovarian prostaglandins critical for reproduction. Developmental Cell. 19 (6), 858-871 (2010).
- Espinal-Enriquez, J., Priego-Espinosa, D. A., Darszon, A., Beltran, C., Martinez-Mekler, G. Network model predicts that CatSper is the main Ca(2+) channel in the regulation of sea urchin sperm motility. Scientific Reports. 7 (1), 4236 (2017).
- Hunter, R. H., Nichol, R. A preovulatory temperature gradient between the isthmus and ampulla of pig oviducts during the phase of sperm storage. Journal of Reproduction and Fertility. 77 (2), 599-606 (1986).
- Hussain, Y. H., Guasto, J. S., Zimmer, R. K., Stocker, R., Riffell, J. A. Sperm chemotaxis promotes individual fertilization success in sea urchins. Journal of Experimental Biology. 219 (Pt 10), 1458-1466 (2016).
- Kantsler, V., Dunkel, J., Blayney, M., Goldstein, R. E. Rheotaxis facilitates upstream navigation of mammalian sperm cells. Elife. 3, e02403 (2014).
- Kubagawa, H. M., et al. Oocyte signals derived from polyunsaturated fatty acids control sperm recruitment in vivo. Nature Cell Biology. 8 (10), 1143-1148 (2006).
- Miki, K., Clapham, D. E. Rheotaxis guides mammalian sperm. Current Biology. 23 (6), 443-452 (2013).
- Ting, J. J., Tsai, C. N., Schalkowski, R., Cutter, A. D. Genetic Contributions to Ectopic Sperm Cell Migration in Caenorhabditis Nematodes. G3. 8 (12), 3891-3902 (2018).
- Yanagimachi, R., et al. Chemical and physical guidance of fish spermatozoa into the egg through the micropyledagger, double dagger. Biology of Reproduction. 96 (4), 780-799 (2017).
- Zhang, Y., et al. Generation of Gradients on a Microfluidic Device: Toward a High-Throughput Investigation of Spermatozoa Chemotaxis. PloS One. 10 (11), e0142555 (2015).
- Hoang, H. D., Miller, M. A. Chemosensory and hyperoxia circuits in C. elegans males influence sperm navigational capacity. PLoS Biology. 15 (6), e2002047 (2017).
- Hansen, J. M., Chavez, D. R., Stanfield, G. M. COMP-1 promotes competitive advantage of nematode sperm. Elife. 4, (2015).
- L'Hernault, S. W. Spermatogenesis. WormBook: The Online Review of C. Elegans Biology. , 1-14 (2006).
- Miller, M. A., et al. A sperm cytoskeletal protein that signals oocyte meiotic maturation and ovulation. Science. 291 (5511), 2144-2147 (2001).
- Greenstein, D. Control of oocyte meiotic maturation and fertilization. WormBook: The Online Review of C. Elegans Biology. , 1-12 (2005).
- O'Hagan, R., Wang, J., Barr, M. M. Mating behavior, male sensory cilia, and polycystins in Caenorhabditis elegans. Seminars in Cell & Developmental Biology. 33, 25-33 (2014).
- Hoang, H. D., Prasain, J. K., Dorand, D., Miller, M. A. A heterogeneous mixture of F-series prostaglandins promotes sperm guidance in the Caenorhabditis elegans reproductive tract. PLoS Genetics. 9 (1), e1003271 (2013).
- McKnight, K., et al. Neurosensory perception of environmental cues modulates sperm motility critical for fertilization. Science. 344 (6185), 754-757 (2014).
- Chaudhuri, J., Parihar, M., Pires-daSilva, A. An introduction to worm lab: from culturing worms to mutagenesis. Journal of Visualized Experiments. (47), (2011).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Chatterjee, I., et al. Dramatic fertility decline in aging C. elegans males is associated with mating execution deficits rather than diminished sperm quality. Experimental Gerontology. 48 (11), 1156-1166 (2013).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. , 80-90 (2017).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent Window into Biology: A Primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Sato, M., Sato, K. Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science. 334 (6059), 1141-1144 (2011).
- Wang, Y., et al. Kinetics and specificity of paternal mitochondrial elimination in Caenorhabditis elegans. Nature Communications. 7, 12569 (2016).
- Wolke, U., Jezuit, E. A., Priess, J. R. Actin-dependent cytoplasmic streaming in C. elegans oogenesis. Development. 134 (12), 2227-2236 (2007).
- Mottram, L. F., Forbes, S., Ackley, B. D., Peterson, B. R. Hydrophobic analogues of rhodamine B and rhodamine 101: potent fluorescent probes of mitochondria in living C. elegans. Beilstein Journal of Organic Chemistry. 8, 2156-2165 (2012).
- Singson, A., Hill, K. L., L'Hernault, S. W. Sperm competition in the absence of fertilization in Caenorhabditis elegans. Genetics. 152 (1), 201-208 (1999).
- Wu, J. C., et al. Sperm development and motility are regulated by PP1 phosphatases in Caenorhabditis elegans. Genetics. 190 (1), 143-157 (2012).
- Seidel, H. S., et al. A novel sperm-delivered toxin causes late-stage embryo lethality and transmission ratio distortion in C. elegans. PLoS Biology. 9 (7), e1001115 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved