Method Article
Измерение сперматозоидов Руководство и подвижность в Caenorhabditis elegans Гермафродит репродуктивного тракта
В этой статье
Резюме
Сперма должна успешно перемещаться по яйцеклетке, чтобы оплодотворить яйцеклетку. Здесь мы описываем результаты для измерения миграции спермы в c. elegans hermaphrodite uterus. Этот анализ может предоставить количественные данные о распределении спермы в матке после спаривания, а также о скорости, направленной скорости и частоте разворота.
Аннотация
Успешное оплодотворение имеет основополагающее значение для полового размножения, но мало что известно о механизмах, которые направляют сперму к яйцеклеткам в женском репродуктивном тракте. В то время как исследования in vitro показывают, что сперма внутренне оплодотворяющих животных может реагировать на различные сигналы из их окружения, неспособность визуализировать свое поведение внутри женского репродуктивного тракта создает проблему для понимания миграции спермы и мобильность в родной среде. Здесь мы описываем метод с использованием C. elegans, который преодолевает это ограничение и использует их прозрачный эпидермис. C. elegans самцы, окрашенные митохондриальным красителем, спариваются со взрослыми гермафродитами, которые действуют как модифицированные самки, и откладывают флуоресцентно помеченную сперму в гермафродитную матку. Миграция и подвижность помеченной спермы затем можно непосредственно отслеживать с помощью эпи-флуоресцентного микроскопа в живом гермафродите. У диких животных примерно 90% помеченной спермы проползают через матку и достигают места оплодотворения, или сперматеи. Изображения матки могут быть приняты 1 ч после спаривания, чтобы оценить распределение спермы в матке и процент спермы, которые достигли сперматеи. Кроме того, замедленное изображение может быть принято сразу после спаривания для оценки скорости спермы, направленной скорости и частоты разворота. Этот метод может быть объединен с другими генетическими и молекулярными инструментами, доступными для C.elegans для выявления новых генетических и молекулярных механизмов, которые играют важную роль в регулировании сперматозоидов и подвижности в женском репродуктивном тракте.
Введение
Молекулярные механизмы, с помощью которых сперматозоиды (называемые спермой) перемещаются по женскому репродуктивному тракту к яйцеклетке, не очень хорошо изучены, но имеют основополагающее значение для полового размножения. Подвижность спермы очень динамична и зависит от надежных коммуникационных сигналов, которые изменяют скорость спермы и направленную подвижность1,2,3,4,5,6 , 7 (г. , 8 , 9 До 9 , 10 Лет , 11 Год , 12. C. elegans стала мощной моделью для изучения движения спермы in vivo, потому что прозрачный эпидермис гермафродита позволяет отслеживать живую сперму при одноклеточном разрешении2,3, 8,10. Целью данной работы является предоставление методов для оценки движения спермы в C. elegans гермафродит матки.
У животных, где сперма то и яйцеклетки встречаются во внешней среде (т.е. в аватизм), сперматозоиды реагируют на хемотаксические сигналы, выделяемые ооцитами. Эти сигналы направляют направление движения спермы, приближаяих к источнику сигнала 4,6,11. Тем не менее, гораздо меньше известно о движении спермы в видах, которые оплодотворяют внутренне. Одной из основных проблем является архитектура женского репродуктивного тракта, который недоступен для микроскопии у большинства видов. В пробирке исследования на людях, мышах и свиньях, например, дают доказательства того, что субпопуляции сперматозоидов могут реагировать на химиоаттракторы, поток жидкости, и термические градиенты1,5,7,9, 12. С помощью этих систем, неспособность визуализировать и отслеживать движение спермы in vivo места серьезные ограничения на стратегии, чтобы обнаружить ключевые механизмы, регулирующие эти функции.
Чтобы преодолеть эти ограничения, мы разработали методы с использованием нематод C. elegans непосредственно визуализировать сперму после оплодотворения, для измерения индивидуальных параметров миграции спермы in vivo, и для измерения способности популяции спермы для целевой участка оплодотворения. Эти методы, вместе с C. elegans молекулярно-генетический набор инструментов, способствовать открытию химических сигнальных молекул и молекулярного механизма, которые регулируют поведение подвижности спермы. Например, генетические экраны могут быть проведены в гермафродитов или мужчин, чтобы определить гены, которые необходимы для эффективного движения спермы in vivo13. Молекулы могут быть введены в гермафродит гонад для проверки воздействия на активацию спермы, скорость миграции, и направленная подвижность3. Кроме того, описанные методы могут быть использованы для мониторинга изгоев миграции спермы в эктопические места тела и для оценки спермы конкуренции10,14.
C. elegans существуют в природе как гермафродиты и самцы (см. рисунок 1). Гермафродит гонад имеет два U-образных рук, которые являются зеркальными изображениями друг друга. Во время личиночной стадии L4, наиболее проксимальных зародышевых клеток (т.е. клетки вблизи сперматеи) проходят сперматогенез. Каждый первичный сперматоцит входит в мейоз и производит четыре гаплоидных сперматозоидов. Эти сперматозоиды толкаемых в сперматеи вместе с первым зрелым яйцеклетки и проходят спермиогенез15. Взрослые гермафродиты переходят от сперматогенеза к огенезу. Ооциты созревают в сборочной линии моды вдоль гонада, с наиболее зрелых яйцеклетки в проксимальном конце гонада, рядом с сперматеей. СИГНАЛы MSP от спермы необходимы для того чтобы вызвать meiotic созревания и овуляции16,17. Мужчины C. elegans, с другой стороны, имеют J-образный гонад, которые производят только сперму. Сперматиды хранятся в семенной везикуле. После спаривания с гермафродитом или самкой самец вставляет спикулы возле хвоста в вульву. Сперматиды активируются во время эякуляции, когда они вступают в контакт с семенной жидкости18. C. elegans сперма не плавают, поскольку они не flagellated. Вместо этого они ползают по репродуктивному тракту, используя псевдопод для передвижения. Хорошо известно, что мужская сперма, которые больше по размеру, имеют конкурентное преимущество над спермой гермафродита14.
В этом методе, мужчины C. elegans выступать в качестве донора спермы и спариваются со взрослыми гермапромитами. Взрослые самцы окрашены флуоресцентным митохондриальным красителем для производства маркированной спермы. После осаждения через гермафродит вульвы, сперма должна ползать вокруг эмбрионов в матке к сперматеке, или оплодотворения сайта. Прозрачный эпидермис модели C. elegans позволяет напрямую визуализировать каждую индивидуальную сперму при ее навигации по женскому репродуктивному тракту. В последние годы наша лаборатория успешно использовала этот метод, чтобы продемонстрировать важность класса F-серии простагландинов в руководстве спермы от вульвы к сперматеке19,20. Молекулярные механимы, регулирующие его синтез гермафродитом и реакцию спермы, все еще находятся под следствием. Тем не менее, этот метод для оценки подвижности спермы и миграции значительно облегчает идентификацию ключевых игроков, которые контролируют сперматозоидов и яйцеклетки связи внутри оплодотворения животных. Следующий протокол описывает шаг за шагом, как выполнить этот ассс.
протокол
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИ этом протоколе выполняются при комнатной температуре (20-22 градусов по Цельсию) или в постоянном температурном инкубаторах, установленных до 16 градусов по Цельсию или 20 градусов по Цельсию. Мужской и гермафродит C. elegans выращиваются с использованием стандартных условий культуры и NA22 или OP50 E. coli в качестве источника пищи21,22. В приведенной ниже процедуре используются самцы дикого типа N2 и туман-2 (q71).
1. День 1. Выбор L4 Этап гермафродиты для спаривания
- Чтобы получить последовательные результаты, все гермафродиты должны быть синхронизированы как активно воспроизводящие взрослых. Выберите 20-30 L4 стадии гермафродитов на 6 см семян нематод роста среднего (NGM) пластины. Инкубировать гермафродиты при 20 градусах по Цельсию при 28-30 ч.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Только 12-15 гермафродитов будут использоваться для спаривания. Остальные гермафродиты излишки.
2. День 1. Окрашивание самцов флуоресцентным митохондриальным красителем (Мито-краситель)
- Сделайте мужскую пластину для окрашивания, поместив точку кишечной палочки (пищевой точки) в центре несеяной пластины NGM. Чтобы сделать пищевую точку, используйте конец стеклянного перемешивающего стержня, чтобы соскребать кишечную палочку с бактериями газон с семенной тарелки и нахранение его на несеяную тарелку. Точка должна быть 5-7 мм в диаметре.
- Смешайте 2 мЛ 1 мМ мито-красителя (см. Таблица материалов) в DMSO и 10 qL буфера M9 (3 г KH2PO4, 6 г Na2HPO4, 5 г NaCl, 1 мл 1 M MgSO4, H2O до 1 Л. Добавить MgSO4 после autoclaving). Pipette все раствормия мито-красителя на пищевую точку на мужской пластины окрашивания. Пусть тарелка высохнет в темноте (30 мин).
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Мито-краситель светочувствительный. Защитите все растворы, пластины и червей, содержащих мито-краситель от света. Храните 1 мМ акцию при -20 градусах По Цельсию. - Выберите 100 1-3 день старых взрослых самцов23 мито-красителя окрашенных пищевой точек на мужской пластины окрашивания. Оберните тарелку в алюминиевую фольгу и инкубируйте на ночь при 16 градусах Цельсия. Для спаривания используйте 50-60 самцов на 12-15 гермафродитов. Если более 100 мужчин необходимы, сделать больше окрашивания пластин, чтобы предотвратить переполненность мужчин.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Мужчины также могут быть окрашены путем инкубации в 10 ммэ-краситель раствор в m9 буфера для 3 ч на часовом стекле. Держите червей покрыты, чтобы предотвратить испарение и воздействие света. После 3 ч используйте трубу Pasteur для переноса самцов на 10-сантиметровую посеянную пластину NGM. Передача как мало мито-краситель раствор, как это возможно. Оберните тарелку в алюминиевую фольгу и инкубируйте на ночь в 16 градусов по Цельсию.
3. День 2. Спаривание
- Выберите окрашенных мужчин с первого дня на новый, семенами ПЛАСТИНы NGM. Оставьте тарелку в темноте до спаривания. Этот шаг гарантирует, что избыток мито-красителя окрашенных бактерий вокруг мужчин удаляются. Перенос чрезмерного мито-красителя окрашенных бактерий на брачной пластины может пятно гермафродитной ткани.
- Сделать спаривания пластины, сбросив 2 злицы толстой смеси кишечной палочки на несеяной пластины NGM. Пусть толстые бактерии высохнут, чтобы сделать спаривание точки. Самцы и гермафродиты будут перенесены на эту точку для спаривания. Чтобы сделать толстый кишечной палочки,спина вниз 3 мл ночь кишечной палочки и resuspend гранулы бактерий в 1 мл M9. Эта смесь может храниться при 4 градусах Цельсия и повторно использоваться до 6 месяцев.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Толщина раствора кишечной палочки может быть скорректирована. Если раствор слишком тонкий, самцы могут отползти от точки спаривания вместо того, чтобы агрегировать на ней для спаривания. Спаривание точек из E. coli soluton, что является слишком толстым может снизить эффективность спаривания. - В то время как брачная пластина от Шага 3.2 высыхает, смешайте 300 л 1% (w/v) Tricaine (Tri), 300 л 0,1% (w/v) Тетрамизол (Тет) и 900 Л L M9.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Хранить 1% (w/v) Трикаин и 0,1% (w/v) Тетрамизол в качестве аликотики при -20 градусов по Цельсию. Избегайте повторного замораживания оттепели. - Передача 600 злител раствора Tet/Tri в часовое стекло.
- Передача 12-15 гермафродитов, собранных в первый день, в раствор Tet/Tri в часовом стекле. Инкубировать в течение 30 минут, чтобы обездвижить гермафродиты. Держите стекло часов закрытым, чтобы предотвратить испарение раствора Tet/Tri.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Важно, чтобы гермафродиты были обезображены в течение не менее 30 мин. Меньше времени может привести к перемещению червя во время приобретения изображения, которое может interefere с изображением. - В то время как гермафродиты инкубируют, выберите 50-60 окрашенных самцов из шага 3.1 на точку спаривания (Шаг 3.2). Храните тарелку в темноте до шага 3.8.
- После 30-минутной инкубации в растворе Tet/Tri используйте стеклянный труба Pasteur для переноса обездвиженных гермафродитов из часового стекла на несеяную пластину NGM. Удалите как можно больше жидкости, как это возможно, и дайте избыток жидкости высохнуть.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Не дайте гермафродитов высохнуть чрезмерно. Как только вся видимая жидкость испарится, начните следующий шаг. - Перенесите обезопаживание гермафродитов из несеяной пластины NGM на брачную точку с окрашенными самцами. Инкубировать в темноте в течение 30 минут, чтобы мужчины спариваться с гермафродитами.
- После спаривания в течение 30 минут, смонтировать гермафродиты немедленно для замедленного изображения или передать гермафродиты на новый, семенами пластины NGM для отдыха в течение 1 ч до изображения.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Видео замедленного использования гермафродитной матки используются для количественной оценки скорости спермы и частоты разворота. Тем не менее изображения матки, принятые 1 ч после спаривания используются для количественной оценки распределения спермы, или spem руководства.
4. День 2. Монтаж червей для визуализации
-
Создание монтажной площадки с 2% агарозой в H2O
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ, 2% агарозможет может быть сделано оптом, aliquoted в стеклянные пробирки, и хранится при 4 градусах Цельсия. При необходимости каждый aliquot может быть микроволновой печи перед каждым использованием и храниться в теплоблоке, чтобы предотвратить его от затвердевания.- Чтобы сделать монтаж площадку, выровнять три стеклянные микроскоп слайды бок о бок с длинными краями трогательно. Поместите два куска липкой ленты друг на друга на обоих внешних слайдах. Эти внешние стеклянные слайды с лентой будет выступать в качестве опоры, так что толщина в результате агарозы площадку будет "две ленты глубоко".
- Поместите 75 л расплавленной 2% агарозы на центральной горке (это слайд без ленты). Немедленно поместите новый стеклянный микроскоп слайд на вершине агарозы. Этот верхний стеклянный слайд должен быть перпендикулярно другим слайдам, при этом каждый конец лежит на ленте двух слайдов поддержки.
- Пусть агароуз затвердеет (30 с). Тщательно удалите верхний стеклянный слайд, сдвинув его с агарозной площадки.
- Поместите 10-15 л раствора Tet/Tri на 2% агарозную площадку. Перенесите спариванные гермафродиты на площадку. Позаботьтесь о передаче как можно меньше бактерий, как это возможно.
- Поместите крышку скольжения над червями на агарозе площадку.
5. День 2. Настройка приобретения изображений
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Любой прямой мископ, оснащенный эпифлуоресценцией, 10x и 60x целей, и цифровая камера может быть использована для получения изображений для распределения спермы. Программное обеспечение, способное приобретать замедленное изображение, требуется для оценки скорости спермы, конечной скорости и частоты разворота.
-
Приобретение изображения 1 ч после спаривания
- Установите слайд на сцену микроскопа. Посмотрите через кусочки глаз, чтобы сканировать для червей на агарозной площадке с помощью 10-кратной цели с красным флуоресценционным фильтром для выбросов (фильтр TRITC). После того, как червь был найден, кратко включите флуоресценцию свет, чтобы увидеть, если червь спаренный. Если сперма видна в матке, переключитесь на цель 60x.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Давление, созданное 60x цель юбитором может повредить некоторые хрупкие черви, в результате чего кишечник или гонад, чтобы выдавливать из животного. Сканирование для успешного спаривания с использованием 10-x цели может свести к минимуму воздействие червей на дополнительное давление. Не подвергайте спаренных червей длительным периодам флуоресцентного света. - Использование дифференциального вмешательства Контрастная микроскопия (DIC), положение червя так, что и вульвы и один сперматеи находятся в поле зрения. Сосредоточьте изображение, сосредоточившись на центре сперматозоидов. Проверьте экспозицию как для каналов DIC, так и для TRITC. В DIC, внутренние структуры червя должны быть хорошо видны. В TRITC, отдельные сперматозоиды должны быть видны как различные puncta.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Каждое изображение должно захватить матку от вульвы к одному из сперматеки. Если матка слишком длинна, чтобы поместиться на одном изображении, два отдельных изображения могут быть приняты. Не обязательно, чтобы все изображения были сделаны на одном уровне экспозиции. Тем не менее, важно, чтобы отдельные сперматозоиды могут быть различимы и количественно в флуоресценции изображений. - Приобретите DIC и флуоресценции изображения для каждой матки.
- Повторите шаги 5.1.1-5.1.3 до тех пор, пока не будут изображены все спаренные гермафродиты.
- Установите слайд на сцену микроскопа. Посмотрите через кусочки глаз, чтобы сканировать для червей на агарозной площадке с помощью 10-кратной цели с красным флуоресценционным фильтром для выбросов (фильтр TRITC). После того, как червь был найден, кратко включите флуоресценцию свет, чтобы увидеть, если червь спаренный. Если сперма видна в матке, переключитесь на цель 60x.
-
Захват замедленного видео
- Сканирование агарозы площадку и найти гермафродиты, которые содержат помечены спермы в матке, как описано в шаге 5.1.1 и 5.1.2
- Нанастройка программного обеспечения для получения изображений замедленного времени в каналах DIC и TRITC. Как правило, замедленное изображение принимается с интервалом 15-30 с интервалом в 10-20 минут на матку.
6. Количественная оценка
-
Количественная оценка распределения спермы на изображениях матки, сделанных 1 ч после спаривания
- Начиная с вульвы на одном конце и сперматеи на другом, разделить матку на третьи. Они будут представлять три зоны. Зона 1 (No1) содержит вульвы и зону 3 (No3) содержит сперматею.
- Вручную подсчитайте количество сперматозоидов в каждой трети матки, и сообщите о количестве в каждой зоне в процентах от общей численности спермы во всей матке. Приведен пример ниже.
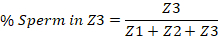
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ- Иногда интенсивность сигнала изображения канала TRITC должна быть отрегулирована так, что каждая сперма, которая была захвачена на изображении, может быть видима и количественно.
-
Отслеживание спермы в замедленном изображении
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ В этой статье мы использовали программное обеспечение NIS-Elements для анализа. В приведенных ниже разделах мы даем инструкции по ручному отслеживанию спермы с помощью этого программного обеспечения (шаг 6.2.1), а также программного обеспечения с открытым исходным кодом ImageJ/Fiji (шаг 6.2.2).-
Отслеживание спермы с помощью NIS-элементов
- Откройте файл .nd2 с замедленной серией, которая будет отслеживаться. Чтобы начать отслеживание, откройте панель отслеживания, нажав правое нажатие на программное обеспечение и выбрав контроль анализа Отслеживание.
- В панели отслеживания выберите Define New ROI. Определите каждую область интереса (ROI), нажав на каждую сперму, которая будет отслеживаться. Над выбранной спермой появится цветной знак. Нажмите Закончить, когда все ROIs были выбраны.
- Как только ROIs были определены, перейдите к следующему кадру в серии тайм-лап. Перетащите маркер ROI в новое положение спермы на изображении. Продолжайте делать это до тех пор, пока сперма больше не может быть отслежена. Появятся пунктирные линии, соединяющие каждое из мест, которые маркер ROI был размещен через все кадры изображения замедленного времени.
ПРИМЕЧАНИЕ ОТНОсяСЬ к СВЕДЕНИ Только сперматозоиды в Зоне 2 должны быть отслежены как сперматозоиды в зонах 1 и 3 клонат двинуть в круговой картине даже в животных дикого типа. - Экспортировать все количественные данные (например, длина пути, время, положение XY и т.д.) от отслеживаемой спермы к документу Excel, нажав на экспорт в панели отслеживания.
-
Отслеживание спермы с Фиджи
- Преобразуйте изображения каналов TRITC в серии замедленного времени в файлы .tif. Сохраните все файлы из одной серии в одну папку.
- Импортируйте изображения на Фиджи с помощью функции импорта BioFormats. Импорт изображения из одной временной серии, как один гиперстек.
- Открыть TrackMate на Фиджи24 через плагины ()) Отслеживание (слежение) Ручное отслеживание с помощью TrackMate. Откроется коробка с диаглогом.
- Выберите инструмент TrackMate в панели инструментов Фиджи. Дважды нажмите на сперму, которая будет отслеживаться. Появится зеленый круг с разбитыми линиями. Этот круг может быть перемещен, нажав внутри круга и перетаскивая в нужное положение. Размер этого круга может быть изменен путем одновременного нажатия клавиши ALT и прокрутки мыши.
- После того, как размер и положение трекера был установлен, нажмите на круг еще раз. Разбитые зеленые линии превратятся в сплошную зеленую линию. Одновременно нажмите клавиши SHIFT и L, чтобы включить режим слежения. Это будет указано в панели инструментов Фиджи.
- Перейдите к следующему кадру в серии тайм-лап. Чтобы установить новое местоположение гусеничной спермы в новом кадре, нависните над мышью над новой точкой и нажмите клавишу A. Теперь трекер будет отображаться на новом месте, и появится строка, соединяющая места, где трекер был помещен в предыдущих кадрах.
- После завершения работы по трассам нажмите «Анализ» в поле диалога TrackMate для генерации необходимых данных.
- Чтобы рассчитать скорость, разделите общую длину пути спермы на прошедшее время.
- Чтобы вычислить векторную скорость, нарисуйте линию через матку, начиная от вульвы, указывающей на сперматею. Измерьте расстояние спермы мигрировало вдоль этой линии от начала до конца следа. Разделите это расстояние на прошедшее время. Отрицательные значения указывают на то, что сперма мигрировала от сперматеи.
- Чтобы зафиксировать частоту разворота, подсчитайте количество раз, в течение которых след спермы генерировал угол менее 90 градусов в течение трех последовательных кадров замедленного времени.
-
Отслеживание спермы с помощью NIS-элементов
Результаты
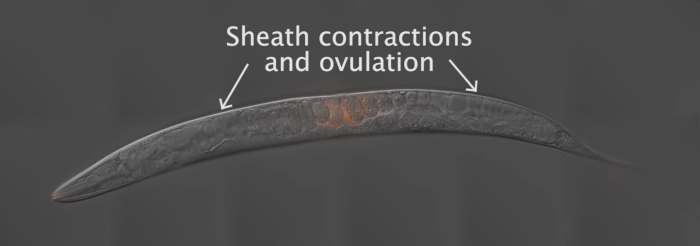
Для получения результатов, изображенных в этой работе, самцы тумана-2 (q71) были окрашены мито-красителями и спарены с диким типом, N2 гермафродиты. Рисунок 2 обеспечивает общую схему для метода, включая подготовку червя, спаривание и анализ. Как показывает фильм 1, взрослый гермафродит репродуктивного тракта имеет две руки, которые являются зеркальными изображениями друг друга. После спаривания, помеченные спермы откладываются в гермафродит матки через вульву. Сперма перемещается вокруг развивающихся эмбрионов в матке к сперматеке, где они хранятся до оплодотворения. По мере того как клетки зародыша в взрослом hermaphrodite превращаются в oocytes, proximal, большинств возмужалый oocyte нажат в spermatheca через contrations клетки оболочки. Оплодотворение происходит в то время как яйцеклетка находится в сперматеи.
Для количественной оценки распределения спермы и миграции через женский репродуктивный тракт, гермафродитная матка делится на три зоны (фильм1, Рисунок 3A). Зона 1 охватывает первую треть матки, начиная с вульвы. Зона 2 охватывает среднюю треть матки, а зона 3 охватывает последнюю треть матки и включает в себя сперматею. Правильное руководство спермы с использованием дикого типа, N2 гермафродитов и туман-2 (q71) мужчины должны привести примерно к 90% помечены спермы достижения сперматеи, или зона 3B (Рисунок 3B). Спаривания, которые приводят к слишком мало(Рисунок 3C, менее 10-15 спермы) или слишком много (Рисунок 3D, матка заполнена спермой) спермы в матке не следует считать. В спаривания, которые приводят к менее чем 10-15 сперматозоидов, 3-4 изгоев спермы может сильно исказить данные. Аналогичным образом, когда матка полностью заполнена спермой, сперма не может мигрировать соответствующим образом. Сперма может показаться рассеянной по всей утробе некоторых мутантов, которые отображают плохой фенотип руководства спермы. Однако, в этом случае, сперма не должна заполнять каждый щель матки, как видно на рисунке 3D. Количественная оценка каждой руки гонада считается одним образцом, или одним n.
Снимки замедленного времени принимаются для количественной оценки скорости спермы и частоты разворота. Только сперматозоиды в зоне 2 должны быть отслежены(Рисунок 4A), потому что сперма в зонах 1 и 3 (Фильм1)как правило, движутся по круговой схеме даже в диком типе животных. Время-ласпе изображения, сделанные на 15-30 s интервалы, как правило, используются для отслеживания спермы. Только сперматозоиды, которые могут следовать в последовательных кадров в течение более 2,5-3 мин количественно. На рисунке 4B-M, сперма, отмеченная красными и синими точками, удовлетворяет этот критерий, в то время как сперма, отмеченная зеленой точкой, не соответствует этому критерию. Таким образом, значения, определенные на рисунке 4N количественно для спермы отмечены красными и синими точками(Рисунок 4O), в то время как для спермы отмечены зеленой точкой не были количественно.
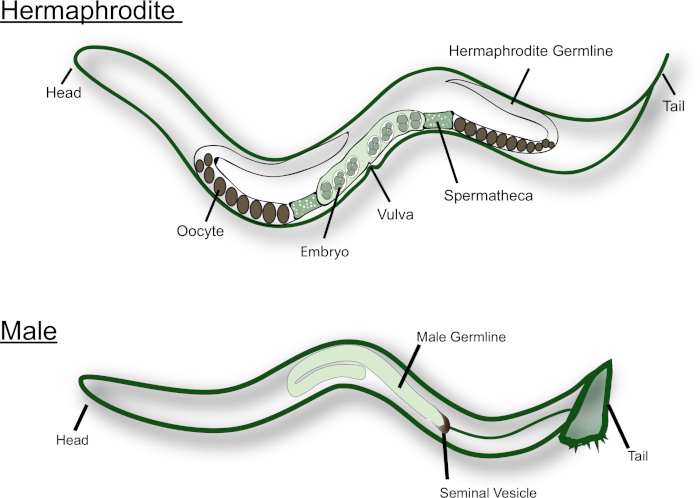
Рисунок 1. Мультфильм взрослого C. elegans гермафродита и мужчины. Основные репродуктивные структуры обозначены на рисунке. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2. Схематическая схема подготовки выборки и сбора данных. Самцы, окрашенные мито-краситель, спариваются с синхронизированными взрослыми гермафродитами. Замедленное изображение спаренных гермафродитов принимаются сразу после спаривания для сбора данных о скорости спермы и частоте разворота. Тем не менее изображения спариваемых гермафродитов принимаются 1 ч после спаривания для оценки распределения спермы в матке. Для более подробной информации обратитесь к тексту. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3. Количественная оценка распределения спермы в гермафродитной матке. (A). Схема C. elegans гермафродит матки. V - вульва, E - эмбрион, S s сперматека, O й ооцит, No1-No3 - Зоны 1-3, используемые для измерения распределения спермы. (B-D). DIC-TRITC объединили (левые панели) и TRITC только (правые панели) изображения дикого типа гермафродита uteri 1 ч после спаривания с туманом-2 (q71) мужчины окрашенные мито-краситель. Сперма появляются красными. В желтых очертаниях указывается расположение сперматеи. Шкала бары, 20 мкм. No 1, No 2, No 3 количественной оценки в B представляют собой процент спермы в каждой зоне и стандартное отклонение. Изображения в C и D представляют спаривания, которые привели к слишком мало (C) или слишком много (D) спермы для количественной оценки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4. Количественная оценка скорости спермы и частоты разворота во время миграции через матку. (A). DIC-TRITC слилось изображение гермафродита матки, содержащей флуоресцентные сперматозоиды (красный). V - вульва, желтая сперматека, No1-3 - три зоны матки, черный ящик, зона 2. (B-M). Time-lapse TRITC образы канала увеличено в зоне 2 (черный ящик в A). Изображения были получены с интервалом в 20 см. 3 отдельные сперматозоиды были отслежены в каждом изображении (красные, зеленые и синие точки). Цветные точки в панели M представляет путь каждой спермы от B-L. Шкала бар 20 м. (N). Уравнения и определения скорости спермы, скорости переносчика и частоты разворота. (O). Скорость, векторная скорость и частота разворота спермы отслеживается в панелях B-L красными и синими точками. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Фильм 1. Фильм о движении спермы и миграции. Дикий гермафродит был спарен с туманом-2 (q71) самцов окрашенных мито-красителя. Фильм представляет собой композицию из замедленного изображения, сделанные с различными интервалами времени. Пожалуйста, нажмите здесь, чтобы посмотреть это видео. (Правый клик для загрузки.)
Обсуждение
Способность спермы ориентироваться в запутанной женской репродуктивной тракте и найти яйцеклетки имеет решающее значение для полового размножения. Недавние исследования с использованием спермы внутренне оплодотворяющих животных показывают, что они активно реагируют на различные экологические сигналы, в том числе химические сигналы, поток жидкости, и температурные градиенты1,5,7, 9 До 9 , 12. Однако, эти наблюдения в значительной степени в результате экспериментов в пробирке и мало что известно о поведении спермы и связи в репродуктивном тракте. Одним из основных препятствий на пути получения данных in vivo о миграции спермы и подвижности является отсутствие видимости в большинстве женских репродуктивных путей. Метод, описанный здесь с помощью C. elegans, преодолевает это ограничение. Как показывают репрезентативные результаты, прозрачный эпидермис позволяет для прямой визуализации и отслеживания каждой спермы в одном разрешении клеток в живом, нетронутом организме.
C. elegans имеет два пола. Самцы, с генотипом XO, производят только сперму, и в этом методе, использованы как дарители спермы. Гермафродит, с XX генотипом, модифицированные женщины. Их гонады впервые проходят сперматогенез во время четвертой личиночной стадии и перейти к oogenesis в зрелом возрасте25. В этом ассее используются взрослые гермафродиты, репродуктивные ткани которых являются моделью для женского репродуктивного тракта. Использование обоих полов в этом анализе позволяет нам определить генетические и молекулярные пути как у мужчин, так и у женщин, которые могут регулировать руководство спермой и подвижность. В сочетании с целым рядом генетических и молекулярных методов, доступных для C. elegans,этот метод может привести к новым пониманием миграции спермы и подвижности, а также спермы и яйцеклетки связи.
Несколько важных шагов в этом протоколе требуют дальнейшего рассмотрения, в дополнение к деталям, представленным в разделе протокола.
Черви
Туман-2 (q71), он-5 (e1490), или его-8 (e1489) мутантных самцов могут быть использованы вместо N2 мужчин. Эти мутации увеличивают частоту мужчин в культурах, но не влияют на мужское спаривание или функции спермы13. Самки, такие как самки тумана-2 (q71), могут быть использованы вместо гермафродитов. Тем не менее, женщины должны быть предварительно спарены с мужчинами, чтобы обеспечить надлежащее развитие яйцеклеток. Наличие оплодотворенных эмбрионов от этого предварительного спаривания также гарантирует, что матка достаточно долго, чтобы правильно оценить распределение спермы. Если мутант или экспериментальные гермафродиты оцениваются, включите контрольную группу (ы). Например, мутантные гермафродиты должны быть в паре с гермафродитами дикого типа N2 в качестве контроля для других переменных в ассее. Гермафродиты, которые были поданы с бактериями, содержащими плазмиды для РНК-интерференции анализы также должны быть поданы с бактериями, содержащими пустой вектор контроля. Расстояние от вульвы, где осеменены сперматозоиды, до сперматеи, места оплодотворения, может варьироваться в зависимости от количества яйцеклеток в матке (т.е. матка расширяется с увеличением количества яйцеклеток). Если проводятся сравнения между генотипами, выберите гермафродиты, матка которых содержит одинаковое количество яиц. Не выбирайте гермафродиты, содержащие вылупляющиеся эмбрионы или движущиеся личинки. Временный курс может быть выполнен для определения оптимального возраста, в котором гермафродиты должны быть асссес.
Выбор гермафродитов и самцов
Важно, чтобы гермафродиты, выбранные для этого асссея, не были заросшими или голодаемыми пластинами. Пища и феромонные сигналы модулируют выражение DAF-7, гомолога TGF. Путь DAF-7 был показан регулировать синтез F-серии простагландинов, которые играют важную роль в руководстве спермы спермы сперматеи20. Выбор гермафродитов из переполненных или голодали пластин может привести к плохой спермы руководство, не связанные с целью интереса. Плотность пластин, кажется, не влияет на мужскую сперму. Тем не менее, мужчины, которые слишком молоды или слишком стары, могут привести к снижению эффективности спаривания (т.е. процент гермафродитов на брачной пластине, которые имеют достаточно спермы в матке для количественной оценки). 1-3 дня старые взрослые самцы являются оптимальными для этого исследования23.
Анестезия гермафродитов
В наших руках комбинация Tetramisole и Tricaine гарантирует, что черви обездвижены и остаются в живых во время спаривания и приобретения изображения. Другие анестезии, такие как азид натрия, также могут быть использованы. Тем не менее, азид натрия является высокотоксичным и условия должны быть стандартизированы. Методы иммобилизации с использованием микробусов, агарозы и микрофлюидных камер не рекомендуются, поскольку они мешают спариванию.
Мужское окрашивание
Мито-краситель, используемый в этой рукописи, MitoTrackerCMXRos, широко используется для маркировки спермы, а также других митохондрий, в C. elegans. Сперма помечена с этим мито-краситель полностью функциональным, сохраняя свою способность быть активирована, мигрировать, оплодотворять яйцеклетки, и производить жизнеспособные потомство26,27. Другие митохондриальные красители, такие как родамин 6G и DiOC6 были использованы для окрашина C. elegans митохондрии28,29. Тем не менее, условия для этих красителей должны быть стандартизированы для маркировки спермы в этом случае. В дополнение к механизмам митохрондриальной маркировки, пятна ДНК, такие как Syto17, также могут быть использованы для обозначения спермы для миграционных анализов30. Хотя эти методы маркировки относительно легко и быстро выполнять, трансгенные стратегии также могут быть использованы для создания спермы, которые выражают флуоресцентные метки под спермой конкретных промоутеров31,32.
Спаривание
Спаривание точек, которые являются слишком толстыми может снизить эффективность спаривания. Следует позаботиться о переносе как можно меньше бактерий при передаче самцов и анестезированных гермафродитов на точку спаривания.
Изготовление агарозных прокладок и размещение крышки скольжения
Воздушные пузыри могут быть созданы в агарозных колодках. Они могут преломлять свет во время приобретения изображения или, когда достаточно большой, причиной червей падать до конца, что делает невозможным приобретение изображения (ы). Аналогичным образом, пузырьки воздуха могут быть созданы вдоль гермафродитов, когда крышка скольжения помещается над ними на агарозной площадке. Эти пузырьки преломляют свет и приводят к снижению качества изображения. Практика поможет уменьшить возникновение пузырьков воздуха.
Количественная оценка
При количественной распределении спермы, различные z-планы через матку червя могут иметь небольшие различия в распределении спермы. Мы находим, что принятие одного изображения сосредоточены на сперматеи дает нам воспроизводимые результаты, которые аналогичны результатам, полученным путем усреднения нескольких z-секций. Мы рекомендуем фокусировать изображение на центре сперматеи, но фокусные плоскости могут быть изменены немного на основе потребностей экспериментатора. Однако крайне важно, чтобы все изображения были сделаны одинаково. Кроме того, важно, что только сперматозоиды, которые находятся в центре внимания учитываются. Это усмотрение счетчика в определении критериев для в фокусе спермы. Тем не менее, очень важно, чтобы критерии систематически применяются к каждому червю, который количественно. Для отслеживания спермы, многие программы предлагают возможности автоматического отслеживания. Тем не менее, мы находим, что ручное отслеживание превосходит алгоритм автоматического отслеживания программного обеспечения по двум основным причинам, 1) Обилие ядер аналогичного размера в ограниченном пространстве затрудняет для программного обеспечения, чтобы различать отдельные спермы и создать определенные ROIs для каждой спермы. 2) По мере того как сперма идет в и из фокуса, их интенсивность смещает, делая его трудным для произносного обеспечения для того чтобы держать след спермы над выдвинутыми периодами времени.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Мы искренне благодарим нашего покойного наставника, доктора Майкла Миллера, за его вдохновляющее и самоотверженное наставничество и создание этого метода в качестве инструмента для лучшего понимания спермы и яйцеклетки связи. Его внезапная кончина стала огромной потерей для его семьи, его лаборатории и научного сообщества. Это исследование было поддержано NIH (R01GM085105 до MAM и F30HD094446 для MH). Содержание является исключительно ответственностью авторов и не обязательно отражает официальные взгляды Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents and Material | |||
| 60 mm x 15 mm Petri dish | Fisher | FB0875713A | |
| Agar | Fisher | BP1423-500 | |
| Sodium Chloride | Fisher | S671-3 | |
| Peptone | Fisher | BP1420-500 | |
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB broth, Miller | Fisher | 1426-2 | |
| Escherichia coli strain NA22 | Caenorhabditis Genetics Center (CGC) | NA22 | Either this or OP50 E. coli can be used for C. elegans maintenance and assay. Both may be purchased at the CGC |
| N2 | CGC | N2 | |
| fog-2(q71) | CGC | CB4108 | |
| Platinum wire 0.25 mm dia | Alfa Aesar | 10288 | |
| 5 3/4" Disposable Pasteur pipet | Fisher | 13-678-20A | |
| Watch glass | Fisher | 02-612A | |
| 5 mm Dia. Glass rod | Fisher | 50-121-5269 | |
| MitoTracker CMXRos (Mito-dye) | Fisher | M7512 | Shield from light, store at -20 °C |
| Monopostassium phosphate | Fisher | P285-500 | |
| Disodium phosphate | Fisher | S374-1 | |
| Magnesium sulfate | Fisher | M63-500 | |
| Dimethyl sulfoxide | Fisher | BP231-1 | DMSO |
| Aluminum foil | Fisher | 01-213-102 | |
| Ethyl 3-aminobenzoate methanesulfonate | Sigma | E10521-10G | Tricaine is the common name. Store in aliquotes at -20 °C. |
| Tetramisole hydrochloride | Sigma | L9756-5G | Store in aliquotes at -20 °C |
| Agarose | Fisher | BP1356-100 | |
| Coverslips | Fisher | 12-548-A | 18 x 18-1 |
| Frosted microscope slides | Fisher | 12-552-3 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 16 °C and 20 °C incubators | Fisher | 97-990E | Same model, set at different temperatures. |
| Upright Microscope with epi-fluorescence illuminator, camera, and 10x and 60x objectives | Nikon | ||
| Software with image acquisition and tracking capabilities | Nikon | NIS-elements AR | |
| Stereo-microscope | Nikon | SMZ800N | Any stereo-microscope that can be used to visualize C. elegans may be used with this protocol |
Ссылки
- Boryshpolets, S., Perez-Cerezales, S., Eisenbach, M. Behavioral mechanism of human sperm in thermotaxis: a role for hyperactivation. Human Reproduction. 30 (4), 884-892 (2015).
- Edmonds, J. W., McKinney, S. L., Prasain, J. K., Miller, M. A. The gap junctional protein INX-14 functions in oocyte precursors to promote C. elegans sperm guidance. Developmental Biology. 359 (1), 47-58 (2011).
- Edmonds, J. W., et al. Insulin/FOXO signaling regulates ovarian prostaglandins critical for reproduction. Developmental Cell. 19 (6), 858-871 (2010).
- Espinal-Enriquez, J., Priego-Espinosa, D. A., Darszon, A., Beltran, C., Martinez-Mekler, G. Network model predicts that CatSper is the main Ca(2+) channel in the regulation of sea urchin sperm motility. Scientific Reports. 7 (1), 4236 (2017).
- Hunter, R. H., Nichol, R. A preovulatory temperature gradient between the isthmus and ampulla of pig oviducts during the phase of sperm storage. Journal of Reproduction and Fertility. 77 (2), 599-606 (1986).
- Hussain, Y. H., Guasto, J. S., Zimmer, R. K., Stocker, R., Riffell, J. A. Sperm chemotaxis promotes individual fertilization success in sea urchins. Journal of Experimental Biology. 219 (Pt 10), 1458-1466 (2016).
- Kantsler, V., Dunkel, J., Blayney, M., Goldstein, R. E. Rheotaxis facilitates upstream navigation of mammalian sperm cells. Elife. 3, e02403 (2014).
- Kubagawa, H. M., et al. Oocyte signals derived from polyunsaturated fatty acids control sperm recruitment in vivo. Nature Cell Biology. 8 (10), 1143-1148 (2006).
- Miki, K., Clapham, D. E. Rheotaxis guides mammalian sperm. Current Biology. 23 (6), 443-452 (2013).
- Ting, J. J., Tsai, C. N., Schalkowski, R., Cutter, A. D. Genetic Contributions to Ectopic Sperm Cell Migration in Caenorhabditis Nematodes. G3. 8 (12), 3891-3902 (2018).
- Yanagimachi, R., et al. Chemical and physical guidance of fish spermatozoa into the egg through the micropyledagger, double dagger. Biology of Reproduction. 96 (4), 780-799 (2017).
- Zhang, Y., et al. Generation of Gradients on a Microfluidic Device: Toward a High-Throughput Investigation of Spermatozoa Chemotaxis. PloS One. 10 (11), e0142555 (2015).
- Hoang, H. D., Miller, M. A. Chemosensory and hyperoxia circuits in C. elegans males influence sperm navigational capacity. PLoS Biology. 15 (6), e2002047 (2017).
- Hansen, J. M., Chavez, D. R., Stanfield, G. M. COMP-1 promotes competitive advantage of nematode sperm. Elife. 4, (2015).
- L'Hernault, S. W. Spermatogenesis. WormBook: The Online Review of C. Elegans Biology. , 1-14 (2006).
- Miller, M. A., et al. A sperm cytoskeletal protein that signals oocyte meiotic maturation and ovulation. Science. 291 (5511), 2144-2147 (2001).
- Greenstein, D. Control of oocyte meiotic maturation and fertilization. WormBook: The Online Review of C. Elegans Biology. , 1-12 (2005).
- O'Hagan, R., Wang, J., Barr, M. M. Mating behavior, male sensory cilia, and polycystins in Caenorhabditis elegans. Seminars in Cell & Developmental Biology. 33, 25-33 (2014).
- Hoang, H. D., Prasain, J. K., Dorand, D., Miller, M. A. A heterogeneous mixture of F-series prostaglandins promotes sperm guidance in the Caenorhabditis elegans reproductive tract. PLoS Genetics. 9 (1), e1003271 (2013).
- McKnight, K., et al. Neurosensory perception of environmental cues modulates sperm motility critical for fertilization. Science. 344 (6185), 754-757 (2014).
- Chaudhuri, J., Parihar, M., Pires-daSilva, A. An introduction to worm lab: from culturing worms to mutagenesis. Journal of Visualized Experiments. (47), (2011).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. Elegans Biology. , 1-11 (2006).
- Chatterjee, I., et al. Dramatic fertility decline in aging C. elegans males is associated with mating execution deficits rather than diminished sperm quality. Experimental Gerontology. 48 (11), 1156-1166 (2013).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. , 80-90 (2017).
- Corsi, A. K., Wightman, B., Chalfie, M. A Transparent Window into Biology: A Primer on Caenorhabditis elegans. Genetics. 200 (2), 387-407 (2015).
- Sato, M., Sato, K. Degradation of paternal mitochondria by fertilization-triggered autophagy in C. elegans embryos. Science. 334 (6059), 1141-1144 (2011).
- Wang, Y., et al. Kinetics and specificity of paternal mitochondrial elimination in Caenorhabditis elegans. Nature Communications. 7, 12569 (2016).
- Wolke, U., Jezuit, E. A., Priess, J. R. Actin-dependent cytoplasmic streaming in C. elegans oogenesis. Development. 134 (12), 2227-2236 (2007).
- Mottram, L. F., Forbes, S., Ackley, B. D., Peterson, B. R. Hydrophobic analogues of rhodamine B and rhodamine 101: potent fluorescent probes of mitochondria in living C. elegans. Beilstein Journal of Organic Chemistry. 8, 2156-2165 (2012).
- Singson, A., Hill, K. L., L'Hernault, S. W. Sperm competition in the absence of fertilization in Caenorhabditis elegans. Genetics. 152 (1), 201-208 (1999).
- Wu, J. C., et al. Sperm development and motility are regulated by PP1 phosphatases in Caenorhabditis elegans. Genetics. 190 (1), 143-157 (2012).
- Seidel, H. S., et al. A novel sperm-delivered toxin causes late-stage embryo lethality and transmission ratio distortion in C. elegans. PLoS Biology. 9 (7), e1001115 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены